Содержание
Ростовская студентка планирует создать экологичные активные соединения из растений — rostovgazeta.ru
Студентка Южного федерального университета Тамара Дудникова занимается разработкой способа получения из дикорастущих растений экологически чистых биологически активных соединений, сообщили в пресс-службе вуза.
Благодаря этому методу не потребуются использовать опасные химические растворители. Так, метанол, хлороформ и диэтиловый эфир можно будет заменить водой, которую предварительно нагреют под давлением.
Тамаре Дудниковой, которая является магистрантом второго года обучения кафедры почвоведения и оценки земельных ресурсов, удалось одержать победу в конкурсе «Умник». При реализации программы академического стратегического лидерства «Приоритет 2030» ЮФУ на базе лаборатории «Агробиотехнологии для повышения плодородия почв и качества сельскохозяйственной продукции» будет разработан новый способ получения соединений.
Тамара Дудникова рассказала, что для получения 0,1 грамма соединений из растительного материала необходимо до 100 миллилитров этанола, 50 миллилитров — хлороформа, до 50 мл ацетилата, ацетона, петролейного эфира и до 100 мл гексана. После этого нужна специальная утилизация химотходов. В новом методе упор будет сделан на экологичность.
После этого нужна специальная утилизация химотходов. В новом методе упор будет сделан на экологичность.
Фото: ЮФУ
Исследование поможет создать экологически чистый метод получения природных пенообразователей, гемолитически и бактерицидно активных веществ. Этот проект курируют профессор Татьяна Минкина, а также ведущий научный сотрудник лаборатории ЮФУ Светлана Сушкова.
Новый метод поможет сэкономить время, которое тратится на извлечение соединений. Сейчас необходимо от 12 часов до суток, с новым методом нужен будет один час.
Процесс получения соединений станет дешевле, он будет более доступными для производителей. В том числе косметики, медикаментов и БАДОВ, найдется применение в пищевой и сельхозпромышленности.
По словам Татьяны Минкиной, целью является создание прорывных технологий, что сохранить природно-ресурсный потенциал и повысить плодородие почв на юге страны.
В данный момент есть предварительные договоренности с компаниями «Биопочва», «Агрохолод» и «Гранула-9» о намерениях купить лицензию на новую технологию.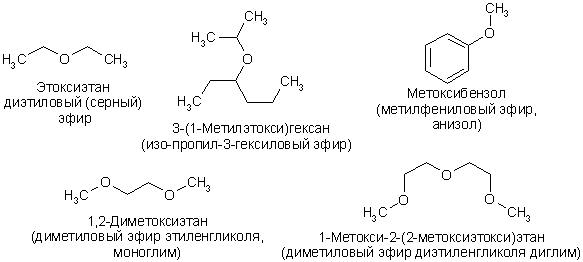
Ранее ученые доказали эффективность этого метода для извлечения из почв и растений опасного канцерогена, вещества первого класса опасности — бенз (а)пирена.
#Новости#Общество
Подпишитесь
В Новочеркасске неизвестный мужчина-азиат пытался украсть пятилетнюю девочку
Вчера, 22:07
В Ростовской области задержали белоруса, осуждавшего российских военных и СВО
Вчера, 19:04
Население Ростовской области продолжает вымирать в 2022 году
Вчера, 16:07
С военными летчиками из Ростовской области будут работать психологи
Вчера, 19:37
В Ростовской области жители уходят в армию и не слышат тревожных сирен
Вчера, 19:42
Приезжие из Донецка станцевали под песню «Ще не вмерла Украина» в ростовском кафе
Вчера, 22:05
Утилизация полигонного ПЭТФ
Р.Ю. Митрофанов,
ИПХЭТ СО РАН, Бийск,
В.П. Севодин,
Бийский технологический институт (филиал) Алтайского государственного технического университета им. И.И. Ползунова, Россия
И.И. Ползунова, Россия
ПЭТФ широко используется для изготовления волокон, преформ, пленок, композиционных материалов. Значительная доля выпускаемого полимера расходуется на изготовление различной упаковки для жидкостей, порошков, паст и т.д. Между тем с ростом объемов производства полимера увеличивается количество технологических и бытовых отходов этого полимера. Поэтому задача его утилизации становится все более актуальной.
Согласно прогнозной оценке намерений предприятий и при условии их осуществления к 2008 г. мощности по выпуску ПЭТФ в России должны увеличиться в 9,5 – 12,5 раз и составить от 502,6 до 656,6 тыс. т в год. Новые мощности планируют ввести в строй фирмы «Полиэф» (120 тыс. т), Retal Industries (154 тыс. т), «Завод новых полимеров Сенеж» (180 тыс. т). Кроме того, заявлено о строительстве завода по производству ПЭТФ в Калининграде (150 тыс. т).
К сожалению, механические способы не решают проблему утилизации отходов ПЭТФ, так как полученные в результате гранулят или крошка являются лишь потенциальным сырьем и для получения конечного продукта должны быть подвергнуты физико-химической обработке, при которой свойства вторичного материала ухудшаются.
При химической переработке решаются, в основном, задачи рецикла мономеров, к чистоте которых предъявляются повышенные требования, что ведет к дополнительным затратам.
Технологические отходы ПЭТФ – это ценный продукт, из которого могут быть регенерированы исходные мономеры. Отходы можно расщеплять этиленгликолем или его парами при температуре кипения этиленгликоля. Расщепление отходов водой до терефталевой кислоты может быть проведено в присутствии серной, азотной или фосфорной кислоты в качестве катализатора или щелочным раствором с концентрацией 5–7 % и гидромодуле 1:(8,5–7).
Наиболее часто для регенерации диметилтерефталата используют метод метанолиза, при котором выход диметилтерефталата достигает 80 % при следующих условиях: температура – 180°С, давление 2,5–2,8 МПа (25–28 ат), время реакции 2–3 ч.
Следует заметить, что разработан новый способ переработки ПЭТФ-отходов с использованием суперкритической воды. Гидролиз ПЭТФ протекает за 30 мин при температуре 350–400 °С и давлении 25–30 МПа. Преимущество разработанного способа перед уже известными – метанолизом и гликолизом – заключается в простоте и небольшой продолжительности процесса.
Преимущество разработанного способа перед уже известными – метанолизом и гликолизом – заключается в простоте и небольшой продолжительности процесса.
После реализации любого из описанных процессов расщепления отходов получают мономеры, часто требующие дополнительной очистки.
Рассмотренные технологии весьма разнообразны. Но далеко не все из них применимы к отходам пищевой тары. Многие из данных технологий позволяют перерабатывать только незагрязненные технологические отходы. К тому же применяемые в этом случае установки сложны в эксплуатации и ориентированы на переработку большого объема отходов, оставляя незатронутой утилизацию пищевой тары, которая, как правило, очень сильно загрязнена.
Авторы попытались взглянуть на ту часть ПЭТФ-отходов, которая в силу большой загрязненности не может быть утилизирована в виде полимера, как на источник индивидуальных химических соединений пригодных для синтеза лекарственных средств. На какой-то период времени (время жизни полимера на рынке) такой подход вполне правомерен. Иллюстрацией этого решения проблемы утилизации ПЭТФ служит приведенная ниже схема (см. рис.).
Иллюстрацией этого решения проблемы утилизации ПЭТФ служит приведенная ниже схема (см. рис.).
В последние годы опубликован ряд работ, в которых предлагается ПЭТФ-отходы подвергать деполимеризации, а терефталевую кислоту (ТФК) использовать в синтезе различных производных, имеющих коммерческое значение. Одним из таких продуктов является диамид терефталевой кислоты – мономер для синтеза полиамидов различного назначения. Его очистка намного проще, чем очистка диэфиров терефталевой кислоты и самой терефталевой кислоты. Самым известным из полиамидов, выпускаемых в мире большим тоннажем, является полипарафенилентерефталамид (кевлар) – синтетическое волокно, обладающее высокой прочностью. Механические свойства этого материала делают его пригодным для изготовления пуленепробиваемых жилетов. Кевлар находит и более мирное применение – его используют для изготовления нитей, применяемых для армирования чулочно-носочных изделий и тросов.
Кевлар относится к классу амидов, классическим способом получения которых является образование связи между карбонильным углеродом и аминным азотом. Синтез обычно осуществляется путем обработки аммиака, первичного или вторичного амина ацилирующим агентом с образованием незамещенного, моно- или N,N-дизамещенного амида.
Синтез обычно осуществляется путем обработки аммиака, первичного или вторичного амина ацилирующим агентом с образованием незамещенного, моно- или N,N-дизамещенного амида.
Для получения диамида терефталевой кислоты наиболее привлекательными исходными веществами выглядят ТФК и диэтиловый эфир терефталевой кислоты (ДЭТ).
В 1990 г. был запатентован способ утилизации отходов ПЭТФ, в результате которого получают различные мономеры на основе диамида терефталевой кислоты [1]. Процесс основан на обработке отходов ПЭТФ в этиленгликоле жидким аммиаком при 120–180 °С. Выход диамида составляет 90 %, однако работа с жидким аммиаком под давлением усложняет аппаратурное оформление, а регенерация этиленгликоля сопряжена с некоторыми трудностями.
Предлагаемая в настоящей работе периодическая схема переработки ПЭТФ-тары позволяет перерабатывать полигонный ПЭТФ без предварительной тщательной мойки материала. Все процессы проводятся в качающемся автоклаве (фото 1, 2) спроектированном В.А. Куничан и Г.И. Севодиной.
Куничан и Г.И. Севодиной.
Реактор недорог, прост в изготовлении, представляет собой цилиндр длиной 110 см с внутренним диаметром 6,5 см. Ось качания находится в области геометрического центра цилиндра. Конструкция автоклава позволяет изготавливать его различной емкости. Реактор способен поддерживать температуру до 400°С и давление до 250 атм. Данная конструкция позволяет эффективно проводить реакции в гетерофазных системах [2].
Подготовка тары для деструкции заключается в грубом измельчении и ополаскивании горячей водой, причем материал не подвергался сортировке по цветам.
Ранее было установлено, что ДЭТ может быть получен с достаточно высоким выходом, этанолизом ПЭТФ-тары. В качестве деструктирующего агента используют концентрат головной фракции (КГФ) – отход спиртового производства с содержанием спирта 86 % [3], ТФК получают гидролизом ПЭТФ-тары водой при 280–285 °С [5].
В ходе экспериментов по получению диамида ТФК было установлено, что для ацилирования аммиака выгоднее использовать ТФК-сырец, так как ee этерификация и очистка увеличивают расходы и трудоемкость, а выход диамида повышается незначительно, вследствие протекания конкурирующей реакции гидролиза. Кроме того, положительным отличием предлагаемого способа утилизации можно считать то, что диамид выкристаллизовывается из реакционной массы в достаточно чистом виде, даже если на стадии ацилирования аммиака была использована ТФК-сырец, полученная гидролизом ПЭТФ без сортировки тары по цвету.
Кроме того, положительным отличием предлагаемого способа утилизации можно считать то, что диамид выкристаллизовывается из реакционной массы в достаточно чистом виде, даже если на стадии ацилирования аммиака была использована ТФК-сырец, полученная гидролизом ПЭТФ без сортировки тары по цвету.
Реакцию проводят в автоклаве при соотношении ТФК : водный аммиак = 1:4. По завершении реакции диамид отфильтровывают, а фильтрат, представляющий собой гомогенный водный раствор аммониевой соли ТФК и терефталамовой кислоты, дополнительно насыщают газообразным аммиаком при охлаждении и снова загружают в автоклав для проведения реакции. С учетом такого способа проведения процесса можно провести конверсию ТФК в диамид с выходом, близким к теоретическому.
Литература
1. Pat. 4.973.746 US, Appl. № 261,800 Process for converting pet scrap to diamine monomers. /K.P. Blackmon, D.W. Fox, S.J. Shafer. 27.11.1990.
2. Севодина Г.И. Исследование гетерогенных процессов в качающихся автоклавах: Дис. канд. техн. наук: 05.17.08 / Г.И. Севодина. – Бийск, 1998.
канд. техн. наук: 05.17.08 / Г.И. Севодина. – Бийск, 1998.
3. Митрофанов Р.Ю. Переработка полигонного ПЭТФ: Способ получения диэтилового эфира терефталевой кислоты /Р.Ю. Митрофанов, П.Н. Бочкарев, В.В. Будаева // Сотрудничество для решения проблемы отходов: Материалы 3-й межд. науч.-практ. конф. г. Харьков. – Изд-во «Независимое агентство экологической информации», Харьков, 2006. С. 181–182.
4. Митрофанов Р.Ю. Химический способ переработки полигонного полиэтилентерефталата / Р.Ю. Митрофанов, П.Н. Бочкарев, В.П. Севодин // Прикладная химия. 2007. Т. 80. Вып. 6. С. 1017–1019.
Диэтиловый эфир , также известный как эфир и этоксиэтан , представляет собой прозрачную, бесцветную и легковоспламеняющуюся жидкость с низкой температурой кипения и характерным запахом. Это наиболее распространенный член класса химических соединений, известных как простые эфиры. Это изомер бутанола. Диэтиловый эфир имеет формулу CH 3 -СН 2 -О-СН 2 -СН 3 . Он используется в качестве общего растворителя и используется в качестве общего анестетика. Дополнительные рекомендуемые знания
История Алхимику Раймунду Луллу приписывают открытие соединения в 1275 году нашей эры, хотя современных свидетельств этому нет. Впервые он был синтезирован в 1540 году Валериусом Кордусом, который назвал его « масло сладкого купороса » ( oleum dulci vitrioli ) — это название было связано с тем, что первоначально оно было обнаружено путем перегонки смеси этанола и серной кислоты (тогда известной как купоросное масло) и отметил некоторые ее лечебные свойства. Примерно в то же время Теофраст Бомбаст фон Гогенгейм, более известный как Парацельс, открыл обезболивающие свойства эфира. МетаболизмПредполагается, что фермент цитохром Р450 метаболизирует диэтиловый эфир. [1] Диэтиловый эфир ингибирует алкогольдегидрогеназу и тем самым замедляет метаболизм этанола. [2] Он также ингибирует метаболизм других лекарственных средств, требующих окислительного метаболизма [3] Приложения Диэтиловый эфир — обычный лабораторный растворитель. Он имеет ограниченную растворимость в воде, поэтому обычно используется для жидкостной экстракции. Будучи менее плотным, чем вода, эфирный слой обычно находится сверху. Его аналогом является дихлорметан, который также нерастворим в воде и также используется для жидкостно-жидкостной экстракции (дихлорметан обычно является нижней фазой). Диэтиловый эфир является обычным растворителем для реакции Гриньяра и многих других реакций с участием металлоорганических реагентов. Он особенно важен в качестве растворителя при производстве целлюлозных пластиков, таких как ацетат целлюлозы. Применение анестезииАмериканский врач Кроуфорд Уильямсон Лонг, доктор медицинских наук, был первым хирургом, применившим его в качестве общего наркоза 30 марта 1842 года. [6] William T.G. Ранее Мортону приписывали первую публичную демонстрацию эфирной анестезии 16 октября 1846 года в Эфирном куполе в Бостоне, штат Массачусетс, хотя теперь известно, что доктор Кроуфорд Лонг публично продемонстрировал ее использование другим официальным лицам в Джорджии. Вместо хлороформа иногда использовали эфир, потому что он имел более широкий диапазон терапевтического индекса, большую разницу между рекомендуемой дозировкой и токсической передозировкой. Сегодня эфир используется редко. Использование легковоспламеняющегося эфира уменьшилось, когда стали доступны негорючие анестетики, такие как галотан. Эфир можно использовать для обезболивания клещей перед их удалением из тела животного или человека. Анестезия расслабляет клеща и не позволяет ему удерживать свой ротовой аппарат под кожей. [ ссылка необходима ] Рекреационное использованиеОбезболивающее действие эфира сделало его рекреационным наркотиком, хотя и не очень популярным. Диэтиловый эфир не так токсичен, как другие растворители, используемые в качестве рекреационных наркотиков. Эфир, смешанный с этанолом, продавался в 19 веке как панацея и рекреационный наркотик во время одного из движений западного общества за воздержание. В то время считалось неприличным для женщин употреблять алкогольные напитки на общественных мероприятиях, и иногда вместо них употребляли наркотики, содержащие эфир. Из-за его несмешиваемости с водой и того факта, что неполярные органические соединения хорошо растворяются в ней, эфир также используется в производстве кокаина в свободном основании и включен в Таблицу II в качестве прекурсора в соответствии с Конвенцией Организации Объединенных Наций о борьбе с незаконным оборотом. по наркотическим средствам и психотропным веществам. [8] Производство Диэтиловый эфир редко получают в лабораториях из-за связанных с этим опасностей и легкой доступности для законных лабораторий. Большая часть диэтилового эфира производится как побочный продукт парофазной гидратации этилена с получением этанола. Диэтиловый эфир может быть получен как в лабораторных условиях, так и в промышленных масштабах путем синтеза кислого эфира. Этанол смешивают с сильной дегидратирующей кислотой, обычно серной кислотой, H 2 SO 4 . Кислота диссоциирует с образованием ионов водорода H + . Ион водорода протонирует электроотрицательный атом кислорода этанола, придавая молекуле этанола положительный заряд:
Нуклеофильный атом кислорода непротонированного этанола вытесняет молекулу воды из протонированной молекулы акулы воды, водородного (электрофильного) этанола и этанола эфир.
Реакция получения диэтилового эфира является обратимой, поэтому в конце концов достигается равновесие между реагентами и продуктами. Для получения хорошего выхода эфира необходимо, чтобы эфир был отогнан из реакционной смеси до того, как он превратится в этанол, используя принцип Ле Шателье. Безопасность Диэтиловый эфир склонен к образованию перекиси и может образовывать взрывоопасную перекись диэтилового эфира. Пероксиды эфира имеют более высокую температуру кипения и в сухом виде являются контактными взрывчатыми веществами. Диэтиловый эфир обычно поставляется со следовыми количествами антиоксиданта BHT (2,6-ди-трет-бутил-4-метилфенол), который уменьшает образование пероксидов. Эфир – легковоспламеняющийся материал. При использовании эфира следует избегать открытого огня и даже устройств с электрическим нагревом, поскольку он легко воспламеняется от пламени или искры. Температура самовоспламенения эфира составляет всего 170°C (338°F), поэтому он может воспламениться от горячей поверхности без пламени или искры. Наиболее распространенной практикой в химических лабораториях является использование пара (таким образом ограничивая температуру до 100 ° C (212 ° F)), когда эфир необходимо нагреть или перегнать. Культурные ссылки Рекреационное использование диэтилового эфира было показано в фильме Страх и ненависть в Лас-Вегасе , основанном на одноименной книге Хантера С. Томпсона, и изображено в романе Правила виноделов Джона Ирвинга и в одноименная экранизация. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Эта статья находится под лицензией GNU Free Documentation License. Он использует материал из статьи Википедии «Диэтиловый_эфир». Список авторов есть в Википедии. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Понимание рисков безопасности диэтилового эфира
Что такое диэтиловый эфир?
Диэтиловый эфир, ранее использовавшийся в качестве анестетика, представляет собой органическое соединение, используемое в основном в качестве растворителя. Это бесцветное, очень летучее химическое вещество имеет резкий, но несколько сладковатый запах.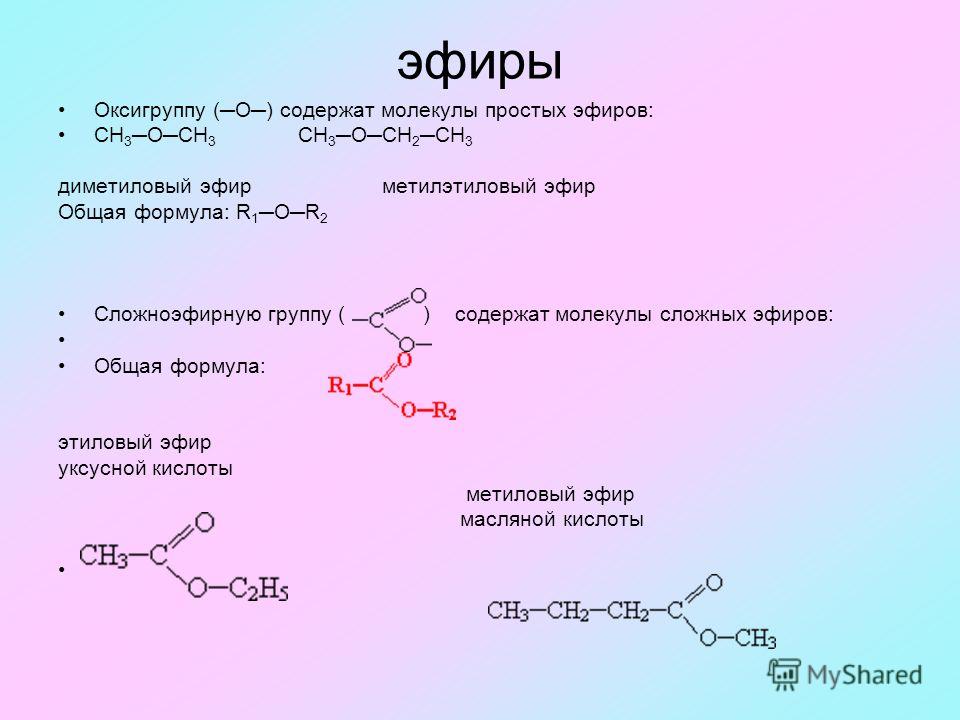 Из-за его чрезвычайной воспламеняемости и других потенциальных опасностей диэтиловый эфир следует хранить и обращаться с ним на рабочем месте с особой осторожностью. Ознакомьтесь с нашими советами по безопасному обращению с диэтиловым эфиром и его хранению, а также о том, как справиться с воздействием и разливами.
Из-за его чрезвычайной воспламеняемости и других потенциальных опасностей диэтиловый эфир следует хранить и обращаться с ним на рабочем месте с особой осторожностью. Ознакомьтесь с нашими советами по безопасному обращению с диэтиловым эфиром и его хранению, а также о том, как справиться с воздействием и разливами.
Обычное использование диэтилового эфира
Диэтиловый эфир получают из комбинации этанола и серной кислоты и имеют несколько основных применений. Этот химикат используется как:
- Пусковая жидкость в дизельных и бензиновых двигателях
- Лабораторный растворитель
- Растворитель в производстве целлюлозопластов
Опасность для здоровья, связанная с диэтиловым эфиром
Диэтиловый эфир является летучим химическим веществом, которое может легко загореться или даже взорваться. Пары диэтилового эфира могут воспламениться не только от открытого огня, но и от источников тепла или даже от статического электричества. Кроме того, он может производить взрывоопасные перекиси при воздействии света и воздуха. Это химическое вещество также представляет опасность при вдыхании и может вызвать раздражение глаз и кожи. Из-за этих опасностей важно соблюдать осторожность при работе с диэтиловым эфиром или при нахождении рядом с ним.
Кроме того, он может производить взрывоопасные перекиси при воздействии света и воздуха. Это химическое вещество также представляет опасность при вдыхании и может вызвать раздражение глаз и кожи. Из-за этих опасностей важно соблюдать осторожность при работе с диэтиловым эфиром или при нахождении рядом с ним.
Диэтиловый эфир Безопасность, правильное обращение и первая помощь
При использовании диэтилового эфира на рабочем месте следует использовать только взрывозащищенное (группа С) электрооборудование. Необходим доступ к соответствующему противопожарному оборудованию. В случае небольших возгораний используйте сухой химический порошок. В случае сильного пожара используйте спиртовую пену, водяной спрей или аэрозоль. Нагретые контейнеры можно охлаждать струей воды, чтобы предотвратить повышение давления, воспламенение или взрыв.
Используйте адекватную вентиляцию, чтобы избежать скопления паров. Обеспечьте доступность мест для промывания глаз и аварийных душей, а также используйте защитные очки, перчатки и одобренный противопаровой респиратор. В случае воздействия диэтилового эфира обратитесь за медицинской помощью и следуйте этим рекомендациям по оказанию первой помощи:
В случае воздействия диэтилового эфира обратитесь за медицинской помощью и следуйте этим рекомендациям по оказанию первой помощи:
- Вдыхание – Выйдите на свежий воздух. Если дыхание пострадавшего затруднено, введите кислород. Если дыхание отсутствует, сделайте искусственное дыхание и немедленно обратитесь за медицинской помощью.
- Контакт с глазами – Снимите контактные линзы, если они есть. Немедленно промойте глаза большим количеством воды в течение не менее 15 минут и немедленно обратитесь за медицинской помощью.
- Контакт с кожей – Промойте кожу большим количеством воды и нанесите на раздраженную кожу смягчающее средство. Снять загрязненную одежду. В случае серьезного воздействия на кожу используйте антибактериальный крем и быстро обратитесь за медицинской помощью.
- Проглатывание— НЕ вызывать рвоту. Расстегните тесную одежду. Никогда не давайте ничего в рот человеку, находящемуся без сознания.


 д.
д.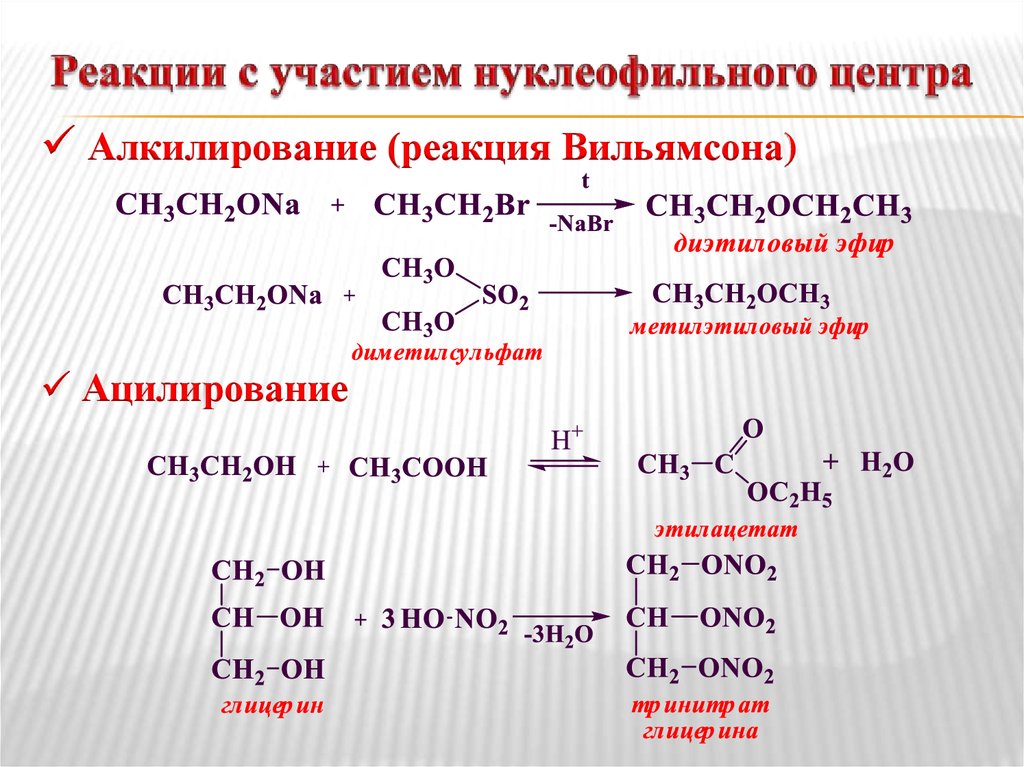 Эфир мало растворим в воде (6,9 г/100 мл).
Эфир мало растворим в воде (6,9 г/100 мл). Имя эфир был дан веществу в 1730 году Августом Зигмундом Фробениусом.
Имя эфир был дан веществу в 1730 году Августом Зигмундом Фробениусом. [4] Диэтиловый эфир имеет высокое цетановое число 85–96 и используется в качестве пусковой жидкости для дизельных и бензиновых двигателей [5] из-за его высокой летучести и низкой температуры самовоспламенения.
[4] Диэтиловый эфир имеет высокое цетановое число 85–96 и используется в качестве пусковой жидкости для дизельных и бензиновых двигателей [5] из-за его высокой летучести и низкой температуры самовоспламенения. Кроме того, у эфира было много нежелательных побочных эффектов, таких как посленаркозная тошнота и рвота. Современные анестетики, такие как метилпропиловый эфир (неотил) и метоксифлуран (пентран), уменьшают эти побочные эффекты. [6]
Кроме того, у эфира было много нежелательных побочных эффектов, таких как посленаркозная тошнота и рвота. Современные анестетики, такие как метилпропиловый эфир (неотил) и метоксифлуран (пентран), уменьшают эти побочные эффекты. [6] 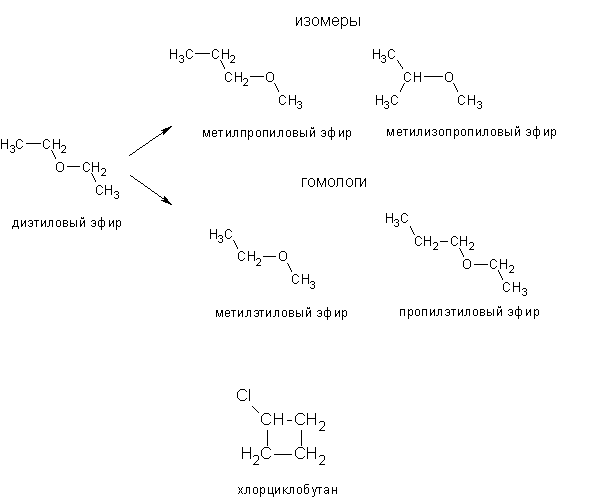 Лекарство от кашля под названием «Капли Хоффмана» в то время продавалось как одно из таких лекарств и содержало в своих капсулах как эфир, так и спирт. [7] Эфир, как правило, трудно употреблять отдельно, поэтому его часто смешивали с такими наркотиками, как этанол, для рекреационного использования. Эфир также можно использовать в качестве ингалятора.
Лекарство от кашля под названием «Капли Хоффмана» в то время продавалось как одно из таких лекарств и содержало в своих капсулах как эфир, так и спирт. [7] Эфир, как правило, трудно употреблять отдельно, поэтому его часто смешивали с такими наркотиками, как этанол, для рекреационного использования. Эфир также можно использовать в качестве ингалятора.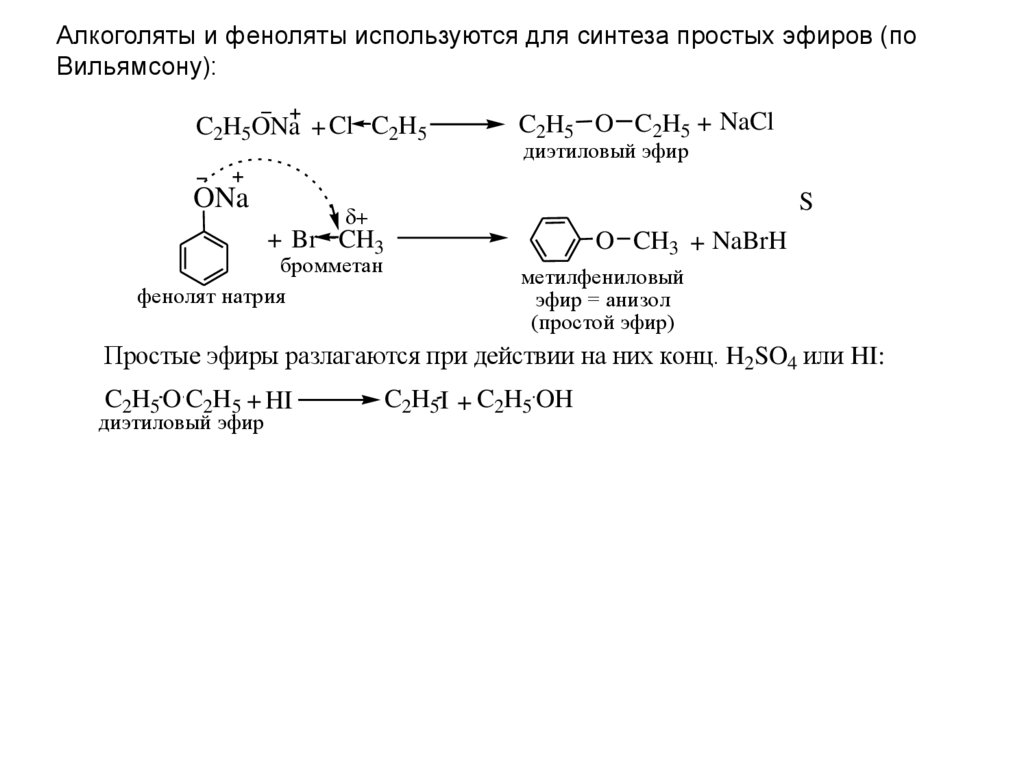 В этом процессе используются катализаторы на основе фосфорной кислоты на твердом носителе, и при необходимости его можно отрегулировать для получения большего количества эфира. [4] Дегидратация этанола в паровой фазе над некоторыми катализаторами на основе оксида алюминия может давать выход диэтилового эфира до 95% [9] .
В этом процессе используются катализаторы на основе фосфорной кислоты на твердом носителе, и при необходимости его можно отрегулировать для получения большего количества эфира. [4] Дегидратация этанола в паровой фазе над некоторыми катализаторами на основе оксида алюминия может давать выход диэтилового эфира до 95% [9] .
 Хранение над NaOH приводит к осаждению промежуточных гидропероксидов эфира. Воду и пероксиды можно удалить либо отгонкой натрия и бензофенона, либо пропусканием через колонку с активированным оксидом алюминия. [10]
Хранение над NaOH приводит к осаждению промежуточных гидропероксидов эфира. Воду и пероксиды можно удалить либо отгонкой натрия и бензофенона, либо пропусканием через колонку с активированным оксидом алюминия. [10]  Пример использования эфира в качестве наркотика в 19 веке можно найти в романе Итало Свево Senilità (1898). Одна из главных героинь, Амалия, замкнутая старая дева лет тридцати с небольшим, пристрастилась к эфиру, впадает в бред и умирает.
Пример использования эфира в качестве наркотика в 19 веке можно найти в романе Итало Свево Senilità (1898). Одна из главных героинь, Амалия, замкнутая старая дева лет тридцати с небольшим, пристрастилась к эфиру, впадает в бред и умирает.