Содержание
10.5.3. Температура кипения и кристаллизации растворов. Эбулиоскопический и криоскопический законы Рауля.
Пример 1. Определите
температуру кипения и замерзания
раствора, содержащего 1 г нитробензола
C6H5NO2
в 10 г
бензола. Эбулиоскопическая и криоскопическая
константы равны 2,57 и 5,10С.
Температура кипения чистого бензола
80,20С,
температура замерзания –5,40С.
Решение: По
закону Рауля:
где ∆tзам
и ∆tкип
–
соответственно понижение температуры
замерзания и повышение температуры
кипения раствора; Ккр
и Э–
соответственно криоскопическая и
эбулиоскопическая константы растворителя;
m1—
масса растворенного вещества, г; mр-ля—
масса растворителя, г; М- молекулярная
масса растворенного вещества; M
(С6H5NO2)=
123,11.
Повышение температуры
кипения раствора нитробензола в бензоле:
Температура кипения
раствора: tкип=80,2+2,09=82,29
°C.
Понижение температуры
замерзания раствора нитробензола в
бензоле:
Температура
замерзания раствора: tзам=
5,4 – 4,14 =1,260C.
Пример
2.
Раствор камфоры массой 0,522 г в 17 г эфира
кипит при температуре на 0,4610С
выше, чем чистый эфир. Эбулиоскопическая
константа эфира 2,160С.
Определите молекулярную массу камфоры.
Решение:
Молекулярную
массу камфоры определяем, пользуясь
соотношением
M=
Молекулярная масса
камфоры равна 155,14.
1 Вычислить повышение
температуры кипения раствора, содержащего
0,488 г бензойной кислоты С7Н6О2
в 50,0 г
хлороформа Ехлороформа=3,
88 град. Ответ: 0,31 град.
Ответ: 0,31 град.
2 Вычислить
температуру кипения раствора, содержащего
0,5 моль растворенного вещества в 1000 г
ацетона. Eацетона=1,5
град; температура кипения ацетона 56,0
град. Ответ: 56,75 град.
3 Вычислить
температуру кипения раствора анилина
в этиловом эфире, содержащего 12 г анилина
С6Н5NH2
в 200 г раствора. Еэфира=2,12
град; температура кипения эфира 35,6 град.
Ответ: 370С.
4 В каком количестве
сероуглерода нужно растворить 0,1 моль
вещества, чтобы раствор кипел при 470С?
Температура кипения сероуглерода
46,30С;
ЕCS2
=2,29 град.
Ответ: 327
г.
5 Температура
кипения эфира 35,60С,
Еэфира=2,12
град. Вычислить молекулярную массу
бензойной кислоты, если 10%-ный раствор
ее в эфире кипит при 37,530С.
Ответ: 122.
6 Раствор, содержащий
4,6 г глицерина С3Н5(ОН)3
в 200 г ацетона, кипит при 56,730С.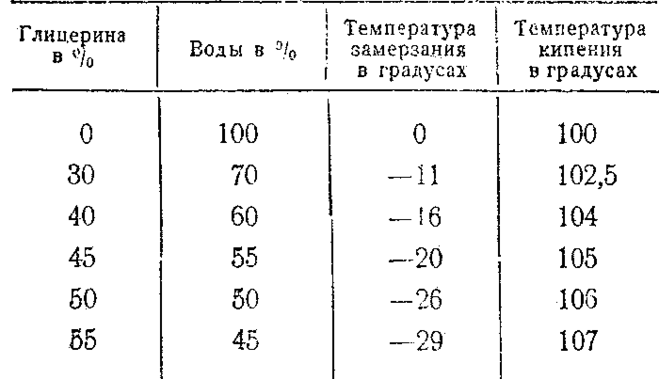
Чистый ацетон закипает при 56,30C.
Вычислить эбулиоскопическую константу
ацетона. Ответ: 1,720.
7 Сколько
граммов глюкозы С6Н12О6
растворено в 500 г воды, если раствор
закипает при 100,2580С?
Ответ: 45,35 г.
8 Сколько глицерина
С3Н5(ОН)3
надо взять
на 2 л воды, чтобы получить раствор с
температурой кипения 106 °С? Ответ: 2,156
кг.
9 5 г некоторого
вещества растворено в 200 г воды. Температура
кипения раствора 100,4320С.
Вычислить молекулярную массу растворенного
вещества. Ответ: 29,6.
10 Температура
кипения раствора 0,36 г фосфора в 60 г
сероуглерода (Е=2,4 град) на 0,120С
выше, чем у чистого растворителя. Чему
равна молекулярная масса фосфора в
растворе? Сколько атомов фосфора
заключается в одной молекуле? Ответ:
Р4.
11 Температура
кипения раствора 12,8 г серы в 250 г бензола
(Е=2,57град. ) на 0,5140С
) на 0,5140С
выше, чем у чистого растворителя. Вывести
молекулярную формулу серы в растворенном
состоянии. Сколько атомов серы входит
в состав одной молекулы этого вещества?
Ответ: S8.
12 Определите
температуру кипения 10%-ного водного
раствора глюкозы С6Н12O6.
Ответ: 100,320C.
13 Определите
температуру кипения раствора 1 г нафталина
С10Н8
в 20г эфира, если температура кипения
эфира равна 35,60С,
а Е=2,160С.
Ответ:36,440С.
14 Раствор, состоящий
из 9,2 г иода и 100 г метилового спирта,
закипает при 65,00С.
Сколько атомов входит в состав молекулы
иода, находящегося в растворенном
состоянии? Температура кипения спирта
64,70С,
а E=0,840.
Ответ: I2.
15
Вычислить
температуру кипения раствора, содержащего
100 г сахара С12Н22О11
в 750 г воды.
Ответ: 100,20С.
16 Вычислить
процентное содержание сахара С12Н22O11
в растворе, температура кипения которого
100,130С.
Ответ: 7,88%.
17 В каком количестве
воды следует растворить 23 г глицерина
С3Н8О3,
чтобы получить раствор с температурой
кипения 100,1040С?
Ответ:1250 г.
18 Какая часть моля
сахара C12H22O11приходится
на 1 моль воды в растворе, температура
кипения которого 100,0390С?
Ответ: 1,35∙10-3
моль.
19 В скольких молях
воды следует растворить 0,02 моля некоторого
неэлектролита для получения раствора
с температурой кипения 100,0260С?
Ответ: 22,2 моль.
20 Температура
кипения ацетона 56,10С,
а Е=1,730.
Вычислить температуру кипения 8%-ного
раствора глицерина С3Н803
в ацетоне.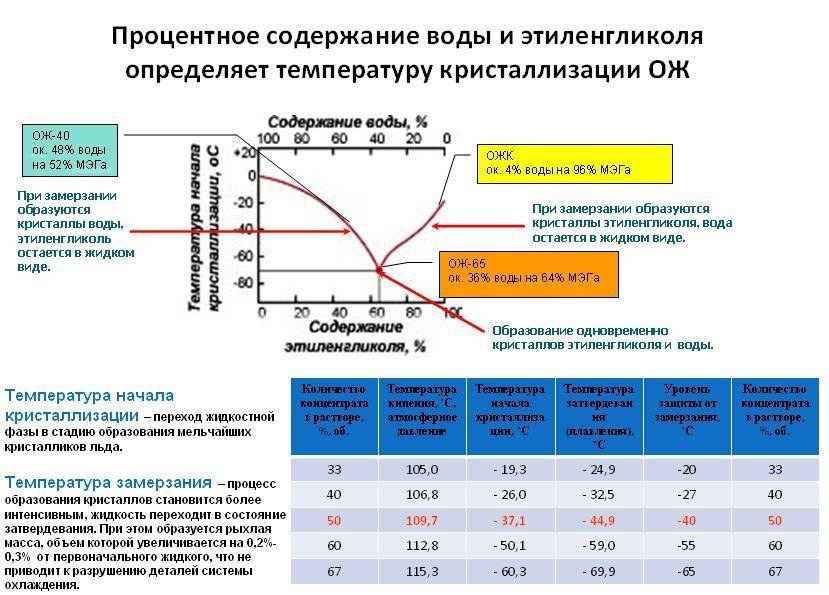 Ответ:57,730С.
Ответ:57,730С.
21 Температура
кипения эфира 34,50С,
а Е=2,160.
Вычислить молекулярную массу бензойной
кислоты, если известно, что 5%-ный раствор
этой кислоты в эфире кипит при 35,530С.
Ответ: 122.
22 Температура
кипения разбавленного раствора сахара
C12H22O11
100,0650С.
Вычислить осмотическое давление раствора
при 00С.
Плотность раствора принять равной
единице. Ответ: 271,5 кПа.
23 Раствор 55,4 г
неэлектролита в 2,5 л воды кипит при
100,160С.
Чему равна молекулярная масса
неэлектролита? Ответ: 72,0.
24 Повышение
температуры кипения раствора 0,94 г фенола
С6Н5ОН
в 50 г этилового спирта (Е=1,16 град) 0,2320С.
Найти молекулярную массу фенола. Ответ:
94.
25 Раствор 15г
хлороформа в 400г диэтилового эфира
(Е=2,02 град) кипит при температуре,
превышающей температуру кипения
растворителя на 0,635 °C.
Вычислите молекулярную массу хлороформа.
Ответ: 119,3.
26 При какой
температуре должен кипеть раствор,
содержащий 0,062моль неэлектролита в 200
мл воды? Ответ: 100,160С.
27 Раствор, содержащий
2,3 г С3Н8О3
в 100г ацетона
(Ткип.=56,30С),
кипит при 56,730С.
Найдите Е для ацетона. Ответ: 1,720С.
28 Сколько граммов
сахара С12H22O11
надо растворить в 100 г воды, чтобы а)
повысить температуру кипения на 1 градус?
б) Понизить температуру замерзания на
1 град? Ответ: а) 65,8 г; б) 18,4 г.
29 При растворении
13 г неэлектролита в 400 г диэтилового
эфира (С2Н5)2O
температура кипения повысилась на 0,453
градуса. Определить молекулярную массу
растворенного вещества. Ответ: 145.
30 Температура
кипения водного раствора сахара C12H22O11
равна
101,40С.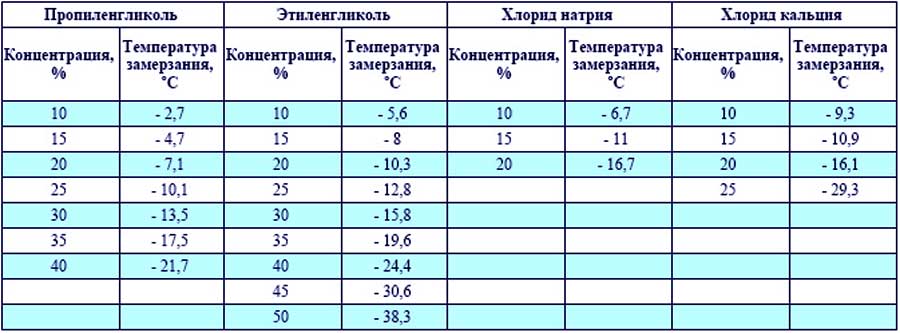
Вычислить моляльность раствора. При
какой температуре замерзает этот
раствор? Ответ: 2 моль/кг; -3,720С.
31 Вычислить
понижение температуры замерзания
раствора, содержащего 0,2 моль растворенного
вещества в 750 г бензола (К=5,12 град). Ответ:
1,365 град.
32 Температура
замерзания уксусной кислоты 16,650С,
а К=3,9 град. Вычислить температуру
замерзания раствора, содержащего 0,1
моль растворенного вещества в 150 г
уксусной кислоты. Ответ: 14,050С.
33 Вычислить
температуру замерзания 10%-ного водного
раствора глюкозы С6Н12О6.
Ответ: -1,0480С.
34 Температура
замерзания бензола 5,50С.
Криоскопическая константа 5,12 град.
Сколько молей растворенного вещества
содержится в 125 г бензола, если раствор
замерзает при 4,990С?
Ответ: 0,012 моль.
35 Сколько глицерина
С3Н8О3
нужно растворить в 200 г воды, чтобы
раствор замерзал при -10С?
Ответ: 9,9 г.
36 Водный раствор
сахара замерзает при -1,050С.
Сколько процентов сахара содержит этот
раствор, если молекулярная масса сахара
342? Ответ:16,2%
37 Раствор, содержащий
1,74 г растворенного вещества в 45,0 г воды,
замерзает при -1,20С.
Вычислить молекулярную массу растворенного
вещества. Ответ: 60.
38 Антифризы –
жидкости с пониженной температурой
замерзания, применяемые в системах
охлаждения двигателей. Вычислить
количество этиленгликоля С2Н4(ОН)2
которое необходимо прибавить к 1 кг воды
для приготовления антифриза с температурой
замерзания -150С.
Ответ: 500 г.
39 При растворении
0,502 г ацетона (СН3)2
CO
в 100 г уксусной кислоты температура
замерзания понижается на 0,3390C.
Вычислить криоскопическую константу
уксусной кислоты. Ответ: 3,92 град.
40 Сколько граммов
нафталина С10Н8
содержится
в 3 кг бензола, если раствор замерзает
при 4,550С?
Т. зам. бензола 5,50С,
зам. бензола 5,50С,
а К=5,1 град. Ответ:71,5г.
41 В 250 г воды
растворено 1,6 г некоторого неэлектролита.
Температура замерзания раствора -0,20С.
Вычислить молекулярную массу неэлектролита.
Ответ: 59,5.
42 Раствор, содержащий
6 г мочевины в 50 г воды, замерзает при
-3,720С.
Вычислить молекулярную массу мочевины.
Ответ: 60.
43 Для приготовления
охлаждающей жидкости на 20 л воды взято
6 л глицерина С3Н8О3.
Чему равна температура замерзания
приготовленной смеси? Плотность глицерина
равна 1,26 г/мл. Ответ: -7,560С.
44 Формалин, уксусная
кислота и глюкоза имеют одинаковый
элементарный состав: С – 39,97%; Н – 6,73% и
О – 53,30%. Приготовлены три раствора: по
1,5 г каждого из перечисленных веществ
на 25 г воды. Температура замерзания
растворов равны: первого – 3,72 °C,
второго -1,860С
и третьего – 0,620С,
Вывести молекулярные формулы указанных
веществ. Ответ: Формалин СН2O;
Ответ: Формалин СН2O;
уксусная кислота СН3СOOН;
глюкоза С6Н12O6.
45 Раствор 1,05 г
неэлектролита в 30 г воды замерзает при
-0,70С.
Вычислите молекулярную массу неэлектролита.
Ответ: 92,5.
46 Какова температура
замерзания раствора неэлектролита,
содержащего 2,02∙1023
молекул в литре воды? Ответ: -0,620С.
47 Определите
формулу вещества, содержащего 39,34%
углерода, 8,20% водорода и 52,46% серы, если
раствор 0,2 г этого вещества в 26 г бензола
замерзает при температуре на 0,3180С
ниже, чем чистый бензол. Oтвет:
C4H10S2.
48 Понижение
температуры замерзания раствора 0,052 г
камфоры в 26г бензола равно 0,0670C.
Рассчитайте молекулярную массу камфоры.
Ответ:152,2.
49 Для приготовления
охлаждающей жидкости на 30 л воды взято
9 л глицерина С3Н8О3.
Чему равна температура замерзания
приготовленного раствора? Плотность
глицерина равна 1,261 г/мл. Ответ: 7,60С.
50 При какой
температуре будет замерзать 25%-ный
раствор этилового спирта С2Н5ОН
в воде? Ответ: -13,40С.
51 При какой
температуре будет замерзать раствор,
содержащий в 4 л воды 500 г этиленгликоля
С2Н4(ОН)2?
Ответ: -3,730C.
52 Сколько граммов
нафталина С10Н8
находится
в 8 кг бензола, если этот раствор замерзает
при 3,4 50С?
Температура замерзания чистого бензола
5,400С.
Ответ: 392 г.
53 Вычислить
процентное содержание сахара С12Н22О11
в водном
растворе, температура замерзания
которого -0,410С.
Ответ: 7%.
54 Вычислить
температуру замерзания водного раствора
мочевины СО(NH2)2
, в котором
на 100 молей воды приходится 1 моль
растворенного вещества.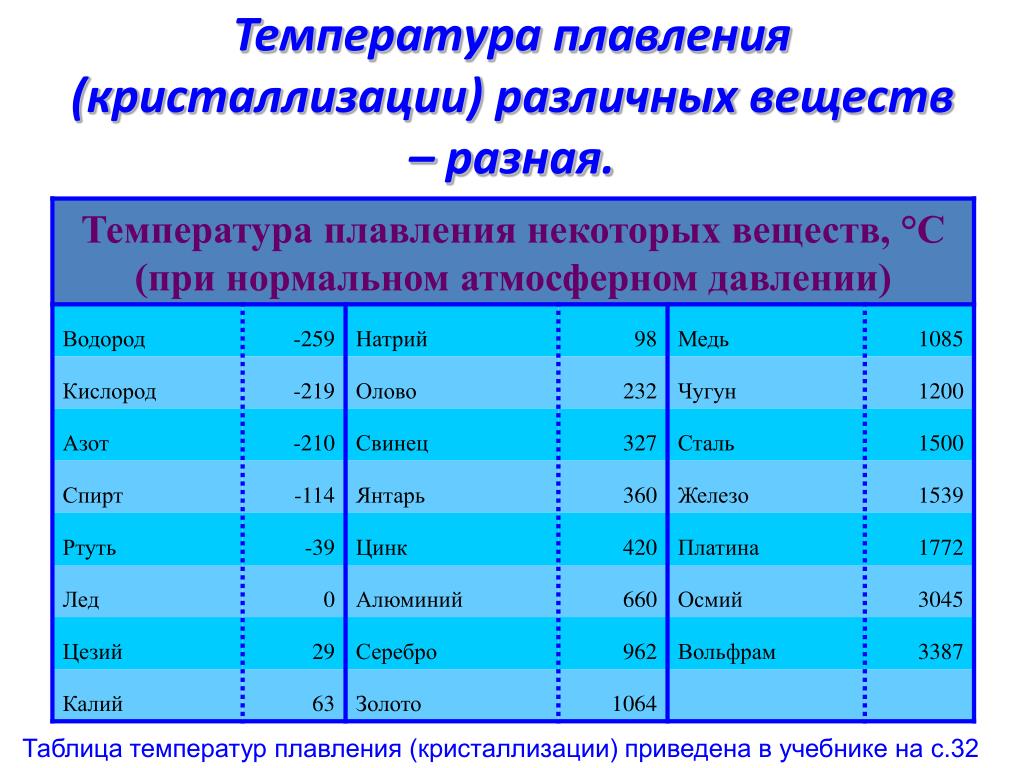 Ответ: -1,0330С.
Ответ: -1,0330С.
55 Раствор сахара
С12H22O11
оказывает при 270C
осмотическое давление, равное 156 кПа.
Принимая плотность раствора равной
единице, вычислить температуру его
замерзания. Ответ: -0,1190С.
56 В каком количестве
воды следует растворить 0,5 кг глицерина
С3H8O3
для получения раствора с температурой
замерзания – 30С?
Ответ:3,37кг.
57 При растворении
0,4 г некоторого вещества в 10 г воды
температура замерзания раствора
понижается на 1,240C.
Вычислить молекулярную массу растворенного
вещества. Ответ: 60.
58 Водный раствор
глицерина замерзает при температуре
-2,790С.
Вычислить число молей глицерина,
приходящихся на каждые 100 молей воды, и
давление пара раствора при 200С.
Давление пара воды при 200С
равно 2,34 кПа. Ответ: 2,7 моля.
59 Раствор сахара
в воде показывает повышение температуры
кипения на 0,312 °С. Вычислить величину
Вычислить величину
понижения температуры замерзания этого
раствора. Ответ: 1,116 °С.
60 Давление пара
водного раствора глицерина составляет
98% от давления пара воды при той же
температуре. Вычислить процентное
содержание глицерина в растворе и
температуру кристаллизации раствора.
Ответ: 9,44%; -2,10С.
ТЕМПЕРАТУРА ЗАТВЕРДЕВАНИЯ | Энциклопедия Кругосвет
ТЕМПЕРАТУРА ЗАТВЕРДЕВАНИЯ (точка затвердевания) – температура, при которой жидкость превращается в твердое вещество.
Для чистого вещества совпадает с его температурой плавления, т.е. температурой перехода из твердого состояния в жидкое. Строго определенную температуру затвердевания имеют лишь чистые кристаллические вещества.
Аморфные же, т.е. некристаллические вещества (например, стекло, сливочное масло), затвердевают (и плавятся) в некотором интервале температур. Для таких веществ проводят различие между температурами затвердевания и плавления: под температурой затвердевания понимают температуру, при которой в системе при охлаждении появляются первые признаки твердой фазы либо при нагревании исчезают последние ее следы, а под температурой плавления – наинизшую температуру, при которой в процессе охлаждения исчезают последние следы жидкой фазы или при нагревании появляются первые ее признаки. Температура затвердевания большинства веществ немного изменяется при изменении давления: как правило, она повышается с его повышением.
Температура затвердевания большинства веществ немного изменяется при изменении давления: как правило, она повышается с его повышением.
Смеси жидкостей, например воды и спиртов, тоже затвердевают (замерзают) в широком интервале температур, причем температура их замерзания всегда ниже, чем у чистого компонента с более высокой точкой замерзания. Поэтому в качестве одного из компонентов антифриза в системе охлаждения автомобилей широко применяются этиловый спирт (температура замерзания -130° С) и этиленгликоль (температура замерзания -25° С).
Температура, при которой замерзают последние следы жидкой смеси, может быть гораздо ниже, чем у компонента с более низкой точкой замерзания.
Некоторые вещества, например иод и парадихлорбензол, переходят из твердого состояния сразу в газообразное (сублимируются). У них нет ни температуры плавления, ни температуры затвердевания.
ТЕМПЕРАТУРА ЗАТВЕРДЕВАНИЯ (ПЛАВЛЕНИЯ) НЕКОТОРЫХ ВЕЩЕСТВ | |
| Вещество | Температура, °С |
| Вода | 0 |
| Золото | 1062 |
| Изопропиловый спирт | –89 |
| Метиловый спирт | –97,8 |
| Морская вода | –2,5 |
| Ртуть | –38,87 |
| Серебро | 960 |
| Этиленгликоль | –25 |
| Этиловый спирт | –130 |
| Эфир | –117,6 |
При определенных условиях жидкости можно охладить ниже их истинной температуры затвердевания без перехода в твердое состояние. Такие жидкости называется переохлажденными. Поскольку твердое тело нельзя «перегреть» так, чтобы оно не перешло в жидкость, температуры плавления и затвердевания обычно определяют экспериментально по расплавлению. Это позволяет избежать ошибки, обусловленной переохлаждением жидкости. По тем же соображениям в научной и технической литературе при описании физических свойств вещества предпочитают термин «температура плавления». См. также ТЕМПЕРАТУРА КИПЕНИЯ; ТЕПЛОТА; ЖИДКОСТЕЙ ТЕОРИЯ.
Такие жидкости называется переохлажденными. Поскольку твердое тело нельзя «перегреть» так, чтобы оно не перешло в жидкость, температуры плавления и затвердевания обычно определяют экспериментально по расплавлению. Это позволяет избежать ошибки, обусловленной переохлаждением жидкости. По тем же соображениям в научной и технической литературе при описании физических свойств вещества предпочитают термин «температура плавления». См. также ТЕМПЕРАТУРА КИПЕНИЯ; ТЕПЛОТА; ЖИДКОСТЕЙ ТЕОРИЯ.
Проверь себя!
Ответь на вопросы викторины «Физика»
Что такое изотоп, чему равно число Авогадро и что изучает наука реология?
Пройти тест
Диметиловый эфир | Продукты | Mitsubishi Gas Chemical Company, Inc.
Этот веб-сайт использует файлы cookie. Использование этого сайта будет означать, что вы согласны со всеми условиями нашей Политики конфиденциальности.close
| Сокращение | ДМЭ |
|---|---|
| Завод | Ниигата |
| Основное применение | Аэрозольный пропеллент |
| Существующее химическое вещество № | (2)-360 |
Свойства
| Химическая формула | СН 3 ОСН 3 |
|---|---|
| Молекулярный вес | 46.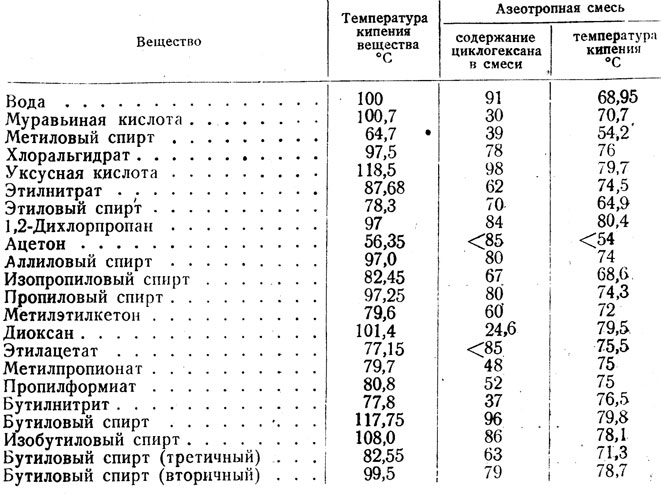 07 07 |
| Внешний вид | Бесцветный газ |
| Запах | Слегка сладковатый запах |
| Удельный вес (25℃/4℃) | 0,661 (20℃ жидкость) |
| Температура кипения (℃ 760 мм рт.ст.) | -24,9 |
| Температура замерзания (℃ 760 мм рт.ст.) | -141,5 |
| Температура вспышки (℃ Tagliabue (Tag) в закрытом тигле) | -41,1 |
| Температура воспламенения (℃) | 350 |
| Пределы воспламеняемости (об.%) | 3,4~27 |
| Давление паров (мм рт.ст. 25℃) | 1930(0℃) 3800(20,8℃) |
| Вязкость (CP 25℃) | Нет данных |
| Растворимость | 7,0 г/100 г воды (18 ℃) 35 мас.% (24 ℃ 5 атмосферное давление) |
| Стабильность и Реактивность | Термически стабилен в атмосфере инертного газа даже при высоких температурах 400℃. Также стабилен в нейтральных и разбавленных кислых и щелочных растворах. Также стабилен в нейтральных и разбавленных кислых и щелочных растворах. |
Применимое законодательство
| Закон о промышленной безопасности и охране здоровья | Легковоспламеняющийся газ |
|---|---|
| Газ высокого давления | Газ высокого давления, горючий газ, сжиженный газ |
| Закон о пожарной службе | - |
| Закон о контроле за ядовитыми и вредными веществами | - |
| Закон о предотвращении загрязнения моря и морских бедствий | - |
| Закон о безопасности судов | Опасный материал, газ высокого давления |
| Закон о гражданской авиации | Взрывчатые вещества, газ высокого давления |
| Другие основные применимые законы | Стандарт качества косметики (Стандарты на сырье для косметики) |
Классификация опасности
| Классификация | Газ высокого давления, горючий газ |
|---|---|
| Опасный | Сжиженный газ высокого давления и легковоспламеняющийся |
| Вредный | Очень слабое наркотическое действие; дискомфорт при воздействии высоких концентраций, т. е. 7,5%; без видимых физических изменений; прямой контакт со сжиженным газом может привести к поражению кожи или обморожению. е. 7,5%; без видимых физических изменений; прямой контакт со сжиженным газом может привести к поражению кожи или обморожению. |
Стандарт продукта
| Чистота (мас.%) | 99,9 или выше |
|---|---|
| Двуокись углерода (мас.%) | 0,1 или менее |
| Метилформиат (мас.%) | 0,01 или менее |
| Метанол (мас.%) | 0,01 или менее |
| Содержание воды (мас.%) | 0,002 или менее |
| Давление пара (МПа) | 0,41 ± 0,02 (20 ℃) |
| Удельный вес (20/4℃) | 0,67±0,01 |
Запросы, касающиеся продуктов
Бизнес-сектор основных химических веществ
Основные химические вещества, подразделение I
Отдел продаж и маркетинга
ТЕЛ. Форма
Депрессия точки замерзания Проблемы №1-10
Задача №1: Сколько граммов пиразина (C 4 H 4 N 2 ) нужно растворить в 1,50 кг четыреххлористого углерода, чтобы понизить температуру замерзания на 4,4 °C? Константа точки замерзания четыреххлористого углерода составляет 30 °С/м.
Задача №2: При растворении 0,258 г молекулярного соединения бензойной кислоты в 40,0 г бензола температура замерзания раствора понизилась до 5,23 °С. Какова молекулярная масса бензойной кислоты?
Мы проверяем K f на наличие бензола и обнаруживаем, что он составляет 5,12 °C/м. Установлено, что температура замерзания бензола составляет 5,5°С.
Задача №3: При растворении 92,0 г молекулярного соединения в 1000 г воды температура замерзания раствора понизилась до −3,72 °C. Какова молекулярная масса соединения?
Задача № 4: Каково понижение температуры замерзания, когда 62,2 г толуола (C 7 H 8 ) растворяют в 481 г нафталина? Константа точки замерзания нафталина составляет 7,00 °С/м.
62,2 г / 92,1402 г/моль = 0,675058 моль
Δt = i К ф м
x = (1) (7,00 °C кг моль¯ 1 ) (0,675058 моль / 0,481 кг)
х = 9,82 °С
Задача №5: Сколько граммов пиразола (C 3 H 4 N 2 ) нужно растворить в 736 г камфоры, чтобы понизить температуру замерзания на 15,0 °C? Константа точки замерзания камфоры составляет 40 °С/м.
Решение:
Δt = i К f м
15,0 °C = (1) (40, °C кг моль¯ 1 ) (х/0,736 кг)
15,0 °C = (54,3478 °C моль¯ 1 ) (x)
х = 0,276 моль
68,0786 г/моль умножить на 0,276 моль = 18,8 г (до трех цифр)
Задача № 6: Какова температура замерзания раствора, полученного добавлением 140 г трихотецина (C 19 H 24 O 5 ) к 0,746 кг бензола? Температура замерзания чистого бензола 5,5°С. Константа точки замерзания бензола составляет 5,12 °С/м.
Решение:
140 г / 332,39 г/моль = 0,421192 моль
Δt = i К f м
x = (1) (5,12 °C кг моль¯ 1 ) (0,421192 моль / 0,746 кг)
x = 2,89 °C 5,5 °C − 2,89 °C = 2,6 °C (с точностью до двух цифр это новая точка замерзания)
Задача № 7: Каково понижение температуры замерзания, когда 309 г изопрена (C 5 H 8 ) растворяют в 747 г этилового эфира? Константа точки замерзания этилового эфира равна 1,79. °С/м.
°С/м.
Решение:
309 г / 68,1182 г/моль = 4,536233 моль
Δt = i К f м
x = (1) (1,79 °C кг моль¯ 1 ) (4,536233 моль / 0,747 кг)
х = 10,87 °С
Задача №8: Какова температура замерзания раствора, полученного добавлением 239,0 г пентагидрата сульфата меди(II) к 4,00 л воды? Депрессия точки замерзания воды 1,86 °С/м.
Решение:
239,0 г / 249,681 г/моль = 0,95722 моль
Δt = i К f мx = (2) (1,86 °C кг моль¯ 1 ) (0,95722 моль / 4,00 кг)
х = 0,89 °С
Раствор замерзает при -0,89 °C.
Обратите внимание на использование коэффициента Вант-Гоффа, равного 2, для CuSO 4 .
Задача № 9: Раствор, содержащий 55,0 г аскорбиновой кислоты (витамина С) в 250 г воды, замерзает при температуре -2,34 °C. Рассчитайте молярную массу (в г/моль) растворенного вещества.
Решение:
1) Используйте ΔT = i K f м
2,34 = (1) (1,86) (х)
х = 1,258 моль/кг
Примечание: фактор Ван-т-Гоффа для аскорбиновой кислоты равен 1, так как она не ионизируется в растворе (это слабая кислота, поэтому она немного ионизируется, но мы игнорируем ее для этой проблемы)
2) молекулярная масса, метод №1
1,258 моль соответствует 1 кг, а х соответствует 0,250 кг
х = 0,3145 моль
55,0 г/0,3145 моль = 175 г/моль
3) молекулярная масса, метод №2
55 г/0,250 кг = 220 г/1 кг
220 г до х как 1,258 моляль до 1 моляль
х = 175 г
175 г – масса аскорбиновой кислоты в 1 моляльном растворе, что соответствует 1 молю растворенного вещества на 1 кг растворителя.
Заключение: молярная масса 175 г/моль
Задача №10: Когда 1,150 грамма неизвестного неэлектролита растворяются в 10,0 граммах воды, раствор замерзает при -2,16 °C. Какова молекулярная масса неизвестного соединения? К f для воды = 1,86 °С/м.
Какова молекулярная масса неизвестного соединения? К f для воды = 1,86 °С/м.
Решение:
1) Определить, сколько молей растворенного соединения:
Δt = i К f м
2,16 °C = (1) (1,86 °C кг моль¯ 1 ) (x / 0,0100 кг)
2,16 °C = (186 °C моль¯ 1 ) (x)
х = 0,0116129 моль
2) Определите молекулярную массу:
1,150 г / 0,0116129 моль = 99,0 г/моль
Бонусная задача №1: Уксусная кислота (CH 3 COOH) представляет собой полярную молекулу и может образовывать водородные связи с молекулами воды. Поэтому он имеет высокую растворимость в воде. Однако уксусная кислота также растворима в бензоле (C 6 H 6 ), неполярном растворителе, который не способен образовывать водородные связи. Раствор 3,80 г CH 3 COOH в 80,0 г C 6 H 6 имеет температуру замерзания 3,46 °C. Какова молярная масса растворенного вещества?
Какова молярная масса растворенного вещества?
Решение:
1) Некоторые поиски дают следующие значения для бензола:
точка замерзания = 5,49 °C
криоскопическая постоянная (K f = 5,12 °C кг моль¯ 1
2а) Нам нужно определить, сколько молей уксусной кислоты было растворено:
Δt = i К f м
2,03 °C = (1) (5,12 °C кг моль¯ 1 ) (x / 0,0800 кг)
2,03 °C = (64 °C моль¯ 1 ) (x)
х = 0,031719 моль
Обратите внимание на использование 1 для фактора Ван ‘т Хоффа. Это делается потому, что уксусная кислота растворяется в неполярном растворителе. Обычно ионы не образуются в неполярном растворителе.
2b) Вот альтернативный путь к родинкам:
Δt = K f m m = Δt / K f
m = 2,03 °C / 5,12 °C кг моль¯ 1 = 0,396484 моль/кг
моль —> (0,396484 моль/кг) (0,0800 кг) = 0,031719 моль
3) Определите молярную массу:
3,80 г/0,031719 моль = 119,8 г/моль
4) Рассчитанный ответ примерно вдвое превышает известную молярную массу (60,0 г/моль) уксусной кислоты. Уксусная кислота в бензоле образует димеры, состоящие из двух химически соединенных молекул уксусной кислоты. Это предполагаемая структура димера:
Уксусная кислота в бензоле образует димеры, состоящие из двух химически соединенных молекул уксусной кислоты. Это предполагаемая структура димера:
5) Образование димеров привело бы к изменению фактора Вант-Гоффа до значения 0,5.
Дополнительная задача № 2: Какой объем этиленгликоля (C 2 H 6 O 2 ), неэлектролита, необходимо добавить к 20,0 л воды, чтобы получить раствор антифриза с температурой замерзания −34,0 °С? (Плотность этиленгликоля 1,11 г/см 3 , плотность воды 1,00 г/см 3 .)
Решение:
1) Нужно определить моли этиленгликоля:
Δt = i К f м
34,0 °C = (1) (1,86 °C кг моль¯ 1 ) (x / 20,0 кг)
34,0 °C = (0,093 °C моль¯ 1 ) (x)
х = 365,59 моль
2) Сколько это в граммах?
(365,59 моль) (62,0674 г/моль) = 22691,22 г
3) Какой объем это занимает?
22691,22 г / 1,11 г/см 3 = 20442 см 3
Это 20,44 л
Приблизительное 50/50 (по объему) смешивание этиленгликоля и воды дает нам необходимое понижение точки замерзания. Обратите внимание, что я не удосужился показать, как 20,0 л воды превратились в 20,0 кг.
Обратите внимание, что я не удосужился показать, как 20,0 л воды превратились в 20,0 кг.
Дополнительная задача №3: Соединение содержит 42,9 % C, 2,4 % H, 16,6 % N и 38,1 % O по массе. Добавление 3,16 г этого соединения к 75,0 мл циклогексана (d = 0,779 г/мл) дает раствор с температурой замерзания 0,0 °С. Нормальная температура замерзания циклогексана составляет 6,5 °С, а его константа депрессии температуры замерзания составляет 20,2 °С/м. Какова молекулярная формула растворенного вещества?
Решение:
1) Определить массу циклогексана:
75,0 мл x 0,779 г/мл = 58,425 г
2) Определить количество молей растворенного соединения:
Δt = i К f м
6,5 °C = (1) (20,2 °C кг моль¯ 1 ) (x / 0,058425 кг)
6,5 °C = (345,7424 °C моль¯ 1 ) (x)
х = 0,0188 моль
3) Определите молекулярную массу соединения:
3,16 г/0,0188 моль = 168 г/моль
4) Определите эмпирическую формулу соединения:
Предположим, что присутствует 100 г соединения.

