Охлаждение — устаревший способ местной анестезии. Так как эфир легко испаряющаяся
ЭФИРЫ | АРТконсервация
ПРОСТЫЕ ЭФИРЫ
Простые эфиры — это органические соединения, в которых два радикала замещены на атом кислорода. Эфиры растворяют воска и жиры.
Этиловый эфир (С2Н5)2О — легкая, быстро улетучивающаяся жидкость (точка кипения 34,5°), которая хорошо растворяет масла, смолы и воска. Одна часть эфира растворяется в 13 частях воды. Смесь паров диэтилового эфира с воздухом образует гремучую смесь; взрывается при нагревании также остаток после испарения эфира. Так как эфир разлагается в воздухе и на свету, его следует хранить в темных, хорошо закупоренных бутылях. Пары эфира действуют наркотирующе. Этиловый эфир известен с XVI столетия, его часто называют серным эфиром.
Глнколевые эфиры, целлозольвы,— недавно примененная группа медленно испаряющихся растворителей с точкой кипения 126—137°. Они хорошо растворяют сложные эфиры целлюлозы, искусственные смолы и старые лакокрасочные покрытия.
Диоксан — бесцветная жидкость, кипящая при 101,5°, с эфирным запахом. Смешивается с водой и с большей частью органических растворителей. Растворяет природные и искусственные смолы, масла, жиры, воска и производные целлюлозы. Его пары ядовиты и в смеси с воздухом взрываются.
СЛОЖНЫЕ ЭФИРЫ
Образуются этерификацией органических кислот спиртами. Низшие сложные эфиры растворяются в воде. Сложные эфиры уксусной кислоты хорошо растворяют смолы и производные целлюлозы.
Метилацетат (СН3.СОО.СН3), с точкой кипения 58% похож своими свойствами на ацетон.
Пропилацетат, с точкой кипения 102°, испаряется медленнее, чем ацетон, на который он похож своим действием.
С другими растворителями он образует весьма эффективные смеси.
Бутилацетат (СН3.СОО.С4Н9) — жидкость с запахом эфира, с точкой кипения 126°. Растворяет производные целлюлозы. Не ядовит и заменяет слишком едко пахнущий амилацетат.
Амилацетат (СН3.СОО.С5Н11) — жидкость с едким запахом, с точкой кипения 135—148°. Хорошо растворяет смолы, масла и нитроцеллюлозу. Не смешивается с водой. Синтетически получается из керосина.
Сложные эфиры молочной кислоты не имеют запаха. Из них наиболее употребительным является бутилоктат [СН3СН(ОН)СООС4Н9], весьма медленно испаряется, кипит при температуре 185—195°. Растворяет поливинилацетатные смолы, которые применяются в качестве связующих художественных красок. Зарекомендовал себя и при растворении старых лакокрасочных покрытий.
Первоисточник:
Техника живописи. Б. Сланский - АХ СССР, М., 1962art-con.ru
Как заморозить жидкость, заставляя ее кипеть
В одном из предыдущих разделов мы указывали на то, что количество теплоты, необходимое для испарения, настолько велико, что горячая вода, кипящая без нагревания при низком давлении, поглощает столько собственной теплоты, что очень скоро сильно охлаждается. Нам нужно только продолжать этот опыт дальше, чтобы заставить кипящую воду замерзнуть, если давление, под которым она находится, будет достаточно низко. Для того чтобы получить такое низкое давление, надо было бы обратиться к очень хорошему воздушному насосу и беспрерывно поглощать возникающий водяной пар при помощи крепкой серной кислоты. Удобнее морозить воду при помощи других жидкостей, которые испаряются легче воды, как, например, сернистый углерод или эфир. Сернистый углерод является таким веществом, против присутствия которого в доме могут быть, благодаря его запаху, сделаны некоторые возражения, так как аромат моторных экипажей по сравнению с ним напоминает скорее свежий ветерок Цейлонского острова. По этой причине мы возьмем эфир, хотя его запах тоже не слишком подходит к домашней обстановке, поэтому лучше всего выбрать для опыта послеобеденное время, когда родители и другие старшие будут заняты делами вне дома. Удобнее всего это устроить так, как показано на рис.43.В куске дерева надо сделать углубление и в него налить несколько капель воды. В воду опустить наперсток, почти наполненный эфиром. Если взять эфира на 10 коп., то его хватит на несколько опытов. Потом взять резиновые меха, которые бывают у пульверизаторов для жидкостей, и конец резиновой трубки надеть на стеклянную трубку или на другой наконечник с очень узким отверстием.Если экспериментатор молод и обладает хорошими легкими, то он может обойтись без мехов.Чтобы эфир, на который дуют, не пролился в воду, следует расширить край наперстка, вставляя его в тоненькую дощечку с круглым отверстием. Или вместо этого следует дуть осторожно и терпеливо. Пары эфира легко воспламеняются, и потому нельзя держать вблизи эфира свечу или лампу.Струя воздуха заставляет эфир быстро испаряться. Этим пользуются прачки, вешая белье для просушки на воздухе в ветреный день. Непрерывно ветер уносит слой воздуха, насыщенный паром, а на его место гонит сухой воздух, и поэтому вода в белье быстрее испаряется. Ток воздуха, искусственно направленный на эфир, производит такое же действие, т. е. ускоряет испарение эфира. Поглощение теплоты, доставленной самим эфиром, настолько велико, что прежде чем эфир из наперстка испарится, он уже настолько охладится, что будет в состоянии заморозить воду. Наперсток в конце концов примерзнет к доске. Если даже в этом опыте замерзание вызвано не собственно кипением, то во всяком случае сходным с кипением процессом ускоренного парообразования.
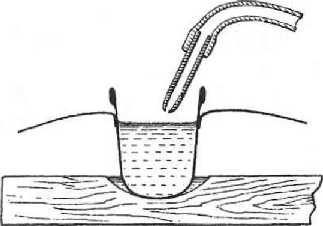
Рис.43. Замораживание воды при помощи испаряющегося эфира
Мы уже говорили, что для замораживания воды путем кипения при низком давлении нужен хороший воздушный насос и очень быстрое поглощение водяного пара серной кислотой. Еще есть другая жидкость, которая легко переходит в твердое состояние, если мы часть ее заставим испариться (настоящего кипения и здесь также не будет). Это — жидкая углекислота. Угольная кислота в газообразной форме всем известна. Этот газ выделяется при открытии бутылки из многих напитков, как сельтерская вода, пиво, шипучее вино, заставляя все эти напитки пениться. При давлении в 60 атмосфер удается угольную кислоту привести в жидкое состояние при обыкновенной температуре. В таком виде она продается, большею частью, в стальных бутылках. Если открыть затвор такой бутылки, когда она стоит, то выделится сильная струя газообразной угольной кислоты, которая, вследствие уменьшения давления при открытии бутылки, получается из жидкой кислоты. Давлением этой еще достаточно сгущенной газообразной угольной кислоты пользуются в пивных для вытеснения пива из бочек. Наполнить такую бутылку углекислотой стоит недорого (около одного рубля) и некоторые читатели, может быть, в состоянии выписать себе эту бутылку с угольной кислотой от какой-нибудь фирмы, занимающейся производством жидкой углекислоты. Такую бутылку с угольной кислотой кладут на пол или на устойчивый стол, так чтобы отверстие, откуда течет жидкость, лежало бы ниже закрытого конца. Тогда находящаяся внутри газообразная углекислота скопляется у закрытого конца, а жидкая у выхода. Если теперь мы откроем кран, то сжатый газ вытолкнет жидкость. При этом удивительно то, что мы совершенно не замечаем струи жидкости, а только видим, как выделяется белый туман, который осаживается на полу или столе в виде белого налета, т. е. в совершенно твердом состоянии. Отсюда ясно, что этот налет состоит из твердых частиц, т. е. из твердой углекислоты.Чтобы получить твердую углекислоту в большем количестве, обвязывают крепко горлышко бутылки мешком из толстой фланели или подобного материала, так чтобы струя углекислоты втекала внутрь этого мешка. Если мы теперь откроем затвор бутылки достаточно широко, то мешок быстро наполнится снегообразной массой твердой угольной кислоты. Все это может быть объяснено очень просто.При нормальной температуре жидкая углекислота остается в жидком состоянии, только при очень высоком давлении, если это давление, когда бутылка открыта, уменьшается, то углекислота довольно быстро переходит в газообразное состояние. Этот газ бесцветен и невидим. Необходимая для испарения теплота берется у самой углекислоты, как у той, которая остается в жидком виде, так и у той, которая переходит в газ. Поэтому то часть углекислоты покидает бутылку в виде маленьких твердых частиц, которые и соединяются в мешке в большие массы, газообразная же углекислота фильтруется в воздух через мешок. Теперь мы действительно убедились, что при испарении одной части жидкости другая часть может замерзнуть. Твердая углекислота обладает, понятно, очень низкой температурой, около -60 °С. Необходимо касаться ее очень осторожно, так как охлаждение может вызвать те же явления, какие получаются при сильном нагревании, т. е. «ожог». Если у нас есть под рукой ртуть, из случайно разбитого термометра, то можно ее заморозить; это ясно докажет нам, как низка температура твердой углекислоты. Для этого наполним деревянную чашку, при помощи какой-нибудь ложки, снегообразной углекислотой и крепко ее сожмем, предварительно сделав посредине маленькое углубление. Когда мы нальем в это углубление ртуть, то уже через несколько минут мы можем ложкой вынуть совершенно твердый комок ртути. Но металл не следует оставлять на столе, так как он уже при температуре в -39 °С начинает таять. При незначительном колебании или наклоне поверхности стола ртуть скатывается в форме шарообразных капель, которые потом довольно трудно поймать, так как они легко проваливаются в щели пола. Так как пары ртути очень ядовиты, то ее не следует оставлять открытой на долгое время в комнате, даже в небольшом количестве. Следует еще заметить, что термометры из ртути не годятся для измерения температуры ниже -39 "С. Для таких случаев берут термометр, содержаний жидкость, у которого точка замерзания значительно ниже, например спирт.Здесь мы скажем еще об одном наблюдении. Если в течение некоторого времени мы оставим лежать снегообразную угольную кислоту, то легко заметим, что масса ее станет уменьшатся, но не таять. Это объясняется тем, что при обыкновенном атмосферном давлении она, минуя жидкое состояние, переходит непосредственно из твердого состояния в газообразное и делается невидимой для глаз. Так и снег, или кусок льда, который лежит в морозную погоду в открытом месте на весах, постепенно становится легче благодаря непосредственному испарению. Если же вы заметите, что снегообразная угольная кислота или вещество, которое с ней соприкасается, покроются небольшим количеством жидкости, то не подумайте, что это жидкая угольная кислота! Это просто вода, осевшая на очень холодных предметах благодаря сгущению водяного пара из воздуха.
gl-lib.ru
Эфиры горение - Справочник химика 21
| Рис. 12. Прибор для демонстрации горения борнометилового эфира |  |
Почему эфир так легко воспламеняется Ответить на этот вопрос чрезвычайно трудно, так как мы очень мало знаем о химии горения, химии взрывов и т. п. Существует так называемая точка воспламенения — минимальная температура, которую должно достигнуть данное вещество, чтобы загореться, если его поджечь. Так вот, точка воспламенения эфира ниже, чем у бензина и большинства растворителей, которые применяются в лаборатории диэтиловый эфир —49° С, бензин (октановое число 100) —38° С, бензол 11 С и этиловый спирт 13° С. [c.440]
Решение. Реакция горения диэтилового эфира протекает по уравнению [c.47]
Основное применение борогидрид лития находит в органической химии в качестве восстановителя [6 . Он восстанавливает альдегиды и сложные эфиры до первичных спиртов, кетоны до вторичных спиртов, но не восстанавливает нитрилы, амиды, ароматические кислоты. Борогидрид лития используют для получения боразола, который применяется как инициатор горения топлива [7], в электролитах для осаждения циркония [8], как источник водорода при получении губчатых материалов [9]. [c.27]
Опыт 23.3. В фарфоровую чашечку поместить около 0,1 г буры, добавить 1 мл этилового спирта, перенести под тягу и поджечь. Какого цвета пламя Написать уравнение реакции образования борноэтилового эфира и его горения. [c.214]
Температурой вспышки называется та низшая темпе ратура, при которой пожароопасная жидкость, испаряясь, образует с воздухом смесь, способную воспламениться при поднесении к ней источника зажигания. При вспышке количество выделившегося тепла недостаточно для того, чтобы вызвать новое выделение паров жидкости и воспламенить саму жидкость, поэтому горение прекращается. Температура вспышки — один из важнейших параметров, по которому определяется степень пожароопасности жидкости. Жидкости с температурой вспышки паров до 45 С, например эфир, бензол или метиловый спирт, называются легковоспламеняющимися (ЛВЖ), а с температурой вспышки выше 45 °С, например глицерин, нитробензол, фурфурол, этиленгликоль,— горючими жидкостями (ГЖ). Знание температуры вспышки имеет большое значение. для пожарной профилактики для надлежащего размещения зданий и аппаратуры, применения строительных конструкций и материалов, разработки мер по тушению пожаров и эвакуации людей. [c.31]
Первичные амины легко образуются при щелочном омылении эфиров изоциановой кислоты именно этим путем они были впервые получены Вюрцем, который установил их отличие от аммиака на основании способности к горению [c.161]
ОПЫТЫ С ЭФИРОМ Горение паров эфира [c.139]
Теплоты горения жирных кислот и их метиловых и этиловых эфиров [12] [c.539]
Метилбутиловый третичный эфир (рис. 48) с октановым числом 115—135 и точкой кипения 55 °С особенно улучшает антидетонационные свойства моторного топлива в конце фронта горения. Эфир образуется при взаимодействии изобутана с метанолом при относительно низком давлении в жидкой фазе и использовании каталитического обмена кислотного иона при температурах ниже 100°С [c.230]
Несколько кристаллов борной кислоты поместите в маленькую фарфоровую чашку, добавьте 2—3 капли концентрированной серной кислоты и 10—15 капель спирта. Смесь тщательно перемешайте палочкой, перенесите чашку в вытяжной шкаф и подожгите содержимое. Обратите внимание на ярко-зеленую кайму горящего эфира. Составьте уравнение реакции образования эфира и его горения. [c.173]
В 1776 г. он показал, что при горении угля и алмаза образуется один и тот же газ, известный тогда под названием фиксированный воздух (СО2). А. Лавуазье нашел, что этот газ состоит из угля и кислорода. В 1777 г. им было исследовано горение органических веществ и установлено, что спирт, эфир, воск образуют при сгорании также фиксированный воздух . Количественный состав углекислого газа (28% С и 72% О) был определен [c.89]
Опыт 3. Образование и горение эфиров борной кислоты. Поместите в небольшую фарфоровую чашечку или в тигель 2—3 кри- [c.208]
Если загорится жидкость в колбе или стакане, то прикрыть сосуд сверху мокрым полотенцем, фарфоровой чашкой или чем-то другим, прекращая доступ воздуха к месту горения. Горящие жидкости, нерастворимые в воде, нельзя тушить водой. Загоревшийся бензол, эфир, бензин и т. п. гасить песком или четыреххлористым углеродом. Последний испаряется, и его тяжелые пары изолируют место горения от воздуха. Горящие жидкости, растворимые в воде (спирт, ацетон, и т. д.), можно гасить водой. [c.19]
Являясь составной частью древесины, целлюлоза используется в строительном и столярном деле и как топливо (горение идет с выделением энергии) из древесины получают бумагу и картон, этиловый спирт. В виде волокнистых материалов (хлопка,льна, конопли) целлюлоза используется для изготовления тканей, нитей эфиры целлюлозы идут на изготовление нитролаков, кинопленок, бездымного пороха, пластмасс, медицинского коллодия, искусственного волокна. [c.629]
В первом случае однозначной связи между температурой и скоростью горения не обнаружено, что, впрочем, естественно, если исходить из формул (9) и (10), так как значения энергии активации мог т меняться при переходе от одной смеси к другой. Тем не менее оказалось [9], что для определенных групп смесей зависимость и (Гг) является одной и той же (например, на одну и ту же кривую ложатся точки для ряда углеводородов, спиртов и эфиров в смеси с О2 и N2, однако эта кривая построена не по формулам (9) и (10)). [c.25]
В ре зультате реакции окисления могут образовываться малоустойчивые соединения, являющиеся источниками радикалов, которые в дальнейшем ускоряют эту реакцию. Поэтому при бесконтрольном течении процесса может получиться сложная смесь органических соединений (сложные эфиры, оксикислоты, различные MOHO- и дикарбоновые кислоты и т. д.) и даже продукты горения с образованием двуокиси углерода и воды. Учитывая это, процесс окисления высших алканов проводят при температуре около 150°С в присутствии солей марганца (катализатор). При этом можно добиться получения только одного определенного продукта (с небольшими примесями). Например, при каталитическом окислении высших парафинов нормального строения ( 12 — С25) получают высшие л ирные кислоты (ВЖК) и высшие жирные спирты (ВЖС), представляющие собой весьма ценные продукты, применяемые для производства поверхностно-активных веществ (ПАВ). [c.54]
Первым обширным исследованием, проведенным с помощью масс-спектрометра, была работа Лейфера и Ури [23], которые изучали пиролиз диметилового эфира и ацетальдегида.Хотя им и не удалось обнаружить радикалы, но они смогли показать, что промежуточным продуктом разложения димети лового эфира является формальдегид, и проследить его концептрацию. Более успешной была попытка Эльтентона [24, 25], которому удалось сконструировать установку, способную обнаружить свободные радикалы при пиролитических реакциях и в пламенах даже нри высоких давлениях (около 160 мм рт. ст.). Он также смог обнаружить присутствие радикалов СНз при пиролизе углеводородов, радикалов СНг из СНгКг, а также СНО и СНз при горении СН в кислороде. Метод определения основан в принципе на том, что энергия электронов, необходимая для ионизации радикалов, меньше энергии электронов, необходимой для образования ионизированных частиц из самих исходных молекул. Это дает возможность определять малые количества радикалов в присутствии больших количеств соединений, собственные спектры которых затмевают спектры радикалов. [c.97]
Со смесью спирта и концентрированной серной кислоты НзВОд образует эфиры, горящие зеленым пламенем. Напишите уравнения реакций получения борнометилового и борноэтилового эфиров и их графические формулы. Какие продукты образуются при горении эфиров [c.286]
Спирты, эфиры, кетоны и другие кислородсодержащие производные при сгорании превращаются в СО2 и Н2О, однако устойчивость галоген-производных этих соединений к горению увеличивается по мере повышения в них содержа- [c.462]
Диэтиловый эфир при горении прогревается в глубину, образуя все возрастающий гомотермический слой. Скорость выгорания 30 см/ч, скорость нарастания прогретого слоя 45 см/ч. Тушить рекомендуется химической пеной, подаваемой с интенсивностью 0,8 л/ сек-м ). Воздушно-механическая пена является недостаточно стойкой против прорыва паров эфира через ее слой, Вследствие высокого давления паров эфира они прорываются в ряде случаев даже через слой химической пены. Для устранения повторного воспламенения паров эфира от нагретых стенок резервуара необходимо усиленно их охлаждать. Рекомендуемый расход воды на охлаждение стенок горящего резервуара 0,8 л/ сек-м ), смежных — 0,4 л/(сек-м). При объемном тушении минимальная огнегасительная концентрация углекислого газа 38% объемн., азота 49% объемн. [c.105]
Вода может служить средством огнетушения при воспламенении жидкостей, смешивающихся с водой. Воду нельзя применять для тушения горящих жидкостей, не смешивающихся с водой, например бензола, эфира. Горение при этом не только не будет ликогнеопасные органические вещества легче воды, и при соприкосновении с ней образуют тонкую горящую пленку. При тушении водой площадь горящей пленки возрастает, и тем опаснее становится пожар. [c.20]
Эта связь вполне понятна в свете изложенных выше исследований, констатировавших зависимость детонационной волны горения от реакций окисления п образования перекисей. Повидимому, реакции, предшествующие образованию холодных пламен, при низких температурах и давлениях имеют ту же природу, что и реакции, идущие при высоких температурах и давлениях перед возникновением детонации в моторе. Холодные пламена в смесях углеводородов с кислородом или воздухом, как следует из работ М. Б. Неймана с сотр., могут быть исполь-юваны и промышленностью органического синтеза для получения больших количеств альдегидов, кислот, спиртов и т. д. Продукты окисления в холодном пламени сложной смеси углеводородов моторного топлива СК были исследованы А. Д. Петровым, Е. Б. Соколовой и ]М. С. Федотовым [23]. Ими были идентифицированы и количественно определены разнообразные кислородсодержащие соединения (кислоты, альдегиды, сложные эфиры, спирты, ацетали, кетоны), находящиеся I водном слое. Установлено, что среди продуктов окисления альдегидов (муравьиного и уксусного) и спиртов (метилового и этилового), образующихся, очевидно, путем распада первичных продуктов окисления, преобладают перекиси газообразных углеводородов — продуктов крекинга углеводородов моторного топлива. [c.345]
Чолимерные материалы отличаются высоким содержанием углерода большинство из них не содержит кислорода или содержит его в небольшом количестве. Поэтому для их горения необходим значительный объем воздуха (10—12 м кг) горение их происходит с образованием продукта неполного сгорания — технического углерода. При нагревании большинство полимерных материалов плавится с образованием на поверхности горения жидкого слоя. При дальнейшем нагревании расплавленной массы на воздухе происходит термоокислительная деструкция с образованием горючих и часто ядовитых паров и газов (диоксида и оксида углерода, непредельных углеводородов, органических кислот, эфиров, альдегидов и др.). За исключением диоксида углерода, все продукты деструкции горючие, поэтому, когда концентрация их в воздухе достигает предельного значения, полимерные материалы воспламеняются от источника воспламенения. [c.187]
Пусковые жидкости (табл. 31). Основной составляющей этих жидкостей является легко испаряющийся этиловый эфир (45...60%), который обладает хорошей воспламеняемостью. Для поддержания процесса горения к эфиру добавляют петролейный эфир, газовый бензин и другие низкокипящие углеводороды. Кроме того, для первоначальной смазки поверхновтей трения цилиндро-поршневой группы в жидкость вводят 2...12% маловязкого смазочного масла. С помощью специального пускового приспособления (ПП-40 или 6-ПП-40) эту жидкость подают во впускной трубопровод холодного двигателя при одновременном прокручивании коленчатого вала. Для воспламенения эфира нужна сравнительно невысокая температура в, камере сгорания (180...200° С). Воспламенившись, эфир поджигает пары бензина, в результате сгорания которого в цилиндрах создается давление, достаточное для пуска двигателя. Например, с помощью пусковой жидкости Холод Д-40 можно пускать холодный дизельный дви-гатель при температуре воздуха до —40 С при условии провертывания вручную коленчатого вала с частотой вращения 100 об/мин. [c.61]
Концентрированная ссрная кислота пог. ющаст выделяющуюся воду н способствует сдвигу равновесия реакции вправо. Бораты в среде серной кислоты переходят в борную кислоту, а затем также и эфир. Реакция горения проходит по уравнению [c.137]
При горении борнометилового или борноэтилового эфира пламя окрзшено в зеленый цвет. Реакция используется в аналитической химии. [c.236]
При замене воздуха во взрывчатой смеси кислородом давление при взрыве резко увеличивается за счет увеличения температуры горения. При взрыве даже стехиометрической газовоздуш-пой смеси значительное количество тепла затрачивается на нагревание азота, находящегося в смеси, поэтому температура взрыва таких смесей много ниже температуры взрыва смесей с кислородом. Так, в стехиом-гтрических смесях метана, этилена, ацегона, метилового и этилового эфиров с кислородом давление, образующееся при взрыве, находится в пределах от 15 до 19 атм, в то время как в стехиометрических смесях их с воздухом оно не превышает 10 атм. [c.160]
Из числа добавок наров различных жидкостей эффективно снижали скорость горения анилин, бензол, этиловый эфир, пентакарбонил железа, толуол, к-октан, ацетон незначительно [c.22]
К горючим относится большинство орг. и нек-рые неорг. (напр., S, Р) в-ва. Среди них выделяют легковоспламеняющиеся в-ва, к-рые загораются без предварит, подогрева при кратковрем. воздействии источника зажигания с низкой энергией (пламя спички, искра, накаленный электропровод и др.). К легковоспламеняющимся относят все горючие газы, а также жидкости с т-рой вспышки не выше 61 °С. Легковоспламеняющиеся жидкости делят на особо опасные (т. всп. не более — 18°С, напр, ацетон, диэтиловый эфир, изопентан) постоянно опасные (т. всп. от — 17 до 23 °С, напр, этанол, бензол, этилацетат) опасные при повыш. т-ре (т. всп. от 24 до 61 °С, напр, хлорбензол, скипидар, сольвент). Для легковоспламеняющихся твердых материалов (напр., полистирол, целлулоид, сухая древесная стружка) характерна способность распространять горение по пов-сти при горизонтальном расположении материала. [c.600]
Стекло органическое, горючий листовой материал. Получается полимеризацией метилового эфира метакри-ловой кислоты. Плотн. 1180—1190 кг/л теплота сгорания 6620 ккал/кг т. пл. 125° С. Т. воспл. 260° С т. самовоспл. 460° С. Склонен к тепловому самовозгоранию самонагревание наблюдалось при 100° С т. тлен, отсутствует. Взвешенная в воздухе пыль влажностью 0,6% и зольностью 0,05% и мелкая стружка, образующиеся при обработке стекла, очень взрывоопасны пыль фракции 74 мк имеет нижн. предел взр. 12,6 г м т. искр, отсутствует т. самовоспл. 579° С. По данным [63], нижн. предел взр. 20 г/л макс. давл. взр. 7 кГ/см минимальное содержание кислорода для горения аэровзвеси 14% объемн. миним. энергия зажигания 15 мдж. Осевшая пыль пожароопасна т. самовоспл. около 300° С. Тушить тоикораспыленной водой, пеной. [c.239]
При произ-ве К. для достижения необходимой степени пластификации пироксилин смешивают с р-ром нитроглицерина в летучем р-рителе-ацетоне или смеси этанола с эфиром. Для облегчения переработки пороховой массы добавляют вазелин. Из полученной массы выпрессовывают порох, удаляют летучий р-ритсль и сушат при повыш т-рс К. обладают сильным разгарно-эрозиоиным воздействием на ствол оружия, что является их недостатком. В К., используемые в ствольной артиллерии, для снижения теплоты горения вводят обычно динитротолуол, дибутилфталат, для ослабления дульного пламени-соли калия. [c.471]
Бутиловый эфир 2,4-Д технический (ВСТУ 5-321—62), горючая маслянистая жидкость коричневого цвета со специфическим запахом. Представляет собой техяиче-ский бутиловый эфир 2,4-дихлорфеноксиуксусной кислоты, содержащий 89—93% вес. основного вещества, а также примеси 2,4-дихлорфеноксиуксусной кислоты и бутилового спирта. Плотн. 1240—1244 кг/м в воде не растворяется. Пожароопасные свойства изменяются от образца к образцу т. всп. 74—9ГС т. воспл. 201 — 208° С миним. т. самовоспл. 282—292° С (метод МакНИИ). Устойчивое горение продукта в стальном тигле диаметром 50 мм наблюдалось только при нагреве до 270° С, пламя при этом коптящее оранжевокрасное при-подаче воды и пены пламя увеличивается в несколько раз, эфир вскипает и разбрызгивается, тушение достигается с трудом. Тушение легко достигается тонкораспыленной водой. См, также Бутиловый эфир [c.67]
Изопропилфенилкарбамат, изопропиловый эфир фенилкарбаминовой кислоты (СНз)2СНОСОЫНСбН5, бесцветное твердое горючее вещество. Мол. вес 179,22 плотн. 1090 лг/ж т. пл. 91°С (чистого), >84°С (технического) т. кип. 112—113° С при 1—1,5 мм рт. ст., Т. всп. 135°С т. самовоспл. 427° С минимальное содержание кислорода для диффузионного горения 15,2%. объемн. Взвешенная в воздухе пыль взрывоопасна нижн. предел взр. 13 г/ж т. самовоспл. 870° С. Осевшая пыль пожароопасна. В расплавленном состоянии продукт горит ярким коптящим пламенем. Тушить пеной, тонкораспыленной водой при объемном тушении минимальная огнегасительная концентрация углекислого газа 22% объемн., азота 27% объемн. [c.114]
Октиловый эфир 2,4-Д (С7—Сд) без ОП-7 (СТУ 12-10-196—62), горючая жидкость темно-коричневого цвета, представляет собой продукт этерификацин технической 2,4-дихлорфеноксиуксусной кислоты со смесью жирных спиртов состава —Сд. Т. всп. (в закр. тигле) 114° С, т. всп. (в откр. тигле) 128° С т. воспл. 223° С миним. т. самовоспл. 258° С (метод МакНИИ) темп, пределы воспл. нижн. 100, верхй. 144° С. При температуре 225° С продукт устойчиво горит в стальном тигле диаметром 50 мм при подаче грубодисперсной воды и низкократной пены происходит разбрызгивание продукта и увеличение интенсивности горения. Тущить высокократной пеной. [c.191]
Пластификаторы оказывают существенное влияние на горючесть пластифицированных полимеров. Низкомолекулярные рласти-фикаторы тппа сложных эфиров дикарбоновых кислот, находящиеся в пластифицированном полимере, при контакте с пламенем выделяются из пленки, а затем воспламеняются. Скорость горения пластификатора зависит от его состава и условий, в которых происходит горение. ПВХ-пластикаты, содержащие хлорированные парафины различной степени хлорирования, воспламеняются с трудом. Хорошие результаты по огнестойкости получаются и при частичной замене диэфирного пластификатора хлорированными парафинами [363—368] или галогенсодержащими диэфирами [369—371]. [c.186]
Свойства. М 52,04. Бесцветный ядовитый газ с раздражающим, вызывающим слезотечение запахом, / л —27,9°С /шт —21,17 °С /крит 126,6 °С ж 0,95 (—21°С) АЯобр 260 кДж/моль. ИК-спектр 2662 (сл.), 2562 (ср.), 2156 (оч. с.), 2143 (оч. с.), 2092 (сл.), 739 (с.), 724 (с.), 618 (сл.) см . При горении пламя окрашивается в цвет цветущего персика, к периферии — в голубоватый цвет. Смесь с 14 об.% О2 взрывается. Растворяется в Н2О, спирте и эфире однако в растворах быстро разлагается. Полимеризуется до твердого коричнево-черного парациана на солнечном свету или при нагревании. С водой дает-H N и HN O (см. разд. Псевдогалогены ). [c.689]
chem21.info
Охлаждение - устаревший способ местной анестезии
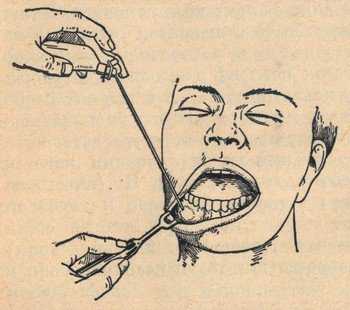
Наиболее простым и легким способом местной анестезии, не требующим никаких приготовлений, является значительное охлаждение вплоть до замораживания поля операции.
Этот метод использовался как в хирургии, так и в стоматологии. Конечно же, сегодня данный способ практически «канул в лету», потому что появились гораздо более совершенные анестетики и методики анестезии. Так, например, каждый стоматолог в своей практике вместо охлаждения может использовать инъекционную, проводниковую или аппликационную анестезию.
Однако, информация о местной анестезии охлаждением хотя сегодня и не актуальна, будет интересна с точки зрения истории медицины.
Местное обезболивание охлаждением
Охлаждение эфиром
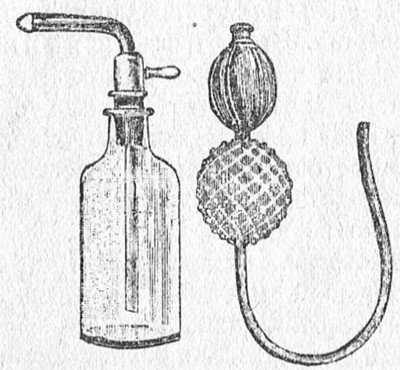
Пульверизатор Ричардсона
В 19-20 веке для охлаждения использовали распыление сернокислого эфира, который быстро испаряется и поглощает тепло из тканей. Струя эфира, непрерывно направляемая на определенное место, в течение нескольких минут вызывает его промерзание. Кожа становится совершенно белой, жесткой, ее можно в это время резать, колоть, так как чувствительность ее потеряна.
Распыливание эфира производится при помощи особого прибора — пульверизатора Ричардсона (смотрите рисунок). Надавливание на резиновые баллоны дает равномерную струю, которая направляется на тот участок кожи, где должна быть произведена операция.
К сожалению этот способ, несмотря на свою простоту, быстроту действие и совершенную безопасность, не свободен и от некоторых весьма существенных недостатков. Анестезия при нем длится всего в течении нескольких минут, так что он пригоден лишь для самых мелких операций (разрез при вскрытии нарыва). Кроме того этот способ отличается крайне неприятным последствием, появлением тягостного чувства ломоты и боли в оттаивающих тканях. Не следует также упускать из виду, что эфир легко воспламеняется. Поэтому его нельзя распылять вблизи какого-либо источника света (керосиновые лампы, свечи), за исключением электрического.
Охлаждение хлористым этилом
Трубка с хлорэтилом (с автоматичоским затвором)
Гораздо лучше, чем эфир, действует другое средство, употребляющееся для охлаждения и замораживания — хлористый этил. Это — бесцветная, легко испаряющаяся, прозрачная жидкость, отпускаемая в особых флаконах, закрывающихся герметически колпачком или же снабженных автоматическим затвором (смотрите рисунок).

Обезболивание при помощи хлористого этила
Чтобы вызвать анестезию, охватывают трубку всей ладонью и открывают крышку или затвор. Теплоты руки достаточно, чтобы вызвать испарение жидкости, вытекающей равномерной струей из отверстия. Необходимо держать трубку на некотором отдалении от анестезируемого места. Уже по прошествии одной-двух минут наступает анестезия, которая узнается по тому, что на коже появляется участок белоснежного цвета. При оттаивании тканей дает знать о себе повышенная чувствительность вследствие оттаивания.
blog-health.ru
Пьющая птичка. Научные игрушки - Класс!ная физика
Пьющая птичка. Научные игрушки
07.2011
Может быть это все-таки "вечный двигатель"? Раз только макни ее носом в воду, а дальше кажется, что все повторяется само собой ... Принцип работы пьющей птички не так уж и нов, он был использован еще великим И. Бернулли в термометре для измерения максимальных температур. Интересно, что птичка будет наклоняться и "пить" раз в 5 чаще, если воду в стакане заменить каким-либо спиртовым раствором, а облучение ее светом или теплом также заставит птичку менять частоту своих движений ...

Медленно опускает "пьющая птичка" свой клюв в стоящий перед ней стакан с водой, затем выпрямляется, покачивается слегка туда-сюда, как-будто собирается остановиться, но через некоторое время, как-будто набравшись сил, вновь наклоняется и макает свой клюв в воду.
Так птичка может пить до бесконечности, пока при наклоне под ее клювом будет вода.
Познакомимся с устройством игрушки. Физическая игрушка "пьющая птичка" состоит из двух полых стеклянных шариков соединенных узкой трубочкой. Причем один из концов трубочки впаян в шарик так, что заканчивается недалеко от дна шарика. При изготовлении игрушки система заполняется жидкостью и запаивается. В качестве жидкости берется легко испаряющаяся жидкость с низкой температурой кипения, например, эфир или метанол. Для большего эффекта жидкость подкрашивают. Наливают жидкости столько, чтобы выступающий в шарик конец трубочки, был в нее погружен.
Шарик с выступающей трубочкой - это "живот" птички, противоположный шарик - "головка". Сверху стекло разрисовывается и декорируется под птичку: перья, шляпка, хвостик. Обязательной частью птички является клюв достаточной длины, который часто обклеивают фетром. Игрушка закреплена чуть выше живота на вращающейся горизонтальной оси и опорах, в результате чего птичка может переворачиваться вниз, т.е. "клевать". Для приведения игрушки в действие перед игрушкой ставят стакан с водой и один раз наклоняют ее, чтобы намочить клюв. А дальше все происходит без остановки ... Пока птичка сможет достать клювом воду в стакане об остановке игрушки можно не беспокоиться!
Каковы же причины "самопроизвольных" наклонов?
Изначально внутри замкнутого сосуда-птички есть легко испаряющаяся жидкость, между жидкостью и парами над ее поверхностью устанавливается термодинамическое равновесие. Пары в зависимости от температуры создают давление на жидкость.
Обмакнем клюв птички в поставленный перед ней сосуд с водой и отпустим. Центр тяжести лежит чуть ниже оси вращения(ближе к животу), таким образом, птичка вынуждена будет выпрямиться.
Вода с намокшего фетрового клюва начнет испаряется, при этом головка птички будет охлаждаться. При охлаждении головки термодинамическое равновесие нарушается. Понижение температуры паров в головке ведет к конденсации паров эфира на внутренних стенках головки. Давление паров эфира в головке упадет. Таким образом, давление паров в головке станет меньше, чем давлением паров над жидкостью в животе птички. Так как выравнивание давлений становится возможным только после того, как жидкость будет вытесняться более высоким давлением паров из нижнего сосуда вверх по трубочке, уровень жидкости в трубочке начнет повышаться. Это при ведет к поднятию точки центра тяжести над осью вращения. и птичка перевернется, снова макая клюв в воду.
При перевороте нижний конец трубочки поднимается над поверхностью жидкости, и жидкость из трубочки стекает опять вниз, а давление паров в верхнем и нижнем шарике выравниваются. Центр тяжести опускается, птичка возвращается в вертикальное положение. Но процесс повторяется, так как клюв уже опять мокрый ... Вот Вам и сказка про бычка, у которой нет конца ...
Если позаботиться, чтобы уровень жидкости в стакане оставался постоянным, то птичка может "пить" вечно!
Но, заметьте! В результате выравнивания давлений паров в верхней и нижней частях птички, давление пара в нижней части трубочки становится меньше первоначального. В нижней части начинается испарение жидкости, и температура жидкости при этом падает. Температура жидкости в нижней части птички становится ниже температуры окружающей среды, и начинается теплопередача от окружающей среды животу птички.
Вот Вам и итог: процессы в птичке можно сравнить с процессами, наблюдаемыми в тепловой машине: циклический процесс (abcd) за счет теплообмена с окружающей средой, при котором внутренняя энергия превращается в механическую.
где:
ab - изотермическое расширение bc - адиабатический расширение cd - изотермическое сжатиеda - адиабатическое сжатие
Интересно, что птичка будет наклоняться-"пить" раз в 5 чаще, если воду в стакане заменить каким-либо спиртовым раствором. Даже облучение ее каким-нибудь образом светом или теплом заставляет птичку менять частоту своих движений. Она будет реагировать по-разному, если облучать , например, голову или живот. При облучении головы она замедляет, а затем и вовсе прекращает свои наклоны. Если же направить свет или источник тепла на живот птички, то она оживляется и кланяется чаще. Птичка замирает и тогда, когда ее ставят под стеклянный колпак и откачивают водух. Создается впечатление, что ей нужна не только вода в стакане, но и наличие воздуха вокруг.
Можно даже убрать стакан с водой, но облучать теплом или светом живот птички, В этом случае птичка также будет совершать свои бесконечные наклоны.

Так как же, есть здесь "вечный двигатель" или нет?
class-fizika.ru
Вода, диметилформамид, диметилсульфоксид, тетрагидрофуран, этилацетат и другие растворители в органической химии
 Это небольшая часть того, что каждый день используется в лаборатории Если вы считаете, что химия - это сливание разных растворчиков вместе, то вы в принципе недалеки от истины. Подавляющее число реакций требуют растворителя - в противном случае реагенты не провзаимодействуют или реакция пройдёт не до конца. Существуют исключения (например, твёрдофазный синтез), а также иногда растворителем является один из реагентов. Но сейчас о более классических случаях. Вода. В отличие от неорганической химии, целый раздел которой посвящён реакциям в водной среде (реакции ионного обмена), в органике далеко не каждый реагент будет растворяться в воде в разумных количествах. В основном в воде ведут реакции с участием неорганических соединений например, реакции окисления). Вода считается относительно химически активной: например, сложные эфиры медленно разлагаются в присутствии воды, не говоря уже об ангидридах кислот, алкоголятах и металлоорганических соединениях. Однако, если в реакции удаётся заменить органический растворитель на воду, то это считается хорошим достижением (особенно в промышленности) и называется "Green Chemistry", поскольку вода впоследствии легко очищается, регенерируется или другим способом утилизируется. Наиболее близкими к воде по свойствам являются, пожалуй, спирты. Но по сравнению с водой, их растворяющая способность (за исключением неорганики) выше. Спирты так же, как и вода, являются полярными, то есть положительные и отрицательные заряды в молекуле расположены неравномерно. Благодаря этому низшие спирты смешиваются с водой и в той или иной степени растворяют неорганические соединения. Также они растворяют жиры и прочие неполярные соединения. Некоторых случаях спирт сам вступает в реакцию, образуя побочные продукты. Преимуществом низших спиртов является лёгкость их выпаривания (особенно под вакуумом), а изопропанол утягивает с собой при этом ещё порядка 15% воды, что позволяет при необходимости легко удалить воду из раствора в довольно щадящих условиях. Спирты: метанол этанол, изопропанол Есть курьёзный случай использования а также других алкогольных напитков – по сути растворов спирта в воде как растворителя в реакции. (см. ссылки)
Это небольшая часть того, что каждый день используется в лаборатории Если вы считаете, что химия - это сливание разных растворчиков вместе, то вы в принципе недалеки от истины. Подавляющее число реакций требуют растворителя - в противном случае реагенты не провзаимодействуют или реакция пройдёт не до конца. Существуют исключения (например, твёрдофазный синтез), а также иногда растворителем является один из реагентов. Но сейчас о более классических случаях. Вода. В отличие от неорганической химии, целый раздел которой посвящён реакциям в водной среде (реакции ионного обмена), в органике далеко не каждый реагент будет растворяться в воде в разумных количествах. В основном в воде ведут реакции с участием неорганических соединений например, реакции окисления). Вода считается относительно химически активной: например, сложные эфиры медленно разлагаются в присутствии воды, не говоря уже об ангидридах кислот, алкоголятах и металлоорганических соединениях. Однако, если в реакции удаётся заменить органический растворитель на воду, то это считается хорошим достижением (особенно в промышленности) и называется "Green Chemistry", поскольку вода впоследствии легко очищается, регенерируется или другим способом утилизируется. Наиболее близкими к воде по свойствам являются, пожалуй, спирты. Но по сравнению с водой, их растворяющая способность (за исключением неорганики) выше. Спирты так же, как и вода, являются полярными, то есть положительные и отрицательные заряды в молекуле расположены неравномерно. Благодаря этому низшие спирты смешиваются с водой и в той или иной степени растворяют неорганические соединения. Также они растворяют жиры и прочие неполярные соединения. Некоторых случаях спирт сам вступает в реакцию, образуя побочные продукты. Преимуществом низших спиртов является лёгкость их выпаривания (особенно под вакуумом), а изопропанол утягивает с собой при этом ещё порядка 15% воды, что позволяет при необходимости легко удалить воду из раствора в довольно щадящих условиях. Спирты: метанол этанол, изопропанол Есть курьёзный случай использования а также других алкогольных напитков – по сути растворов спирта в воде как растворителя в реакции. (см. ссылки)Если нужен полярный растворитель (а от полярности растворителя часто зависит скорость и направление протекания реакции), то также можно взять диметилформамид (ДМФ). Это относительно дешёвый растворитель, производящийся промышленностью в огромных количествах. За счёт отсутствия OH-групп ДМФ более химически инертен и в большинстве случаев может быть нагрет аж до температуры кипения (153°С). Однако высокая температура кипения имеет свои минусы: упаривать его имеет смысл только под вакуумом. Зато ДМФ смешивается с водой, поэтому при выделении продукта часто реакционную смесь выливают в воду и отделяют продукт в виде осадка (для твёрдых и нерастворимых соединений), либо в виде отдельного слоя (если продукт-жидкость), либо экстрагируют из получившегося раствора или эмульсии. Хотя на самом деле ДМФ без проблем отгоняется/перегоняется на роторном испарителе при ~35мм.рт.ст.
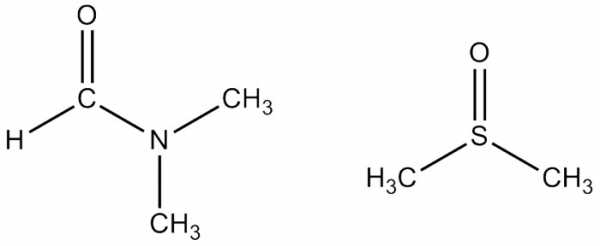 Формулы ДМФ и диметилсульфоксида Ещё один растворитель, смешивающийся с водой - это ДиМетилСульфОксид (ДМСО). ДМСО в чём-то похож на воду: он сильно полярен, вследствие чего растворяет многие неорганические соли. ДМСО смешивается с водой и удивительно нетоксичен: аптечный препарат "димексид" - это чистый диметилсульфоксид. Некоторые неудобства доставляет его высокая температура кипения (189°С) и удивительно высокая температура замерзания (18°С). В большинстве случаев целевой продукт выделяют так же, как и с ДМФ - разбавляя раствор в несколько раз водой. ДМСО, однако, представляет некоторую опасность, т.к. растворённые в нём вещества при попадании на кожу могут беспрепятственно всасываться, что нежелательно, когда это токсичные, ядовитые или раздражающие вещества. Из числа смешивающихся с водой растворителей хочется выделить ТетраГидроФуран, который гораздо менее полярен, чем ДМФ, ДМСО и спирты, но зато более стабилен, поскольку с химической точки зрения является простым эфиром. Кислоты и основания ему нипочём, органику он растворяет отлично (в тяжёлых случаях им можно отмывать посуду, но ДМФ дешевле), при атмосферном давлении кипит при 66°C, что очень удобно. ТГФ - один из немногих растворителей, подходящих для металлорганических соединений (магний- и даже литийорганики). Но он ощутимо дороже большинства растворителей и уже несколько лет считается прекурсором. Тетрагидрофуран и диэтиловый эфир С химической точки зрения ближайшим родственником ТГФ можно назвать диэтиловый эфир. Если говорят "эфир", то обычно именно он и подразумевается. Эфир неполярен (в отличие от ТГФ!) и мало растворяется в воде, что позволяет проводить экстракцию органики из водного раствора. Он очень легко испаряется (Ткип 36°С), и надо быть всегда очень осторожным из-за его выдающейся пожароопасности. Ещё из неприятных свойств - у него очень характерный навязчивый запах, а в больших концентрациях пары эфира вызывают наркоз. Но при соблюдении предосторожности эфир очень удобен в работе, а иногда совершенно незаменим. При невозможности купить его - синтезируют из этанола. Говоря об экстракции, приходит на ум ещё один очень распространённый экстрагент - это петролейный эфир, представляющий собой лёгкие фракции бензина. При соответствующих возможностях используют чистый пентан, гексан или гептан. Вообще алканы обладают довольно слабой растворяющей способностью, и в большинстве случаев стоит использовать что-нибудь другое. Набор реакций, которые можно проводить в петролейном эфире, тоже очень ограничен. В основном петролейный эфир используют для очистки веществ - кристаллизации и хроматографии.
Формулы ДМФ и диметилсульфоксида Ещё один растворитель, смешивающийся с водой - это ДиМетилСульфОксид (ДМСО). ДМСО в чём-то похож на воду: он сильно полярен, вследствие чего растворяет многие неорганические соли. ДМСО смешивается с водой и удивительно нетоксичен: аптечный препарат "димексид" - это чистый диметилсульфоксид. Некоторые неудобства доставляет его высокая температура кипения (189°С) и удивительно высокая температура замерзания (18°С). В большинстве случаев целевой продукт выделяют так же, как и с ДМФ - разбавляя раствор в несколько раз водой. ДМСО, однако, представляет некоторую опасность, т.к. растворённые в нём вещества при попадании на кожу могут беспрепятственно всасываться, что нежелательно, когда это токсичные, ядовитые или раздражающие вещества. Из числа смешивающихся с водой растворителей хочется выделить ТетраГидроФуран, который гораздо менее полярен, чем ДМФ, ДМСО и спирты, но зато более стабилен, поскольку с химической точки зрения является простым эфиром. Кислоты и основания ему нипочём, органику он растворяет отлично (в тяжёлых случаях им можно отмывать посуду, но ДМФ дешевле), при атмосферном давлении кипит при 66°C, что очень удобно. ТГФ - один из немногих растворителей, подходящих для металлорганических соединений (магний- и даже литийорганики). Но он ощутимо дороже большинства растворителей и уже несколько лет считается прекурсором. Тетрагидрофуран и диэтиловый эфир С химической точки зрения ближайшим родственником ТГФ можно назвать диэтиловый эфир. Если говорят "эфир", то обычно именно он и подразумевается. Эфир неполярен (в отличие от ТГФ!) и мало растворяется в воде, что позволяет проводить экстракцию органики из водного раствора. Он очень легко испаряется (Ткип 36°С), и надо быть всегда очень осторожным из-за его выдающейся пожароопасности. Ещё из неприятных свойств - у него очень характерный навязчивый запах, а в больших концентрациях пары эфира вызывают наркоз. Но при соблюдении предосторожности эфир очень удобен в работе, а иногда совершенно незаменим. При невозможности купить его - синтезируют из этанола. Говоря об экстракции, приходит на ум ещё один очень распространённый экстрагент - это петролейный эфир, представляющий собой лёгкие фракции бензина. При соответствующих возможностях используют чистый пентан, гексан или гептан. Вообще алканы обладают довольно слабой растворяющей способностью, и в большинстве случаев стоит использовать что-нибудь другое. Набор реакций, которые можно проводить в петролейном эфире, тоже очень ограничен. В основном петролейный эфир используют для очистки веществ - кристаллизации и хроматографии. 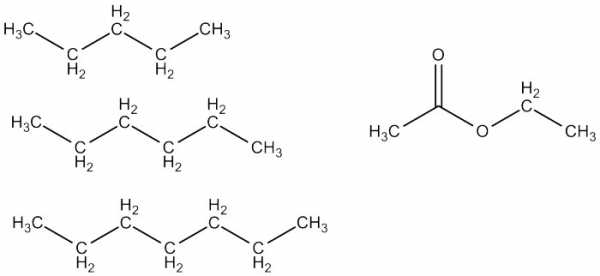 Некоторые из компонентов петролейного эфира и этилацетат (справа) Хорошим экстрагентом является, например, этилацетат (этиловый эфир уксусной кислоты). Он относительно дёшев и нетоксичен, хотя и напоминает запахом лак для ногтей. Он растворяет довольно широкий спектр различной органики, но не очень стоек - в присутствии кислоты или щёлочи распадается, что, кстати, ограничивает возможности экстракции. Смеси этилацетата с петролейным эфиром в разных соотношениях используют для хроматографического разделения веществ, и на это занятие можно спокойно извести за день по нескольку литров каждого компонента. Продолжая тему несмешивающихся с водой растворителей, было бы неправильно обойти стороной хлорорганические растворители: дихлорметан и хлороформ. Они растворяют широкий спектр органики (вплоть до солей аминов), практически не растворяют в себе воду и очень легко испаряются (Ткип 40°С и 61°С соответственно). Важным отличием их является плотность: оба они почти в полтора раза плотнее воды, и поэтому при экстракции органический слой оказывается внизу, что иногда бывает удобно. Дихлорметан и хлороформ Дихлорметан считается относительно безопасным растворителем, а вот хлороформ может вызывать серьёзные отравления и повреждение печени, поэтому без вытяжки работать с ним не рекомендуется. Это, однако, не мешало ему когда-то использоваться как средство для ингаляционного наркоза. Также хлороформ при стоянии на воздухе и свету образует примесь фосгена, которая и является, скорее всего, основной причиной токсичности. Храните ваш хлороформ в тёмном и прохладном месте! Для поиска свойств растворителей удобнее всего использовать Wikipedia, но можно использовать бумажные справочники (см. ниже), а также каталоги поставщиков хим. реактивов, например:
Некоторые из компонентов петролейного эфира и этилацетат (справа) Хорошим экстрагентом является, например, этилацетат (этиловый эфир уксусной кислоты). Он относительно дёшев и нетоксичен, хотя и напоминает запахом лак для ногтей. Он растворяет довольно широкий спектр различной органики, но не очень стоек - в присутствии кислоты или щёлочи распадается, что, кстати, ограничивает возможности экстракции. Смеси этилацетата с петролейным эфиром в разных соотношениях используют для хроматографического разделения веществ, и на это занятие можно спокойно извести за день по нескольку литров каждого компонента. Продолжая тему несмешивающихся с водой растворителей, было бы неправильно обойти стороной хлорорганические растворители: дихлорметан и хлороформ. Они растворяют широкий спектр органики (вплоть до солей аминов), практически не растворяют в себе воду и очень легко испаряются (Ткип 40°С и 61°С соответственно). Важным отличием их является плотность: оба они почти в полтора раза плотнее воды, и поэтому при экстракции органический слой оказывается внизу, что иногда бывает удобно. Дихлорметан и хлороформ Дихлорметан считается относительно безопасным растворителем, а вот хлороформ может вызывать серьёзные отравления и повреждение печени, поэтому без вытяжки работать с ним не рекомендуется. Это, однако, не мешало ему когда-то использоваться как средство для ингаляционного наркоза. Также хлороформ при стоянии на воздухе и свету образует примесь фосгена, которая и является, скорее всего, основной причиной токсичности. Храните ваш хлороформ в тёмном и прохладном месте! Для поиска свойств растворителей удобнее всего использовать Wikipedia, но можно использовать бумажные справочники (см. ниже), а также каталоги поставщиков хим. реактивов, например:http://www.merckmillipore.com/RU/ru/product/Diethyl-ether,MDA_CHEM-100931?https://www.alfa.com/ru/catalog/042254/http://www.sigmaaldrich.com/catalog/product/sial/276855?lang=en®ion=RU
Справочники:CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010.Справочник по растворимости. - М.-Л.: ИАН СССР, 1962.Справочник химика. - Л.-М.: Химия, 1964.
Журнал “Green Chemistry”: http://pubs.rsc.org/en/journals/journalissues/gc#!recentarticles&advРеакции в пиве и прочих напитках: https://www.chemistryworld.com/news/alcoholic-drinks-perfect-solvents-for-polymerisation-/6682.article
chemiday.com
Эфир упругость паров над растворами
Кроме коллоидных систем рассмотренных типов, известно много веществ, представляющих собой естественные золи и студни без всякого предварительного измельчения. К этой группе веществ относятся белки, крахмалы, декстрины, каучуки, эфиры целлюлозы и многие другие соединения. Общей характеристикой этих веществ является их сложное высокомолекулярное строение. Эти вещества обладают настолько большими молекулярными весами, что их трудно определить обычными методами физической химии (понижением упругости пара растворов, криоскопией, эбулиоскопией). [c.11]
Простые вещества. Физические и химические свойства. Бром — темно-красная жидкость, а его пар — желто-бурого цвета с резким раздражающим запахом. Красно-коричневые игольчатые кристаллы брома обладают слабым металлическим блеском. Бром растворим в воде (3,53 г в 100 г воды при комнатной температуре), во многих органических растворителях, обладает высокой упругостью паров. Иод представляет собой черно-серое твердое вещество с металлическим блеском, характеризующееся ромбической молекулярной решеткой. Иод легко возгоняется, образуя фиолетовые пары, состоящие из молекул Та. Иод плохо растворяется в воде, хорошо — в растворах иодидов металлов и органических растворителях. При этом в сольватирующих растворителях (вода, спирты, кислоты) иод образует растворы бурого цвета, а в несольватирую-щих (бензол, сероуглерод, эфиры, углеводороды) — фиолетовые растворы. [c.366]Крайне важно, чтобы растворы диазометана не подвергались непосредственному действию солнечного света или не находились поблизости от сильного источника искусственного света, так как предполагается, что свет был причиной некоторых взрывов, происшедших при работе с диазометаном. Особую осторожность следует соблюдать при применении органических растворителей, имеющих более высокую температуру кипения, чем эфир поскольку упругость паров такого растворителя меньше упругости паров эфира, концентрация диазометана в парах над реакционной смесью будет больше и тем самым увеличивается возможность взрыва. [c.25]
Концентрированную серную кислоту употребляют главным образом для осушения газов, а в эксикаторах—для осушения жидкостей и твердых веществ. Будучи сильной кислотой, она растворяет слабые органические основания, например спирты, простые эфиры, сложные эфиры, амины и т. п. Поэтому серная кислота пригодна для осушения таких веществ в эксикаторе только в том случае, когда упругость паров органического вещества мала. Иногда это свойство серной кислоты используют для удаления непрореагировавшего спирта, например при встряхивании неочищенного алкилгалогенида с концентрированной серной кислотой. При употреблении серной кислоты в эксикаторах она частично восстанавливается [c.573]
Однако и закон Гиббса—Дальтона не всегда соответствует экспериментальным данным по растворимости веществ в сжатых газах. Шиллер [41 показал, что в воздухе при П5 ат растворяется в 2,9 раза больше эфира, чем при атмосферном давлении. Расчет [4] по закону Гиббса — Дальтона дает увеличение всего в 1,7 раз. При 100 ama и 12° сжатый этилен [51 растворяет в 25 600 раз больше нафталина, чем это следует при расчете по упругости пара нафталина при атмосферном давлении. Сжатый водяной пар растворяет соли в таком количестве, что с этим приходится считаться при эксплуатации паровых турбин. Сжатый азот при 100° и 1000 ama растворяет до 10 мол. % бензола [4]. [c.191]
Органические жидкости, которыми приходится пользоваться при приготовлении растворов или при экстрагировании, испаряются особенно быстро, что объясняется или малой величиной скрытой теплоты парообразования этих веществ или высокой упругостью их пара. Такие вещества, как эфир и хлороформ, обладающие особенно высокой упругостью пара, выталкиваются из тонких капилляров, запаянных с одного конца, под действием собственных паров, образуя на открытом конце капилляра быстро испаряющуюся каплю. Испарение органических жидкостей можно уменьшить, проводя работу с ними в атмосфере паров соответствующего вещества. [c.10]
Цианистый водород растворим в воде, спирте и эфире в любых отношениях. Упругость паров безводной синильной кислоты при 0° составляет 264 мм рт. ст. [c.617]
При повышении температуры растворимость жидкостей может возрастать или убывать. Так, в приведенном примере растворимость эфира в воде при повышении температуры от 0° С до 30° С уменьшается, а растворимость воды в эфире увеличивается. Пар над раствором содержит молекулы обеих жидкостей, причем парциальное давление каждого компонента меньше, чем упругость паров над каждой жидкостью. Для разделения таких растворов на отдельные компоненты, которое обычно осуществляется путем фракционной (дробной) перегонки, важно их поведение в условиях кипения. В некоторых случаях такое разделение путем перегонки произвести невозможно. Нельзя, нанример, получить из растворов спирта и воды 100%-ный спирт, так как нри разгонке получается нераздельно кипящая смесь, состоящая из 96% спирта и 4% воды. [c.101]
Пластификаторы служат для повышения эластичности полимера и повышения его морозостойкости. Они должны характеризоваться малой упругостью пара, не растворяться в воде и обладать термо- и светостойкостью. Для пластифицирования эпоксидных смол могут применяться фталаты, адипинаты, себацинаты, эпоксидированные и хлорированные (совол) продукты и низкомолекулярные полиэфиры. Наиболее часто используют эфиры о-фталевой кислоты, например, дибутилфталат, диоктилфталат, ди-(2-этилгексил)-фталат и др. [c.10]
Отсюда следует, что упругость паров насыщенного раствора эфира в воде равна упругости паров воды, растворенной в эфире при той же температуре. Это правило будет справедливо и по отношению к остальным жидкостям, частично растворимым друг в друге (анилин и вода, фенол и вода и др.). [c.41]
Частично смешивающиеся жидкости. Промежуточное положение занимает случай, когда смесь разделяется на два слоя, состоящие каждый из насыщенного раствора одного компонента в другом. Упругость пара смеси, как и в случае двух несмешивающихся жидкостей, равна сумме упругостей обоих слоев, и точка кипения смеси поэтому ниже точек кипения каждого из слоев. Состав пара над обоими слоями один и тот же, что и следует ожидать из теории например при i=19,8° над водой, насыщенной эфиром (6,48% эфира), Р = 43,01 мм, а над эфиром, насыщенным водой (98,78% эфира), Р = 43,21 мм (Коновалов, 1881). [c.261]
Пары смеси жидкостей, частично растворимых друг в друге, будут обладать следующими свойствами. Пока мы имеем какую-либо однородную жидкость, например воду, ее пары будут иметь вполне определенную упругость, зависящую лишь от температуры (табл. 1). При постепенном прибавлении к воде другой жидкости (например эфира) упругость паров воды будет уменьшаться (закон Рауля), а упругость паров эфира возрастать (закон Генри). Так как при этом возрастание упругости паров эфира будет итти при данной температуре быстрее чем уменьшение упругости паров воды, то общая упругость паров смеси будет повышаться до тех пор, пока мы не получим насыщенный раствор эфира в воде. При дальнейшем прибавлении эфира общая упругость уже меняться не будет, оставаясь постоянной за все время, пока будет существовать два слоя жидкости (т. е. слой раствора эфира в воде и. слой раствора воды в эфире). Совершенно такая же картина получится и при прибавлении воды к эфиру. Упругость паров воды будет возрастать быстрее, чем уменьшаться упругость паров эфира, и при возникновении двух слоев мы получим совершенно такую же общую упругость как и при растворении эфира в воде. [c.41]
Окончательные результаты можно получить обычно только через несколько недель. Применяя легколетучие растворители, как, например, метилэтиловый эфир, жидкую двуокись серы, бутадиен, триметиламин, можно сократить время проведения опытов даже до 30 мин. [278], но одновременно усложняется прибор и обслуживание его. В целях ускорения установления равновесия между растворами Чайлдс [106] ввел третий сборник, содержащий чистый растворитель. Поскольку упругость паров растворителя больше, чем упругость паров растворов, этот растворитель перегоняется в оба раствора в количестве, пропорциональном их молярным концентрациям. Эта модификация позволила сократить время выполнения определения до 3 дней без одновременного усложнения прибора. Количество вещества, требующегося для выполнения определения в аппарате Чайлдса, составляет 5—15 мг. [c.211]
О свойствах высокомолекулярных сульфокислот можно получить представление после ознакомления со свойствами 1-гексаде-кансульфокислоты [246], более детально изложенными ниже. Свободную кислоту трудно выделить в чистом виде из растворов воды и спирта, из эфира же она кристаллизуется в виде белого твердого вещества, плавящегося при53—54 . Кислота трудно растворима в воде при комнатной температуре, но легко растворяется при температуре выше 50 . В обычных органических растворителях она хорошо растворяется при комнатной температуре 0,0008 н. водный раствор ее имеет легкую муть, в то время как 0,3 н. раствор представляет собой очень вязкую желатинообразную массу. При 90 растворы прозрачны даже после длительного стояния. Вязкость 1,0 н. раствора при 90 так велика, что пузырьки водорода проходят через него очень медленно [246]. Степень диссоциации, найденная путем измерения электропроводности, составляет около 25% для 0,1 п., 85% для 0,0001 н. и 30% для 0,5 н. водного раствора, что напоминает поведение натриевого и калиевого мыл. Степень диссоциации нри 90 , вьгчисленная из значений электропроводности, понижения упругости пара и измерений электродвижущей силы, составляет соответственно 29,8, 38,4 и 63%. Детальная сводка этих результатов сделана в работе Мак-Вэна и Вильямса [246]. Кондуктометрическое титрование [c.126]
Состав кутикулы свидетельствует о ее хрупкости. Кутин и воски легко плавятся при повышении температуры, растворяются в петролейном эфире, бензине и других гидрофобных растворителях. Кутикула головки волосков легко повреждается -при незначительных механических воздействиях — от соприкосновения частей растения в ветреную погоду, при уборке, погрузочно-транспортных операциях, измельчении, песчинками при сильном ветре (шалфей мускатный). Велики потерн эфирного масла из сырья с такими вместилищами как при уборке, так и особенно при хранении. Потери уменьшаются только в тех случаях, когда железистые волоски располагаются в углублениях, надежно предохраняются от повреждений обильньши разветвленными простыми волосками (лаванда, розмарин) или же когда душистые вещества характеризуются очень низкой упругостью паров (пачули, ладанник). Такой вид вместилищ характерен для герани, шалфея, табака, тагетиса, непеты и др. [c.16]
Процесс нленкообразования изучался рядом авторов [1—3], главным образом в связи со скоростью удаления растворителей и закономерностями, лежащими в основе этого явления. Непосредственно вопросу усадки посвящен ряд технологических исследований, в которых изучались и подбирались те практические мероприятия, нри помощи которых оказывалось возможным регулировать этот эффект, увеличивая его для лаковых покрытий. Андреев и Рыжков [4,5] считают, что максимальный эффект усадки эфироцеллюлозных пленок достигается при повышении в растворе концентрации эфира целлюлозы, вследствие чего рекомендуют работать на низковязких продуктах. Клеман и Ривьер [6], Дринкер [7] и рядом других авторов обнаружено, что наиболее эффективное повышение усадки наблюдается в случае применения лаков на низкокипящих растворителях с высокой упругостью паров. Клейн и его сотрудники [8] основным фактором, повышающим усадку, также считают состав жидкой части. Однако это влияние они расценивают иначе, считая, что величина усадки не связана непосредственно с температурой кипения и упругостью пара растворителя, указывая, например, на метилцеллозольв (т. кип. 130°) как на растворитель, дающий максимальный эффект усадки у ацетилцеллюлозпых лаков. При этом авторы высказывают весьма интересное предположение о том, что максимальный эффект усадки достигается в том случае, когда в геле, в период его высыхания, присутствует минимум активного растворителя. [c.226]
НИИ пенных установок предусматривать аварийные сливы и дренажные устройства. В некоторых случаях применение пены может существенно уменьшить опасность образования взрывоопасной паровоздушной среды при проливах ЛВЖ, что обусловлено растворением ЛВЖ в воде и тем самым снижением упругости ее паров. Такой эффект был, например, обнаружен в случае добавления раствора ПО-11 к дизтиловому эфиру. В этих опытах интенсивность испарения эфира при добавлении раствора ПО-И уменьшалась в 2—2,5 раза. [c.129]
К пластификаторам предъявляются следующие основные требования возможно малая упругость паров пластификатора, т. е. нелетучесть низкая температура плавления устойчивость к воздействию света и атмосферных влияний хи.мическая стабильность, в частности трудная омыл51емость при старении способность растворять эфиры целлюлозы, смолы и летучие компоненты лака (требование для желатинирующих пластификаторов) отсутствие запаха бесцветность или слабая окраска негигроскопичность способность понижать горючесть лаковой пленки (температура вспышки пластификатора должна быть достаточно высокой). Пластификатор должен также обладать достаточной вязкостью, обеспечивающей нормальную переработку пигментов в пасту на краскотерке, и химически не дол>1-ен воздейстЕовать на пигменты. [c.226]
РЬ (С2Н5)4-—эффективный антидетонатор моторных топлив, получивший широкое распространение во всех странах мира. Бесцветная, сильно ядовитая маслянистая жидкость плотностью 1,659. Не растворим в воде, легко растворяется в углеводородах, спиртах и эфирах. Т-ра плавл. —136°, кипит с частичным разложением при 200°, обладает следующ ей упругостью паров [c.653]
Метилэтилкетон является прекрасным растворителем, который для многих целей мог бы заменить ацетон, если бы ето можно было получать по доступной цене и е достаточно. количестве. Более низкая упругость пара этого кетона делает его менее способным, в сравнении с ацетоном, производить покраснение лаков. Он смешивается с касторовым и льняным маслами и со многими углеводородами, растворяет нитроцеллюлозу, растительную камедь, бензиловый эфф абиетиновой кислоты, уксусновиниловый эфир и кумарон, а также некоторые смолы. Частично смешивается с водой (кетон растворяет при 20° 90 весовых процентов, воды, а последняя растворяет 24 весовых процента кетона), с которой образует константнокипящую смесь (содержащую 11,4% воды), кипящую при 79,6°. Метилэтилкетон применяется в качестве растворителя, преимущественно лаков из эфиров целлюлозы, а также используется, хотя и в весьма ограниченных размерах, для производства некоторых высокоценных продуктов, например духов, метидионона и фармацевтического препарата трионала. [c.451]
Свойства. В.— бесцветная жидкость с запахом эфира 4 0-9342 1,3953 Т] 0,432 мн-сек/м, или спз т. пл. —100,2° С т. кии. 72,5° С критич. темп-ра 228,9° С критич. давление 2,27 Мн/м (23,1 m j M ) теплоты образования, сгорания, испарения и полимеризации соответственно 118 2084 32,7 и I02 кдж/моль (28,3 497,8 7,8 и 24,3 ккал/моль). В. образует азеотроп-ную смесь с водой (концентрация В. по массе 93,5%) с т. кип. 66°С т. вспышки от—5 до—8 °С (в открытом со-с,уде) упругость паров 31 (О °С) 113,7 (25 °С) и 334,3 мм рт.ст. ( 50 °С) [1 мм рт. ст. = 133,322 н/мЦ поверхностное натяжение при 20 °С 23,95 мн/м, или дин/см. В. хорошо растворяется в обычных органич. растворителях в 100 г воды при 20 °С растворяется 2,4 г В. в 100 г мономера — 0,1 г воды. [c.192]
Чнстыйозон представляет собой при очень низких температурах фиолетово-черное кристаллическое вещество при—249,7° озон плавится, образуя темно-синюю жидкость, а при —111,9° н атмосферном давлении кипит без разложения, давая синеватый газ. Уже при —180° упругость пара жидкого озона равна 3 мм. Критическая температура озона равна —12,1°, а критическое давление 54,6 атм. Из этих данных ясно, что озон превращается в жидкость гораздо легче обычного кислорода. Жидкий озон и жидкий двухатомный кислород растворяются друг в друге до известной степени, но далеко не во всех отношениях, а потому так же, как в случае простого этилового эфира и воды, могут быть получены два насыщенных раствора, не смешивающихся друг с другом. Нижний, более тяжелый, слой представляет раствор Ог в Оз, а верхний — раствор Оз в Ог. [c.70]
Раствор 1 г третично-бутшшмтша ъ Ь мл эфира взбалтывают в закрытом сосуде с 10 г льда и 20 мл нейтрального раствора моно-надсерной кислоты, т. е. с раствором натриевой соли (ср. ниже), соответствующим 0,18 г кислорода. Через несколько минут эфир окрашивается в светлосиний, постепенно темнеющий цвет, который впоследствии снова светлеет. Примерно через 6 мин. отделяют эфирный слой, экстрагируют его небольшим количеством разбавленной серной кислоты и с ат хлористым кальцием. Эфирные растворы от 16 таких опытов были соединены и отогнаны на водяной бане. Питрозобутан перегоняется с эфиром. Для выделения нитрозосоединения эфир отдувают сухим воздухом. При этом получаются большие потери и в остатке остается несколько сантиграммов твердого, кристаллического бесцветного нитрозосоединения. Ввиду высокой упругости паров этого соединения температуру его плавления приходится определять в запаянных капиллярах т. пл. 76—76,5°. Кристаллический нитрозобутан легко растворяется в органических растворителях. Сначала получаются бесцветные растворы, которые с течением времени окрашиваются в темносиний цвет в результате деполимеризации. [c.281]
Частичная раствори-дгость Эфир-вода Вода-анилин Вода-фенол В период наличия двух слоев жидкости постоянна больше, чем упругость паров каждой жидкости, взятой отдельно, но меньше суммы этих упругостей В период наличия двух слоев жидкости постоянна ниже, чем точки кипения отдельных жидкостей В период наличпя двух слоев жидкости постоянен и зависит от парциальной упругости паров отдельных жидкостей и от их молекулярных весов [c.51]
Гербицид 2-метокси-3,6-дихлорбензойная кислота (дикамба) — белое кристаллическое вещество, без запаха, стабильное, негигроскопичное упругость паров при 100° — 3,75-мм рт. ст. Молекулярный вес — 221,05, температура плавления — 114—116°. Растворимость в воде при 25° (г/100 мл) кислоты — 0,15, натриевой соли — 38, диметиламинной соли > 75. Дикамба хорошо растворяется в этаноле, пропаноле, серном эфире, хлороформе, ацетоне и н-гексане слабее — в петролейном эфире и бутаноле [1,2]. [c.180]
Обезвоженный сернокислый натрий (не сплавленны , чтобы не уменьшать его поверхность) является самым индиферентным из всех имеющихся высушивающих средств и потому находит почти универсальное применение. Безводный сернокислый натрий теоретически дает декагидрат и может поглощать воду в ко-.пичестве, большем своего веса. Известно, что упругость пара над глауберовой солью так высока, что она дан е на воздухе быстро выветривается.Так как влажный эфир содержит при комнатной температуре около 3% воды, то по расчету нужно около 100 г сернокислого натрия, чтобы связать 30 г воды в I л эфира. Ио Зибен-року [41], эфир, содержащий спирт, растворяет меньше воды, например при 10% спирта—только 0,4% воды. Следовательно, при высушивании сернокислым натрием, если это допустимо и по другим соображениям, можно прибавлять соответствующее количество спирта. [c.76]
Парадихлорбензол (1,4-дихлорбензол) — СбН4СЬ. Па-радихлорбензол, иногда называемый ПДБ ( ДБ ), получается как побочный продукт при хлорировании бензола. По внешнему виду напоминает нафталин. Темп, плавл. 56°, темп. кип. 173°, упругость паров при 25° равна 1,0 мм. В воде растворяется слабо, в эфире, бензоле и хлороформе хорошо. Легко испаряется и обладает большей летучестью, чем нафталин. [c.177]
chem21.info