Испарение. Насыщенный и ненасыщенный пар. Так как эфир легко испаряющаяся жидкость то
Absorption of energy by evaporation of the liquid and its isolation in vapor condensation
Departing from the liquid molecules overcome the force of attraction of the remaining molecules, t. it is. perform work against these forces. Not all molecules fluid can make the necessary work, only those, which have sufficient kinetic energy for this, sufficient velocity.
But if you come out from the liquid during evaporation fastest molecules, the average speed of the remaining liquid becomes smaller molecules, - Consequently, and average the kinetic energy of the fluid remaining in the molecules decreases. Это означает, that the internal energy of the evaporating liquid is reduced. Поэтому, if there is no power supply to the external fluid, evaporating liquid cools.
Cooling of the liquid by evaporation can be observed experimentally. To do this, wrap the wool ball thermometer (or a piece of matter) and pour it with ether. volatile ether-consuming part of the internal energy of the thermometer bulb, whereby the latter temperature drops. If ether moisten hand, we will feel the chilling hands.
Coming out of the water, even on a hot day, we feel the cold. water, evaporates from the surface of the body, It takes a certain amount of heat.
However, the evaporation of water, poured into a glass, we do not see lowering its temperature. How to explain this? Дело в том, that in this case the evaporation takes place slowly and the water temperature is maintained constant by the quantity of heat, supplied from the ambient air. so, to evaporation of the liquid occurs without a change of its temperature, fluid should be reported to the energy. So, mass to evaporate water 1 kg at 35 ° C, required 2,4 • 106 Дж, and to evaporate the ether mass 1 кг, taken at the same temperature (35 °С),- 0.4 • 106 J. energy.
Evaporation is of great importance in the life of animals. Difficulty violates evaporation heat and can cause overheating of the body.
We spoke, that the process of transition of molecules from the vapor to a liquid is called condensation. Vapor condensation is accompanied by the release of energy. summer night, when the air gets colder, dew drops. This water vapor, is in the air, while cooling air is deposited on grass and leaves in the form of small droplets of water.
The condensation of steam is due to the formation of clouds. water vapor, rising above the ground, formed in the upper, colder air layers of clouds, consisting of tiny water droplets.
questions.
- What kind of work make the molecule, liquid exiting the evaporative?
- How to explain the drop in temperature of the liquid when it evaporates?
- How can the experience show liquid cooling by evaporation?
- How can we explain, that at the same conditions Some liquids evaporate faster, others - more slowly?
- Under what conditions there is steam condensation?
- What natural phenomena are explained by the condensation of steam?
Exercises.
- In what weather soon dry up the puddles from the rain: in calm or windy? in warm or cold? How do you explain?
- Why hot tea cools down more, if you blow on it?
- The speaker in the heat on the body of sweat cools the body. Почему?
- Why is dry air to transfer heat more easily, than cheese?
- To get the cool water in the summer heat, her poured into receptacles, made of clay slaboobozhzhennoy, through which water slowly seeps. Water in such vessels colder ambient. Почему?
- A small amount of water is in the beaker and the same amount of water is in the saucer. Where the water evaporates faster? Почему?
- On the glass board or brush strokes applied to a variety of liquids: эфира, alcohol, Oil and water. Watching strokes, notice, that the liquid evaporate at different rates. Repeat this experience and explain his.
- What summer after rain or watering the tree trunks of fruit trees covered with a layer of humus, manure or peat?
tehnar.net.ua
Охлаждение при испарении - Наука и образование
При превращении жидкости в пар молекулы жидкости, преодолевая силы сцепления в поверхностном слое, совершают работу. Так как из жидкости улетают молекулы, имеющие большую скорость, то средняя скорость оставшихся молекул жидкости уменьшается, уменьшается их кинетическая энергия. Поэтому, когда нет притока энергии к жидкости извне, испарение ведет к уменьшению внутренней энергии жидкости, вследствие чего жидкость охлаждается.
Охлаждение жидкости при испарении легко наблюдать, обмотав кисеёй или ватой шарик термометра и полив его эфиром. Быстро испаряющийся эфир отнимает часть внутренней энергии шарика термометра, вследствие чего температура последнего значительно понижается. Если налить на деревянную подставку тонкий слой воды и поставить на него стакан с эфиром, то эфир при обдувании воздухом быстро испаряется и его температура настолько понижается, что стакан примерзает к подставке.
Явление охлаждения при испарении жидкости широко используется в практике. При перевозке скоропортящихся продуктов для охлаждения вагонов в специальных устройствах испаряют жидкий аммиак или жидкую двуокись углерода.
Для получения льда в холодильных установках испаряется жидкий аммиак в змеевиках, которые проходят через раствор соли и охлаждают его ниже 0°С. В раствор соли помещают формы из листовой стали, наполненные водой; в этих формах, омываемых охлаждённым рассолом, и образуются блоки льда.
В настоящее время широкое применение в быту получили электрические холодильники. Рассмотрим принцип действия компрессионного холодильник. Этот холодильник состоит из трёх основных частей; компрессора А, конденсатора В и испарителя С.
В змеевике-конденсаторе посредством компрессора А сжимают какое-нибудь вещество, которое легко переходит из газообразного состояния в жидкое и из жидкого состояния в газообразное. В качестве таких веществ применяют аммиак, фреон-12 (дифтордихлорметан – CF2Cl2), сернистый ангидрид и др.
При сжатии холодильный агент переходит из газообразного состояния в в жидкое. Одновременно с этим компрессор создает в змеевике-испарителе С разрежение. Туда через регулирующий вентиль К, устремляется жид холодильный агент, который быстро там испаряется. Испарение сопровождается поглощением энергии от стенок змеевика С, воздуха, соприкасающегося с ним, и далее от продуктов, находящихся в холодильной камере Вследствие этого в холодильной камере понижается температура и продукты охлаждаются.
Компрессор приводится в действие электродвигателем.
В жарких странах воду обычно содержат в пористых глиняных сосудах. Вода, просачивающаяся через поры сосуда, испаряется, вследствие чего неиспарившаяся вода в сосуде остаётся холодной.
scibio.ru
Испарение | Физика
Испарение — это переход вещества из жидкого состояния в газообразное (пар), происходящее со свободной поверхности жидкости.
Сублимацию, или возгонку, т. е. переход вещества из твердого состояния в газообразное, также называют испарением.
Из повседневных наблюдений известно, что количество любой жидкости (бензина, эфира, воды), находящейся в открытом сосуде, постепенно уменьшается. Жидкость не исчезает бесследно — она превращается в пар. Испарение — это один из видов парообразования. Другой вид — это кипение.
Механизм испарения. Как происходит испарение? Молекулы любой жидкости находятся в непрерывном и беспорядочном движении, причем чем выше температура жидкости, тем больше кинетическая энергия молекул. Среднее значение кинетической энергии имеет определенную величину. Но у каждой молекулы кинетическая энергия может быть как больше, так и меньше средней. Если вблизи поверхности окажется молекула с кинетической энергией, достаточной для преодоления сил межмолекулярного притяжения, она вылетит из жидкости. То же самое повторится с другой быстрой молекулой, со второй, третьей и т. д. Вылетая наружу, эти молекулы образуют над жидкостью пар. Образование этого пара и есть испарение.
Поглощение энергии при испарении. Поскольку при испарении из жидкости вылетают более быстрые молекулы, средняя кинетическая энергия оставшихся в жидкости молекул становится все меньше и меньше. Это значит, что внутренняя энергия испаряющейся жидкости уменьшается. Поэтому если нет притока энергии к жидкости извне, температура испаряющейся жидкости понижается, жидкость охлаждается (именно поэтому, в частности, человеку в мокрой одежде холоднее, чем в сухой, особенно при ветре).
Однако при испарении воды, налитой в стакан, мы не замечаем понижения ее температуры. Чем это объяснить? Дело в том, что испарение в данном случае происходит медленно, и температура воды поддерживается постоянной за счет теплообмена с окружающим воздухом, из которого в жидкость поступает необходимое количество теплоты. Значит, чтобы испарение жидкости про исходило без изменения ее температуры, жидкости необходимо сообщать энергию.
Количество теплоты, которое необходимо сообщить жидкости для образования единицы массы пара при постоянной температуре, называется теплотой парообразования.
Скорость испарения жидкости. В отличие от кипения испарение происходит при любой температуре, однако с повышением температуры жидкости скорость испарения возрастает. Чем выше температура жидкости, тем больше быстро движущихся молекул имеет достаточную кинетическую энергию, чтобы преодолеть силы притяжения соседних частиц и вылететь за пределы жидкости, и тем быстрее идет испарение.
Скорость испарения зависит от рода жидкости. Быстро испаряются летучие жидкости, у которых силы межмолекулярного взаимодействия малы (например, эфир, спирт, бензин). Если капнуть такой жидкостью на руку, мы ощутим холод. Испаряясь с поверхности руки, такая жидкость будет охлаждаться и отбирать у нее некоторое количество теплоты.
Скорость испарения жидкости зависит от площади ее свободной поверхности. Это объясняется тем, что жидкость испаряется с поверхности, и чем* больше площадь свободной поверхности жидкости, тем большее количество молекул одновременно вылетает в воздух.
В открытом сосуде масса жидкости вследствие испарения постепенно уменьшается. Это связано с тем, что большинство молекул пара рассеивается в воздухе, не возвращаясь в жидкость (в отличие от того, что происходит в закрытом сосуде). Но небольшая часть их возвращается в жидкость, замедляя тем самым испарение. Поэтому при ветре, который уносит молекулы пара, испарение жидкости происходит быстрее.
Применение в технике. Испарение играет важную роль в энергетике, холодильной технике, в процессах сушки, испарительного охлаждения. Например, в космической технике быстроиспа-ряющимися веществами покрывают спускаемые аппараты. При прохождении через атмосферу планеты корпус аппарата в результате трения нагревается, и покрывающее его вещество начинает испаряться. Испаряясь, оно охлаждает космический аппарат, спасая его тем самым от перегрева.
ibrain.kz
Почему испарение жидкости происходит при любой температуре?
[contact-form-7 404 "Not Found"]

Испарение жидкости происходит при любой температуре и тем быстрее, чем выше температура, больше площадь свободной поверхности испаряющейся жидкости и быстрее удаляются образовавшиеся над жидкостью пары.
При некоторой определенной температуре, зависящей от природы жидкости и давления, под которым она находится, начинается парообразование во всей массе жидкости. Этот процесс называется кипением.
Это процесс интенсивного парообразования не только со свободной поверхности, но и в объеме жидкости. В объеме образуются пузыри, заполненные насыщенным паром. Они поднимаются вверх под действием выталкивающей силы и разрываются на поверхности. Центрами их образования являются мельчайшие пузырьки посторонних газов или частиц различных примесей.
Если пузырек имеет размеры порядка нескольких миллиметров и более, то вторым слагаемым можно пренебречь и, следовательно, для больших пузырьков при неизменном внешнем давлении жидкость закипает, когда давление насыщенного пара в пузырьках становится равным внешнему давлению.
В результате хаотического движения над поверхностью жидкости молекула пара, попадая в сферу действия молекулярных сил, вновь возвращается в жидкость. Этот процесс называется конденсацией.
Испарение и кипение

Испарение и кипение – это два способа перехода жидкости в газ (пар). Сам процесс такого перехода называется парообразованием. То есть испарение и кипение – это способы парообразования. Между этими двумя способами есть существенные отличия.
Испарение происходит только с поверхности жидкости. Оно является результатом того, что молекулы любой жидкости постоянно перемещаются. Причем скорость у молекул разная. Молекулы с достаточно большой скоростью, оказавшись на поверхности, могут преодолеть силу притяжения других молекул и оказаться в воздухе. Молекулы воды, находящиеся по отдельности в воздухе, как раз и образуют пар. Увидеть глазами пар невозможно. То, что мы видим, как водяной туман, это уже результат конденсации (обратный парообразованию процесс), когда при охлаждении пар собирается в виде мельчайших капелек.
В результате испарения сама жидкость охлаждается, так как ее покидают наиболее быстрые молекулы. Как известно, температура как раз определяется скоростью движения молекул вещества, то есть их кинетической энергией.
Скорость испарения зависит от многих причин. Во-первых, она зависит от температуры жидкости. Чем температура выше, тем испарение быстрее. Это и понятно, так как молекулы двигаются быстрее, а значит, им легче вырваться с поверхности. Скорость испарения зависит от вещества. У одних веществ молекулы притягиваются сильнее, и следовательно, труднее вылетают, а у других – слабее, и следовательно, легче покидают жидкость. Испарение также зависит от площади поверхности, насыщенности воздуха паром, ветра.
Самое главное, что отличает испарение от кипения, это то, что испарение протекает при любой температуре, и оно протекает только с поверхности жидкости.
В отличие от испарения, кипение протекает только при определенной температуре. Для каждого вещества, находящегося в жидком состоянии, характерна своя температура кипения. Например, вода при нормальном атмосферном давлении кипит при 100 °C, а спирт при 78 °C. Однако с понижением атмосферного давления температура кипения всех веществ немного понижается.
При кипении из воды выделяется растворенный в ней воздух. Поскольку сосуд обычно нагревают снизу, то в нижних слоях воды температура оказывается выше, и пузыри сначала образуются именно там. В эти пузыри испаряется вода, и они насыщаются водяным паром.
Так как пузыри легче самой воды, то они поднимаются вверх. Из-за того, что верхние слои воды не прогрелись до температуры кипения, пузыри остывают и пар в них обратно конденсируется в воду, пузыри становятся тяжелее и снова опускаются.
Когда все слои жидкости прогреваются до температуры кипения, то пузыри уже не опускаются, а поднимаются на поверхность и лопаются. Пар из них оказывается в воздухе. Таким образом, при кипении процесс парообразования происходит не на поверхности жидкости, а по всей ее толще в образующихся пузырьках воздуха. В отличие от испарения, кипение возможно лишь при определенной температуре.
Следует понимать, что когда жидкость кипит, то происходит и обычное испарение с ее поверхности.
От чего зависит скорость испарения жидкости?

Мерой скорости испарения является количество вещества, улетающего в единицу времени с единицы свободной поверхности жидкости. Английский физик и химик Д. Дальтон в начале XIX в. нашел, что скорость испарения пропорциональна разности между давлением насыщенного пара при температуре испаряющейся жидкости и действительным давлением того реального пара, который над жидкостью имеется. Если жидкость и пар находятся в равновесии, то скорость испарения равна нулю. Точнее, оно происходит, но с той же скоростью происходит и обратный процесс – конденсация (переход вещества из газообразного или парообразного состояния в жидкое). Скорость испарения зависит также от того, происходит ли оно в спокойной атмосфере или движущейся; скорость его увеличивается, если образующийся пар сдувается потоком воздуха или откачивается насосом.
Если испарение происходит из жидкого раствора, то разные вещества испаряются с разной скоростью. Скорость испарения данного вещества уменьшается с увеличением давления посторонних газов, например воздуха. Поэтому испарение в пустоту происходит с наибольшей скоростью. Напротив, добавляя в сосуд посторонний, инертный газ, можно очень сильно замедлить испарение.
Иногда испарением называют также сублимацию, или возгонку, т. е. переход твердого вещества в газообразное состояние. Почти все их закономерности действительно похожи. Теплота сублимации больше теплоты испарения приблизительно на теплоту плавления.
Итак, скорость испарения зависит от:
- Рода жидкости. Быстрее испаряется та жидкость, молекулы которой притягиваются друг к другу с меньшей силой. Ведь в этом случае преодолеть притяжение и вылететь из жидкости может большее число молекул.
- Испарение происходит тем быстрее, чем выше температура жидкости. Чем выше температура жидкости, тем больше в ней число быстро движущихся молекул, способных преодолеть силы притяжения окружающих молекул и вылететь с поверхности жидкости.
- Скорость испарения жидкости зависит от площади её поверхности. Эта причина объясняется тем, что жидкость испаряется с поверхности, и чем больше площадь поверхности жидкости, тем большее число молекул одновременно вылетает с неё в воздух.
- Испарение жидкости происходит быстрее при ветре. Одновременно с переходом молекул из жидкости в пар происходит и обратный процесс. Беспорядочно двигаясь над поверхностью жидкости, часть молекул, покинувших её, снова в неё возвращается. Поэтому масса жидкости в закрытом сосуде не изменяется, хотя жидкость продолжает испаряться.
Выводы

Мы говорим, что вода испаряется. Но что это значит? Испарение – это процесс, при котором жидкость на воздухе быстро становится газом или паром. Многие жидкости испаряются очень быстро, гораздо быстрее, чем вода. Это относится к алкоголю, бензину, нашатырному спирту. Некоторые жидкости, например ртуть, испаряются очень медленно.
Из-за чего происходит испарение? Чтобы понять это, надо кое-что представлять о природе материи. Насколько мы знаем, каждое вещество состоит из молекул. Две силы оказывают воздействие на эти молекулы. Одна из них – сцепление, которое притягивает их друг к другу. Другая – это тепловое движение отдельных молекул, которое заставляет их разлетаться.
Если сила сцепления выше, вещество остается в твердом состоянии. Если же тепловое движение настолько сильно, что оно превосходит сцепление, то вещество становится или является газом. Если две силы примерло уравновешены, то тогда мы имеем жидкость.
Вода, конечно, является жидкостью. Но на поверхности жидкости есть молекулы, которые движутся настолько быстро, что преодолевают силу сцепления и улетают в пространство. Процесс вылета молекул и называется испарением.
Почему вода испаряется быстрее, когда она находится на солнце или нагревается? Чем выше температура, тем интенсивнее тепловое движение в жидкости. Это значит, что все большее количество молекул набирает достаточную скорость, чтобы улететь. Когда улетают самые быстрые молекулы, скорость оставшихся молекул в среднем замедляется. Почему остающаяся жидкость охлаждается за счет испарения.
Так что, когда вода высыхает, это означает, что она превратилась в газ или пар и стала частью воздуха.
Видео
Источники
mfina.ru
Испарение. Насыщенный и ненасыщенный пар
Из бытовых наблюдений, уже давно известно, что количество жидкости (эфир, бензин) пребывающее в открытом сосуде, медленно уменьшается. Вполне очевидным является и то, что жидкость не может просто так исчезнуть, она превращается в пар. Подобное явление получило название парообразование.
В природе существует два возможных пути перехода жидкости в газообразное состояние: испарение и кипение.
Парообразование, которое происходит с поверхности жидкости, называется испарением.
Мы уже знаем, что молекулы жидкости непрерывно передвигаются с разными скоростями. Если одна из «особо быстрых» молекул окажется у поверхности жидкости, то она вполне может преодолеть барьер притяжения своих соседних молекул, таким образом, покинув пределы жидкости. Молекулы, которые покинули пределы жидкости, образуют над ней пар. У оставшихся молекул жидкости при соударениях меняется скорость. Некоторые молекулы начинают приобретать нужную скорость, которая позволит им покинуть пределы жидкости. Это процесс постоянно продолжается, таким образом, жидкость испаряется постепенно.
Скорость испарения молекул зависит от определенных условий.
Если взять листок бумаги и смочить его в одном месте эфиром, а другое место водой, то мы увидим, что эфир будет испаряться намного быстрее, чем вода. Можно сделать вывод: скорость процесса испарения напрямую зависит от рода жидкости. Быстрее будет испаряться та жидкость, молекулы которой притягиваются друг к другу с меньшей силой. Это можно легко объяснить тем, что преодолеть притяжение становится намного легче и, следовательно, большее количество молекул может покинуть ее. В жидкости всегда имеется определенное число молекул, которые двигаются быстрее других, а значит, испарение может происходить при любой температуре. Это можно легко подтвердить. Возьмем, к примеру, лужи, образовавшиеся после грозы, они высыхают как летом, когда жарко, так и осенью, когда прохладно. Однако летом они высыхают намного быстрее. Это обусловлено тем, что чем выше температура жидкости, тем большим количеством быстро передвигающихся молекул она обладает. Делаем еще один вывод: испарение происходит еще быстрее, если температура жидкости выше.
Возьмем два сосуда с водой: узкий и широкий. Можно увидеть, что в широком сосуде вода будет испаряться намного интенсивнее. Вода, которая в стакане, будет испаряться дольше, чем вода, налитая в блюдце. Скомканное белье высыхает дольше, чем развешанное. Это можно объяснить тем, что жидкость испаряется с поверхности, и, следовательно, чем шире или больше поверхность жидкости, тем большее количество молекул сможет вылететь из жидкости.
Подводим вывод: скорость испарения жидкости напрямую зависит от площади ее поверхности.
Во время процесса перехода жидкости в пар, может происходить и обратный процесс. Двигаясь хаотично над поверхностью жидкости, некоторая часть молекул покинувших ее, возвращается опять обратно в жидкость.
Если же процесс испарения происходит в закрытом сосуде, то начальное число молекул вылетевших из жидкости, будет превосходить число молекул возвратившихся в нее. Таким образом, плотность пара в сосуде будет медленно увеличиваться. При увеличенной плотности пара увеличится и плотность количества молекул, возвращающихся в жидкость. Через некоторое время число молекул, которые покидают жидкость, сравняется с числом молекул, которые возвращаются в нее. Таким образом, количество парящих молекул над жидкостью станет постоянным. Наступит так называемое динамическое равновесие между паром и жидкостью.
Пар, который находится в динамическом равновесии со своей жидкостью, называется насыщенным. И наоборот, если в пространстве с паром какой-нибудь жидкости может наблюдаться дальнейшее испарение данной жидкости, пар, который находится в этом пространстве, называется ненасыщенным паром.
Остались вопросы? Не знаете, как сделать домашнее задание?Чтобы получить помощь репетитора – зарегистрируйтесь.Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Насыщенный пар. Кипение. Видеоурок. Физика 10 Класс
Из курса физики 8 класса вам хорошо известно, что такое агрегатное состояние вещества. Кроме того, вы хорошо знаете, каким образом вещество может переходить из одного состояния в другое. В частности, вы знаете, что, если жидкость превращается в пар, такой процесс называется парообразованием, обратный же процесс, переход из пара в жидкость, называется конденсацией. Схема таких преобразований представлена на рисунке 1.
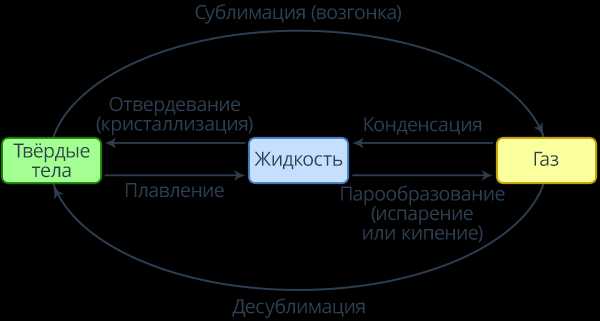
Рис. 1. Схема изменения аргатного состояния вещества
Рекомендую посмотреть соответствующие уроки в разделе физики 8 класса.
Парообразование – свойство капельных жидкостей заменять свое агрегатное состояние и превращаться в пар.
Из материала 8 класса мы знаем, что парообразование делится на два вида:
1. Испарение, которое происходит с поверхности раздела жидкости и окружающего воздуха;
2. Кипение, которое происходит во всем объеме жидкости при определенных условиях.
Теперь рассмотрим эти процессы более серьезно, имея на вооружении знания, которые мы получили в разделе «Молекулярно-кинетическая теория».
Давайте задумаемся над таким вопросом. Как мы знаем, все молекулы жидкости находятся в состоянии непрерывного хаотического движения. Хаотичность, в частности, означает, что направление движения отдельных молекул носит случайный характер. Почему же при этом жидкость сохраняет свой объем, а не распадается на отдельные частицы? Между молекулами действуют силы притяжения, которые не позволяют им покинуть жидкость. Кроме того, очевидно, что значение скоростей молекул также случайны, а следовательно, среди них обязательно найдутся очень быстрые молекулы. Если такая молекула вследствие хаотического перемещения окажется вблизи поверхности раздела жидкости и окружающего воздуха, то ее кинетической энергии может хватить на то, чтобы преодолеть силы притяжения и вырваться наружу (см. рис. 2).
Рис. 2. Наглядное изображение поведения молекул в жидкости
Это и есть упомянутый выше процесс испарения. Когда количество испарившихся молекул становится значительным, они образуют пар. Конечно, может произойти и обратное. Вырвавшиеся за пределы жидкости молекулы вследствие хаотического движения снова вернутся в объем жидкости, такой процесс, как мы знаем, называется конденсацией. Если сосуд с жидкостью будет открыт, то испарившиеся молекулы могут безвозвратно покидать пространство над жидкостью, в результате чего количество последней будет постепенно уменьшаться. Примеры описанного мы можем повсеместно наблюдать вокруг, все процессы высыхания именно так и происходят – жидкость испаряется, а пар обратно не конденсируется вследствие того, что молекулы этого пара удаляются от жидкости.
Проделайте дома очень простой эксперимент: наполните стакан водой и проследите за уровнем воды в течение нескольких дней. Через несколько дней вы увидите, что уровень воды стал значительно ниже, вода испарялась.
Разные жидкости испаряются с разными скоростями. Чем больше силы притяжения молекул друг к другу, тем меньшее число молекул в единицу времени окажется в состоянии их преодолеть и вылететь наружу и тем меньше скорость испарения.
Быстро испаряются такие жидкости, как эфир, ацетон, спирт. Из-за этого свойства их иногда называют летучими жидкостями. Медленнее – вода. Намного медленнее воды испаряются масло и ртуть.
Поскольку испарение – это уход из жидкости самых быстрых молекул, то средняя кинетическая энергия молекул, которые остались в жидкости, естественно уменьшается.
А что такое средняя кинетическая энергия молекул? Это, фактически, температура, т. е. жидкость при испарении остывает. Вам хорошо знакомо ощущение прохлады и порой даже зябкости, особенно при ветре, когда выходишь из воды. Вода, испаряясь по всей поверхности тела, уносит тепло. Ветер же ускоряет процесс испарения.
А что будет, если мы закроем сосуд с жидкостью? Молекулы пара уже не смогут покидать пространство над ней, по мере испарения их количество сначала будет расти, а значит, будет расти и количество молекул, которые конденсируются в единицу времени.
Рис. 3. Процессы испарения и конденсации в закрытой системе (сосуде)
Т. е. в такой системе будут идти два конкурирующих процесса (см. рис. 3).
Первый – это процесс испарения, для которого количество покидающих жидкость молекул будет определяться только температурой. Почему? Смотрите ответвление № 1.
Работа выхода
Попробуем разобраться, какими параметрами определяется скорость испарения жидкости, от чего она зависит. Чтобы вырваться из объема жидкости, молекула должна преодолеть притяжение со стороны других молекул той же жидкости. Другими словами, ей необходимо совершить работу против сил межмолекулярного взаимодействия. Величина этой работы зависит от рода жидкости и носит название работы выхода. Таким образом, в парообразное состояние могут перейти те молекулы, чья кинетическая энергия превосходит значение работы выхода, это отражено в формуле:
Рис. 4. Процесс испарения (процесс вылета молекулы с поверхности жидкости)
Долю молекул, удовлетворяющих этому условию, можно оценить, зная, так называемое, распределение молекул по скоростям, т. е. долю от общего числа молекул, обладающих данным значением скорости, а значит, и кинетической энергией.
Изучением таких распределений занимается раздел физики, который называется статистическая физика, однако ввиду его математической сложности в курс физики школы он не включен.
В 8 классе вы называли основные факторы, которые повлияют на скорость испарения. Итак, от чего же будет фактически зависеть количество молекул, которые убежали из жидкости? Эти факторы:
1. Род жидкости
2. Температура жидкости
3. Скорость отвода испарившихся молекул от жидкости (вспомните: для того чтобы остудить чай, мы дуем)
4. Площадь поверхности жидкости
На примере с чаем: для того чтобы он остывал быстрее, мы наливаем его в блюдце.
Итак, мы обсудили, какой же параметр характеризует способность молекул той или иной жидкости испаряться – это работа выхода – и какие факторы влияют на скорость испарения.
А второй процесс – это процесс конденсации, в котором количество возвращающихся в жидкость молекул будет, помимо прочего, зависеть и от концентрации молекул пара: чем больше молекул пара, тем большая вероятность, что одна из них вернется в жидкость.
Вначале, пока эта концентрация невелика, количество конденсирующихся молекул за единицу времени будет, естественно, меньше количества испаряющихся молекул, т. е. молекул, покидающих жидкость. Однако по мере роста концентрации пара поток молекул пар – жидкость будет расти, а обратный поток будет оставаться прежним, ведь он определяется только температурой.
В какой-то момент оба количества молекул станут равными. Как говорят физики, в системе установится динамическое равновесие, а пар достигнет состояния так называемого насыщения. Соответственно, пар, который находится в состоянии динамического равновесия со своей жидкостью, мы будем называть насыщенным.
Представьте себе здание с огромным количеством дверей. Какое-то количество людей заходит в это здание, а какое-то количество людей выходит из этого здания. Если количество людей, которые входят в здание, равно количеству людей, которые выходят из здания в единицу времени, то можно сказать, что достигнуто состояние насыщения. Вот точно так же происходит и в случае с паром.
Насыщенный пар – это в некотором смысле предельное состояние пара. Имеется в виду, что значение давления этого пара и его плотности являются максимальными при данном значении температуры. В противном же случае мы будем называть пар ненасыщенным.
До сих пор газообразное состояние мы обсуждали лишь на примере идеального газа, тем более удивительным является тот факт, что некоторые уравнения, которые описывают идеальный газ, вполне подходят и для состояния насыщенного пара.
Оказывается, что состояние насыщенного пара хоть и приближенно, но вполне удовлетворительно описывается уравнением Менделеева – Клапейрона:
Здесь индекс Н указывает на то, что данные параметры относятся к насыщенному пару, µ – это молярная масса пара.
Теперь обсудим, какими основными свойствами обладает насыщенный пар и как эти свойства отличаются от свойств идеального газа или совпадают с ними. Все то, о чем мы будем говорить ниже, получено экспериментально, однако мы постараемся дать и качественное объяснение этих свойств.
Итак, свойство первое: при постоянной температуре плотность насыщенного пара не зависит от его объема. Понять это свойство легко. Представим себе, что мы, не меняя температуры, уменьшим объем сосуда, в котором находится насыщенный пар (см. рис. 5).
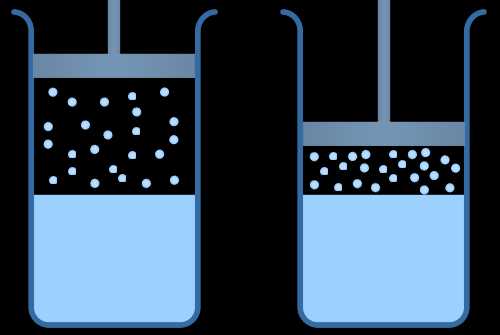
Рис. 5. Процесс сжатия пара в цилиндре (уменьшение обьема)
Количество молекул, переходящих от пара к жидкости в единицу времени, естественно, превысит количество испаряющихся молекул, но при этом часть пара просто сконденсируется, а оставшийся пар снова придет в состояние динамического равновесия. В итоге плотность этого пара будет равна начальной плотности:
Второе свойство: давление насыщенного пара не зависит от его объема. Этот факт очевиден ввиду простой связи давления и плотности, выраженной уравнением Менделеева – Клапейрона. Как следствие, закон Бойля-Мариотта для насыщенного пара выполняться не будет. Закон Бойля-Мариотта имеет вид:
Третье свойство: при неизменном объеме плотность насыщенного пара растет с повышением температуры и уменьшается с понижением температуры. Действительно, при увеличении температуры возрастает скорость испарения жидкости. Динамическое равновесие в первый момент будет нарушено, т. е. произойдет дополнительное испарение некоторой части жидкости. Плотность пара будет возрастать до тех пор, пока динамическое равновесие вновь не восстановится.
А при охлаждении произойдет обратный процесс: часть пара сконденсируется, уменьшая его плотность.
Четвертое свойство: давление насыщенного пара растет с температурой быстрее, чем по линейному закону, как это было в случае идеального газа. В самом деле, с ростом температуры возрастает плотность насыщенного пара, а согласно уравнению Менделеева – Клапейрона давление пропорционально произведению плотности на температуру.
Т. е. в случае идеального газа рост давления обуславливался только ростом температуры, теперь работают два фактора: зависимость давления насыщенного пара от температуры, что представлено участком 1-2 графика (см. рис. 6).
Рис. 6. График зависимости давления насыщенного пара от температуры
Эту зависимость нельзя вывести из законов идеального газа. При изохорном нагревании или охлаждении насыщенного пара его масса меняется. Поэтому закон Шарля в данном случае работать не будет.
Обратите внимание: в точке 2 вся жидкость испаряется. При дальнейшем повышении температуры пар становится ненасыщенным и его давление здесь растет как раз согласно закону Шарля. Это участок 2-3 (см. рис. 6). Закон Шарля имеет вид:
Вспомним, что линейный рост давления идеального газа вызван ростом интенсивности ударов молекул о стенки сосудов. В случае нагревания насыщенного пара молекулы начинают бить не только сильнее, но и чаще, ведь пара становится больше. Именно одновременным действием этих двух факторов и вызван нелинейный рост давления насыщенного пара на участке 1-2.
Если подытожить приведенные выше сво
interneturok.ru
Выделение летучих веществ испарением - Справочник химика 21
Выделение летучих веществ испарением [c.37]С целью увеличения выработки кокса и улучшения показателей работы отечественных установок необходимо для каждой из них осуществить специальную подготовку сырья. Способ подготовки следует подбирать на каждом НПЗ в зависимости от свойств исходной нефти и схемы ее переработки. Подготовленное сырье коксования должно иметь высокую коксуемость, низкое содержание серы, металлов и золы. Химический и фракционный состав сырья должны обеспечивать его максимальную ароматизацию, испарение и заданное разложение в реакционном змеевике печи. При этих условиях в камере увеличивается доля реакций уплотнения, идущих с выделением тепла, что улучшает тепловой баланс камеры и позволяет повысить качество кокса (механическую прочность, летучие вещества) [1,2, 7—9]. Этим требованиям наиболее полно могли бы удовлетворять остатки малосернистых и малозольных смолистых нефтей. Однако на отечественных заводах в основном перерабатываются или легкие малосернистые парафинистые нефти, или тяжелые смолистые сернистые нефти. Поэтому в первом случае необходимо снизить содержание парафиновых углеводородов, плохо подготовленных к образованию кокса в камере и способствующих закоксовыванию труб печи. Во втором — подготовка сырья должна обеспечить уменьшение содержания в коксе серы и металлов, при сохранении высокого выхода. За рубежом, особенно в США, вопросам подготовки придают большое значение сырье коксования дифференцируют в зависимости от направления использования кокса [7, 9]. Основную массу кокса для алюминиевой промышленности получают из прямогонных остатков, а кокс для графитированных электродов (премиальный) — из дистиллятных крекинг-остатков [c.16]
При газификации топлива с высоким выходом летучих и большой влажностью (торф, древесная щепа, бурые угли) большое значение имеет хорошая подготовка топлива до поступления в зону газификации. Процесс подготовки топлива — сушки и выделения летучих (полукоксования) — представляет совокупность ряда явлений подвода тепла к куску топлива, прогрева куска, испарения влаги, термического разложения топлива с выделением летучих веществ, диффузии паров и газов и др. Скорость подготовки топлива будет определяться наиболее медленной стадией этого процесса. [c.128]В первый период происходят подогрев топлива, испарение влаги, выделение летучих веществ и образование кокса. Длительность этого периода зависит от влажности топлива, размера его кусков, условий теплообмена и других факторов. [c.138]
Сокращение потерь и защита окружающей среды возможны только при использовании современных методов снижения испарения, а также при хранении нефтепродуктов и нефтей способами, исключающими выделение летучих веществ в атмосферу. Рассмотрим некоторые из них более детально. [c.267]
При извлечении летучих веществ экстракция может успешно конкурировать с ректификацией в тех случаях, когда разделение ректификацией либо затруднено, а иногда и практически невозможно (разделение смесей, состоящих из близкокипящих компонентов и азеотропных смесей), либо сопряжено с чрезмерно высокими затратами (извлечение вредных примесей или ценных веществ из сильно разбавленных растворов). Так, например, извлечение уксусной кислоты из ее малоконцентрированных водных растворов экстракцией этилацетатом (или смесью этилацетата и бензола) является значительно более экономичным, чем выделение ректификацией, так как, несмотря на довольно большую разность температур кипения воды и кислоты, относительная летучесть их невелика. Кроме того, необходимость испарения очень больших количеств воды весьма удорожает ректификацию. [c.522]
Выбор группы методов концентрирования для конкретного анализируемого чистого вещества, с одной стороны, зависит от свойств элементов основы и примесей. Например, концентрирование при анализе щелочных и щелочноземельных металлов проводится, в основном, путем группового выделения примесей (экстракцией, ионным обменом, соосаждением с коллектором и пр.). Для элементов, расположенных в середине Периодической системы, и переходных металлов в высших степенях валентности характерно образование летучих соединений с ковалентным Типом связи и для целей концентрирования при анализе названных элементов и их соединений часто могут быть использованы методы испарения (сублимации) основы. Переходные металлы (с достраивающимися электронными -оболочками) склонны к комплексообразованию в растворах и для их отделения перспективны экстракционные и ионообменные методы. Разделения в группах редкоземельных и актинидных элементов (с достраивающимися /-оболочками) требуют использования высокоэффективных хроматографических методов, в частности, метода ионообменной хроматографии. С другой стороны, важное значение для выбора метода концентрирования имеют физико-химические свойства анализируемого соединения (летучесть, плавкость, растворимость). Так, соединения, которые с трудом переводятся в раствор, следует подвергать обогащению методами испарения или направленной кристаллизации. Те же методы, не связанные с химической обработкой пробы, если они могут обеспечить концентрирование нужных примесей, следует применять и при анализе прочих чистых соединений. [c.319]
У живых растений как естественные выделения (бальзамы), так и патологические (например, живица) всегда почти жидкие. Естественное отвердевание смолы происходит на воздухе частью из-за испарения летучих веществ (терпены, эфирные масла), частью вследствие самоокисления первичных или летучих веществ. Искусственно такого же результата можно добиться, например, перегонкой. [c.14]
Коксование — метод переработки твердых топлив, преимущественно углей, заключающийся в нагревании их без доступа воздуха до 900—1050° С. Топливо при этом разлагается с образованием летучих веществ и твердого остатка — кокса. При постепенном нагревании компоненты угля претерпевают глубокие физические и химические превращения до 250° С происходит испарение влаги, выделение окиси и двуокиси углерода около 300° С начинается [c.149]
При общеобменной вентиляции и наличии газовых выделений одна треть их вытягивается из верхней зоны, а две трети — из нижней зоны в производствах, где выделения тепла не превышают теплопотерь цеха, а именно в следующих случаях при выделении в рабочую зону газов с удельным весом тяжелее воз духа и при работе с летучими веществами, газы которых тяжелее воздуха (спирто-эфирная смесь, ацетон, сероуглерод и т. п.), или когда испарение сопровождается поглощением тепла из воздуха ( бензол, эфир и др.). [c.226]
При анализе жидких смол и лаков в большинстве случаев образец может подвергаться непосредственному хроматографированию без предварительного разделения. Методы прямого анализа основаны на быстром испарении летучих веществ из полимеров. Такие методы менее длительны и трудоемки, однако ошибка определения может достигать значительной величины вследствие неполноты выделения летучих, удержания части растворителя в пленке высохшего полимера, а также разложения смолы. [c.41]
Процесс удаления летучих растворителей происходит за счет теплоты испарения. При этом, как известно, охлаждается испаряющаяся жидкость и окружающее ее пространство. В результате интенсивного охлаждения возможна конденсация влаги из воздуха. Так как вода не является растворителем ацетилцеллюлозы, происходит выделение пленкообразующего вещества из раствора и накопление его на поверхности пленки в виде белых пятен. [c.264]
Необходимый в настоящее время уровень глубокой очистки веществ может быть достигнут только с использованием многоступенчатых методов разделения смесей. Наибольшее применение сейчас находят днстилляционные и кристаллизационные методы. С повышением температуры плавления и температуры кл-пения очищаемого вещества возможности этих методов быстро уменьшаются из-за загрязняющего действия материала аппаратуры. Особо чистые простые вещества (так называемые элементы особой чистоты), которые все еще являются основным объектом исследования в области получения веществ особой чистоты, в значительной части представляют собой или тугоплавкие металлы, или металлоиды, с атомной кристаллической решеткой, обладаю-шие высокими температурами кипения и плавления. Трудности подбора материала аппаратуры для работы с такими веществами становятся непреодолимыми. Поэтому для глубокой очистки простых веществ все большее распространение получает метод, состоящий в выделении их из особо чистых сложных летучих веществ, имеющих молекулярную кристаллическую решетку и, как следствие этого, низкие значения температуры плавления и температуры кипения. Выделение производится путем термораспада сложного соединения или путем восстановления его водородом. Продукты распада и исходное вещество должны иметь существенно более высокую летучесть, чем выделяемый элемент, чтобы от них можно было освободиться простым испарением без применения многоступенчатого процесса очистки. Этим требованиям в значительной мере удовлетворяют летучие неорганические гидриды, галиды и металлоорганические соединения (МОС). [c.3]
Каменный уголь загружают в закрытые камеры — коксовые печи. При постепенном нагревании компоненты угля претерпевают глубокие физические и химические превращения до 250°С происходит испарение влаги, выделение оксида и диоксида углерода, около 300 °С начинается выделение паров смолы, выше 350 °С уголь переходит в пластическое состояние, при 500—550°С наблюдается бурное разложение пластической массы с выделением газа и смолы и твердение ее с образованием полукокса. При дальнейшем повышении температуры из полукокса выделяются остатки летучих веществ, и он превращается в кокс. Летучие продукты в зоне печи, нагретой до 1000°С, превращаются в сложную смесь паров с преобладанием ароматических соединений и газов, содержащих в основном водород и метан. [c.219]
В тех случаях, когда топливо содержит в своей минеральной части значительное количество карбонатов (см. 4.2), заметный вклад в потерю массы навески Дт вносит помимо процессов испарения влаги и разложения органической части топлива также разложение карбонатов, которое сопровождается выделением диоксида углерода. При содержании диоксида углерода карбонатов в аналитической пробе топлива более 2 % ГОСТ предписывает рассчитывать выход летучих веществ с учетом соответствующей поправки. Расчетная формула в этом случае имеет вид [c.97]
I — частица топлива 2 — нагревание частицы 3 — испарение влаги 4 — выделение и горение летучих веществ 5 — горение коксового остатка 6 — золовая частица [c.171]
При постепенном нагревании компоненты угля претерпевают глубокие физические и химические превращения до 250°С происходит испарение влаги, выделение окиси и двуокиси углерода около 300°С начинается выделение паров смолы и образование пирогенетической воды выше 350°С уголь переходит в пластическое состояние при 500—550°С наблюдается бурное разложение пластической массы с выделением первичных продуктов (газа и смол) и твердение ее с образованием полукокса. Повышение температуры до 700°С сопровождается дальнейшим разложением полукокса, выделением из него газообразных продуктов выше 700°С преимущественно происходит упрочение кокса. Летучие продукты, соприкасаясь с раскаленным коксом, нагретыми стенками и сводом камеры, в которой происходит коксование, подвергаются пиролизу, превращаются в сложную смесь паров (с преобладанием соединений ароматического ряда) и газов, содержащих водород, метан и др. Большая часть серы исходных углей и все минеральные вещества остаются в коксе. [c.458]
Обычно, но не всегда экстракцию предваряют стадией разделения, такой, как перегонка с водяным паром. В качестве экстрагирующей жидкости обычно используют неполярный органический растворитель, причем применяют самые разнообразные растворители. Если экстрагирование ведется низкокипящим растворителем, то перед анализом основную часть его извлекают фракционированной перегонкой или испарением. При использовании высококипящего растворителя наиболее летучие компоненты анализируемого вещества извлекают из него перегонкой обычно при пониженном давлении. Этот способ более подходит в тех случаях, когда исследователь заинтересован в выделении низкокипящих летучих компонентов. Для вытеснения экстрагируемых соединений из водной фазы в органический растворитель часто применяют соли, такие, как хлорид или сульфат натрия. Однако иногда действие этих солей оказывается более сложным, чем обычно полагают, и вопрос об их применении следует внимательно проанализировать. В некоторых случаях соль вытесняет растворенные вещества из водной фазы, но при этом они могут появиться в парах над обрабатываемым материалом, а не экстрагироваться органическим растворителем. [c.144]
Под понятием летучие растворители объединены органические соединения, жидкие при обычной температуре, сравнительно низкокипящие, которые могут растворять без изменения химического состава другие, главным образом твердые органические вещества, причем последние могут быть выделены из раствора простым испарением. Например, каучук растворяется в бензине. Получается однородный раствор, из которого затем каучук может быть выделен испарением, отгонкой растворителя — бензина. [c.70]
Динамику выделения летучих веществ из нефтяных коксоз изучали в работе [23]. Скорость выделения летучих характеризуется сложной зависимостью от температуры — наблюдается ряд максимумов скоростей. Первый максимум — при 100—200 °С — обусловлен испарением влаги, которая нонадает в кокс второй — испарением и дококсовыванием адсорбированных продуктов при 470—520 °С. Испарение смол, видимо, сопровождается нх деструкцией, так как газы прокаливания кроме Нг и СН4 содержат непредельные углеводороды этилен, пропилен и следы бутиленов. [c.196]
По мере усовершенствования конструкции прибора и геометрии колонки лимитирующим фактором становится ввод пробы. Работа при высоких входных давлениях и температурах приводит к выделению летучих веществ из резиновых колпачков. Это влияет на распределение абсорбции в колонке и изменяет сигнал детектора, вызывая дрейф нулевой линии и повышенный шум. Последние факторы снижают точность измерений, особенно при использовании температурного программирования. Метод капсулирования позволяет обойтись без резиновых колпачков, но, несмотря на это преимущество, этот метод все же требует предварительного введения в капсулу проб, на подготовку которых расходуется значительное время, и выполнения многих операций вручную. Автоматизация этих ручных процессов весьма полезна. Требования к устройству для ввода пробы в аналитический хроматограф уже обсуждались. Чтобы преодолеть трудности, возникающие при вводе летучих жидкостей с помощью шприца и связанные с изменением объема вводимой пробы и селективным испарением (особенно в случае мгновенного испарения), Нерхейм [20] раз- [c.255]
Таким образом, степень деформации полукокса и характер пористости готового кокса будут определяться, с одной стороны, эффектом действия капиллярных сил и, с другой — сопротивляемостью материала сжатию. По мере нагревания вместе с повышением жесткости скелета полукокса, увеличивающим сопротивляемость его сжатию, увеличивается также и интенсивность испарения веществ, заполняющих поры. Эффект действия капиллярных сил в процессе выделения летучих веществ может превысить сцепление частиц материала в первую очередь в более слабых местах, что вызовет образование трещин. Чем менее жесткой будет связь между частицами полукокса и чем более последний будет эластичен, тем в большей степени он поддается сжатию без образования трещин и тем более мелконористым должен получиться готовый кокс. [c.318]
Куросаки и Мурано [174] применяли порапак Р в качестве наполнителя колонок при определении воды в некоторых полимерных пленках методом испарения. Пробу помещают в пиролизер (рис. 5-25) и нагревают в потоке газа-носителя, который переносит выделяющиеся летучие вещества в хроматограф. На рис. 5-26 показано относительное количество воды, выделенной из некоторых полимеров. Для большинства изученных материалов в интервале температур 70—160 °С количество выделяемой воды стремится к постоянному значению. При более высоких температурах некоторые конденсационные полимеры полимеризуются далее. Авторы работы [174] считают оптимальными следующие условия проведения анализа размер пробы 10—20 мг длина колонки [c.330]
Пиролиз древесины Процесс разложения древесины при пиролизе можно подразделить на четыре стадии 1) сушк>, 2) на чало разложения, 3) образование, испарение и возгонку основного количества продуктов разложения древесины, протекающие при 270—450 °С с бурным выделением тепла (экзотерми ческий процесс), 4) прокаливание угля до конечной температуры обычно не выше 550—600 °С и удаление остатков летучих веществ Кроме третьей стадии, все стадии процесса требуют подвода тепла извне [c.42]
Судьба летучих веществ такая же, как и во всех схемах газификации, в которых осуществляется полуобращенный процесс часть летучих сжигается, а другая часть подвергается пиролизу и конверсии. Несмотря на то, что п подземный газогенератор с поверхности подается воздушное дутье, в самом подземном газогенераторе происходит большое выделение водяных паров, получаемых в результате испарения влаги топлива и грунтовых вод. Водяные пары поступают в подземный газогенератор беспорядочно во все зоны в нерегулируемых количествах. В зоне умеренных температур водяные пары создают благоприятные условия для бурного протекания реакции конверсии окиси углерода. В зоне более повышенных температур, кроме реакций разложения НаО протекает реакция конверсии СН4 и других углеводородов, образующихся при пиролизе летучих веществ. [c.202]
Выделение легких компонентов из твердых полимерных образцов затруднено. Для уменьшения времени десорбции во всех случаях следует использовать для анализа по возможности мелкий порошок полимера. В связи с тем что время десорбции (испарения) летучих компонентов из полимера, как правило, достаточно велико и, следовательно, велика ширина начальной зоны, последуюш ее эффективное хроматографическое разделение невозможно. Поэтому определение легких компонентов полимерных систем путем непосредственного ввода пробы полимера в нагретый испаритель, как правило, не применяется. Для преодоления указанных затруднений десорбцию летучих веществ проводят в течение определенного времени либо в замкнутом небольшом объеме, включая затем этот объем в поток газа-посителя перед хроматографическо11 колонкой, либо в проточной системе с ловушкой, расположенной между десорбционной камерой и хроматографической колонкой. После окончания десорбции ловушку быстро нагревают, в результате чего выделившиеся из полимера продукты импульсно поступают из ловушки в хроматографическую колонку. [c.120]
Взрывы от повышенного давления происходят в результате нагревания какого-либо вещества в замкнутой системе выше темпе-ратуры кипения или проведения в закрытом приборе реакции, сопровождающейся выделением больших количеств газообразных продуктов. Сильное испарение легко летучих веществ может начаться в результате реакции, при которой сильно повышается температура смеси это же может произойти если закрытый сосуд с легколетучей жидкостью поместить вблизи нагревательных приборов или в месте, где на жидтюсть будут действовать прямые солнечные лучи. В подобных случаях серьезную опасность представляет применение тонкостенной посуды, которая часто разрывается от повышения температуры на 30 — 40°. Поэтому принесенная из холодного склада легколетучая жидкость, оставленная в закрытой тонкостенной колбе, иногда разрывает ее разлившаяся жидкость, например, ацетон или эфир, может образовать с воздухом взрывчатую смесь, которая отличается сильнейшей разрушительной силон и притом взрывается от ничтожных причин. [c.105]
Основной причиной растянутого во времени и пространстве процесса горения щелочного стока следует считать большую длительность подготовительных стадий процесса горения нагрев и испарение влаги нз капель отхода, нагрев и разложение частиц соли (адипатов натрия) с выделением летучих горючих веществ. Кроме того, процесс тер.мпческого разложения натриевых солей органических кислот сопровождается образованием сильно минерализованного коксового остатка. Из-за стадии выгорания коксового остатка увеличивается общая продолжительность горения капель отхода. [c.95]
Алюминий энергично взаимодействует с галогенами, образуя А1Гз. Фторид алюминия — малорастворимое и тугоплавкое вещество, остальные галогениды алюминия хорошо растворимы не только в воде, но и во многих органических растворителях, легкоплавки и летучи. В расплавленном состоянии они неэЛектро-проводны. Они дымят на воздухе вследствие испарения, поглощения паром влаги и образования твердых кристаллогидратов. Растворение галогенидов алюминия в воде сопровождается выделением большого количества теплоты если кусок А1Вгз бросить в воду, то происходит сильный взрыв (ДЯ° растворения [c.341]
При. авариях (разрывах трубопроводов, по которым транспортируется газ с большим содержанием вредных веществ, взрывах цистерн с вредными веществами, разливе на почве легкокипя-щих и летучих жидкостей) выделяется на несколько порядков больше вредных веществ, чем при нормальной работе оборудования. Как правило, такое выделение происходит кратковременно. Авария ликвидируется в течение одного-двух часов, разлившаяся химическая жидкость также в короткий срок собирается или сливается в закрытые емкости, или покрывается каким-либо изолирующим материалом, препятствующим ее испарению. [c.100]
Если рассматривать удаление воды как чисто физический процесс, то ему должно способствовать повышение температуры, и, действительно, вся вода удаляется при 365 °С, т. е. при достижении критической температуры воды [238]. Однако для большинства органических веществ повышение температуры сопровождается выделением других летучих соединений. На рис. 3-4 показаны кривые зависимости давления паров воды от температуры для некоторых органических веществ. (Кривые построены в полулогарифмическом масштабе по табличным данным, опубликованным Стуллом [333 ].) Даже при относительно низких температурах давление паров воды над растворителями обычно превышает соответствующее парциальное давление паров воды в окружающей среде, что обеспечивает испарение значительных количеств воды в процессе относительно длительного высушивания. На ранних стадиях высушивания вместе с удаляемой водой могут также удаляться жиры, свободные кислоты, азотистые основания и т. д. [270]. При повышенных температурах заниженные результаты могут быть обусловлены гидролизом таких веществ,, как соли, дисахариды или крахмал [270]. После того как свободная вода будет в основном удалена, дальнейшее высушивание может сопровождаться выделением дополнительных количеств воды за счет протекания реакций окисления и конденсации, например самоокисление жиров [270], кислотная конденсация сахаров [129, 159, 229], конденсация восстанавливающихся соединений с производными аминокислот [58, 192, 310]. Таким образом, при определении воды по потере массы получаются заниженные результаты, если высушивание сопровождается гидролизом или окислением, или же завышенные результаты, если при высушивании происходят реакции конденсации. [c.73]
Прямая перегонка позволяет только очищать вещества и отделять их от нелетучих смолистых примесей. Фракционирование возможно только при сильном уменьшении скорости испарения, причем температуру испарения выбирают так, чтобы каждый раз перегонялось только несколько процентов летучей фракции. В качестве примера применения этого метода в препаративной неорганической химии следовало бы упомянуть о выделении НгЗз и НгЗб [517]. [c.474]
В результате элюирования растворителем обычно получают более разбавленные пробы относительно большого объема, что позволяет осуществить несколько аналитических определений состава элюата. Однако концентрации анализируемых соединений в нем обычно ниже предела их обнаружения, поскольку увеличение объема пробы приводит к ее разбавлению. При чрезмерном уменьшении объема растворителя, используемого для элюирования, извлечение проходит неполностью. В то же время если часть растворителя впоследствии удалить вы-лариванием, то при этом может снизиться содержание. летучих компонентов. Некоторые трудности, с которыми -сталкиваются при удалении излишков растворителя, рассматриваются в разделе Экстракционные методы . Недостатком метода элюирования, из-за которого многие авторы предпочитают термическую десорбцию, является также токсичность наиболее эффективных из обычно используемых элюентов, например бензола, толуола, сероуглерода. Избежать потери легкокипящих веществ при испарении можно, применяя в качестве элюента жидкий диоксид углерода. Жидким диоксидом углерода можно проводить и предварительную очистку адсорбента, и выделение пробы с использованием описанного в следующем разделе аппарата Сокслета для экстракции при высоком давлении [73]. Как будет показано далее, жидким диоксидом углерода особенно целесообразно вести элюирование с активного угля. [c.55]
chem21.info
















