Содержание
ICSC 0468 — ДИПРОПИЛОВЫЙ ЭФИР
ICSC 0468 — ДИПРОПИЛОВЫЙ ЭФИР
« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| ДИПРОПИЛОВЫЙ ЭФИР | ICSC: 0468 (Апрель 2002) |
| CAS #: 111-43-3 |
| UN #: 2384 |
| EINECS #: 203-869-6 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Воспламеняющееся. При температуре превышающей 21°C могут образовываться взрывоопасные смеси паров с воздухом. При температуре превышающей 21°C могут образовываться взрывоопасные смеси паров с воздухом. | НЕ использовать открытый огонь, НЕ допускать образование искр, НЕ КУРИТЬ. При температуре свыше 21°C применять замкнутую систему, вентиляцию и взрывозащищенное электрическое оборудование. | Использовать пену, сухой порошок, двуокись углерода. НЕ использовать воду. В случае пожара: охлаждать бочки и т.д. распыляя воду. |
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
|---|---|---|---|
| Вдыхание | Кашель. Боли в горле. Головокружение. Головная боль. | Применять вентиляцию, местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. Обратиться за медицинской помощью. |
| Кожа | Покраснение. Боль. Сухость кожи. Боль. Сухость кожи. | Защитная одежда. Защитные перчатки. | Снять загрязненную одежду. Ополоснуть и затем промыть кожу водой с мылом. |
| Глаза | Покраснение. Боль. | Использовать защитные очки или маску для лица. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. | |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Индивидуальная защита: респиратор с фильтром для органических газов и паров, подходящий для концентрации вещества в воздухе.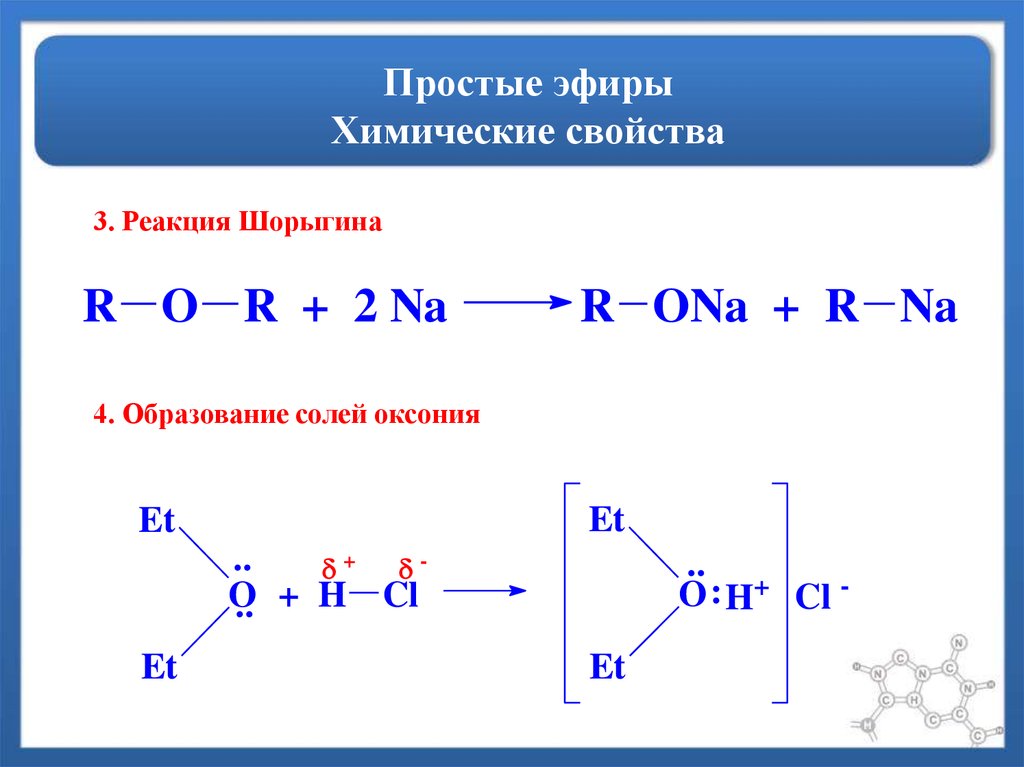 Вентилировать. Удалить все источники воспламенения. НЕ сливать в канализацию. Накрыть разлитый материал сухой землей песком другим негорючим материалом. Как можно быстрее собрать пролитую жидкость в закрывающиеся емкости. Вентилировать. Удалить все источники воспламенения. НЕ сливать в канализацию. Накрыть разлитый материал сухой землей песком другим негорючим материалом. Как можно быстрее собрать пролитую жидкость в закрывающиеся емкости. |
Согласно критериям СГС ООН
Транспортировка |
| ХРАНЕНИЕ | |
| Обеспечить огнестойкость. Прохладное место. Хранить в темноте. | |
| УПАКОВКА | |
| ДИПРОПИЛОВЫЙ ЭФИР | ICSC: 0468 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: C6H14O |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
|
|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
Перед дистилляцией следует проверить наличие перекисей и удалить их в случае обнаружения.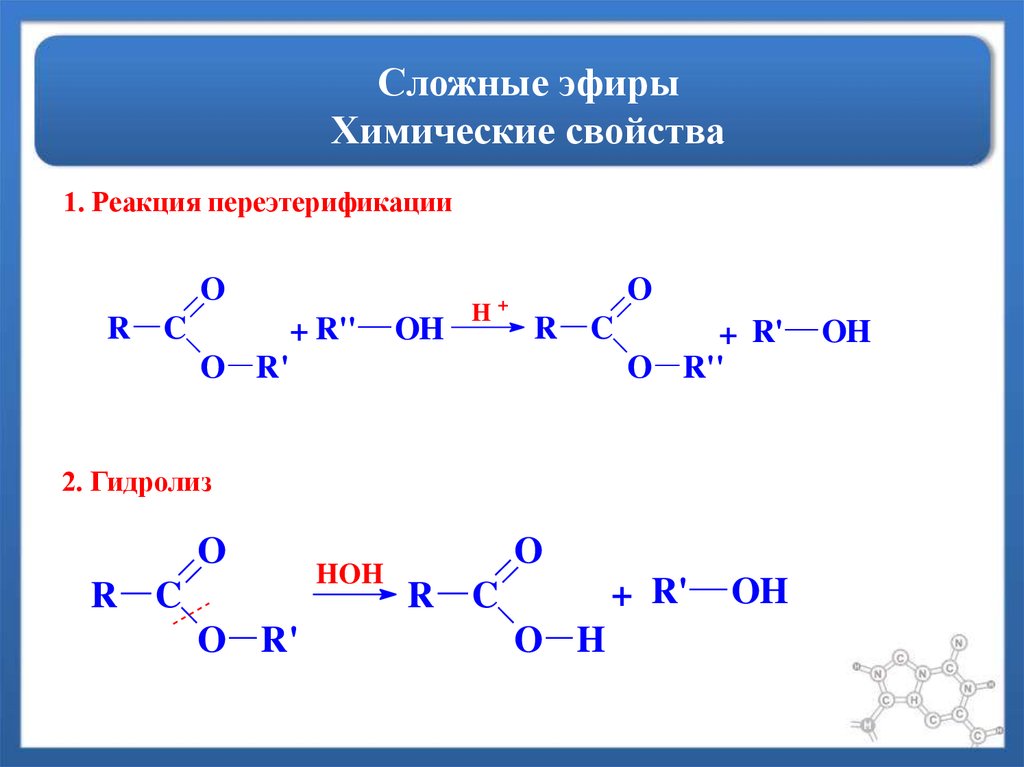
|
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС Символ: F; R: 11-19-66-67; S: (2)-9-16-29-33; Примечание: C |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Френкель Я. И. На заре новой физики. — 1970 — Электронная библиотека «История Росатома»
Френкель Я. И. На заре новой физики. — 1970 — Электронная библиотека «История Росатома»
Главная → Указатель произведений
ЭлектроннаябиблиотекаИстория Росатома
Ничего не найдено.
Загрузка результатов…
Закладки
ОбложкаФронтиспис123456789101112131415161718192021222324252627282930313233343536373839404142434445464748495051525354555657585960616263646566676869707172737475767778798081828384858687888990919293949596979899100101102103104105106107108109110111112113114115116117118119120121122123124125126127128129130131132133134135136137138139140141142143144145146147148149150151152153154155156157158159160161162163164165166167168169170171172173174175176177178179180181182183184185186187188189190191192193194195196197198199200201202203204205206207208209210211212213214215216217218219220221222223224225226227228229230231232233234235236237238239240241242243244245246247248249250251252253254255256257258259260261262263264265266267268269270271272273274275276277278279280281282283284285286287288289290291292293294295296297298299300301302303304305306307308309310311312313314315316317318319320321322323324325326327328329330331332333334335336337338339340341342343344345346347348349350351352353354355356357358359360361362363364365366367368369370371372373374375376377378379380381382383384
Увеличить/уменьшить масштаб
По ширине страницы
По высоте страницы
Постранично/Разворот
Поворот страницы
Навигация по документу
Закладки
Поиск в издании
Структура документа
Скопировать текст страницы
(работает в Chrome 42+,
Microsoft Internet Explorer и Mozilla FireFox
c установленным Adobe Flash Player)
Добавить в закладки
Текущие страницы выделены рамкой.
Содержание
ОбложкаОбложка
ФронтисписФронтиспис
1Титульные листы
3Предисловие редактора
5
Френкель В. Я.
К биографии Я. И. Френкеля
27I. Квантовая механика
27Кванты и радио
55Частицы и волны
69Механические и электромагнитные свойства световых атомов (квантов)
85Происхождение и развитие волновой механики
109Принципы квантовой статистики
136II. Теория относительности
136Мистика мирового эфира
147Теория относительности Эйнштейна
174III. Физика металлов
174Теория металлов
201Об элементарном выводе некоторых соотношений электронной теории металлов
209IV. Физика жидкостей
209Об электрических явлениях, связанных с кавитацией, обусловленной ультразвуковыми колебаниями в жидкостях
215Теория жидкого состояния
238Действие электрического поля на струю жидкости
244О возможности замены шариков в подшипниках каплями
247V. История физики. Разное
Разное
247Международный физический конгресс в память А. Вольты в г. Комо
259Метод аналогий в физике
275Проблемы современной физики
306Теоретическая физика в СССР за 30 лет
338Атомная энергия и ее освобождение
368Комментарии
378Даты жизни и деятельности Я. И. Френкеля
380Литература
383Содержание
Обращаясь к сайту «История Росатома — Электронная библиотека»,
я соглашаюсь с условиями использования представленных там материалов.
Правила сайта (далее – Правила)
- Общие положения
- Настоящие правила определяют порядок и условия использования материалов, размещенных на сайте www.biblioatom.ru (далее именуется Сайт), а также правила использования материалов Сайтом и порядок
взаимодействия с Администрацией Сайта. - Любые материалы, размещенные на Сайте, являются объектами интеллектуальной собственности (объектами авторского права или смежных прав, а также прав на средства индивидуализации).
 Права Администрации
Права Администрации
Сайта на указанные материалы охраняются законодательством о правах на результаты интеллектуальной деятельности. - Использование материалов, размещенных на Сайте, допускается только с письменного согласия Администрации Сайта или иного правообладателя, прямо указанного на конкретном материале, размещенном на
Сайте, или в непосредственной близости от указанного материала. - Права на использование и разрешение использования материалов, размещенных на Сайте, принадлежащих иным правообладателям, нежели Администрация Сайта, допускается с разрешения таких правообладателей
или в соответствии с условиями, установленными такими правообладателями. Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала. - Настоящие Правила распространяют свое действие на следующих пользователей: информационные агентства, электронные и печатные средства массовой информации, любые физические и юридические лица, а также
индивидуальные предприниматели (далее — «Пользователи»).
- Настоящие правила определяют порядок и условия использования материалов, размещенных на сайте www.biblioatom.ru (далее именуется Сайт), а также правила использования материалов Сайтом и порядок
- Использование материалов. Виды использования
- Под использованием материалов Сайта понимается воспроизведение, распространение, публичный показ, сообщение в эфир, сообщение по кабелю, перевод, переработка, доведение до всеобщего сведения и иные
способы использования, предусмотренные действующим законодательством Российской Федерации. - Использование материалов Сайта без получения разрешения от Администрации Сайта не допустимо.
- Внесение каких-либо изменений и/или дополнений в материалы Сайта запрещено.
- Использование материалов Сайта осуществляется на основании договоров с Администрацией Сайта, заключенных в письменной форме, или на основании письменного разрешения, выданного Администрацией Сайта.
- Запрещается любое использование (бездоговорное/без разрешения) фото-, графических, видео-, аудио- и иных материалов, размещенных на Сайте, принадлежащих Администрации Сайта и иным правообладателям
(третьим лицам).
- Стоимость использования каждого конкретного материала или выдача разрешения на его использование согласуется Пользователем и Администрацией Сайта в каждом конкретном случае.
- В случае необходимости использования материалов Сайта, права на которые принадлежат третьим лицам (иным правообладателям, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в
непосредственной близости от них), Пользователи обязаны обращаться к правообладателям таких материалов для получения разрешения на использование материалов.
- Под использованием материалов Сайта понимается воспроизведение, распространение, публичный показ, сообщение в эфир, сообщение по кабелю, перевод, переработка, доведение до всеобщего сведения и иные
- Обязанности Пользователей при использовании материалов Сайта
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- в печатных изданиях или в иных формах на материальных носителях Пользователи обязаны в каждом случае использования материалов указать источник – электронная библиотека «История Росатома»
(www. biblioatom.ru)
biblioatom.ru)
- в интернете или иных формах использования в электронном виде не на материальных носителях, Пользователи в каждом случае использования материалов обязаны разместить гиперссылку на Сайт —
электронная
библиотека «История Росатома» (www.biblioatom.ru), гиперссылка должна являться активной и прямой, при нажатии на которую Пользователь переходит на конкретную страницу Сайта, с которой заимствован
материал. - Ссылка на источник или гиперссылка, указанные в пп. 3.1.1 и 3.1.2. настоящих Правил, должны быть помещены Пользователем в начале используемого текстового материала, а также непосредственно
под используемым аудио-, видео-, фотоматериалом, графическим материалом Администрации Сайта.
- в печатных изданиях или в иных формах на материальных носителях Пользователи обязаны в каждом случае использования материалов указать источник – электронная библиотека «История Росатома»
- Размеры шрифта ссылки на источник или гиперссылки не должны быть меньше размера шрифта текста, в котором используются материалы Сайта, либо размера шрифта текста Пользователя, сопровождающего аудио-,
видео-, фотоматериалы и графические материалы Сайта, а также цвет ссылки должен быть идентичен цветам ссылок на Сайте и должен быть видимым Пользователю.
- Использование материалов с Сайта, полученных из вторичных источников (от иных правообладателей, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в непосредственной близости от
них), возможно только со ссылкой на эти источники и, в случае необходимости, установленной такими источниками (правообладателями), — с их разрешения. - Не допускается переработка оригинального материала (произведения), взятого с Сайта, в том числе сокращение материала, иная его переработка, в том числе приводящая к искажению его смысла.
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- Права на материалы третьих лиц, урегулирование претензий
- Материалы, права на которые принадлежат третьим лицам, размещенные на Сайте, размещены либо с разрешения правообладателя, полученного Администрацией Сайта, либо, в случае, если таковое использование
прямо не запрещено правообладателем, в соответствии с Законодательством РФ в информационных целях с обязательным указанием имени автора, материал которого используется, и источника заимствования.
- В случае, если в обозначении авторства материалов в соответствии с п. 4.1. настоящих Правил содержится ошибка, или в случае использования материала с предполагаемым или реальным нарушением прав
третьих лиц, или в иных спорных случаях использования объектов интеллектуальной собственности, размещенных на Сайте, в том числе в случае, когда права третьего лица тем или иным образом нарушаются с
использованием Сайта, применяется следующая схема урегулирования претензий третьих лиц к Администрации Сайта:- в адрес Администрации Сайта по электронной почте на адрес [email protected] направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав; - Администрация Сайта обязуется рассмотреть надлежаще оформленную претензию в срок не менее 5 (пяти) рабочих дней с даты ее получения по электронной почте. Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии; - Администрация Сайта в любом случае предпринимает все возможные меры к скорейшему удовлетворению обоснованных претензий третьих лиц и стремиться к максимально скорому урегулированию всех
спорных
вопросов.
- в адрес Администрации Сайта по электронной почте на адрес [email protected] направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
- Материалы, права на которые принадлежат третьим лицам, размещенные на Сайте, размещены либо с разрешения правообладателя, полученного Администрацией Сайта, либо, в случае, если таковое использование
- Прочие условия
- Администрация Сайта оставляет за собой право изменять настоящие Правила в одностороннем порядке в любое время без уведомления Пользователей. Любые изменения будут размещены на Сайте. Изменения
вступают в силу с момента их опубликования на Сайте. - По всем вопросам использования материалов Сайта Пользователи могут обращаться к Администрации Сайта по следующим координатам: [email protected]
- Во всем, что не урегулировано настоящими Правилами в отношении вопросов использования материалов на Сайте, стороны руководствуются положениями Законодательства РФ.
- Администрация Сайта оставляет за собой право изменять настоящие Правила в одностороннем порядке в любое время без уведомления Пользователей. Любые изменения будут размещены на Сайте. Изменения
СогласенНе согласен
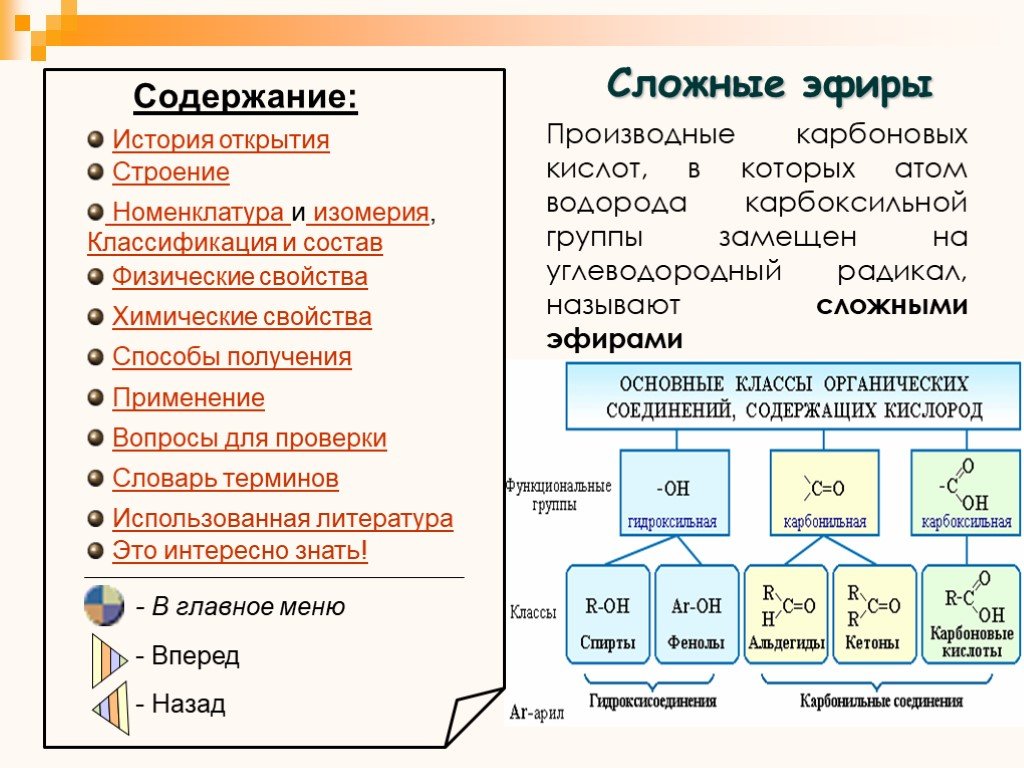
Свойства эфира – физические свойства, химические свойства и электрофильное замещение
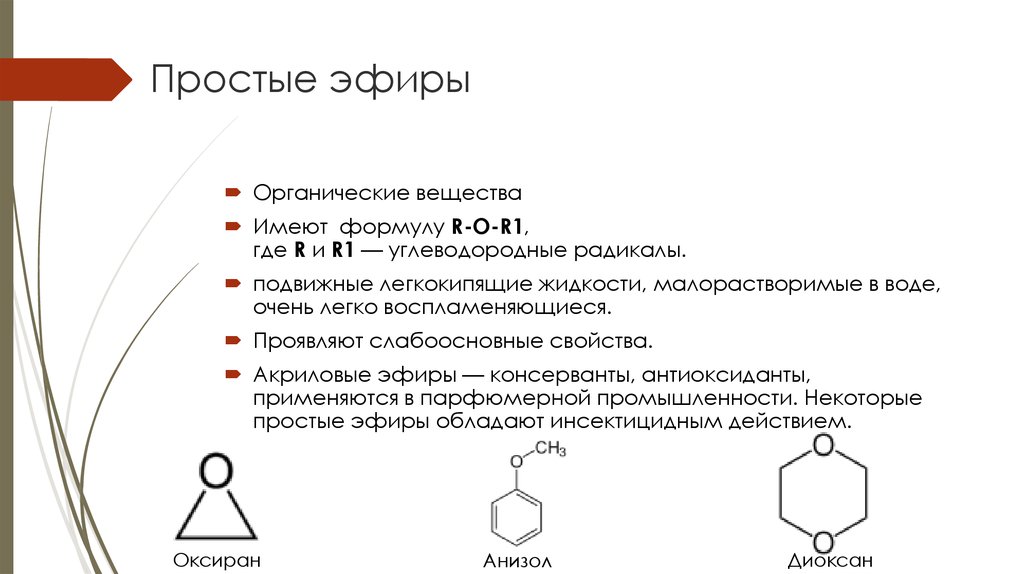
Простые эфиры представляют собой классы органических соединений, которые содержат эфирную группу, атом кислорода, связанный с двумя арильными или алкильными группами. Они имеют общую формулу R-O-R’, где R и R’ представляют собой арильные или алкильные группы. Эфиры можно разделить на две разновидности. Предположим, если алкильные группы одинаковы по обе стороны от атома кислорода, то он известен как простой или симметричный эфир. С другой стороны, если они различны, эфиры называются смешанными или несимметричными эфирами.
Они имеют общую формулу R-O-R’, где R и R’ представляют собой арильные или алкильные группы. Эфиры можно разделить на две разновидности. Предположим, если алкильные группы одинаковы по обе стороны от атома кислорода, то он известен как простой или симметричный эфир. С другой стороны, если они различны, эфиры называются смешанными или несимметричными эфирами.
Типичным примером первой группы является растворитель и анестетик диэтиловый эфир, называемый просто «эфир» (Ch4 — Ch3 — O — Ch3 — Ch4). В органической химии простые эфиры распространены и даже более распространены в биохимии, поскольку они являются обычными связями в лигнине и углеводах. Строение простых эфиров сходно со строением спирта, а спирты и эфиры сходны по строению с водой.
Общая формула простых эфиров может быть R-O-R, R-O-Ar или Ar-O-Ar, где Ar представляет собой арильную группу, а R представляет собой алкильную группу.
Структура эфира
Связь С-О-С характеризуется валентными углами 104,5 градусов, при этом расстояние С-О составляет около 140 пикометров. Кислород эфира более электроотрицательный, чем кислород углерода. Следовательно, альфа-водороды более кислые, чем в обычных углеводородных цепях.
Кислород эфира более электроотрицательный, чем кислород углерода. Следовательно, альфа-водороды более кислые, чем в обычных углеводородных цепях.
(Изображение скоро будет загружено)
Номенклатура эфира
Назвать эфир можно двумя способами. Один из наиболее распространенных способов — идентифицировать алкильные группы по обе стороны от атома кислорода в алфавитном порядке, записывая их как «эфир». Например, этилметил — это тот, который имеет этильную группу и метильную группу с любой стороны атома кислорода. Если две алкильные группы идентичны, эфир называется ди(алкиловым) эфиром. И, допустим, диэтиловый эфир — это тот, у которого этильная группа находится по обе стороны от атома кислорода.
Другой способ именования является формальным по методу IUPAC. Здесь форма представляет собой короткую алкильную цепь, окси и длинную алкильную цепь. Например, название этилметилового эфира по классификации ИЮПАК — метоксиэтан.
Основа соединения называется оксациклоалканом в циклических эфирах. «Окса» является индикатором замены углерода кислородом в кольце. Оксациклопентан является примером пятичленного кольца, в котором четыре атома углерода и один атом кислорода.
(Изображение скоро будет загружено)
Свойства эфира
Эфиры довольно неполярны из-за присутствия алкильной группы по обе стороны от центрального кислорода. Рядом с ним существуют объемные алкильные группы, что означает, что атом кислорода крайне неспособен участвовать в водородных связях. Таким образом, эфиры имеют более низкую температуру кипения по сравнению со спиртами той же молекулярной массы.
Алкильная цепь простых эфиров удлиняется; однако разница в температурах кипения становится меньше. Это происходит из-за эффекта усиления ван-дер-ваальсовых взаимодействий по мере увеличения количества атомов углерода. И, таким образом, количество электронов также увеличивается. Две неподеленные пары электронов в атомах кислорода позволяют эфирам образовывать водородные связи, реагируя с водой. Простые эфиры гораздо более полярны, чем алкены, но не так полярны, как спирты, сложные эфиры или амиды сопоставимых структур.
Две неподеленные пары электронов в атомах кислорода позволяют эфирам образовывать водородные связи, реагируя с водой. Простые эфиры гораздо более полярны, чем алкены, но не так полярны, как спирты, сложные эфиры или амиды сопоставимых структур.
Физические и химические свойства эфира приведены ниже.
Физические свойства эфира
Физические свойства эфира можно описать следующим образом.
Молекула эфира обладает чистым дипольным моментом. Это можно объяснить полярностью связи С-О.
Температура кипения эфира сравнима с алканами. Однако он очень низок по сравнению со спиртами сопоставимой молекулярной массы. Кроме того, это факт полярности связи С-О.
Смешиваемость эфира с водой напоминает спирт.
Молекулы эфира смешиваются с водой.
 Также мы можем объяснить это тем, что, как и спирты, атом кислорода эфира также может образовывать водородные связи с молекулой воды.
Также мы можем объяснить это тем, что, как и спирты, атом кислорода эфира также может образовывать водородные связи с молекулой воды.
Химические свойства эфира
Обычно простые эфиры вступают в химические реакции двумя способами. Давайте посмотрим на это в разделе ниже.
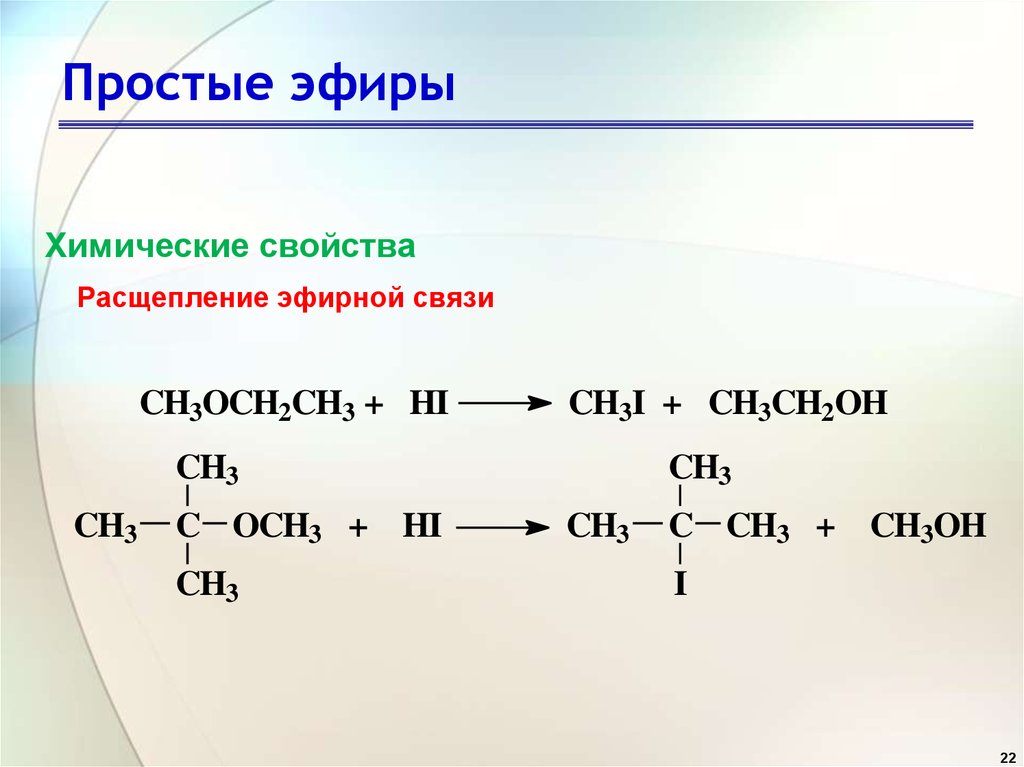
Расщепление связи C-O
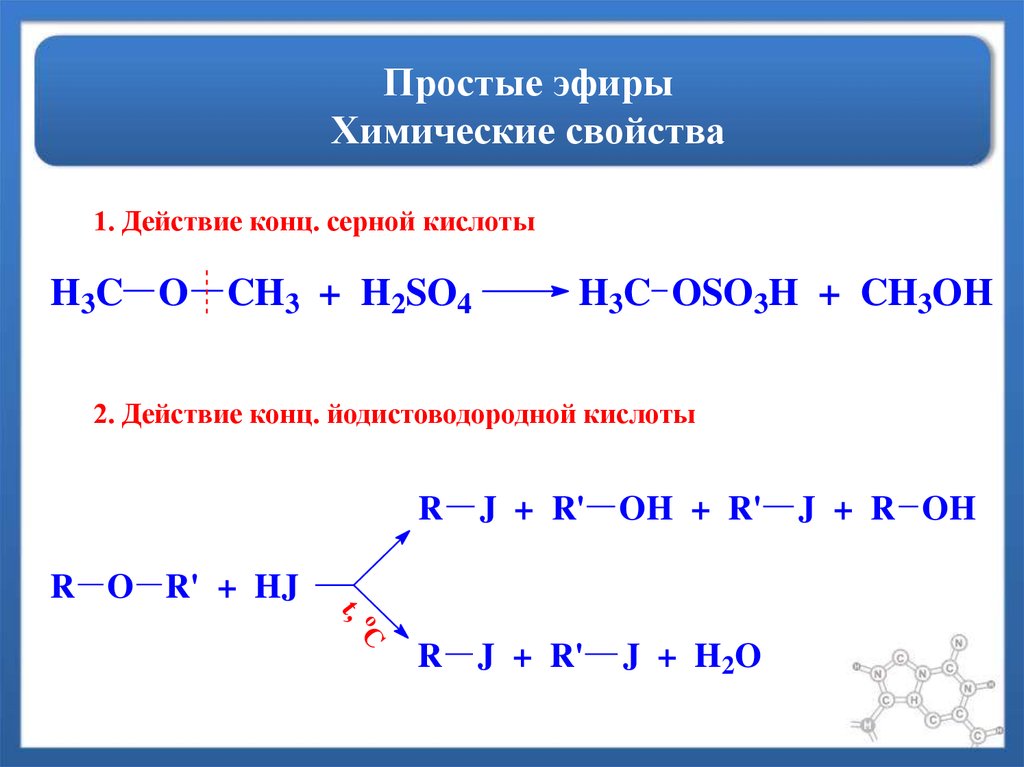
Как правило, эфиры очень неактивны по своей природе. Когда мы добавляем к эфиру избыток галогеноводорода, происходит разрыв связи С-О. Это приводит к образованию алкилгалогенидов. Порядок реактивности следующий.
HI > HBr > HCl
R-O-R + HX → RX + R-OH
Электрофильное замещение
Алкоксигруппа простого эфира активирует ароматическое кольцо в пара- и орто-положениях для электрофильного замещения. Некоторыми распространенными реакциями электрофильного замещения являются реакция Фриделя-Крафтса, галогенирование и некоторые другие.
Реакция галогенирования эфира
Простые эфиры ароматического типа подвергаются галогенированию. Допустим, бромирование — когда мы добавляем атомы галогена в присутствии или в отсутствие катализатора.
Допустим, бромирование — когда мы добавляем атомы галогена в присутствии или в отсутствие катализатора.
(Изображение будет загружено в ближайшее время)
Реакция эфиров Фриделя-Крафтса
Ароматические эфиры подвергаются реакции Фриделя-Крафтса. Например, добавление ацильной или алкильной группы, когда мы вводим ее в ацил или алкилгалогенид в присутствии кислоты Льюиса в качестве катализатора.
Замещение электрофилов
Алкоксигруппа эфира активирует ароматическое кольцо в пара- и орто-положениях для электрофильного замещения. Реакция Фриделя-Крафтса, галогенирование и некоторые другие являются образцами распространенных реакций электрофильного замещения.
В этой статье мы обсудили эфир и его свойства. Чтобы узнать больше об основных терминах и других связанных с химией темах, вы можете посетить наш веб-сайт.
Химические свойства эфиров: определение, формулы, свойства, применение 9\circ }\), два диполя не компенсируют друг друга, что приводит к чистому дипольному моменту.
 Эфиры используются в качестве анестетиков, а также используются для охлаждения. В этой статье мы изучим некоторые химические свойства алифатических и ароматических эфиров.
Эфиры используются в качестве анестетиков, а также используются для охлаждения. В этой статье мы изучим некоторые химические свойства алифатических и ароматических эфиров.
Проверить физические свойства эфиров
Что такое эфиры?
Простые эфиры представляют собой органические соединения, содержащие атом кислорода, присоединенный к двум алкильным или арильным группам, которые могут быть одинаковыми или разными. Общая формула эфиров может быть записана как \({\rm{R — O — R,R — O — Ar,}}\) или \({\rm{Ar — O — Ar}}\). Органическая номенклатура \({\rm{R}}\) представляет собой алкильную группу, а \({\rm{Ar}}\) представляет собой арильную группу в приведенной выше формуле. Эти соединения можно разделить на два типа или категории. Эта классификация определяется группами заместителей, присоединенными к соединению. В результате мы можем классифицировать их как
1. Атом кислорода присоединен к двум одинаковым группам в симметричном эфире.
2. Атом кислорода присоединен к двум различным группам в асимметричном эфире.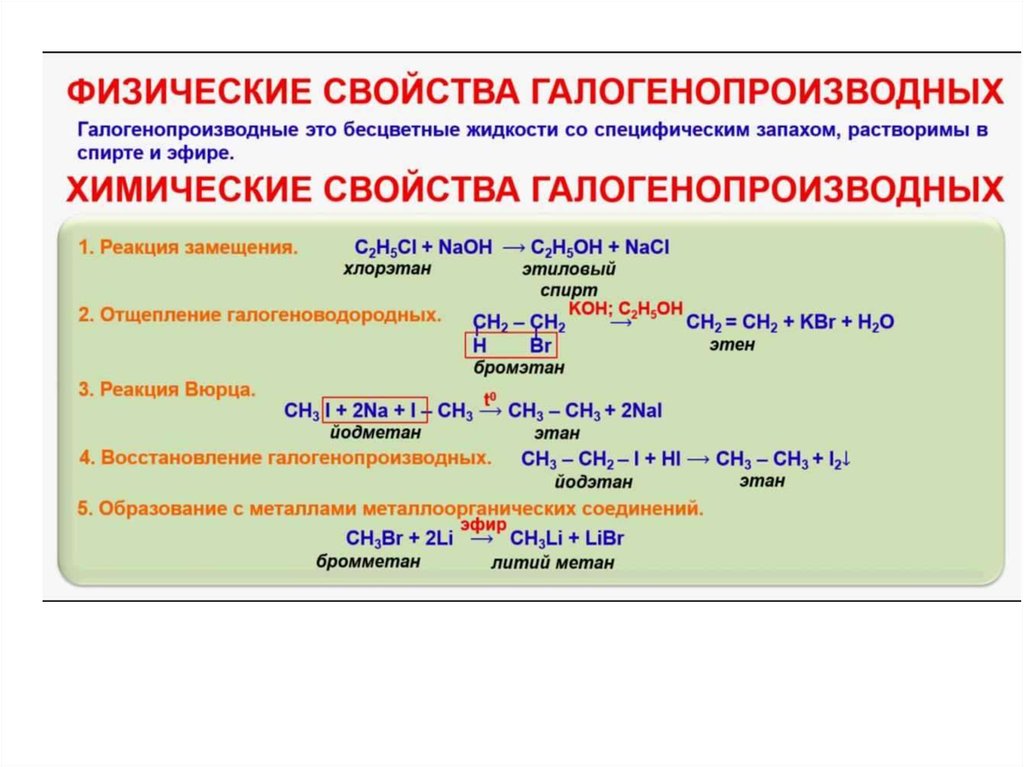
Эфиры обладают различными свойствами. Мы подробно обсудим некоторые химические свойства эфиров.
Химические свойства эфиров
Эфиры представляют собой бесцветные жидкости со сладким запахом, очень летучие и легковоспламеняющиеся. Из-за водородной связи и гидрофобных алкильных или арильных групп простые эфиры мало растворимы в воде. 9\circ }\), и, таким образом, дипольные моменты двух связей \({\rm{C}} — {\rm{O}}\) не сокращаются. Таким образом, простые эфиры полярны, но имеют слабую полярность (для диэтилового эфира \( = 1,18\,{\rm{D}}\)).
Простые эфиры имеют более низкую реакционную способность, чем функциональные группы соединений. На них не действуют активные металлы, сильные основания, восстановители и окислители. Химические свойства простых эфиров обусловлены наличием алкильной группы, неподеленной пары электронов на атоме кислорода и разрывом связи \({\rm{C}} — {\rm{O}}\) .
Реакции, обусловленные алкильной группой
Горение
Эфиры легко воспламеняются и взрывоопасно смешиваются с воздухом с образованием двуокиси углерода и воды.
\({{\rm{C}}_2}{{\rm{H}}_5}{\rm{O}}{{\rm{C}}_2}{{\rm{H}}_5} + 6{{\rm{O}}_2} \to 4{\rm{C}}{{\rm{O}}_2} + 5{{\rm{H}}_2}{\rm{O} }\)
Галогенирование
В отсутствие солнечного света алкильная группа эфира подвергается реакции замещения хлором или бромом с образованием а-галогенированных эфиров.
Однако в присутствии солнечного света все атомы водорода в эфирах замещаются.
Реакция, вызванная эфирным кислородом
Образование перекиси
Из-за присутствия неподеленной пары электронов в эфирном кислороде, когда эфир вступает в контакт с атмосферным кислородом в присутствии солнечного света, он реагирует с кислородом с образованием перекиси эфира. Перекись эфира крайне нестабильна и при нагревании сильно взрывается, что приводит к серьезным авариям. В результате кипячение образца эфира, который хранился в течение длительного периода времени, рискованно.
Образование солей оксония
Поскольку простые эфиры могут вести себя как слабые основания Льюиса, они могут растворяться в холодных и концентрированных минеральных кислотах, таких как соляная кислота или серная кислота, с образованием солей оксония.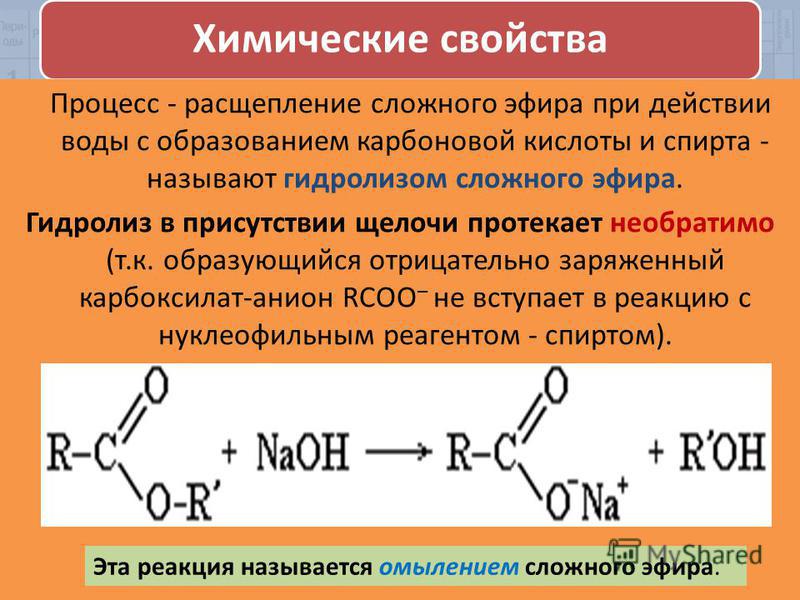 (То есть протонирование кислотой).
(То есть протонирование кислотой).
Реакции, связанные с разрывом связи C-O
Реакция с галогеновыми кислотами (HX)
При нагревании простых эфиров с концентрированными галогенокислотами (особенно \({\rm{HI}}\) и \({\rm{HBr}} \)), связь \({\rm{CO}}\) расщепляется с образованием спирта и алкилгалогенида.
Когда речь идет о несимметричных простых эфирах, большая алкильная группа образует алкилйодид, а меньшая алкильная группа образует спирт.
Порядок реакционной способности следующий:
\({\rm{HI}} > {\rm{HBr}} > {\rm{HCl}}\)
Расщепление происходит только в экстремальных условиях: концентрированные кислоты ( обычно \({\rm{HI}}\) или \({\rm{HBr}}\)) и высокие температуры.
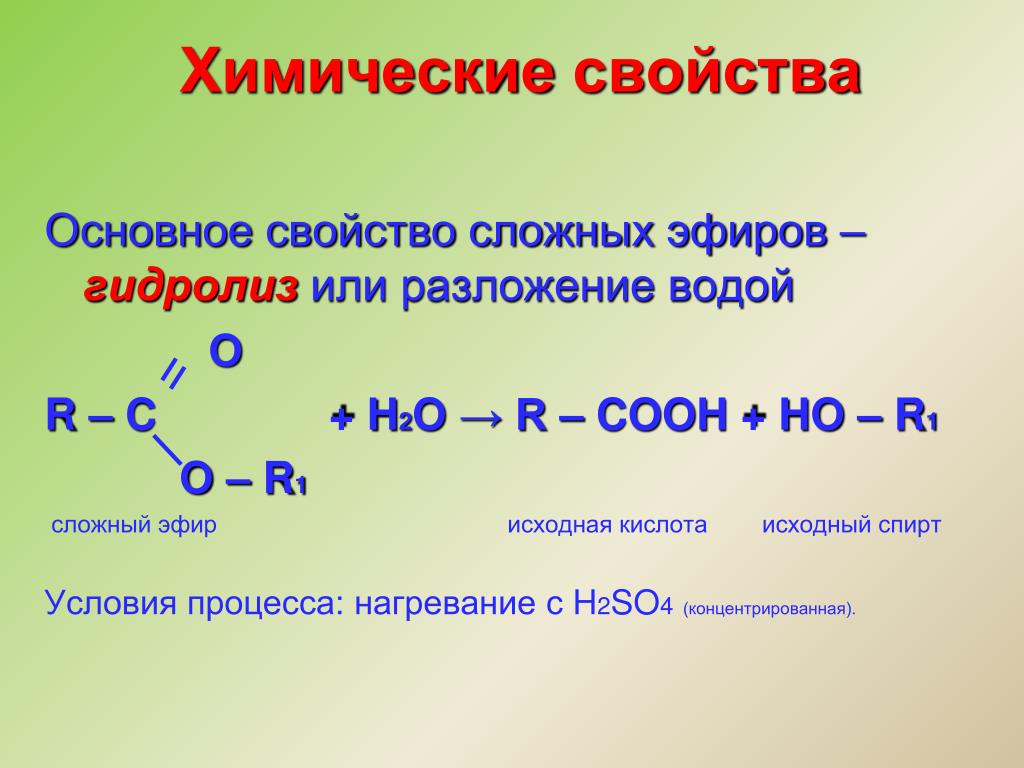
Гидролиз
Эфир образует спирт при кислотном гидролизе.
Реакция с \({\rm{PC}}{{\rm{l}}_{\rm{5}}}\)
При нагревании эфира с \({\rm{PC}}{{\rm{ l}}_{\rm{5}}}\), связи \({\rm{C-O}}\) в эфире расщепляются, что приводит к образованию алкилхлорида.
Реакции в ароматических эфирах
Электрофильное замещение
Так же, как и у фенола, алкоксигруппа \(( – {\rm{OR}})\) находится в орто-, пара-направлении и активирует ароматическое кольцо в сторону электрофильного замещения .
II, III и IV демонстрируют высокую электронную плотность в орто- и пара-положениях.
Галогенирование
Фенилалкиловые эфиры обычно подвергаются галогенированию в бензольном кольце. Например, анизол подвергается бромированию бромом в этановой кислоте даже в отсутствие катализатора на основе бромида железа (III). Это вызвано тем, что метоксигруппа активирует бензольное кольцо. \({\rm{90 \%}}\) времени пара-изомер получается в качестве основного продукта.
Реакция Фриделя-Крафтса
Анизол подвергается реакции Фриделя-Крафтса, которая включает введение алкильных и ацильных групп в орто- и пара-положениях посредством реакций с алкилгалогенидом и ацилгалогенидом в присутствии безводного хлорида алюминия (кислоты Льюиса) в качестве катализатор.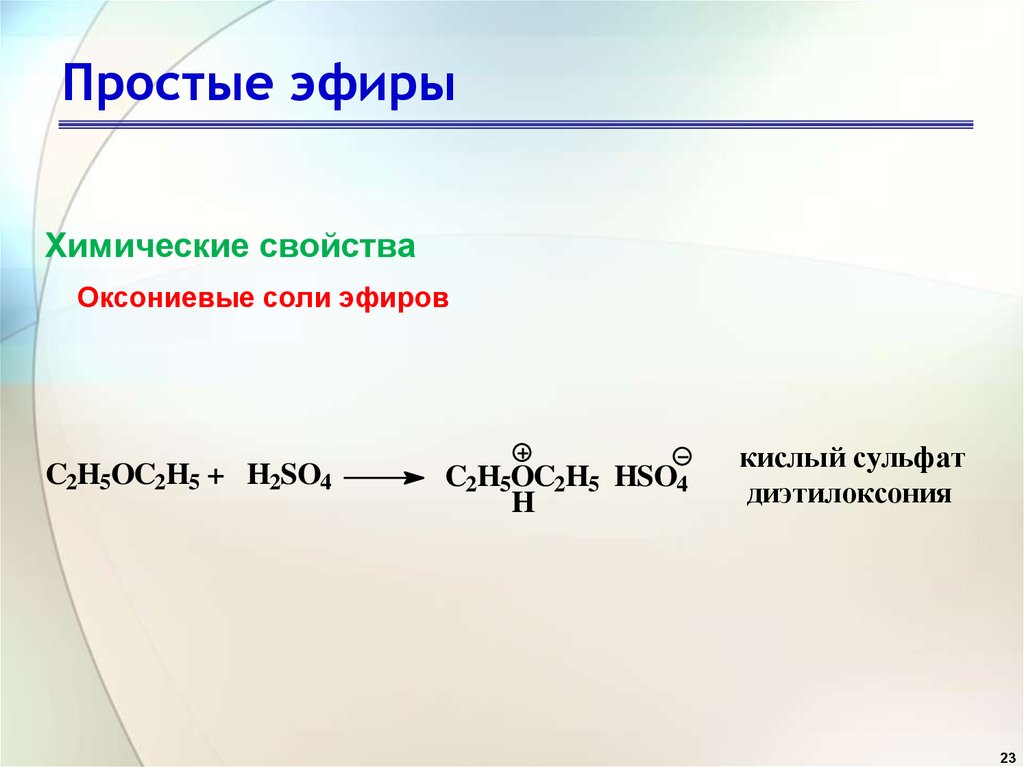
Нитрование
Анизол реагирует с концентрированными серной и азотной кислотами с образованием орто- и пара-нитроанизола.
Использование эфиров
Ниже приведены некоторые виды использования эфиров:
i. Эфир — это растворитель, который используется для растворения масла, смолы, бензина, камеди и других веществ.
ii. Из-за своей почти инертности и высокой растворяющей способности они также используются в качестве реакционной среды для некоторых реакций, например, при получении реактива Гриньяра, реакции Вюрца и т. д. 9\prime }\) — это общая формула эфира. Мы также изучили, что эфиры в целом очень неактивны по своей природе. Связь \({\rm{C-O}}\) разрывается при добавлении к эфиру избытка галогеноводорода. В результате образуются алкилгалогениды. Теперь мы знаем, что алкоксигруппа эфира активирует ароматическое кольцо в пара- и орто-положениях для электрофильного замещения. Реакция Фриделя-Крафтса, галогенирование и некоторые другие являются примерами распространенных реакций электрофильного замещения. Мы также изучили некоторые варианты использования эфиров.
Мы также изучили некоторые варианты использования эфиров.
Часто задаваемые вопросы
Q.1. Почему эфир хранят в бутылке с железной проволокой?
Ответ: В присутствии солнечного света эфир сильно реагирует с атмосферным кислородом, образуя пероксид, который взрывается при нагревании, вызывая серьезную аварию.
Когда эфир хранится в бутылке с железной проволокой, кислород соединяется с железом с образованием оксида железа, предотвращая образование перекиси эфира. В результате эфир хранится в бутылке с железной проволокой.
Q.2. Каковы области применения диэтилового эфира?
Ответ: Некоторые из применений диэтилового эфира следующие:
i. Он в основном используется в качестве растворителя для масел, жиров, камедей, смол, пластмасс и других подобных веществ.
ii. Он служит хладагентом.
III. В хирургии он используется как средство для общей анестезии.
iv. Он смешивается со спиртом и используется в качестве заменителя бензина под торговой маркой Natalite.
Он смешивается со спиртом и используется в качестве заменителя бензина под торговой маркой Natalite.
Q.3. Одинаковы ли химические свойства эфиров и спиртов?
Ответ: Нет, химические свойства простых эфиров и спиртов неодинаковы. Это связано с тем, что принципиальное различие между этими соединениями заключается в наличии групп \({\rm{OH}}\) в спирте, отсутствующих в эфире. Поскольку между молекулами эфира не могут образовываться водородные связи, температура кипения этого соединения более чем на 80 градусов Цельсия ниже, чем у соответствующего спирта.
Q.4. Каковы физические свойства эфиров?
Ответ: Физические свойства простых эфиров следующие:
i. В молекуле эфира существует чистый дипольный момент. Это связано с полярностью связи \({\rm{CO}}\).
ii. Температура кипения эфира сравнима с температурой кипения алканов.
III. Смешиваемость эфира с водой такая же, как у спирта.
iv. Молекулы эфира смешиваются с водой.
Q.5. Является ли диэтиловый эфир кислотным или основным?
Ответ: Диэтиловый эфир является сильным основанием Льюиса, которое реагирует с широким спектром кислот Льюиса. Поскольку атом кислорода в молекуле диэтилового эфира имеет две неподеленные пары электронов, доступных для координации, он ведет себя как основание.
Последние обновления
Структура платы за обучение в CBSE Class 12: Проверьте важные детали
Структура оплаты за обучение в CBSE Class 12: Центральный совет по среднему образованию (CBSE) является крупнейшим советом по образованию в Индии. Многие учащиеся стремятся получить с его помощью свое среднее образование или 12-й класс. Принимаются оценки CBSE класса 12…
Подробнее
Решения NCERT для политологии класса 9, глава 2
Решения NCERT для политологии класса 9 Глава 2: Конституционный дизайн — одна из важных тем политологии класса 9.

 03
03
 Права Администрации
Права Администрации

 biblioatom.ru)
biblioatom.ru)

 В претензии также указывается адрес
В претензии также указывается адрес
 Также мы можем объяснить это тем, что, как и спирты, атом кислорода эфира также может образовывать водородные связи с молекулой воды.
Также мы можем объяснить это тем, что, как и спирты, атом кислорода эфира также может образовывать водородные связи с молекулой воды.