Способ получения сложных эфиров янт.лрнойкислоты. Сложный эфир янтарной кислоты
14.Образование сложных эфиров, тиоэфиров, амидов, ангидридов, галогенгидридов карбоновых кислот. Ацетилкофермент а in vivo как переносчик ацильных групп на нуклеофильные субстраты.
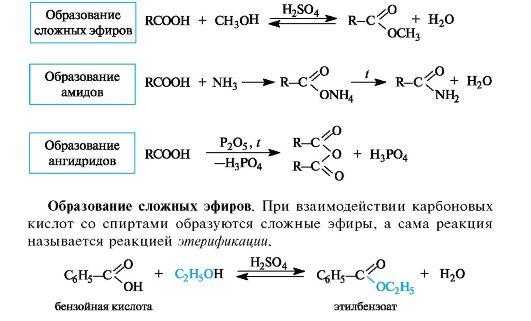
Образование амидов. При действии на карбоновые кислоты аммиака (газообразного или в растворе) непосредственно замещения группы ОН не происходит, а образуется аммониевая соль. Лишь при значительном нагревании сухие аммониевые соли теряют воду и превращаются в амиды
Образование ангидридов кислот. Нагревание карбоновых кислот с оксидом фосфора(V) приводит к образованию ангидридов кислот
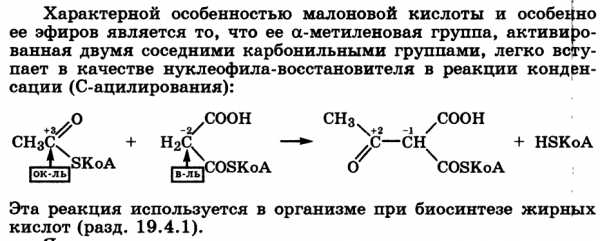
Образование тиоэфиров. конденсация карбоновых кислот в присутствии водоотнимающих реагентов[2] (например, N,N'-дициклогексилкарбодиимида[3] (DCC, ДЦК):
RSH + R’CO2H → RSC(O)R' + h3O
При всей сложности строения молекулы ацетилкофермента А с позиций химического подхода можно определить, что этот кофермент функционирует как тиоэфир. 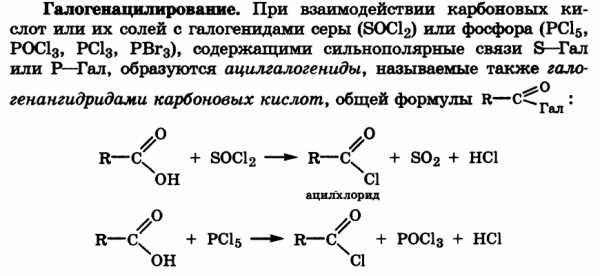
В качестве тиола, участвующего в его образовании, выступает кофермент А (сокращенно обозначаемый CoASH), молекула которого построена из остатков трех компонентов - 2-аминоэтантиола, пантотеновой кислоты и аденозиндифосфата (дополнительно фосфорилированного по положению 3 в рибозном фрагменте). Аденозиндифосфат (АДФ) рассмотрен в дальнейшем как представитель другой важной группы коферментов - нуклеозидполифосфатов (см. 14.3.1). Пантотеновая кислота образует, с одной стороны, амидную связь с 2-аминоэтанти- олом, а с другой - сложноэфирную связь с остатком АДФ.
Ацетилкофермент А in vivo является переносчиком ацетильных групп на нуклеофильные субстраты.
15. Двухосновные карбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая, фумаровая. Оксалаты. Декарбоксилирование щавелевой и малоновой кислот. Превращение янтарной кислоты в фумаровую. Биологическое значение.
| Название кислоты | Формула | Название аниона или основы сложного эфира |
| Щавелевая (этандиовая) Малоновая (пропандиовая) Янтарная (бутандиовая) Глутаровая (пентандиовая) | НООС-СООН НООССН2СООН НООС(СН2)2СООН НООС(СН2)3СООН | Оксалат Малонат Сукцинат Глутарат |
Щавелевая кислота - простейшая двухосновная кислота. Некоторые ее соли, например оксалат кальция, трудно растворимы и часто образуют камни в почках и мочевом пузыре (оксалатные камни).
Янтарная кислота в заметном количестве была обнаружена в янтаре, откуда получила название сама кислота и ее производные сукцинаты (от лат. succinium - янтарь).
Малеиновая и фумаровая кислоты - представители ненасыщенных дикарбоновых кислот с одной двойной связью. Фумаровая кислота участвует в обменных процессах, протекающих в организме.
Кислотные свойства. С накоплением кислотных групп увеличиваются кислотные свойства соединений. Кислотность дикарбоновых кислот больше, чем монокарбоновых. Так, щавелевая кислота (pKa 1,23) значительно сильнее уксусной (pKa 4,76), что связано с -/- эффектом группы СООН, и благодаря этому более полной делокализации отрицательного заряда в сопряженном основании.
Влияние заместителя наиболее отчетливо проявляется при его близком расположении к кислотному центру.
Декарбоксилирование. При нагревании с серной кислотой щавелевая кислота декарбоксилируется, а образовавшаяся муравьиная кислота разлагается далее.
Малоновая кислота легко декарбоксилируется при нагревании выше 100 ?С
Малеиновая и фумаровая кислоты проявляют сходные химические свойства: вступают в реакции, свойственные соединениям с двойной связью (обесцвечивание бромной воды, водного раствора перманганата калия) и соединениям с карбоксильными группами (образуют два ряда производных - кислые и средние соли, эфиры и т. п.). Однако только одна из кислот, а именно малеиновая, в относительно мягких условиях претерпевает внутримолекулярную циклизацию с образованием циклического ангидрида. В фумаровой кислоте вследствие удаленности карбоксильных групп друг от друга в пространстве образование циклического ангидрида невозможно.
Окисление янтарной кислоты in vivo. Дегидрирование (окисление) янтарной кислоты в фумаровую, катализируемое в организме ферментом, осуществляется с участием кофермента ФАД . Реакция протекает стереоспецифично с образованием фумаровой кислоты (в ионной форме - фумарат).
Сукцинатдегидрогеназа ( КФ 1.3.99.2) катализирует превращение янтарной кислоты в фумаровую. Кофактором фермента является ФАД. Фермент прочно связан с внутренней мембраной митохондрий.
Малоновая кислота в малых концентрациях ( 0 01 М) является высокоспецифичным ингибитором одной из стадий постулированной схемы реакций, а именно стадии превращения янтарной кислоты в фумаровую. Введение малоновой кислоты в дышащую дыхательную систему приводит к уничтожению отмеченного каталитического эффекта и накоплению янтарной кислоты
studfiles.net
Способ получения сложных эфиров янт.лрнойкислоты
О П И С А Н И Е 1!1) 419512
ИЗОБРЕТЕНИЯ
Союз Советск а О ° у д
Р6с
Госудврствс!!!!ь:",=::,си1.-.."-т
Сссстс
Спубс!иковапо 15.03.74. Ьюллстснь ¹ 10
Дата опубликования описания 22.08.74 (53) УДК 547.461.4.07 (088.S) (72) 4вторы ! 3 о б р с т с и 1 51
Г. C. Геворкян и Г. !. Гa3ap5:и (71) Заяви гель
Ереванск-!; завод химических реактивов (54) СПОСОБ ПОЛУЧЕНИЯ СЛОЖНЫХ Эфi".ÐOÂ ЯНТАРНОЙ
КИСЛОТЫ
Изобретение относится к способу получения слоскных эфиров янтарной кислоты, широко применяемых в качестве пластификаторов в производстве IIJIBcTII IccKHx масс и синтетических смол.
Известен способ получения сложных эфиров янтарной кислоты, заключающийся в Toil, что яптар1!ую кислоту этерифицируют спир гом при
IIaI pc!I. IviliI в присутствии серной кислоты.
Выход эфира составляет 72 — 75
Цель изобретения — повышение выхода целевого продукта и упрощение технологического процесса.
Согласно предлагаемому способу малсицовый ангидрид гидрируют в присутствии активированпого никеля Ренея в среде низшего алифатичсского спирта при повышенных температуре и давлении, предпочтительны темпера
11рсдлагасмым способом получают продукт с рсактивпой квалификацией чистоты при выходе до 98%.
П р и м с р. Б реактор из нержавеющей стали, представляющий собой аппарат колонного типа емкостью 2 л, загружа!от 196 г (2 моль) малеинового ангидрида, -!60 г (10 моль) абсолютного этилового спирта и 10 г активированного никеля Рснся. Подачей водорода 11од5 пимают давление до 2.5 — 3 Oòì 11 одповрсiieIivo нагревают смесь до 80 — 100 С. Для интенсивного иерем сшива!и!я массы I30. Lopoд, нагнетаемый 1;омпрессором, циркулирует со скоростью 20 л мпп. Через 2 — 2,5 lvc поглощ.-!1!!c
10 водорода iipcI
Реакционную массу фильтруют, удаляют избыток спирта, а продукт выдсля!от известным
Выход диэтплового эфира янтарной кислоты 341 г (98"-,j теорстпчсского. c÷IIT351 на малеиновы i ангидрид). Чистота продукта 99,5%.
Предмет изобретения
1. Способ получс 1гя ело>к5!ых эфиров янтарной кислоть с использованием низшего алифатичсского спирта при нагревании H vpuсутcTBI
11111 .ел51 Рсп я в срс1с низп!его (l,lифатll lсско! о
30 с,ирта прп температуре ки1!сипя рс I!ii
419512
Составитель T. Лавриненко
Техред 3. Тараненко Корректор Л. Чуркина
Редактор Е. Хорина
Заказ 1863/12 Изд. ¹ 1386 Тираж 506 Подписное
ЦНИИПИ Государственного комитета Совета Министров СССР по делам изобретений и открытий
Москва, Ж-35, Раушская наб., д. 4/5
Типография, пр. Сапунова, 2
2. Способ по п. 1, отличающийся тем, что процесс ведут при температуре 80 — 100 С н давлении 2,5 — 3 атм.
3. Способ по п. 1, отличающийся тем, что процесс ведут при соотношении малеинового ангидрида и катализатора 1: 0,03 — 0,05,
www.findpatent.ru
Янтарная кислота диэтиловый эфир - Справочник химика 21
Диэтиловый- эфир янтарной киСлоты -> диэтиловый эфир [c.167]
Диэтилсукцинат см. Диэтиловый эфир янтарной кислоты [c.215]
Диэтиловый эфир янтарной кислоты в условиях проведения сложноэфирной конденсации образует циклический продукт [c.234]
Диэтиловый эфир винной кислоты Этиловый эфир лауриновой кислоты Диэтиловый эфир щавелевой кислоты в) Диэтиловый эфир янтарной кислоты Диэтиловый эфир малеиновой кислоты [c.390]
Этиловый эфир аце-тоуксусной кислоты Диэтиловый эфир щавелевой кислоты Диметиловый эфир янтарной кислоты Диметиловый эфир-1-яблочной кислоты Бромистый циклогексил [c.80]Диэтиловый эфир янтарной кислоты А, Б 103 (14 мм рт. ст.) 1,4201 90 [c.77]
Оксициклогексил-1-ацетилен Циклогексил-метилкетон Диметиловый эфир адипиновой кислоты Диэтиловый эфир янтарной кислоты Нитрил 2-этилкапроновой кислоты [c.194]
Напишите уравнения реакций получения а) диэтилового эфира щавелевой кислоты б) моноэтилового эфира адипиновой кислоты в) диметилового эфира янтарной кислоты. [c.54]
Выход диэтилового эфира ди ацетил янтарной кислоты—16,5 г (65% )т теоретического). [c.622]
Применяют для получения пропиловых эфиров одно- и двухосновных органических кислот и кортикостероидов. Особенно часто используют для этерификации молочной и янтарной кислот. Пропиловые эфиры этих кислот легко извлекаются хлороформом и диэтиловым эфиром (экстрагирование метиловых эфиров затруднено из-за значительной их растворимости в воде). Хроматографическое разрешение пропиловых эфиров лучше, чем бутиловых и TMS-эфиров. [c.362]
Акрилонитрил, диэтиловый эфир янтарной кислоты Диэтиловый эфир 1-(2-цианэтил)-янтар-ной кислоты К2СО3, катализатор добавляют в начале и после 5 ч кипячения, затем кипятят еще 18 [7131 [c.87]
Дипропиловый эфир щавелевой кислоты (дипропилоксалат) Диизопропиловый эфир щавелевой кислоты (диизопропилоксалат) Диэтиловый эфир янтарной кисло [c.647]
Диэтиловый эфир винной кислоты Этиловый эфир октановой кислоты Этиловый эфир декановой кислоты Этиловый эфир лауриновой кислоты Этиловый эфир тетрадекановой (ми-ристиновой) кислоты Диэтиловый эфир щавелевой кислоты Диэтиловый эфир янтарной кислоты Диэтиловый эфир малеиновой кислоты [c.85]
Напишите структурные формулы и назовите другими способами а) этиловый эфир метакриловой кислоты б) амид 2-метилпропионовой кислоты в) нитрил пропеновой кислоты г) метиловый эфир льхлор-бензойной кислоты д) оксалат кальция е) диэтиловый эфир малоновой кислоты ж) диметиловый эфир терефталевой кислоты з) ангидрид янтарной кислоты. [c.91]
Бензофенон конденсируется с карбанионами с трудом однако при реакции конденсации Штоббе с диэтиловым эфиром янтарной кислоты бензофенон конденсируется гладко и с высоким выходом. Легкость, с которой происходит эта реакция, заставляет предположить образование промежуточных соединений, например I, которые увеличивают реакционную способность. Поэтому диэтиловый эфир янтарной кислоты особенно легко конденсируется с карбонильными соединениями. Опубликован обзор [351, посвященный этой реакции. Ее применимость для синтетических целей определяется ценностью получаемого продукта декарбоксилирования, т. е. ненасыщенных кислот или лактонов [36] [c.327]
П) (92—94% из бензофенона, диэтилового эфира янтарной кислоты и трет-бутилата калия) [411. [c.327]
Диэтиловый эфир а,а -диметил-а-карбэтокси-янтарной кислоты Диэтиловый эфир а,7 -диметил-а-карбэтокси-янтарной кислоты (СНзОХ)а СНСН (СОХНз)а и (СНд02С) С=С (СОХНз)2 [c.244]
Циклогександион-1,4 (2,5-дикарбэтоксициклогександион-1,4) получают с выходами 64—68% при самоконденсации диэтилового эфира янтарной кислоты под действием этилата натрия этот эфир гидролизуют и декарбоксилируют при нагревании с водой в автоклаве при 195 °С в течение 15 мин выход циклогександиона-1,4 81—89% [53]. [c.147]
В добавление к данным, приведенным в табл. 1, интересно отметить, что этилацетат и диэтилоксалат не образуют комплексов. Среди эфиров нормальных двухосновных кислот диэтиловый эфир янтарной кислоты и высшие гомологи образуют комплексы. Как и следовало ожидать, небольшое разветвление низкомолекулярных соединений препятствует комплексообразованию. Так, диэтиловые эфиры 1-метилянтарной и 2-метилглута-ровой кислот, диизопропиловый эфир адипиновой кислоты и диметиловый эфир 2,2 -диметилпробковой кислоты не образуют комплексов. [c.206]
Различные доноры (применявшиеся в отдельных случаях) а-ацето-у-бу-тиролактон, этиловый эфир щавелевоуксусной кислоты и его а-метильное производное, этиловый эфир Р-метил- -нитромасляной кислоты, диэтиловый эфир янтарной кислоты, изофорон, 1-формил-2-кето-10-метил-Д -гексагидро-нафталин, а-нафтол (кетоформа), этиловый эфир 4-окси-2,3-бензофуран- [c.526]
Для солей и сложных эфиров сохраняются принятые ныне правила Иапример бутаноат натрия, или натриевая соль бутановой кислоты диэтил-1,2 этандикарбоксилат, или диэтиловый эфир янтарной кислоты. [c.295]
Диэтилацетосукцинат см. Диэтиловый эфир ацето-янтарной кислоты [c.209]
Хлористый кальций применяют для высушивания углеводородов, галоидопроизводыых углеводородов, простых эфиров и многих других органических соединений. Нельзя применять его для высушивания спиртов и аминов, с которыми он образует продукты присоединения. Продукты присоединения с хлористым кальцием способны давать также некоторые кетоны и сложные эфиры (например, ацетон, диэтиловый эфир янтарной кислоты). [c.27]
Высушивание с использоваинем реакции гидролиза. Приготовление безводного этилового спирта (99,9%) и.1 продаж-ного абсолютного спирта (99%) илн полученного обезвоживанием над окисью кальция (99,5%) оказывается возможным благодаря тому, что при гидролизе сложного эфира потребляется вода. Если обычный абсолютный спирт обработать небольшим количеством натрия в присутствий высококипящего сложного эфира (диэтилового эфира фталевой илн янтарной кислоты) н перегнать смесь па водяной бапе, то перегоняется абсолютно сухой этиловый спирт [c.44]
Эта реакция конденсации, которой посвящен обзор [24], обычно ограничивается образованием пяти- и шестичленных колец, но в некоторых случаях, при использовании метода сильного разбавления, может с успехом осуш,ествляться для колец большего размера [25].. Этиловый эфир янтарной кислоты, который можно было бы рассматривать как источник получения трехчленных колец, в условиях проведения реакции Дикмана сначала димеризуется, а затем циклизуется, образуя 2,5-дикарбэтоксициклогександион-1,4 (пример 6.1). Можно использовать также различные диэфиры, причем диэтиловые эфиры глутаровой и ш,авелевой кислот образуют 3,5-дикарбэтокси-циклопентандион-1,2 с выходом 65% [261. [c.325]
Опыт 31. Получение ангидрида янтарной кислоты
Реактивы и оборудование: янтарная кислота; фильтровальная бумага, пробирки.
В сухую пробирку помещают 0,5 г янтарной кислоты. Верхнюю часть пробирки обертывают влажной фильтровальной бумагой, а нижнюю осторожно нагревают на пламени горелки. Янтарная кислота сначала плавится, а затем происходит ее дегидратация. Пробирку не перегревать, т.к. получаемый ангидрид легко возгоняется и раздражает верхние дыхательные пути. Образующийся ангидрид янтарной кислоты осаждается на охлажденных стенках пробирки:
янтарная янтарный кислота ангидрид
Опыт 32. Образование фталевого ангидрида
Реактивы и оборудование: фталевая кислота; пробирки.
В сухую пробирку помещают 0,5 г фталевой кислоты и нагревают на небольшом пламени. При этом образуется фталевый ангидрид, который возгоняется и оседает на холодных стенках пробирки в виде белых кристаллов:
фталевая кислота фталевый ангидрид
По опытам 30.2, 31 и 32 сделайте вывод о различном отношении двухосновных кислот к нагреванию и объясните.
5.3. Сложные эфиры предельных одноосновных кислот Опыт 33. Получение этилацетата
Реактивы и оборудование: этиловый спирт, ледяная уксусная кислота, концентрированная серная кислота, насыщенный раствор хлорида натрия; водяная баня, термометр, лед, пробирки.
В сухую пробирку наливают 2 мл этилового спирта, 2 мл ледяной уксусной кислоты и 1 каплю концентрированной серной кислоты. Пробирку на водяной бане 5—10 мин при температуре около 70 °С.
Раствор охлаждают. Для выделения этилацетата к содержимому пробирки приливают 3—4 мл насыщенного раствора хлорида натрия. Этилацетат в процессе высаливания всплывает, образуя слой бесцветной жидкости с приятным запахом.
Рассмотрите механизм реакции этерификации. В чем заключается роль серной кислоты? Почему при добавлении избытка концентрированной серной кислоты сложный эфир карбоновой кислоты не образуется?
Опыт 34. Гидролиз этилацетата
Реактивы и оборудование: этилацетат, 20%-ный раствор серной кислоты, 30%-ный раствор гидроксида натрия; водяная баня, пробирки.
В две пробирки наливают по 2—3 мл этилацетата. В первую добавляют 1 мл 20%-ного раствора серной кислоты, во вторую — 1 мл 30%-ного раствора гидроксида натрия. Пробирки энергично перемешивают и нагревают на водяной бане (t = 70—75 °С) в течение 10 мин.
После окончания опыта сравнивают, насколько уменьшилось количество этилацетата в каждой пробирке, и делают вывод о скорости гидролиза сложного эфира в зависимости от рН среды.
Напишите уравнения и механизмы реакций гидролиза этилацетата в кислой и щелочной средах. Почему реакция щелочного гидролиза сложного эфира необратима, в отличие от кислотного гидролиза?
5.4. Жиры и масла Опыт 35. Определение непредельности растительного масла реакцией с бромом
Реактивы и оборудование: подсолнечное масло, раствор брома в CCl4; пробирки.
В пробирку вносят 0,5 мл растительного масла и 1—2 мл раствора брома в CCl4, который при встряхивании содержимого пробирки быстро обесцвечивается вследствие присоединения брома к остаткам непредельных жирных кислот:
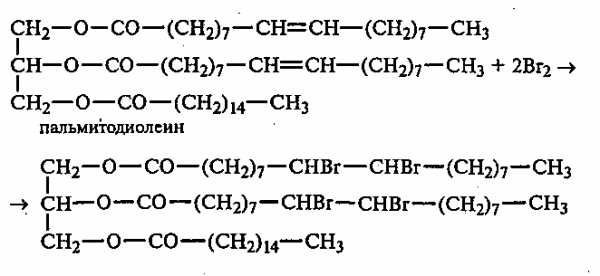
Напишите уравнение реакции присоединения брома к диолеолинолену.
studfiles.net
Янтарная кислота, амид - Справочник химика 21
Нагреванием аммонийной соли янтарной кислоты получают ее имид (сукцинимид). Механизм этой реакции такой же, как при получении амидов монокарбоновых кислот из их солей (см. разд. 6.1.3.1) [c.397]
Щавелевая кислота Янтарная кислота Янтарной кислоты амид [c.335]
Кроме того, используют описательные названия амидов амид уксусной кислоты СНз—СОЫНа, амид янтарной кислоты НаМОС—СН.,—СНз—СОЫН, и т. д. [c.23]В качестве деэмульгаторов были также предложены натровые соли сульфированных эфиров янтарной и фталевой кислот, амиды [c.88]
Напишите структурные формулы и назовите другими способами а) этиловый эфир метакриловой кислоты б) амид 2-метилпропионовой кислоты в) нитрил пропеновой кислоты г) метиловый эфир льхлор-бензойной кислоты д) оксалат кальция е) диэтиловый эфир малоновой кислоты ж) диметиловый эфир терефталевой кислоты з) ангидрид янтарной кислоты. [c.91]
СЛОЖНЫХ эфиров, солей, амидов и хлорангидридов, но примечательно то, что при нагревании до температуры кипения (235°С) янтарная кислота образует циклический ангидрид [c.189]
Как известно, в ряду карбоновых кислот муравьиная кислота занимает особое место. Ее амид цианэтилируется по аминогруппе а нитрил, т. е. цианистый водород, обладает подвижным атомом водорода и присоединяется к акрилонитрилу при высокой температуре над окисью кадмия 2 или при комнатной температуре в присутствии щелочных агентов с образованием динитрила янтарной кислоты 241 g качестве щелочных агентов применяют добавки цианистого калия, поташа или же ведут реакцию в пиридине [c.93]
Вицинальные динитрилы (1.55), производные как алифатических, так и ароматических и гетероциклических соединений, легко взаимодействуют с различными нуклеофильными, электрофильными, а иногда радикальными реагентами. Так, динитрил янтарной кислоты (1.55, Н-Н) циклизуется под действием кислот [129, 130], оснований (жидкого аммиака, аминов, амида натрия) [131], гидропероксидов [132] или восстановителей (литийалюминийгидрида) [133 в соответствующие [c.19]
Соли многовалентных металлов амидов замещенных янтарной кислоты ....... [c.328]
Окись этилена реагирует с имидами фталевой и янтарной кислот . Для осуществления реакции с амидами требуются повышенная температура и щелочной катализатор . [c.112]
Было установлено, что янтарная кислота составляет исключение и мешает определению янтарного ангидрида. Однако это влияние не является результатом нейтрализации анилина кислотой. В этом случае, чтобы довести реакцию с ангидридом до конца, необходимы столь жесткие условия, что высвобождающаяся при реакции кислота, а также присутствующая в пробе свободная кислота также реагирует с анилином, образуя амид. Реакция кислоты с анилином не слишком быстрая, но погрешность определения при этом значительна. При работе с чистым янтарным ангидридом получают результат, завышенный на 5%, а при взаимодействии чистой янтарной кислоты с анилином в тех же условиях, что и с ангидридом, наблюдается заметный расход анилина. [c.190]
В русской терминологии амид уксусной кислоты, амид янтарной кислоты, амид ма лспновой кислоты, амид яблочной кнсло1Ы, амид щавелевой кислоты, Название ацетамид танже общеупо1ребительно. — Прим. редактора,] [c.272]
Напишите структурные формулы щавелевой, малоновой, метилмалоновой и адипиновой кислот, ангидрида янтарной кислоты, амида адипиновой кислоты, калиевой соли кислого эфира янтарной кислоты. [c.80]
Моюще-диспергирующими присадками к маслам могут служить продукты взаимодействия трисгидроксиметиламинометана с амидо- или имидоэфирами, полученными из ангидрида алкенил-янтарной кислоты, и моно- и бисоксазолинов, получаемых из ал-килзамещенного ангидрида янтарной кислоты, с 2,2 -дизамещен-ным 2-амино-1-алканолом [англ. пат. 984409]. [c.85]
В качестве ингибиторов коррозии, вводимых в масла, получены и исследованы [241] литиевые, натриевые и кальциевые соли суль-фоалкенилянтарной кислоты. Механизм защитного действия этих соединений заключается в смачивании цветного металла, вытеснении агрессивного электролита и образовании адсорбционно-хемо-сорбционной -защитной пленки. Для повышения защитных свойств смазочного масла [австрал. пат. 87745/75] к нему добавляют сульфат иолиоксиалкилированного спирта или полиоксиалкилиро-ванного фенола молекулярной массы 500—5 000. В качестве ингибиторов коррозии к маслам предложены литиевые соли амидов алкенил- или алкилзамещенных янтарных кислот (С12 — С20). Амид получают взаимодействием кислот с аммиаком или алифатическим полиамином [англ. па-т. 1575467]. [c.187]
В качестве диспергаторов предлагается вводить в жидкое топливо производные янтарной кислоты, содержащие в молекуле атом азота, непосредственно связанный с полярной группой R O, R N (NH) или R OO, в частности амиды, имиды, сложные эфиры и соли аминов и органических кислот [англ. пат. 1310847]. [c.263]
Папуамид малеиновой кислоты р-Полуамид /-нблочн( й кислоты Этиловый эфнр оксамипопой кислоты Амид малеиновой кислоты Амид янтарной кислоты [c.273]
Р-Аланйн можно получить действием аммиака и на этиленциангидрин кроме того, его можно получить из амида янтарной кислоты действием гипсбромида натрия каталитическим восстановлением эфира или соли Циануксусной кислоты гидролизом р-аминопропионитрила и действием жидкого аммиака на метилакрилат . [c.588]
Образование неполных амидов по схеме (2) часто применяется для идентификации циклических ангидридов, так как соединения, образующиеся при применении в этой реакции ароматических аминов, обычно представляют кристаллические вещества. Кроме того,-полуанилиды производных янтарной кислоты превращаются при нагревании выше температуры плавления в кристаллические циклические полные анилиды . [c.302]
Замыкание цикла Ы-формильных производных, бензольное кольцо которых содержит алкоксильные группы, протекает нормально, и выходы замещенных изохинолинов удовлетворительные [9, 18]. Было осуществлено также двойное замыкание цикла арилэтиламидов неразветвленных двухосновных кислот [19,20]. Эта реакция протекает нормально для амидов двухосновных кислот, имеющих пять и более атомов углерода, но не имеет места в случае амидов щавелевой, малоновой и янтарной кислот [9,19,21]. Циклизация К-карбо-метоксигомопиперониламина приводит к образованию соответствующего диги-дроизокарбостирила [22]. [c.266]
Дикетогексагидропиридазины обнаруживают обычные свойства амидов карбоновых кислот. Циклический гидразид янтарной кислоты может быть потенциометрически оттитрован как одноосновная кислота [216], в то время как М-аминосукцинимид обладает основными свойствами. Для каждого из этих соединений получены диацетаты, обладающие различными температурами плавления. Гидрирование циклического гидразида в присутствии скелетного никеля приводит к образованию амида янтарной кислоты [216]. [c.111]
chem21.info
Янтарная кислота со спиртами - Справочник химика 21
Этилмеркаптан. . Этилмеркурфосфат Этилмеркурхлорид Этилнитрат. ... Этилнитрит. . . Этиловый спирт Этиловый эфир (ди этиловый, серный) Яблочная кислота Янтарная кислота Янтарная кислота, хлоримид. . . Янтарный ангидрид [c.144]
Об этом способе упоминается в гл. 5 (стр. 87). Реакцию обычно проводят в органических растворителях, например в этиловом спирте, чтобы помешать протеканию побочных процессов. В качестве хлористых алкилов можно использовать моно- и полихлориды например, дихлорэтан превращается в динитрил янтарной кислоты. В одном промышленном методе получения адипонитрила исходным продуктом служит 1,4-дихлорбутан. Если несколько изменить условия, нитрилы можно получать этим способом и из ненасыщенных моно- и дихлоридов. [c.380]Например, в системе нитрил янтарной кислоты—спирт—вода изотерма растворимости обращена выпуклостью не к стороне, отвечающей двойной системе НаО—СзН ОН (АВ на нашей диаграмме), а к вершине треугольника, отвечающей нитрату янтарной кислоты (точка С на нашей диаграмме). [c.303]
Гидролиз эфиров проводился водой, содержащей тяжелый кислород 0, отмеченный на схемах звездочкой. Если реакция протекает по первой схеме, то в результате должен получиться спирт, содержащий тяжелый кислород в случае протекания реакции по второй схеме образующийся спирт не будет содержать тяжелого кислорода. Для опыта был взят уксусноамиловый эфир. Реакция проводилась в присутствии щелочи. Отделенный от продуктов реакции спирт дал после гидрирования воду нормальной плотности. Таким образом, опыт показал, что реакция протекает по второй схеме. Аналогичные результаты были получены при гидролизе монометилового эфира янтарной кислоты. [c.370]
При гидрировании янтарной кислоты наряду с бутандиолом образуются побочные продукты — у бутиролактон, тетрагидрофуран, масляная кислота и бутиловый спирт. [c.38]
Важнейшими побочными продуктами спиртового брожения являются ацетальдегид, ацеталь, глицерин, янтарная кислота и так называемое сивушное масло, представляющее собой смесь бутиловых и амиловых спиртов и их высших гомологов. Янтарная кислота и спирты сивушного масла образуются не из сахара, а в результате особого процесса брожения аминокислот, которые получаются из белков питательного субстрата и дрожжевых клеток и количество которых непрерывно пополняется вследствие процессов белкового обмена у дрожжей. [c.124]
Перебродившую жидкость подвергают затем фракционной перегонке для возможно более тщательного отделения этилового спирта от остальных продуктов брожения и воды. Так как этиловый спирт и вода не слишком сильно отличаются по температурам кипения, то для получения фракции с высоким содержанием спирта необходимы перегонные аппараты с многократной конденсацией и испарением дистиллата. Путем применения ректификационных колонн и дефлегматоров, т. е. соединенных с перегонным кубом насадок, на охлаждаемых стенках которых происходит частичная конденсация паров, удается из перебродившей жидкости отогнать сырой спирт (сырец) более чем 90%-ной концентрации. Остающаяся в перегонном кубе жидкость, так называемая барда, содержит наряду с водой нелетучие вещества — золу, белки, жиры, глицерин, янтарную кислоту — и является превосходным кормом для скота. [c.125]
ЯНТАРНАЯ КИСЛОТА — представитель гомологического ряда двухосновных насыщенных кислот НООССНа —СНоСООН бесцветные кристаллы, т. нл. 183° С умеренно растворяется в воде, спирте, эфире. Незначительные количества Я- к. содержатся в буром угле, различных смолах, янтаре, во многих растениях. Я- к. стимулирует рост и [c.297]
Алкены превращают в сложные эфиры янтарной кислоты по реакции с моноксидом углерода, спиртом и хлоридом палладия в присутствии хлорида ртути (И) [868]. Присоединение идет главным образом как ww-процесс. По аналогичной реакции из алкинов как терминальных, так и внутренних получают сложные эфиры замещенной малеиновой кислоты. [c.276]
Постепенно накапливая знания в области химических и биохимических превращений органических веществ, человек научился проводить различные опыты с органическими веществами. Вначале это, как правило, был переход сложных веществ в более простые например, брожением сахара получали этиловый спирт и уксус, окислением ископаемой смолы — янтаря — янтарную кислоту. [c.268]
Встречаясь с бесконечным разнообразием природы, человеческий ум, первоначально, быть может, даже бессознательно, стремится прежде всего объединить сходные предметы или явления, облегчая себе таким образом их дальнейшее понимание. Поэтому первым этапом развития молодой науки является всегда накопление фактов и систематизация опытного материала. Пытаясь произвести такую систематизацию, химики древности и средних веков не делали различия между органическими и минеральными веществами. Свою классификацию они основывали на внешних признаках веществ. Например, солями именовались все бесцветные кристаллические вещества, растворимые в воде. Вместе с настоящими солями сюда попадали янтарная кислота, щавелевая кислота, винная кислота. Маслами считались все густые жидкости сюда причислялись и растительные масла (подсолнечное, хлопковое и др.), и масло винного камня (расплывшееся во влажном воздухе едкое кали), и купоросное масло — название, еще и сегодня употребляемое в технике для концентрированной серной кислоты. Спиртовыми веществами считались летучие жидкости винный спирт, хлорное олово, соляная и азотная кислоты, водный раствор аммиака. Для последнего еще и ныне употребительно название нашатырный спирт . [c.3]
Сукцинимид получают путем перегонки аммониевой СОЛИ янтарной кислоты после перекристаллизации из спирта т. пл. 123—125°. [c.811]
Монометиловый эфир янтарной кислоты (95—96% из янтарного ангидрида и метилового спирта) [77]. [c.292]
Кроме винного спирта, при спиртовом брожении образ тотся вешества, кипящие при более низкой (уксусный альдегид) и более высокой температуре, представляющие собой смесь высших гомологов спирта, называемую сивушными маслами . Одновременно образуются и небольшие количества глицерина и янтарной кислоты. [c.117]
Эфиры (I) малеиновой, фумаровой, янтарной кислот спирты С — Y-Бутиролактон Медно-цинковый (СиО 2пО = 5 1 — 1 3, вес.) 180—270° С, I Нз= 1 30 — 1 100 (мол.) [10] [c.955]
Выше при описании изомеров спиртов, оксикислот и оксиальдегидов было показано, как с помощью обозначений р—а сохранить наглядное представление о пространственном строении молекул. Эта система помогает и тогда, когда система ключей заходит в тупик. Так, написанная выше 2-амино-З-окси-янтарная кислота (IV) может быть названа 2а-амино-Зз-оксиянтарная кислота, или, по женевской номенклатуре, Зр-аминобутанол-2р-диовая-, 4 кислота. [c.386]
Разрыв связи С—С при окислении может происходить в любой точке молекулы, поэтому в оксидате содержатся продукты самого различного молекулярного веса. В оксидате были обнаружены и идентифицированы следующие летучие жирные кислоты муравьиная, уксусная, пропионовая, масляная,валерьяновая, капроновая и далее вплоть до 10 углеродных атомов в цепи. Водонерастворимые нелетучие кислоты представляют собой очень сложную жирных кислот, оксидат может содержать окси-кпслоты, лактоны, ангидриды, альдегидо-кислоты, кетоно-кислоты, альдегиды, спирты и простые эфиры [328—336]. Твердые кислоты более чем на 80% состоят из предельных соединений с молекулярным весом от 145 до 300 и на 50% — из соединений с числом углеродных атомов не выше 14 [339]. Сообщалось об идентификации миристиновой, пальмитиновой, стеариновой, арахиновой, лигно-цериновой и изоиальмитиновой кислот [340]. Образование двухосновных кислот незначительно, хотя янтарную кислоту удалось выделить из оксидата [341, 342]. Неокисленный остаток по впеш- [c.587]
Учреждение, ответственное за школьные экзамены в Англии, теперь рекомендовало использовать номенклатуру в той форме, как она описана в данной книге. Таким образом, выпускникам школ все в большей степени будут привычны названия этанол, а не этиловый спирт бутандиовая кислота, а не янтарная кислота. В 1979 г. ожидается новое издание этих правил. [c.74]
В качестве ингибиторов коррозии, вводимых в масла, получены и исследованы [241] литиевые, натриевые и кальциевые соли суль-фоалкенилянтарной кислоты. Механизм защитного действия этих соединений заключается в смачивании цветного металла, вытеснении агрессивного электролита и образовании адсорбционно-хемо-сорбционной -защитной пленки. Для повышения защитных свойств смазочного масла [австрал. пат. 87745/75] к нему добавляют сульфат иолиоксиалкилированного спирта или полиоксиалкилиро-ванного фенола молекулярной массы 500—5 000. В качестве ингибиторов коррозии к маслам предложены литиевые соли амидов алкенил- или алкилзамещенных янтарных кислот (С12 — С20). Амид получают взаимодействием кислот с аммиаком или алифатическим полиамином [англ. па-т. 1575467]. [c.187]
Реакция таурина с азотистой кислотой протекает нормально с выделением азота и образованием изэтионовой кислоты [158а]. Таурин реагирует с цианамидом, давая не растворимое в спирте вещество, напоминающее соединение, получаемое из глицина Ц736]. При взаимодействии с азидом холевой кислоты таурин превращается в природное соединение—таурохолевую кислоту [175]. Нагревание с фталевым ангидридом или янтарной кислотой ведет к образованию соответствующих имидов [176] [c.135]
В качестве антистатических присадок к реактивным топливам предложены самые различные зольные и беззольные соединения. Одна ко за рубежом широкое промышленное применение нашла присадка А5А-3 фирмы Шелл . Присадка состоит из смеси хромовых солей алкилсалициловых кислот, кальциевой соли сульфированного сложного эфира янтарной кислоты и октилового спирта. В качестве стабилизатора в присадку введен сополимер лаури-лового и стеаринового метакрилатов и метилвинилпиридина. Присадка А5А-3 хорошо растворима в топливах и пе ухудшает их эксплуатационные сворктва она полностью предотвращает взрывы и пожары, связанные с накоплением статического электричества, при введении в топливо в концентрации 0,000075%- [c.299]
М-(р- Оксиэти л) сукцинимид. В круглодонную колбу емкостью 500 мл помещают 118 г (1 моль) янтарной кислоты и постепенно прибавляют 61 г (1 моль) безводного 2-аминоэтилового спирта. Содержимое колбы нагревают в течение 60—90 мин. на воздушной бане при 160°. После прекращения выделения паров воды и охлаждения К-(р-оксиэтил)сукцин-имид застывает в светло-желтую кристаллическую массу. Н-(р-Оксиэтил)-сукцинимид перегоняют в вакууме и получают вещество с т. кип. 178° (5 мм). Перекристаллизовывают из бензола и получают белый кристаллический порошок с т. пл. 58° выход составляет 95% от теорет. [262]. [c.222]
Диазокетоны при нагревании выше 100 °С в присутствии оксида серебра претерпевают перегруппировку Вольфа, образуя малоустойчивые кетены, из которых действием воды, спирта или алкиламина получаются карбоновые кислоты (имеющие на один атом углерода больше, чем исходный хлорангндрид), сложные эфиры или /V-алкнламиды. Если же исходить из хлор-ангидридов двухосновных кислот, то таким способом можно удлинить углеродную цепь сразу на два атома углерода. Например, из ангидрида янтарной кислоты получается адипиновая кислота. [c.469]
Янтарная кислота. В автоклав емкостью 325 мл помещают 100 мл водного раствора натриевой соли малеиновой кислоты, которая была получена растворением 58 Р малеиновой кислоты в 100 мл раствора едкого натра, содержащего на 5 г болып щелочи, чем это нужно для нейтрализации. Прибавляют 5—8 а никеля Ренея [180], эатем подают водород до начального давления 170 urn it гидрируют при 100й С, поддерживая эту температуру до окончания гидрирования. Давление в процессе реакции начинает заметно падать. Примерно через 26 мин падение давления прекращаете, после чего отфильтровывают катализатор (осторожно, катализатор пирофореи ). Реакционную массу нейтрализуют м удаляют в вакууме воду. Янтарную кислоту экстрагируют абсолютным спиртом н отгоняют спирт в вакууме. Выход янтарной кислоты 57 s (98% от теоретического). После перекристаллизации из воды кислота плавится при 184—185° С, [c.47]
II. Жидкости, ограниченно взаимно растворимые. Двухкомпонентные системы ан.члин — вода, метиловый спирт — гексан и др. Трехкомпонептные системы вода—эфир — нитрил янтарной кислоты бензол — бромоформ — муравьиная кислота вода — ацетон — ксилол и др. Прп этом трехкомпоиентные системы могут образовать два или три равновесных жидких слоя. [c.99]
Напишите уравнения реакций взаимодействия в присутствии кислотного катализатора между а ) а-ок-симасляной кислотой и метиловым спиртом б) 7-оксива-лериановой кислотой и 2-пропанолом в) яблочной (окси-янтарной) кислотой и 2 молекулами этилового спирта [c.57]
Ярко выраженными смачивающими свойствами обладают сульфонаты диэфиров янтарной кислоты. В этом случае полярная группировка, обусловливающая растворимость соединения, расположена близко к центру цеги, как это видно нй примере типичного представителя этого класса — аэрозола ОТ (см. ниже). Синтез этих сое,динений состоит во взаимоде1 ствин соответствующего спирта с малеиновым ангидридом с последующим присоединением бисульфита натрия к образовавшемуся малеиновому эфиру. Ниже в качестве примера приведена схема полу- [c.612]
По Смигу [850J этот же спирт готовят пропусканием II 1 Б тщательно обезвоженный глицерин с добавкой 2% янтарной кислоты без подвода тепла в течение 8 ч. За счет экзотермнчности процесса температура массы возрастает до 60-70° С. [c.207]
Хлористый кальций применяют для высушивания углеводородов, галоидопроизводыых углеводородов, простых эфиров и многих других органических соединений. Нельзя применять его для высушивания спиртов и аминов, с которыми он образует продукты присоединения. Продукты присоединения с хлористым кальцием способны давать также некоторые кетоны и сложные эфиры (например, ацетон, диэтиловый эфир янтарной кислоты). [c.27]
Высушивание с использоваинем реакции гидролиза. Приготовление безводного этилового спирта (99,9%) и.1 продаж-ного абсолютного спирта (99%) илн полученного обезвоживанием над окисью кальция (99,5%) оказывается возможным благодаря тому, что при гидролизе сложного эфира потребляется вода. Если обычный абсолютный спирт обработать небольшим количеством натрия в присутствий высококипящего сложного эфира (диэтилового эфира фталевой илн янтарной кислоты) н перегнать смесь па водяной бапе, то перегоняется абсолютно сухой этиловый спирт [c.44]
В колбу Вюрца емкостью 250 мл помещают 18 г янтарной кислоты, 55 мл этилового спирта, 24 мл толуола и 0,3 мл концентрированной h3SO4 (рис. 7 в Приложении I). Реакционную смесь нагревают на глицериновой бане и отгоняют азеотропную смесь спирта, толуола и воды, выкипающую в пределах 74—80 °С. Отгон сушат над 25 г безводного К2СО3, приливают к реакционной смеси и снова перегоняют из колбы Вюрца, пока температура отходящих паров не достигнет 80 °С. Остаток перегоняют в вакууме водоструйного насоса (рис. 5 в Приложении 1). Выход 23 г (87% от теоретического) т. кип. 105°С при 15 мм рт.ст. 1,4200. [c.74]
Под действием фермента янтарная кислота дегидрируется до фумарово ), которая в результате присоединения по ее двойной связи молекулы воды превращается в яблочную кислоту. Подобно изолимонной кислоте, яблочную кислоту можно рассматривать как сложный спирт, который окисляется НАД , в данном случае в щавелевоуксусную кислоту. Если эта кислота соединится со второй молекулой ацетилкофермента А, весь цикл начнется снова. [c.190]
chem21.info
Опыт 31. Получение ангидрида янтарной кислоты
Реактивы и оборудование: янтарная кислота; фильтровальная бумага, пробирки.
В сухую пробирку помещают 0,5 г янтарной кислоты. Верхнюю часть пробирки обертывают влажной фильтровальной бумагой, а нижнюю осторожно нагревают на пламени горелки. Янтарная кислота сначала плавится, а затем происходит ее дегидратация. Пробирку не перегревать, т.к. получаемый ангидрид легко возгоняется и раздражает верхние дыхательные пути. Образующийся ангидрид янтарной кислоты осаждается на охлажденных стенках пробирки:
янтарная янтарный кислота ангидрид
Опыт 32. Образование фталевого ангидрида
Реактивы и оборудование: фталевая кислота; пробирки.
В сухую пробирку помещают 0,5 г фталевой кислоты и нагревают на небольшом пламени. При этом образуется фталевый ангидрид, который возгоняется и оседает на холодных стенках пробирки в виде белых кристаллов:
фталевая кислота фталевый ангидрид
По опытам 30.2, 31 и 32 сделайте вывод о различном отношении двухосновных кислот к нагреванию и объясните.
5.3. Сложные эфиры предельных одноосновных кислот Опыт 33. Получение этилацетата
Реактивы и оборудование: этиловый спирт, ледяная уксусная кислота, концентрированная серная кислота, насыщенный раствор хлорида натрия; водяная баня, термометр, лед, пробирки.
В сухую пробирку наливают 2 мл этилового спирта, 2 мл ледяной уксусной кислоты и 1 каплю концентрированной серной кислоты. Пробирку на водяной бане 5—10 мин при температуре около 70 °С.
Раствор охлаждают. Для выделения этилацетата к содержимому пробирки приливают 3—4 мл насыщенного раствора хлорида натрия. Этилацетат в процессе высаливания всплывает, образуя слой бесцветной жидкости с приятным запахом.
Рассмотрите механизм реакции этерификации. В чем заключается роль серной кислоты? Почему при добавлении избытка концентрированной серной кислоты сложный эфир карбоновой кислоты не образуется?
Опыт 34. Гидролиз этилацетата
Реактивы и оборудование: этилацетат, 20%-ный раствор серной кислоты, 30%-ный раствор гидроксида натрия; водяная баня, пробирки.
В две пробирки наливают по 2—3 мл этилацетата. В первую добавляют 1 мл 20%-ного раствора серной кислоты, во вторую — 1 мл 30%-ного раствора гидроксида натрия. Пробирки энергично перемешивают и нагревают на водяной бане (t = 70—75 °С) в течение 10 мин.
После окончания опыта сравнивают, насколько уменьшилось количество этилацетата в каждой пробирке, и делают вывод о скорости гидролиза сложного эфира в зависимости от рН среды.
Напишите уравнения и механизмы реакций гидролиза этилацетата в кислой и щелочной средах. Почему реакция щелочного гидролиза сложного эфира необратима, в отличие от кислотного гидролиза?
5.4. Жиры и масла Опыт 35. Определение непредельности растительного масла реакцией с бромом
Реактивы и оборудование: подсолнечное масло, раствор брома в CCl4; пробирки.
В пробирку вносят 0,5 мл растительного масла и 1—2 мл раствора брома в CCl4, который при встряхивании содержимого пробирки быстро обесцвечивается вследствие присоединения брома к остаткам непредельных жирных кислот:
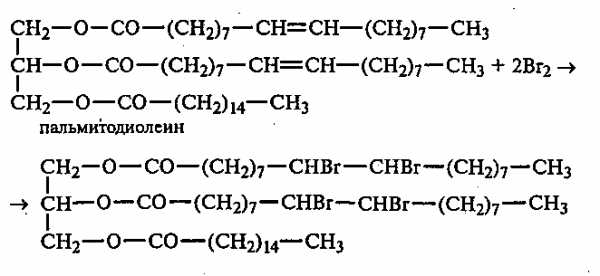
Напишите уравнение реакции присоединения брома к диолеолинолену.
studfiles.net