Содержание
Урок по теме «Сложные эфиры» | Химия
Автор: Берлизова Юлия Викторовна
Организация: МБОУ СШ 1
Населенный пункт: Ростовская область, г. Гуково
Тип урока: урок открытия новых знаний, обретения новых умений и навыков
Вид урока: урок формирования и совершенствования знаний
Цель урока: создать условия для формирования представления о сложных эфирах, как кислородсодержащих органических веществах, продолжить развитие навыков самостоятельного познания школьников.
Задачи:
образовательные:
- систематизировать знания о сложных эфирах, их строении, номенклатуре;
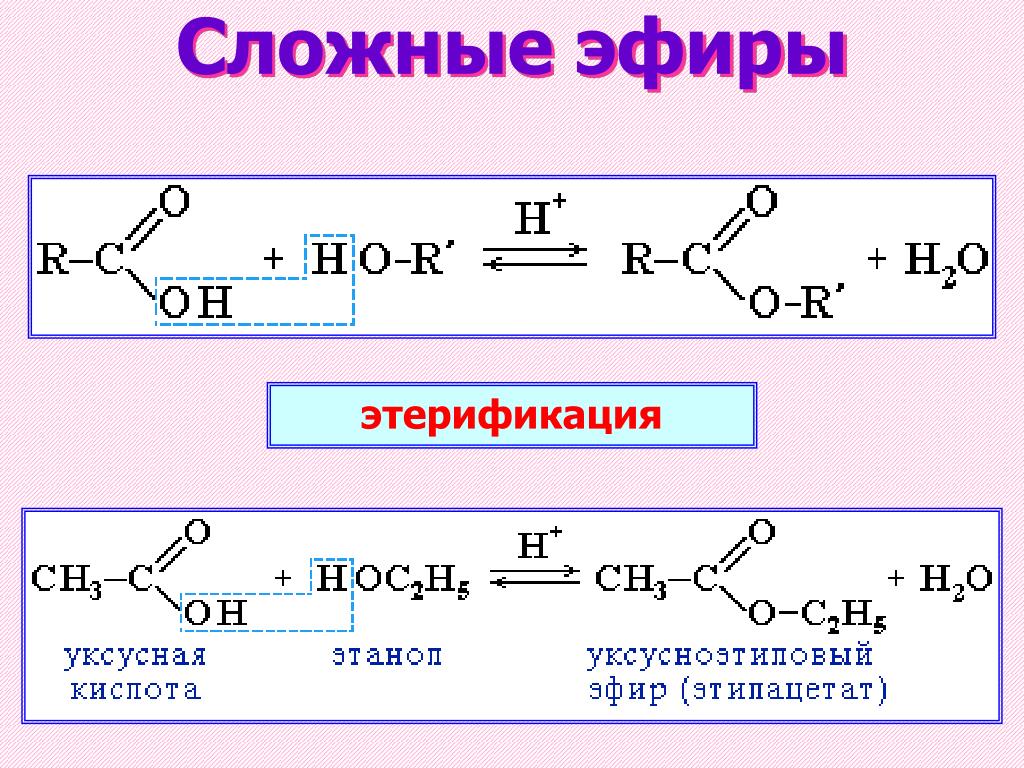
- рассмотреть особенности реакции этерификации, как одной из основных реакций получения эфиров;
- дать понятия о физических и химических свойствах сложных эфиров, нахождении в природе;
- продолжить формировать умения решать химические задачи с использованием знаний, полученных на уроке.

развивающие:
- развивать положительные мотивы учебно-познавательной деятельности, познавательный интерес к предмету, творческую инициативу и активность;
- продолжить формирование химической речи учащихся, творческого мышления;
- создать условия для развития логического мышления, памяти, внимания и познавательных умений;
- применять знания и собственный опыт в различных ситуациях, в том числе и проблемных: умение анализировать, делать вывод; умения работать самостоятельно и в группе.
воспитательные:
- содействовать формированию культуры умственного и практического труда, формированию самооценки учащихся, воспитанию у обучающихся организованности и самостоятельности в познании;
- создать условия для осознания учащимися практической и личностной значимости изучаемого материала;
- содействовать развитию у учащихся научного мировоззрения, правильного представления о роли естественных наук в современном обществе, целостной картины мира.

Основные понятия темы: сложные эфиры, реакция этерификации, гидролиз.
Межпредметные связи: биология, технология, информатика
Технологии: технология проблемного обучения, технология (в т.ч. элементы) развития критического мышления, ИКТ — технологии.
Методы и приемы организации обучения: объяснительно-иллюстративный, эвристический, проблемный, сообщение, самостоятельная работа, демонстрационный эксперимент, работа с текстом, ИКТ.
Форма организации познавательной деятельности: фронтальная, парная, групповая, индивидуальная.
Средства обучения: презентация к уроку «Сложные эфиры», проектор и компьютер, учебник Кузьменко Н.Е. Химия. 10 класс, ноутбук с виртуальной лабораторией, инструктивные карты, раздаточные материалы (образцы сложных эфиров: растворы фруктовых эссенций).
Планируемые результаты обучения
личностные
- формирование умения понимать значимость естественнонаучных знаний в практической жизни;
- умение управлять своей познавательной деятельностью; определять общие и индивидуальные правила поведения;
- формирование ответственного отношения к учению, готовности и способности обучающихся к саморазвитию и самообразованию на основе мотивации к обучению и познанию.

метапредметные
- использовать основные интеллектуальные операции: анализ и синтез, сравнение, обобщение, выявление причинно-следственных связей;
- формирование и развитие компетентности в области использования ИКТ- технологий;
- использование различных источников для получения химической информации
- осознанно и произвольно строить речевое высказывание в устной форме; аргументировано отвечать на вопросы, обосновывать свою точку зрения; вступать в учебное сотрудничество с учителем и одноклассниками, осуществлять совместную деятельность в парах, группах и др.
- умение соотносить свои действия с планируемыми результатами, осуществлять контроль своей деятельности в процессе достижения результата, определять способы действий в рамках предложенных условий и требований, корректировать свои действия в соответствии с изменяющейся ситуацией, оценивать результаты решения поставленных задач.
предметные
- умение давать определения изученных понятий: сложные эфиры, реакция этерификации, гидролиз;
- умение называть формулы сложных эфиров, составлять структурные формулы изомеров, составлять уравнения реакций этерификации и гидролиза;
- умение делать выводы и умозаключения из наблюдений, изученных химических закономерностей, прогнозировать свойства сложных эфиров
План урока
1. Организационный момент – 1 мин.
Организационный момент – 1 мин.
2.Актуализация знаний и умений, проверка домашнего задания – 5 мин.
3.Мотивация учебной деятельности учащихся. – 3 мин.
4. Постановка цели и задач урока — 2 мин.
5. Изучение нового материала – 15 мин.
6. Первичное закрепление изученного на уроке — 7 мин.
7. Контроль и самопроверка знаний — 5 мин.
8. Подведение итогов (Рефлексия) — 5 мин.
9. Домашнее задание – 2 мин
|
Этапы урока, время
|
Деятельность учителя
|
Деятельность учащихся
|
|
Организационный момент
0,5 мин
|
Приветствие. Проверка готовности учащихся к уроку.
Добрый день! У нас сегодня необычный урок химии тем, что на нем присутствуют гости.
|
Подготовка класса к работе, проверка рабочего места.
|
|
Мотивация учебной деятельности учащихся
0,5 мин
|
Создание проблемной ситуации:
У меня в руках сладкая газированная вода со вкусом и запахом груши. Как вы думаете, что за вещество придает сладкой газированной воде приятный аромат и вкус груши? (Ароматизатор груши) Какую формулу он имеет? Чтобы ответить на этот вопрос, выполним задание (задание на слайде и у каждого учащегося на столе)
|
Учащиеся делают предположения к какому классу веществ оно относится.
|
|
Актуализация знаний и умений, проверка домашнего задания
|
Учитель предлагает выполнить учащимся задание, которое находятся на слайде презентации (обсудить в парах)
|
Учащиеся выполняют упражнение, определяют название ароматизатора.
Вывод: ИЗОПЕНТИЛАЦЕТАТ.
|
|
Постановка цели и задач урока
1 мин
|
Сегодня нам предстоит выяснить:
Запишите тему урока: «Сложные эфиры»
(Озвучивает цели и задачи урока)
Каково строение молекул сложных эфиров?
Есть ли у них изомеры?
Как их называют?
Каковы их свойства?
Встречаются ли они в природе?
Можно ли их использовать?
|
Учащиеся записывают тему урока.
Ученики отмечают, что им известно о сложных эфирах и что они хотят еще узнать
|
|
Изучение нового материала.
15 мин
1 мин
5 мин
1 мин
3 мин
3 мин
|
Исходя из названия по междунородной номенклатуре определите из каких исходных веществ оно образовано?
Для получения этого вещества к доске пойдут учащиеся и выполнят это задание.
Вспомнить правила техники безопасности!
Остальные выполнят это задание в ноутбуке в виртуальной лаборатории.
1. К какому классу веществ принадлежит получившееся вещество?
2. Как называется взаимодействие кислот со спиртами?
3. Для чего в реакционную смесь, содержащую спирт и карбоновую кислоту, добавляют концентрированную серную кислоту?
Изложение с применением компьютерной презентации и наглядного материала.
1. Организует деятельность по написанию уравнений реакций этерификации:
вводит определение сложных эфиров, номенклатуру, изомерию сложных эфиров, определение реакции этерификации.
Мы подробно изучим сложные эфиры, являющиеся производными карбоновых кислот.
(Слайды)
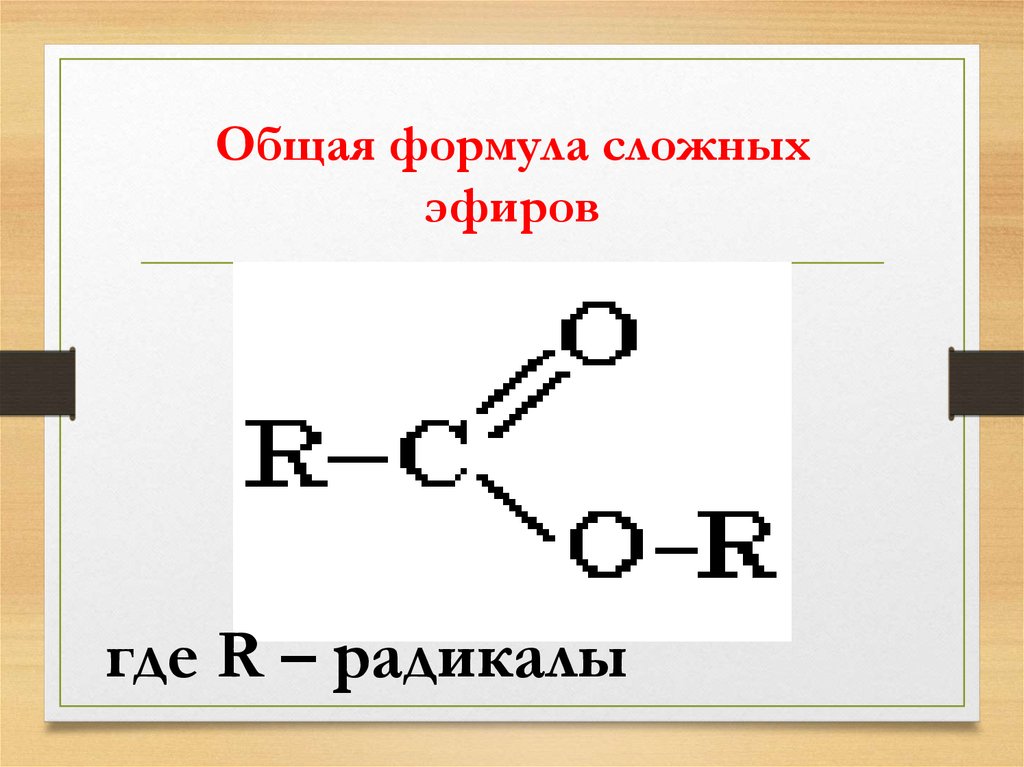
Задание Выведем общую формулу сложных эфиров, образованных остатками предельных карбоновой кислоты и спирта
Закрепление:
1. Какие виды изомерии характерны для сложных эфиров?
2. Как называется реакция получения сложных эфиров?
Самостоятельная работа по группам.
Задание по группам: Запишите уравнения реакций этерификации между следующими веществами:
1.
2. масляной кислотой и бутиловым спиртом (персик)
3. масляной кислотой и метиловым спиртом (яблоко)
4. муравьиной кислотой и амиловым спиртом (пентанолом) (вишня)
5. бензойной кислотой и этиловым спиртом (жасмин)
6. уксусной кислотой и изобутиловым спиртом (банан)
Номенклатура сложных эфиров.
Задание. Назовите получившиеся сложные эфиры разными способами (по международной и тривиальной номенклатуре).
Для того чтобы назвать сложный эфир нужно:
1. По названию спирта + тривиальное (историческое название кислоты) = метиловый эфир уксусной кислоты;
2. Название углеводородного радикала спирта + название аниона кислоты + окончание «ат” (все пишется слитно) = метилацетат;
3.
4. Название радикала по спирту + систематическое (название кислоты + окончание «оат” = метилэтаноат
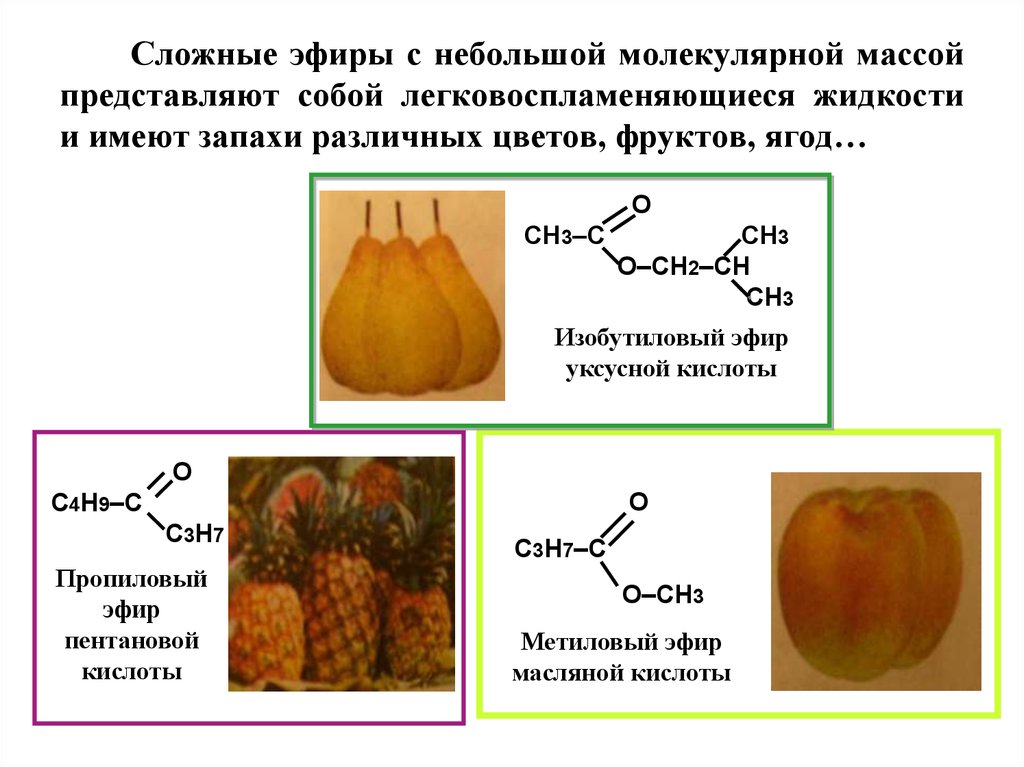
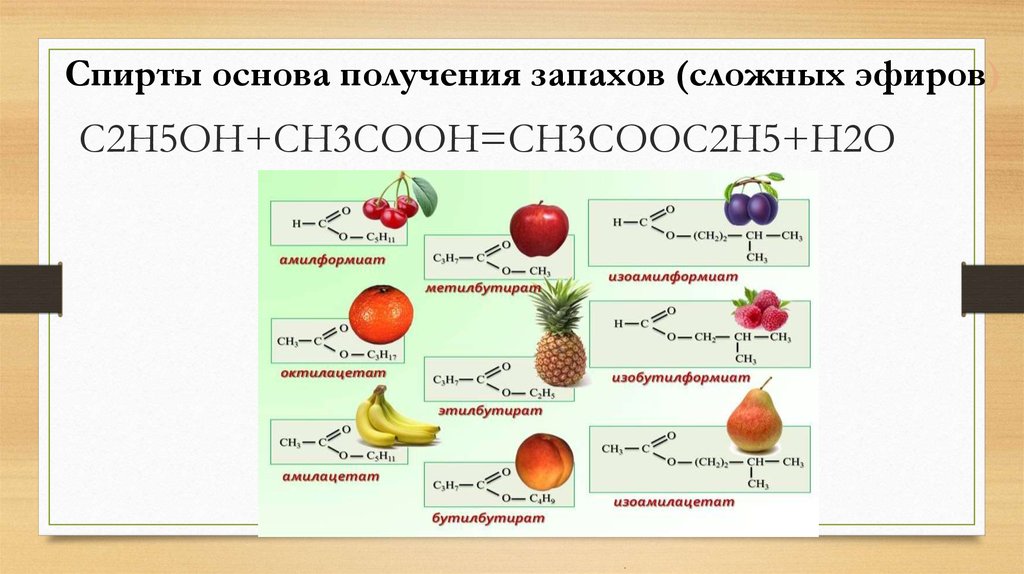
Нахождение в природе сложных эфиров (слайды) Посмотрите на экран и рассмотрите состав сложных эфиров, которые придают запах цветам. Демонстрируются слайды: запах жасмина — бензилпропаноат, хризантемы – сложный эфир фенилэтилового спирта и муравьиной кислоты. Как мы видим сложные эфиры, которые имеют цветочные запахи, это чаще всего производные ароматических кислот или ароматических спиртов. А вот сложные эфиры, которые входят в состав известных вам фруктов имеют довольно простой состав.
2.Организует деятельность по изучению физических, химических свойств и применению сложных эфиров.
Задание. Работа с учебником и инструктивными картами.
На основании строения сложных эфиров спрогнозируйте, какими химическими свойствами они обладают?
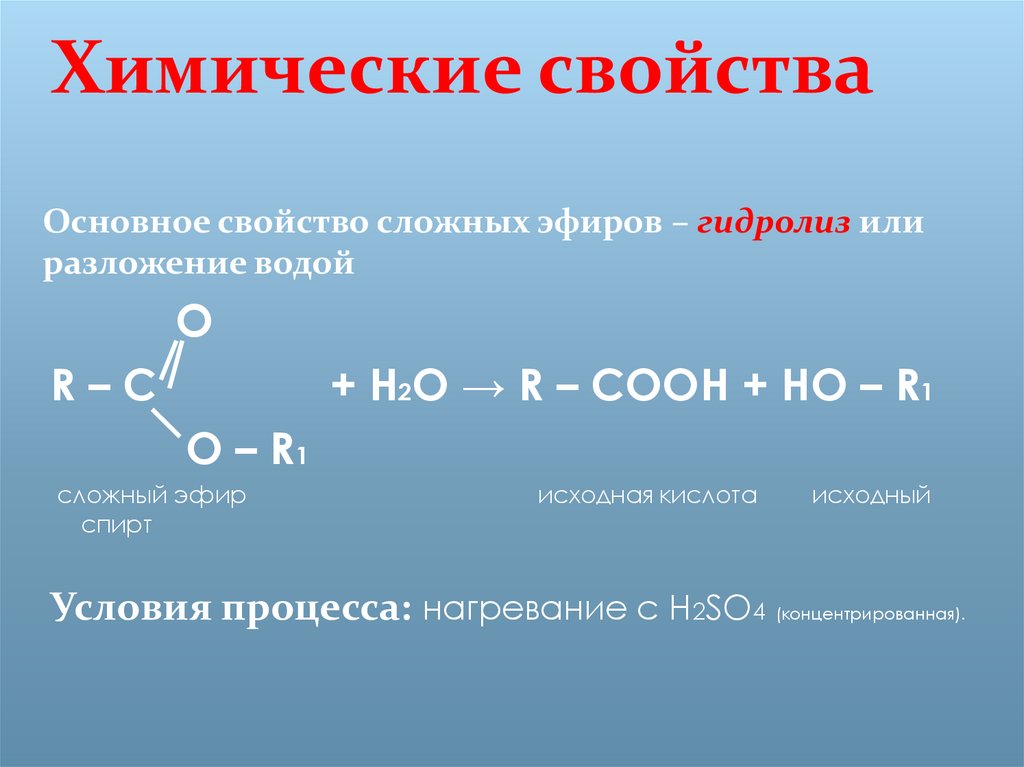
1. Реакция гидролиза или омыления.
При взаимодействии эфиров с водой образуются исходные вещества – кислота и спирт. Эта реакция обратна реакции этерификации. Реакция протекает
2. Горение эфиров
Демонстрационный опыт: Резко сожмем кусочек свежей апельсиновой корочки, и “выстрелим” капельки клеточного сока на огонь горелки – они ярко вспыхнут.
Задание: Напишите уравнение реакции горения октилацетата
|
Ученики: для того, чтобы получить изопентилацетат необходимо взять изопентиловый (изоамиловый) спирт и уксусную кислоту.
Бондаренко Арина поясняет свои действия: В пробирку налить 2 мл изоамилового (изопентилового) спирта, 2 мл уксусной кислоты и 0,5 мл концентрированной серной кислоты. Закрыть пробирку газоотводной трубкой и нагреть на водяной бане в течение нескольких минут. После охлаждения добавить в пробирку несколько миллилитров воды. При этом образуется слой изоамилового эфира уксусной кислоты (изоамилацетата) с характерным запахом грушевой эссенции.
Ознакомить остальных учащихся с запахом получившегося эфира
Плакунов: Образующееся вещество изопентиламин – сложный эфир.
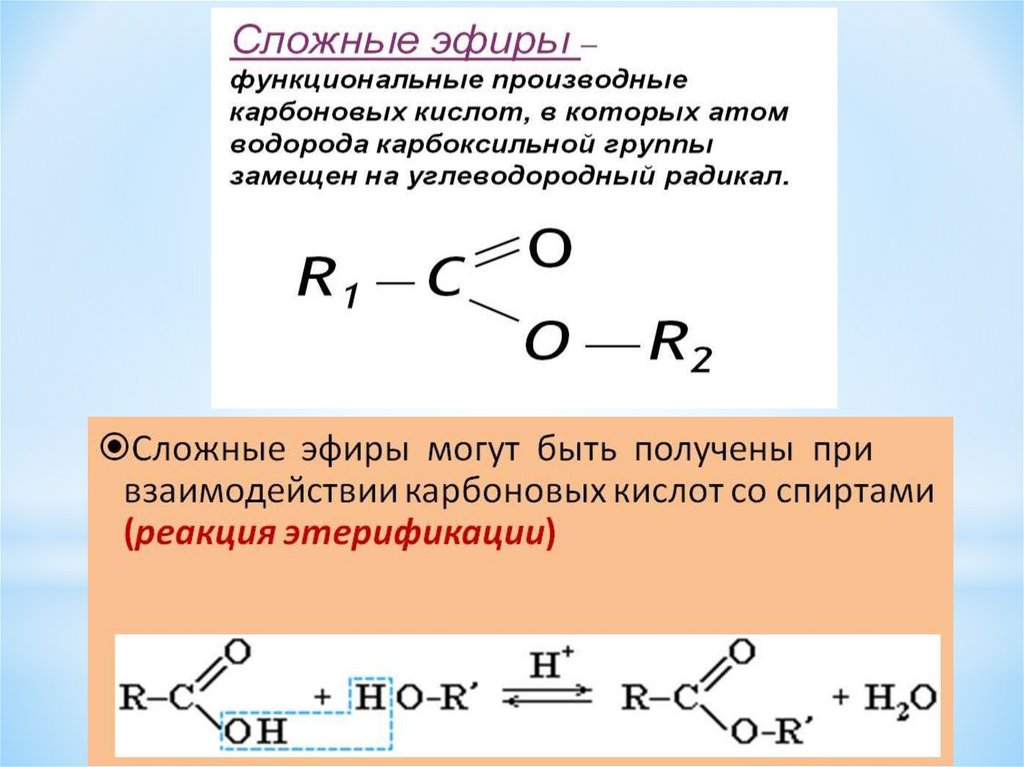
Взаимодействие карбоновых кислот со спиртами в присутствии концентрированной кислоты называется реакцией этерификации. Это обратимая реакция, поэтому в реакционную смесь добавляют концентрированную серную кислоту как водоотнимающее вещество
Записывает уравнение реакции изоамилового спирта с уксусной кислотой.
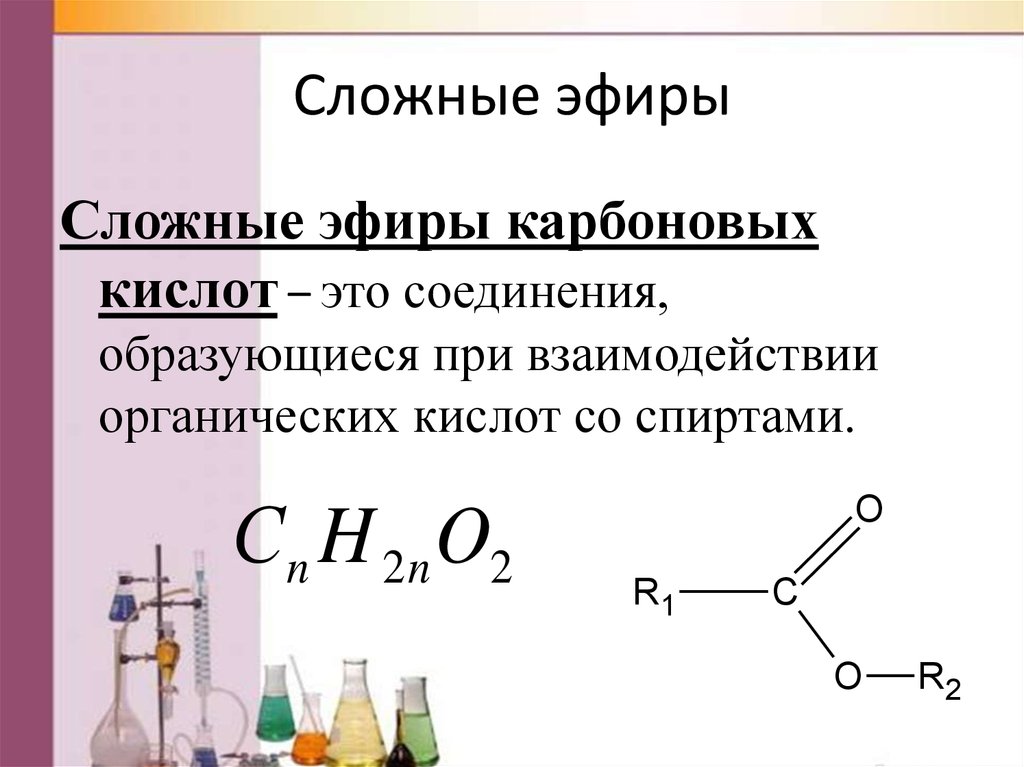
СnH2nO2
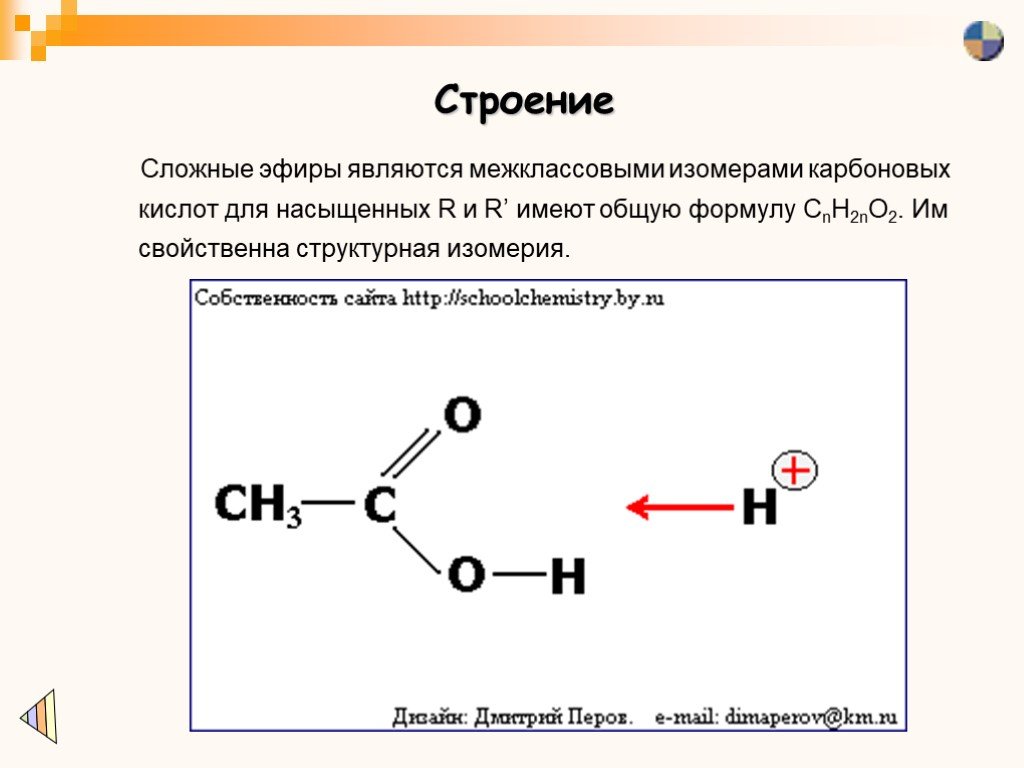
Углеродного скелета, положения функциональной группы, межклассовая с карбоновыми кислотами.
Этерификации
Учащиеся по группам обсуждают уравнение реакции получения сложных эфиров, затем один человек из группы записывает результаты на
Называют вещество
Упражнения для глаз.
На экран проектируются слайды: запах вишни — пентилформиат, абрикосов — этилбутаноат, яблок — метилбутаноат, апельсинов – пентилпентаноат, груш – изопентлацетат; и даются формулы эфиров, которые называют учащиеся.
Ученики сравнивают, обсуждают в парах
Ученики записывают уравнение гидролиза сравнивают, обсуждают
RCOOR* + HOH
RCOOH +R*OH
RCOOR*+NaOH->RCOONa+R*OH
Индивидуальная работа.
СН3-СОО-С8Н17 (апельсиновый запах)
С10Н20 О2+ 15O2 => 10CO2 + 10Н2О
|
|
Минутка релаксации
|
Области применение сложных эфиров
Опережающее задание
|
Ответы учеников
|
|
Первичное закрепление изученного на уроке
3 мин
|
Задание: Два изомерных органических вещества имеют состав C2h5O. Одно из них реагирует с раствором карбоната натрия с выделением углекислого газа, другое не взаимодействует с этим реагентом, но при нагревании с гидроксидом натрия образует спирт и соль.
|
Работа в парах, взаимопроверка
Запись уравнений на доске
|
|
Подведение итогов урока. Рефлексия
5 мин
|
Итак, давайте подведём итоги нашего урока, достигнуты ли наши цели урока, оценим результаты своей работы. Достигли ли мы поставленной цели?
Цели появляются на слайде презентации. Обсуждение, формулировка результатов урока:
Продолжите фразу « Сложные эфиры…»
|
Ученики подводят итоги
Изучили строение, номенклатуру сложных эфиров;
Научились записывать изомеры и определять тип изомерии;
Изучили свойства;
Определили практическое применение химических свойств эфиров
Сложные эфиры – класс соединений на основе минеральных (неорганических) или органических карбоновых кислот, у которых атом водорода в НО-группе замещен органической группой R.
|
|
Оценки
0,5 мин
|
3. Организует контроль и оценку заданий учеников.
|
Комментируют ответы
|
|
Домашнее задание
0,5 мин
|
Воспользуйтесь материалом § 21, а также, если это будет необходимо, дополнительной информацией из Интернета.
Творческое задание: подготовить сообщение «Сложные эфиры в медицине» (дополнительно — по желанию)
Урок окончен.
|
Учащиеся записывают домашнее задание.
|
Используемая литература.
- Учебник Н. Е. Кузьменко. Химия. Углубленный курс. 10 класс.)
- М.Ю. Горковенко. Поурочные разработки по химии. М.:Вако, 2006. 320с.
- http://www.zavuch.info/uploads/methodlib/2013/8/28/esters.jpg
- http://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/SLOZHNIE_EFIRI.html
- http://files.school-collection.edu.ru/dlrstore/a83f86a8-3fdd-b9f0-0e3d-d00691ad9401/1012089A.htm
- http://www.xumuk.ru/encyklopedia/2/5451.html
- http://school.xvatit.com/images/3/33/HimR10-90.jpg
- nsportal.ru›shkola…2013/03/19…teme—slozhnye—efiry
Полный текст статьи см. в приложении.
Приложения:
- file1.docx.
 . 83,5 КБ
. 83,5 КБ - file2.docx.. 48,6 КБ
- file0.ppt.zip.. 7,1 МБ
Опубликовано: 11.10.2021
Урок с применением ИКТ «Сложные эфиры». 10-й класс
Цели урока: Продолжить формирование системы
знаний о классах органических соединений.
Изучить строение, свойства, получение и
применение сложных эфиров.
Задачи урока:
1. Закрепить и углубить знания о сложных эфирах,
их номенклатуре.
2. Дать понятие о физических и химических
свойствах сложных эфиров, механизме реакции
этерификации.
3. Развить понятие о водородной связи, взаимном
влиянии атомов, воздействии этих явлений на
свойства вещества.
4. Способствовать развитию эрудиции, и
логического мышления учащихся.
Оборудование и реактивы: п\о «Уроки химии
Кирилла и Мефодия. 10 — 11 класс. Органическая
химия», компьютер, медиапроектор, интерактивная
доска, набор карбоновых кислот, набор предельных
одноатомных спиртов, концентрированная серная
кислота, пробирки, горелка, зажим для пробирок.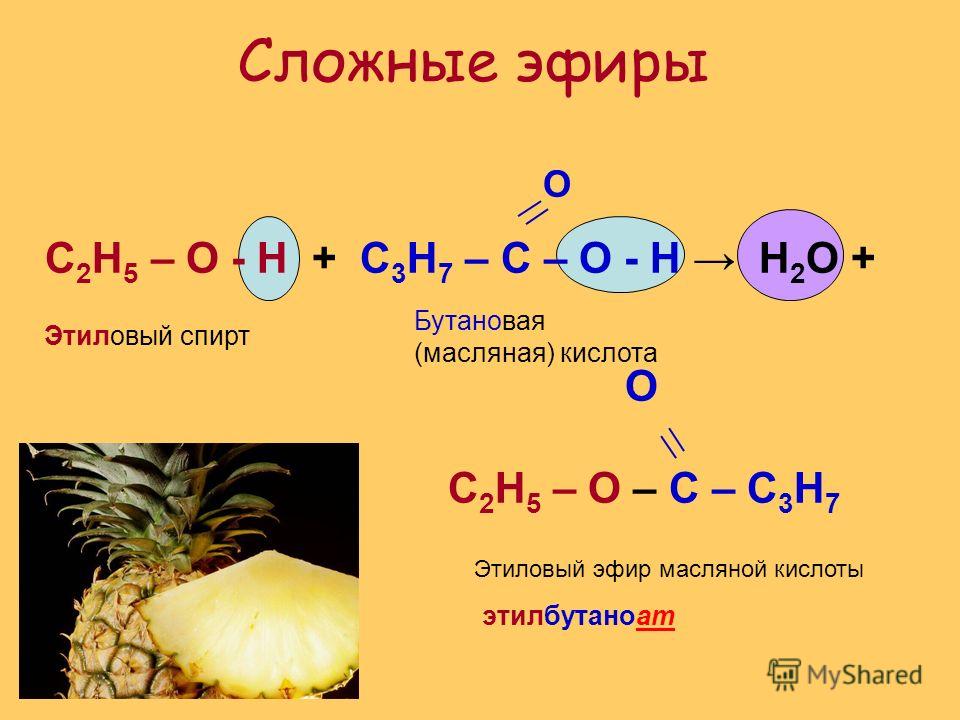
Ход урока
На кануне урока каждой группе учащихся был
роздан кроссворд на тему «Сложные эфиры».
(Опережающее обучение). В начале урока учитель
предлагает учащимся сдать кроссворды, чтобы
иметь возможность оценить фактически
выполненное домашнее задание, и в процессе
объяснения нового материала учащиеся не смогли
бы дописать недостающие слова.
На доске слова » Природа дала нам обоняние, и
чтобы раскрасить нашу жизнь создала сложные
эфиры».
Для работы класс делится на три группы. В ходе
урока учитель оценивает работу всех групп на
каждом этапе. Для этого на классной доске
записываются названия групп в зависимости от
цвета маркера, которым работает группа в течении
урока на интерактивной доске. При выполнении
каждого задания группе ставятся баллы. В конце
урока учитель суммирует результаты, и подводит
итог. Группа, набравшая больше всех баллов,
получает оценку отлично, остальные в зависимости
от числа набранных балов.
I. Мотивация к изучению темы.
На интерактивной доске презентация в программе
PowerPoint в которой с помощью ярких, красивых
картинок показано, где в жизни мы сталкиваемся со
сложными эфирами.
У -ль: В повседневной жизни мы сталкиваемся
с фруктами, цветами, косметикой, продуктами
питания которые имеют запахи. Во фруктах и цветах
эти ароматы природного происхождения, а в
некоторых продуктах питания, косметике они
созданы человеком. Но объединяет все эти запахи
класс сложных эфиров. Ребята, а вы замечали, что
продукты питания созданные человеком всегда
имеют более насыщенные запахи, чем продукты
природного происхождения? Как вы думаете, почему?
У -ся: Концентрация сложных эфиров в
продуктах созданных человеком выше, чем в
продуктах природного происхождения, видимо это
связано с тем, что сложные эфиры могут испаряться
в процессе приготовления.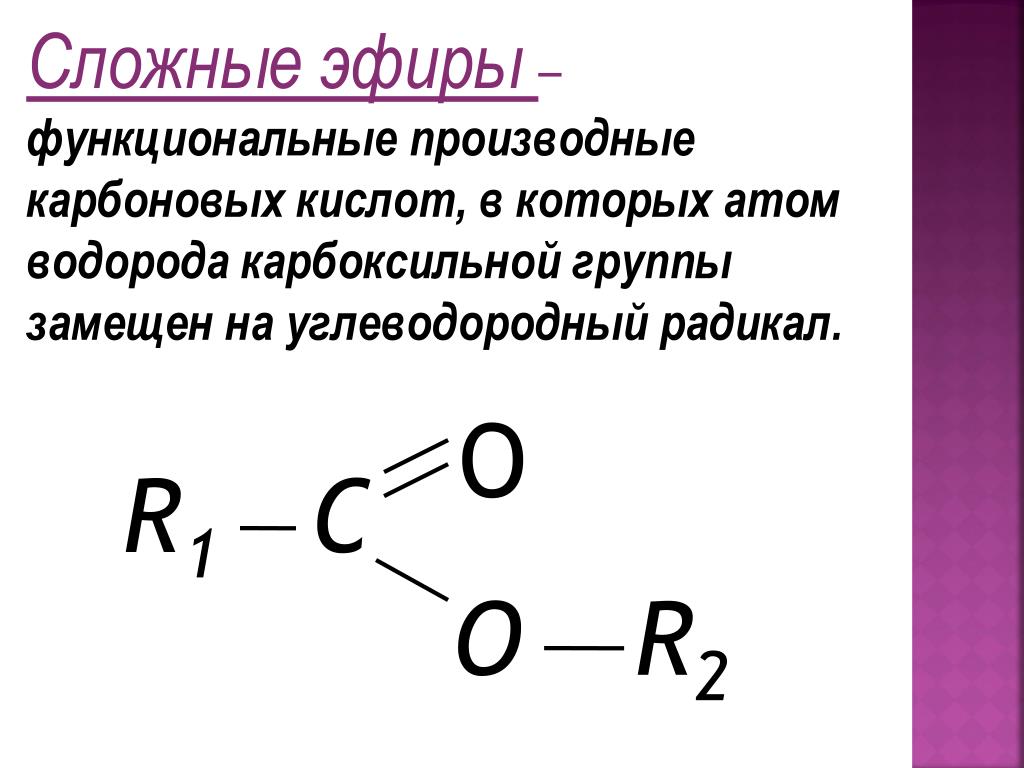
У — ль: Абсолютно верно.
У каждой группы на столе стоят по три чашки
Петри. В каждой чашке лежит раскрошенная
карамель «Чупа-чупс» разных вкусов. Учащимся
предлагается попробовать карамель из каждой
чашки, для того чтобы они почувствовали и
сравнили разные запахи.
У -ль: Карамель, которую вы попробовали,
содержит синтетические сложные эфиры. Это
небольшая часть обширной области применения
сложных эфиров. И сегодня на уроке мы с вами
познакомимся с этими веществами, их свойствами,
строением их молекул, способами получения и
номенклатурой. Частично в ходе изучения тем
«Спирты» и «Карбоновые кислоты» мы уже
встречались с этими веществами, сегодня разберем
их подробно. Запишите, пожалуйста, в тетради тему
урока.
У — ся: в тетради записывают тему урока
У — ль: (работа с программой «КиМ«)
Ребята, скажите, из каких веществ образуются
сложные эфиры.
У -ся: Из карбоновой кислоты и спирта.
У — ль: Предлагает задание для самоконтроля
№2. («Уроки химии КиМ» Урок №1)
У -ль: В переводе с латыни слово эфир звучит
как «Этер». Как бы вы назвали реакцию
образования сложных эфиров?
У -ся: Дают варианты ответов.
У — ль: Предлагает задание для самоконтроля №1
из программы «КиМ». (урок №1)
Предложите определение класса сложных
эфиров.
У — ся: Предлагают определение.
У — ль: Открывает чистый лист на
интерактивной доске, записывает формулу
сложного эфира и выделяет разными цветами
радикал кислоты и спирта и просит учащихся на
основании этой формулы вывести общую формулу
класса сложных эфиров.
В уроке №2 программы «КиМ» учитель
открывает определение класса сложных эфиров,
определение реакции этерификации и общую
формулу класса.
У-ся: Сравнивают определение класса
сложных эфиров, определение реакции
этерификации и их общую формулу, и записывают в
тетрадь.
II. Способы получения сложных эфиров.
Рассматриваются с помощью программы «КиМ», но
так как в данной программе не представлены все
способы получения изучаемых веществ, учитель на
интерактивной доске объясняет недостающие в
программе.
У-ль: Рассмотрим получение сложных эфиров.
(Медиалекция в уроке №3 программы «КиМ»). Как
уже было сказано раньше, сложные эфиры получают
из спирта и карбоновой кислоты. Действительно,
данную реакцию мы рассматривали при изучении тем
«Спирты» и «Карбоновые кислоты». Остается
добавить только, что в образовании сложных
эфиров могут участвовать не только органические,
но и неорганические кислоты. Запишите уравнения
реакций получения сложного эфира из карбоновой
кислоты и спирта и азотной кислоты и спирта.
У — ся: К интерактивно доске выходят двое
учащихся и записывают уравнения реакций. Дают
названия полученным веществам самостоятельно,
так как раньше при изучении карбоновых кислот
уже упоминалась номенклатура сложных эфиров.
Отмечают также что, реакции протекают в
присутствии концентрированной серной кислоты.
RCOOH + R1OH = RCOOR1 + H2O
HNO3 + ROH = RONO2 + H2O
У — ль: Напоминает, в данных реакциях
молекула воды образуется из гидроксогруппы
молекулы кислоты и атома водорода молекулы
спирта.
А теперь посмотрим, как достаточно просто в
лабораторных условиях самим получить сложные эфиры.
(Демонстрация реакции этерификации).
Учитель отмечает роль серной кислоты для
смещения равновесия в сторону образования
сложного эфира, как водоотнимающего средства.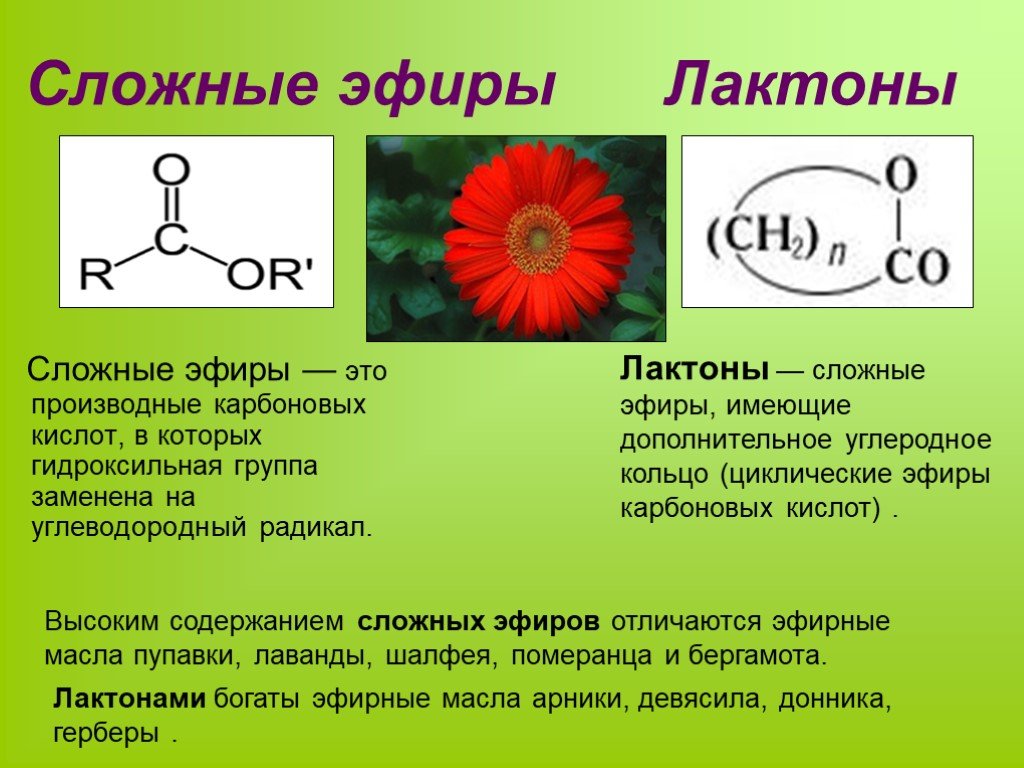
После этого учитель предлагает каждой группе
учащихся из имеющихся на их лотках реактивов
самим получить сложный эфир. После окончания
эксперимента группы обмениваются пробирками с
полученным эфиром, предварительно приложив к
пробирке сопроводительную записку, в которой
указано какие вещества использованы для
получения данного эфира, записано уравнение
реакции и каким запахом на их взгляд этот эфир
обладает. Полученные результаты всех трех групп
у каждого учащегося должны быть записаны в
тетрадь. После окончания эксперимента учащимся
предлагается решить задачу. Текст задачи
выводится на интерактивную доску.
Задача: В реакцию этерификации
вступило 1мл 70% — раствора уксусной кислоты (p = 1,07
г/мл) и 1мл 95% — ного этанола (p = 0,8 г/мл). Сколько
этилацетата (p = 0,9 г/мл) при этом получится, если
выход реакции этерификации составляет 80%?
Задачу решает на доске один из учащихся,
остальные в тетради.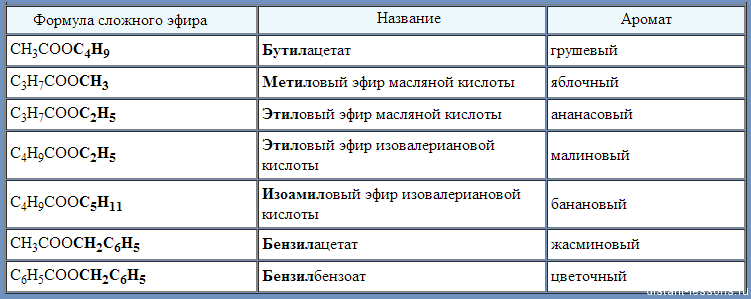
У -ль: Предлагает учащимся задание: В каком
из случаев выход эфира будет большим: при
взаимодействии карбоновых кислот а) с первичными
спиртами; б) вторичными; в) третичными.
У — ся: Предлагают аргументированные
варианты ответов. Учащиеся других групп вносят
поправки и коррективы. Совместно с учителем
приходят к правильному ответу и вывод записывают
в тетрадь.
При взаимодействии кислот с первичными
спиртами выход эфира больше, т.к. вторичные и
третичные спирты более устойчивы.
У -ль: Кроме рассмотренного нами способа
получения сложных эфиров существуют и другие.
1. Взаимодействие хлорангидридов со спиртами.
2. Взаимодействие ангидрида кислоты со спиртом.
4. Алкилирование солей карбоновых кислот
галогеналканами.
RCOONa +R1Br = RCOOR1 + NaBr
У — ся: Записывают способы получения в
тетрадь.
У — ль: На чистом листе интерактивной доски
рисует полную развернутую структурную формулу
сложного эфира. Предлагает учащимся рассмотреть
строение молекулы сложного эфира, взаимное
влияние атомов в молекуле, а так же смещение
электронной плотности и на основании этого
предположить свойства эфиров.
У — ся: Каждая группа работает над
предложенным заданием в течении 3-5 минут
самостоятельно. После этого представитель любой
группы выходит к интерактивной доске,
рассказывает, дорисовывает маркером своего
цвета все, что наработала группа. Представители
других групп дополняют, дорисовывают, или
исправляют маркерами другого цвета. Под
руководством учителя приходят к правильному
мнению и записывают выводы в тетрадь.
II. Химические свойства сложных эфиров.
(Программа «КиМ», урок № 5)
У — ль: А теперь рассмотрим химические
свойства сложных эфиров. Данные вещества
Данные вещества
вступают в реакции гидролиза, горения,
восстановления до спиртов, в реакцию аммонолиза.
Гидролиз может быть двух типов — кислотный и
щелочной. Щелочной гидролиз еще иначе называют
реакцией омыления.
Учитель показывает реакцию восстановления до
спиртов, и реакцию аммонолиза записывая их на
интерактивной доске с объяснением условий
протекания. (Данные реакции отсутствуют в п\о
«Уроки химии Кирилла и Мефодия»)
1. Действие аммиака на сложные эфиры(аммонолиз):
Ch4 — CO — OC2H5 + Nh4 -> Ch4 — CO — Nh3 + C2H5OH
2. Восстановление сложных эфиров до спиртов.
R — CO — OR’ <-> R — Ch3OH + R’OH
Реакции гидролиза учитель предлагает учащимся
рассмотреть самостоятельно. Для этого два
ученика выходят к доске и записывают
предложенные реакции.
У — ся: Самостоятельно рассматривают
гидролиз сложных эфиров в воде (кислотный
гидролиз) и в щелочной среде, т. к. данные реакции
к. данные реакции
можно записать самостоятельно применяя
логические рассуждения.
У — ль: Какая из двух реакций может быть
обратимой? Почему щелочной гидролиз (омыление)
необратим?
У -ся: При кислотном гидролизе
результатом реакции являются карбоновая кислота
и спирт, по этой причине гидролиз обратим. А при
щелочном гидролизе образуется соль и спирт,
которые не реагируют друг с другом, поэтому
реакция необратима.
У — ль: Показывает демонстрацию химических
свойств сложных эфиров в программе «КиМ».
III. Физические свойства сложных эфиров.
(Программа «КиМ», урок №5)
У -ль: Рассматривает с учащимися физические
свойства сложных эфиров в программе.
Говорит о том, что сложные эфиры — жидкости с
характерными запахами, легко кипящие, летучие,
плохо растворимые в воде.
IV. Изомерия и номеклатура сложных эфиров.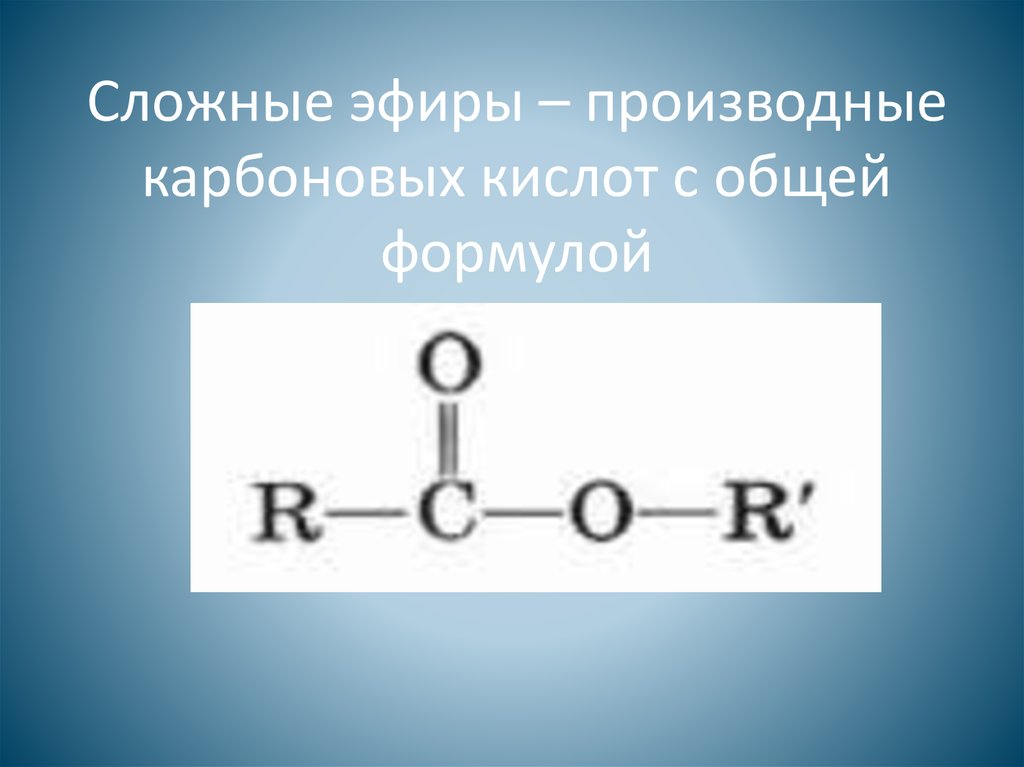
(Программа «КиМ», урок №4)
У — ль: Ребята, как вы думаете, какие виды
изомерии могут быть у сложных эфиров?
У — ся:
1. Изомерия углеродного скелета;
2. Положения функциональной группы.
3. Межклассовая изомерия с карбоновыми
кислотами.
У — ль: Абсолютно верно. Запишите виды
изомерии в тетрадь. А теперь вспомним еще раз
номенклатуру сложных эфиров. Систематическое
название эфирам дается по названию радикала и
кислотного остатка: алкилалканат. Применяют
рациональные и тривиальные названия.
Например: CH3COOCH3 — метилэтанат,
метилацетат, метиловый эфир уксусной кислоты,
уксуснометиловый эфир.
Предлагает дать название при помощи тренажера
в уроке №4, программы «КиМ». Затем
учащимся предлагается дать названия сложным
эфирам изображенным на этой же странице урока,
предварительно закрыв «режимом фонаря» на
интерактивной доске названия. После того как
После того как
учащиеся называют вещества, учитель открывает
названия, давая возможность учащимся проверить
себя.
V. Применение сложных эфиров. Программа
«КиМ», урок №6. Презентация в программе PowerPoin.
У — ль: Приводит названия сложных эфиров,
говорит, какой запах имеет каждый из них.
У — ся: Самостоятельно записывают формулы
эфиров, их названия в тетрадях и на доске.
У — ль: Перечисляет области применения
сложных эфиров (пищевая промышленность,
парфюмерная, легкая и химическая).
У — ся: Записывают в тетрадь применение
сложных эфиров.
VI. Домашний кроссворд выводится на
интерактивную доску.
У — ся каждой группы маркером своего цвета
заполняют клетки. Учащиеся других групп
проверяют правильность заполнения кроссворда,
вносят коррективы по мере необходимости.
У — ль: Оценивает баллами на классной доске
каждую группу по количеству слов правильно
отгаданных в кроссворде.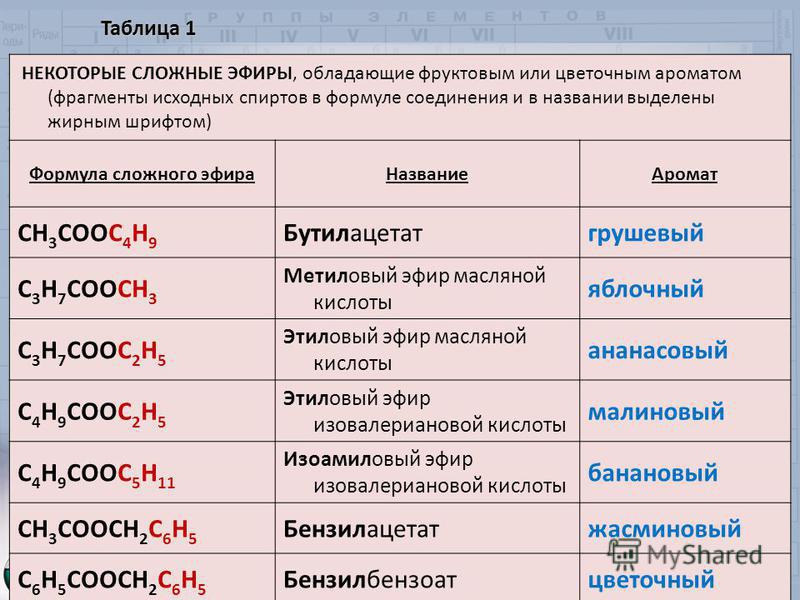
VII. Закрепление пройденного материала.
Тест выводится на интерактивную доску.
Метилацетат можно получить при взаимодействии
- Метанола с муравьиной кислотой;
- Этанола с муравьиной кислотой;
- Метанола с уксусной кислотой;
- Этанола с уксусной кислотой.
Уравнение реакции этерификации:
- C2H5OH + C2H5OH =
- C2H5OH = C2H4 + H2O
- CH3COOH + C2H5OH =
- C2H4 + H2O = C2H5OH
Чтобы сместить химическое равновесие реакции
CH3COOH + C2H5OH = CH3COOС2Н5
+ Н2О + Q в сторону исходных веществ
необходимо:
- Повысить температуру;
- Отделить сложный эфир;
- Добавить спирт;
- Применить катализатор;
При гидролизе метилового эфира пропионовой
кислоты образуются продукты:
- Метанол и муравьиная кислота;
- Метанол и пропионовая кислота;
- Этанол и муравьиная кислота;
- Этанол и пропионовая кислота.

Сложный эфир можно получить при
взаимодействии:
- C2H5OH с C2H5OH
- CH3COOH с Na2CO3
- CH2 = CH2 c HCl
- CH3COOH c C2H5OH
Если к CH3COOH прилить СН3ОН,
концентрированную серную кислоту и смесь
нагреть, то
- Образуется этилформиат
- Образуется этилацетат
- Образуется метилацетат
- Химическая реакция не протекает.
Тест учащиеся выполняют на листочках бумаги, и
сдают на проверку учителю. Учитель проверит
выполненную работы к следующему уроку и все
учащиеся получат оценки. После того как работы
сданы, учитель проверяет тест на доске вместе с
учащимися в целях корректировки знаний.
У — ль: А теперь ребята, давайте подведем
итог урока и сделаем выводы.
У — ся: Вместе с учителем формулируют
выводы урока.
У — ль: Открывает выводы в программе «КиМ».
У — ся: Сравнивают свои выводы с выводами,
которые приведены в программе и записывают их в
тетрадь.
VIII. Домашнее задание. Домашнее задание по
учебнику записано на доске. Учащимся
предлагаются также адресе сайтов в Интернете,
где можно посмотреть дополнительную информацию
по данной теме.
У — ль: Выставляет оценки за работу на уроке
всем трем группам учащихся и комментирует их.
Кроссворд.
По горизонтали:
3. Реакция взаимодействия карбоновых кислот со
спиртами, которая приводит к образованию сложных
эфиров.
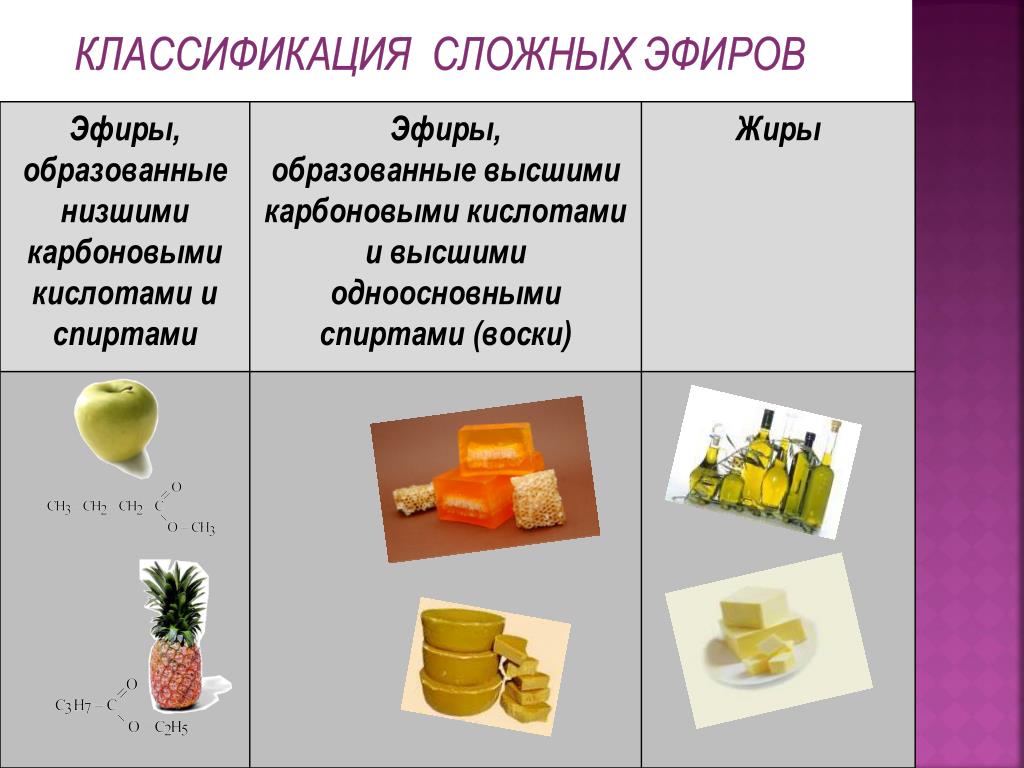
4. Сложные эфиры высших карбоновых кислот и
высших одноосновных спиртов.
8. Название кислоты С17Н33СООН.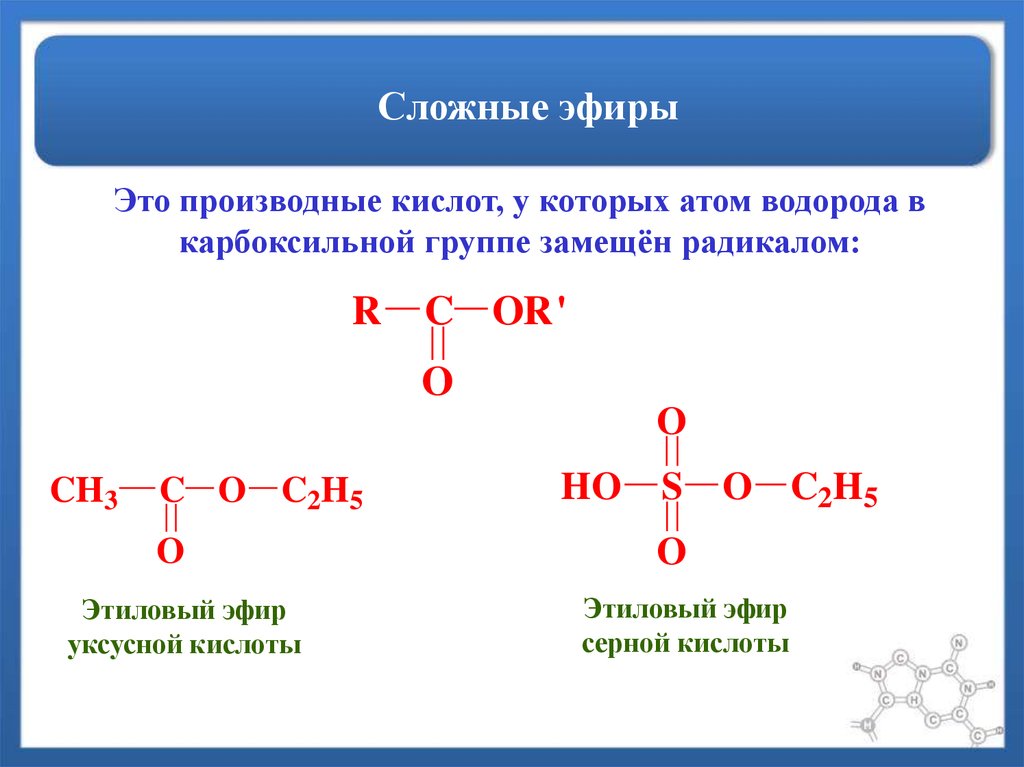
10. Кашалотовый воск.
11. Органические вещества, сложные эфиры
глицерина и высших карбоновых кислот.
12. Название кислоты С15Н31СООН.
По вертикали:
1. Соль стеариновой кислоты.
2. Реакция сложных эфиров с водой, обратная
реакции этерификации.
5. Гидролиз эфиров в щелочной среде.
6. Продукт взаимодействия С3Н7СООН и
С2Н5ОН в присутствии серной кислоты.
7. Твердый жир, продукт гидрирования
растительных масел.
9. Число атомов углерода в молекуле метилового
эфира масляной кислоты.
Термодинамические свойства органических соединений и смесей · Плотность сложных и простых эфиров
Landolt-Börnstein — Группа IV Физическая химия
Том 8П 2001
Редакторы:
К. Р. Холл, К. Н. Марш
ISBN:
978-3-540-41035-5 (печать)
978-3-540-45305-5 (онлайн)
DOI:
10. 1007/b76770
1007/b76770
Онлайн-документ 1
Название, Авторы, Предисловие
Онлайн-документ 2
Плотность сложных и простых эфиров · 1 Введение
М. Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Онлайн-документ 3
2 насыщенных моноэфира, C2-C5
М. Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Онлайн-документ 4
2 насыщенных моноэфира, C6
М. Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Онлайн-документ 5
2 насыщенных моноэфира, C7
М.
 Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Френкель, X. Хонг, Р. К. Уилхойт, К. Р. ХоллОнлайн-документ 6
2 насыщенных моноэфира, C8
М. Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Онлайн-документ 7
2 насыщенных моноэфира, C9
М. Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Онлайн-документ 8
2 насыщенных моноэфира, C10
М. Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Онлайн-документ 9
2 насыщенных моноэфира, C11-C12
М. Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Онлайн-документ 10
2 насыщенных моноэфира, C13-C15
М.
 Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Френкель, X. Хонг, Р. К. Уилхойт, К. Р. ХоллОнлайн-документ 11
2 насыщенных моноэфира, C16-C18
М. Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Онлайн-документ 12
2 насыщенных моноэфира, C19-C28
М. Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Онлайн-документ 13
2 ненасыщенных моноэфира
М. Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Онлайн-документ 14
Плотности сложных и простых эфиров · 2 диэфира
М. Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Онлайн-документ 15
3 насыщенных моноэфира, C2-C6
М.
 Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Френкель, X. Хонг, Р. К. Уилхойт, К. Р. ХоллОнлайн-документ 16
3 насыщенных моноэфира, C7-C9
М. Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Онлайн-документ 17
3 насыщенных моноэфира, C10-C12
М. Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Онлайн-документ 18
3 насыщенных моноэфира, C13-C22
М. Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Онлайн-документ 19
3 ненасыщенных моноэфира
М. Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Онлайн-документ 20
3 диэфира и триэфира
М.
 Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Френкель, X. Хонг, Р. К. Уилхойт, К. Р. ХоллОнлайн-документ 21
Ссылки на 2 и 3
М. Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Получение сложных эфиров из спиртов и кислот | Эксперимент
- Пять из пяти
На этом практическом занятии учащиеся изучают образование сложных эфиров благодаря способности различных спиртов реагировать с органическими кислотами. Вместе класс может быстро произвести ряд сложных эфиров в пробирке с различными интересными запахами, чтобы попробовать и сравнить ряда спиртов, реагирующих с рядом органических кислот. Рабочие группы могли сравнить свои результаты с другими, чтобы составить общее представление об этом пути образования сложных эфиров с различными запахами.
В зависимости от фактической организации урока он может длиться от 15 минут до часа.
Оборудование
Аппаратура
- Защита глаз
- Стеклянные пробирки для образцов x4 (примечание 3)
- Пластиковые пипетки-капельницы, доступ к соответствующему запасу
- Стакан, 100 см 3 или 250 см 3 (примечание 3)
- Пробирки x4
- Штатив для пробирок
- Горелка Бунзена
- Термостойкий мат
- Штатив
- Марля
- Щипцы для тигля
Химикаты
- Ледяная (концентрированная) этановая кислота (КОРРОЗИОННОЕ), около 2 см 3
- Пропановая кислота (КОРРОЗИОННОЕ), около 2 см 3
- Бензойная кислота (ВРЕДНАЯ), около 0,2 г
- Концентрированная серная кислота (КОРРОЗИОННОЕ ВЕЩЕСТВО), 5–10 капель (примечание 7)
- Доступ к следующим спиртам (требуется около 10 капель каждого) (примечание 8):
- Метанол (ЛЕГКО ВОСПЛАМЕНЯЕМЫЙ, ТОКСИЧНЫЙ)
- Этанол (ЛЕГКО ВОСПЛАМЕНЯЕМЫЙ, ВРЕДНЫЙ при использовании промышленного денатурированного спирта, IDA)
- Пропан-1-ол (ЛЕГКО ОГНЕОПАСНЫЙ, РАЗДРАЖАЮЩИЙ)
- Бутан-1-ол (ВРЕДНЫЙ)
- Один или несколько других спиртов, имеющихся в наличии, из следующих (около 10 капель каждого используемого спирта) (примечание 8):
- Бутан-2-ол (РАЗДРАЖАЮЩЕЕ СРЕДСТВО)
- Пропан-2-ол (ЛЕГКО ОГНЕОПАСНЫЙ, РАЗДРАЖАЮЩИЙ)
- 2-Метилпропан-1-ол (РАЗДРАЖАЮЩЕЕ СРЕДСТВО)
- Раствор карбоната натрия, 0,5 М, около 10 см 3 на сложный эфир
Примечания по охране труда и технике безопасности
- Прочтите наше стандартное руководство по охране труда и технике безопасности.

- Всегда носите очки.
- Основные требования к этим пробиркам: нейтральное боросиликатное стекло, широкое плоское основание, чтобы они были стабильными, когда стояли в стакане. Если их нет в наличии, вместо них можно использовать маленькие пробирки, стоящие в большей (250 см 3 ) стакан.
- Ледниковая (концентрированная) этановая кислота, CH 3 COOH(l), (КОРРОЗИОННОЕ) – см. карточку опасности CLEAPSS HC038a.
- Пропановая кислота, CH 3 CH 2 COOH(ж) (КОРРОЗИОННОЕ) – см. карточку опасности CLEAPSS HC038b.
- Бензойная кислота, C 6 H 5 COOH(s) (ВРЕДНЫЕ) – см. карточку опасности CLEAPSS HC013A.
- Концентрированная серная кислота, H 2 SO 4 (л), (КОРРОЗИОННОЕ ВЕЩЕСТВО) – см. карточку опасности CLEAPSS HC098а. Для младших школьников подготовьте пробирки с образцами, добавив в каждую по одной капле концентрированной серной кислоты. Это сводит к минимуму риски, связанные с такими учащимися, имеющими дело с этим веществом.
 Продвинутые учащиеся могут быть достаточно надежными, чтобы подготовить свои собственные пробирки таким образом.
Продвинутые учащиеся могут быть достаточно надежными, чтобы подготовить свои собственные пробирки таким образом. - Спирты (и органические кислоты) лучше всего предоставлять в виде центрального источника, вдали от пламени, с запасом пластиковых пипеток для каждого (или в маленьких флаконах-капельницах).
- Метанол, CH 3 OH(l), (ЛЕГКО ВОСПЛАМЕНЯЕМЫЙ, ТОКСИЧНЫЙ) – см. карточку опасности CLEAPSS HC040b.
- Этанол, CH 3 CH 2 OH(l), (ЛЕГКО ВОСПЛАМЕНЯЕМЫЙ и ВРЕДНЫЙ при использовании IDA) – см. карточку опасности CLEAPSS HC040A.
- Пропан-1-ол, CH 3 CH 2 CH 2 OH(l), (ЛЕГКО ВОСПЛАМЕНЯЕМОЕ, РАЗДРАЖАЮЩЕЕ) – см. карточку опасности CLEAPSS HC084A.
- Бутанол-1, CH 3 CH 2 CH 2 CH 2 OH(l) (ВРЕДЕН) – см. CLEAPSS Hazcard HC084B.
- Пропан-2-ол, CH 3 CH(OH)CH 3 (л), (ЛЕГКО ВОСПЛАМЕНЯЕМОЕ, РАЗДРАЖАЮЩЕЕ) – см.
 карточку опасности CLEAPSS HC084A.
карточку опасности CLEAPSS HC084A. - Бутан-2-ол, CH 3 CH(OH)CH 2 CH 3 (l), (РАЗДРАЖАЮЩЕЕ СРЕДСТВО) – см. карточку опасности CLEAPSS HC084B.
- 2-Метилпропан-1-ол, CH 3 CH(CH 3 )CH 2 OH(l), (РАЗДРАЖАЮЩЕЕ СРЕДСТВО) – см. карточку опасности CLEAPSS HC084A.
- Раствор карбоната натрия, Na 2 CO 3 (водн.) – см. CLEAPSS Hazcard HC095A и книгу рецептов CLEAPSS RB080.
Процедура
- Добавьте 10 капель этановой кислоты (или пропановой кислоты) к серной кислоте в пробирке для образца.
- Добавьте к смеси 10 капель этанола (или другого спирта).
- Налейте около 10 см 3 воды в стакан объемом 100 см 3 . Осторожно опустите пробирку в стакан так, чтобы она стояла вертикально.
- Осторожно нагрейте химический стакан на штативе и марле, пока вода не закипит, затем прекратите нагревание.

- Постоять 1 минуту в горячей воде. Если смесь в трубке закипит, щипцами вытащите ее из воды до прекращения кипения, а затем верните в горячую воду.
- Через 1 минуту с помощью щипцов осторожно извлеките трубку и дайте ей остыть на термостойком коврике.
- Когда смесь остынет, перелейте ее в пробирку, наполовину заполненную 0,5 М раствором карбоната натрия. Будет некоторое шипение. Хорошо перемешайте, вылив обратно в пробирку с образцом – при необходимости повторите. Слой сложного эфира отделится и будет плавать поверх водного слоя.
- Понюхайте продукт, осторожно направляя запах рукой к носу – не подносите нос к верхней части тюбика!
- Повторите эту процедуру для трех других эфиров.
- Сравните запахи различных эфиров, приготовленных вашей группой и другими группами. Напишите словесные уравнения для каждой реакции и (для продвинутых учащихся) химические уравнения, используя структурные формулы.
- Для твердых кислот необходимо изменить процедуры этапов 1 и 2:
- Добавьте 1 см 3 метанола (или другого спирта) к серной кислоте в пробирке для образца.

- Взвесьте 0,2 г бензойной кислоты (или другой твердой кислоты, такой как салициловая (2-гидроксибензойная) кислота (ВРЕДНА – см. CLEAPSS Hazcard HC052) и добавьте ее в пробирку. Затем действуйте, как указано выше. Выход твердых кислот не такой отлично, но запахи различимы и различимы.
- Добавьте 1 см 3 метанола (или другого спирта) к серной кислоте в пробирке для образца.
№
№
Учебные заметки
Этот метод представляет собой обновленную версию традиционного подхода к приготовлению сложных эфиров на основе пробирок, который сводит к минимуму риски, связанные с работой с соответствующими реагентами. Для получения дополнительной информации об этом методе получения сложных эфиров см. информационный бюллетень CLEAPSS PS67-07 «Получение сложных эфиров».
Этот метод подходит только для подготовки небольших образцов для характеристики по запаху. Продвинутые учащиеся могут увеличить количество, используя пробирки большего размера, но это все равно не даст достаточного количества продукта для выделения, характеристики по температуре кипения или расчета процентного выхода.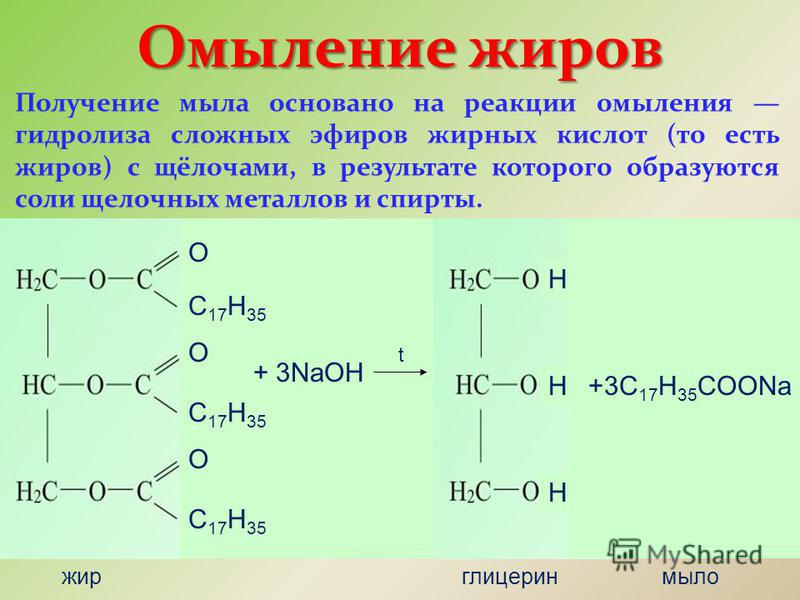




 Добро пожаловать в увлекательный мир волшебства.
Добро пожаловать в увлекательный мир волшебства.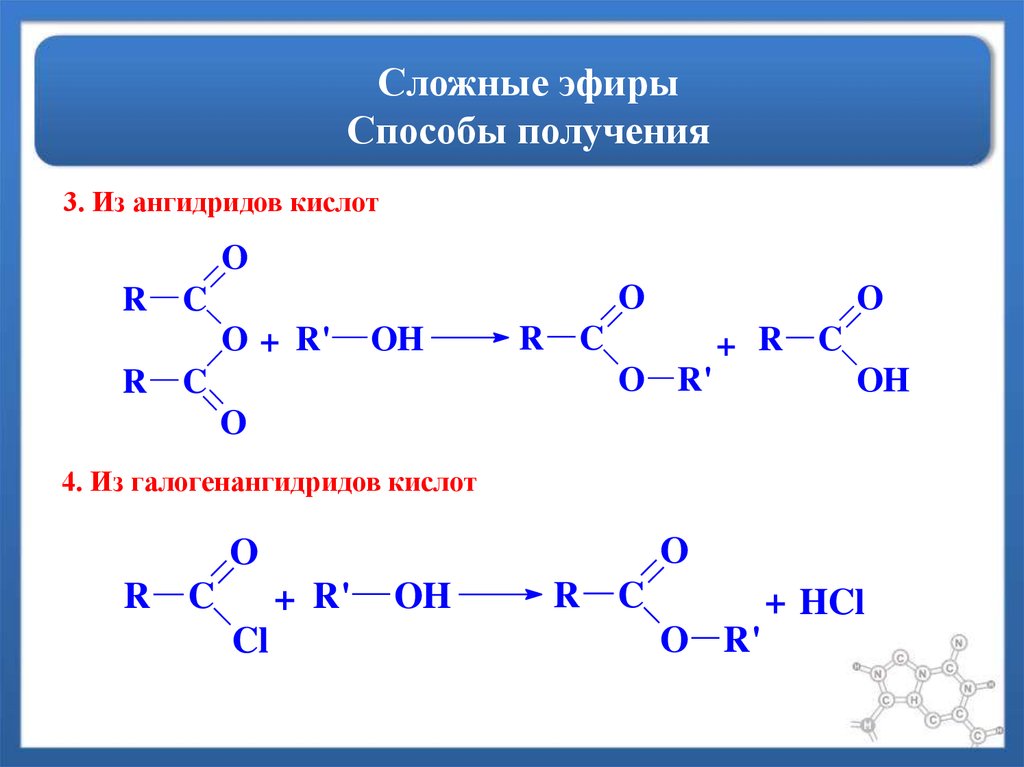 Происходит коллективная проверка (ответы высвечиваются на слайде презентации).
Происходит коллективная проверка (ответы высвечиваются на слайде презентации).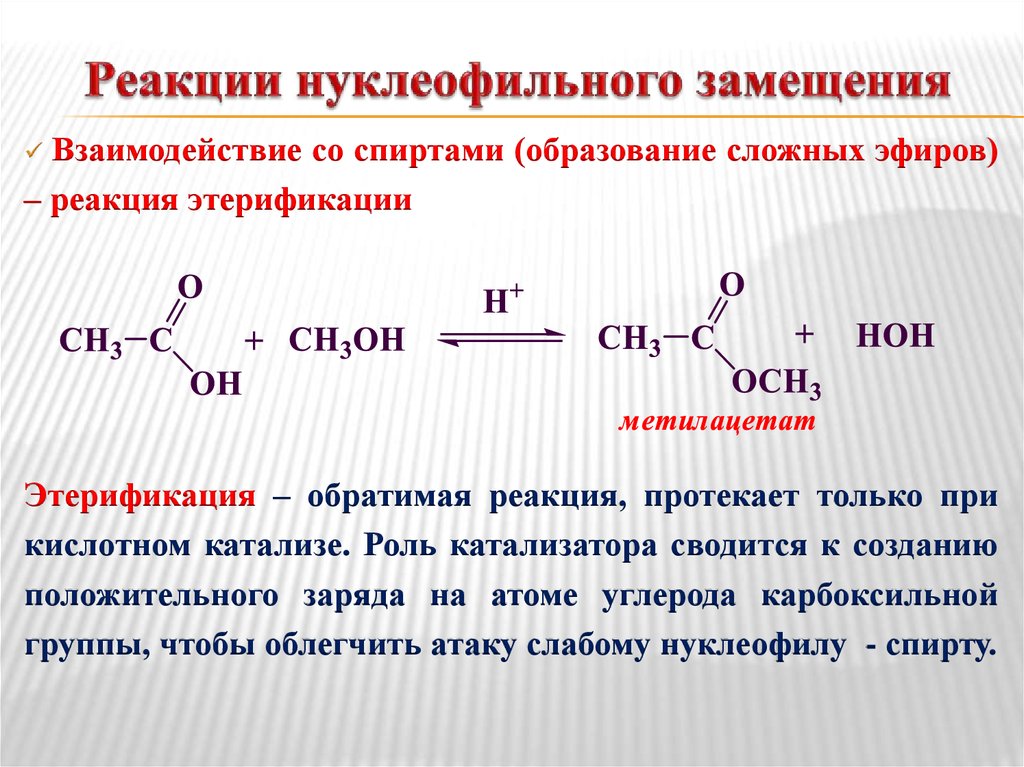
 масляной кислотой и этиловым спиртом (ананас)
масляной кислотой и этиловым спиртом (ананас)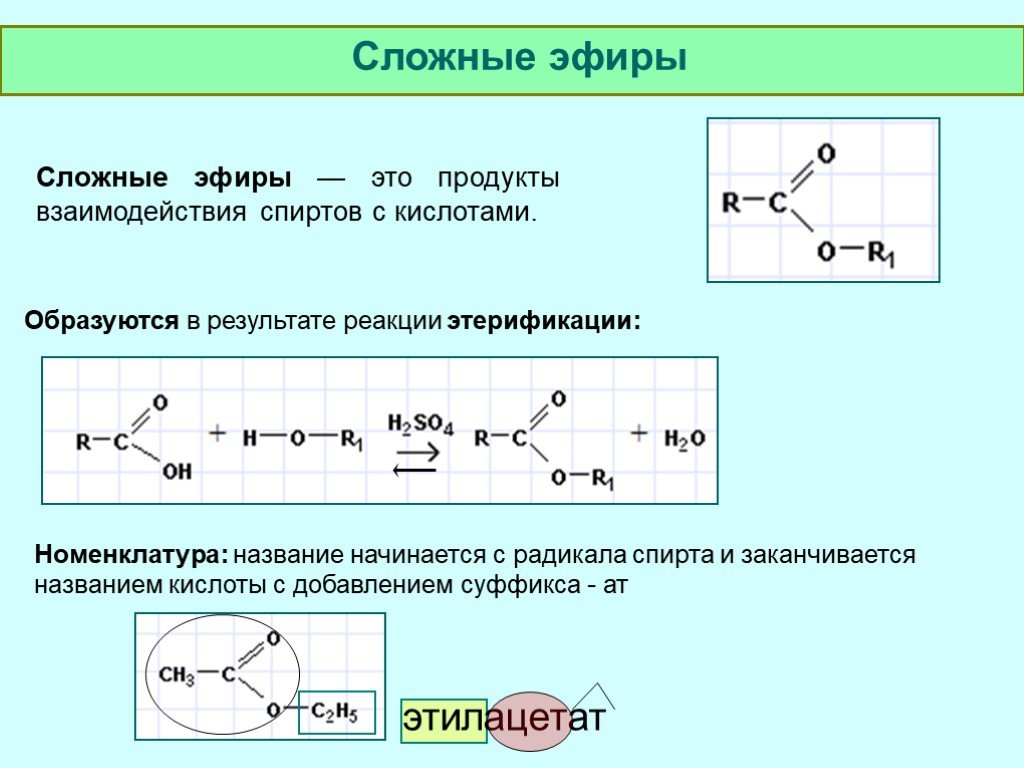 Тривиальное название кислоты + название радикала от спирта + слово эфир = уксуснометиловый эфир;
Тривиальное название кислоты + название радикала от спирта + слово эфир = уксуснометиловый эфир;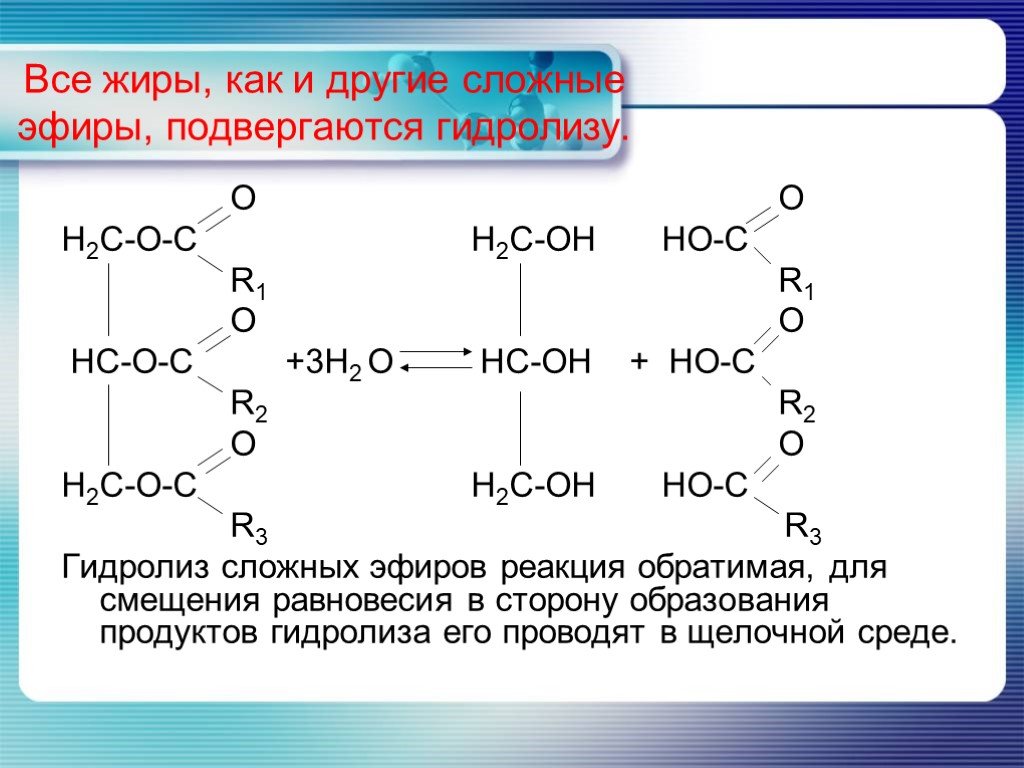 Изучите текст параграфа, сравните физические свойства сложных эфиров (сложные эфиры низших карбоновых кислот и сложные эфиры высших жирных кислот и спиртов), используя диаграмму Венна. Найдите общее и различие в свойствах.
Изучите текст параграфа, сравните физические свойства сложных эфиров (сложные эфиры низших карбоновых кислот и сложные эфиры высших жирных кислот и спиртов), используя диаграмму Венна. Найдите общее и различие в свойствах.

 (Взаимопроверка)
(Взаимопроверка)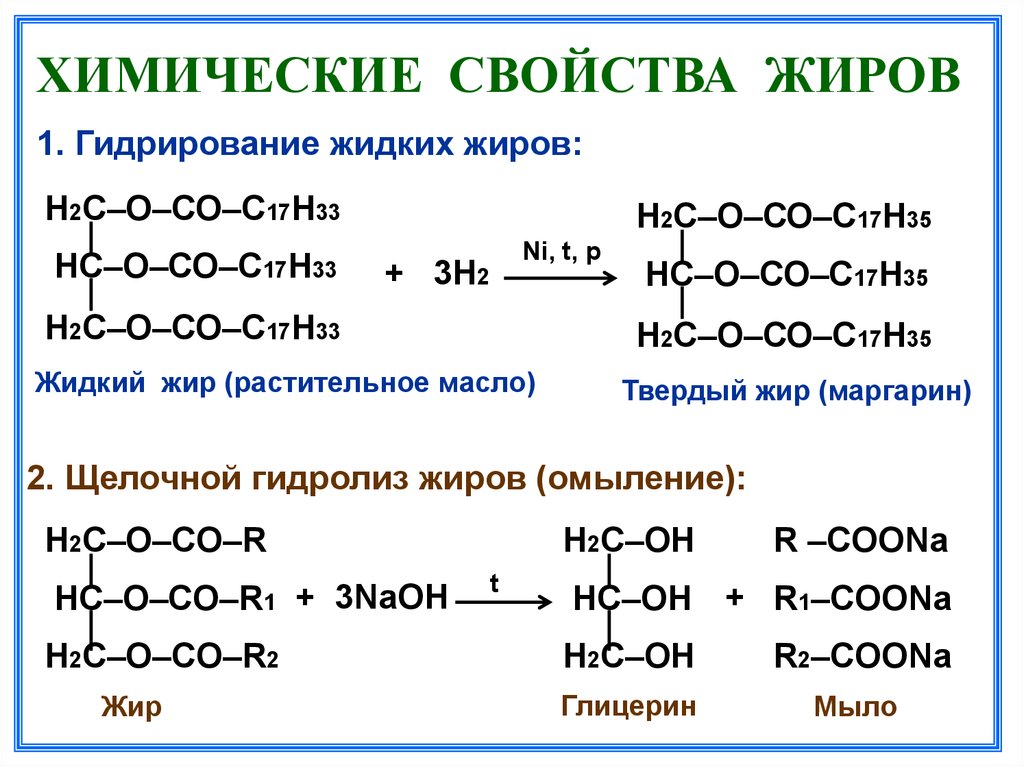 Что это за вещества? Напишите уравнения соответствующих реакций.
Что это за вещества? Напишите уравнения соответствующих реакций.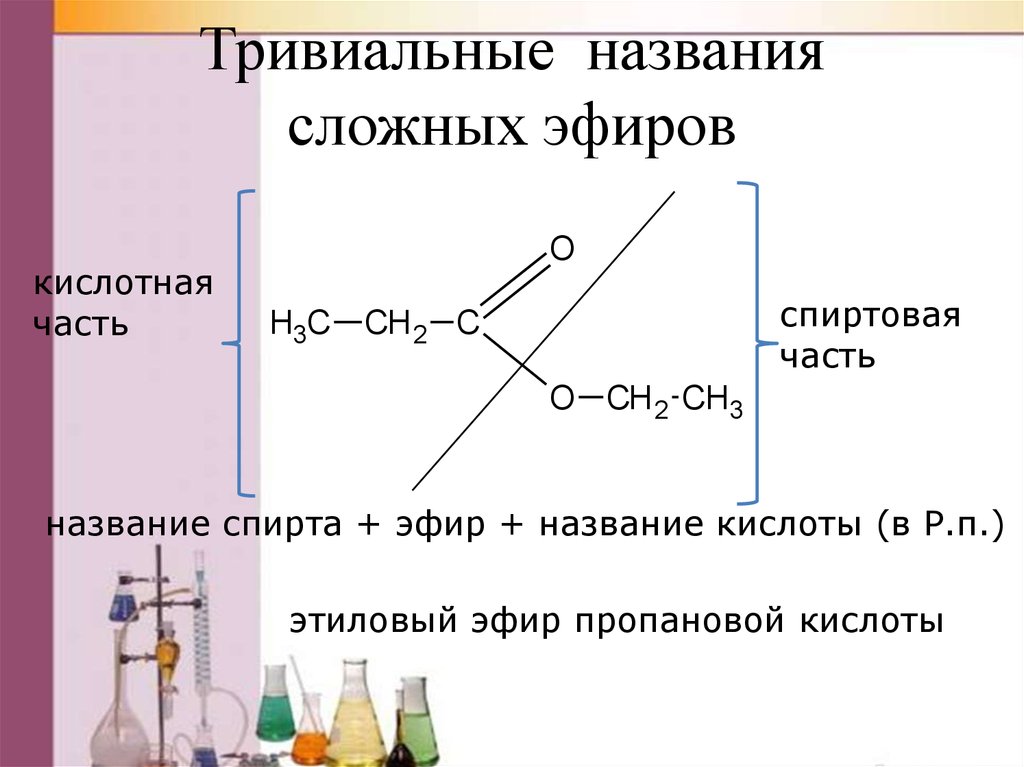 Реакции образования сложных эфиров называют реакциями этерификации. Характерное свойство сложных эфиров — их взаимодействие с водой. Реакцию щелочного гидролиза сложного эфира называют омылением. Сложные эфиры содержатся в цветках, фруктах, ягодах. Применяются сложные эфиры в парфюмерной, пищевой промышленностях, как растворители, для получения волокон (нитрона).
Реакции образования сложных эфиров называют реакциями этерификации. Характерное свойство сложных эфиров — их взаимодействие с водой. Реакцию щелочного гидролиза сложного эфира называют омылением. Сложные эфиры содержатся в цветках, фруктах, ягодах. Применяются сложные эфиры в парфюмерной, пищевой промышленностях, как растворители, для получения волокон (нитрона).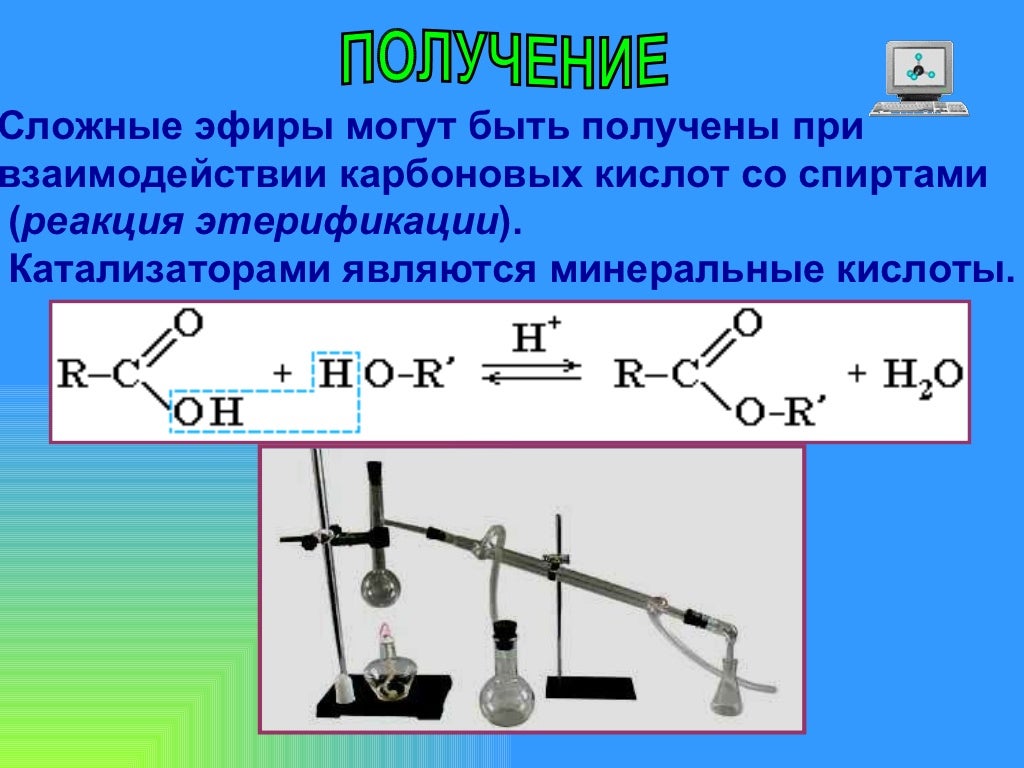 Спасибо за урок.
Спасибо за урок.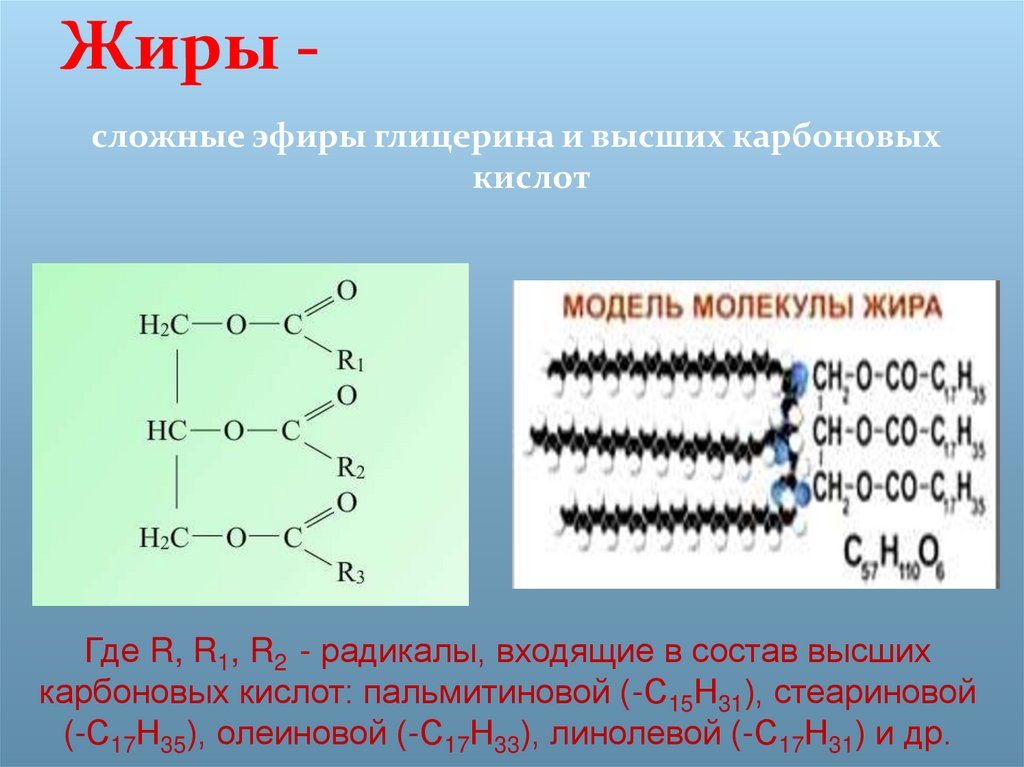 . 83,5 КБ
. 83,5 КБ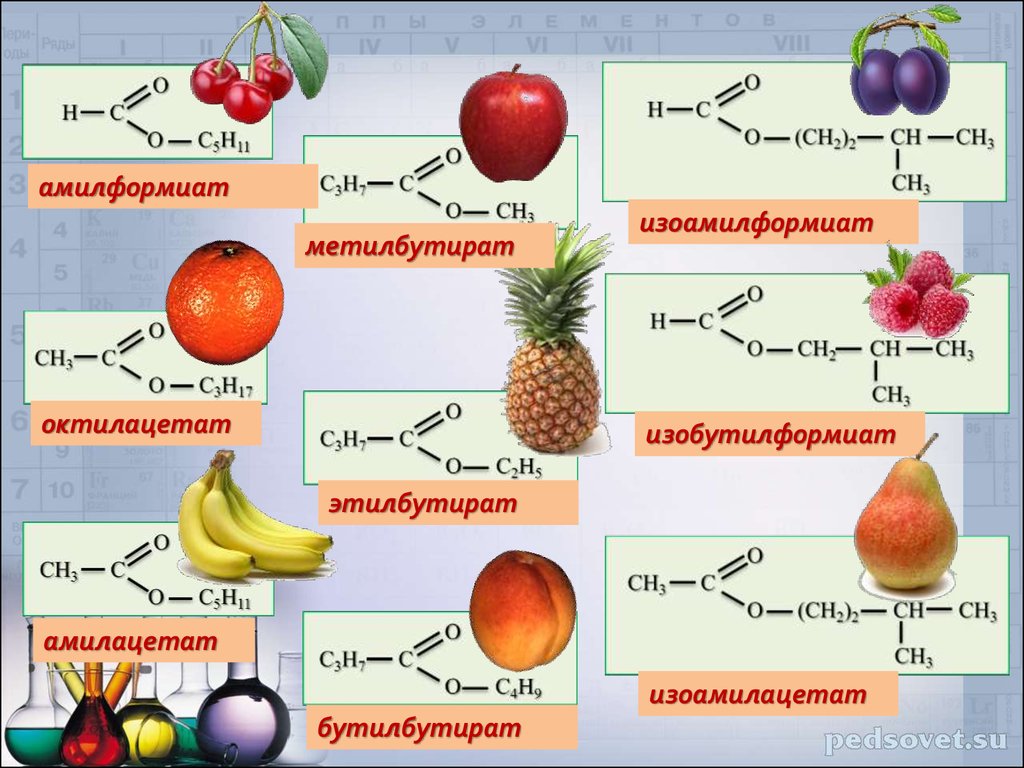
 Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл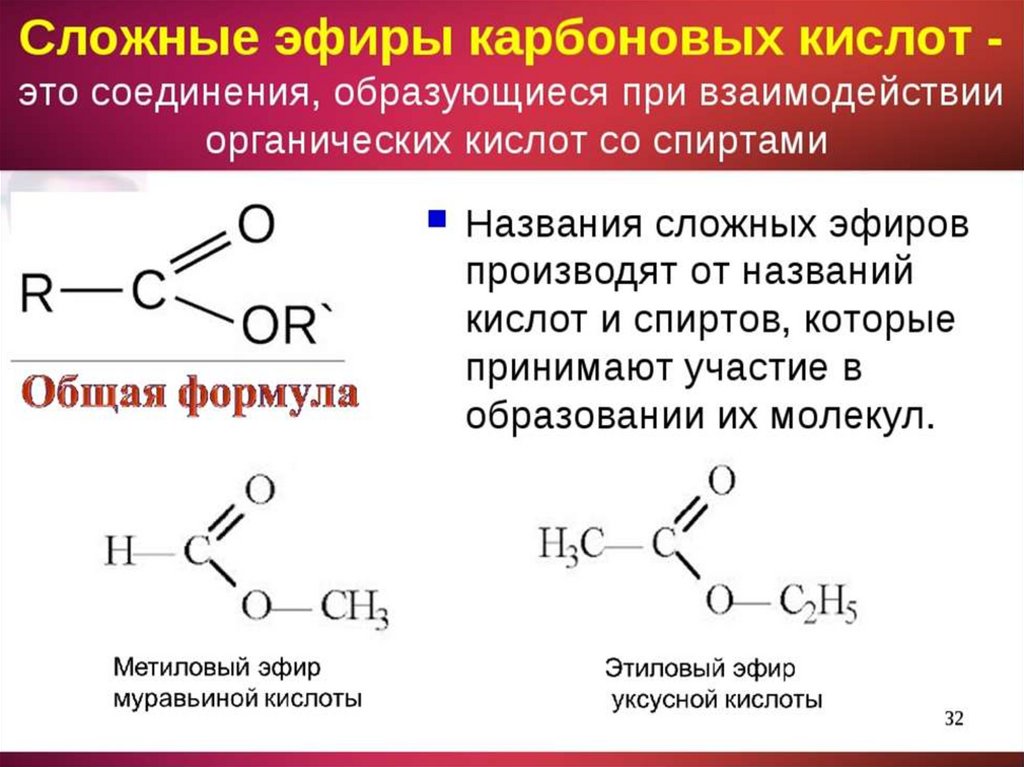 Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл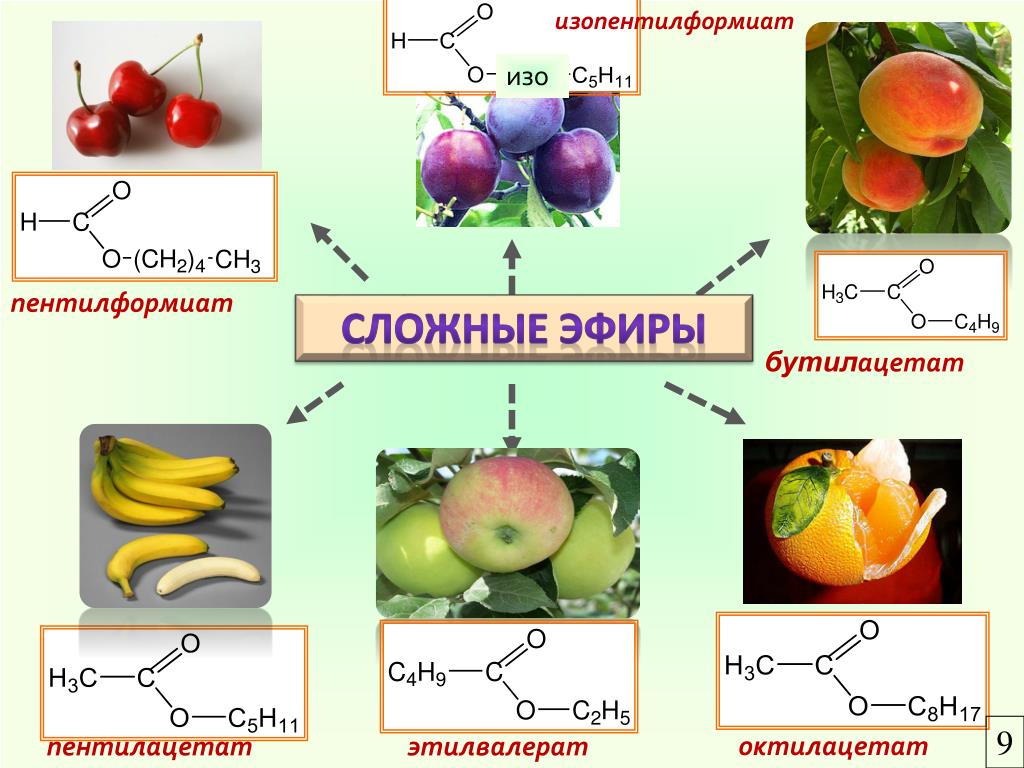 Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл
Френкель, X. Хонг, Р. К. Уилхойт, К. Р. Холл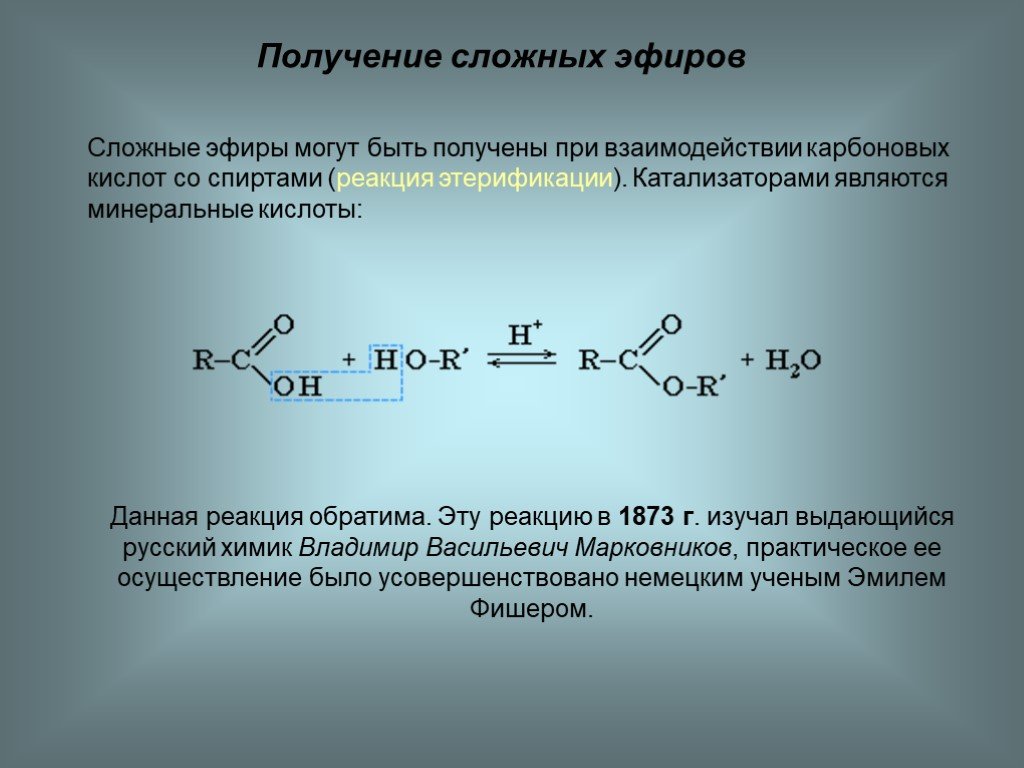
 Продвинутые учащиеся могут быть достаточно надежными, чтобы подготовить свои собственные пробирки таким образом.
Продвинутые учащиеся могут быть достаточно надежными, чтобы подготовить свои собственные пробирки таким образом.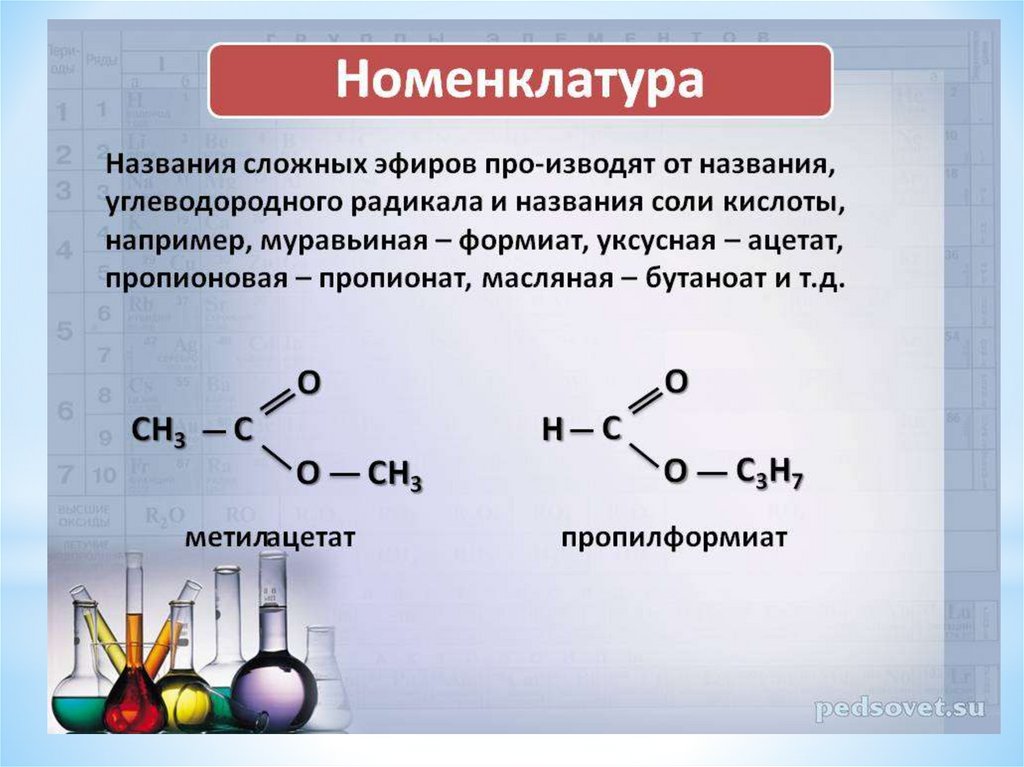 карточку опасности CLEAPSS HC084A.
карточку опасности CLEAPSS HC084A.
