Содержание
Сложные эфиры | План-конспект урока по химии (10 класс) по теме:
Тема урока: Сложные эфиры
І. Организационный момент. (1 мин.)
1. Приветствие.
2. Проверка подготовленности обучающихся к учебному занятию.
3. Организация внимания.
ІІ. Проверка домашнего задания. (7 мин.)
Для проверки домашнего задания (повторение химических свойств спиртов и карбоновых кислот) обучающимся выдаются карточки с заданиями (2 варианта). Работы выполняются в тетрадях для самостоятельных работ. По истечении времени ребята сдают работы учителю.
Задания 1 варианта:
1. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ:
Этан → Этилен → Этиловый спирт → Уксусная кислота → Ацетат натрия
2. К раствору, содержащему 24,4 г карбоната натрия прибавили избыток уксусной кислоты. Определите массу образовавшейся соли.
3. В двух склянках без этикеток находятся два вещества: этилен, этанол. Как определить эти вещества химическим путем?
Как определить эти вещества химическим путем?
Задания 2 варианта:
1. Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений веществ:
Карбид кальция → Ацетилен → Этилен → Этанол → Уксусная кислота
2. К раствору, содержащему 24,4 г карбоната натрия прибавили избыток уксусной кислоты. Определите объем (н.у) выделившегося газа.
3. В двух склянках без этикеток находятся два вещества: глицерин, уксусная кислота. Как определить эти вещества химическим путем?
III. Изучение нового материала (25 мин)
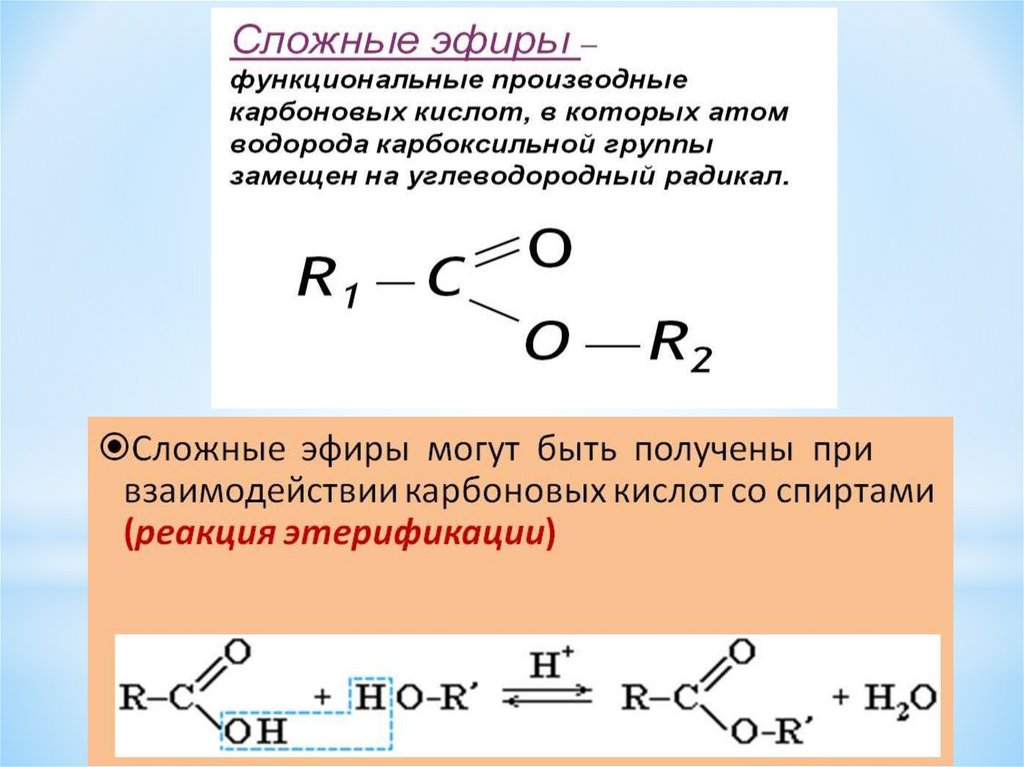
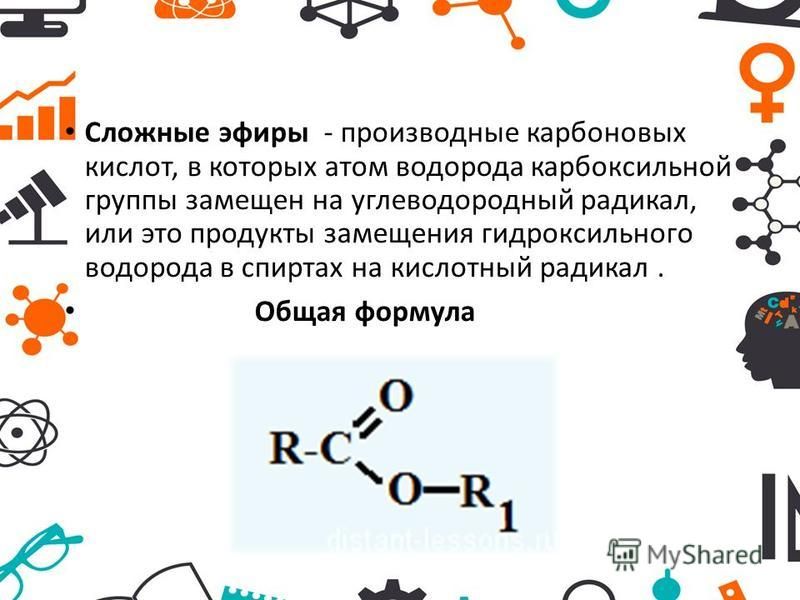
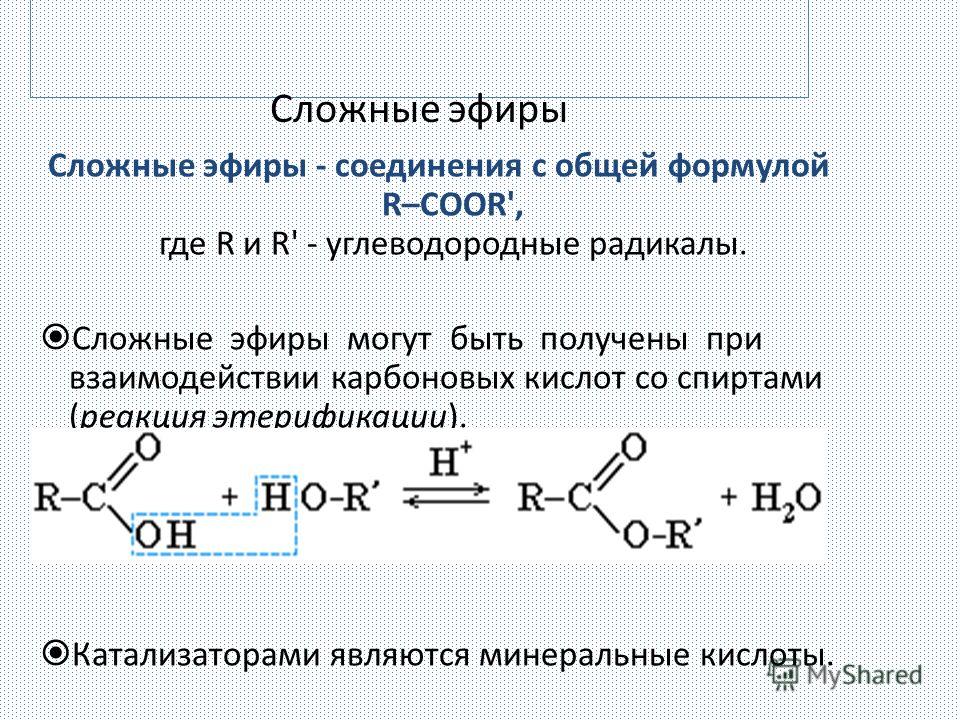
Учитель. При изучении кислот мы неоднократно встречались с их производными — сложными эфирами. Рассмотрим этот класс соединений более углубленно. Откройте, пожалуйста, §29, страница 135. Органические вещества, которые образуются в реакциях кислот со спиртами, относят к сложным эфирам. (Дети записывают определение)
Реакции образования сложных эфиров идут с отщеплением воды:
O O
// //
R — C + H-O-R1 → R — C + h3O
\ \
O-H O-R1
карбоновая спирт сложный
кислота эфир
(R и R1 – радикалы углеводородов, одинаковые или разные).
При помощи изотопа кислорода с массовым числом 18 удалось установить, что гидроксильная группа в этой реакции отщепляется от молекулы карбоновой кислоты:
O O
// //
R — C + H 188O-R1 → R — C + h3O
\ \
O-H 188O-R1
Физкультминутка. (1 мин.)
Упражнения для глаз.
- Двигать глазами вверх – вниз, влево – вправо. Зажмурившись, снять напряжение, считая до десяти.
- Представить себе большой круг. Обводить его глазами по часовой стрелке, потом против часовой стрелке.
Учитель. Молодцы! А теперь продолжим изучать сложные эфиры. Итак, номенклатура.
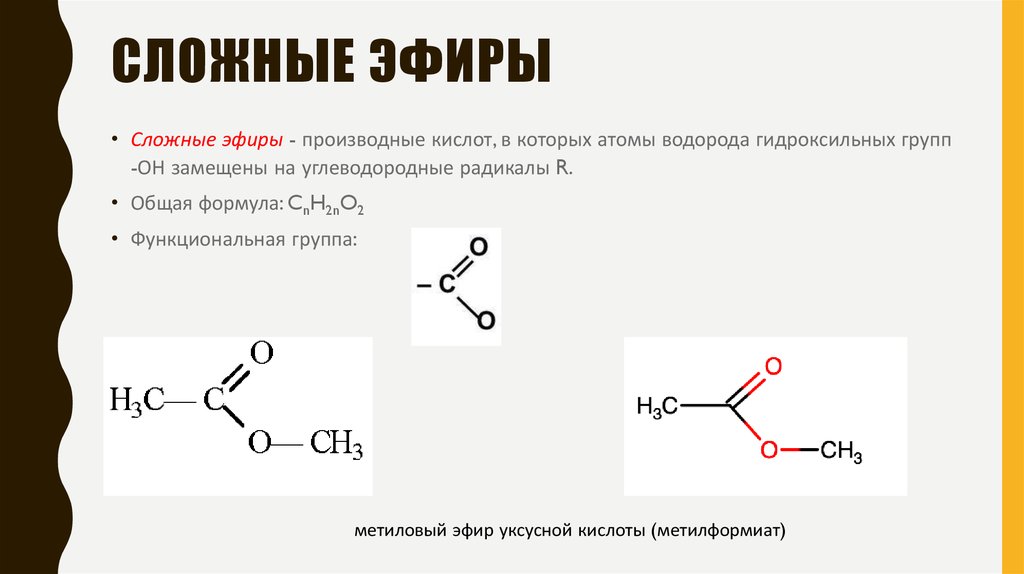
Названия сложных эфиров образуют от названий соответствующих спиртов и кислот, например: (дети записывают формулы и названия веществ)
O O
// //
H — C R — C
\ \
O-Ch4 O-C2H5
метилформиат, этилацетат,
или метиловый эфир или этиловый эфир
муравьиной кислоты уксусной кислоты
O
//
H — C
\
O-Ch3-Сh3-CH-Ch4
|
Ch4
изопентилацетат,
или изопентиловый эфир уксусной кислоты
Физкульминутка.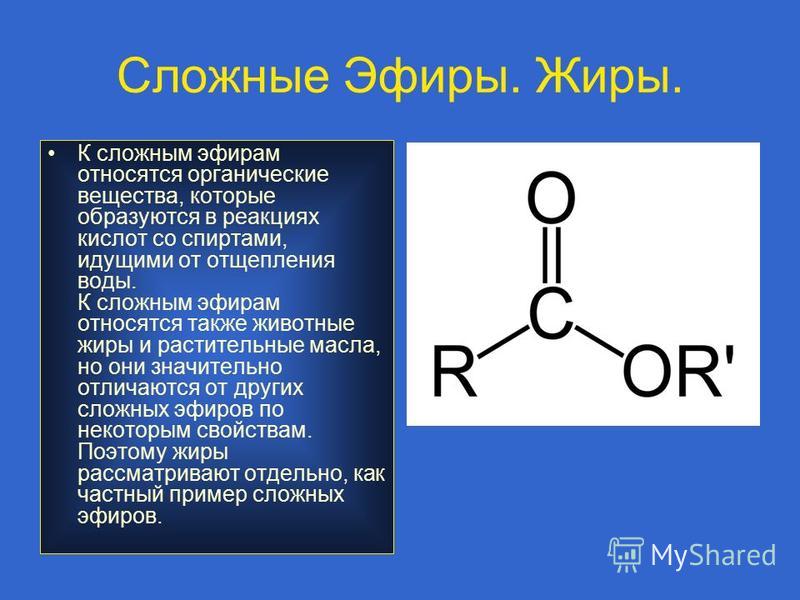 (1 мин.)
(1 мин.)
Выполнение несколько упражнений для улучшения мозгового кровообращения и для снятия утомления с плечевого пояса и рук.
Учитель. Изучим нахождение сложных эфиров в природе и физические свойства.
ЦОР: Нахождение сложных эфиров в природе
http://files.school-collection.edu.ru/dlrstore/d777bfad-8cff-11db-b606-0800200c9a66/ch20_21_03.jpg
Сложные эфиры содержатся в цветках, фруктах, ягодах. Сложные эфиры простейших одноосновных кислот и спиртов — жидкости, легче воды, летучие и в большинстве случаев обладающие приятным запахом. Например, изопентиловый эфир уксусной кислоты (изопентилацетат) имеет запах груши, бутиловый эфир масляной кислоты — ананаса (рис.37, страница 136). Синтетические сложные эфиры в виде фруктовых эссенций используются наряду с другими душистыми веществами в производстве вод, кондитерских изделий, при изготовлении духов и одеколонов. Некоторые из сложных эфиров (например, этиловый эфир уксусной кислоты) служат растворителями.
Температуры кипения и плавления сложных эфиров ниже, чем соответствующих органических кислот.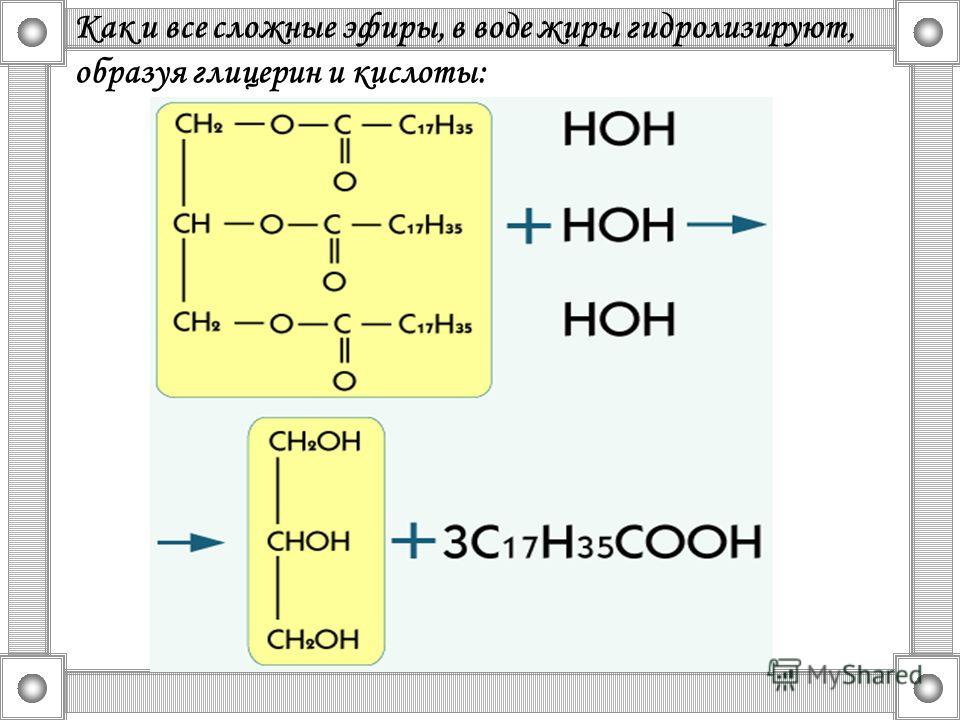 В воде растворимы только сложные эфиры с небольшой относительной молекулярной массой.
В воде растворимы только сложные эфиры с небольшой относительной молекулярной массой.
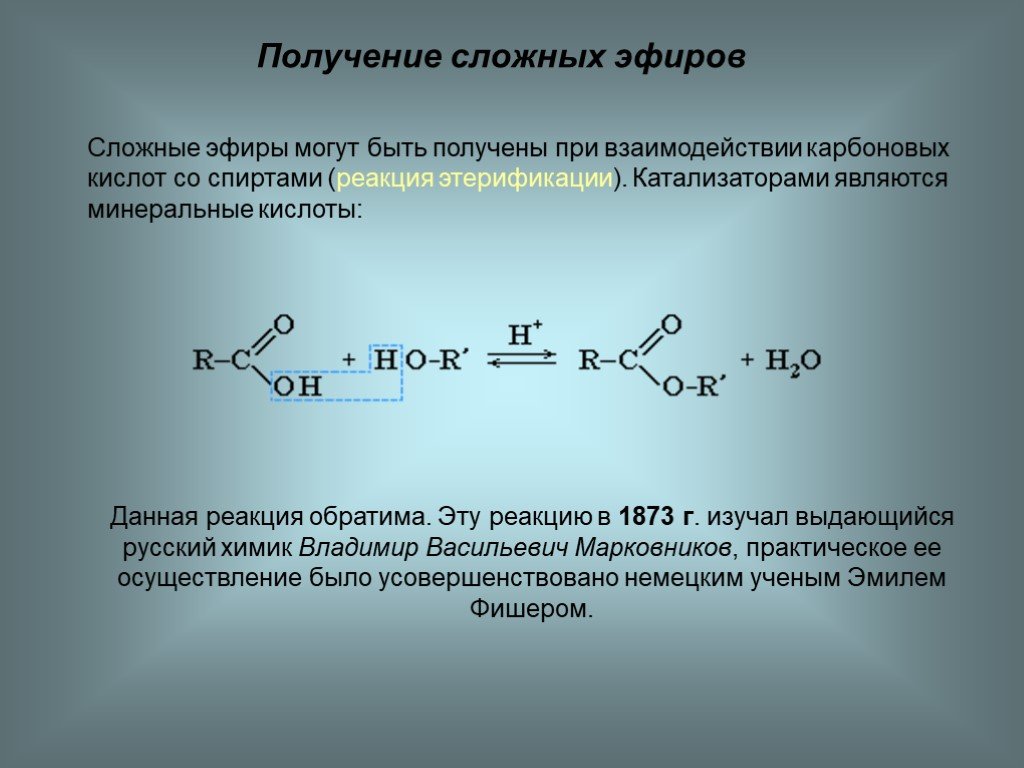
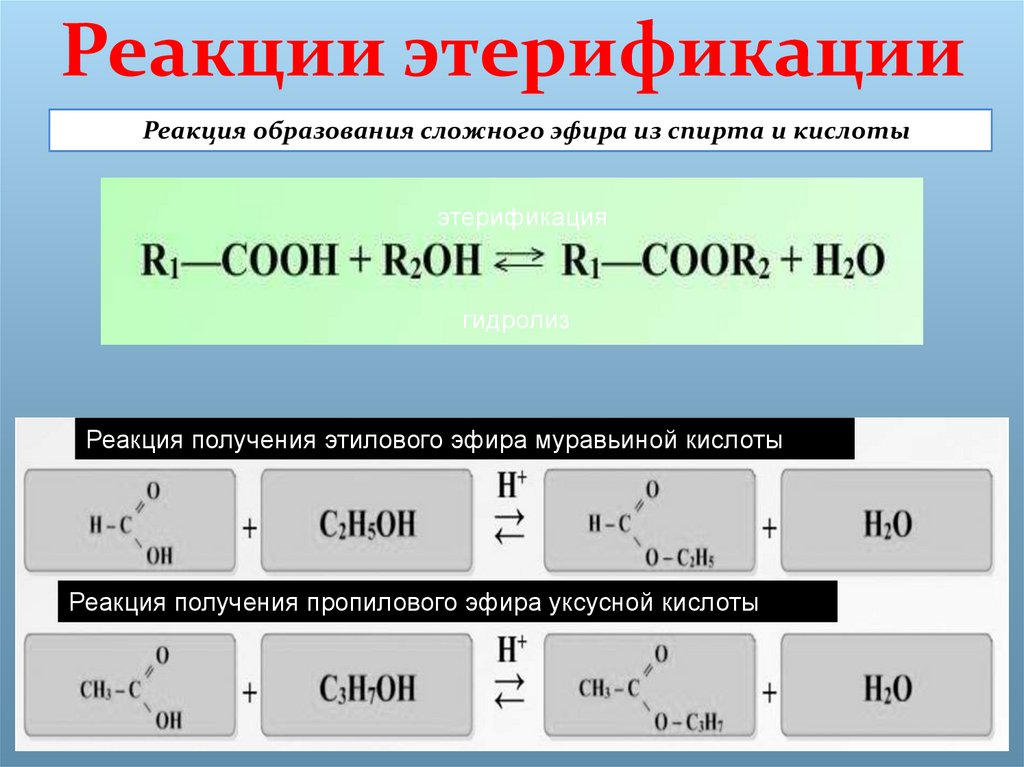
Учитель: Рассмотрим получение эфиров. В лаборатории получают эти вещества путем взаимодействия карбоновых кислот со спиртами. Реакции образования сложных эфиров называют реакциями этерификации.
Реакции этерификации обратимы. Чтобы сместить равновесие такой реакции в сторону выделения сложного эфира, обычно пользуются концентрированной серной кислотой, которая связывает воду.
Сложные эфиры получают также при взаимодействии минеральных кислот со спиртами, например при нитровании глицерина.
Лабораторная работа
Тема: Получение уксусноэтилового эфира
Цель: провести реакцию этерификации и получить уксусноэтиловый эфир
Оборудование: прибор для получения галоидоалканов, штатив, горелка, огнезащитная прокладка, мерный цилиндр, мерная пробирка.
Техника безопасности. Соблюдать правила работы с кислотами и правила работы с горючими жидкостями.
Ход работы:
Проведем реакцию этерификации в приборе для получения галоидоалканов. В реакционную колбу поместим этиловый спирт, уксусную кислоту и концентрированную серную кислоту. Серная кислота используется как водоотнимающее средство. Так как реакция этерификации обратима, необходимо удалять воду. В холодильник нальем насыщенный раствор поваренной соли. В этом растворе растворимость эфира минимальна. При нагревании смеси образуется летучий уксусноэтиловый эфир. Он конденсируется в холодильнике. Он легче воды и раствора соли. Поэтому он образует верхний слой жидкости. Для лучшей видимости прибавим в холодильник подкрашенную воду. Эфир растворяет краситель, и верхний слой становится хорошо заметен.
В реакционную колбу поместим этиловый спирт, уксусную кислоту и концентрированную серную кислоту. Серная кислота используется как водоотнимающее средство. Так как реакция этерификации обратима, необходимо удалять воду. В холодильник нальем насыщенный раствор поваренной соли. В этом растворе растворимость эфира минимальна. При нагревании смеси образуется летучий уксусноэтиловый эфир. Он конденсируется в холодильнике. Он легче воды и раствора соли. Поэтому он образует верхний слой жидкости. Для лучшей видимости прибавим в холодильник подкрашенную воду. Эфир растворяет краситель, и верхний слой становится хорошо заметен.
СН3СООН + С2Н5ОН = h3О + Ch4COOС2Н5
Примечание: Видео «Получение уксусноэтилового эфира»
http://files.school-collection.edu.ru/dlrstore/2638df79-e8e5-0109-e2e2-cd2fa153a7bb/index.htm
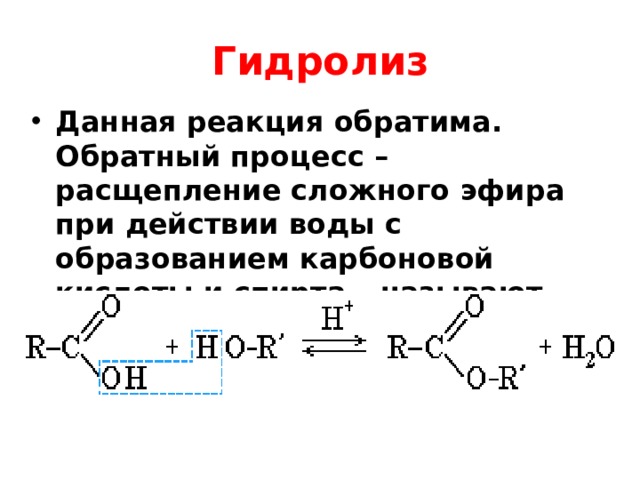
Учитель: Рассмотрим химические свойства. Характерное свойство сложных эфиров — их взаимодействие с водой — гидролиз:
O O
// //
Ch4 — C + HOH → Ch4 — C + C2H5OH
\ \
O-C2H5 OH
этилацетат уксусная кислота этанол
Гидролиз протекает как в кислой, так и в щелочной среде.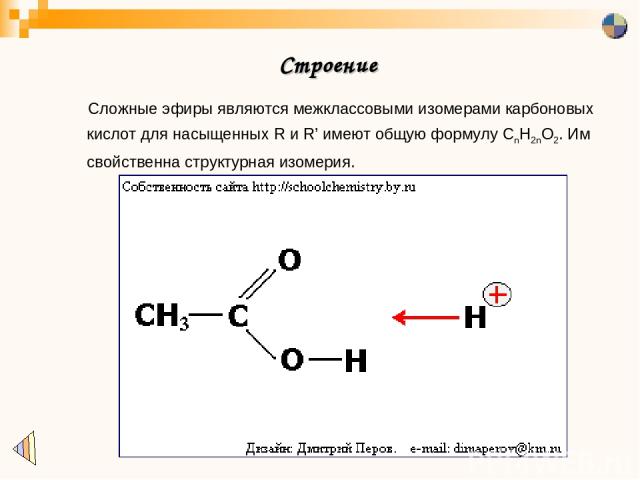 В щелочной среде гидролиз становится необратимым, поскольку щелочь связывает карбоновую кислоту в соль:
В щелочной среде гидролиз становится необратимым, поскольку щелочь связывает карбоновую кислоту в соль:
Реакцию щелочного гидролиза сложного эфира называют омылением.
O O
// //
R1 — C + NaOH → R1 — C + R2-OH
\ \
O-R2 ONa
Учитель: Применение сложных эфиров
ЦОР. Применение сложных эфиров
http://files.school-collection.edu.ru/dlrstore/d777bfae-8cff-11db-b606-0800200c9a66/ch20_21_04.jpg
Рассмотрим рисунок 38, страница 137. Полиметилакрилат (полимер сложного эфира Ch3=CH-COOCh4) широко используются в производстве пластмасс.
В конце XIX — начале ХХ века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров.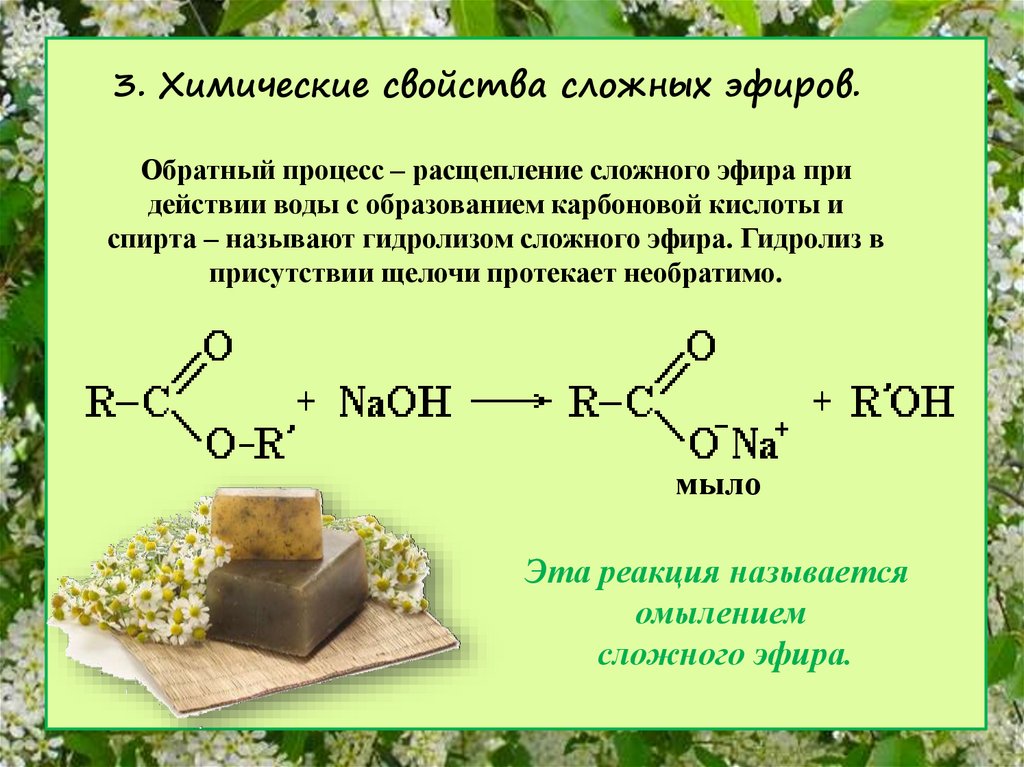 Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
Ребята, скажите, пожалуйста, где применяются сложные эфиры? (Ответы: в парфюмерной, пищевой промышленностях, как растворители, для получения волокон (нитрона)).
Учитель: Рассмотрим схему 7 на странице 130. На схеме показана генетическая связь сложных эфиров с другими классами органических веществ. Из каких веществ можно получить сложные эфиры? (Ответы: из карбоновых кислот и спиртов).
IV. Закрепление знаний. (7 мин.)
Учитель. Для закрепления знаний выполним задания №1, 2, 3, 4, 5(а) по учебнику, страница 138.
Задание №1
Какие вещества относят к сложным эфирам? Составьте две-три уравнения реакций их образования.
Задание №2
Какой вид изомерии характерен для сложных эфиров? Напишите формулы двух-трех изомеров и их названия.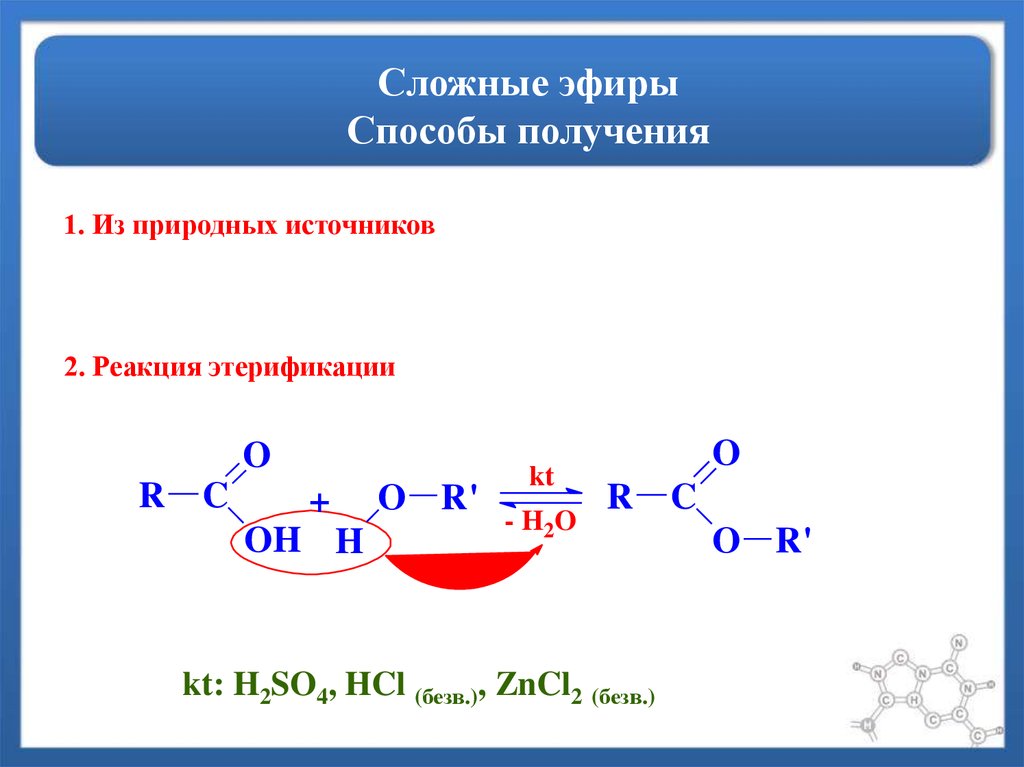
Задание №3
Охарактеризуйте физические и химические свойства сложных эфиров. Напишите уравнения соответствующих реакций.
Задание №4
Где применяют сложные эфиры?
Задание №5
Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения:
СН → Сh4OH
↓
C2h3 → ? →Ch4COOH →Ch4COOC2H5
Задание №6
Какую массу (в г) этилацетата можно получить из 60 г уксусной кислоты и 70 г этанола, если выход сложного эфира равен 80%?
V. Домашнее задание. (1 мин.)
§ 29, №5 (б), 6 с.138
Творческое задание: подготовить сообщение «Сложные эфиры в медицине»
VI. Рефлексия. (1 мин.)
Ответьте на утверждение знаком «+» или «–».
1. На уроке было над чем подумать.
2. Я понял новую тему.
3. На все возникшие у меня вопросы я получил ответы.
4. По новой теме мне необходима дополнительная консультация.
5. На уроке я поработал добросовестно.
VII. Подведение итогов урока. (1 мин.)
(1 мин.)
Сложные эфиры – класс соединений на основе минеральных (неорганических) или органических карбоновых кислот, у которых атом водорода в НО-группе замещен органической группой R. Реакции образования сложных эфиров называют реакциями этерификации. Характерное свойство сложных эфиров — их взаимодействие с водой. Реакцию щелочного гидролиза сложного эфира называют омылением. Сложные эфиры содержатся в цветках, фруктах, ягодах. Применяются сложные эфиры в парфюмерной, пищевой промышленностях, как растворители, для получения волокон (нитрона).
Спасибо за внимание! До свидания!
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ДЕРЖАВНИЙ ВИЩИЙ НАВЧАЛЬНИЙ ЗАКЛАД«ДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ»ФАКУЛЬТЕТ ЕКОЛОГІЇ ТА ХІМІЧНОЇ ТЕХНОЛОГІЇ з вибіркової навчальної дисципліни циклу професійної та практичної підготовки Галузь знань — 0401 «Природничі науки»Напрям підготовки: 6. та збалансоване природокористування» Спеціалізація: «Управління екологічною безпекою» — ЕП Донецьк, 2011 р. МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ДЕРЖАВНИЙ ВИЩИЙ НАВЧАЛЬНИЙ ЗАКЛАД«ДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ»Кафедра «Фізична і органічна хімія» КОНСПЕКТ ЛЕКЦИЙ по дисциплине «Органическая химия» Для студентів напряму підготовки — 6.040106 «Екологія, охорона навколишнього середовища та збалансоване природокористування» – ЕП Донецк 2011 Содержание
ВВЕДЕНИЕ Основой, на которой строится курс, является теория химического строения и взаимного влияния атомов, а также теория переходного состояния, которые в настоящее время не потеряли актуальности и наиболее широко используются химиками – органиками, специализирующимися в области физической органической химии. Одной из важнейших задач курса является изучение возможностей квантовохимической теории реакционной способности и механизмов реакций и реакционной способности органических соединений, а также на более высоком уровне понимание связи современных теорий строения вещества с классическими представлениями качественной электронной теории в органической химии. Многочисленные примеры конкретных реакций, имеющих отношение главным образом к технологии органического синтеза, позволят студентам более легко и качественно справиться с решением контрольных заданий. Теоретические основы органической химии, изложенные в данном курсе лекций, содержат сведения по самым главным моментам программы: номенклатуре и изомерии органических веществ, основным методам синтеза, широко применяемым в промышленности, а также основные правила органической химии. С целью более углубленного рассмотрения вопросов химических превращений органических веществ, а также ориентирующего влияния заместителей в бензольном кольце, приведены механизмы соответствующих процессов. Конечной целью данного курса является формирование глубокого понимания общих закономерностей, связывающих строение органических соединений с их реакционной способностью и умения прогнозировать изменения в механизме и в основном направлении реакции даже при небольших изменениях в строении реагирующих соединений и условий реакции. Лекции 1-2: Основные теоретические положения органической химии.
Общие представления Органическая химия – это химия соединений углерода, атомы которого связаны с атомами других элементов ковалентными, преимущественно мало поляризованными связями. Органические соединения, или соединения углерода, отличаются от неорганических многочисленностью и многообразием превращений. Если неорганических соединений насчитывается порядка 200 тысяч, то органических соединений известно свыше 2 миллионов. Законы химии управляют поведением как неорганических, так и органических веществ. Однако органические соединения имеют ряд отличительных особенностей. Так, большинство неорганических соединений – тугоплавкие вещества, а для органических соединений характерно состояние газов, жидкостей и низкоплавких твердых тел; большинство неорганических соединений не горючи, органические легче окисляются и горят, чем неорганические. К низкомолекулярным относят органические соединения с длиной цепи от 2 до 50 углеродных атомов, к высокомолекулярным – с длиной цепи порядка 200-200000 углеродных атомов и молекулярным весом порядка 104-106 у.е. Органические соединения при длине цепи порядка 200 атомов углерода обладают уже смолоподобными и каучукоподобными свойствами. Если цепи атомов кислорода, азота, фосфора, серы, бора и других элементов мало устойчивы, то длинные цепи атомов углерода в силу большой энергии С-С — связи (339 КДж) — весьма устойчивы. Каталог: bitstream -> 123456789 жүктеу/скачать 2.14 Mb. Достарыңызбен бөлісу: |
Антимикобактериальная активность эфиров на основе циннамата тритерпенов бетулиновой, олеаноловой и урсоловой кислот.
Журнальная статья
- Обзор
- Фон
- Личность
- Дополнительная информация о документе
- Посмотреть все
Обзор
Резюме
Дата публикации
- 2008 г.
Издатель
- Уайли
Опубликовано в
- Журнал ХимИнформ
Фон
Цитата
- Таначатчайратана Т.
 , Бремнер Дж. Б., Чокчайсири Р. и Суксамрарн А. (2008). ХимИнформ Реферат: Антимикобактериальная активность циннаматных эфиров тритерпенов бетулиновой, олеаноловой и урсоловой кислот. Химинформ, 39(32), вып. дои: 10.1002 / chin.200832182
, Бремнер Дж. Б., Чокчайсири Р. и Суксамрарн А. (2008). ХимИнформ Реферат: Антимикобактериальная активность циннаматных эфиров тритерпенов бетулиновой, олеаноловой и урсоловой кислот. Химинформ, 39(32), вып. дои: 10.1002 / chin.200832182
Идентификатор
Цифровой идентификатор объекта (doi)
- 10.1002/кил.200832182
Регистрационный номер Web Of Science
Обзор
Резюме
Дата публикации
- 2008 г.
Издатель
- Уайли
Опубликовано в
- Журнал ХимИнформ
Фон
Цитата
- Таначатчайратана Т.
 , Бремнер Дж. Б., Чокчайсири Р. и Суксамрарн А. (2008). ХимИнформ Реферат: Антимикобактериальная активность циннаматных эфиров тритерпенов бетулиновой, олеаноловой и урсоловой кислот. ХимИнформ, 39(32), нет. дои: 10.1002 / chin.200832182
, Бремнер Дж. Б., Чокчайсири Р. и Суксамрарн А. (2008). ХимИнформ Реферат: Антимикобактериальная активность циннаматных эфиров тритерпенов бетулиновой, олеаноловой и урсоловой кислот. ХимИнформ, 39(32), нет. дои: 10.1002 / chin.200832182
Идентификатор
Цифровой идентификатор объекта (doi)
- 10.1002/кил.200832182
Регистрационный номер Web Of Science
Химические последствия сквозного взаимодействия четырех s-связей в сложных эфирах моносульфоната пергидронафталин-1,4-диола. — Research@WUR
| Язык оригинала | Английский |
|---|---|
| Название принимающей публикации | Резюме 9th Int. конф. Органический синтез, Монреаль, Канада |
Стр.
Орру, Р. Орру, Р.В.А. ; Дженнискенс, L.H.D. ; Вейнберг, J.B.P.A. ; де Гроот, Ae. / Химические последствия сквозного взаимодействия по четырем s-связям в эфирах моносульфокислоты пергидронафталин-1,4-диола. Реферат 9-й междунар. конф. Органический синтез, Монреаль, Канада. 1992. стр. 105 @inbook{bc96c28586354f2c80fc326880a9211b, title = «Химические последствия сквозного взаимодействия четырех s-связей в сложных эфирах моносульфоната пергидронафталин-1,4-диола», автор = «Р.В.А. Орру и Л.Х.Д. Дженнискенс и Дж.Б.П.А. Вейнберг и {де Гроот}, Э.», год = «1992», язык = «английский», страницы = «105», книга = «Реферат 9-й Международной конференции по органическому синтезу, Монреаль, Канада», } Орру, Р. Химические последствия сквозного взаимодействия по четырем s-связям в сложных эфирах моносульфоната пергидронафталин-1,4-диола. / Орру, Р.В.А.; Дженнискенс, LHD; Вейнберг, JBPA; де Гроот, Ae. Резюме 9-го междунар. конф. Органический синтез, Монреаль, Канада. 1992. с. 105. Результаты исследования: глава в книге/отчете/материалах конференции › реферат › академический TY – ГЛАВА T1 — Химические последствия сквозного взаимодействия четырех s-связей в сложных эфирах моносульфонатов пергидронафталина-1,4-диола. AU — Орру, Р.В.А. AU — Jenniskens, L.H.D. AU — Wijnberg, J.B.P.A. AU — де Гроот, Ае. Begin typing your search term above and press enter to search. Press ESC to cancel. Back To Top
|

 040106 «Екологія, охорона навколишнього середовища
040106 «Екологія, охорона навколишнього середовища
 6
6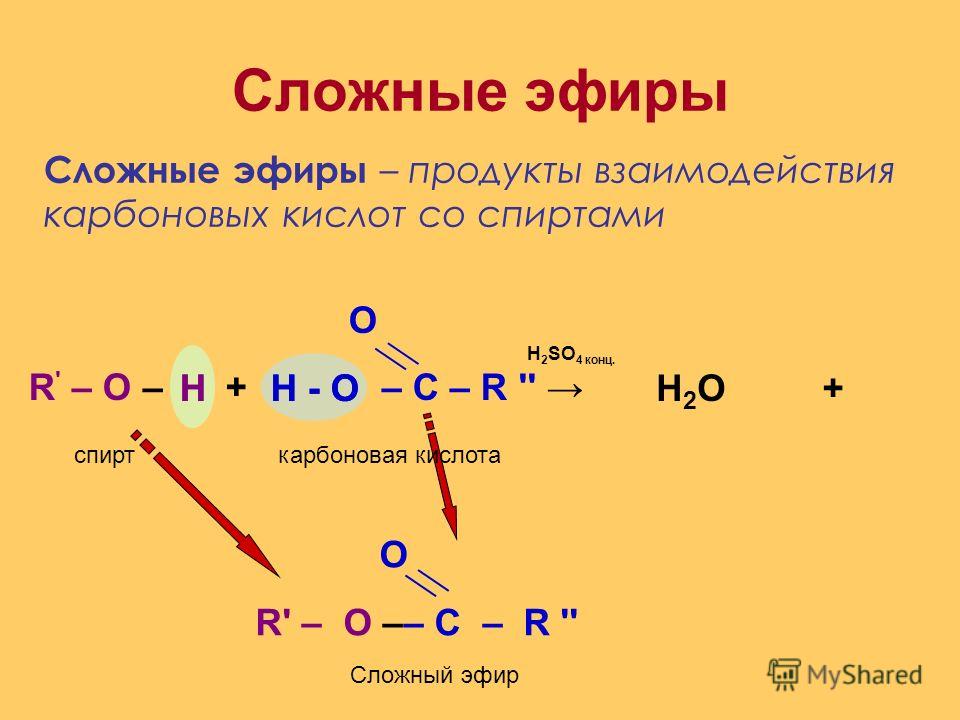 12
12 .
.
 2
2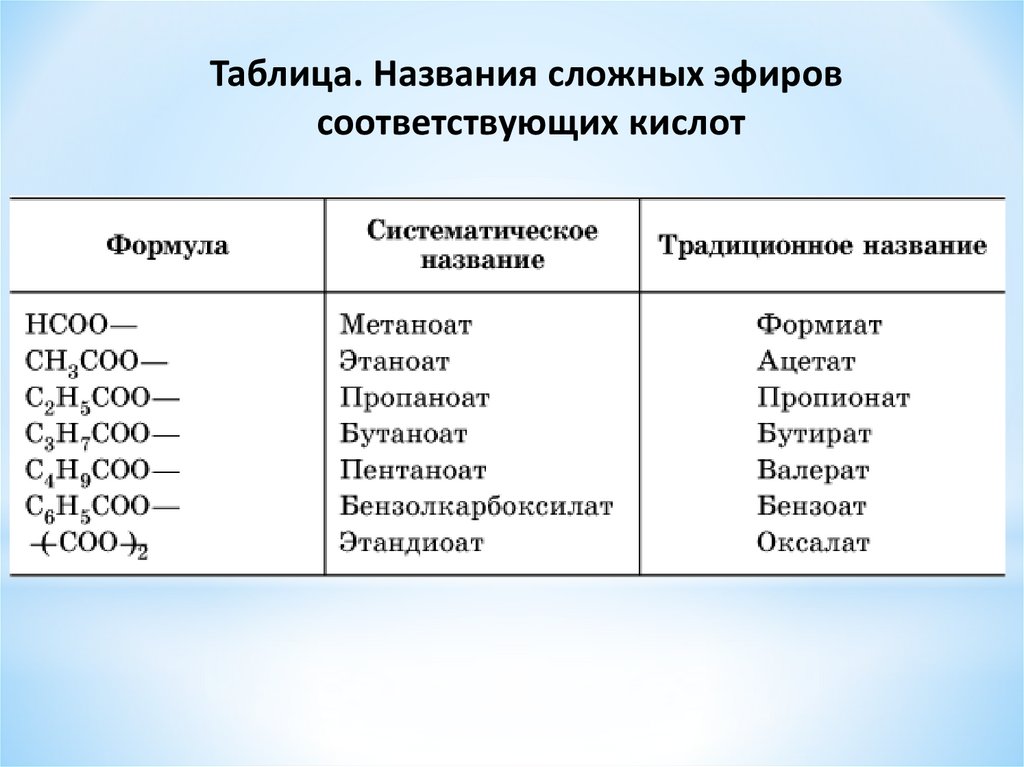 4
4 .
. Токсичность аренов……………….
Токсичность аренов……………….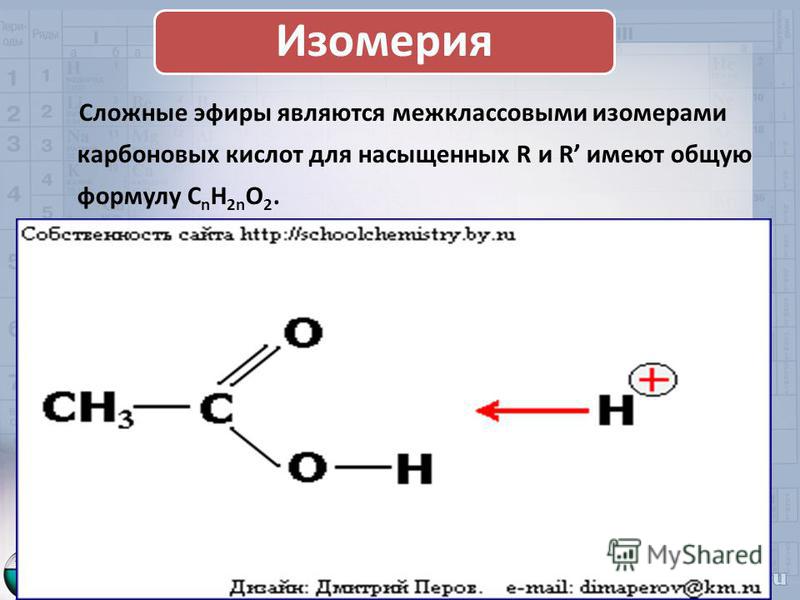
 .
. 2
2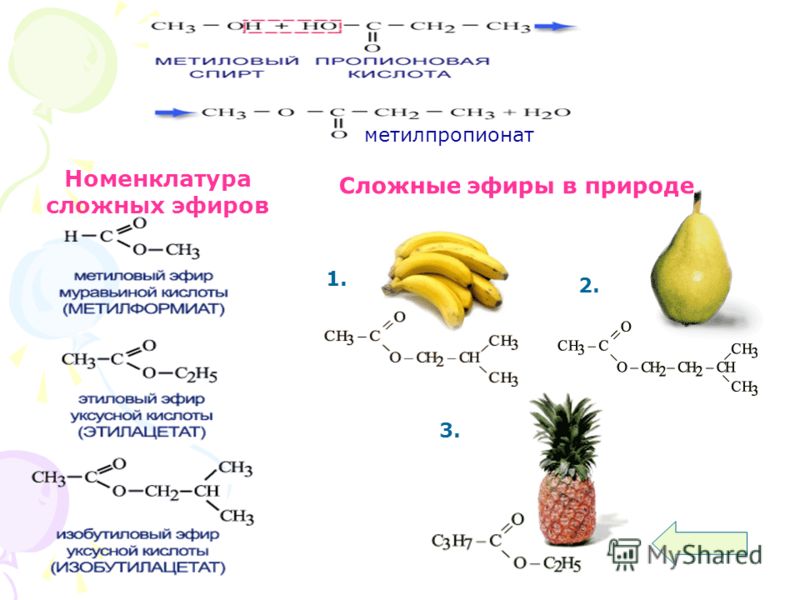 2
2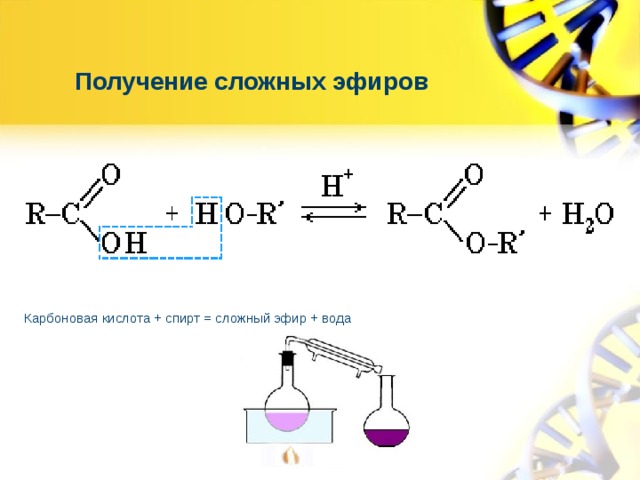 Физические свойства сложных эфиров …………………..
Физические свойства сложных эфиров …………………..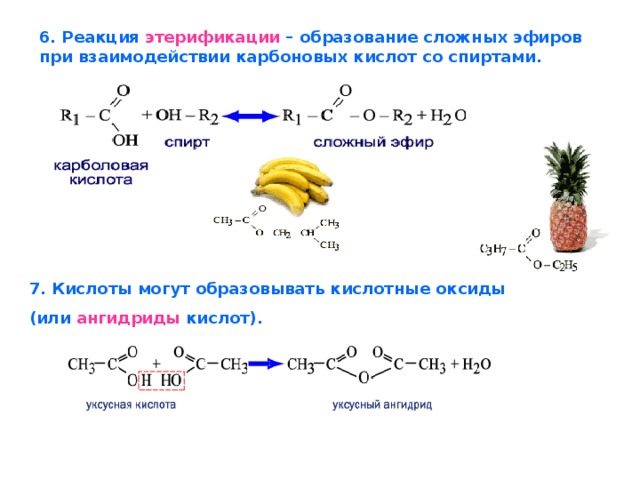 Физические свойства аминов …………………………………………..
Физические свойства аминов …………………………………………..


 org 2022
org 2022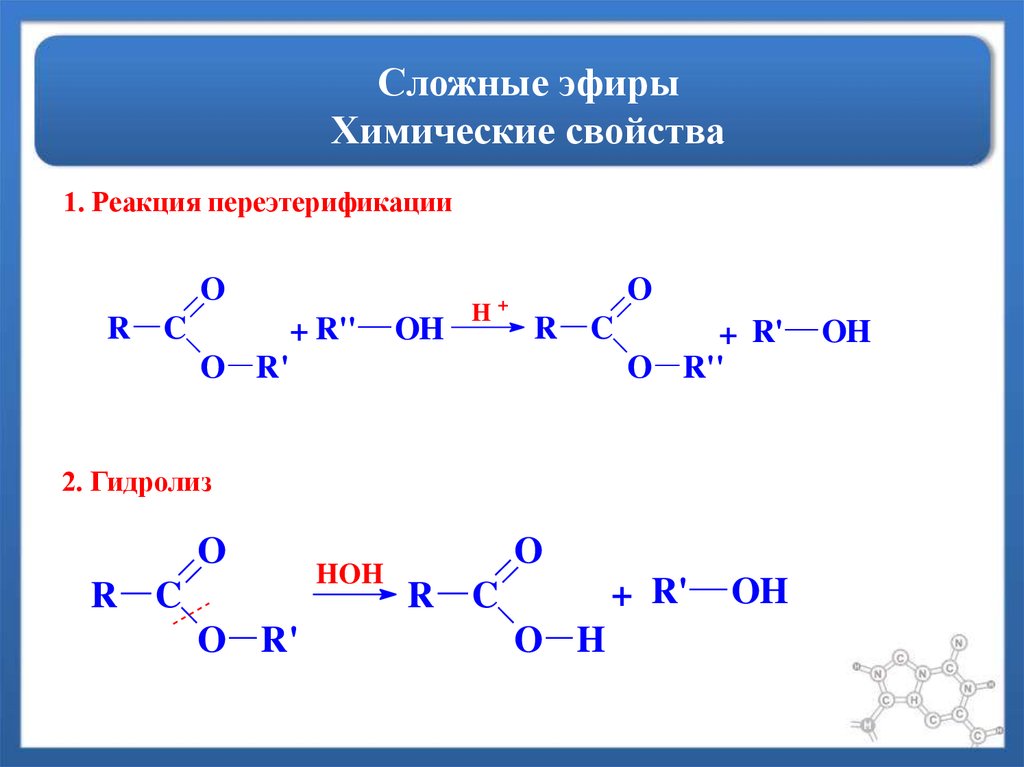 , Бремнер Дж. Б., Чокчайсири Р. и Суксамрарн А. (2008). ХимИнформ Реферат: Антимикобактериальная активность циннаматных эфиров тритерпенов бетулиновой, олеаноловой и урсоловой кислот. Химинформ, 39(32), вып. дои: 10.1002 / chin.200832182
, Бремнер Дж. Б., Чокчайсири Р. и Суксамрарн А. (2008). ХимИнформ Реферат: Антимикобактериальная активность циннаматных эфиров тритерпенов бетулиновой, олеаноловой и урсоловой кислот. Химинформ, 39(32), вып. дои: 10.1002 / chin.200832182 , Бремнер Дж. Б., Чокчайсири Р. и Суксамрарн А. (2008). ХимИнформ Реферат: Антимикобактериальная активность циннаматных эфиров тритерпенов бетулиновой, олеаноловой и урсоловой кислот. ХимИнформ, 39(32), нет. дои: 10.1002 / chin.200832182
, Бремнер Дж. Б., Чокчайсири Р. и Суксамрарн А. (2008). ХимИнформ Реферат: Антимикобактериальная активность циннаматных эфиров тритерпенов бетулиновой, олеаноловой и урсоловой кислот. ХимИнформ, 39(32), нет. дои: 10.1002 / chin.200832182 В. А., Дженнискенс, Л. Х. Д., Вейнберг, Дж. Б. П. А., и де Гроот, А. (1992). Химические последствия сквозного взаимодействия по четырем s-связям в сложных эфирах моносульфоната пергидронафталин-1,4-диола. В Тезисы 9-й Междунар. конф. Органический синтез, Монреаль, Канада (стр. 105)
В. А., Дженнискенс, Л. Х. Д., Вейнберг, Дж. Б. П. А., и де Гроот, А. (1992). Химические последствия сквозного взаимодействия по четырем s-связям в сложных эфирах моносульфоната пергидронафталин-1,4-диола. В Тезисы 9-й Междунар. конф. Органический синтез, Монреаль, Канада (стр. 105)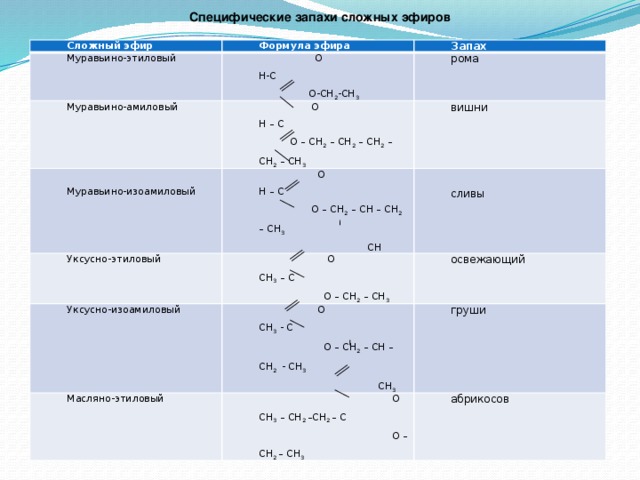 В.А., Дженнискенс, Л.Х.Д., Вейнберг, Дж.Б.П.А. и де Гроот, А. 1992, Химические последствия сквозного взаимодействия четырех s-связей в сложных эфирах моносульфонатов пергидронафталин-1,4-диола. в Тезисы 9-й Междунар. конф. Органический синтез, Монреаль, Канада. стр. 105.
В.А., Дженнискенс, Л.Х.Д., Вейнберг, Дж.Б.П.А. и де Гроот, А. 1992, Химические последствия сквозного взаимодействия четырех s-связей в сложных эфирах моносульфонатов пергидронафталин-1,4-диола. в Тезисы 9-й Междунар. конф. Органический синтез, Монреаль, Канада. стр. 105.