Содержание
Сложные эфиры. Химические свойства
Алканы
Строение, номенклатура, изомерия
Способы получения
Химические свойства
Решение цепочек превращений
Пройти тест
Алкены
Строение, номенклатура, изомерия
Способы получения
Химические свойства
Решение цепочек превращений, часть 1
Решение цепочек превращений, часть 2
Пройти тест
Алкины
Строение, номенклатура, изомерия
Способы получения
Химические свойства
Пройти тест
Алкадиены
Строение, номенклатура, изомерия
Способы получения
Химические свойства
Каучуки
Пройти тест
Циклоалканы
Строение, номенклатура, изомерия
Способы получения
Химические свойства
Пройти тест
Бензол
Строение, номенклатура, изомерия
Способы получения
Химические свойства
Пройти тест
Спирты
Номенклатура, классификация, изомерия
Строение, физические свойства
Способы получения
Химические свойства
Пройти тест
Многоатомные спирты
Номенклатура, физические свойства, применение
Способы получения
Химические свойства
Пройти тест
Фенолы
Строение, номенклатура
Способы получения
Химические свойства
Пройти тест
Альдегиды и кетоны
Строение, номенклатура, изомерия
Способы получения
Химические свойства
Пройти тест
Карбоновые кислоты
Строение, номенклатура, изомерия
Способы получения
Химические свойства
Пройти тест
Амины
Строение, номенклатура, изомерия
Способы получения
Химические свойства
Анилин
Пройти тест
Сложные эфиры
Строение, номенклатура, применение
Способы получения
Химические свойства
Пройти тест
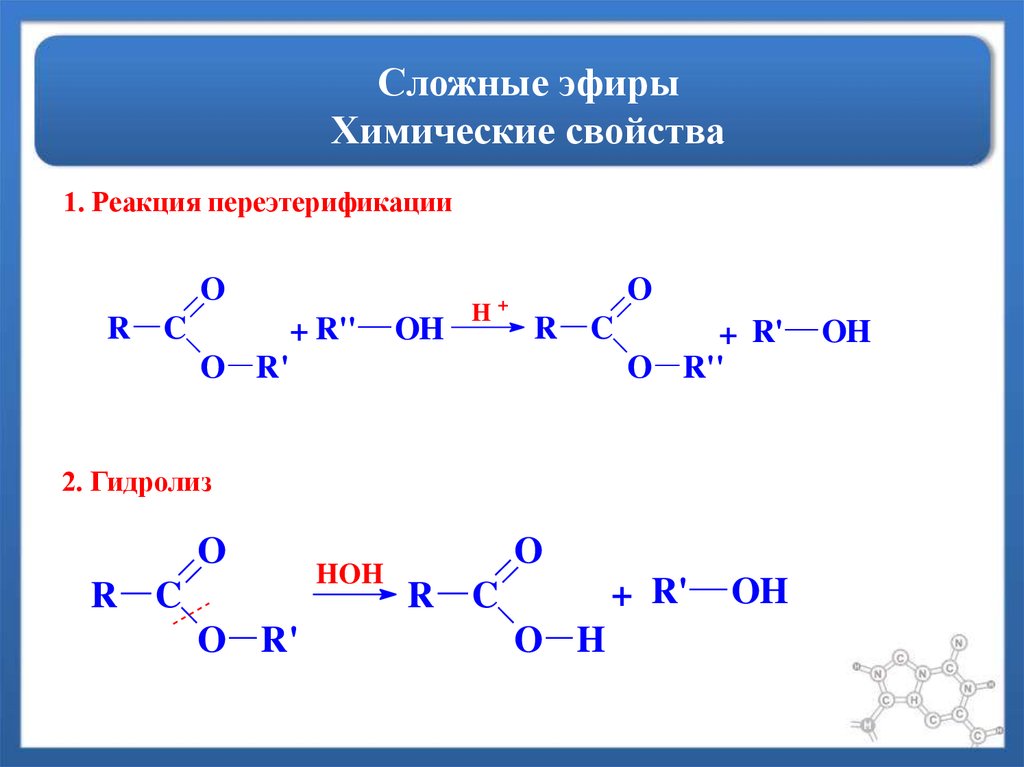
Химические свойства сложных эфиров
1.
Реакция гидролиза, или омыления. Так,
как реакция этерификации является
обратимой, поэтому в присутствии кислот
протекает обратная реакция гидролиза:
Реакция гидролиза
катализируется и щелочами; в этом случае
гидролиз необратим, так как получающаяся
кислота со щелочью образует соль:
2. Реакция присоединения.
Сложные эфиры, имеющие в своем составе
непредельную кислоту или спирт, способны
к реакциям присоединения.
3. Реакция восстановления.
Восстановление сложных эфиров водородом
приводит к образованию двух спиртов:
4. Реакция образования
амидов. Под действием аммиака сложные
эфиры превращаются в амиды кислот и
спирты:
Химические свойства простых эфиров.
Простые
эфиры представляют собой бесцветные
жидкости с характерным (так называемым
эфирным) запахом, практически не
смешиваются с водой и неограниченно
смешиваются с большинством органических
растворителей. В сравнении со спиртами и
В сравнении со спиртами и
альдегидами простые эфиры химически
менее активны, например, они устойчивы
к действию щелочей и щелочных металлов
(металлический Na применяют даже для
удаления следов воды из эфиров). В отличие
от щелочей, кислоты расщепляют эфирный
фрагмент, для этого чаще применяют
галоидоводороды, особенно эффективен
HI. При комнатной температуре образуется
и спирт, и йодистый алкил (рис. 2А), а при
нагревании – йодистый алкил и вода
(рис.2А), т.е. реакция протекает более
глубоко. Простые эфиры, содержащие
ароматические циклы, более устойчивы
к расщеплению, для них возможна только
стадия, аналогичная А, образуется фенол,
а йод к ароматическому ядру не
присоединяется (рис. 2В).
Рис.
2. РАСЩЕПЛЕНИЕ
ЭФИРНОГО ФРАГМЕНТА при
действии HI
Атом
кислорода в эфирном фрагменте содержит
свободную электронную пару С–Ö–C,
благодаря этому эфиры оказываются
способными присоединять различные
нейтральные молекулы, склонные к
образованию донорно-акцепторных связей,
атом кислорода дает для образования
связи электронную пару (донор), роль
акцептора, принимающего эту пару, играет
присоединяющаяся молекула или ион (см.
АМИНЫ).
В результате возникают комплексные
соединения (рис. 3).
Рис.
3. ОБРАЗОВАНИЕ
КОМПЛЕКСНЫХ СОЕДИНЕНИЙ С УЧАСТИЕМ
ПРОСТЫХ ЭФИРОВ
В
присутствии кислорода воздуха на свету
эфиры частично окисляются с образованием
перекисных соединений R–O–O–R’, которые
способны взрываться даже при слабом
нагреве, поэтому, приступая к перегонке
эфира, его предварительно обрабатывают
восстановителями, разрушающими перекиси,
часто вполне достаточно хранить эфир
над металлическим Na.
Применение Применение сложных эфиров неорганических кислот
Эфиры борной
кислоты —
триалкилбораты
— легко получаются нагреванием спирта
и борной кислоты с добавкой концентрированной
серной кислоты. Борнометиловый эфир
(триметилборат) кипит при 65° С, борноэтиловый
(триэтилборат) — при 119° С. Эфиры борной
кислоты легко гидролизуются водой.
Реакция с борной
кислотой служит для установления
конфигурации многоатомных спиртов и
была неоднократно использована при
изучении Сахаров.
Ортокремневые
эфиры —
жидкости. Метиловый эфир кипит при 122°
С, этиловый при 156° С. Гидролиз водой
проходит легко уже на холоду, но идет
постепенно и при недостатке воды приводит
к образованию высокомолекулярных
ангидридных форм, в которых атомы кремния
соединены друг с другом через кислород
(силоксановые
группировки):
Эти высокомолекулярные
вещества (полиалкоксисилоксаны)
находят применение в качестве связующих,
выдерживающих довольно высокую
температуру, в частности для покрытия
поверхности форм для точной отливки
металла.
Аналогично SiCl4
реагируют диалкилдихлорсиланы, например
((СН3)2SiCl2,
образуя диалкоксильные производные:
Их гидролиз при
недостатке воды дает так называемые
полиалкилсилоксаны:
Они обладают разным
(но очень значительным) молекулярным
весом и представляют собой вязкие
жидкости, используемые в качестве
термостойких смазок, а при еще более
длинных силоксановых скелетах —
термостойкие электроизоляционные смолы
и каучуки.
Эфиры ортотитановой
кислоты. Их
получают аналогично ортокремневым
эфирам по реакции:
Это жидкости, легко
гидролизующиеся до метилового спирта
и TiO2
применяются для пропитки тканей с целью
придания им водонепроницаемости.
Эфиры азотной
кислоты. Их
получают действием на спирты смеси
азотной и концентрированной серной
кислот. Метилнитрат СН3ONO2,
(т. кип. 60° С) и этилнитрат C2H5ONO2
(т. кип. 87° С) при осторожной работе можно
перегнать, но при нагревании выше
температуры кипения или при детонации
они очень сильно взрывают.
Нитраты этиленгликоля
и глицерина, неправильно называемые
нитрогликолем и нитроглицерином,
применяются в качестве взрывчатых
веществ. Сам нитроглицерин (тяжелая
жидкость) неудобен и опасен в обращении.
Пентрит — тетранитрат
пентаэритрита С(CH2ONO2)4,
получаемый обработкой пентаэритрита
смесью азотной и серной кислот, — тоже
сильное взрывчатое вещество бризантного
действия.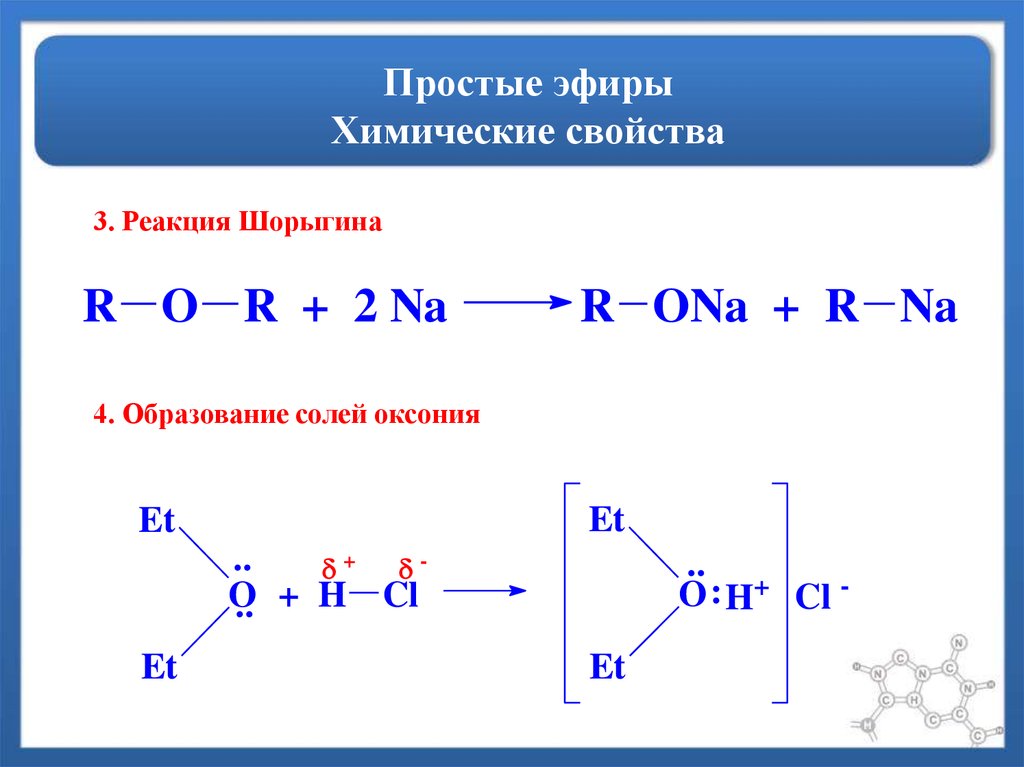
Нитрат глицерина и
нитрат пентаэритрита обладают
сосудорасширяющим эффектом и
применяются как симптоматические
средства при стенокардии.
Эфиры фосфорной
кислоты —
высококипящие жидкости, лишь очень
медленно гидролизуемые водой, быстрее
щелочами и разбавленными кислотами.
Эфиры, образованные этерификацией
высших спиртов (и фенолов), находят
применение как пластификаторы пластмасс
и для извлечения солей уранила из
водных растворов.
Известны эфиры типа
(RO)2S═O, но они не имеют практического
значения.
Из алкилсульфатов
— солей сложных эфиров высших спиртов
и серной кислоты производят моющие
средства. В общем виде образование таких
солей можно изобразить уравнениями:
Эти соли содержат
в молекуле от 12 до 14 углеродных атомов
и обладают очень хорошими моющими
свойствами. Кальциевые и магниевые соли
растворимы в воде, а потому такие мыла
моют и в жесткой воде. Алкилсульфаты
Алкилсульфаты
содержатся во многих стиральных порошках.
Они и обладают
прекрасными моющими способностями.
Принцип их действия тот же, что и у
обычного мыла, только кислотный остаток
серной кислоты лучше адсорбируется
частицами загрязнения, а кальцевые соли
алкилсерной кислоты растворимы в воде,
поэтому это моющее средство стирает и
в жесткой, и в морской воде.
15.6: Физические свойства сложных эфиров
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 16030
- Анонимный
- LibreTexts
Цели обучения
- Сравните точки кипения сложных эфиров со спиртами с аналогичной молекулярной массой.

- Сравните растворимость сложных эфиров в воде с растворимостью сопоставимых алканов и спиртов в воде.
Молекулы сложного эфира полярны, но не имеют атома водорода, присоединенного непосредственно к атому кислорода. Поэтому они не способны вступать в межмолекулярные водородные связи друг с другом и, таким образом, имеют значительно более низкие точки кипения, чем их аналоги изомерных карбоновых кислот. Однако, поскольку молекулы сложных эфиров могут образовывать водородные связи с молекулами воды, сложные эфиры с низкой молекулярной массой в некоторой степени растворимы в воде. Пограничная растворимость наблюдается у тех молекул, которые имеют от трех до пяти атомов углерода. В таблице \(\PageIndex{1}\) перечислены физические свойства некоторых распространенных эфиров.
Сложные эфиры являются распространенными растворителями. Этилацетат используется для извлечения органических растворенных веществ из водных растворов, например, для удаления кофеина из кофе. Он также используется для удаления лака для ногтей и краски. Нитрат целлюлозы растворяют в этилацетате и бутилацетате с образованием лаков. Растворитель испаряется по мере «высыхания» лака, оставляя на поверхности тонкую пленку. Высококипящие сложные эфиры применяют в качестве пластификаторов (пластификаторов) для хрупких пластмасс.
Он также используется для удаления лака для ногтей и краски. Нитрат целлюлозы растворяют в этилацетате и бутилацетате с образованием лаков. Растворитель испаряется по мере «высыхания» лака, оставляя на поверхности тонкую пленку. Высококипящие сложные эфиры применяют в качестве пластификаторов (пластификаторов) для хрупких пластмасс.
| Краткая структурная формула | Имя | Молярная масса | Температура плавления (°C) | Температура кипения (°С) | Аромат |
|---|---|---|---|---|---|
| HCOOCH 3 | метилформиат | 60 | −99 | 32 | |
| HCOOCH 2 CH 3 | этилформиат | 74 | −80 | 54 | ром |
| CH 3 COOCH 3 | метилацетат | 74 | −98 | 57 | |
| СН 3 СООЧ 2 СН 3 | этилацетат | 88 | −84 | 77 | |
| CH 3 CH 2 CH 2 COOCH 3 | метилбутират | 102 | −85 | 102 | яблоко |
| СН 3 CH 2 CH 2 COOCH 2 CH 3 | этилбутират | 116 | −101 | 121 | ананас |
| CH 3 COO(CH 2 ) 4 CH 3 | пентилацетат | 130 | −71 | 148 | груша |
| CH 3 COOCH 2 CH 2 CH(CH 3 ) 2 | изопентилацетат | 130 | −79 | 142 | банан |
| CH 3 COOCH 2 C 6 H 5 | бензилацетат | 150 | −51 | 215 | жасмин |
| CH 3 CH 2 CH 2 COO(CH 2 ) 4 CH 3 | пентилбутират | 158 | −73 | 185 | абрикос |
| CH 3 COO(CH 2 ) 7 CH 3 | октилацетат | 172 | −39 | 210 | оранжевый |
Сложные эфиры имеют полярные связи, но не образуют водородных связей и, следовательно, занимают промежуточное положение по температурам кипения между неполярными алканами и спиртами, которые образуют водородные связи. Молекулы сложных эфиров могут образовывать водородные связи с водой, поэтому сложные эфиры с низкой молекулярной массой в некоторой степени растворимы в воде.
Молекулы сложных эфиров могут образовывать водородные связи с водой, поэтому сложные эфиры с низкой молекулярной массой в некоторой степени растворимы в воде.
Эта страница под названием 15.6: Физические свойства сложных эфиров распространяется под лицензией CC BY-NC-SA 3.0 и была создана, изменена и/или курирована Anonymous с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts. ; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Аноним
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Программа OER или Publisher
- Издатель, имя которого нельзя называть
- Показать страницу TOC
- № на стр.

- Теги
- сложные эфиры
- source@https://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological
Физические свойства сложных эфиров
Цели обучения
- Сравнить температуры кипения сложных эфиров со спиртами аналогичной молекулярной массы.
- Сравните растворимость сложных эфиров в воде с растворимостью сопоставимых алканов и спиртов в воде.
Молекулы сложного эфира полярны, но не имеют атома водорода, присоединенного непосредственно к атому кислорода. Поэтому они не способны вступать в межмолекулярные водородные связи друг с другом и, таким образом, имеют значительно более низкие точки кипения, чем их аналоги изомерных карбоновых кислот. Однако, поскольку молекулы сложных эфиров могут образовывать водородные связи с молекулами воды, сложные эфиры с низкой молекулярной массой в некоторой степени растворимы в воде. Пограничная растворимость наблюдается у тех молекул, которые имеют от трех до пяти атомов углерода. В таблице 15.4 «Физические свойства некоторых сложных эфиров» перечислены физические свойства некоторых распространенных сложных эфиров.
Пограничная растворимость наблюдается у тех молекул, которые имеют от трех до пяти атомов углерода. В таблице 15.4 «Физические свойства некоторых сложных эфиров» перечислены физические свойства некоторых распространенных сложных эфиров.
Примечание
Сложные эфиры являются распространенными растворителями. Этилацетат используется для извлечения органических растворенных веществ из водных растворов, например, для удаления кофеина из кофе. Он также используется для удаления лака для ногтей и краски. Нитрат целлюлозы растворяют в этилацетате и бутилацетате с образованием лаков. Растворитель испаряется по мере «высыхания» лака, оставляя на поверхности тонкую пленку. Высококипящие сложные эфиры применяют в качестве пластификаторов (пластификаторов) для хрупких пластмасс.
Таблица 15.4 Физические свойства некоторых сложных эфиров
| Краткая структурная формула | Имя | Молярная масса | Температура плавления (°C) | Температура кипения (°С) | Аромат |
|---|---|---|---|---|---|
| HCOOCH 3 | метилформиат | 60 | −99 | 32 | |
| HCOOCH 2 CH 3 | этилформиат | 74 | −80 | 54 | ром |
| CH 3 COOCH 3 | метилацетат | 74 | −98 | 57 | |
| CH 3 COOCH 2 CH 3 | этилацетат | 88 | −84 | 77 | |
| CH 3 CH 2 CH 2 COOCH 3 | метилбутират | 102 | −85 | 102 | яблоко |
| CH 3 CH 2 CH 2 COOCH 2 CH 3 | этилбутират | 116 | −101 | 121 | ананас |
| CH 3 COO(CH 2 ) 4 CH 3 | пентилацетат | 130 | −71 | 148 | груша |
| CH 3 COOCH 2 CH 2 CH(CH 3 ) 2 | изопентилацетат | 130 | −79 | 142 | банан |
| CH 3 COOCH 2 C 6 H 5 | бензилацетат | 150 | −51 | 215 | жасмин |
| CH 3 CH 2 CH 2 COO(CH 2 ) 4 CH 3 | пентилбутират | 158 | −73 | 185 | абрикос |
| CH 3 COO(CH 2 ) 7 CH 3 | октилацетат | 172 | −39 | 210 | оранжевый |
Упражнения по обзору концепции
Какое соединение имеет более высокую температуру кипения — CH 3 CH 2 CH 2 CH 2 OH или CH 3 COOCH 3 ? Объяснять.

Какое соединение лучше растворимо в воде — метилбутират или масляная кислота? Объяснять.
Ответы
CH 3 CH 2 CH 2 CH 2 OH, так как имеется межмолекулярная водородная связь (В CH 3 COOCH 3 .)
масляная кислота из-за водородной связи с водой
Ключевые выводы
- Сложные эфиры имеют полярные связи, но не образуют водородных связей, и поэтому имеют промежуточную температуру кипения между неполярными алканами и спиртами, которые образуют водородные связи.
- Молекулы сложных эфиров могут образовывать водородные связи с водой, поэтому сложные эфиры с низкой молекулярной массой в некоторой степени растворимы в воде.
Упражнения
Какое соединение имеет более высокую температуру кипения — CH 3 CH 2 CH 2 COOH или CH 3 CH 2 CH 2 COOCH 3 ? Объяснять.