Содержание
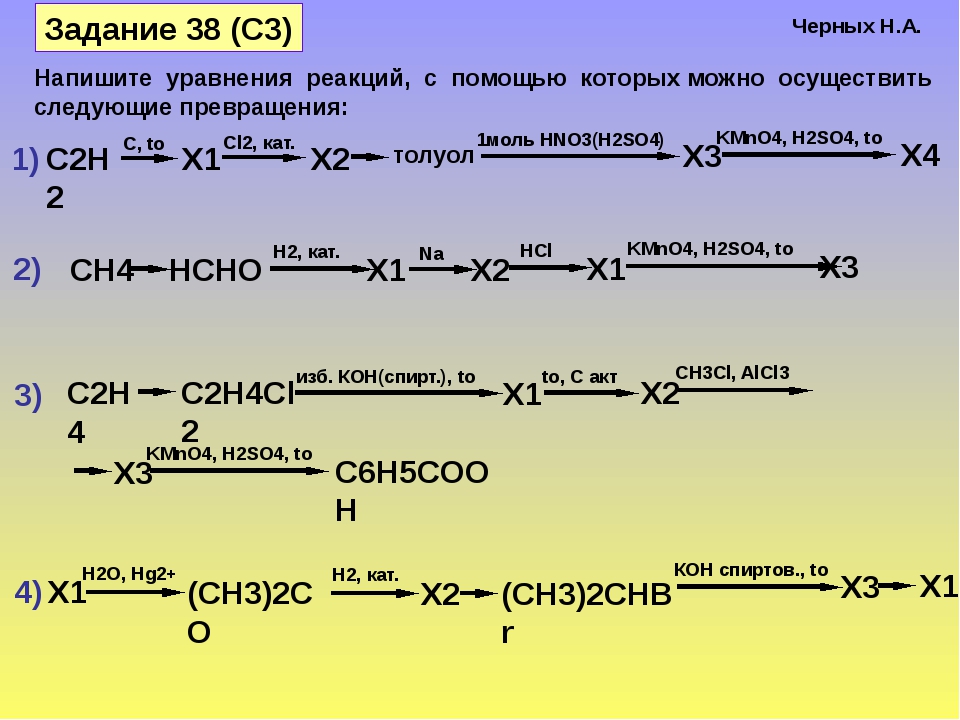
Синтез уксусноизоамилового эфира.
Уравнения
основных реакций:
Реактивы
Основные.
Уксусная кислота (ледяная) | 14,3 см3 |
Изоамиловый спирт | 27,7 см3 |
Вспомогательные
Серная кислота (4 капли) |
Сода Nа2СО3, |
Сульфат натрия или сульфат магния |
Посуда
и приборы
Круглодонная колба | 2 шт. |
Холодильник Либиха | 1 шт. |
Водоотделитель (ловушка Дина-Старка) | 1 шт. |
Делительная воронка | 1 шт. |
Аллонж | 1 шт. |
Колба-приемник | 1 шт. |
Термометр | 1 шт. |
Выполнение синтеза
В круглодонную колбу
на 100 см3
с ловушкой и обратным водяным холодильником
(Приложение В, рис. 6) помещают смесь 14,3
см3
ледяной уксусной кислоты и 27,7 см3
изоамилового спирта. Прибавляют 4 капли
Прибавляют 4 капли
концентрированной серной кислоты,
бросают несколько «кипелок» и нагревают
на электроплитке (Приложение В, рис.6).
Реакционная смесь должна кипеть.
Постепенно в ловушке собирается жидкость,
разделяющаяся на два слоя. Реакция
считается законченной, когда количество
выделившейся воды (нижний слой) будет
равно вычисленному по уравнению реакции.
Верхний слой из ловушки с помощью
делительной воронки возвращают обратно
в колбу.
После охлаждения
реакционную смесь из колбы переливают
в делительную воронку, промывают водой,
затем 5%-ным раствором кальцинированной
соды и вновь водой (до нейтральной
реакции по лакмусу). Уксусноизоамиловый
эфир сушат безводным сульфатом натрия
или магния (до прозрачности раствора).
Затем продукт перегоняют (Приложение
В, рис. 2). Собирают фракцию, кипящую при
138-142С.
Выход уксусноизоамилового эфира 21
г.
По аналогичной методике можно синтезировать
другие амиловые (пентиловые), бутиловые
и гексиловые спирты.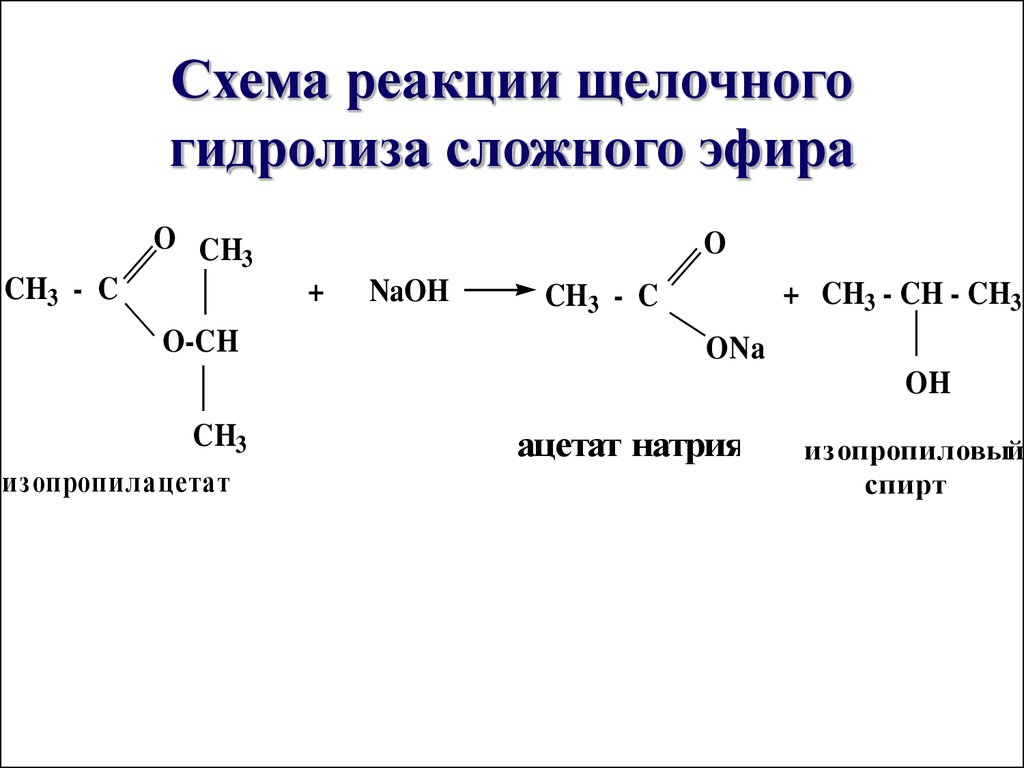
Техника
безопасности.Концентрированная
уксусная кислота – едкая жидкость с
резким удушающим запахом. Все
подготовительные операции с ней проводить
только под тягой. Сильно разъедает кожу,
поэтому при попадании на нее немедленно
смыть обильной струей воды и место ожога
обработать раствором питьевой соды и
опять водой. Сложные эфиры и этанол –
летучие огнеопасные жидкости, при работе
с ними следует удалить источники
открытого огня. Обладают слабым
наркотическим действием.
Присоединение по карбонильной группе.
Электронное строение карбонильной
группы. Присоединение по двойной
углерод-кислородной связи как нуклеофильный
процесс. Относительная активность в
этих реакциях альдегидов и кетонов.
Реакции оксосоединений с синильной
кислотой, гидроксиламином, гидросульфитом
натрия, аммиаком, гидразином и его
фенильными производными, образование
полуацеталей и ацеталей.
Циклическая и линейная полимеризация
алифатических альдегидов.
Магнийорганические синтезы первичных,
вторичных и третичных спиртов.
Синтез 2-метилбутанола-2
Уравнения основных
реакций:
Реактивы
Этил бромистый | 46 г |
Магний (стружки) | 9.6 г |
Ацетон абсолютный (безводный) | 22 г |
Эфир абсолютный (безводный) | 130 см 3 |
Посуда
и приборы:
Трехгорлая реакционная колба (500 см3) | 1 шт. |
Мешалка с герметичным уплотнением | 1 шт. |
Капельная воронка | 1 шт. |
Холодильник обратный | 1 шт. |
Хлоркальциевая трубка | 1 шт. |
Все
части прибора хорошо высушить!
Выполнение синтеза
Синтез органического соединения — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
(Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Синтез органического соединения
Лабораторная работа
СИНТЕЗ ОРГАНИЧЕСКОГО СОЕДИНЕНИЯ
Органический синтез – раздел органической
химии и технологии, изучающий различные
аспекты получения органических соединений
(способы, методики, идентификация,
аппаратура и др.), а также сам процесс
получения веществ.
3. Цель органического синтеза
ЦЕЛЬ ОРГАНИЧЕСКОГО СИНТЕЗА
Получение вещества с ценными физическими,
химическими и биологическими свойствами, имеющего
какое-либо практическое применение или служащего
исходным материалом для дальнейших исследований.
Органический синтез проводится также для
доказательства строения природных и искусственно
получаемых веществ.
Современный органический синтез многогранен и
позволяет получать практически любые органические
молекулы.
4. реакции органического синтеза
РЕАКЦИИ ОРГАНИЧЕСКОГО СИНТЕЗА
Гидрирование – присоединение водорода по кратной связи.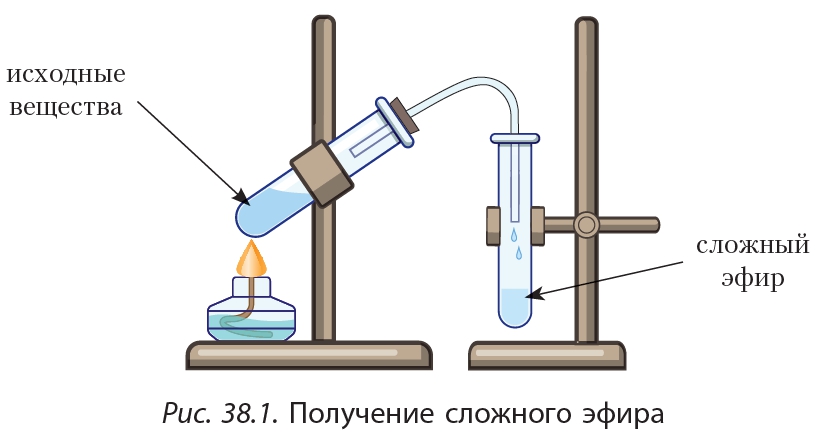
Дегидрирование — отщепление водорода с образованием кратной связи.
Гидратация – присоединение воды по кратной связи с образованием спирта.
Дегидратация – отщепление воды с образованием кратной связи.
Алкилирование – обмен водорода на углеводородный радикал.
Ацилирование – введение в молекулу остатка карбоновой кислоты (ацильной
группы)
Циклизация – образование циклической структуры в молекуле.
Галогенирование – введение атома галогена в молекулу посредством
обмена водорода на галоген или присоединения по кратной связи.
Нитрование – обмен водорода на группу NO2.
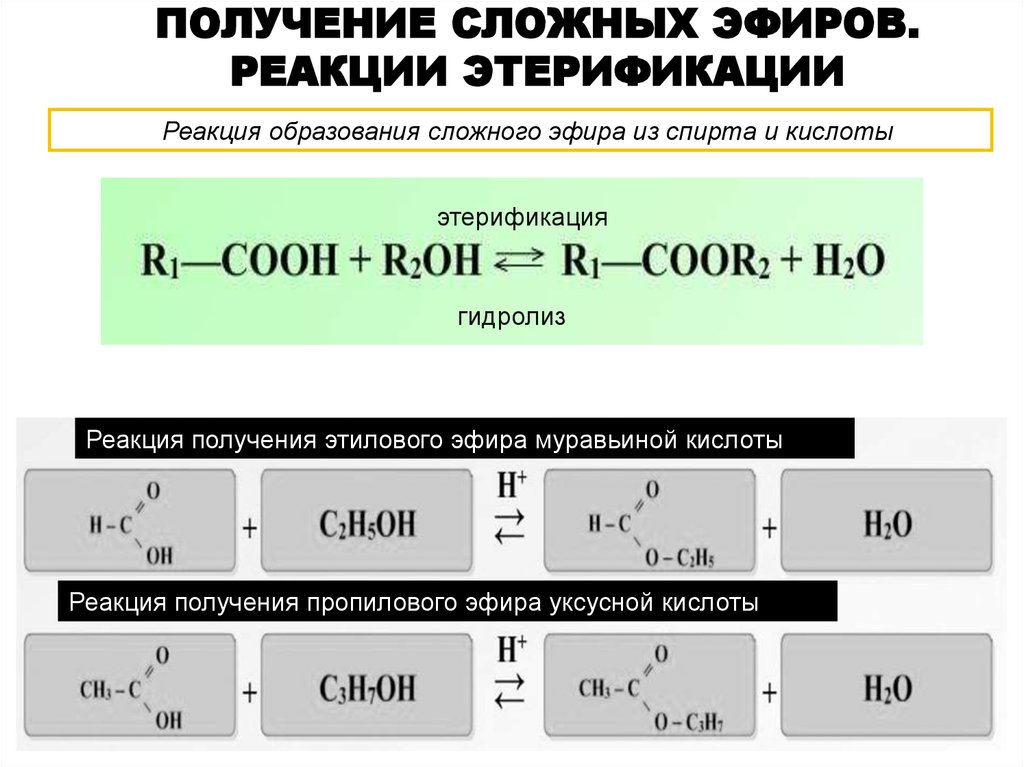
Этерификация – взаимодействие органической или кислородсодержащей
неорганичсекой кислоты со спиртом с получением сложных эфиров.
Окисление – в узком смысле – внедрение кислорода в молекулу, в широком –
любое изменение в молекуле, приводящее к увеличению степени окисления
углерода.
Сульфирование – обмен водорода на сульфогруппу.
Полимеризация и др.
5. Этапы синтеза органического соединения
ЭТАПЫ СИНТЕЗА ОРГАНИЧЕСКОГО
СОЕДИНЕНИЯ
выбор пути синтеза;
расчет количеств исходных продуктов;
экспериментальное проведение реакций;
выделение и очистка целевого продукта,
контроль чистоты;
подтверждение состава и строения
полученного вещества.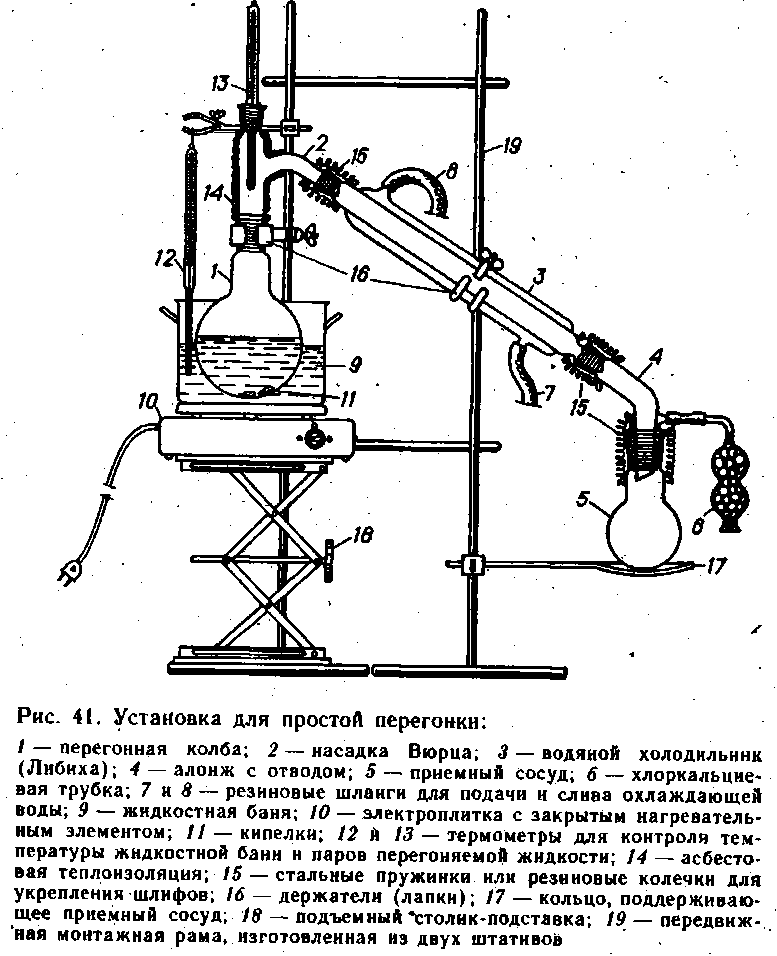
6. Выбор пути синтеза
ВЫБОР ПУТИ СИНТЕЗА
Стандартные синтезы – это синтезы веществ хорошо изученных
классов, общие методы получения которых достаточно полно
разработаны и практически неоднократно реализованы.
Очевидные синтезы – выбор исходных соединений и запись пути
синтеза не вызывает особых затруднений, хотя осуществление этого
очевидного плана на практике зачастую требует большого труда и
искусства.
Сложные синтезы – это синтезы многостадийные, в которых целевое
соединение может быть получено различными путями, из разных
исходных продуктов, и результаты отдельных превращений не вполне
очевидны.
Знание свойств соединений и выработка стратегии синтеза еще не
может дать практического результата без освоения техники,
общепринятых приемов и способов лабораторной работы, типовых
приборов и установок из стекла, используемых в синтетической
органической химии.
7. Расчет количеств исходных продуктов
РАСЧЕТ КОЛИЧЕСТВ ИСХОДНЫХ ПРОДУКТОВ
Наиболее важной характеристикой методики
синтеза является мольное соотношение
вводимых в реакцию продуктов.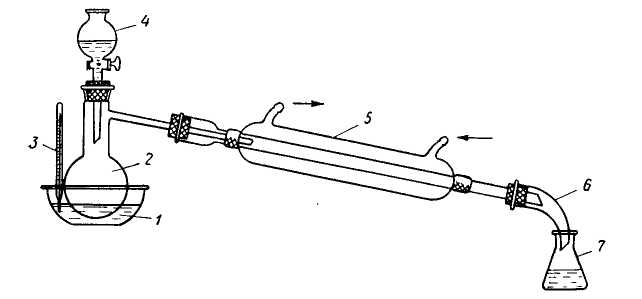
Два варианта расчета синтеза:
прямой расчет — когда задается количество
одного из исходных продуктов
обратный расчет — когда задано количество
получаемого целевого продукта.
8. Выделение и очистка целевого продукта. Контроль чистоты
ВЫДЕЛЕНИЕ И ОЧИСТКА ЦЕЛЕВОГО ПРОДУКТА.
КОНТРОЛЬ ЧИСТОТЫ
В результате экспериментального проведения
реакций обычно получается смесь, в состав
которой помимо основного вещества могут
входить растворители и некоторые количества
исходных реагентов и продуктов промежуточных
и побочных реакций.
Методы выделения и очистки целевого
соединения зависят от физических и химических
свойств разделяемых веществ. В стандартных
синтезах очистка обычно описывается в
прописях.
9. разделение органических веществ
РАЗДЕЛЕНИЕ ОРГАНИЧЕСКИХ ВЕЩЕСТВ
Вещества, находящиеся в осадке, обычно отделяют от
раствора фильтрованием или центрифугированием.
Смеси твердых веществ разделяются
кристаллизацией или возгонкой.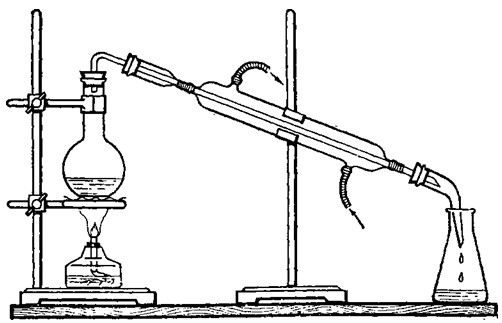
Различные виды перегонок (простая перегонка,
перегонка в вакууме, перегонка с водяным паром,
экстрактивная и азеотропная перегонки,
ректификация и др.) дают возможность разделять
смеси жидких, а иногда и твердых веществ.
Различия в растворимости органических соединений
используются при выделении и очистке их
экстрагированием.
10. удаление остатков воды
УДАЛЕНИЕ ОСТАТКОВ ВОДЫ
твердые вещества сушат на воздухе или под
вакуумом, в сушильных шкафах при
повышенной температуре, в эксикаторах с
поглощающими влагу веществами.
жидкости сушат при помощи осушающих
веществ, связывающих воду.
газы сушат вымораживанием влаги или
пропусканием их через слой осушающего
агента.
11. контроль наличия примесей в полученном соединении
КОНТРОЛЬ НАЛИЧИЯ ПРИМЕСЕЙ В
ПОЛУЧЕННОМ СОЕДИНЕНИИ
Сопоставление его физических констант (температур
кипения и плавления, показателя преломления и др.) с их
справочными значениями.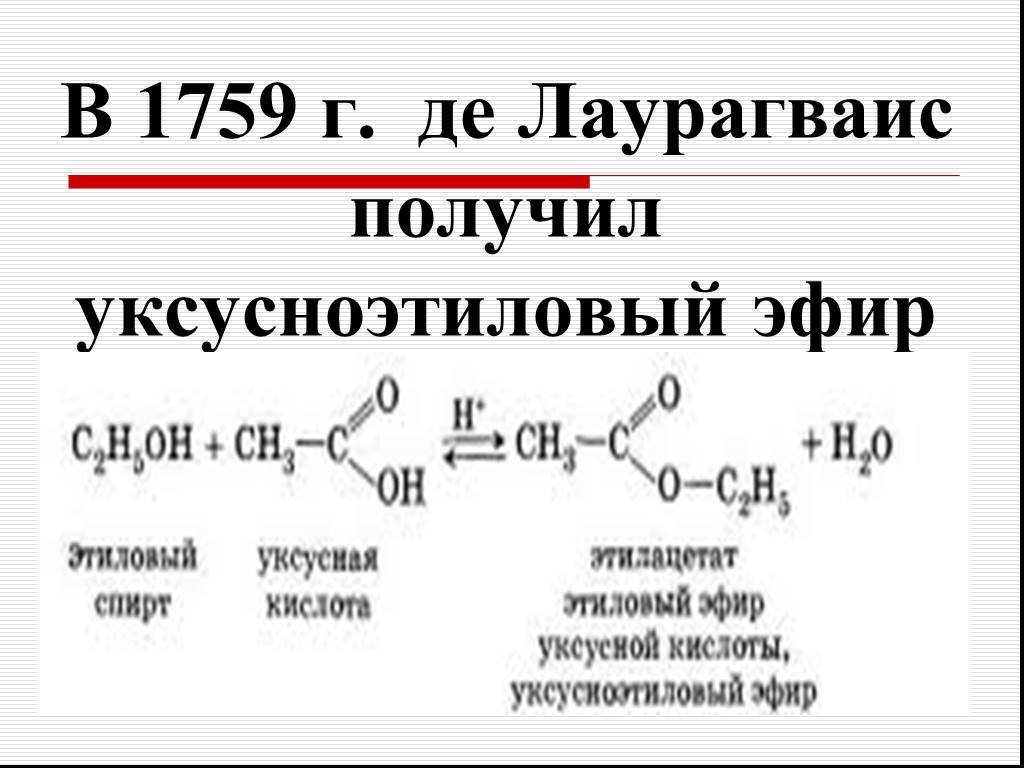
В случае отсутствия справочных данных о чистоте продукта
можно судить по достижению неизменных значений
физических констант в процессе многократно
повторяемых циклов очистки.
Чистота вещества проверяется также спектральными и
хроматографическими методами, с помощью химического
анализа.
При проведении органических синтезов часто бывает
достаточным достижение 97…99% чистоты целевого
продукта.
12. Подтверждение состава и строения полученного органического соединения
ПОДТВЕРЖДЕНИЕ СОСТАВА И СТРОЕНИЯ
ПОЛУЧЕННОГО ОРГАНИЧЕСКОГО СОЕДИНЕНИЯ
Заключительный этап синтеза органического
соединения — сопоставление его физических
констант (температур кипения или плавления,
показателя преломления, удельного
вращения и т.д.) со справочными
значениями.
Химическая идентификация заключается в
проведении элементного или
функционального анализов вещества
13. Лабораторная работа №2
ЛАБОРАТОРНАЯ РАБОТА №2
Синтез уксусно-изоамилового эфира
Цель работы:
ознакомиться с методикой проведения стандартного синтеза
органического соединения, методикой выделения, очистки и
идентификации полученного органического соединения;
синтезировать уксусно-изоамиловый эфир реакцией этерификации
со смещением равновесия;
очистить полученный продукт перегонкой;
провести идентификацию уксусно-изоамилового эфира и контроль
чистоты.
Этерификация – взаимодействие органической или
кислородсодержащей неорганической кислоты со спиртом с
образованием сложных эфиров.
14. Уравнения основных и побочных реакций:
УРАВНЕНИЯ ОСНОВНЫХ И ПОБОЧНЫХ РЕАКЦИЙ:
O
h4C
Ch4
C
Ch3
OH + HO
CH
Ch3
O
h3SO4
Ch4
C
Ch4
h4C
O
Ch3
CH
Ch3
Ch4
+ h3O
Побочные реакции:
Ch4
Ch4
CH
h4C
Ch3
Ch3
OH + HO
Ch3
Ch4
CH
Ch3
Ch4
Ch4
CH
h4C
Ch3
Ch3
Ch4
CH
h4C
Ch3
Ch3
+
OH
6 h3SO4
2CO2 + 6SO2 + 9H O
2
O
Ch3
CH
Ch3
Ch4
15. Реактивы для синтеза уксусноизоамилового эфира
РЕАКТИВЫ ДЛЯ СИНТЕЗА
УКСУСНОИЗОАМИЛОВОГО ЭФИРА
Основные
Уксусная кислота (ледяная) — 14,3 см 3
Изоамиловый спирт — 27,7 см 3
Вспомогательные
Серная кислота (4 капли)
Сода Nа2СО3, 5%-й раствор — до нейтральной
реакции
Сульфат натрия или сульфат магния (безводные)
16.
 Посуда для синтеза уксусноизоамилового эфира
Посуда для синтеза уксусноизоамилового эфира
Круглодонная колба
(100 см3) — 2 шт.
Холодильник
Либиха — 1 шт.
Змеевиковый
холодильник – 1 шт.
Водоотделитель
(ловушка ДинаСтарка) – 1 шт.
Делительная
воронка — 1 шт.
Аллонж — 1 шт.
Колба-приемник
(50 см3) -1 шт.
Термометр — 1 шт.
ПОСУДА ДЛЯ СИНТЕЗА УКСУСНОИЗОАМИЛОВОГО ЭФИРА
17. Основные физические константы синтезируемого вещества и основных исходных органических соединений, используемых в синтезе
Растворимость
Название
Тпл.
Изоамилацетат
-78,5
Изоамиловый
спирт
-117,2
Ткип.
142,5
d420
nD20
в 100 г
воды
0,8719
1,4053
в
органичес
ких
растворит
елях*
0,1625
р. эф,
∞ эт
132,0
0,8120
1,4053
2,6722
х. р. ац,
эт, эф
ОСНОВНЫЕ ФИЗИЧЕСКИЕ КОНСТАНТЫ СИНТЕЗИРУЕМОГО ВЕЩЕСТВА
И ОСНОВНЫХ ИСХОДНЫХ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ, ИСПОЛЬЗУЕМЫХ В
СИНТЕЗЕ
18. Установка для синтеза с удалением воды из реакционной смеси
3
1 – реакционная колба;
2 – водоотделитель;
3 – обратный холодильник;
4 – электронагреватель;
5 – штатив лабораторный
5
5
4
2
3
2
1
1
3
УСТАНОВКА ДЛЯ СИНТЕЗА
С УДАЛЕНИЕМ ВОДЫ ИЗ РЕАКЦИОННОЙ СМЕСИ
4
4
2
1
19.
 Установка для перегонки при атмосферном давлении
Установка для перегонки при атмосферном давлении
1 – перегонная колба;
2 – насадка Вюрца;
3 – термометр;
4 – холодильник
нисходящий;
5 – аллонж;
6 – колба-приемник;
7 – электронагреватель;
8 – штативы
лабораторные
УСТАНОВКА ДЛЯ ПЕРЕГОНКИ ПРИ АТМОСФЕРНОМ ДАВЛЕНИИ
20. Перед началом выполнения практической работы по синтезу органического соединения
ПЕРЕД НАЧАЛОМ ВЫПОЛНЕНИЯ ПРАКТИЧЕСКОЙ
РАБОТЫ ПО СИНТЕЗУ ОРГАНИЧЕСКОГО СОЕДИНЕНИЯ
необходимо ознакомиться с «Инструкцией по
технике безопасности, производственной
санитарии и противопожарным
мероприятиям для студентов в учебных
химический лабораториях», после чего
преподаватель, ведущий занятие, может дать
разрешение на начало работы.
21. Техника безопасности:
ТЕХНИКА БЕЗОПАСНОСТИ:
Концентрированная уксусная кислота –
едкая жидкость с резким удушающим
запахом. Все подготовительные операции с
ней проводить только под тягой.
Сильно
разъедает кожу, поэтому при
попадании на нее немедленно смыть
обильной струей воды и место ожога
обработать раствором питьевой соды и
опять водой.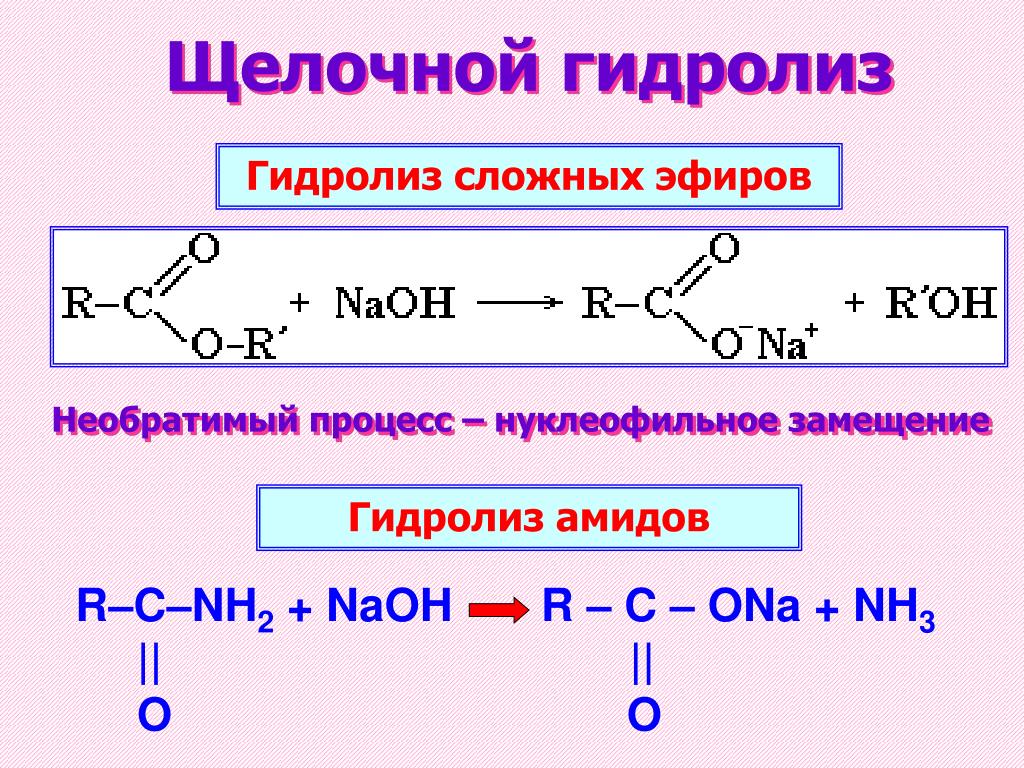
22. Загрузка реагентов в колбу
В круглодонную колбу на 100 см3 с ловушкой и обратным водяным
холодильником помещают смесь 14,3 см3 ледяной уксусной кислоты и
27,7 см3 изоамилового спирта. Прибавляют 4 капли
концентрированной серной кислоты, и бросают несколько «кипелок»
ЗАГРУЗКА РЕАГЕНТОВ В КОЛБУ
23. Синтез эфира с ловушкой
Водоотделитель Дина-Старка (ловушка)
используется для отбора образующейся воды из
реакционной колбы в ходе синтеза.
Реакция этерификации является обратимой, и в
случае наступления равновесия выход эфира
относительно невелик (не более 30-35 % мольн.).
Поэтому для увеличения выхода применяют
принцип Ле-Шателье: удаляя пары образующейся
воды, тем самым поощряем прямую реакцию, т.е.,
ту, в которой образуется желаемый продукт (эфир).
В ловушку так же попадает часть образовавшегося
эфира: наблюдаем двухфазную систему эфир-вода.
СИНТЕЗ ЭФИРА С ЛОВУШКОЙ
24. Экспериментальное проведение этерификации со смещением равновесия
Реакционная смесь
должна кипеть. Постепенно
Постепенно
в ловушке собирается
жидкость, разделяющаяся
на два слоя. Реакция
считается законченной,
когда количество
выделившейся воды
(нижний слой) будет равно
вычисленному по
уравнению реакции.
ЭКСПЕРИМЕНТАЛЬНОЕ ПРОВЕДЕНИЕ ЭТЕРИФИКАЦИИ СО СМЕЩЕНИЕМ
РАВНОВЕСИЯ
25. Отделение бромистого этила от воды
Верхний слой из
ловушки с помощью
делительной воронки
возвращают обратно в
колбу.
После охлаждения
реакционную смесь из
колбы переливают в
делительную воронку,
промывают водой, затем
5%-ным раствором
кальцинированной соды
и вновь водой (до
нейтральной реакции по
лакмусу).
ОТДЕЛЕНИЕ БРОМИСТОГО ЭТИЛА ОТ ВОДЫ
26. Осушка эфира безводным сульфатом натрия
Уксусноизоамиловый
эфир сушат безводным
сульфатом натрия или
магния (до прозрачности
раствора).
ОСУШКА ЭФИРА БЕЗВОДНЫМ СУЛЬФАТОМ НАТРИЯ
27. Перегонка уксусноизоамилового эфира при атмосферном давлении
Затем продукт
перегоняют. Собирают
Собирают
фракцию, кипящую при
138…142 С.
ПЕРЕГОНКА УКСУСНОИЗОАМИЛОВОГО ЭФИРА ПРИ АТМОСФЕРНОМ ДАВЛЕНИИ
28. Приемник дистиллята. аллонж
Так как неочищенный
эфир, «сырой продукт»,
может содержать
некоторое количество
непрореагировавшего
изоамилового спирта
(tкип=121оС), то для
приема чистого
уксусноизоамилового
эфира (tкип=142оС),
понадобится отдельный
приемник
ПРИЕМНИК ДИСТИЛЛЯТА. АЛЛОНЖ
29. Подтверждение состава и строения полученного органического соединения
Заключительный этап синтеза
– идентификация и контроль
чистоты уксусноизоамилового
эфира .
Измерение физических
констант синтезированного
вещества и сопоставление их
о справочными константами
уксусноизоамилового эфира .
Температуру кипения
наблюдали во время
перегонки, показатель
преломления измеряем на
рефрактометре.
Достижение 97…99% чистоты
целевого продукта вполне
достаточно.
ПОДТВЕРЖДЕНИЕ СОСТАВА И СТРОЕНИЯ ПОЛУЧЕННОГО
ОРГАНИЧЕСКОГО СОЕДИНЕНИЯ
English
Русский
Правила
Изоамилацетат | Подкаст | Chemistry World
Мира Сентилингам
На этой неделе вам, возможно, захочется зажать нос, и Дженна Билбри объясняет, почему.
Дженна Билбрей
Наиболее отчетливо в моей памяти запечатлен день, когда мы изготовили изоамилацетат. Это не взрыв, не ярко окрашенный продукт и даже не необычный набор посуды, который я помню. Это запах. После часа кипячения с обратным холодильником изоамилового спирта и уксусной кислоты — комбинация, которая неприятно пахнет, но не слишком плоха для химической лаборатории — у меня потекли слюнки, и мне внезапно захотелось бананов. Да все верно. Изоамилацетат — это запах и вкус бананов.
Источник: © Shutterstock. Реакция, называемая этерификацией Фишера, происходит, когда спирт, в данном случае изоамиловый спирт, реагирует с карбоновой кислотой, в данном случае ледяной уксусной кислотой. С помощью тепла и кислотного катализатора образуется сложный эфир.
Запах почти всех фруктов исходит от алифатических сложных эфиров, простых молекул, содержащих карбоксильную группу непосредственно рядом с эфирной связью, ведущей к алкильным или арильным группам. Молекулы с небольшим количеством углерода пахнут фруктово, но при добавлении большего количества углерода запах меняется на мыльный или даже металлический. Изоамилацетат имеет только шесть атомов углерода, поэтому его запах отчетливо сладкий. Эти сложные эфиры также можно найти в нефруктовых источниках, таких как мята перечная и зеленый чай.
Молекулы с небольшим количеством углерода пахнут фруктово, но при добавлении большего количества углерода запах меняется на мыльный или даже металлический. Изоамилацетат имеет только шесть атомов углерода, поэтому его запах отчетливо сладкий. Эти сложные эфиры также можно найти в нефруктовых источниках, таких как мята перечная и зеленый чай.
В отличие от своих исходных спиртов, сложные эфиры не могут действовать как доноры водородных связей и, как таковые, они не самоассоциируются. Это приводит к тому, что сложные эфиры более летучи, чем карбоновые кислоты аналогичной молекулярной массы. Аэрированные молекулы попадают в обонятельные рецепторы нашего носа, сигналы отправляются в наш мозг, и наше обоняние активируется.
Даже небольшие изменения в молекулярной структуре могут создавать отчетливые запахи. Если мы вырежем один углерод из изоамилацетата, чтобы получить изобутилацетат, запах снова будет фруктовым, но более характерным для малины. Переместите заместитель углерода непосредственно рядом со сложным эфиром, чтобы сформировать втор-бутилацетат и запах остается сладким, но с оттенком растворителя. Разрежем снова до этилацетата и получим жидкость для снятия лака с ногтей. Три атома углерода — это все, что нужно, чтобы превратиться из аппетитного в защемляющий нос.
Разрежем снова до этилацетата и получим жидкость для снятия лака с ногтей. Три атома углерода — это все, что нужно, чтобы превратиться из аппетитного в защемляющий нос.
Источник: © Shutterstock
Как я упоминал ранее, изоамилацетат имеет запах и вкус бананов. Настоящий банан представляет собой комбинацию крахмалов, аминокислот и амилацетата, а также одноименной молекулы. Но многие искусственные продукты со вкусом банана содержат исключительно изоамилацетат. Он используется в качестве ароматизатора в различных обработанных пищевых продуктах: напитках, жевательной резинке, выпечке и, в первую очередь, в конфетах, таких как банановые конфеты Runts и цирковой арахис. Вкус изоамилацетата чрезвычайно силен, и его можно ощутить при концентрации всего 2 части на миллион, что составляет примерно одну каплю на каждые 50 литров.
Если вы не любитель сладкого, возможно, вы пробовали изоамилацетат в неожиданном источнике: пиве. Изоамилацетат естественным образом вырабатывается дрожжами во время ферментации. В вайсбире (в первую очередь баварском хефевайцене), сахти и некоторых бельгийских сортах пива используется искусственный аромат бананов, чтобы повысить сложность и придать пиву фруктовый оттенок. В то время как вкус банана приятен в одних сортах пива, в других он может быть отталкивающим, например, в лагерах.
В вайсбире (в первую очередь баварском хефевайцене), сахти и некоторых бельгийских сортах пива используется искусственный аромат бананов, чтобы повысить сложность и придать пиву фруктовый оттенок. В то время как вкус банана приятен в одних сортах пива, в других он может быть отталкивающим, например, в лагерах.
Во время ферментации изоамилацетат образуется ферментом, называемым ацетаттрансферазой. Контроль типа дрожжей будет контролировать фермент, поэтому важно выбрать правильные дрожжи для правильного пива. Другой способ контролировать образование сложных эфиров — это температура, при которой более высокие температуры способствуют образованию ацетата. Если вы домашний пивовар и хотите, чтобы пиво было фруктовым, попробуйте брожение при температуре от 21 до 24 градусов по Цельсию. Распространенная ошибка начинающих пивоваров — сбраживать лагеры при комнатной температуре, в результате чего получается фруктовый лагер — совсем не то, что нужно!
Итак, в следующий раз, когда вы почувствуете запах бананов в пиве или попробуете их в своих сладостях, помните, что одна маленькая молекула, застрявшая в ваших сенсорных рецепторах, создает этот насыщенный вкус.
Мира Сентилингам
Однозначный и смелый – отличное сочетание. Научный писатель Дженна Билбри со смелой химией изоамилацетата. На следующей неделе мы переходим от жирного к холодному.
Весы Хелен
В ледяных водах Антарктиды обитают незамерзающие рыбы. И это несмотря на то, что температура воды обычно составляет около минус 1,8°C, достаточно холодная, чтобы превратить большинство рыб в сплошную глыбу льда. Так что же мешает антарктическим рыбам замерзнуть?
Мира Сентилингам
Узнайте у Хелен Скейлс в выпуске Химия в ее элементе на следующей неделе. А пока, спасибо за внимание, я Мира Сентилингам.
Изоамилацетат — Обзор — нюх
Изоамилацетат, также известный как изопентилацетат, представляет собой органическое соединение, представляющее собой сложный эфир, образованный изоамиловым спиртом и уксусной кислотой.
Это бесцветная жидкость, мало растворимая в воде, но хорошо растворимая в большинстве органических растворителей. Изоамилацетат имеет сильный запах, который также описывается как похожий на оба банан и груша.
Изоамилацетат имеет сильный запах, который также описывается как похожий на оба банан и груша.
Чистый изоамилацетат или смеси изоамилацетата, амилацетата и других ароматизаторов могут называться банановым маслом (будьте очень осторожны с этим предложением).
См. «Химия банана» для более подробного ознакомления с эволюцией состава
Discovery
Все еще ищу информацию. Если вы знаете что-то, чего я не знаю, свяжитесь со мной здесь.
Встречается в природе
Изопентилацетат встречается в природе в банановом растении, а также производится синтетическим путем.
Профиль
📂 CAS № 123-92-2
⚖️ MW — 130,18 г/моль
Тип 📝
📈 Сила запаха – Высокая, рекомендуется обоняние при 1% раствор. Остается 4 часа на бумаге при полной концентрации.
👃🏼 Профиль запаха – сладкий банановый фруктовый спелый эфир, растворитель. Пьянящий.
Пьянящий.
👅 Вкусовой профиль — банановый, сладкий, фруктовый, банановый.
⚗️ Использование – Алкогольные напитки, яблоко, абрикос, банан, вишня, шоколад, какао, молочные продукты, твердые фрукты, мягкие фрукты.
Рекомендуемый предел 25% в формуле аромата.
Производство
Изоамилацетат получают катализируемой кислотой реакцией (этерификация Фишера) между изоамиловым спиртом и ледяной уксусной кислотой, как показано в приведенном ниже уравнении реакции. Обычно в качестве катализатора используют серную кислоту. В качестве альтернативы в качестве катализатора можно использовать п-толуолсульфокислоту или кислотную ионообменную смолу.
Другое применение
Он также используется в качестве растворителя для некоторых лаков и нитроцеллюлозных лаков. В качестве растворителя и носителя для таких материалов, как нитроцеллюлоза, он широко использовался в авиационной промышленности для придания жесткости и ветрозащитной ткани летным поверхностям, где он и его производные были широко известны как «авиационная присадка».