Содержание
11.3.Простые эфиры
11.3.1.Номенклатура простых эфиров
Согласно тривиальной
номенклатуре, простые эфиры называют
по радикалам, связанным с атомом
кислорода, добавляя слово «эфир»:
(СH3)2CH-OC2H5 изопропилэтиловый эфир | (CH3)2CH-O-CH(CH3)2 диизопропиловый эфир |
CH3-O-СH2CH2CH2CH3 н-бутилметиловый эфир |
По номенклатуре
ИЮПАК эфиры рассматривают как
алкоксиалканы. Корень названия определяет
наиболее длинная алкильная группа:
СH3OCH2CH2OCH3 1,2-диметоксиэтан | 3-пропоксигексан |
1-этокси-4,4-диметилпентан | |
Простые эфиры
имеют ту же геометрию, что и Н2О.
Валентный угол С-О-С соответствует
112° для
СН3ОСН3,
что близко к тетраэдрическому углу и
указывает на
sp3-характер
гибридизации атома кислорода. Простые
эфиры относятся к числу малореакционноспособных
веществ и стабильны по отношению ко
многим реагентам (металлоорганическим
соединениям и др.), но они чувствительны
по отношению к кислороду и легко образуют
взрывчатые гидропероксиды, которые
являются причиной взрыва при неосторожном
обращении.
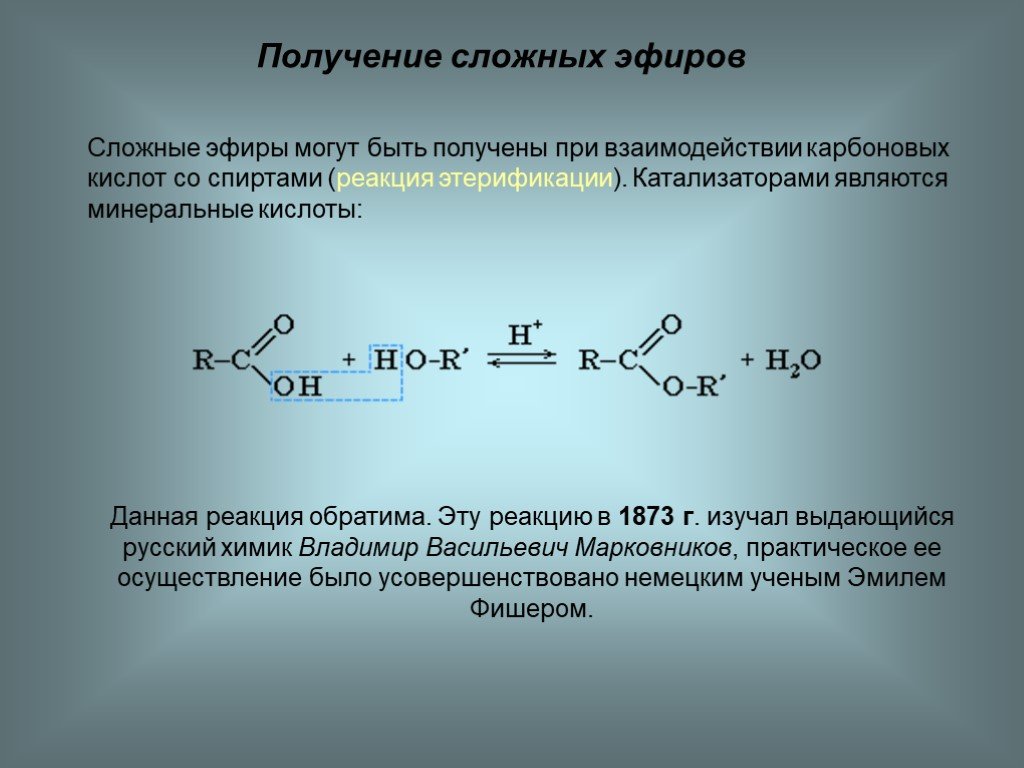
11.3.2.Получение простых эфиров
Существует три
общих метода получения простых эфиров:
межмолекулярная дегидратация спиртов,
алкоксимеркурирование алкенов и реакция
А.Вильямсона.
11.3.2.А. Межмолекулярная дегидратация спиртов
Этот наиболее
старый способ получения простых эфиров
описан ранее в этой главе. Он пригоден
для получения симметричных простых
эфиров из неразветвленных первичных
спиртов:
Третичные спирты
в этих условиях образуют алкены в
результате внутримолекулярной
дегидратации.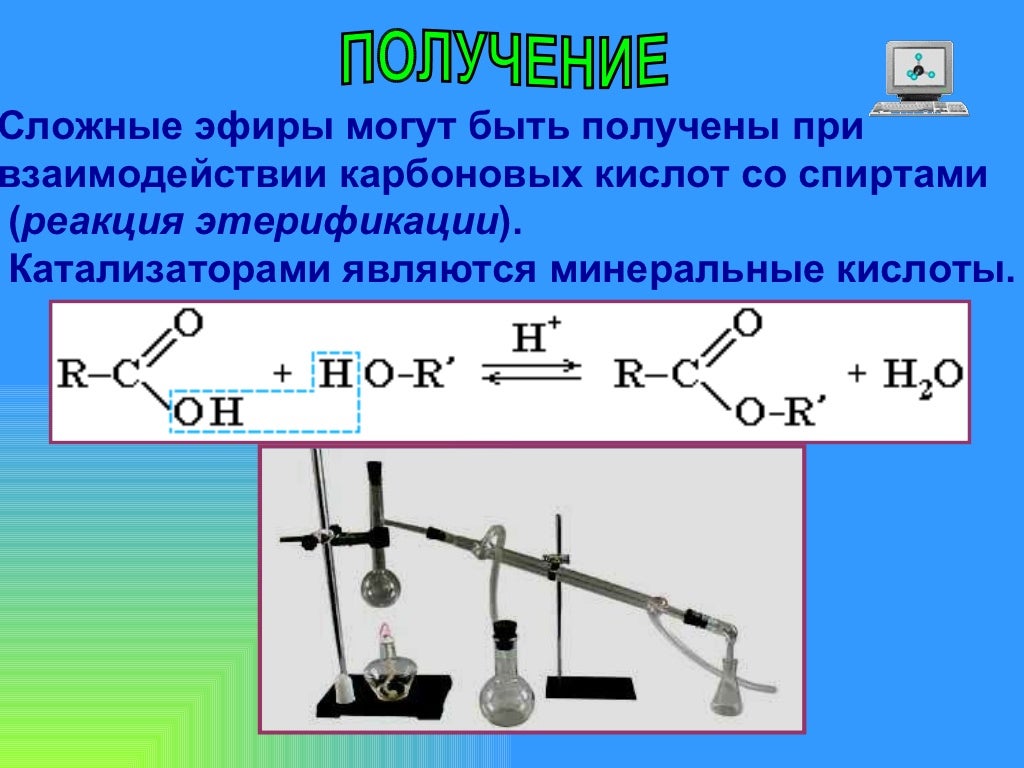 Метод непригоден для
Метод непригоден для
получения смешанных эфиров, за исключением
такого случая, когда один спирт третичный,
а второй
— первичный:
Межмолекулярная
дегидратация спиртов имеет крайне
ограниченное значение в практике
органического синтеза. В промышленности
этим способом получают диэтиловый,
дибутиловый и ряд других простейших
эфиров. Гораздо более важными общими
методами синтеза простых эфиров являются
алкоксимеркурирование алкенов и реакция
Вильямсона.
11.3.2.Б.Алкоксимеркурирование алкенов
Алкоксимеркурирование
алкенов по существу аналогично
оксимеркурированию (гл.
5, ч.
1), единственное
различие состоит в том, что роль «внешнего»
нуклеофильного агента выполняет
спирт, который используется в качестве
растворителя. Для получения эфиров,
содержащих третичную или вторичную
алкильную группу в качестве электрофильного
агента, целесообразно использовать
трифторацетат ртути:
Последующее
демеркурирование осуществляется с
помощью боргидрида натрия.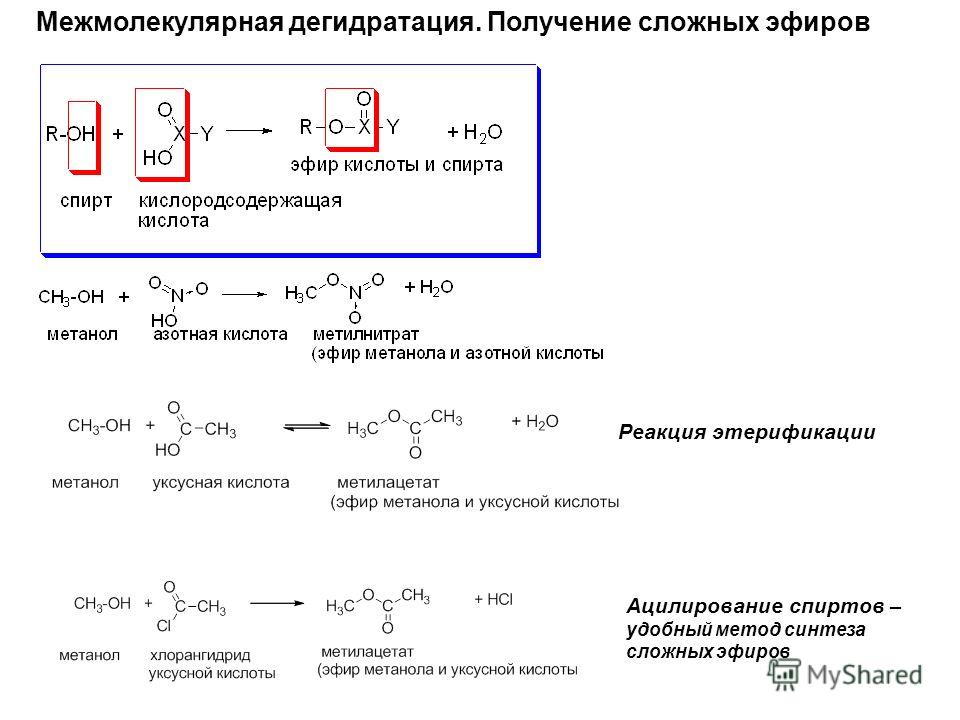 Суммарный
Суммарный
результат соответствует присоединению
спирта по двойной связи алкена в
соответствии с правилом Марковникова:
Механизм реакции
полностью аналогичен механизму
оксимеркурирования алкенов (гл.
5, ч.
1).
11.3.2.В. Синтез простых эфиров по а.Вильямсону
Эта реакция
рассматривалась ранее в этой же главе:
Так можно получать
как симметричные, так и несимметричные
эфиры. Механизм реакции и область ее
применения обсуждались ранее. Эта
старая реакция неожиданно обрела второе
рождение после открытия нового класса
простых эфиров, так называемых
краун-полиэфиров1.
Краун-полиэфирами называют макроциклические
полиэфиры, содержащие несколько атомов
кислорода в цикле. Все краун-полиэфиры
характеризуются регулярной структурой,
где каждые два атома кислорода в цикле
связаны посредством двух метиленовых
звеньев, т.е. формально краун-полиэфиры
можно рассматривать как продукты
циклоолигомеризации окиси этилена. В
В
названиях краун-полиэфиров первая цифра
указывает на размер цикла, а вторая
определяет число атомов кислорода
в цикле.
12-краун-4 | 15-краун-5 | 18-краун-6 | 24-краун-8 |
Первый краун-полиэфир
дибензо-18-краун-б был получен К.Педерсеном
в
1967 г. с
помощью реакции Вильямсона между
динатриевой солью пирокатехина и
бис-(2-хлорэтиловым)
эфиром:
Другие краун-полиэфиры
также получают при конденсации
дигалогенидов или дисульфонатов с
дианионом диолов. В качестве примера
приведем синтез 18-краун-6 (Д.Крам) как
наиболее важного из краун-полиэфиров
и 24-краун-8-полиэфира. Выход циклических
Выход циклических
краун-полиэфиров очень сильно зависит
от природы катиона основания:
Наиболее высокий
выход 18-краун-6-полиэфира наблюдается
при использовании алкоголятов калия,
а для 12-краун-4
— алкоголятов
лития. Выходы обоих краун-полиэфиров
падают практически до нуля, если в
качестве основания берется гидроксид
тетраалкиламмония. Это указывает на
то, что катион играет роль матрицы
при образовании цикла, содержащего
определенное число атомов кислорода.
Размер цикла определяется координационным
числом катиона щелочного металла.
Координационное число К+
по отношению к кислородсодержащим
лигандам равно шести, поэтому катион
калия наиболее эффективен при получении
18-краун-б-полиэфира с шестью атомами
кислорода в цикле. Аналогично катион
лития с координационным числом четыре
способствует замыканию цикла, содержащего
столько же атомов кислорода:
Влияние катиона
на размер образующего цикла получило
название матричного, или «темплатного»,
эффекта.
Краун-полиэфиры
образуют стабильные комплексы с
катионами непереходных и переходных
металлов. Стабильность этих комплексов
зависит от соответствия диаметра катиона
размеру полости кольца, а также от
координационного числа катиона металла.
Катион лития с диаметром иона
1,20 Å
образует стабильный комплекс с
12-краун-4-полиэфиром с диаметром полости
кольца
1,2—1,5 Å;
катион натрия
(d
=
1,9 Å)
даст наиболее стабильный комплекс
с 15-краун-5 (d
=
1,7-2,2 Å),
катион калия (d
=
2,66 Å)
— с 18-краун-6
(d
= 2,6-3,2
Å).
Катион цезия с d
= 3,38 Å
образует прочный комплекс с
24-краун-8-полиэфиром с диаметром полости
кольца порядка
4 Å.
Комплексообразование краун-полиэфиров,
их сернистых и азотных аналогов, а также
полициклических краун-соединений
— так
называемых криптандов
— с катионами
металлов составляет интересный
самостоятельный раздел современной
аналитической химии:
криптанд[2,2,2]
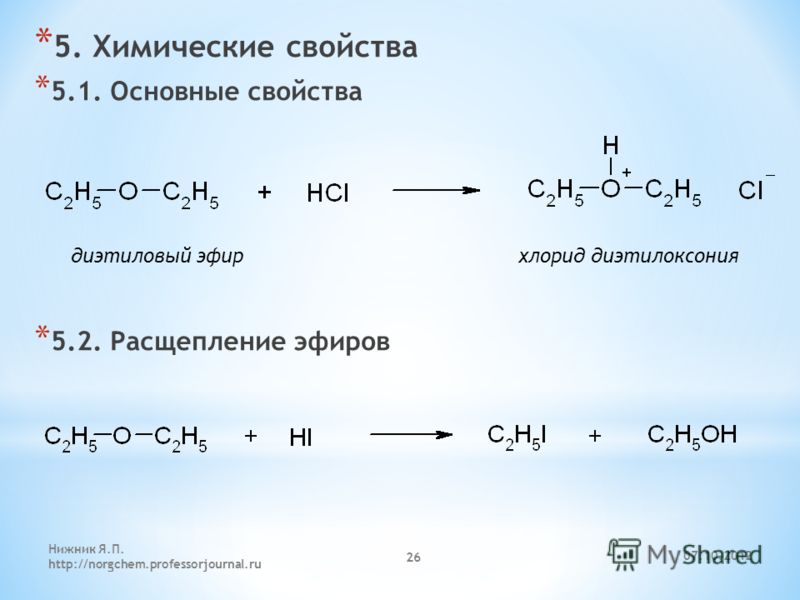
Простые эфиры
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Синтез эфира Вильямсона – Мастер органической химии
Все о синтезе эфира Вильямсона
В предыдущем посте мы обсуждали кислотно-щелочные свойства спиртов. Два поста назад мы говорили, что кислотно-основные реакции часто используют для «постановки» реакций замещения и элиминирования спиртов. В этом посте мы поговорим о том, что, вероятно, является лучшим примером этого последнего пункта — Williamson Ether Synthesis .
Спойлер: это просто S N 2 реакция между RO(-) и алкилгалогенидом, но есть много мелких складок. Читать дальше!
Содержание
- Что такое синтез эфира Вильямсона?
- Почему мы используем R–O(–), а не R–OH в качестве нуклеофила?
- Какие алкилгалогениды хорошо работают в синтезе эфира Вильямсона?
- Начиная со спирта: хороший и плохой выбор основания
- Как выбрать растворитель для синтеза эфира Вильямсона?
- Резюме: Синтез эфира Вильямсона
- (Дополнительно) Ссылки и дополнительная литература
1.
 Что такое синтез эфира Вильямсона?
Что такое синтез эфира Вильямсона?
Williamson Ether Synthesis — старая реакция, восходящая к 1851 году, но до сих пор не превзойденная. Просто нет более простого способа сделать эфир.
Это тип реакции, которую мы уже видели много раз раньше — реакция S N 2 между депротонированным спиртом [«алкоксидом»] и алкилгалогенидом, который образует эфир. ( См. статью: S N 2 Механизм )
Обратите внимание, что здесь мы образуем и , разрывая связь на углероде — хрестоматийный признак реакции замещения .
Это стандартная реакция. Оно работает. Но просто взглянув на Williamson, который «работает», мы получим только половину картины. В оставшейся части этого поста мы рассмотрим, как Уильямсон может пойти не так, и ответим на следующие вопросы:
- Почему RO-, а не ROH в качестве нуклеофил ?
- Какие алкилгалогениды работают хорошо, а какие нет?
- Если мы начнем со спирта (ROH) и добавим основание, чтобы получить RO- , как мы выберем хорошее основание для использования?
- Как выбрать растворитель ?
Давайте углубимся.
2. Почему мы используем RO – , а не ROH в качестве нуклеофила?
Первое, что вы можете заметить в Williamson, это тот факт, что мы используем алкоксид (RO – ) в дополнение к спирту (ROH) в реакции. Вы спросите, а зачем заморачиваться?
Не будет ли ROH реагировать с алкилгалогенидом так же, как RO – , и по-прежнему давать нам эфир?
Ответ возвращается к тому, о чем мы говорили два поста назад: сопряженное основание всегда является лучшим нуклеофилом. Реакция RO – с алкилгалогенидом всегда будет намного быстрее , чем реакция ROH, из-за более высокой электронной плотности на нуклеофиле (кислороде). Вот почему мы используем RO – . ( См. публикацию: Что делает хорошим нуклеофилом? )
Наиболее распространенный способ представить алкоксид, добавленный в присутствии спирта.
Также можно начать со спирта, добавить основание , чтобы получить RO – , а затем добавить алкилгалогенид [, обратите внимание на затененный раздел ].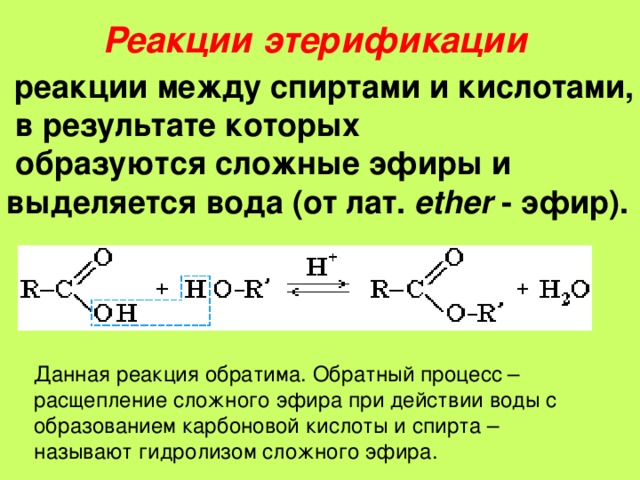 Мы поговорим об этом ниже.
Мы поговорим об этом ниже.
3. Какие алкилгалогениды хорошо работают в синтезе эфира Вильямсона? (а какие нет)
Здесь мы возвращаемся к концепциям из середины организации 1, которые всплывают в этой главе, посвященной спиртам.
Синтез эфира Вильямсона представляет собой реакцию S N 2 . Помните, что, поскольку реакция S N 2 протекает через одну стадию, когда нуклеофил осуществляет «обратную атаку» на алкилгалогенид, «большим барьером» для реакции S N 2 является стерическое препятствие .
Скорость реакции S N 2 была наибольшей для метилгалогенидов, затем первичных, затем вторичных, затем третичных (которых по сути вообще не бывает). Тот же образец существует для реакции эфира Вильямсона.
Метил и первичные алкилгалогениды являются отличными субстратами для Вильямсона.
[ одно исключение: сильно затрудненный анион трет-бутоксида (t-BuO-) медленнее вступает в реакцию S N 2 , чем его другие алкоксидные аналоги. Этот алкоксид, также являющийся сильным основанием, вместо этого может начать давать побочные продукты элиминирования (Е2) при использовании первичных алкилгалогенидов, особенно при нагревании ].
Этот алкоксид, также являющийся сильным основанием, вместо этого может начать давать побочные продукты элиминирования (Е2) при использовании первичных алкилгалогенидов, особенно при нагревании ].
Поскольку алкоксиды являются сильными основаниями (напомним, что pK a спиртов находится в диапазоне 16-18), конкуренция с путями элиминации [E2] становится проблемой, когда алкилгалогенид становится более стерически затрудненным.
По этой причине попытка провести анализ Вильямсона на вторичном алкилгалогениде несколько более проблематична, чем на первичном алкилгалогениде .
Один из способов добиться преимущества S N 2 перед E2 заключается в использовании полярного апротонного растворителя (такого как ацетонитрил или ДМСО), который увеличивает нуклеофильность алкоксида. Однако, если применяется тепло, E2, скорее всего, будет доминировать.
Одним из субстратов, который полностью не соответствует с помощью Williamson, являются третичные алкилгалогениды.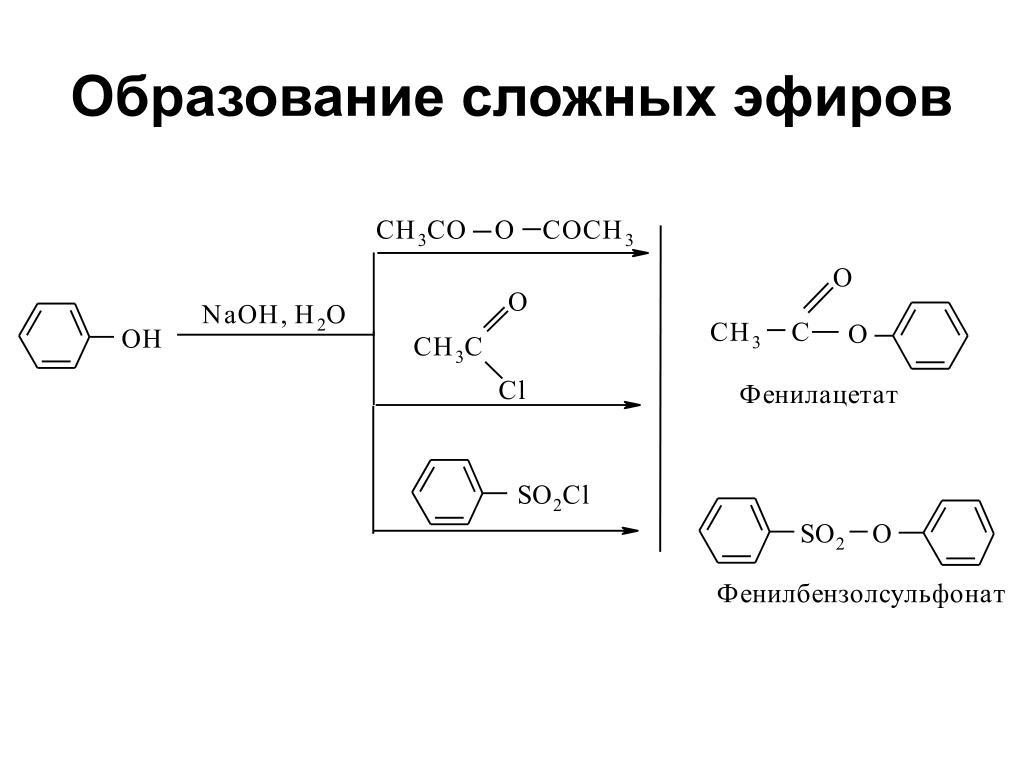 Это не должно вызывать удивления, поскольку атака с тыльной стороны третичного алкилгалогенида сталкивается с огромными стерическими затруднениями. Вместо замещения происходят реакции элиминации посредством механизма E2 ( См. пост: Механизм E2 )
Это не должно вызывать удивления, поскольку атака с тыльной стороны третичного алкилгалогенида сталкивается с огромными стерическими затруднениями. Вместо замещения происходят реакции элиминации посредством механизма E2 ( См. пост: Механизм E2 )
4. Начиная со спирта и добавляя основание – что работает?
Как упоминалось выше, наиболее распространенным способом представления шкалы Вильямсона является демонстрация добавления алкоксидного основания к алкилгалогениду в присутствии сопряженной с ним кислоты в качестве растворителя.
Однако также можно начать со спирта, добавить основание (с образованием алкоксида), а затем добавить алкилгалогенид.
Вопрос в том, какую базу мы должны использовать?
Прежде всего, само собой разумеется, что основание должно быть достаточно сильным, чтобы действительно депротонировать спирт . Использование чего-то вроде Cl- или RCO 2 – (ацетат) не поможет. В идеале нам нужно что-то не менее сильное, чем алкоксид, или даже сильнее.
В идеале нам нужно что-то не менее сильное, чем алкоксид, или даже сильнее.
Во-вторых, нам нужно беспокоиться о побочных реакциях. Было бы полезно подумать о том, как эти реакции протекают. Обычно мы начинаем с колбы со спиртовым растворителем, добавляем основание, а затем добавляем наш алкилгалогенид. Затем, когда реакция завершится, мы выделяем продукт. Это означает, что после депротонирования основания его сопряженная кислота все еще плавает в растворе и, следовательно, может вступить в реакцию с нашим алкилгалогенидом (испортить ситуацию).
Вот пример плохой выбор основания:
NaNH 2 определенно является достаточно сильным основанием для депротонирования спирта. Однако после того, как это сделано, мы имеем NH 3 в растворе, и это достаточно хороший нуклеофил, чтобы реагировать с алкилгалогенидом, давая нам побочные продукты амина в нашей реакции . Не идеально!
Как мы можем сделать это правильно? Можно сделать алкоксид непосредственно из спирта, просто добавив металлический натрий или калий, который высвобождает водород. Водород является совершенно безвредным побочным продуктом в отношении алкилгалогенида — он не будет действовать как конкурирующий нуклеофил, а будучи газом, просто пузырится из раствора. После образования алкоксида мы можем добавить наш алкилгалогенид.
Водород является совершенно безвредным побочным продуктом в отношении алкилгалогенида — он не будет действовать как конкурирующий нуклеофил, а будучи газом, просто пузырится из раствора. После образования алкоксида мы можем добавить наш алкилгалогенид.
Другой (но более распространенный) способ сделать это — добавить гидрид натрия или калия (например, NaH или KH) . Это имеет тот же эффект, что и добавление металлического натрия или калия — образует алкоксид, а также H 2 — и имеет дополнительный бонус, заключающийся в том, что он не сильно восстанавливается, что может вызвать беспокойство, если мы имеем дело со сложным исходным материалом, который легко восстанавливается. .
5. Как выбрать растворитель для синтеза эфира Вильямсона?
Как упоминалось выше, наш обычный растворитель — это сопряженная кислота алкоксида . [Есть исключения — мы можем попробовать использовать полярный апротонный растворитель, если нас беспокоит конкуренция с E2].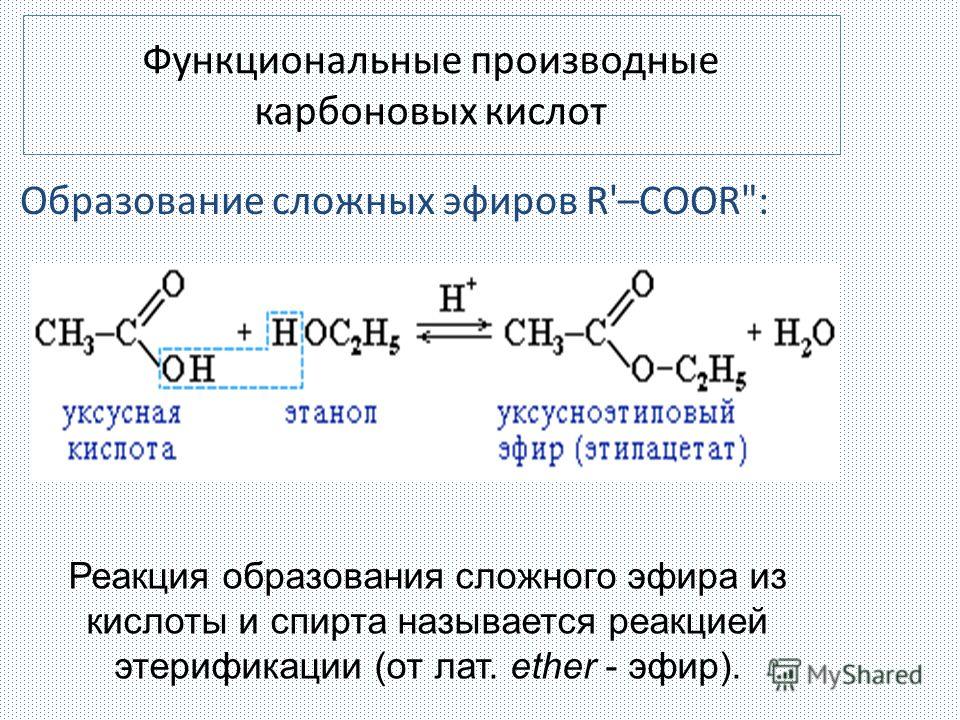
Вопрос «почему» ? Вы поняли это?
Представьте, что мы решили добавить этоксид натрия в пропанол, а затем добавить наш алкилгалогенид. Что может случиться?
Это установит равновесие! Наш «этоксид натрия» не будет оставаться таким долго — он может депротонировать пропанол, чтобы получить пропоксид натрия вместе с этанолом. Теоретически мы можем иметь смесь этоксида натрия и пропоксида натрия в растворе, что может привести к смеси эфирных продуктов. Опять же не идеал.
Зачем себе эта головная боль? Это бессмысленно. По этой причине мы значительно упростим ситуацию, если будем использовать только спиртовой растворитель, который представляет собой сопряженную кислоту алкоксида.
6. Резюме: Синтез эфира Вильямсона
Это все, что можно сказать о Вильямсоне на сегодня. Однако в следующем посте мы подумаем об этой реакции назад . Начав с данного эфира, как мы можем спланировать его синтез с помощью реакции Вильямсона?
Следующий пост – Синтез эфира Вильямсона: планирование
Примечания
(Дополнительно) Ссылки и дополнительная литература:
- XLV.
 Теория этерификации.
Теория этерификации.
Александр Уильямсон (1850 г.), The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 37:251, 350-356,
DOI: 080/14786445008646627
Оригинальная статья Уильямсона. - Эквиленин 3-бензиловый эфир
M. Hoehn, Clifford R. Dorn и Bernard A. Nelson
Журнал органической химии 1965 30 (1), 316-316
DOI: DOI: 10.1021/JO01012A5209 OTI: DOI: 10.1021/JO01012A5209 OTI: Реакции в этой статье представляют собой классическую реакцию Вильямсона – защиту спирта в дегидроэстроне в виде бензилового эфира с помощью бензилхлорида. - Полный синтез (+)-7-дезоксипанкратистатина: подход радикальной циклизации
Gary E. Keck, Stanton F. McHardy, and Jerry A. Murry
Журнал Американского химического общества 1995 117 (27), 7289-7290
doi: 1021/ja00132a047
В современном органическом синтезе реакция Williamson используется для . спирты в субстрате. Общие защитные группы включают метоксиметил (МОМ) и 2-метоксиэтоксиметил (МЕМ). Защита MOM используется в этом полном синтезе профессором Кеком и его коллегами.
спирты в субстрате. Общие защитные группы включают метоксиметил (МОМ) и 2-метоксиэтоксиметил (МЕМ). Защита MOM используется в этом полном синтезе профессором Кеком и его коллегами.
Синтез затрудненного диалкилового эфира с электрогенерированными карбокатионами
- Письмо
- Опубликовано:
- Jinbao Xiang 1,2 na1 ,
- Ming Shang 1 na1 ,
- Yu Kawamata 1 ,
- Helena Lundberg 1,3 ,
- Solomon H. Reisberg 1 ,
- Мяо Чен 1 ,
- Павел Михайлюк 1,4,5 ,
- Грегори Бейтнер 6 ,
- Майкл Р.
 Коллинз 7 ,
Коллинз 7 , - Alyn Davies 8 ,
- Matthew Del Bel 7 ,
- Matthew Del Bel 7 ,
- M.Salle , ,
- Matthew Del Bel 7 ,
- Matthew Del Bel 7 ,
- . 7 ,
- Jillian E. Spangler 7 ,
- Jeremy Starr 8 ,
- Shouliang Yang 7 ,
- Donna G. Blackmond 1 &
- …
- Phil S. Baran 1
,
,
Природа
том 573 , страницы 398–402 (2019)Цитировать эту статью
44 тыс.
 обращений
обращений168 цитат
89 Альтметрический
Сведения о показателях
Предметы
- Электрокатализ
- Методология синтетической химии
- Устойчивое развитие
Abstract
Затрудненные эфиры имеют большое значение для различных приложений; однако они остаются малоизученной областью химического космоса, поскольку их трудно синтезировать с помощью обычных реакций 1,2 . Такие мотивы очень востребованы в медицинской химии, потому что широкое замещение эфирной связи предотвращает нежелательные метаболические процессы, которые могут привести к быстрой деградации in vivo. Здесь мы сообщаем о простом пути к синтезу затрудненных эфиров, в котором электрохимическое окисление используется для высвобождения высокоэнергетических карбокатионов из простых карбоновых кислот. Эти реакционноспособные промежуточные соединения карбокатионов, которые образуются при низких электрохимических потенциалах, захватывают донора спирта в некислых условиях; это позволяет образовывать ряд эфиров (здесь было приготовлено более 80), которые в противном случае были бы труднодоступны. Карбкатионы также могут быть перехвачены простыми нуклеофилами, что приводит к образованию затрудненных спиртов и даже алкилфторидов. Этот метод был оценен на предмет его способности обойти синтетические узкие места, возникающие при приготовлении 12 химических каркасов, что привело к более высокому выходу необходимых продуктов, а также к существенному сокращению количества стадий и количества труда, необходимого для их приготовления. Использование молекулярных зондов и результаты кинетических исследований подтверждают предполагаемый механизм и роль добавок в исследованных условиях.
Здесь мы сообщаем о простом пути к синтезу затрудненных эфиров, в котором электрохимическое окисление используется для высвобождения высокоэнергетических карбокатионов из простых карбоновых кислот. Эти реакционноспособные промежуточные соединения карбокатионов, которые образуются при низких электрохимических потенциалах, захватывают донора спирта в некислых условиях; это позволяет образовывать ряд эфиров (здесь было приготовлено более 80), которые в противном случае были бы труднодоступны. Карбкатионы также могут быть перехвачены простыми нуклеофилами, что приводит к образованию затрудненных спиртов и даже алкилфторидов. Этот метод был оценен на предмет его способности обойти синтетические узкие места, возникающие при приготовлении 12 химических каркасов, что привело к более высокому выходу необходимых продуктов, а также к существенному сокращению количества стадий и количества труда, необходимого для их приготовления. Использование молекулярных зондов и результаты кинетических исследований подтверждают предполагаемый механизм и роль добавок в исследованных условиях.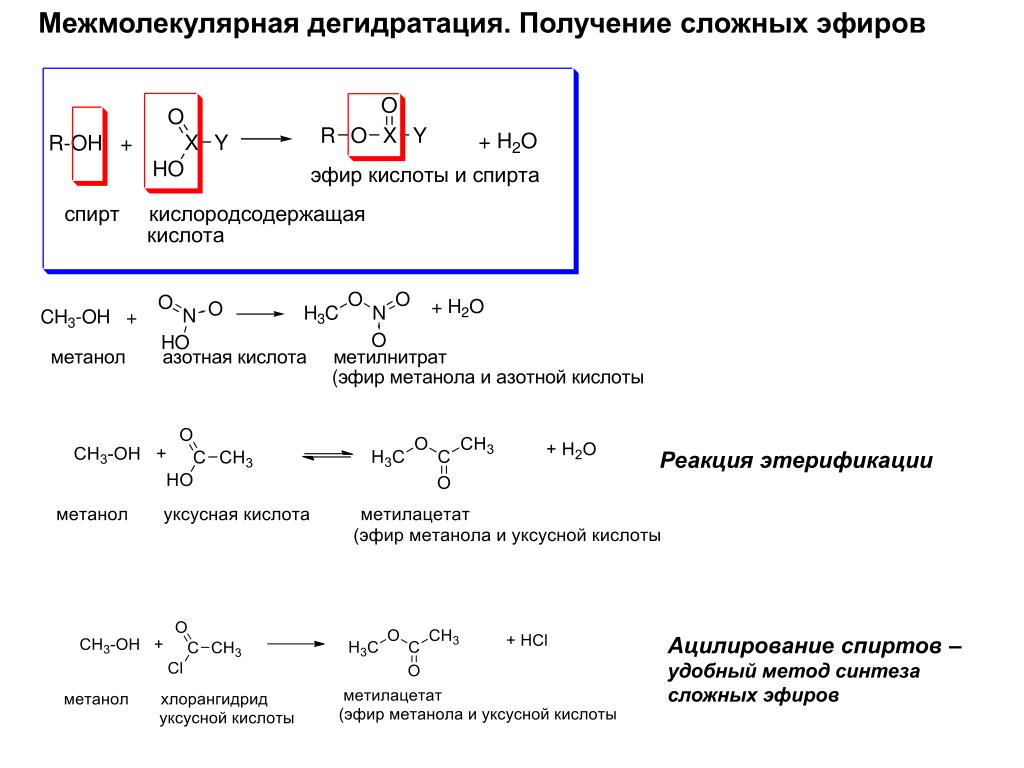 Многообразие реакций, о котором мы здесь сообщаем, демонстрирует возможности электрохимии для доступа к высокореактивным промежуточным продуктам в мягких условиях и, в свою очередь, существенное повышение эффективности, которое может быть достигнуто с помощью этих недоступных иным образом промежуточных продуктов.
Многообразие реакций, о котором мы здесь сообщаем, демонстрирует возможности электрохимии для доступа к высокореактивным промежуточным продуктам в мягких условиях и, в свою очередь, существенное повышение эффективности, которое может быть достигнуто с помощью этих недоступных иным образом промежуточных продуктов.
Это предварительный просмотр содержимого подписки, доступ через ваше учреждение
Соответствующие статьи
Статьи открытого доступа со ссылками на эту статью.
Фоторедокс-катализируемый разрыв связи C–C циклопропанов с образованием связей C(sp3)–гетероатом
- Лян Гэ
- , Чи Чжан
- … Чао Фэн
Связь с природой
Открытый доступ
08 октября 2022 г.
Легкое и общее электрохимическое дейтерирование неактивированных алкилгалогенидов
- Пэнфэй Ли
- , Чэнчэн Го
- … Юай Цю
Связь с природой
Открытый доступ
30 июня 2022 г.Катализируемый никелем многокомпонентный стереодивергентный синтез олефинов с использованием электрохимии, фотокатализа и фотоэлектрохимии
- Чен Чжу
- , Хуэйфэн Юэ
- и Магнус Рупинг
Связь с природой
Открытый доступ
10 июня 2022 г.
Варианты доступа
Подписаться на журнал
Получить полный доступ к журналу на 1 год
199,00 €
всего 3,90 € за номер
Подписаться
Расчет налогов будет завершен во время оформления заказа.
Купить статью
Получите ограниченный по времени или полный доступ к статье на ReadCube.
32,00 $
Купить
Все цены указаны без учета стоимости.
Рис. 1: Фон и развитие реакции. Рис. 2: Применение и частичная область синтеза стерически затрудненных эфиров посредством электрохимического декарбоксилирования. Рис. 3: Применение и частичный объем захвата электрогенерированных карбокатионов другими нуклеофилами, а также демонстрация масштабируемости.
Доступность данных
Данные, подтверждающие результаты этого исследования, доступны в документе и его дополнительной информации.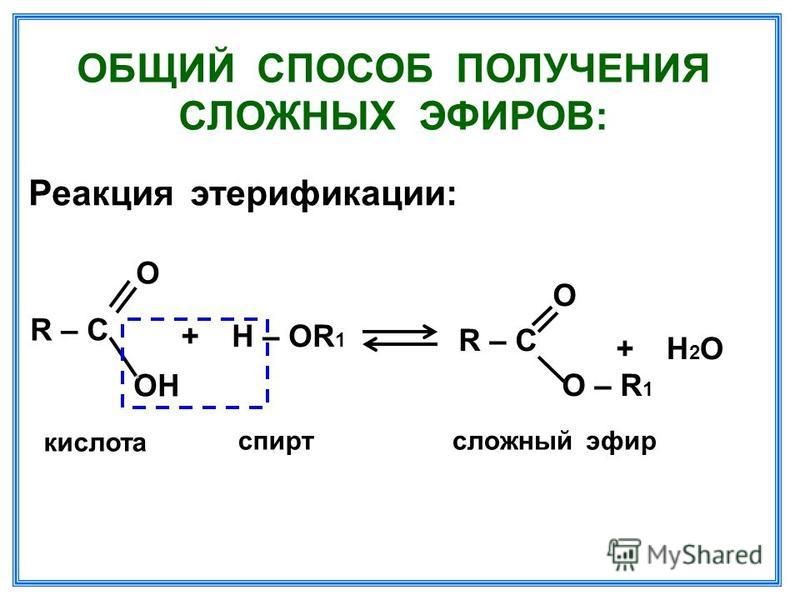 Метрические параметры структур (2 R )- 77 и (11 R )- 138 доступны бесплатно в Кембриджском центре кристаллографических данных (https://www.ccdc.cam.ac). .uk/) под номерами ссылок 1918528 и 1
Метрические параметры структур (2 R )- 77 и (11 R )- 138 доступны бесплатно в Кембриджском центре кристаллографических данных (https://www.ccdc.cam.ac). .uk/) под номерами ссылок 1918528 и 1
3 соответственно.
Ссылки
Roughley, S.D. & Jordan, A.M. Набор инструментов фармацевта: анализ реакций, используемых при поиске потенциальных лекарств. J. Med. Химия . 54 , 3451–3479 (2011).
Артикул
КАСGoogle ученый
Fischer, J. & Ganellin, C.R. (eds) Analog-based Drug Discovery 206–217 (Wiley, 2006).
Williamson, W. Ueber die theory der aetherbildung. Юстус Либигс Энн. Химия . 77 , 37–49 (1851).
Артикул
КАСGoogle ученый
«>Свами, К.К.К., Кумар, Н.Н.Б., Балараман, Э. и Кумар, К.В.П.П. Мицунобу и родственные реакции: достижения и приложения. Хим. Версия . 109 , 2551–2651 (2009).
Артикул
КАСGoogle ученый
Beyerman, H.C. & Heiszwolf, G.J. Реакция стероидных спиртов с изобутеном. Полезность t -бутил как гидроксилзащитная группа в синтезе тестостерона. Рек. Трав. Чим. Pays-Bas 84 , 203–212 (1965).
Артикул
КАСGoogle ученый
Smith, M.B. & March, J. March’s Advanced Organic Chemistry 1037–1041 (Wiley, 2007).
Абрахам С. и др. Соединения киназ аврора и способы их применения. Международный патент №.
 WO2011088045A1 (2011 г.).
WO2011088045A1 (2011 г.).Kolbe, H. Beobachtungen über die oxydirende wirkung des sauerstoffs, wenn derselbe mit hülfe einer elektrischen säule entwickelt wird. J. Prakt. Химия . 41 , 137–139 (1847).
Артикул
Google ученый
Hofer, H. & Moest, M. Mittheilung aus dem dem elektrochemischen Laboratorium der Königl, Высшая техническая школа Мюнхена. Юстус Либигс Энн. Химия . 323 , 284–323 (1902).
Артикул
КАСGoogle ученый
Кори, Э. Дж., Баулд, Н. Л., Ла Лонд, Р. Т., Казанова, Дж., Младший и Кайзер, Э. Т. Получение катионного углерода анодным окислением карбоновых кислот. Дж. Ам. хим. Соц . 82 , 2645–2646 (1960).
Артикул
КАСGoogle ученый
«>Буньян П.Дж. и Хей Д.Х. Электролиз некоторых арилзамещенных алифатических кислот. J. Chem. Соц . 1360–1365 (1962).
Ивасаки Т., Хрорикава Х., Мацумото К. и Миёси М. Электрохимический синтез и реакционная способность производных α-алкокси α-аминокислот. Бык. хим. соц. Япония . 52 , 826–830 (1979).
Артикул
КАСGoogle ученый
Тадзима Т., Курихара Х. и Фучигами Т. Разработка электролитической системы для электролиза без Кольбе на основе кислотно-основной реакции между карбоновыми кислотами в качестве субстрата и основаниями на твердом носителе.
 Дж. Ам. хим. Соц . 129 , 6680–6681 (2007).
Дж. Ам. хим. Соц . 129 , 6680–6681 (2007).Артикул
КАСGoogle ученый
Штельман А.В., Беккер Дж.Ю. Электрохимический синтез 1,2-дисилилэтанов из α-силилуксусных кислот. J. Org. Химия . 76 , 4710–4714 (2011).
Артикул
КАСGoogle ученый
Тории С., Инокути Т., Мидзугути К. и Ямадзаки М. Реакции электролитического декарбоксилирования. 4. Электросинтез ацетатов 3-алкил-2-циклоалкен-1-ола из 1-алкил-2-циклоалкен-1-карбоновых кислот. Получение dl-мускона из циклопентадеканона. Дж. Орг. Химия . 44 , 2303–2307 (1979).
Артикул
КАСGoogle ученый
Коулман Дж. П., Лайнс Р., Атли Дж. Х. П. и Уидон Б. С. Л. Электроорганические реакции. Часть II. Механизм колбе-электролиза замещенных ионов фенилацетата.
 J. Chem. Soc., Perkin Trans . 2 1064–1069 (1974).
J. Chem. Soc., Perkin Trans . 2 1064–1069 (1974).Артикул
Google ученый
Мао, Р., Балон, Дж. и Ху, X. Декарбоксилатное перекрестное сочетание C (sp 3 )–O. Анжю. хим. Междунар. Эд . 57 , 13624–13628 (2018).
Артикул
КАСGoogle ученый
Ян М., Кавамата Ю. и Баран П. С. Синтетические органические электрохимические методы с 2000 г.: на пороге возрождения. Хим. Версия . 117 , 13230–13319 (2017).
Артикул
КАСGoogle ученый
Росс, С. Д. и Финкельштейн, М. Анодное окисление. V. Окисление по Кольбе фенилуксусной кислоты и 1-метилциклогексануксусной кислоты по платине и по углероду. J. Org. Химия . 34 , 2923–2927 (1969).
Артикул
КАСGoogle ученый
«>Koehl, WJ. Анодное окисление алифатических кислот на угольных анодах. Дж. Ам. хим. Соц . 86 , 4686–4690 (1964).
Артикул
КАСGoogle ученый
Ивасаки Т., Хорикава Х., Мацумото К. и Миёси М. Электрохимический синтез производных 2-ацетокси-2-аминокислот и 3-ацетокси-3-аминокислот. Дж. Орг. Химия . 42 , 2419–2423 (1977).
Артикул
КАСGoogle ученый
Huang, X., Liu, W., Hooker, JM & Groves, JT. Направленное фторирование фторид-ионом путем декарбоксилирования, катализируемого марганцем. Анжю. хим. Междунар. Эд . 54 , 5241–5245 (2015).

Артикул
КАСGoogle ученый
Эберсон Л. и Найберг К. Исследования электролитического синтеза Кольбе. V. Электрохимический аналог реакции Риттера. Акта Хим. Скан . 18 , 1567–1568 (1964).
Артикул
КАСGoogle ученый
Кюрти, Л. и Чако, Б. Стратегическое применение именованных реакций в органическом синтезе 484–485 (Elsevier, 2005).
Луо, X., Ма, X., Лебрекс, Ф., Марко, И. Э. и Лам, К. Электрохимическое метоксиметилирование спиртов – новый, экологичный и безопасный подход к получению эфиров МОМ и других ацеталей. Хим. Коммуна . 54 , 9969–9972 (2018).
Артикул
КАС
Google ученый
Шефер, Х. Дж. Недавний вклад электролиза Кольбе в органический синтез. Верх. Курс. Химия . 152 , 91–151 (1990).
Артикул
Google ученый
Ссылки на скачивание
Благодарности
Финансовая поддержка этой работы была предоставлена Pfizer, Inc., Национальным научным фондом (грант CCI Phase 1 1740656) и Национальным институтом здравоохранения (номер гранта GM-118176). Китайский стипендиальный совет и Университет Цзилинь поддержали стипендию для JX, Zhejiang Yuanhong Medicine Technology Co. Ltd поддержала стипендию для MS, Фонд Хьюитта поддержала стипендию для YK, Шведский исследовательский совет поддержал стипендию для HL, Стипендия Фулбрайта поддержала стипендию для П.М. и С.Х.Р. отмечает программу стипендий для выпускников NSF (№ 2017237151) и стипендию Дональда и Делии Бакстер.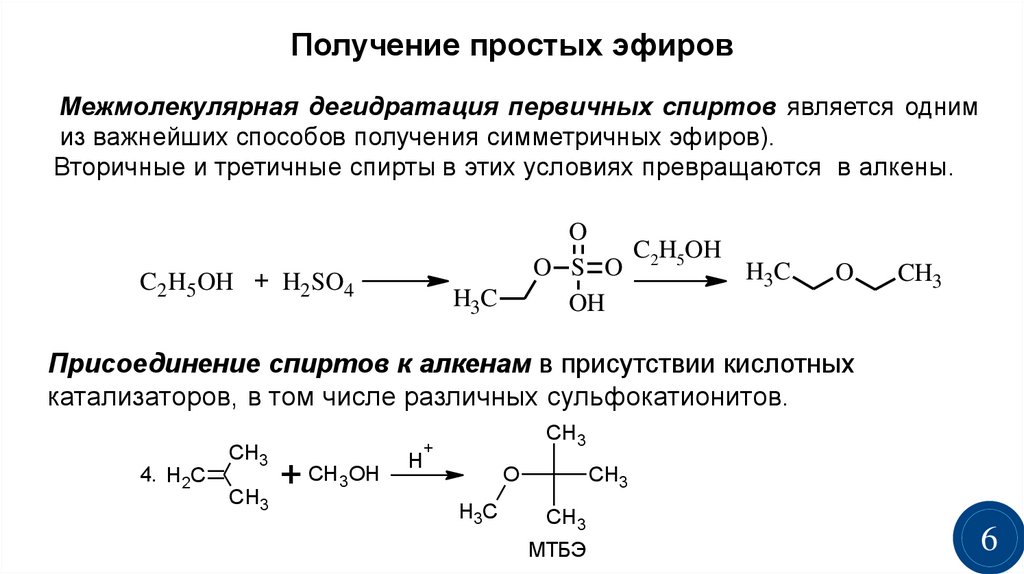 Мы благодарим Д.-Х. Хуанг и Л. Пастернак за помощь в ЯМР-спектроскопии; J. Chen за измерение данных масс-спектроскопии высокого разрешения и A. Rheingold, C.E. Moore и M.A. Galella за рентгеноструктурный анализ.
Мы благодарим Д.-Х. Хуанг и Л. Пастернак за помощь в ЯМР-спектроскопии; J. Chen за измерение данных масс-спектроскопии высокого разрешения и A. Rheingold, C.E. Moore и M.A. Galella за рентгеноструктурный анализ.
Информация о авторе
Авторы Примечания
Эти авторы внесли свой вклад: Джинбао Сян, Мин Шан
Авторы и принадлежности
Отдел химии, Scripps Research, La Jolla
. , Минг Шан, Ю Кавамата, Хелена Лундберг, Соломон Х. Рейсберг, Мяо Чен, Павел Михайлюк, Донна Г. Блэкмонд и Фил С. Баран
Центр комбинаторной химии и открытия лекарств Цзилиньского университета, Фармацевтическая школа наук, Цзилиньский университет, Цзилинь, Китайская Народная Республика
Jinbao Xiang
Department of Chemistry, KTH Royal Institute of Technology, Stockholm, Sweden
Helena Lundberg
Enamine Ltd, Kiev, Ukraine
Pavel Mykhailiuk
Chemistry Department, Taras Shevchenko National University г.
 Киев, Киев, Украина
Киев, Киев, УкраинаПавел Михайлюк
Chemical and Synthetic Development, Bristol-Myers Squibb, New Brunswick, NJ, USA
Gregory Beutner
Химический факультет, La Jolla Laboratories, Pfizer Inc., Сан-Диего, Калифорния, США
Майкл Р. Коллинз, Мэтью Дель Бел, Гэри М. Гальего, Джиллиан Э. Спэнглер и Шоулян Ян
Pfizer Medicinal Sciences, Groton, CT, USA
Alyn Davies & Jeremy Starr
Авторы
- Jinbao Xiang
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Академия - Ming Shang
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Yu Kawamata
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Helena Lundberg
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Соломон Х.
 Рейсберг
РейсбергПосмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Miao Chen
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Павел Михайлюк
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Gregory Beutner
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Michael R. Collins
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Alyn Davies
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Мэтью Дель Бел
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Гэри М.
 Гальего
ГальегоПросмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Jillian E. Spangler
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Jeremy Starr
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Академия - Shouliang Yang
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Donna G. Blackmond
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Phil S. Baran
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Взносы
J.X., M.S. и P.S.B. задумал проект. Дж. Х., М. С. , Ю. К., Х. Л., Д. Г. Б. и P.S.B. разработали эксперименты и проанализировали данные. Дж. К. и М. С. разработал электрохимические методы декарбоксилирования и выполнил их приложения. Х.Л. и Ю.К. провел механистическое исследование. J.X., M.S., SHR, M.C., P.M., G.B., M.R.C., A.D., M.D.B., G.M.G., J.E.S., J.S. и С.Ю. провел эксперименты, чтобы продемонстрировать масштаб подложки. P.S.B. написал рукопись. Дж. Х., М. С., Ю. К., С. Х. Р., П. М., Х. Л. и Д. Г. Б. помощь в написании и редактировании рукописи.
, Ю. К., Х. Л., Д. Г. Б. и P.S.B. разработали эксперименты и проанализировали данные. Дж. К. и М. С. разработал электрохимические методы декарбоксилирования и выполнил их приложения. Х.Л. и Ю.К. провел механистическое исследование. J.X., M.S., SHR, M.C., P.M., G.B., M.R.C., A.D., M.D.B., G.M.G., J.E.S., J.S. и С.Ю. провел эксперименты, чтобы продемонстрировать масштаб подложки. P.S.B. написал рукопись. Дж. Х., М. С., Ю. К., С. Х. Р., П. М., Х. Л. и Д. Г. Б. помощь в написании и редактировании рукописи.
Автор, ответственный за переписку
Переписка с
Фил С. Баран.
Заявление об этике
Конкурирующие интересы
Авторы не заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя: Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительная информация
Дополнительная информация
Дополнительные данные 1
CIF-файл (2R) -77
Дополнительные данные 2
CIF-файл (11R) -138
Дополнительные данные 3
Checkcif of (2r) -777
PUMPERMARE DATE.

Контрольный номер (11R)-138
Права и разрешения
Перепечатка и разрешения
Об этой статье
Эта статья цитируется
Катализируемый никелем многокомпонентный стереодивергентный синтез олефинов с использованием электрохимии, фотокатализа и фотоэлектрохимии
- Чэнь Чжу
- Хуйфэн Юэ
- Магнус Рупинг
Nature Communications (2022)
Катализируемое серебром сайт-селективное C(sp3)-H бензилирование простых эфиров N-трифтозилгидразонами
- Чжаохун Лю
- Хунвэй Ван
- Сихэ Би
Nature Communications (2022)
Каталитически контролируемая функционализация карбоновых кислот путем электроокисления самоорганизующихся карбоксильных монослоев
- Хизер А.
 Хинтц
Хинтц - Христо С. Севов
Nature Communications (2022)
- Хизер А.
Легкое и общее электрохимическое дейтерирование неактивированных алкилгалогенидов
- Пэнфэй Ли
- Чэнчэн Го
- Юай Цю
Nature Communications (2022)
Фоторедокс-катализируемый разрыв связи C–C циклопропанов с образованием связей C(sp3)–гетероатом
- Лян Гэ
- Чи Чжан
- Чао Фэн
Nature Communications (2022)
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и Правила сообщества.

 Теория этерификации.
Теория этерификации.  спирты в субстрате. Общие защитные группы включают метоксиметил (МОМ) и 2-метоксиэтоксиметил (МЕМ). Защита MOM используется в этом полном синтезе профессором Кеком и его коллегами.
спирты в субстрате. Общие защитные группы включают метоксиметил (МОМ) и 2-метоксиэтоксиметил (МЕМ). Защита MOM используется в этом полном синтезе профессором Кеком и его коллегами. Коллинз 7 ,
Коллинз 7 , обращений
обращений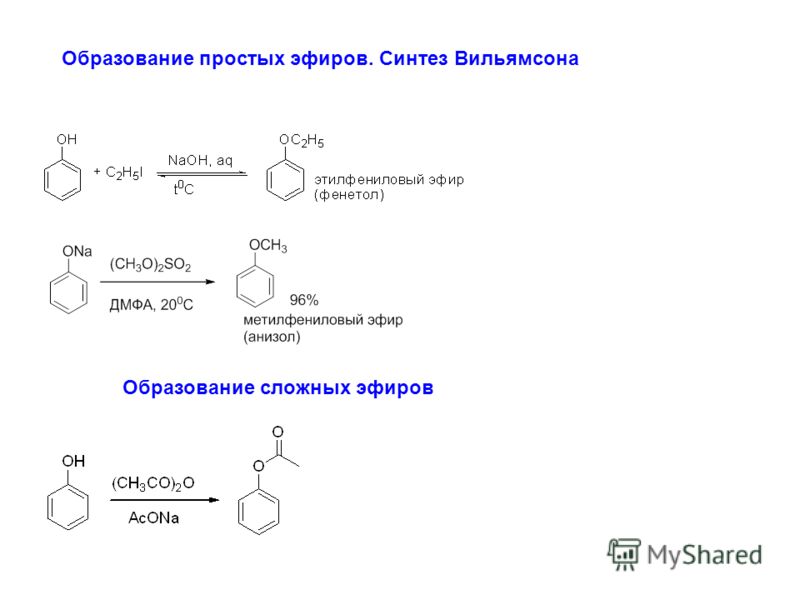

 WO2011088045A1 (2011 г.).
WO2011088045A1 (2011 г.). Дж. Ам. хим. Соц . 129 , 6680–6681 (2007).
Дж. Ам. хим. Соц . 129 , 6680–6681 (2007).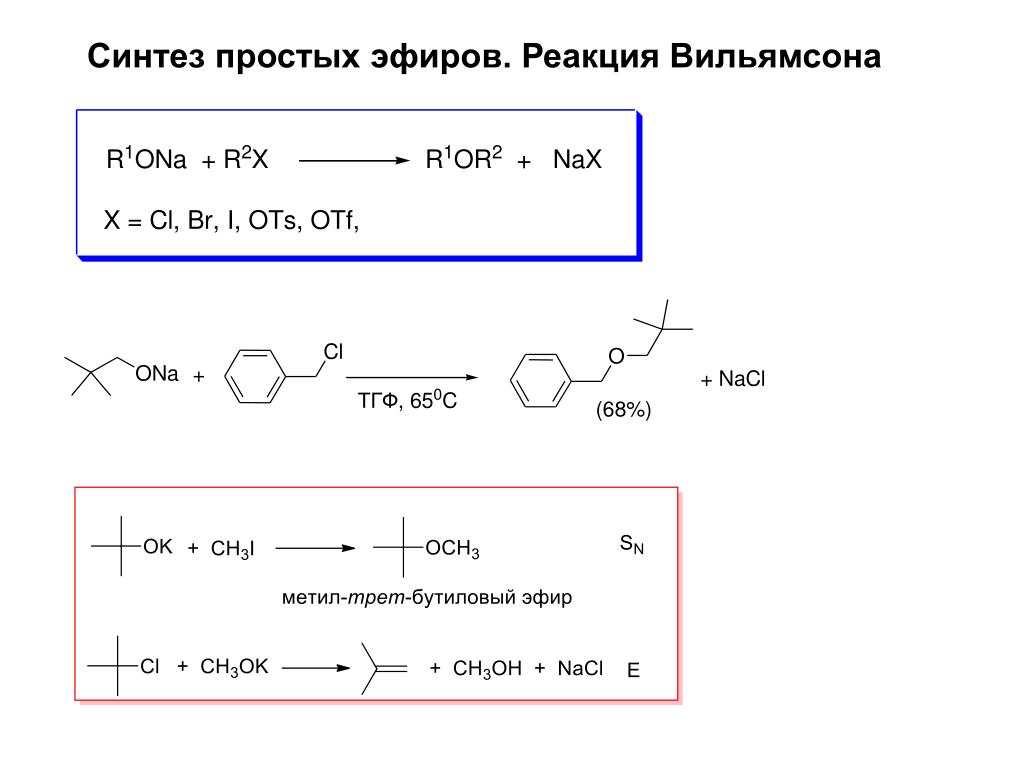 J. Chem. Soc., Perkin Trans . 2 1064–1069 (1974).
J. Chem. Soc., Perkin Trans . 2 1064–1069 (1974).
 Киев, Киев, Украина
Киев, Киев, Украина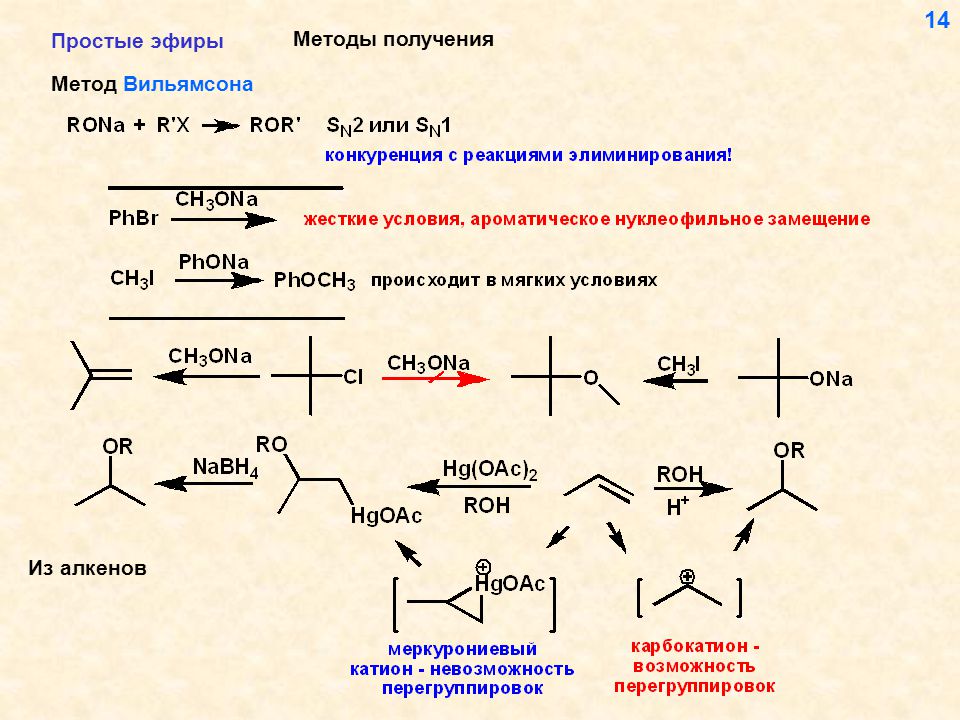 Рейсберг
Рейсберг Гальего
Гальего