Содержание
Диэтиловый эфир. Мини-справочник по химическим веществам (3340 веществ)
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
Синонимы:
серный эфир
этиловый эфир
этоксиэтан
Внешний вид:
бесцветн. жидкость
Кристаллические модификации, цвет растворов и паров:
В твердом виде — ромбические кристаллы.
Брутто-формула (система Хилла): C
4H10O
Формула в виде текста: C2H5OC2H5
Молекулярная масса (в а.е.м.): 74,12
Температура плавления (в °C): -116,3
Температура кипения (в °C): 35,6
Растворимость (в г/100 г или характеристика):
ацетон: хорошо растворим
бензол: хорошо растворим
вода: 6,5 (20°C)
лигроин: хорошо растворим
хлороформ: хорошо растворим
этанол: хорошо растворим
Дополнительное описание:
Порог восприятия запаха в воздухе (мг/л) = 0,001
Метод получения 1.

(лабораторный синтез)
Источник информации: «Препаративная органическая химия» М. 1959 стр. 342
В круглодонную широкогорлую колбу емкостью 750 мл помещают 150 мл этилового спирта, затем порциями добавляют, при перемешивании и охлаждении, 150 мл серной кислоты (d=l,84). Колбу закрывают пробкой (резиновые не рекомендуются), сквозь которую пропущены капельная воронка, термометр и трубка, соединяющая колбу с вертикально поставленным спиральным холодильником.
Приемником служит колба Бунзена, на боковой отвод которой надета каучуковая трубка, отводящая пары эфира в раковину водопровода. Сборник охлаждают водой со льдом. Ртутный шарик термометра и трубка капельной воронки должны быть погружены в жидкость (но не глубоко).
В капельную воронку, с хорошо смазанным краном, вливают 300 мл этилового спирта. Содержимое колбы нагревают на горелке с предохранительной сеткой. Когда температура достигнет 140°, к смеси начинают по каплям, приливать спирт с такой скоростью, чтобы, несмотря на начавшуюся отгонку эфира, уровень жидкости в колбе оставался постоянным. Температура не должна превышать 145° (иначе образуется этилен). По окончании приливания спирта смесь нагревают еще 5 минут, после чего горелку гасят.
Температура не должна превышать 145° (иначе образуется этилен). По окончании приливания спирта смесь нагревают еще 5 минут, после чего горелку гасят.
Дистиллят, содержащий, кроме эфира, воду, спирт и сернистую кислоту, дважды промывают в делительной воронке 100 мл холодного 5%-ного раствора едкого натра. Эфирный слой после отделения дважды промывают 50%-ным раствором хлористого кальция, взятым в количестве, равном половине объема дистиллята.
Тщательно отделенный эфирный слой переливают в сухую склянку и сушат хлористым кальцием (не менее 30 г) в течение 4—5 часов. Высушенный эфир отфильтровывают от хлористого кальция и перегоняют с дефлегматором на водяной бане, собирая фракцию, кипящую при 33— 38°.
Выход — около 135 г (66% от теоретического). Все работы с эфиром следует проводить вдали от огня.
Метод очистки или выделения из смесей 1.
Источник информации: Гитис С.С., Глаз А.И., Иванов А.В. «Практикум по органической химии: Органический синтез» М. : Высшая школа, 1991 стр. 47
: Высшая школа, 1991 стр. 47
Удалить пероксиды можно действием щелочей или восстановителей — сульфита натрия или соли железа (II). В первом случае эфир встряхивают с порошкообразным гидроксидом калия. Восстановление осуществляют насыщенным на холоду и разбавленным затем в три раза водой раствором сульфита натрия или концентрированным подкисленным раствором соли железа (II). Очистку ведут до тех пор, пока проба перестанет давать реакцию на перокснды. На 1 л эфира берут около 70 г щелочи, 70… 75 мл раствора сульфита натрия или 10…20 мл концентрированного раствора соли железа (11), разбавленного 100 мл воды. Исходный раствор соли железа готовят из 60 г кристаллического сульфата железа (II), 6 мл концентрированной серной кислоты и 110 мл воды, либо из 100 г хлорида железа (II), 42 мл концентрированной соляной кислоты и 85 мл воды.
Метод очистки или выделения из смесей 2.
Источник информации: Гитис С.С., Глаз А.И., Иванов А.В. «Практикум по органической химии: Органический синтез» М.: Высшая школа, 1991 стр. 47-48
«Практикум по органической химии: Органический синтез» М.: Высшая школа, 1991 стр. 47-48
Очищенный от пероксидов эфир для удаления примеси этилового спирта промывают водой, а затем насыщенным на холоду раствором хлорида кальция. Промытый эфир переливают в склянку, закрывающуюся корковой пробкой, вносят в нее 150 г безводного хлорида кальция и оставляют стоять не менее чем на сутки, время от времени перемешивая смесь. Затем эфир фильтруют через большой складчатый фильтр в чистую, сухую склянку, следя за тем, чтобы все горелки в радиусе 3 м были выключены. В эфир вносят тонко нарезанные кусочки натрия, очищенного от оксидов, и закрывают корковой пробкой с хлоркальциевой трубкой. Если водород больше не выделяется и поверхность свежих кусочков натрия остается блестящей, то склянку закрывают хорошей корковой пробкой и ставят в темное место. Если поверхность натрня сильно изменилась, необходимо отфильтровать эфир в другую сухую темную склянку и повторить обработку натрием. Иногда эфир дополнительно перегоняют над натрием со всеми предосторожностями, используя предварительно нагретую воздушную баню.
Природные и антропогенные источники:
Выделяется в небольшой концентрации гречихой при цветении.
Плотность:
0,7135 (20°C, г/см3)
0,70778 (25°C, г/см3)
Показатель преломления (для D-линии натрия):
1,3526 (20°C)
Давление паров (в мм.рт.ст.):
1 (-74,3°C)
10 (-48,1°C)
40 (-27,7°C)
200 (2,2°C)
400 (17°C)
Диэлектрическая проницаемость:
4,3 (25°C)
Дипольный момент молекулы (в дебаях):
1,15 (20°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
0,242 (20°C)
Поверхностное натяжение (в мН/м):
17,01 (20°C)
Стандартная мольная теплоемкость C
p (298 К, Дж/моль·K):
172 (ж)
Энтальпия кипения ΔH
кип (кДж/моль):
26,6
Температура вспышки в воздухе (°C):
-41
Температура самовоспламенения на воздухе (°C):
164
Теплота сгорания Q
p(кДж/моль):
2726,7
Критическая температура (в °C):
193,4
Критическое давление (в МПа):
3,61
Дополнительная информация:
Входит в список IV (прекурсоры) наркотических и психотропных веществ.
- Бабаян Э.А., Гаевский А.В., Бардин Е.В. «Правовые аспекты оборота наркотических, психотропных, сильнодействующих, ядовитых веществ и прекурсоров» М.: МЦФЭР, 2000 стр. 148
- Гурвич Я.А. «Справочник молодого аппаратчика-химика» М.:Химия, 1991 стр. 229
- Девяткин В.В., Ляхова Ю.М. «Химия для любознательных, или о чем не узнаешь на уроке» Ярославль:Академия Холдинг, 2000 стр. 48
- Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 148
Источники информации:
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
Еще по теме:
- ДИЭТИЛОВЫЙ ЭФИР — химическая энциклопедия
- диэтиловый эфир — химическая энциклопедия
- диэтиловый эфир — химическая энциклопедия
Новости медицины фармации и здравоохранения
Новости медицины фармации и здравоохранения | Remedium. ru
ru
Популярное
- Подписан закон об изменениях в обращении медицинских изделий
- У крупнейших фармацевтических дистрибьюторов сокращается рыночная доля
- Появятся ли в российских регионах передвижные аптечные пункты
- Аптечная розница: ожидания и реальность
- Внесены изменения в закон о санитарно-эпидемиологическом благополучии населения
Карта портала
- СМИ — Новости
- Пресс-Релизы
- Фармацевтам
- Врачам
- Акушерство и гинекология
- Аллергология
- Гастроэнтерология
- Гепатология
- Дерматология
- Диетология
- Инфекционные заболевания
- Исследования и разработки
- Кардиология
- Неврология
- Онкология
- Оториноларингология
- Педиатрия
- Психиатрия
- Психология
- Пульмонология
- Ревматология
- Стоматология
- Терапия
- Травматология
- Урология
- Хирургия
- Эндокринология
- Специалистам здравоохранения
- Фармацевтический рынок
- Промышленность
- Фармацевтическая промышленность
- Медтехника +
- Правовая хроника
- Аналитика
- Законодательство
- Документы для аптечных учреждений
- Документы о здравоохранении
- Разные документы
- Медицинские издания
- Журналы
- Книги
- Мероприятия
- О компании
- О проекте
- Реклама
- Контакты
- Поиск
- Еnglish
| Логин: | |
| Пароль: | |
| Запомнить меня | |
| Регистрация | |
| Забыли свой пароль? | |
Подписка Онлайн
Книги Журналы
Новости
11 ноября 2022
Фармацевтический кластер для разработки лекарств создают в Пермском крае
Заключено соглашение о создании в регионе Центра кластерного развития фармотрасли «Парма».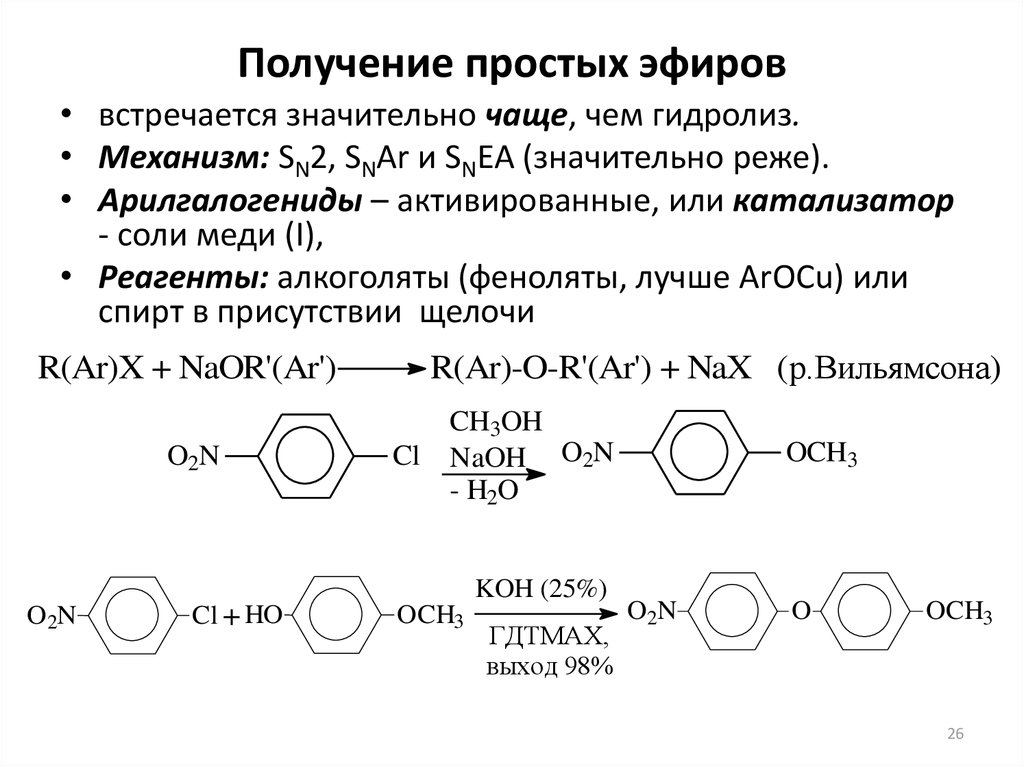
Подробнее
11 ноября 2022
За полгода в стране закрылись более тысячи аптек
11 ноября 2022
Фонд «Семьи СМА» скептически относится к разработке аналога препарата Золгенсма
/pharmacy/detail.php%3fid%3d57548
Врачам
10 ноября 2022
Пришеечный кариес — симптомы и лечение
Кариес зубов представляет собой опосредованное биопленками многофакторное динамическое…
Подробнее
9 ноября 2022
Ингаляции маннитола для детей с муковисцидозом: эффективность и безопасность
7 ноября 2022
Многогранные свойства эрдостеина и его место в лечении заболеваний респираторного тракта
Фармацевтам
24 октября 2022
Открытие конкурентов рядом с аптечной организацией
Совсем рядом с нашей аптекой, стенка в стенку, открылись конкуренты.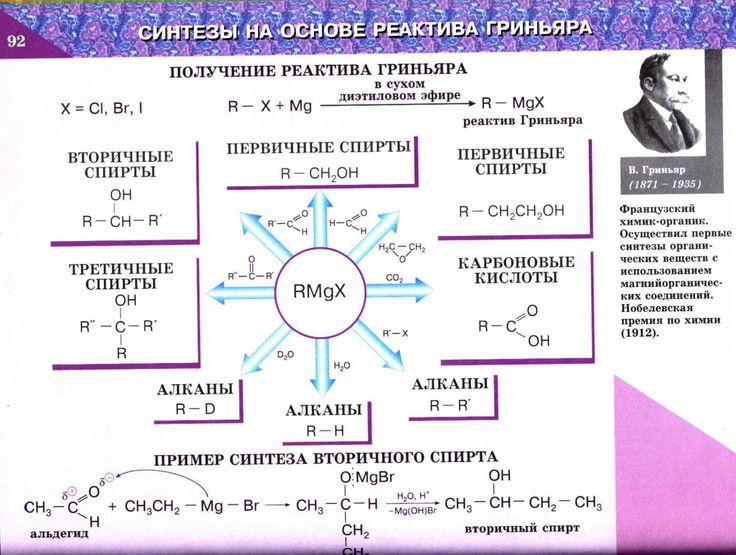 Это законно?
Это законно?
Подробнее
30 августа 2022
Отпуск сразу большого количества упаковок ОТС-препарата
9 августа 2022
Душно в торговом зале аптеки – улучшение условий труда в такой ситуации
Искать
Раздел не найден.
Раздел не найден.
Метанол — Sciencemadness Wiki
Метанол или метиловый спирт — простейший спирт с формулой CH 3 OH , также сокращенно MeOH . Это легкая, бесцветная, летучая, легковоспламеняющаяся жидкость. Это важное химическое соединение в качестве растворителя и органического соединения исходного сырья. [1]
Это важное химическое соединение в качестве растворителя и органического соединения исходного сырья. [1]
Содержание
- 1 Свойства
- 1.1 Химическая
- 1.2 Физический
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.1.1 Идентификация метанола
- 5.2 Хранение
- 5.3 Утилизация
- 5.1 Безопасность
- 6 Каталожные номера
- 6.1 Соответствующие темы Sciencemadness
Свойства
Химический
Метанол является исходным продуктом для многих органических соединений, таких как формальдегид, который получают путем окисления метанола.
- CH 3 OH + [O] → CH 2 O + H 2 O
Метанол сгорает при воспламенении на воздухе с образованием углекислого газа и паров воды. В качестве побочного продукта образуются мельчайшие следы формальдегида, если при горении не происходит избытка кислорода.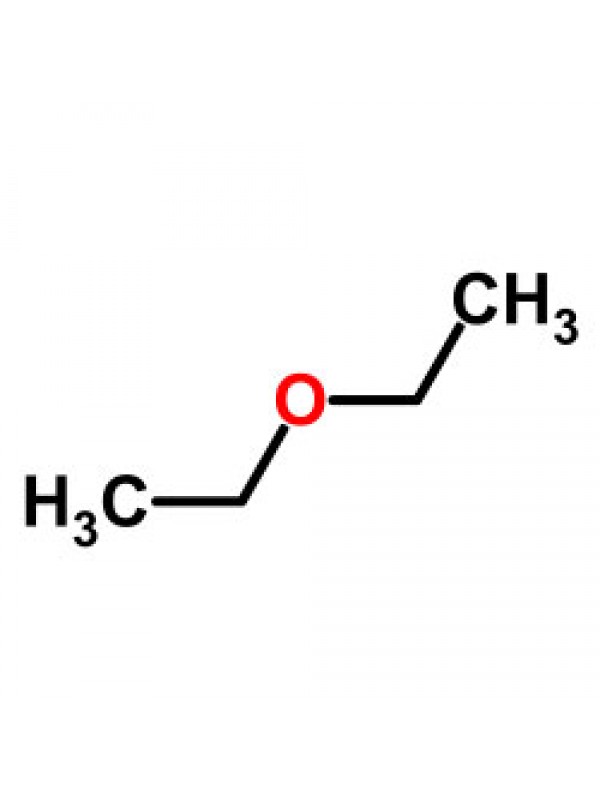
- 2 CH 3 OH + 3 O 2 → 2 CO 2 + 4 H 2 O
Реакция метанола с йодистоводородной кислотой дает йодистоводородную кислоту.
- CH 3 OH + HI → CH 3 I + H 2 O
В отличие от этанола, добавление аниона гипохлорита к метанолу дает не хлороформ, а метилгипохлорит, очень опасный и нестабильный соединение, которое быстро разлагается и может даже взорваться при высоких концентрациях.
- CH 3 OH + 2 NaClO → CH 3 ClO + NaCl + NaOH
Пары метанола в воздухе разлагаются в течение нескольких дней с образованием углекислого газа и водяного пара. [2]
Метанол также используется в производстве биодизеля.
Физический
Метанол представляет собой бесцветную летучую легковоспламеняющуюся жидкость со спиртовым запахом. Он имеет молекулярную массу 32,04, температуру кипения 65 °C и плотность 0,7914 г/см 3 . [3] Метанол смешивается с различными органическими и неорганическими растворителями, хотя и не так часто, как этанол. Смеси метанол/вода можно разделить на два слоя высаливанием карбонатом калия.
[3] Метанол смешивается с различными органическими и неорганическими растворителями, хотя и не так часто, как этанол. Смеси метанол/вода можно разделить на два слоя высаливанием карбонатом калия.
Доступность
Метанол доступен по низкой цене у большинства поставщиков химикатов.
Тип антифриза и автомобильного очистителя, известный как Heet, можно найти на большинстве заправочных станций в Соединенных Штатах, и он содержит метанол на 99% или выше. Некоторые альтернативные виды топлива полностью или в основном состоят из метанола, и из-за обычно продаваемых больших количеств это может быть очень эффективным способом его покупки.
Метанол иногда продается в магазинах красок в виде древесного спирта или метилового спирта. [4] Его также можно купить у научных поставщиков в более высоких классах. Поставки оборудования иногда продают метанол как «метилгидрат». Наконец, некоторые домашние камины используют в качестве топлива метанол, поэтому его также можно найти таким образом. Некоторые растворы для мытья окон содержат 50-90% метанола, а также следы воды и красителя или других спиртов, хотя это встречается реже, поскольку метанол дешевле других спиртов. Некоторые технические спирты представляют собой не что иное, как почти чистый метанол, смешанный с красителем.
Некоторые растворы для мытья окон содержат 50-90% метанола, а также следы воды и красителя или других спиртов, хотя это встречается реже, поскольку метанол дешевле других спиртов. Некоторые технические спирты представляют собой не что иное, как почти чистый метанол, смешанный с красителем.
В некоторых странах продажа «чистого» (высокочистого) метанола может регулироваться из-за того, что он классифицируется как яд или из-за его использования в поддельном спирте. С мая 2018 года продажа средств для мытья окон, содержащих более 0,6% метанола, ограничена в странах ЕС, хотя во многих странах этот запрет, по-видимому, в значительной степени игнорируется, или средства для мытья окон на основе метанола были перемаркированы как технический спирт для общего использования и целей. . [5]
Подготовка
В промышленности метанол получают реакцией монооксида углерода и водорода на катализаторе (обычно это смесь оксидов меди и цинка) при высоких температурах и давлениях. Этот маршрут не практичен в лабораторных масштабах.
Этот маршрут не практичен в лабораторных масштабах.
Неочищенный метанол можно получить деструктивной перегонкой древесины. Этот процесс экономически нецелесообразен в небольших масштабах и дает много побочных продуктов / загрязняющих веществ, в том числе уксусную кислоту, ацетон и смолы. Тем не менее, это все еще интересный процесс, и его можно было бы попробовать исключительно в образовательных целях. [6]
Другой возможный способ получения включает гидролиз метиловых эфиров, таких как метилбензоат. [7] Этот способ позволяет получить гораздо более чистый метанол.
Проекты
- Производство формальдегида
- Сделать триметилборат
- Получение метилсалицилата и других метиловых эфиров
- Синтез йодистого метила
- Синтез диметилового эфира
- Топливный элемент прямого действия на метаноле
- Отделение мочевины от солей аммония (мочевина хорошо растворима в метаноле, но сульфат аммония, например, нет)
Обращение
Безопасность
Метанол значительно более токсичен, чем другие распространенные спирты, такие как этанол или изопропанол, поскольку он метаболизируется к муравьиной кислоте в организме, вызывая слепоту и смерть при высоких дозах. По возможности следует избегать вдыхания паров и контакта с кожей.
По возможности следует избегать вдыхания паров и контакта с кожей.
Случайное проглатывание большого количества метанола приведет к слепоте, а дозы выше 10 мл могут оказаться смертельными. При случайном употреблении метанола первая помощь заключается в том, чтобы дать больному этанол, перорально, водку или другой пищевой спиртосодержащий напиток, а затем немедленно вызвать скорую помощь. Этанол не нейтрализует действие метанола, а конкурирует с ним и препятствует его немедленному метаболизму, что дает врачам больше времени для спасения пациента.
Пламя метанола, как правило, имеет чрезвычайно низкую видимость, особенно в дневное время или в хорошо освещенных помещениях, что затрудняет обнаружение горящего метанола и создает большой риск. Если он используется в случаях, когда возможно возгорание, добавление небольшого количества борной кислоты окрашивает пламя в зеленый цвет и позволяет его увидеть.
Идентификация метанола
Учитывая, что метанол очень похож на этанол по свойствам (запах практически идентичен, их плотность также очень похожа), важно иметь хороший метод различения метанола и этанола.
Поскольку даже минимальное количество примесей в метаноле окрашивает пламя, сжигание спирта — не лучший способ определить, метанол ли у вас там.
Грубый способ обнаружения метанола заключается в том, чтобы поместить в спирт раскаленный кусок медной проволоки. Если пары имеют резкий запах типа «морга» (запах формальдегида), то спирт может содержать метанол. Однако этот метод не очень надежен, так как многие другие соединения могут давать похожий запах, и не каждый человек воспринимает запах формальдегида одинаково, обычно из-за генетики или других биологических факторов.
Лучший способ проверить, содержит ли ваш спирт метанол или это метанол, это добавить небольшое количество вашего спирта к легкому алкану, такому как пентан, гексан или гептан к спирту, так как алканы смешиваются с этанолом, а метанол не смешивается. . Если ваш спирт образует отдельный слой, это не вода, то это метанол. Это лучше всего работает с почти безводным спиртом, но не подходит для пищевого спирта, который обычно содержит воду или некоторые другие органические соединения, которые мешают тесту.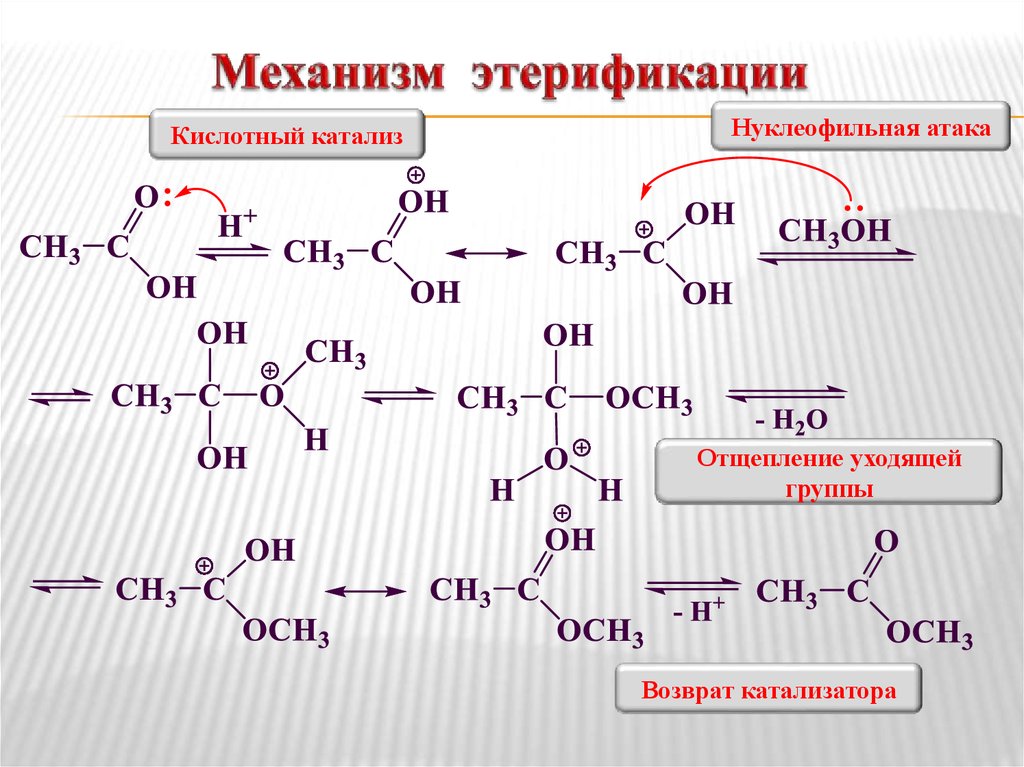
Хранение
Метанол лучше всего хранить в стеклянных или пластиковых бутылках вдали от открытого огня, так как он очень летуч и легко воспламеняется. Убедитесь, что вы четко обозначили бутылку, чтобы отличить ее от менее токсичного и аналогичного этанола.
Утилизация
Сжигание метанола — хороший способ его уничтожения. Делайте это на улице или в вытяжном шкафу. Поскольку метанол горит почти невидимым пламенем, что может представлять серьезную опасность, рекомендуется сделать пламя видимым, смешав метанол с другим растворителем, таким как этанол или ацетон. Старайтесь не сжигать слишком много сразу, чтобы предотвратить его испарение в воздухе или вдыхание продуктов парциального окисления, таких как формальдегид, муравьиная кислота или окись углерода.
Ссылки
- ↑ http://en.wikipedia.org/wiki/Метанол
- ↑ http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=887&loc=ec_rcs#itabs-2d
- ↑ CRC Справочник по химии и физике, 66-е издание, 1985 г.

- ↑ http://en.wikipedia.org/wiki/List_of_commonly_available_chemicals#L.E2.80.93N
- ↑ https://eur-lex.europa.eu/legal-content/EN/ALL/?uri=CELEX:32018R0589
- ↑ http://www.sciencemadness.org/talk/viewthread.php?tid=2652
- ↑ https://www.youtube.com/watch?v=GJMGzIQE4RM
Соответствующие темы Sciencemadness
- Метанол -> метаналь (формальдегид)
- Деструктивная перегонка древесины
- Methanol Synthesis(Newer thread)
Diethyl ether — wikidoc
Template:Chembox E numberTemplate:Chembox RTECSTemplate:Chembox AppearanceTemplate:Chembox OdourTemplate:Chembox DensityTemplate:Chembox MeltingPtTemplate:Chembox BoilingPtTemplate:Chembox SolubilityInWaterTemplate:Chembox VaporPressureTemplate:Chembox RefractIndexTemplate:Chembox ViscosityTemplate:Chembox StructureTemplate:Chembox ThermochemistryTemplate:Chembox MainHazardsTemplate:Chembox RPhrasesTemplate:Chembox SPhrasesTemplate:Chembox NFPATemplate:Chembox FlashPtTemplate:Chembox AutoignitionPtTemplate:Chembox ExploLimitsTemplate:Chembox NIOSH (набор)
Главный редактор: C. Майкл Гибсон, MS, MD [1]
Майкл Гибсон, MS, MD [1]
Обзор
Диэтиловый эфир , также известный как Etoxyethane , этиловый эфир , Sulfuric Ether , или просто Ether , является органическим соединением в классе Ether с Formula (C 666 868686 8686 868686 8686 868686 8686 86868686 8686 8686 8686 8686 86868686 868686 868686 868686 864686 8646 8646 8646 8646 8646 8646 8646 86466 864646 8646468. 2 . H
5 )
2 O. Это бесцветная легколетучая легковоспламеняющаяся жидкость. Он обычно используется в качестве растворителя и когда-то использовался в качестве общего анестетика. Он обладает наркотическими свойствами и, как известно, вызывает временную зависимость, единственным симптомом которой является желание потреблять больше, иногда называемое эфироманией.
История
Комплекс мог быть создан либо Джабиром ибн Хайяном в 8 веке [4] , либо Рамоном Луллием в 1275, [4] [5] , хотя современных свидетельств этому нет. Впервые оно было синтезировано в 1540 году Валериусом Кордусом, который назвал его «сладким маслом купороса» ( oleum dulce vitrioli ) — название отражает тот факт, что его получают перегонкой смеси этанола и серной кислоты (тогда известной как масло купороса) — и отметил некоторые его лечебные свойства. [4] Примерно в то же время Парацельс обнаружил обезболивающие свойства эфира у цыплят. [4] Название эфир было дано веществу в 1729 году Августом Зигмундом Фробениусом. [6]
Впервые оно было синтезировано в 1540 году Валериусом Кордусом, который назвал его «сладким маслом купороса» ( oleum dulce vitrioli ) — название отражает тот факт, что его получают перегонкой смеси этанола и серной кислоты (тогда известной как масло купороса) — и отметил некоторые его лечебные свойства. [4] Примерно в то же время Парацельс обнаружил обезболивающие свойства эфира у цыплят. [4] Название эфир было дано веществу в 1729 году Августом Зигмундом Фробениусом. [6]
Применение
Он особенно важен в качестве растворителя при производстве целлюлозных пластиков, таких как ацетат целлюлозы. [7]
В качестве топлива
Диэтиловый эфир имеет высокое цетановое число 85-96 и используется в качестве пусковой жидкости в сочетании с нефтяными дистиллятами для бензиновых и дизельных двигателей [8] из-за его высокой летучести и низкой температуры воспламенения. По той же причине он также используется в качестве компонента топливной смеси для карбюраторных моделей двигателей с воспламенением от сжатия. В этом отношении диэтиловый эфир очень похож на один из своих предшественников — этанол.
В этом отношении диэтиловый эфир очень похож на один из своих предшественников — этанол.
Лабораторное использование
Диэтиловый эфир является обычным лабораторным растворителем. Он имеет ограниченную растворимость в воде (6,05 г/100 мл при 25 °C) [9] и растворяет 1,5 г/100 мл воды при 25 °C. [10] Поэтому он обычно используется для жидкостной экстракции. При использовании с водным раствором органический слой оказывается сверху, поскольку диэтиловый эфир имеет меньшую плотность, чем вода. Обратите внимание, что это неэффективный способ извлечения диэтилового эфира, поскольку вода сильно полярна, а эфир неполярен. Это также обычный растворитель для реакции Гриньяра в дополнение к другим реакциям с участием металлоорганических реагентов. Из-за его применения в производстве незаконных веществ он указан в таблице II как прекурсор Конвенции Организации Объединенных Наций о борьбе с незаконным оборотом наркотических средств и психотропных веществ, а также таких веществ, как ацетон, толуол и серная кислота.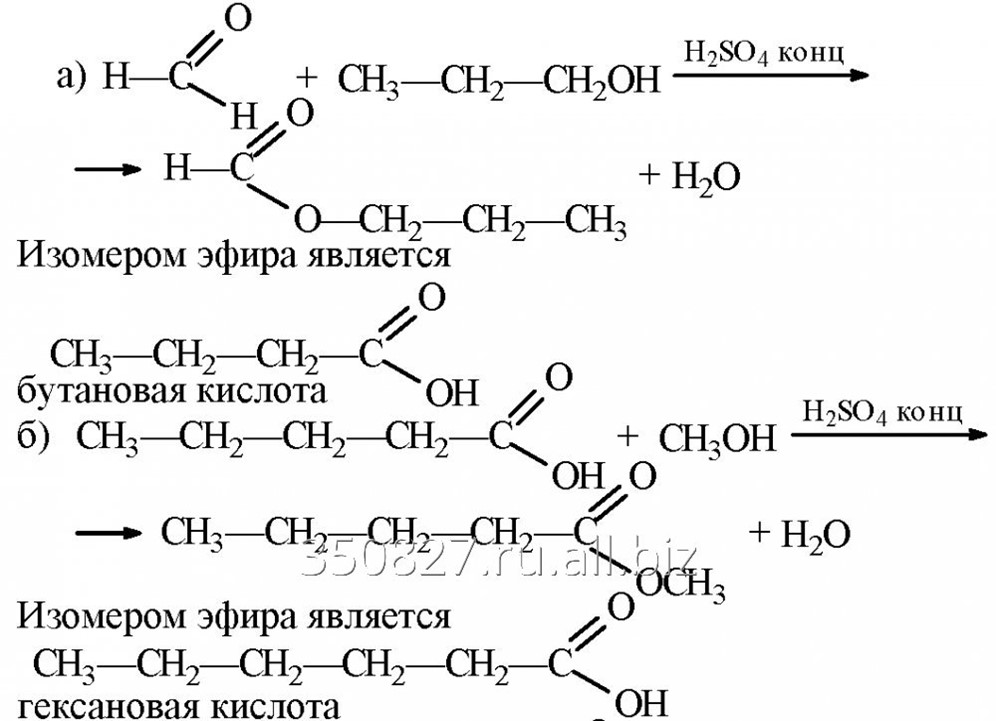 [11]
[11]
Использование анестезии
Панель памятника в Бостоне, посвященная демонстрации Мортоном использования эфира для анестезии.
Уильям Т.Г. Мортон участвовал в публичной демонстрации эфирной анестезии 16 октября 1846 года в Эфирном куполе в Бостоне, штат Массачусетс. Однако теперь известно, что Кроуфорд Уильямсон Лонг, доктор медицины, в частном порядке продемонстрировал его использование в качестве общего анестетика в хирургии официальным лицам в Джорджии еще 30 марта 1842 года, а Лонг публично продемонстрировал использование эфира в качестве хирургического анестетика шесть раз до этого. демонстрация в Бостоне. [12] [13] [14] Британские врачи знали об анестезирующих свойствах эфира еще в 1840 году, когда его широко назначали в сочетании с опиумом. [15]
Диэтиловый эфир в значительной степени вытеснил использование хлороформа в качестве общего анестетика благодаря более благоприятному терапевтическому индексу эфиров, то есть большей разнице между эффективной дозой и потенциально токсичной дозой.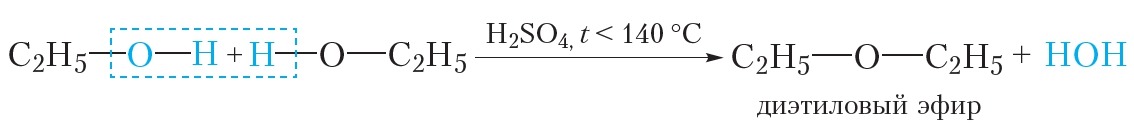 [16] Из-за ассоциации с Бостоном использование эфира стало известно как «Уловка Янки».
[16] Из-за ассоциации с Бостоном использование эфира стало известно как «Уловка Янки».
Диэтиловый эфир угнетает миокард и увеличивает трахеобронхиальную секрецию. [17]
Диэтиловый эфир также можно смешивать с другими анестезирующими агентами, такими как хлороформ для получения смеси ХЭ или хлороформ и спирт для приготовления АСЕ. смесь.
Сегодня эфир используется редко. Использование легковоспламеняющегося эфира было вытеснено негорючими фторированными углеводородными анестетиками. Галотан был первым разработанным таким анестетиком, а другие используемые в настоящее время ингаляционные анестетики, такие как изофлуран, десфлуран и севофлуран, представляют собой галогенированные эфиры. [18] Было обнаружено, что диэтиловый эфир имеет нежелательные побочные эффекты, такие как постнаркозная тошнота и рвота. Современные анестетики уменьшают эти побочные эффекты. [12]
Медицинское применение
Когда-то он использовался в фармацевтике. Смесь спирта и эфира была известна как «спирт эфира» или капли Гофмана. В Соединенных Штатах он был исключен из Фармакопеи до июня 1917 года. [19]
Смесь спирта и эфира была известна как «спирт эфира» или капли Гофмана. В Соединенных Штатах он был исключен из Фармакопеи до июня 1917 года. [19]
Рекреационное использование
0015
Обезболивающее действие эфира сделало его рекреационным наркотиком. Диэтиловый эфир в дозе анестетика — это ингалянт, который давно используется в рекреационных целях. Одним из недостатков является высокая воспламеняемость, особенно в сочетании с кислородом. Одним из преимуществ является четко определенный разрыв между терапевтической и токсической дозами, что означает, что человек потеряет сознание до того, как будет достигнут опасный уровень растворенного эфира в крови. Обладая сильным, густым запахом, эфир вызывает раздражение слизистой оболочки дыхательных путей и вызывает дискомфорт при дыхании, а при передозировке вызывает слюноотделение, рвоту, кашель или судороги. В концентрациях 3-5% в воздухе обезболивающий эффект может быть достигнут медленно через 15-20 минут вдыхания примерно 15-20мл эфира, в зависимости от массы тела и физического состояния. Эфир вызывает очень долгую стадию возбуждения перед потерей сознания.
Эфир вызывает очень долгую стадию возбуждения перед потерей сознания.
В 19 веке и начале 20 века употребление эфира было популярно среди польских крестьян. [20] Это традиционный и до сих пор относительно популярный рекреационный наркотик среди лемков. [21] Обычно его употребляют в небольшом количестве ( кропка , или «точка»), разливая его по стакану с молоком, водой с сахаром или апельсиновым соком.
Метаболизм
Предполагается, что фермент цитохром Р450 метаболизирует диэтиловый эфир. [22]
Диэтиловый эфир ингибирует алкогольдегидрогеназу и тем самым замедляет метаболизм этанола. [23] Он также ингибирует метаболизм других лекарственных средств, требующих окислительного метаболизма.
Например, диазепам требует окисления в печени, тогда как его окисленный метаболит оксазепам этого не требует. [24]
Производство
Большая часть диэтилового эфира производится как побочный продукт парофазной гидратации этилена с получением этанола. В этом процессе используются катализаторы на основе фосфорной кислоты на твердом носителе, и при необходимости его можно отрегулировать для получения большего количества эфира. [7] Парофазная дегидратация этанола над некоторыми алюмооксидными катализаторами может давать выход диэтилового эфира до 95%. [25]
В этом процессе используются катализаторы на основе фосфорной кислоты на твердом носителе, и при необходимости его можно отрегулировать для получения большего количества эфира. [7] Парофазная дегидратация этанола над некоторыми алюмооксидными катализаторами может давать выход диэтилового эфира до 95%. [25]
Диэтиловый эфир может быть получен как в лабораторных, так и в промышленных масштабах путем синтеза кислого эфира. [26] Этанол смешивают с сильной кислотой, обычно с серной кислотой, H 2 SO 4 . Кислота диссоциирует в водной среде с образованием ионов гидроксония, H 3 O + . Ион водорода протонирует электроотрицательный атом кислорода этанола, придавая молекуле этанола положительный заряд:
- CH 3 CH 2 OH + H 3 O + → CH 3 CH 2 OH 2 + + H 2 O
Aucleopilic oxygen Atomage oxygen Atoontoontointed Atoontoonatic AtoontoNated AtoNatoNated Atoonatic Atoonatic Atoonatic Atoonatic.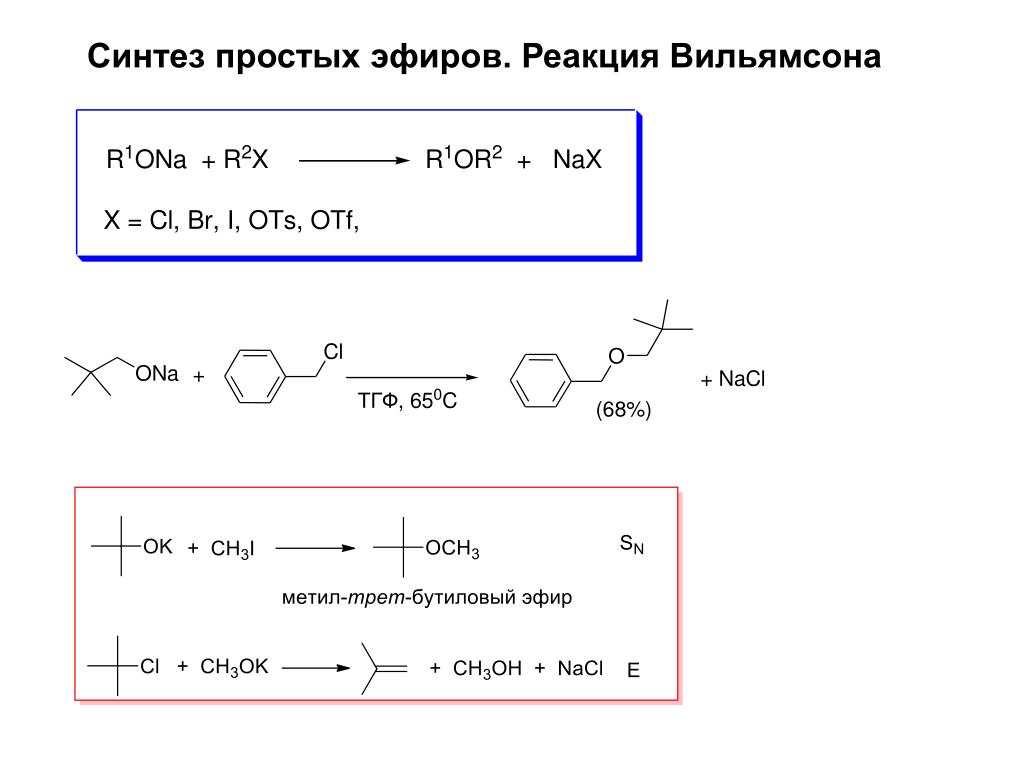 этанол вытесняет молекулу воды из протонированной (электрофильной) молекулы этанола, образуя воду, ион водорода и диэтиловый эфир.
этанол вытесняет молекулу воды из протонированной (электрофильной) молекулы этанола, образуя воду, ион водорода и диэтиловый эфир.
- CH 3 CH 2 OH 2 + + CH 3 CH 2 OH → H 2 O + H + + CH 3 CH 2 OCH 2 CH 3
Эту реакцию необходимо проводить при температуре ниже 150 °C, чтобы обеспечить удаление продукта (этилен) не является продуктом реакции. При более высоких температурах этанол дегидратируется с образованием этилена. Реакция получения диэтилового эфира обратима, поэтому в конечном итоге достигается равновесие между реагентами и продуктами. Для получения хорошего выхода эфира необходимо, чтобы эфир был отогнан из реакционной смеси до того, как он превратится в этанол, используя принцип Ле Шателье.
Другой реакцией, которую можно использовать для получения эфиров, является синтез эфира Вильямсона, в котором алкоксид (полученный путем растворения щелочного металла в используемом спирте) выполняет нуклеофильное замещение на алкилгалогениде.
Безопасность и стабильность
Диэтиловый эфир чрезвычайно огнеопасен и может быть взрывоопасен. [27]
Поскольку эфир тяжелее воздуха, он может собираться низко над землей, и пары могут перемещаться на значительные расстояния к источникам воспламенения, которыми могут быть не только открытое пламя, но и горячая плита, паровая труба, нагреватель и т. д. [27] Пар может воспламениться от статического электричества, которое может образоваться, когда эфир переливается из одного сосуда в другой. Температура самовоспламенения диэтилового эфира составляет 160 °C (320 °F). Обычной практикой в химических лабораториях является использование пара (таким образом ограничивая температуру до 100 ° C (212 ° F)), когда эфир необходимо нагреть или перегнать. Диффузия диэтилового эфира в воздухе составляет 0,918·10 -5 м 2 /с (298 К, 101,325 кПа). [ ссылка необходима ]
Эфир чувствителен к свету и воздуху, склонен к образованию взрывоопасных перекисей. [27] Пероксиды эфира имеют более высокую температуру кипения, чем эфир, и в сухом виде являются контактными взрывчатыми веществами. [27] Коммерческий диэтиловый эфир обычно поставляется со следовыми количествами антиоксиданта бутилированного гидрокситолуола (BHT), который уменьшает образование пероксидов. Хранение над гидроксидом натрия приводит к осаждению промежуточных эфирных гидропероксидов. Воду и пероксиды можно удалить либо отгонкой натрия и бензофенона, либо пропусканием через колонку с активированным оксидом алюминия. [28]
[27] Пероксиды эфира имеют более высокую температуру кипения, чем эфир, и в сухом виде являются контактными взрывчатыми веществами. [27] Коммерческий диэтиловый эфир обычно поставляется со следовыми количествами антиоксиданта бутилированного гидрокситолуола (BHT), который уменьшает образование пероксидов. Хранение над гидроксидом натрия приводит к осаждению промежуточных эфирных гидропероксидов. Воду и пероксиды можно удалить либо отгонкой натрия и бензофенона, либо пропусканием через колонку с активированным оксидом алюминия. [28]
Список литературы
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 Tear
- ↑ Карл Л. Йос, Справочник по химическим свойствам, McGraw-Hill, Нью-Йорк, 1999, стр. 567.
- ↑ 3.0 3.1 «Паспорт безопасности этилового эфира». Дж.Т. Бейкер. Проверено 24 июня 2010 г. .
- ↑ 4.
 0 4.1 4.2 4.3 Тоски, Джудит А; Бэкон, Дуглас Р.; Калверли, Род К. (2001). История анестезиологии . В: Бараш, Пол Г; Каллен, Брюс Ф; Столтинг, Роберт К. Клиническая анестезия (4-е изд.). Липпинкотт Уильямс и Уилкинс. п. 3. ISBN 978-0-7817-2268-1. CS1 maint: несколько имен: список авторов (ссылка)
0 4.1 4.2 4.3 Тоски, Джудит А; Бэкон, Дуглас Р.; Калверли, Род К. (2001). История анестезиологии . В: Бараш, Пол Г; Каллен, Брюс Ф; Столтинг, Роберт К. Клиническая анестезия (4-е изд.). Липпинкотт Уильямс и Уилкинс. п. 3. ISBN 978-0-7817-2268-1. CS1 maint: несколько имен: список авторов (ссылка) - ↑ Хадеменос, Джордж Дж.; Мерфри, Шон; Захлер, Кэти; Уорнер, Дженнифер М. (12 ноября 2008 г.). McGraw-Hill PCAT . Макгроу-Хилл. п. 39. ISBN 978-0-07-160045-3. Проверено 25 мая 2011 г. . CS1 maint: несколько имен: список авторов (ссылка)
- ↑ Доктор Фробениус (1729 г.) «Отчет о spiritus vini æthereus вместе с несколькими экспериментами, проведенными с ним», Philosophical Transactions of the Royal Society (Лондон), 36 : 283-289.
- ↑ 7.0 7.1 «Эфиры Лоуренса Караса и У. Дж. Пила». Энциклопедия химической технологии Кирка-Отмера .
 John Wiley & Sons, Inc. 2004.
John Wiley & Sons, Inc. 2004. - ↑ «Пусковая жидкость повышенной прочности: как она работает». Валвовин. Архивировано из оригинала 2007-09 гг.-27. Проверено 5 сентября 2007 г. .
- ↑ The Merck Index, 10-е издание, Марта Виндхольц, редактор, Merck & Co., Inc, Rahway, NJ, 1983, стр. 551.
- ↑ HH Rowley, Wm. Р. Рид (1951). «Растворимость воды в диэтиловом эфире при 25°». Дж. Ам. хим. Соц . 73 (6): 2960–2960. дои: 10.1021/ja01150a531.
- ↑ Microsoft Word — RedListE2007.doc
- ↑ 12.0 12.1 Хилл, Джон В. и Колб, Дорис К. Химия для меняющихся времен: 10-е издание . Страница 257. Пирсон: Прентис Холл. Река Аппер-Сэдл, Нью-Джерси. 2004.
- ↑ Мэдден, М. Лесли (14 мая 2004 г.). «Кроуфорд Лонг (1815-1878)». Энциклопедия Новой Джорджии . Издательство Университета Джорджии. Проверено 13 февраля 2015 г.
- ↑ «Кроуфорд В.
 Лонг». День врача . Южная медицинская ассоциация. Проверено 13 февраля 2015 г.
Лонг». День врача . Южная медицинская ассоциация. Проверено 13 февраля 2015 г. - ↑ Граттан, Н. Лечение маточного кровотечения . Губернский медико-хирургический журнал. Том. 1, № 6 (7 ноября 1840 г.), с. 107.
- ↑ Кальдероне, Ф.А. (1935). J. Фармакология Экспериментальная терапия . 55 (1): 24–39 Jpet.aspetjournals.org http://jpet.aspetjournals.org/cgi/reprint/55/1/24.pdf Jpet.aspetjournals.org Проверить
|url=значение (помощь ). Отсутствует или пусто|title=(справка) - ↑ «Эфир и его эффекты при анестезии».
- ↑ Морган, Г. Эдвард-младший и др. «Клиническая анестезиология», 3-е изд., с. 3. Нью-Йорк: МакГроу-Хилл. 2002 г.
- ↑ Национальный аптекарь, том 47, июнь 1917 г., стр. 220.
- ↑ Зандберг, Адриан (2010). «Короткая статья «Деревни… Запах эфирных паров»: употребление эфира в Силезии до 1939 года». История болезни .
 54 (3): 387–396. doi:10.1017/s002572730000466x. PMC 28
54 (3): 387–396. doi:10.1017/s002572730000466x. PMC 28. PMID 20592886.
- ↑ Кашицкий, Нестор (30 августа 2006 г.). «Łemkowska Watra w Żdyni 2006 — pilnowanie ognia pamięci». Histmag.org — история podszewki (на польском языке). Краков, Польша: i-Press. Проверено в 2009 г.-11-25.
Dawniej eteru używało się w lecznictwie do narkozy, ponieważ ma właściwości halucynogenne, a już kilka kropel inhalacji wystarczyło do silnego znieczulenia pacjenta. Jednak eter, jak każda ciecz, może teoretycznie być Napojem. Łemkowie tę teorię praktykują. Mimo to, nazywanie skroplonego eteru – „kropki” – ich „napojem narodowym” byłoby przesadą. Chociaż stanowi to pewną część mitu „bycia Łemkiem”.
CS1 maint: нераспознанный язык (ссылка) - ↑ 109. Мутантный штамм Aspergillus flavus 241, заблокированный в биосинтезе афлатоксина, не накапливает транскрипт aflR. Мэтью П. Браун и Гэри А. Пейн, Государственный университет Северной Каролины, Роли, Северная Каролина, 27695 fgsc.
 net
net - ↑ П. Т. Норманн, А. Рипель и Дж. Морланд (1987). «Диэтиловый эфир ингибирует метаболизм этанола in vivo за счет взаимодействия с алкогольдегидрогеназой». Алкоголизм: клинические и экспериментальные исследования . 11 (2): 163–166. doi:10.1111/j.1530-0277.1987.tb01282.x. PMID 3296835.
- ↑ Ларри К. Кифер, Уильям А. Гарланд, Нил Ф. Олдфилд, Джеймс Э. Свагздис и Брюс А. Мико (1985). «Ингибирование метаболизма N-нитрозодиметиламина у крыс с помощью эфирной анестезии» (PDF) . Исследования рака . 45 (11 часть 1): 5457–60. PMID 4053020. CS1 maint: Несколько имен: список авторов (ссылка)
- ↑ Этиловый эфир, хим. Справочник по экономике . Менло-Парк, Калифорния: SRI International. 1991.
- ↑ Коэн, Юлиус Беренд (1920). Учебник по органической химии, том 1 . Лондон: Macmillan and Co. p. 39.
- ↑ 27,0 27,1 27,2 27,3 http://www.


 0 4.1 4.2 4.3 Тоски, Джудит А; Бэкон, Дуглас Р.; Калверли, Род К. (2001). История анестезиологии . В: Бараш, Пол Г; Каллен, Брюс Ф; Столтинг, Роберт К. Клиническая анестезия (4-е изд.). Липпинкотт Уильямс и Уилкинс. п. 3. ISBN 978-0-7817-2268-1. CS1 maint: несколько имен: список авторов (ссылка)
0 4.1 4.2 4.3 Тоски, Джудит А; Бэкон, Дуглас Р.; Калверли, Род К. (2001). История анестезиологии . В: Бараш, Пол Г; Каллен, Брюс Ф; Столтинг, Роберт К. Клиническая анестезия (4-е изд.). Липпинкотт Уильямс и Уилкинс. п. 3. ISBN 978-0-7817-2268-1. CS1 maint: несколько имен: список авторов (ссылка) John Wiley & Sons, Inc. 2004.
John Wiley & Sons, Inc. 2004.  Лонг». День врача . Южная медицинская ассоциация. Проверено 13 февраля 2015 г.
Лонг». День врача . Южная медицинская ассоциация. Проверено 13 февраля 2015 г.  54 (3): 387–396. doi:10.1017/s002572730000466x. PMC 28
54 (3): 387–396. doi:10.1017/s002572730000466x. PMC 28 net
net