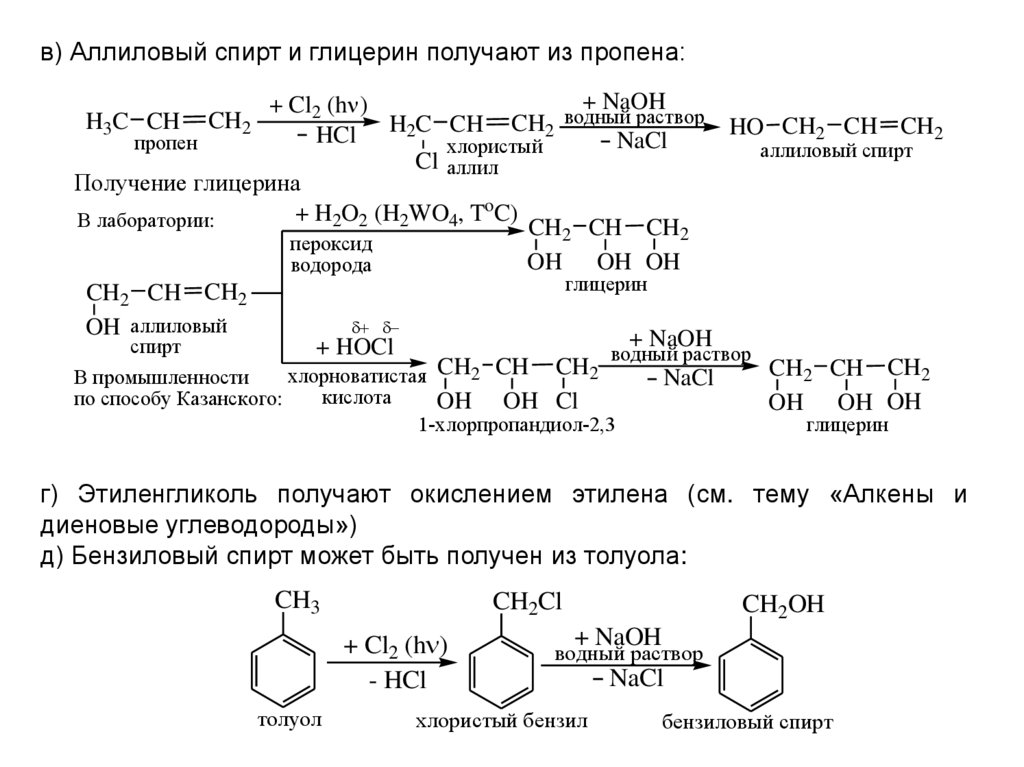
Содержание
Диэтиловый эфир — свойства, получение и применение
Содержание
- История
- Синтез
- Свойства
- Применение
- Фармакология
- Техника
Диэтиловый эфир. По химическим свойствам — типичный алифатический простой эфир. Широко используется в качестве растворителя. Впервые получен в Средние века.
История
Возможно, что впервые диэтиловый эфир был получен в IX веке алхимиком Джабир ибн Хайяном либо алхимиком Раймундом Луллием в 1275 году. Достоверно известно, что он был синтезирован в 1540 году Валерием Кордусом, который назвал его «сладким купоросным маслом» (лат. oleum dulce vitrioli), поскольку получил его перегонкой смеси этилового спирта и серной кислоты, которая тогда называлась «купоросным маслом». Кордус также отметил его анестезирующие свойства. В 1680 году Роберт Бойль вторично синтезировал эфир. Затем в 1704 году Исаак Ньютон открыл эфир в третий раз, в поисках синтеза искусственного золота.
Название «эфир» было дано этому веществу в 1729 году Фробениусом.
В 1794 году эфир был испытан для вдыханий с целью уменьшения болей, а в 1795 году Томас Беддоус создал Медицинский пневматический институт для лечения различных легочных заболеваний газами. Такие газы тогда называли «искусственным воздухом».
Синтез
Получают действием на этиловый спирт кислотных катализаторов при нагревании, например, перегонкой смеси этилового спирта и серной кислоты при температуре порядка 140—150 °C. Также получается как побочный продукт в производстве этилового спирта гидратацией этилена в присутствии фосфорной кислоты или 96—98 % серной кислоты при 65—75 °С и давлении 2,5 МПа. Основная часть диэтилового эфира образуется на стадии гидролиза этилсульфатов (95—100 °C, 0,2 МПа).
Свойства
- Бесцветная, прозрачная, очень подвижная, летучая жидкость со своеобразным запахом и жгучим вкусом.
- Растворимость в воде 6,5 % при 20 °C. Образует азеотропную смесь с водой (т. кип. 34,15 °C; 98,74 % диэтилового эфира). Смешивается с этанолом, бензолом, эфирными и жирными маслами во всех соотношениях.

- Легко воспламеняется, в том числе пары; в определённом соотношении с кислородом или воздухом пары эфира для наркоза взрывоопасны.
- Разлагается под действием света, тепла, воздуха и влаги с образованием токсичных альдегидов, пероксидов и кетонов, раздражающих дыхательные пути.
- Образующиеся пероксиды нестойки и взрывоопасны, они могут быть причиной самовоспламенения диэтилового эфира при хранении и взрыве при его перегонке «досуха»
По химическим свойствам диэтиловый эфир обладает всеми свойствами, характерными для простых эфиров, например, образует нестойкие оксониевые соли с сильными кислотами:
Образует сравнительно стабильные комплексные соединения с кислотами Льюиса: (C2H5)2O·BF3
Применение
Фармакология
В медицине используется в качестве лекарственного средства общеанестезирующего действия, так как его влияние на нейронные мембраны и свойство «обездвиживать» ЦНС очень специфично и полностью обратимо. Применяется в хирургической практике для ингаляционного наркоза, а в стоматологической практике — местно, для обработки кариозных полостей и корневых каналов зуба при подготовке к пломбированию.
Применяется в хирургической практике для ингаляционного наркоза, а в стоматологической практике — местно, для обработки кариозных полостей и корневых каналов зуба при подготовке к пломбированию.
В связи с медленным разложением диэтилового эфира, должны строго выдерживаться установленные сроки хранения. Для наркоза можно применять эфир только из склянок, открытых непосредственно перед операцией. По истечении каждых 6 месяцев хранения эфир для наркоза проверяют на соответствие требованиям. Использование технического эфира в этих целях не допускается.
Выдающийся отечественный хирург Н.И. Пирогов первым в истории медицины начал оперировать раненых с эфирным обезболиванием в полевых условиях и всего провел около десяти тысяч операций под эфирным наркозом.
Техника
- Применяется как растворитель нитратов целлюлозы в производстве бездымного пороха, природных и синтетических смол, алкалоидов.
- Применяется как теплоноситель в криогенной технике, реже как компонент для хладагентов.

- Применяется как экстрагент для разделения плутония и продуктов его деления при получении и переработке ядерного топлива, при выделении урана из руд.
- Применяется как компонент топлива в авиамодельных компрессионных двигателях.
- При запуске бензиновых двигателей внутреннего сгорания в суровых зимних условиях.
В СССР выпускалась пусковая жидкость «Арктика», небольшое количество заливалось во впускной коллектор через карбюратор при снятом воздушном фильтре. Для армии выпускался эфир в алюминиевой запечатанной гильзе, перед использованием гильза протыкалась штык-ножом или отвёрткой. За рубежом выпускается «жидкость для запуска в холодные дни» в аэрозольном баллоне. Состав: диэтиловый эфир, индустриальное масло, пропеллент.
Механизм запуска ДВС в этом случае по большей мере компрессионный: смесь эфира с воздухом воспламеняется от сжатия уже при степени сжатия порядка 5-6. Потерявшие компрессию по разным причинам двигатели могут делать несколько оборотов на эфире, но на бензине, тем не менее, не работают.
Уникальный анестетик или причина пожара?
Рубрика: На правах рекламы
Опубликовано
в
Молодой учёный
№15 (149) апрель 2017 г.
Статья просмотрена:
134 раза
Скачать электронную версию
Библиографическое описание:
Уникальный анестетик или причина пожара?. — Текст : непосредственный // Молодой ученый. — 2017. — № 15 (149). — URL: https://moluch.ru/archive/149/53894/ (дата обращения: 04.11.2022).
Диэтиловый эфир является одним из наиболее известных органических соединений. Его формула – (C2H5)2O. Изначально диэтиловый эфир использовали в качестве анестетика, но сегодня спектр его применения существенно расширился.
Особенности химического вещества
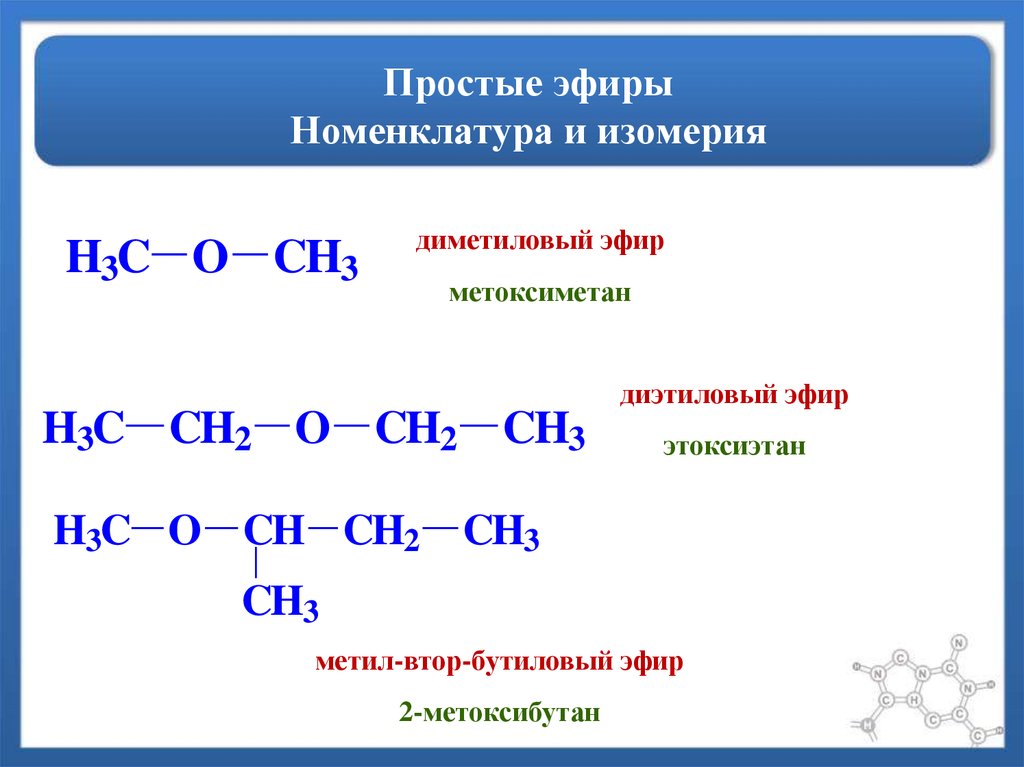
Эфиры – органические соединения, которые можно разделить на две категории:
- простые или симметричные – соединения, в которых алкильные группы одинаковы и расположены по обе стороны атома кислорода;
- смешанные или несимметричные – вещества с различными молекулами углеводородов.
Эфир – чрезвычайно огнеопасный химикат, поэтому его стоит хранить в тёмной банке, в которую не проникает солнечный свет. Плотные стенки сосуда предотвращают возможность возникновения реакции с другими химическими соединениями.
Самый простой представитель группы
Диметиловый эфир – это углеводород, состоящий из двух метильных групп, связанных между собой кислородом. Он имеет ту же эмпирическую формулу, что и этанол (C2H6O), но из-за разных структур изомеры отличаются своими свойствами. Он представляет собой бесцветный газ, который применяется в различных сферах деятельности, например, используется как органический растворитель и экстрагент.
Учёные рассматривают это вещество в качестве инновационного топлива. Он относительно нетоксичен и имеет более высокое октановое число, чем ДТ. Это значит, что эфир будет полностью сгорать, не образуя вредных примесей. В сравнении с дизельным топливом он более энергоэффективен для автомобиля и безопасен для окружающей среды. Прозрачный газ при сгорании не выделяет серу и ароматические соединения. Эти выбросы образуются при использовании дизельного топлива и являются наиболее опасными загрязнителями для окружающей среды.
Реакция горения диметилового эфира:
C2H6O + 3O2 → 2CO2 + 3H2O + Энергия
В реальной жизни эта реакция практически невозможна, потому что эффект полного сгорания возможен чисто теоретически. Идеальных условий, которые необходимы для данного процесса, пока не добиться. В остатке всегда будет некоторое количество топлива или продукты горения обоих веществ. Однако учёные продолжают исследовать этот процесс в надежде найти решение, которое позволит использовать химические реактивы для лаборатории в обычных условиях.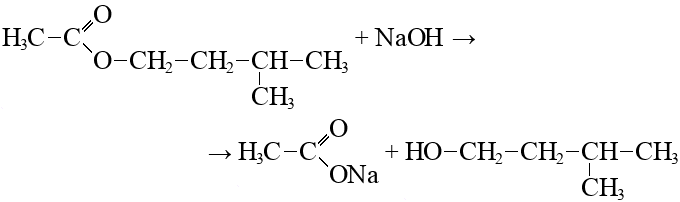
Самый популярный представитель эфиров
Диэтиловый эфир характеризуется специфическим запахом, который оказывает обезболивающее действие. Вещество легко воспламеняется при температуре 170 ⁰C, сгорая без искры или пламени. Нужно совсем немного энергии, чтобы произошло возгорание. Источником может стать горячий радиатор или горящая конфорка плиты. Имеет относительно низкую температуру кипения – 34,6 ⁰C.
Диэтиловый эфир – неполярное соединение, которое растворяет другие неполярные вещества, поэтому его используют для расщепления жиров, воска, масел, духов, алкалоидов и проч. Купить диэтиловый эфир можно и для других целей:
- для запуска дизельного или бензинового двигателя в холодную погоду;
- в качестве хладагента;
- вместо антисептика при введении инъекции в организм.
Бесцветный газ с характерным запахом используется в качестве анестетика в больницах. Это вещество помогает людям засыпать, испытывать эйфорию или вводит в бессознательное состояние во время проведения операций.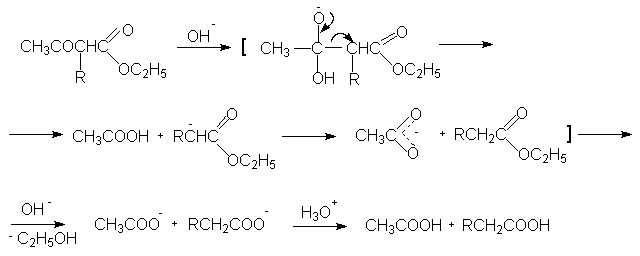
Важно! Передозировка может вызвать паралич органов дыхания, привести к летальному исходу!
Открытие химического реагента позволило врачам использовать более совершенные методы хирургии. Доктора много нового узнали о физиологии человека. Но из-за воспламеняющейся природы газ заменили на более безопасные препараты.
Основные термины (генерируются автоматически): диэтиловый эфир, бесцветный газ, вещество, дизельное топливо, диметиловый эфир, качество анестетика, окружающая среда, соединение.
Похожие статьи
Возможные варианты получения
дизельного топлива…
Также, новым способом получения экологически чистых топлив является целенаправленное производство синтетического дизельного топлива в виде диметилового эфира (ДМЭ) на основе синтез-газа. ДМЭ — ультрачистое дизельное топливо, применение которого позволит…
ДМЭ — ультрачистое дизельное топливо, применение которого позволит…
Переработка углекислого
газа | Статья в журнале…
Основные термины (генерируются автоматически): диметиловый эфир, углекислый газ
водород, окружающая среда, водородная энергетика, внутреннее сгорание, углекислый газ
Технология производства жидкого топлива из газа может обеспечить ключевую связь между…
Разработка технологии производства этил-трет-бутилового
эфира…
Ключевые слова: дизельное топливо, кислые катализаторы, адиабатический реактор, МТБЭ
Экологические исследования показали, что МТБЭ сильнодействующее ядовитое вещество
– обеспечивает получение этил-трет-бутилового эфира из данного сырья с максимальной. ..
..
Возможные варианты получения
дизельных топлив…
Бурное развитие машиностроительных отраслей промышленности, особенно в развитых странах, привело к стремительному увеличению парка автомобилей и других транспортных средств (ТС). Увеличение количества ТС связано с двумя главными экологическими проблемами: с…
Влияние показателей
качества автомобильного бензина…
В статье рассмотрено влияние показателей качества нефтяных топлив, автомобильного бензина и дизельного топлива, на состояние окружающей среды и здоровье человека. Представлены требования современных нормативных документов, предъявляемые к светлым…
Октаноповышающие компоненты бензинов и их свойств
Загрязнение окружающей среды, связанное с применением бензинов, может происходить на этапах транспортирования, заправки и др.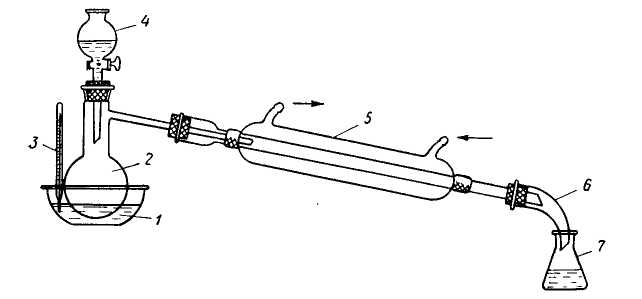 (испарение, утечки и пр.). Однако основным источником загрязнения являются отработавшие газы. В их составе содержится более 300…
(испарение, утечки и пр.). Однако основным источником загрязнения являются отработавшие газы. В их составе содержится более 300…
Химические свойства производного азофенолов
Нам известно, что изоцианаты являются высоко реакционноспособными соединениями. Они легко реагируют с соединениями, содержащими подвижные атомы водорода, например аминами и спиртами. Этот процесс широко используют в лакокрасочных составах для…
Исследование депрессорных присадок к
дизельным топливам…
Развитие топливно-энергетического комплекса любого государства определяется ежегодным ростом потребности в дизельных и моторных топливах. На протяжении долгого времени для улучшения низкотемпературных свойств судовых и котельных топлив…
Местное сырьё — основа для получения депрессорных присадок.
 ..
..
Применение депрессорных присадок является одним из наиболее эффективных способов улучшения низкотемпературных свойств дизельных топлив. Полимеры и сополимеры достаточно эффективно применяют в качестве депрессорных присадок к дизельным топливам.
Проблемы использования альтернативных
экологически чистых…
В качестве альтернативы жидкому топливу рассматривают газ. Газовое топливо дешевле бензина и экологически чище (при выхлопе выделяется почти в два раза меньше угарного газа), двигатель на таком топливе работает дольше. Газ не разжижает моторное масло, не образует…
Похожие статьи
Возможные варианты получения
дизельного топлива. ..
..
Также, новым способом получения экологически чистых топлив является целенаправленное производство синтетического дизельного топлива в виде диметилового эфира (ДМЭ) на основе синтез-газа. ДМЭ — ультрачистое дизельное топливо, применение которого позволит…
Переработка углекислого
газа | Статья в журнале…
Основные термины (генерируются автоматически): диметиловый эфир, углекислый газ
водород, окружающая среда, водородная энергетика, внутреннее сгорание, углекислый газ
Технология производства жидкого топлива из газа может обеспечить ключевую связь между…
Разработка технологии производства этил-трет-бутилового
эфира. ..
..
Ключевые слова: дизельное топливо, кислые катализаторы, адиабатический реактор, МТБЭ
Экологические исследования показали, что МТБЭ сильнодействующее ядовитое вещество
– обеспечивает получение этил-трет-бутилового эфира из данного сырья с максимальной…
Возможные варианты получения
дизельных топлив…
Бурное развитие машиностроительных отраслей промышленности, особенно в развитых странах, привело к стремительному увеличению парка автомобилей и других транспортных средств (ТС). Увеличение количества ТС связано с двумя главными экологическими проблемами: с…
Влияние показателей
качества автомобильного бензина…
В статье рассмотрено влияние показателей качества нефтяных топлив, автомобильного бензина и дизельного топлива, на состояние окружающей среды и здоровье человека.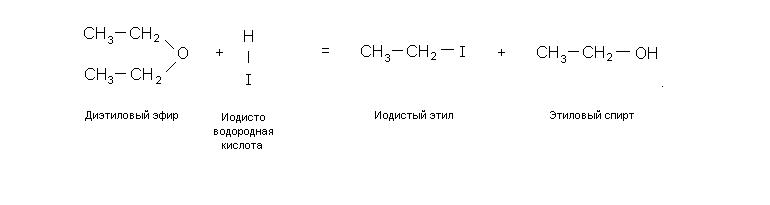 Представлены требования современных нормативных документов, предъявляемые к светлым…
Представлены требования современных нормативных документов, предъявляемые к светлым…
Октаноповышающие компоненты бензинов и их свойств
Загрязнение окружающей среды, связанное с применением бензинов, может происходить на этапах транспортирования, заправки и др. (испарение, утечки и пр.). Однако основным источником загрязнения являются отработавшие газы. В их составе содержится более 300…
Химические свойства производного азофенолов
Нам известно, что изоцианаты являются высоко реакционноспособными соединениями. Они легко реагируют с соединениями, содержащими подвижные атомы водорода, например аминами и спиртами. Этот процесс широко используют в лакокрасочных составах для…
Исследование депрессорных присадок к
дизельным топливам…
Развитие топливно-энергетического комплекса любого государства определяется ежегодным ростом потребности в дизельных и моторных топливах. На протяжении долгого времени для улучшения низкотемпературных свойств судовых и котельных топлив…
На протяжении долгого времени для улучшения низкотемпературных свойств судовых и котельных топлив…
Местное сырьё — основа для получения депрессорных присадок…
Применение депрессорных присадок является одним из наиболее эффективных способов улучшения низкотемпературных свойств дизельных топлив. Полимеры и сополимеры достаточно эффективно применяют в качестве депрессорных присадок к дизельным топливам.
Проблемы использования альтернативных
экологически чистых…
В качестве альтернативы жидкому топливу рассматривают газ. Газовое топливо дешевле бензина и экологически чище (при выхлопе выделяется почти в два раза меньше угарного газа), двигатель на таком топливе работает дольше.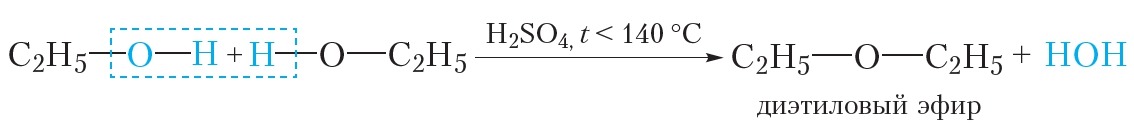 Газ не разжижает моторное масло, не образует…
Газ не разжижает моторное масло, не образует…
Как получают диэтиловый эфир и его свойства
Это доминирующий член класса эфиров. Его также называют просто эфиром или этиловым эфиром.
Методы приготовления
При действии йодэтана и сухого оксида серебра: Диэтиловый эфир получают нагреванием этилйодида с сухим оксидом серебра.
Метод синтеза Уильямсона: В этом методе этоксид натрия или калия нагревают с хлорэтаном, бромэтаном или йодэтаном. Эта реакция приводит к Диэтиловый эфир .
Подробнее о методе синтеза Вильямсона…
C 2 H 5 ONA + C 2 H 5 I → C 2 H 5 — o — C 2 H 5 + NAI 2 H 5 + NAI 9 2 H 5 + NAI 9 2 H 5 + NAI 3 2 H 5 + NAI 3 2 H 5 + NAI 3 2 H 5 + 2 H 5 .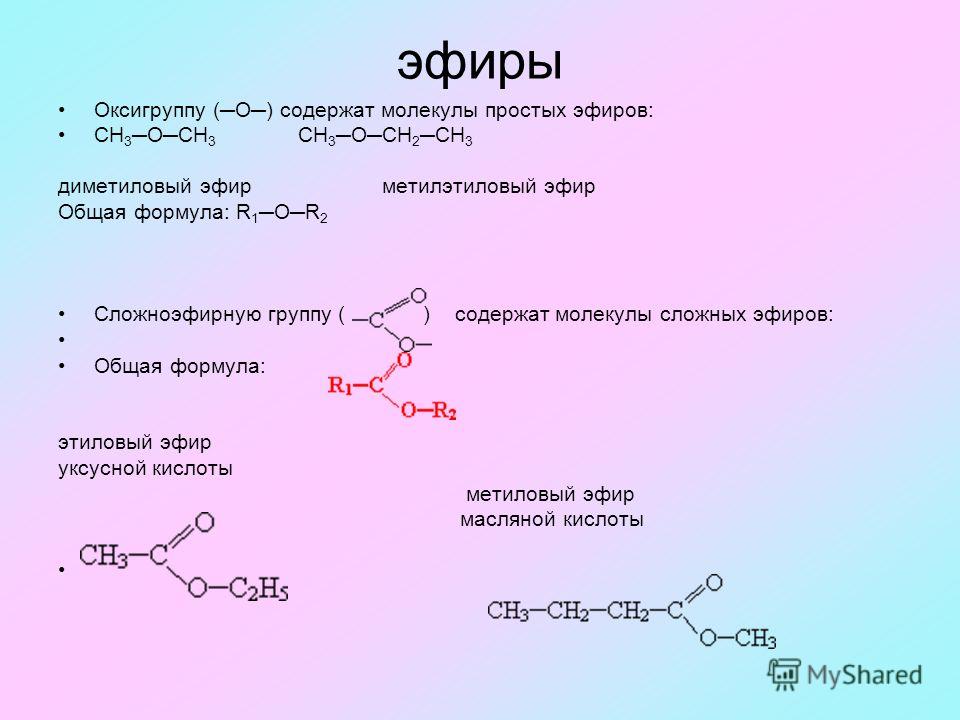
При нагревании смеси этилового спирта и оксида алюминия: при нагревании этилового спирта с оксидом алюминия (Al 2 O 3 ) при 250°C получают диэтиловый эфир.
С 2 H 5 OH + HOC 2 H 5 — AL2O3/250 ° C → C 2 H 5 — o — C 2 H 5 + H 7 2 6 2 6 2 6 2 6 2 6 2 6 2 6 2 6 2 6 2 6 2 6 2 — o — c 2 H 5 + . О
Лабораторный метод:
При нагревании смеси этилового спирта и серной кислоты: Диэтиловый эфир получают путем нагревания этой смеси примерно до 140°C путем смешивания этилового спирта высокой концентрации со слабоконцентрированной серной кислотой.
C 2 H 5 OH + H 2 SO 4 → C 2 H 5 HSO 4 + H 2 O
C 2 H 5 HSO 4 + C 2 H 5 OH → C 2 H 5 – O – C 2 H 5 + H 2 SO 4
Из вышеприведенной реакции ясно, что небольшое количество концентрированной серной кислоты, принятое вначале, может превратить очень большое количество спирта в эфир. Поэтому этот метод также называется Метод непрерывной этерификации .
Поэтому этот метод также называется Метод непрерывной этерификации .
На практике этого не происходит. Потому что некоторое количество серной кислоты восстанавливается с образованием диоксида серы, а водный концентрат в реакции разбавляет серную кислоту. Поэтому время от времени добавляют небольшое количество кислоты.
В перегонную колбу вместимостью 500 мл отбирают около 100 мл чистого спирта. К нему медленно добавляют около 50 мл концентрированной серной кислоты. Добавляя серную кислоту, встряхивайте колбу. Теперь нагрейте колбу до 140°С, поместив ее на песочный нагрев.
Эфир перегоняется и собирается в приемнике. Ресивер имеет боковую трубку, которая соединена с резиновым сливом и доходит до раковины. Это не позволяет парам эфира достигать горелки и нет страха перед огнём.
Вся пробка в оборудовании герметична. Соответственно скорость, с которой эфир собирается в ресивере, удерживает переливание спирта в колбу из точечной воронки.
Магнитный диполь: момент и свойства магнитного диполя
Электрическая потенциальная энергия: электрический диполь, градиент потенциала
Закон Кулона: электрическое поле, разность потенциалов, вольт
Закон Гаусса или теорема Гаусса: телесный угол и электрический поток
Электролиз: определение, принцип и электролитическая ячейка
Адсорбция: скорость адсорбции, физическая и хемосорбция
Электрический элемент: ЭДС, оконечный потенциал, внутреннее сопротивление
Как работает транзистор: Транзисторы PNP и NPN
Ректификация: Спирт, вода и серная кислота присутствуют в виде примесей в эфире, полученном вышеуказанным способом. Для удаления серной кислоты полученный эфир промывают раствором двуокиси натрия.
Для удаления серной кислоты полученный эфир промывают раствором двуокиси натрия.
Для удаления спирта эфир смешивают с 50% раствором хлорида кальция и оставляют на некоторое время, образуя кристаллы CaCl 2 .3C 2 Н 5 ОХ. Их фильтруют и разделяют.
Для удаления воды ее сушат, добавляя к эфиру безводный хлорид кальция, таким образом полученный эфир перегоняют при 35°С до чистого эфира.
Физические свойства диэтилового эфира
Это бесцветная, едкая и очень летучая жидкость. Горит легким пламенем. Его температура кипения составляет 34°C. Он менее растворим в воде, но менее растворим в органических растворителях, таких как спирт, бензол, хлороформ и т. д.
Сам по себе используется как растворитель. Исправляя его пары, возникает бессознательное. Теплоты используется больше, чем ее испарение. Следовательно, нанесение на любую часть тела делает эту часть прохладной. То есть он немеет на какое-то время.
Химические свойства диэтилового эфира
Эфир является относительно инертным веществом.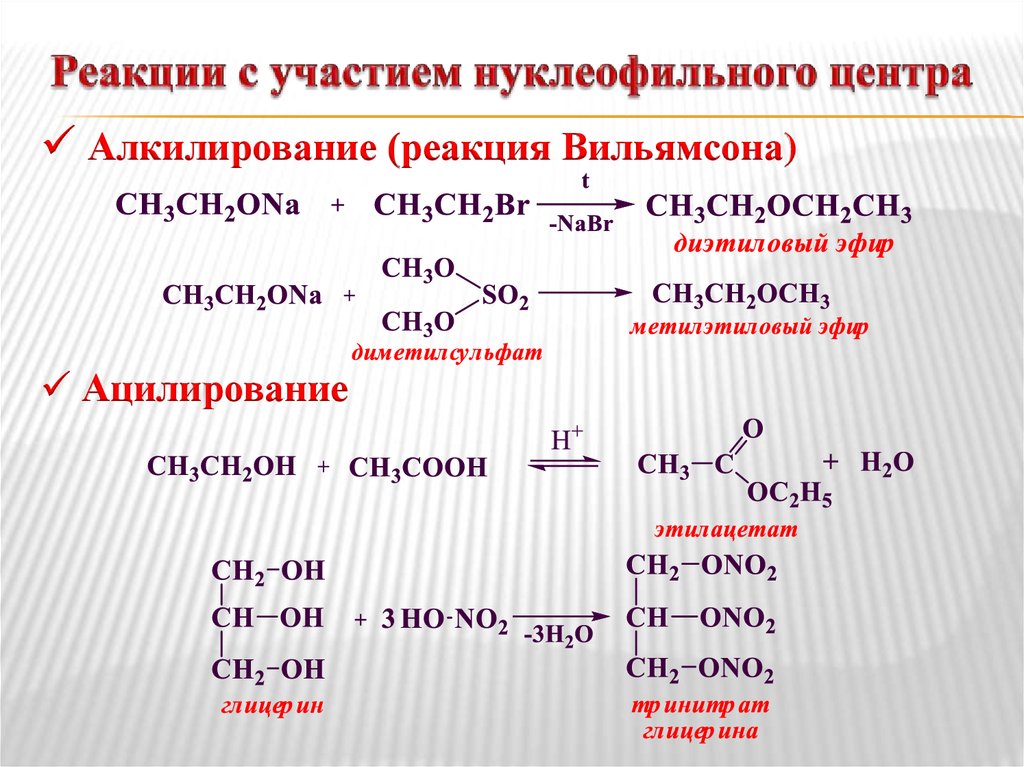 Они не реагируют со щелочами, разбавленными кислотами, восстановителями-окислителями и активными металлами при обычных температурах.
Они не реагируют со щелочами, разбавленными кислотами, восстановителями-окислителями и активными металлами при обычных температурах.
Ниже приведены основные химические реакции диэтилового эфира.
Горение: Из-за высокой огнеопасности быстро горит и образует с воздухом взрывоопасную смесь.
C 2 H 5 — O — C 2 H 5 + 6O 2 → 4CO 2 + 5H 2 O
.
Галогенирование: Реагирует с хлором и бромом с образованием продуктов замещения. Облегчается замещение α-атомов углерода, т.е. сначала замещается водород с кислорода на атом углерода, а затем замещаются другие атомы водорода в зависимости от количества агента и других условий.
Получение оксониевой соли: Реагирует с холодным и концентрированным H 2 SO 4 или HCl с образованием оксониевой соли.
В этой реакции H + кислоты соединяется с неподеленной парой электронов на кислороде. Эта реакция протекает так же, как соли аммония образуются при взаимодействии аммиака или аминосоединений и кислот.
Эта реакция протекает так же, как соли аммония образуются при взаимодействии аммиака или аминосоединений и кислот.
Следовательно, эфир растворим в холодной и концентрированной H 2 SO 4 . С помощью этого свойства эфиров простые эфиры можно дифференцировать в алкены. Элькен нерастворим в холодном и концентрированном виде H 2 SO 4 .
Эфир можно восстановить, добавив воду в оксониевую соль.
R реакция с концентрированной серной кислотой: Этилгидросульфат получают нагреванием диэтилового эфира с концентрированной серной кислотой.
С 2 Н 5 – О – С 2 H 5 + H 2 SO 4 → C 2 H 5 HSO 4 + C 2 H 5 OH
C 2 H 5 OH + H 2 SO 4 → C 2 H 5 HSO 4
При перегреве получается 160 газообразный этилен.
Разложение водой: Разложение эфира водой происходит при нагревании с разбавленной серной кислотой при высоком давлении. Водное разложение диэтилового эфира дает этиловый спирт.
C 2 H 5 — O — C 2 H 5 + H 2 O → 2C 2 H 5 OH 9003
Образование перекиси или самоокисление : В присутствии солнечного света реакция диэтилового эфира с воздухом, кислородом или озоном происходит из перекиси.
перекись эфира — чрезвычайно взрывоопасное вещество. Поэтому при отгонке эфира требуются более осторожные действия, путем удаления детергента, такого как FeSO 4 с восстановителем для удаления пероксида, присутствующего в нем.
Реакция с пентахлоридом фосфора: Этилхлорид образуется при взаимодействии диэтилового эфира с пентахлоридом фосфора.
C 2 H 5 – O – C 2 H 5 + PCl 5 → 2C 2 H 5 Cl + POCl 3
Реакция с йодистоводородной кислотой: диэтиловый эфир с холодной и концентрированной иодистоводородной кислотой образует этилиодид и этанол.
C 2 H 5 – O – C 2 H 5 + HI → C 2 H 5 I + C 2 H 5 OH
Образует этилиодид с горячим и концентрированным HI.
диэтиловый эфир – простой эфир (R – O – R). Реакция смешанного эфира (R 1 – O – R 2 ) с холодным и концентрированным HI может протекать двояко.
R 1 — O — R 2 + HI → R 1 OH + R 1 I
R 1 — o — R 2 + HI → R 1 I I + R 2 ОН
Это известно из детального изучения механизма вышеуказанной реакции. Что если одна из алкильных групп образует более стабильный ион карбония, то образуется его иодид.
(CH 3 ) 3 C – O – CH 3 + HI → (CH 3 ) 3 Cl + CH 3 OH
В других случаях малая алкильная группа образует йодидные соединения.
CH 3 – O – C 2 H 5 + HI → CH 3 I + C 2 H 5
1 OH
Восстановление: Диэтиловый эфир взаимодействует с красным фосфором и йодистоводородной кислотой с получением этана.
С 2 Н 5 – O – C 2 H 5 + 4H → 2C 2 H 6 + H 2 O
Окисление: Реакция с сильными окислителями, такими как кислый дихромат калия, дает ацетальдегид и уксусную кислоту.
C 2 H 5 — O — C 2 H 5 + 2O → 2CH 3 CHO + H 2 O
CH 3 CHO + O → CH 9 3
CH 3 CHO + O → CH → CH → CH → CH → CH → CH → CH . СООН
Реакция с ацетилхлоридом: При нагревании с ацетилхлоридом в присутствии безводного хлорида цинка образует этилхлорид и этилацетат.
C 2 H 5 – O – C 2 H 5 + CH 3 COCl → C 2 H 5 Cl + CH 3 COOC 2 H 5
Реакция с уксусным ангидридом: Реакция диэтилового эфира с уксусным ангидридом аналогична реакции ацетилхлорида.
C 2 H 5 – O – C 2 H 5 + (CH 3 CO) 2 O → 2CH 3 COOC 2 H 5
Реакция с монооксидом углерода: В присутствии треххлористого бора при давлении около 500 атмосфер и температуре около 100°C он реагирует с монооксидом углерода с образованием этилпропаноата.
C 2 H 5 – O – C 2 H 5 + CO → C 2 H 5 – CO – O – C 2 H 5
Эффект нагретого оксида алюминия: Газообразный этилен получают, когда пары диэтилового эфира протекают при 360°C над нагретым оксидом алюминия.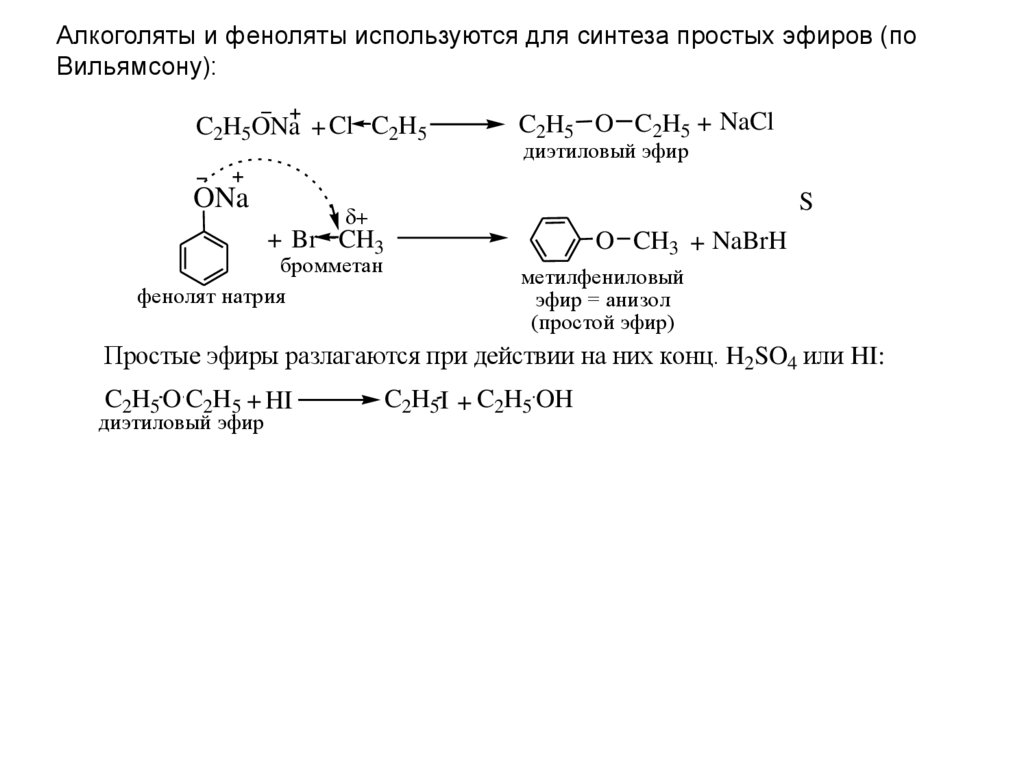
C 2 H 5 – O – C 2 H 5 → 2C 2 H 4 + Н 2 О
Использование диэтилового эфира
Используется в качестве растворителя и среды при получении реактивов Гриньяра и в реакции Берца.
Эфир использовался в хирургии в качестве анестетика в сочетании с хлороформом.
Путем смешивания эфира со спиртом и использования в качестве топлива вместо бензина, например, силового спирта.
Также используется в качестве хладагента.
Эфир в основном используется в качестве растворителя. Он легко растворяет многие органические вещества, такие как масла, жиры и смолы.
Промышленное производство диэтилового эфира из этанола – WorldOfChemicals
Диэтиловый эфир относится к классу эфирных органических соединений. По сути, он имеет характеристики бесцветного, летучего химического вещества со сладким запахом, напоминающим растворитель.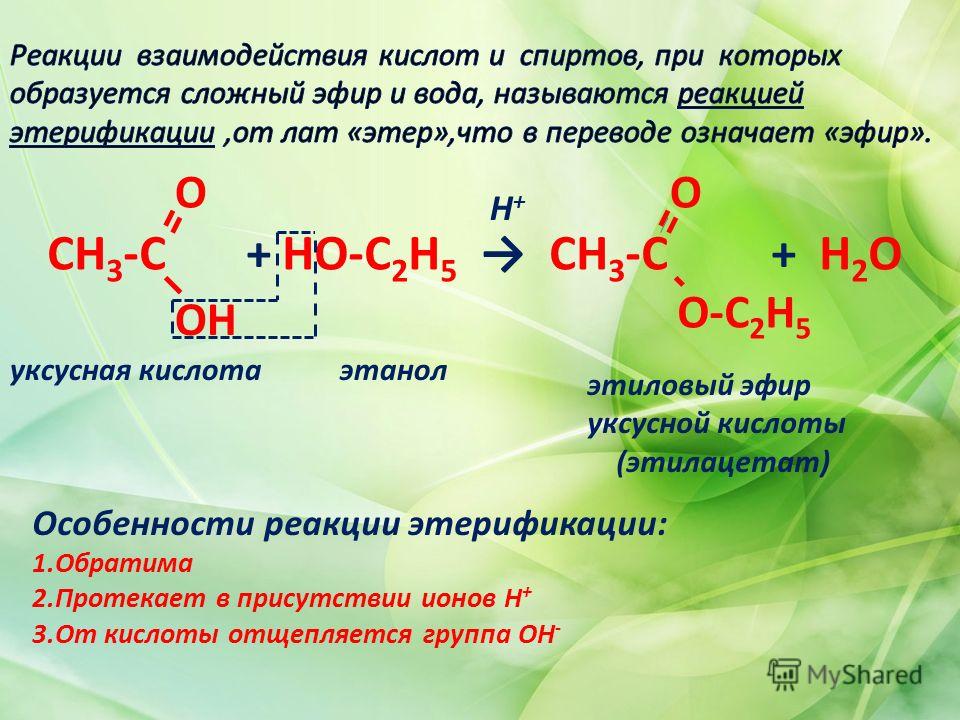 Диэтиловый эфир находит широкое применение в качестве растворителя, а также в различных бытовых продуктах.
Диэтиловый эфир находит широкое применение в качестве растворителя, а также в различных бытовых продуктах.
Это бесцветная легколетучая легковоспламеняющаяся жидкость. Он обычно используется в качестве растворителя в лабораториях и в качестве пусковой жидкости для некоторых двигателей. Диэтиловый эфир также является обычным растворителем для реакции Гриньяра в дополнение к другим реакциям с участием металлоорганических реагентов.
Широко используется в химической промышленности и в качестве пропеллента для аэрозолей. Диэтиловый эфир ранее использовался в качестве общего анестетика, пока не были разработаны негорючие препараты, такие как галотан. Он использовался в качестве рекреационного наркотика, чтобы вызвать интоксикацию.
На протяжении десятилетий он использовался в качестве источника энергии в различных странах, таких как Китай, Япония, Корея, Египет и Бразилия.
В домашних условиях может производиться из различного сырья, включая биогаз из органических отходов.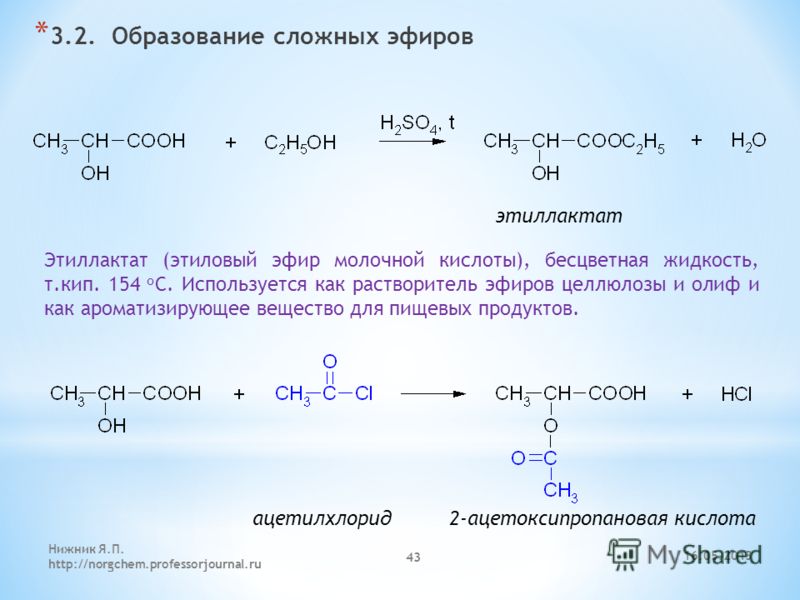 Из-за отсутствия углерод-углеродных связей использование диэтилового эфира в качестве альтернативы дизельному топливу может практически устранить выбросы твердых частиц и потенциально свести на нет необходимость в дорогостоящих дизельных сажевых фильтрах. Диэтиловый эфир имеет высокое цетановое число 85-9.6 и используется в качестве пусковой жидкости в сочетании с нефтяными дистиллятами для бензиновых и дизельных двигателей из-за его высокой летучести и низкой температуры вспышки.
Из-за отсутствия углерод-углеродных связей использование диэтилового эфира в качестве альтернативы дизельному топливу может практически устранить выбросы твердых частиц и потенциально свести на нет необходимость в дорогостоящих дизельных сажевых фильтрах. Диэтиловый эфир имеет высокое цетановое число 85-9.6 и используется в качестве пусковой жидкости в сочетании с нефтяными дистиллятами для бензиновых и дизельных двигателей из-за его высокой летучести и низкой температуры вспышки.
Диэтиловый эфир можно получить как в лабораториях, так и в промышленных масштабах с помощью процесса, называемого синтезом кислого эфира.
Этанол смешивают с сильной кислотой, такой как серная кислота (H 2 SO 4 ). Эта сильная кислота диссоциирует в водной среде с образованием H 3 O + (ионы гидроксония).
Позже ион водорода протонирует электроотрицательный атом кислорода этанола, придавая молекуле этанола положительный заряд.