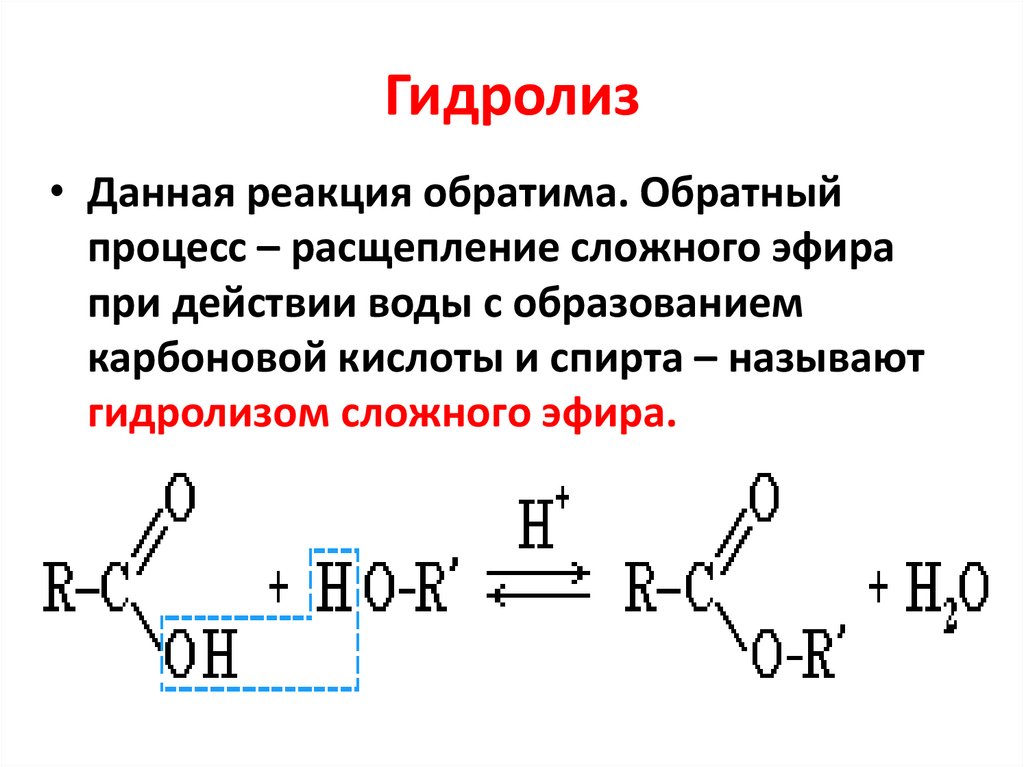
Содержание
Щелочной гидролиз — сложный эфир
Cтраница 3
По механизму необратимых бимолекулярных реакций протекает большая часть реакций щелочного гидролиза сложных эфиров в водном растворе. Развитие физической химии столь многим обязано изучению этих реакций, что они заслуживают специального обсуждения.
[31]
Положительный знак и величины реакционной константы щелочного гидролиза этих пероксиэфиров, близкие к значениям р для щелочного гидролиза сложных эфиров бензойной и алифатических кислот, указывают на слабое влияние второго пероксидного атома кислорода на реакционную способность — C ( O) — OOR — связи. Близкие и меньшие единицы значения изотопного эффекта при щелочном гидролизе подтверждают общность механизма сложных эфиров и пероксиэфиров.
[32]
В качестве вторичных стандартных процессов использованы диссоциация мета — и napa — замещенных фенилуксусных кислот и скорости щелочного гидролиза сложных эфиров этих кислот, а также некоторые другие процессы.
[33]
Конечный продукт реакции — карбоксилат-анион — не проявляет свойств карбонильного соединения вследствие полной делокализации отрицательного заряда; по этой причине щелочной гидролиз сложных эфиров — необратимая реакция.
[34]
В связи с этим для осуществления реакции нуклеофильного присоединения по карбоксильной группе необходимо либо использование достаточно сильных нуклеофилов ( гидроксил-ион в случае щелочного гидролиза сложных эфиров), либо предварительная активация за счет присоединения протона при кислотном гидролизе сложных эфиров.
[35]
Использование изотопов в сочетании с кинетическими измерениями позволяет в ряде случаев сделать выбор между двумя возможными механизмами, как, например, при щелочном гидролизе сложных эфиров.
[36]
Заметим, однако, что не следует ожидать параллелизма во влиянии заместителей на реакции, скорость которых определяется величиной эффективного заряда на реакционном центре ( большинство реакций нуклеофильного замещения, щелочной гидролиз сложных эфиров) и на реакции полярографического восстановления, легкость которых зависит от энергии НСМО.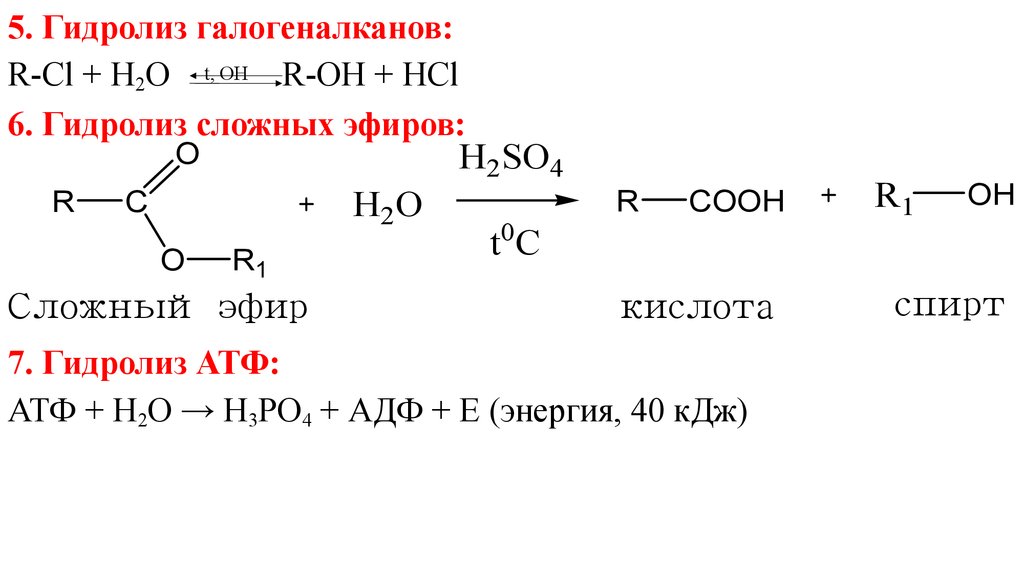 В первом случае влияние заместителя слагается из его воздействия на все занятые орбитали, заселенность которых и определяет эффективный заряд атома. Во втором случае это влияние проявляется лишь в отношении одной граничной орбитали.
В первом случае влияние заместителя слагается из его воздействия на все занятые орбитали, заселенность которых и определяет эффективный заряд атома. Во втором случае это влияние проявляется лишь в отношении одной граничной орбитали.
[37]
Щелочи также ускоряют гидролиз, но при этом надо брать эквивалентное количество основания, ввиду того что образующаяся кислота превращается в карбоксилат-ионы. Иногда щелочной гидролиз сложных эфиров называют омылением в соответствии с частным случаем такого гидролиза — производством мыла из природных жиров ( стр.
[38]
До начала 50 — х годов считалось, что уравнение Гаммета неприменимо в алифатическом ряду. Константы скорости щелочного гидролиза алифатических сложных эфиров, например, не находятся в линейной зависимости от рКа соответствующих кислот. Далее предполагалось, что соблюдение такой простой зависимости как уравнение Гаммета связано с требованием постоянства энтропии реакции или активации. Поскольку предполагалось, что энтропийные эффекты имеют стерическую природу ( аналогия со стерическим фактором Р в теории столкновений), то тем самым для проявления только электронных эффектов принималось необходимым наличие жесткой структуры остова молекулы с достаточной удаленностью переменного заместителя от реакционного центра.
Поскольку предполагалось, что энтропийные эффекты имеют стерическую природу ( аналогия со стерическим фактором Р в теории столкновений), то тем самым для проявления только электронных эффектов принималось необходимым наличие жесткой структуры остова молекулы с достаточной удаленностью переменного заместителя от реакционного центра.
[39]
В то время как щелочной гидролиз сложных эфиров идет быстрее кислотного в несколько тысяч раз, амиды расщепляются щелочами в среднем лишь в 6 раз быстрее, чем кислотами.
[40]
В то время ка щелочной гидролиз сложных эфиров идет быстрее кислотного в не сколько тысяч раз, амиды расщепляются щелочами в среднем лиип в б раз быстрее, чем кислотами.
[41]
| Структура а-цикло-декстрина.
[42] |
В этом слое происходит концентри-рование ( по сравнению с растворителем) ионов Н3О, и большой избыток отрицательных зарядов может стабилизовать катионное переходное состояние, подобно тому, как это имеет место при гидролизе ацеталей ( см.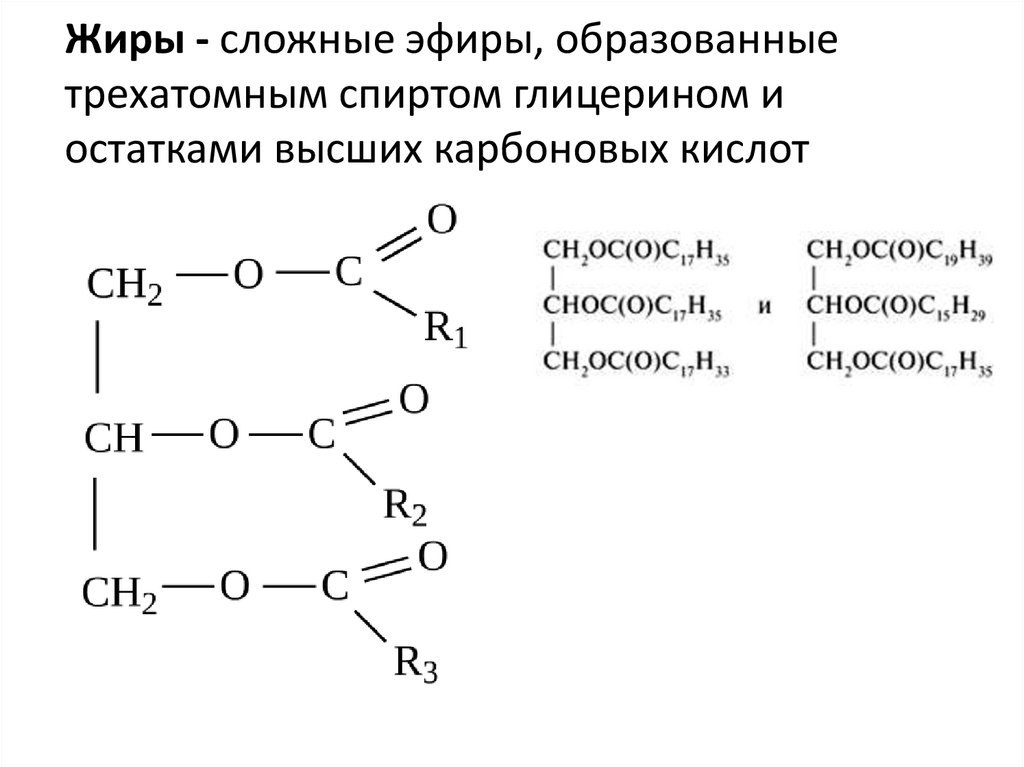 с. Анионная мицелла может существенно ингибировать щелочной гидролиз сложного эфира, так как присутствие гидроксид-ионов в слое Штерна маловероятно. Последняя реакция катализируется катионными мицеллами, где противоионом является гидроксид, а превалирующий заряд положителен.
с. Анионная мицелла может существенно ингибировать щелочной гидролиз сложного эфира, так как присутствие гидроксид-ионов в слое Штерна маловероятно. Последняя реакция катализируется катионными мицеллами, где противоионом является гидроксид, а превалирующий заряд положителен.
[43]
Соотношение величин р и р может быть интерпретировано тогда следующим образом. В случае стандартной реакционной серии ( щелочной гидролиз сложных эфиров) величина г икл гораздо больше, чем это следует из гипотезы передачи индукционного влияния только через а-связи. Поэтому и для замещенных фенилов вклад величины г р весьма существенен и величина р относительно больше. Устанавливая для этой реакционной серии равенство р р, мы тем самым завышаем значение величины р по сравнению с ее значением при нормальной передаче индукционного влияния только по ст-связям. Переходя теперь к реакционным сериям, для которых относительный вклад величины 2 р меньше ( г икл ближе к расчетной величине), мы должны наблюдать и относительное уменьшение величины р, в то время как величина р будет вести себя вполне нормальным образом.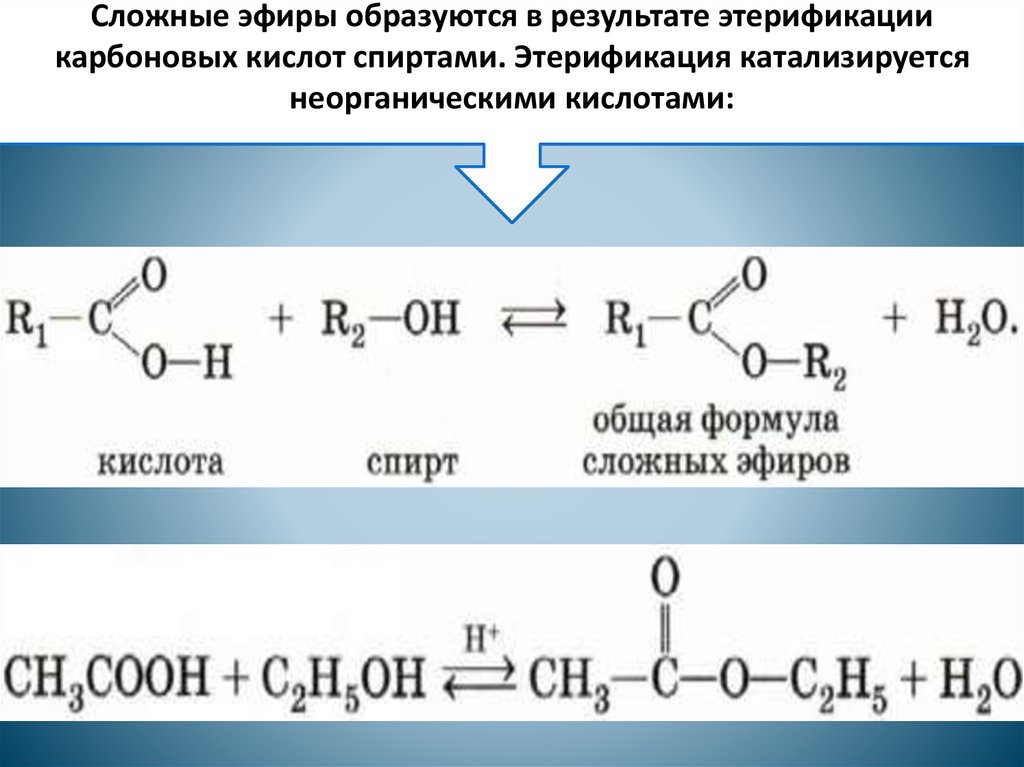
[44]
| Наглядное изображение аддитивности.
[45] |
Страницы:
1
2
3
4
Химия — 11
■ РЕФЛЕКСИЯ И ОЦЕНИВАНИЕ
■ 1. Закончите фразы и проверьте по тексту их правильность.
• В кислой среде гидролиз сложных эфиров … не протекает.
• Гидролиз сложного эфира в щелочной среде … реакция, так взаимодействуют друг с другом.
• Этилацетат более летучий, чем уксусная кислота, так как …
■ II. Выразите свое мнение о теме, ответив на вопрос.
— Оправдались ли ваши ожидания от урока?
■ III. Выполните задания.
1. Определите высказывания относительно метилформиата.
| 1. летучая жидкость 4. в воде растворяется | 2. имеет приятный запах 5. подвергается гидролизу | 3.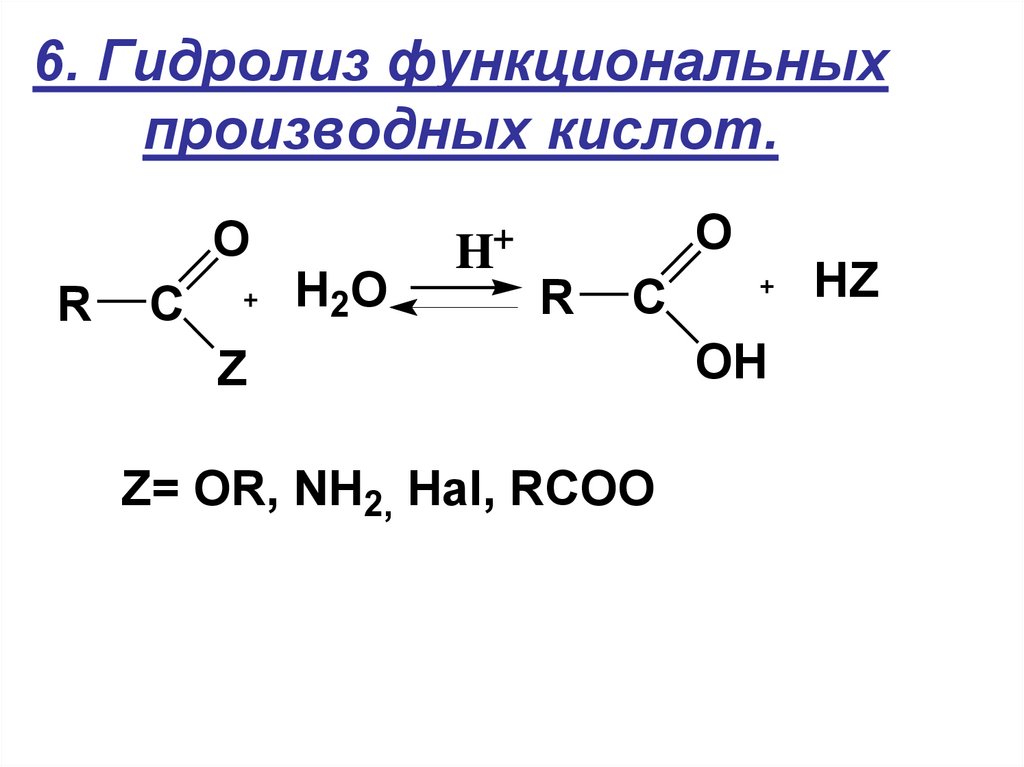 содержит -ОН группу содержит -ОН группу |
2. Укажите области применения сложных эфиров.
| 1. производство прохладительных напитков 3. производство духов | 2. в качестве растворителя 4. производство пластмасс |
3. Назовите сложный эфир, образующийся по схеме:
4. При гидролизе 17,6 г сложного эфира была получена предельная одноосновная кислота и 12 г пропилового спирта. Определите кислоту.
5. Укажите, что верно или неверно для сложных эфиров. Обоснуйте ответы.
| Да (+) | Нет(-) | |
| Гидролизом сложного эфира в кислой среде можно получить мыло | ||
| Температура кипения метилформиата больше, чем у метанола | ||
| Температура кипения метилформиата больше, чем у метановой кислоты | ||
Сложные эфиры высших карбоновых кислот в воде растворимы | ||
| Между молекулами метилформиата водородная связь не образуется |
6. Определите соответственно вещества X, Y и Z.
Определите соответственно вещества X, Y и Z.
7. Охарактеризуйте физические и химические свойства сложных эфиров. Составьте уравнения соответствующих реакций.
8. Составьте уравнения превращений.
C2H6 -> C2H5Cl -> C2H5OH ->
CH3COOH -> CH3COOC5H11 -> C5H11OH
••• После | Подготовьте реферат по теме «Сложные эфиры в нашем питании». |
Кислотный и щелочной гидролиз сложных эфиров
Гидролиз сложных эфиров дает в качестве продуктов карбоновую кислоту (или соль карбоновой кислоты) и спирт. Есть два разных
Есть два разных
методы гидролиза сложных эфиров в органической химии. По методу гидролиза карбоновая кислота или соль карбоновой кислоты
дано. Однако спирт дается как продукт в обоих методах (кислом и щелочном) как продукт .
Методы гидролиза сложных эфиров
- Кислотный гидролиз сложных эфиров
- Щелочной гидролиз сложных эфиров/основной гидролиз
Гидролиз сложных эфиров обычно катализируют кислотами или основаниями (щелочью). Поскольку группа OR является гораздо более бедной уходящей группой, чем галогенид
или OCOR, вода сама по себе не может гидролизовать большинство сложных эфиров. Поэтому мы должны использовать кислоту или основание для реакции гидролиза сложного эфира.
Какая связь углерод-кислород разорвана?
После гидролиза существующий атом кислорода в сложном эфире уходит в сторону спиртового соединения. Поэтому связь между карбонильным углеродом и атомом кислорода разрывается. См. рисунок, чтобы понять разрыв этой связи.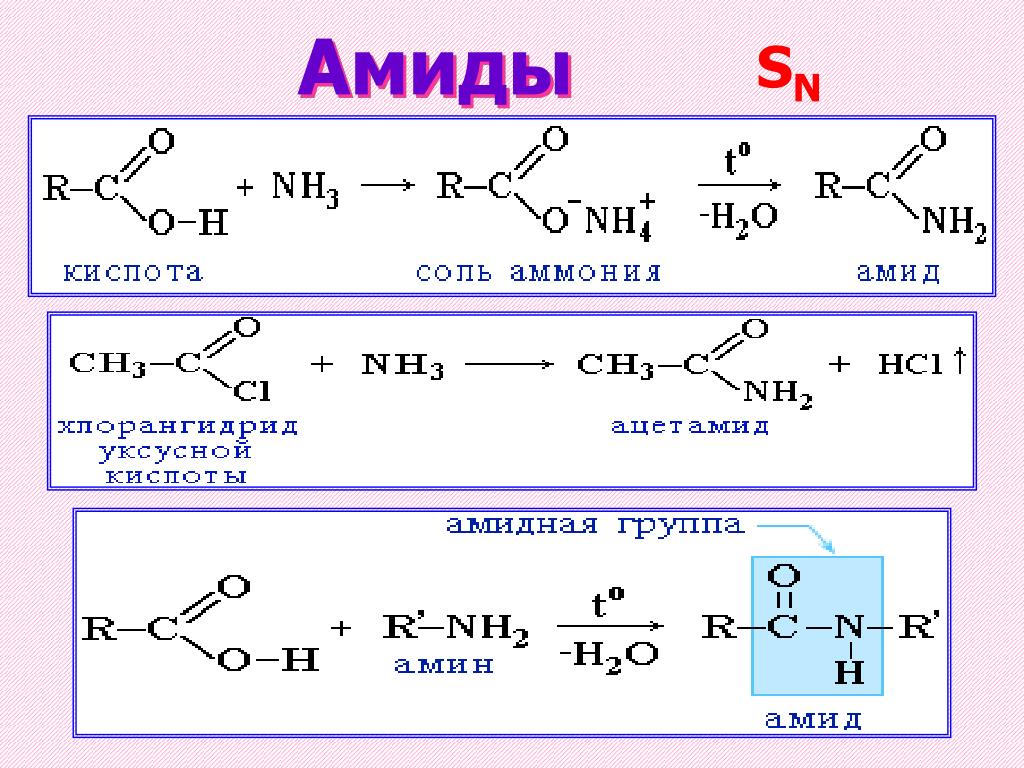 Это справедливо как для кислотного, так и для щелочного гидролиза сложных эфиров.
Это справедливо как для кислотного, так и для щелочного гидролиза сложных эфиров.
Кислотный гидролиз сложных эфиров
Концентрированная серная кислота используется для кислотного гидролиза сложных эфиров. Эта реакция происходит при нагревании. Карбоновый
кислотное соединение и спиртовое соединение представлены как продукты. И эта реакция обратима. Поэтому мы не можем получить
полностью продукты этой реакции.
Концентрированная серная кислота (H 2 SO 4 ) действует как катализатор, повышающий скорость реакции. Особенность в том, что H 2 СО 4
увеличивает скорость реакции как прямой, так и обратной реакции.
Кислотный гидролиз этилэтаноата
Этилэтаноат реагирует с концентрированной серной кислотой с образованием этановой кислоты и этанола, которые представляют собой карбоновую кислоту и спирт соответственно.
Кислотный гидролиз этилпропаноата
Кислотный гидролиз этилпропаноата дает этанол и пропановую кислоту. Концентрированный H 2 SO 4 применяется при нагревании для получения продуктов.
Концентрированный H 2 SO 4 применяется при нагревании для получения продуктов.
Механизм кислотного гидролиза
Реакция катализируется кислотами (H 2 SO 4 ), делая карбонильный углерод более положительным
и, следовательно, более восприимчивы к атаке нуклеофила. Нейклеофилы стремятся атаковать положительно заряженные атомы.
Щелочной гидролиз сложного эфира
Сложные эфиры гидролизуются сильными щелочами, такими как NaOH (водн.) или KOH (водн.) . В качестве продуктов даны натриевая соль карбоновой кислоты и спирт.
Но в этой реакции сначала образуются карбоновая кислота и спирт.
Но образовавшаяся карбоновая кислота реагирует с сильной щелочью с образованием
соль карбоновой кислоты.
Поэтому карбоновая кислота реагирует с NaOH или KOH с образованием натриевой соли карбоновой кислоты.
Щелочной гидролиз этилпропаноата
Щелочной гидролиз этилпропаноата дает этанол и пропаноат натрия.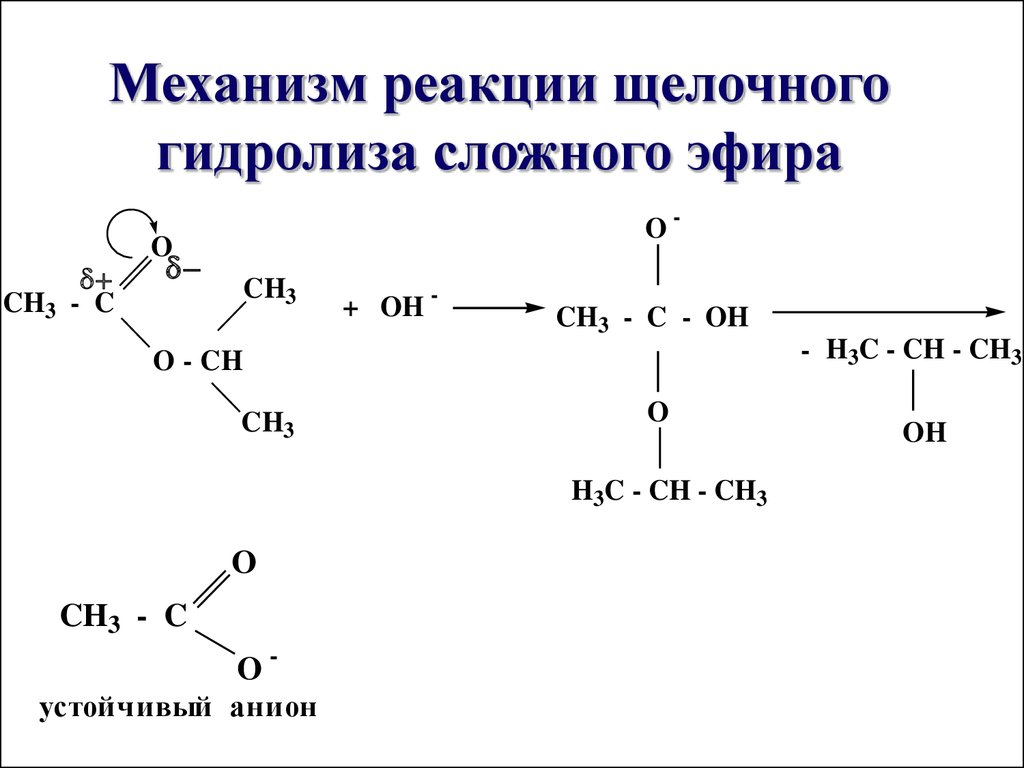 NaOH (водн.) или KOH (водн.) используется
NaOH (водн.) или KOH (водн.) используется
в качестве щелочи для щелочного гидролиза этилпропаноата.
Механизм щелочного гидролиза
Когда основания катализируют гидролиз, атакующим является более сильный нуклеофил OH — .
OH — атакуют положительно заряженные атомы. Эта реакция называется омылением и
дает соль кислоты.
Поведение катализатора
Теперь мы собираемся изучить поведение катализатора при гидролизе сложных эфиров.
H
2 SO 4 гидролиз
В качестве продуктов карбоновая кислота и спирт получаются путем добавления молекулы H 2 O. Концентрация H 2 SO 4 не изменилась. Поэтому H 2 SO 4 ведут себя как катализатор.
Гидролиз NaOH
При кислотном гидролизе сначала получают карбоновую кислоту и спирт. Но карбоновые кислоты имеют достаточную кислотную силу, чтобы реагировать с NaOH.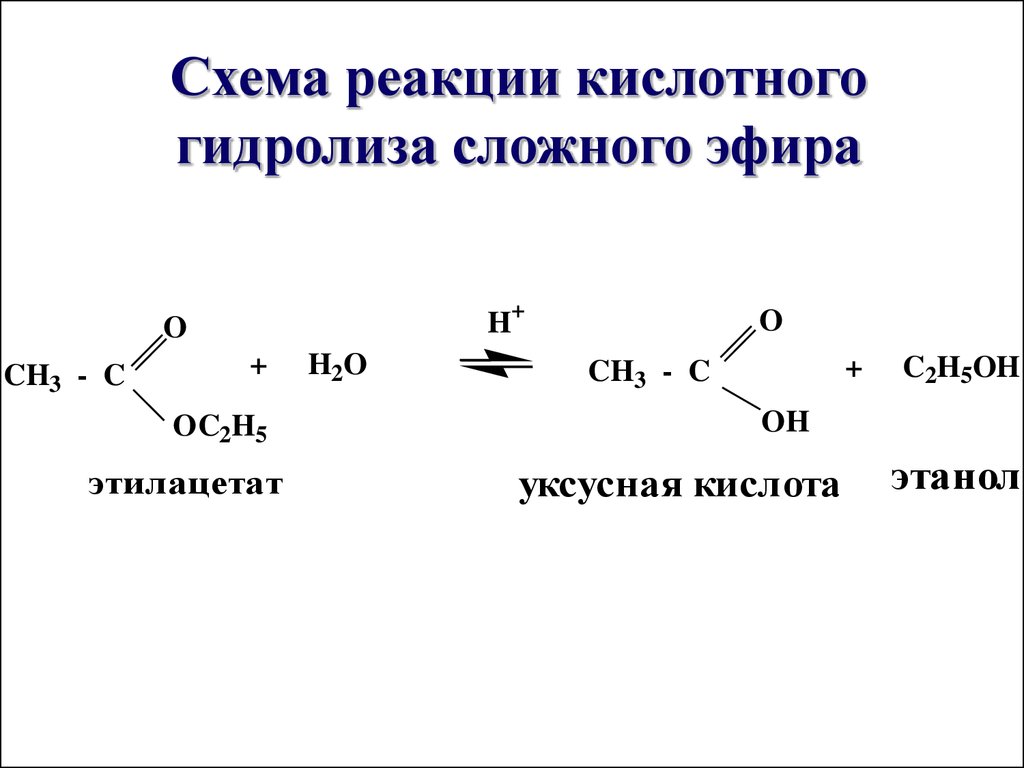 Поэтому NaOH расходуется в реакции. Поэтому NaOH не является катализатором гидролиза эфира.
Поэтому NaOH расходуется в реакции. Поэтому NaOH не является катализатором гидролиза эфира.
Гидролиз сложного эфира является равновесной реакцией
Кислотная реакция гидролиза является равновесной реакцией . Следовательно, это осуществимо только тогда, когда есть способ сместить равновесие вправо, чтобы получить больший выход. В противном случае в растворе будет смесь нескольких соединений.
Как лучше всего получить спирт и карбоновую кислоту путем гидролиза эфира?
- Как мы выяснили, щелочной гидролиз полностью гидролизует сложный эфир и дает натриевую соль карбоновой кислоты и спирта. Чтобы получить карбоновую кислоту из натриевой соли карбоксилата, добавляют разбавленную HCl.
Промышленное применение
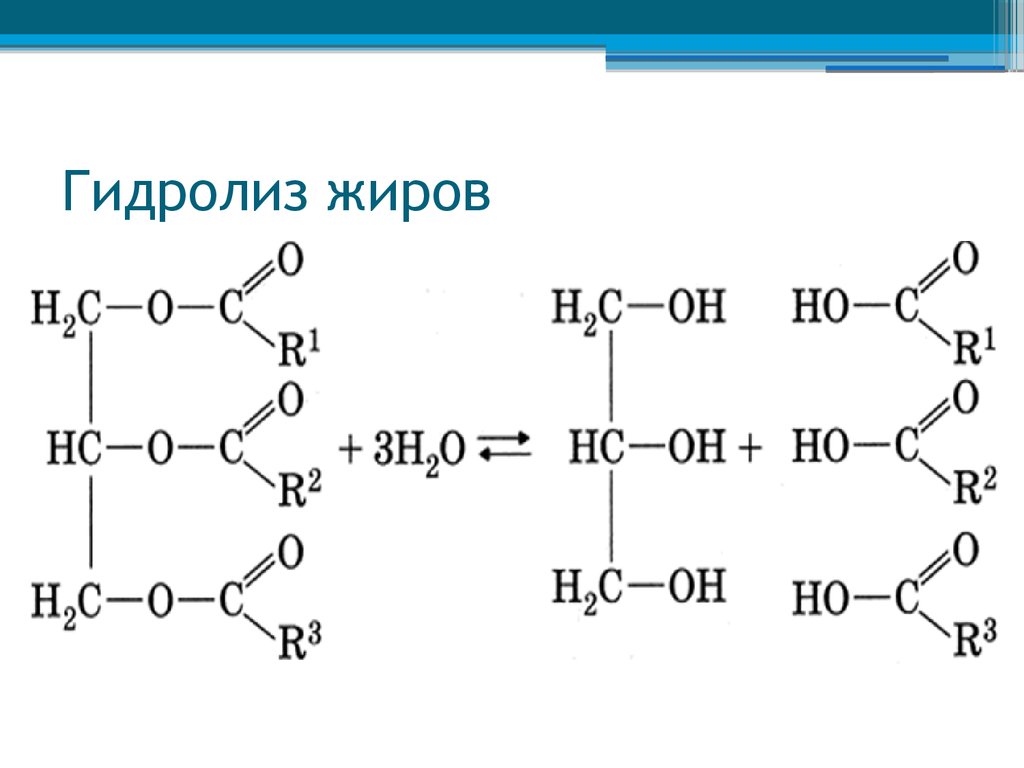
Процесс омыления в производстве мыла
В производстве мыла жир гидролизуется водными растворами NaOH до соли натрия и глицерина. Жир представляет собой смесь сложноэфирных соединений, и существует несколько типов жиров, которые можно использовать для производства мыла.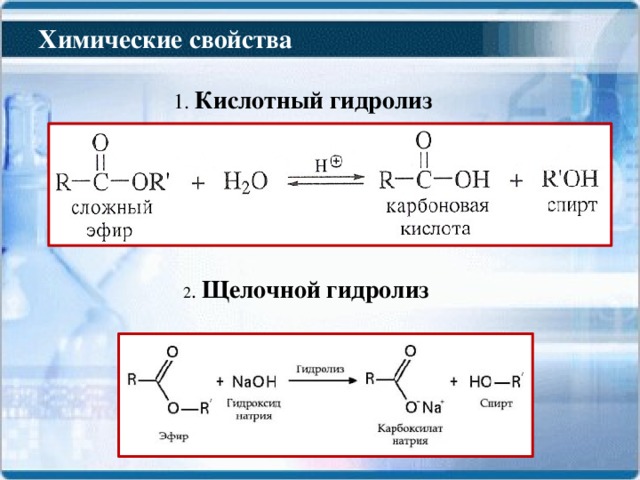 Этот процесс называется омылением .
Этот процесс называется омылением .
Эти сложные эфиры в жире содержат длинные цепочки атомов углерода. В процессе гидролиза происходят следующие стадии.
- Сначала дают карбоновую кислоту и глицерин.
- Затем полученная карбоновая кислота реагирует с NaOH с образованием мыла.
Омыление можно проводить в различных условиях.
- Холодный процесс
- Горячий процесс
При высокой температуре омыление становится более успешным и дает хороший выход за более короткое время. Поэтому горячий процесс более целесообразен при промышленном применении мыловарения.
Вопросы, задаваемые студентами
Эфиры, поддающиеся гидролизу
Эфиры, поддающиеся гидролизу из водных растворов кислот и водных растворов сильных щелочей. Но данные продукты разные.
гидролиз этилового эфира горячей щелочью
Эфир расщепляют на две части: карбоновую кислоту и спирт. Часть Ethyl станет этанолом.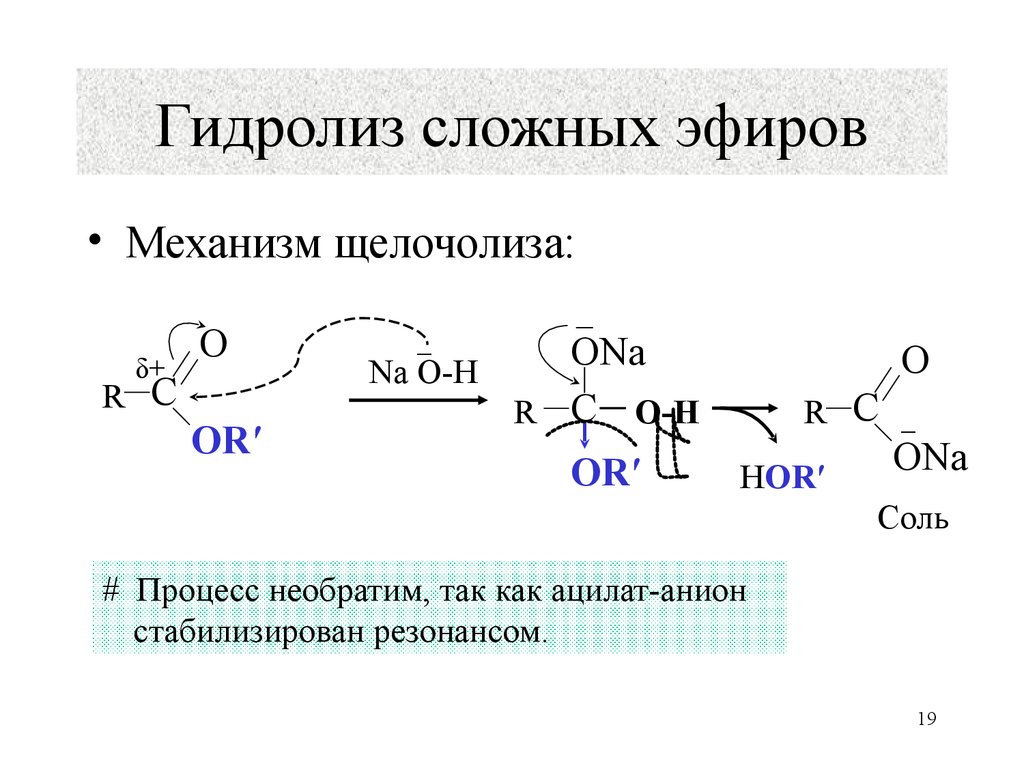
Чем гидролиз сложного эфира отличается от гидролиза алкена?
Сложные эфиры и алкены при гидролизе дают разные продукты. В результате гидролиза алкена в качестве продукта образуется спирт. Также для гидролиза используются разные реагенты.
Является ли сложный эфир кислым или основным?
Сложные эфиры, растворимые в воде, не образуют ионов H + или ионов OH — , проявляющих кислотно-основные характеристики.
гидролиз сложных эфиров, катализируемый основанием
При кислотном гидролизе концентрированный H 2 SO 4 используется в качестве катализатора.
реакция сложного эфира с водным раствором NaOH
Сложный эфир гидролизуется из водного раствора NaOH с получением спирта и карбоксилата натрия в качестве продуктов.
Ссылки — Гидролиз сложных эфиров
ПЕРЕДОВАЯ ОРГАНИЧЕСКАЯ ХИМИЯ МАРТА,
РЕАКЦИИ, МЕХАНИЗМЫ И СТРУКТУРА 6 -е издание, Майкл Б. Смит, Джерри Марч,
16-59 Гидролиз сложных эфиров карбоновых кислот (стр. 1400)
1400)
Органическая химия Реакции для 12 класса по химии
Гидратация алкенов
Алкиновая гидратация
Хлорирование алканов
Восстановление Клемменсеном альдегидов и кетонов
Разложение амида по Гофману
альдольная конденсация альдегида и кетона
Карбоновая кислота
реакция хлорида и воды — гидролиз
Реакция алкена и брома
реактив Гриньяра
реакция на алкоголь
Гидролиз сложных эфиров. Что такое гидролиз?
Гидролиз сложных эфиров – расщепление или разделение их на карбоновые кислоты (или их соли) и спирты с помощью воды, разбавленной щелочи или разбавленной кислоты. Он начинается с рассмотрения гидролиза простых эфиров, таких как этилэтанолат, и продолжается гидролизом более крупных и сложных эфиров для получения мыла.
Гидролиз простых эфиров
Что такое гидролиз?
Именно гидролиз — это реакция с водой. Именно это и происходит при гидролизе сложных эфиров с помощью воды или разбавленных кислот, таких как разбавленная соляная кислота.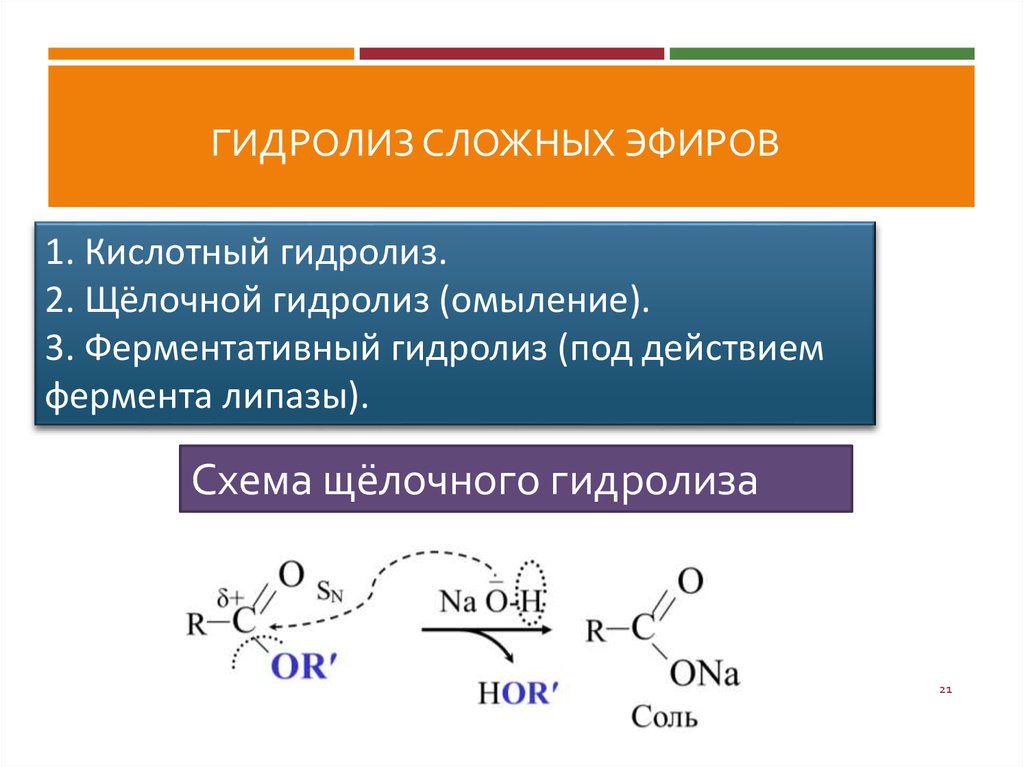
Щелочной гидролиз сложных эфиров в основном включает реакцию с гидроксид-ионами, но общий результат тот же, что и при совместном использовании двух других.
Гидролиз с использованием воды или разбавленной кислоты
Реакция с чистой водой настолько медленная, что ее никогда не используют. Реакция катализируется разбавленной кислотой, поэтому сложный эфир нагревают с обратным холодильником с разбавленной кислотой, такой как разбавленная серная кислота или разбавленная соляная кислота.
Вот два распространенных примера гидролиза с использованием кислотного катализатора.
Сначала гидролиз этилэтаноата:
А затем гидролиз метилпропаноата:
Помните, что реакции обратимы и обратимы. Чтобы сделать гидролиз максимально полным, вам придется использовать большое количество воды. Вода получается из разбавленной кислоты, поэтому вы должны смешать эфир с дополнительным количеством разбавленной кислоты.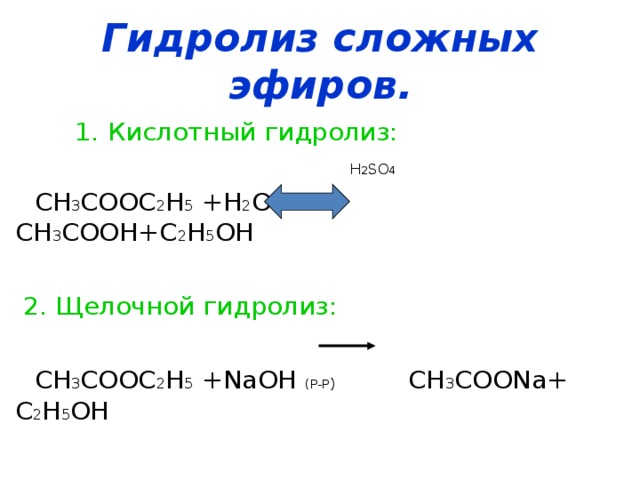
Примечание. Эти реакции обратны тем, которые используются для получения эфира из карбоновой кислоты и спирта. Единственная разница в этой ситуации заключается в том, что вы используете концентрированную кислоту в качестве катализатора. Чтобы получить как можно больше сложного эфира, вы не будете добавлять воду, иначе вы будете способствовать реакции гидролиза. Процесс кислотного гидролиза сложных эфиров приведен в разделе катализа этого сайта.
Гидролиз с использованием разбавленной щелочи
Это обычный способ гидролиза сложных эфиров. Сложный эфир нагревают с обратным холодильником с разбавленной щелочью, такой как раствор гидроксида натрия.
Это дает два больших преимущества перед использованием разбавленной кислоты. Реакции являются односторонними, а не обратимыми, и продукты легче расщепляются.
Взяв те же сложные эфиры, что и выше, но используя раствор гидроксида натрия, а не разбавленную кислоту:
Во-первых, гидролиз этилэтаноата с использованием раствора гидроксида натрия:
. . . а затем аналогичным образом гидролизовать метилпропаноат:
. . а затем аналогичным образом гидролизовать метилпропаноат:
Помните, что вы получаете натриевую соль, а не саму карбоновую кислоту.
Эту смесь сравнительно легко разделить. Учитывая, что вы используете дополнительный раствор гидроксида натрия, эфира не останется.
Полученный спирт можно перегнать. Это просто!
Если вам нужна кислота, а не ее соль, все, что вам нужно сделать, это добавить дополнительное количество сильной кислоты, такой как разбавленная серная кислота или разбавленная соляная кислота, в смесь, оставшуюся после первой перегонки.
Смесь насыщена ионами водорода. Они выбираются ионами этаноата (или ионами пропаноата), присутствующими в солях, для получения этановой кислоты (или пропановой кислоты и т. Д.). Поскольку это слабые кислоты, когда они объединяются вместе с ионами водорода, они, как правило, остаются вместе.
Теперь можно отогнать карбоновую кислоту.
Гидролиз сложных эфиров для производства мыла
Следующие крупные операции по щелочному гидролизу (с помощью раствора гидроксида натрия) сложных эфиров наблюдаются в животных и растительных жирах и маслах.