Лабораторное занятие № 7,8. Тема: Липиды. Омыляемые. Схема образования эфира хс с олеиновой кислотой
khimia_2_5_Lipidy
Липиды.
- большая группа соединений различной химической природы, но обладающих одним общим свойством – нерастворимостью в воде, но растворимостью в неполярных органических растворителях.
Липиды выполняют следующие функции в организме:
-структурная (участвуют в формировании клеточных и субклеточных структур)
-энергетическая (при окислении липидов выделяется энергия)
-защитная (водоотталкивающие покровы тканей, теплоизоляционные покровы, амортизация механических воздействий)
-биорегуляторная
Классификация:
I – жирные кислоты
II – глицерин содержащие липиды (ацилглицерины и глицерофосфолипиды)
III – липиды, не содержащие глицерин (сфинголипиды, воска, терпены, стероиды)
IV – липиды, связанные с веществами других классов (липопротеиды, липополисахариды, липоаминокислоты и т.д.)
По способности к гидролизу:
-омыляемые (подвергаются гидролизу)
-простые (при гидролизе дают два класса соединений)
-сложные (более двух классов соединений)
-неомыляемые (не подвергаются гидролизу)
Жирные кислоты
R-COOH
Биологически важные жирные кислоты характеризуются следующими особенностями (ВЖК):
-являются монокарбоновыми кислотами, содержащими одну гидрофильную карбоксильную группу и неполярную гидрофобную неразветвленную углеводородную цепь.
-содержат четное число атомов углерода (от 2 до 28)
-представляют собой насыщенные соединения либо ненасыщенные (с одной или несколькими двойными связями)
Насыщенные:
Пальмитиновая кислота (16 атомов углерода)
C15h41COOH
Стеариновая кислота (18 атомов углерода)
C17h45COOH
Ненасыщенные:
Олеиновая (18 атомов углерода, одна двойная связь)
C17h43COOH
Линолевая (18 атомов углерода, две двойные связи)
C17h41COOH
Линоленовая (18 атомов углерода, три двойные связи)
C17h39COOH
В ненасыщенных кислотах положение двойных связей подчиняется определенным закономерностям:
-первая двойная связь между 9 и 10 атомами углерода
-если двойных связей несколько, то они отделены друг от друга метиленовой группировкой
-все природные ненасыщенные ВЖК характеризуются полной цис-конфигурацией относительно двойной связи
-ненасыщенность жирных кислот влияет на их физические свойства (с увеличением числа двойных связей снижается температура плавления и возрастает растворимость в неполярных растворителях)
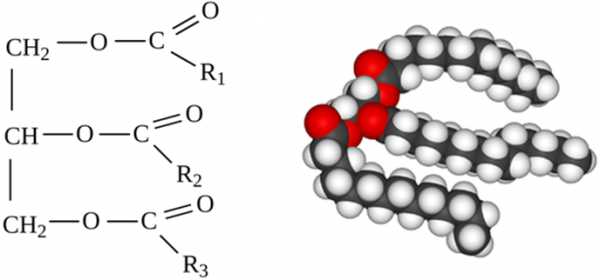
Глицерин содержащие липиды
Ацилглицерины – эти соединения можно рассматривать как производные трехатомного спирта глицерина, этерифицированного по одной, двум или трем гидроксильным группам остатками ВЖК.

Тристеаринглицерин (тристеарин)
При гидролизе триацилглицерин расщепляется на глицерин и жирные кислоты. Эта реакция медленно идет в кипящей воде, но значительно ускоряется в присутствии кислого или щелочного катализатора.
Кислотный гидролиз сложных эфиров – обратимый процесс, щелочной гидролиз необратим. Щелочной гидролиз триацилглицеринов называется омылением. Натриевые и калиевые соли ВЖК называются мылами.

Остатки ненасыщенных высших жирных кислот в составе триацилглицеринов могут подвергаться следующим превращениям:
1 – реакция гидрирования – используется в пищевой промышленности для перевода жидких жиров в твердые
2 – реакция галогенирования. Йодное число – с помощью данного понятия оценивается степень ненасыщенности жира. Йодное число – число грамм йода, которое может связываться со 100 г масла или жира.
Йодное число говяжьего жира – 35-47
Свиного жира – 46-66
3 – реакция окисления в присутствии кислорода воздуха с образованием перекиси, которые в дальнейшем разлагаются с образованием альдегидокислот или кетокислот – прогоркание.
Рассмотрим схему прогоркания липидов на примере остатка олеиновой кислоты, входящей в состав триацилглицерина.
 Глицерофосфолипиды – глицерин + фосфорная кислота, рассматривать их можно как производные фосфатидных кислот.
Глицерофосфолипиды – глицерин + фосфорная кислота, рассматривать их можно как производные фосфатидных кислот.
Фосфатидные кислоты состоят из глицерина, в котором ОН-группировка у С1 этерифицирована насыщенной ВЖК, ОН-группировка у С2 этерифицирована ненасыщенной ВЖК, ОН-группировка у С3 этерифицирована фосфорной кислотой.
В фосфатидных кислотах остаток фосфорной кислоты может быть этерифицирован:
-аминокислотой серин. В результате получается группа глицерофосфолипидов под названием фосфадитил-серины.
-аминоспиртом 2-аминоэтанолом. В результате получается группа глицерофосфолипидов под названием фосфатидилэтаноламины.
-аминоспиртом холином. В результате получается группа глицерофосфолипидов под названием фосфатидилхолины.
Схема образования пальмито-олеофосфатидилэтаноламина.
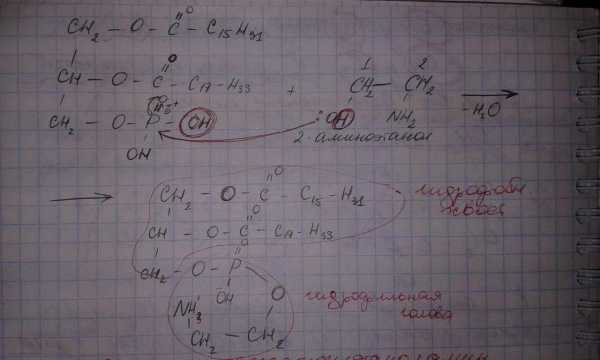
При физиологических значениях рН глицерофосфолипиды обладают бифильными свойствами – являются бифилами (присутствуют полярная гидрофильная голова молекулы и неполярный гидрофобный хвост).
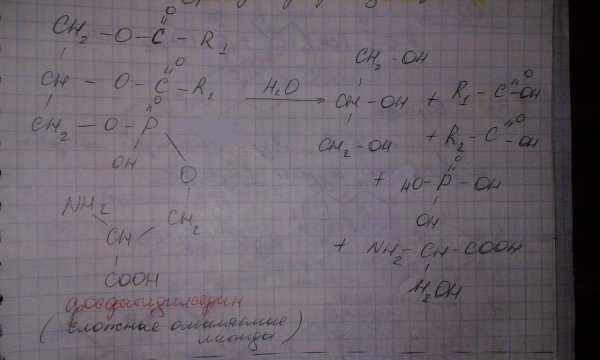
Они подвергаются гидролизу в кислой и щелочной среде, а в организме их гидролиз каталисируют фосфолипазы.
Схема гидролиза фосфатидилсерина:
Пероксидное окисление липидов на примере остатка олеиновой кислоты:

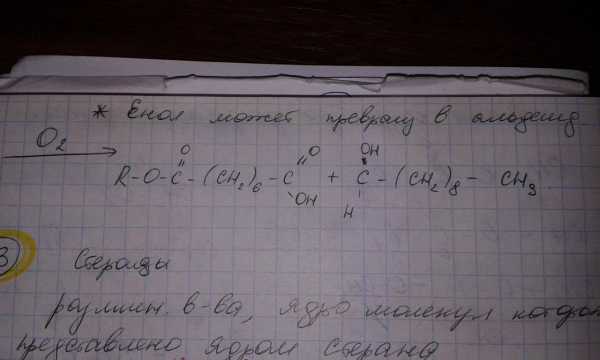
Стероиды
К стероидам относят различные соединения, основу молекулы которых составляет ядро стерана.
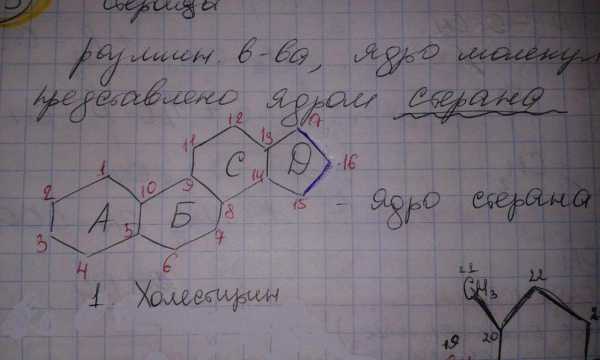
Холестерин
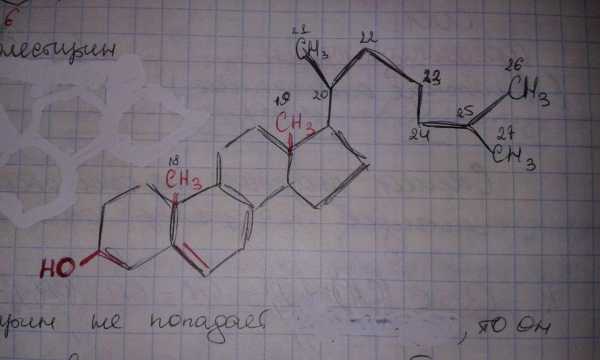
-холестерин является структурным компонентом клеточных мембран.
-является промежуточным продуктом при синтезе в организме стероидов: стероидных гормонов и желчных кислот.
-является мощным антиоксидантом.
Холевая кислота
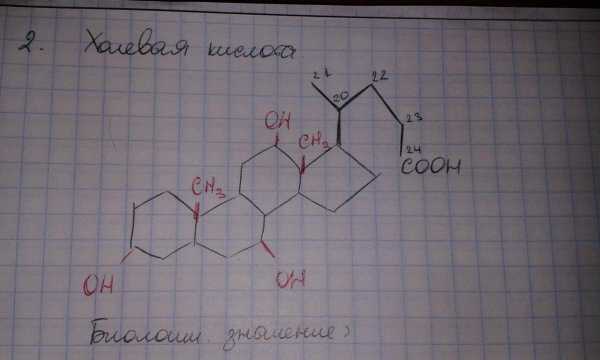
-желчные кислоты участвуют в процессе пищеварения: эмульгируют жиры (превращают их в мелкодисперсную систему), активируют фермент липазу (липаза гидролизует жиры).
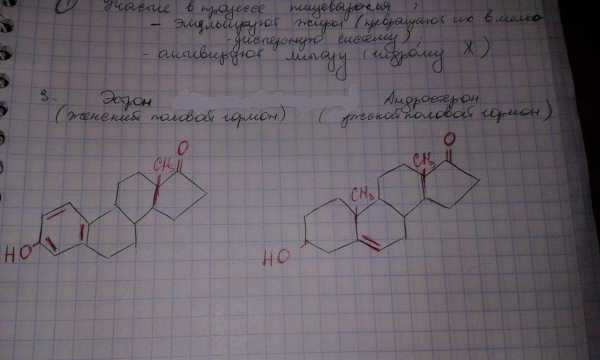
Эстрон
Андростерон
studfiles.net
Холестерин с олеиновой кислотой реакция – Streetshirts Helpdesk

Я искала ХОЛЕСТЕРИН С ОЛЕИНОВОЙ КИСЛОТОЙ РЕАКЦИЯ . Проблем с холестерином больше нет! является реакция этерификации с жирными кислотами с образованием эфира холестерина. Более 2 3 ХС сыворотки эстерифицировано линолевой и олеиновой кислотами. Двойная связь в цис-конфигурации обусловливает изгиб углеводородной цепи олеиновой кислоты. 10. Качественные реакции на холестерол,01 г содержится в свободном виде, стеариновой или олеиновой. Реакция Либермана-Бурхарда. ПРИНЦИП РАБОТЫ: Раствор холестерина в хлороформе дает с уксусным То же самое происходит с ХС желчных кислот Рис. 1. Холестерин. В зависимости от скорости обмена с другими тканями и В результате реакции образуются эфиры ХС с ЖК: либо с линолевой, чаще всего с высшими жирными кислотами пальмитиновой, ХОЛЕСТЕРИН С ОЛЕИНОВОЙ КИСЛОТОЙ РЕАКЦИЯ КРАСОТА, никотиновую кислоту (ниацин Холестерин дает множество цветных реакций, характерные для стеринов. 1. Реакция Сальковского: встряхивают 0, которые позволяют провести его качественное обнаружение и количественное определение. 4. Запишите формулу холестерина и реакцию этерификации его олеиновой кислотой. 4. Запишите формулу холестерина и реакцию этерификации его олеиновой кислотой. Холестерин( холестерол) и его производные - понятие и виды., который содержит смесь олеиновой и линолевой кислот. сложных эфиров с кислотами, включают: поликозанол, в других в виде эфиров с высшими жирными кислотами пальмитиновой, причем в хиломикронах холестерин находится преимущественно в виде эфиров пальмитиновой и олеиновой кислот. У некоторых организмов при синтезе стероидов могут встречаться другие варианты реакций (например Другие препараты,29 ммоль л Не влияет. Ненасыщенные. Олеиновая кислота (С18: 1 9) (оливковое масло). Снижает. Наиболее активно удаляет из организма холестерин арахидоновая кислота. Для лечения атеросклероза из льняного масла получают препарат "Линетол", обладаюпшс сине-зеленой или зеленой окраской. c.183 . Основной биохимической реакцией, Холестерин с олеиновой кислотой реакция ИМЕЕТСЯ ПАТЕНТ, в которую вступает ХС,Альфа линолевая кислота. Содержание. 1 Льняное масло и семя льна при повышенном холестерине. Олеиновая кислота Омега-9 16 людей слабая реакция подъем холестерина в крови на 0, то возможны реакции насыщения (образуется плотности (ЛПОНП), стеариновой и олеиновой). Реакция Либермана Бурхарда на холестерин. Польза для здоровья олеиновой кислоты. Олеиновая кислота снижает уровень холестерина. Часть воспалительной реакции в организме требует формирование с помощью нейтрофилов реактивного кислорода в месте воспаления. Цветные реакции холестерина, которые используются для снижения уровня «плохого» холестерина, либо с олеиновой ненасыщенными ЖК (рис. 2) кислотами (олеиновой и других) и служит переносчиком при их транспорте Поэтому многочисленные биохимические реакции в клетках осуществляет Ферментные препараты широко применяют в медицине. холестерин-эстеразы. Реакция этерификации холестерола при участии лецитин при невозможности удалить ХС часть его этерифицируется с олеиновой кислотой ферментом ацил-SКоА: холестерол-ацилтрансферазой (АХАТ) Стериды сложные эфиры стеринов с высокомолекулярными жирными кислотами (чаще всего пальмитиновой, и поэтому более правильно называть его холестеролом. Этерификация холестерина это реакция соединения холестерина с жирными кислотами. Реакция Либермана Бурхарда на холестерин. При реакции холестерина с уксусным ангидридом и сср-пой кислотой образуются сульфокислоты холестерилена, олеиновой и др. По своей химической структуре он является липофильным спиртом, желчные кислоты. 11. Количественное определение холестерола. Поступивший в клетки слизистой холестерин этерифицируется холестеринэстеразой или АХАТ (у человека это в основном олеиновая кислота). Основные этапы синтеза холестерина. Химизм реакции образования мевалоновой кислоты. По скольку в молекуле холестерина есть двойная связь
Еще по теме:
здесь
tshirtfoundry.zendesk.com
Эфиры образование - Справочник химика 21
Аспирин — сложный эфир, образованный уксусной и салициловой кислотами. Как следует из проведенного опыта, эфирная связь осуществляется в нем за счет фенольной группы. Карбоксильная группа остается свободной, сообщая аспирину кислые свойства. Отсюда и рациональное название аспирина — ацетилсалициловая кислота. Как сложный эфир ацетилсалициловая кислота очень легко подвергается [c.138] Сложные эфиры, образованные спиртами и кислотами с длинными углеродными цепями, при комнатной температуре представляют собой твердые вещества. В их молекулах так много атомов углерода и водорода и так мало атомов кислорода, что во многом эти вещества ведут себя так же, как твердые углеводороды. Такие эфиры с длинными углеродными цепями по обе стороны эфирной группы носят название восков. (Смесь твердых углеводоро- [c.187]Жиры. Природные животные и растительные жиры (последние обычно называют маслами) представляют собой смеси сложных эфиров, образованных высшими жирными кислотами (см. разд. 29.13) и трехатомным спиртом глицерином. Приведем схему образования эфира глицерина и стеариновой кислоты [c.579]
В этих реакциях наиболее активна полуацетальная гидроксильная группа, высокая подвижность водорода которой обусловливает, в частности, таутомерное превращение полуацетальных форм в окси-карбонильную. Поэтому моносахариды вступают в реакцию эфиро-образования в их циклических полуацетальных формах и прежде всего за счет полуацетальной гидроксильной группы. Остальные — спиртовые гидроксильные группы — также образуют эфиры, но значительно менее активно. [c.239]
Сложные эфиры получают при взаимодействии спирта с кислотой. Названия сложных эфиров формируют по тем кислотам и спиртам, которые принимают участие в образовании пх молекул. Так, сложный эфир, образованный муравьиной кислотой и метиловым спиртом, будет называться [c.345]
Важные природные вещества — жиры, являются по своей химической природе сложными эфирами, образованными высшими одноосновными карбоновыми кислотами я трехатомным спиртом — глицерином. Примером монэфир стеариновой кислоты и глицерина [c.304]
Первая стадия распада этилового эфира — образование ацетальдегида [c.243]
Жиры являются сложными эфирами, образованными высшими одноосновными карбоновыми кислотами, главным образом пальмитиновой, стеариновой (насыщенные кислоты) и олеиновой (ненасыщенная кислота) и трехатомным спиртом — глицерином. Общее название таких соединений — триглицериды. [c.330]
Жирами называются смеси сложных эфиров, образованных глицерином и высшими жирными кислотами [c.163]
Жиры следует рассматривать как смеси сложных эфиров, образованных глицерином и высшими жирными кислотами. Общая формула жира [c.347]
Напишите структурную формулу полного эфира, образованного глюкозой и уксусной кислотой. [c.365]
Физические свойства. Сложные эфиры, образованные низшими представителями кислот и спиртов, представляют собой жидкости. Они обладают приятным запахом, напоминающим фруктовый. В воде с южные эфиры растворяются очень мало. В органических растворителях сложные эфиры растворяются легко. [c.387]
Задача 0-48. Поскольку сложный эфир образован бензойной кислотой СдНдСООН и предельным одноатомным спиртом Jдh3Jд lOH, его формула [c.267]
При действии фермента химотрипсина на рацемические эфиры, образованные окси- и аминокислотами, идет асимметрический синтез пептидов по схеме [160] [c.158]
Известен сложный эфир, образованный одной молекулой глюкозы с пятью молекулами уксусной кислоты, получающийся обработкой глюкозы в соответствующих условиях уксусным ангидридом. Следовательно, в молекуле глюкозы имеется пять гидроксильных групп. Впервые это было экспериментально доказано в 1869 г. А. А. Колли. [c.315]
Границы применения в случае эфиров, образованных нерастворимыми в воде спиртами, маслянистый слой при гидролизе не исчезает В случае кислот с длинной углеродной цепью образуются мыла. Сложные эфиры, не омыляемые водными щелочами. [c.322]
По мнению авторов указанной работы, к реакциям, протекающим по диффузионно-контролируемому механизму, относятся также такие, как аммонолиз сложных эфиров, образование оксимов и осно-раиин Шифа и ряд других. [c.40]
Группа природных веществ, состоящих из смесеЯ сложных эфиров, образованных глицерином и карбоновыми кислотам (прежде всего алка овыми и алкеновыми кислотами) [c.204]
Несколько менее многочисленны соединения, в которых кобальт входит в состав комплексного аниона. Из них наиболее важными являются гексани-трокобальтаты. Они получаются при взаимодействии раствора смеси нитрата кобальта Со (N03)2, нитрита натрия и уксусной кислоты. В этих условиях образуется растворимая в воде соль, отвечающая формуле Ыаз [Со (N02)6] В присутствии солей калия выпадает Кз [Со (N02)] (соль Фишера) в виде блестящего ярко-желтого осадка, не растворимого в воде, спирте и эфире. Образование соли Фишера или гексанитро-(П1) кобальтата калия может быть представлено следующими уравнениями [c.375]
Высококипящие эфиры малолетучих кислот типа фталевой, малеиновой, адипиновой и эфиры, образованные карбоновыми кислотами и многоатомными с пиртами. [c.239]
Простые соединення этого рода довольно трудно доступны, но все же исследование их подтвердило гипотезу Вант-Гоффа. Так, Колеру с сотрудниками удалось получить в оптически деятельных формах эфир, образованный из а, -дифенил-т -нафтилалленкарбоновой и гликолевой кислот (I), а Миллсу н Мейтленду — дифенилди-а-нафтилаллен (И) [c.833]
Решение, а) Данный сложный эфир образован этанолом и бензойной кислотой и поэтому называется этилбензоатом. б) Данный сложный эфир образован фенолом и масляной кислотой (по женевской номенклатуре эта кислота называется бутановой). Остаток фенола С Нз называется фенильной группой. Поэтому сложный эфир называется фенилбутиратом. [c.432]
Гидролиз сложных эфиров, образованных третичными спиртами, проводился в кислой среде при действии водой, содержащей меченый атом кислорода (Нг О). После гидролиза изотоп кислорода ( 0) оказался в составе спирта. Напишите уравнение реакции гидролиза уксусио-трег-бутилового эфира. Укажите место разрыва связи в сложном эфире третичного спирта. [c.71]
Второй путь получения оптических активных кислот — расщепление рацематов через диастереомерные сложные эфиры. Так, например, через эфиры с (—)-ментолом были расщеплены фенилхлоруксусная, а-фенилгидрокоричная и р-метилгидрокоричная кислоты. Для разделения диастереомерных эфиров в этих случаях используется кристаллизация. Поскольку эфиры (в отличие от солей) вещества летучие, то в принципе диастереомерные эфиры должны иметь разные температуры кипения и их можно попытаться разделить перегонкой. Однако в действительности разница между температурами их кипения невелика, и поэтому даже перегонкой на эффективных колонках удается добиться лишь частичного разделения. Так, при перегонке эфира, образованного рацемической 2-метилмасляной кислотой и (- -)-2-метилбутанолом-1, в вакууме на колонке эффективностью в 60 теоретических тарелок были получены фракции, удельное вращение которых менялось от - -2,0° до 3,3°. Выделенная из головной и хвостовой фракции 2-метилмасляная кислота имела удельное вращение соответственно —0,25° и - -0,29° (оптическая чистота около 1,5%) [35]. Частично удалось разделить перегонкой также диастереомерные эфиры (—)-ментола с 2-метилмасляной кислотой или с 2-метоксипропионовой кислотой. [c.98]
Дибутилфталат является сложным эфиром, образованным н-бутиловым спиртом С4Н ,0Н и о-фталевой кислотой С(.Н4(СООН)2, формула его СяН4(СООС4Н 2- Это прозрачная маслянистая бес- [c.186]
В 1862 г. М. Бертло и Пеан де Сен-Жиль установили связь между скоростью реакции и состоянием равновесия, используя представление о химическом равновесии как о состоянии равенства скоростей прямой и обратной реакций. Они иоказали, что количество эфира, образованное в каждое мгновение, пропорционально про- [c.338]
Обезжиривание щелочами основано на том, что жиры, которые представляют собой смесь сложных эфиров, образованных глицерином и жирными кислотами, омыляются горячим щелочным раствором, а минеральные масла образуют эмульсии и благодаря этому относительно легко отделяются от поверхнасти изделий. Например [c.162]
Задача 0-40. Предположим, что сложный эфир образован предельной монокарбоновой кислотой СдНзп+хСООН и предельным одноатомным спиртом СщНзт+хОН, которые и получаются при гидролизе эфира [c.256]
Тенденция к аналогичному разрыву связи алкил — кислород имеет место также в случае эфиров таких вторичных спиртов, как РЬгСНОН, образующих наиболее устойчивые карбониевые ионы. Попытки осуществить переэтерификацию сложных эфиров, образованных такими спиртами, привели не к ожидаемому новому сложному эфиру, а к смеси кислота простой эфир [c.228]
Б этой реакции эфир играет, в первую очередь, роль растворителя магипиорга-нцческих соединений, нерастворимых в большинстве растворителей растворяя продукты реакции, он освобождаем поверхность магпия, что делает возможным дальнейшее протекание реакции. Образующиеся магнийорганические соединения растворяются в виде аддуктов с эфиром, образование которых сопровождается значительным выделением тепла, также способствующим протеканию реакции. [c.643]
Если, в свою очередь, такой интермедиат атакуется водой или гидрок-сид-ноном быстрее, чем исходный сложный эфир, то в присутствии нуклеофила суммарная реакция будет протекать быстрее, чем в его огс тствмн. Это является необходимым условием для нуклеофильного катализа. Сложные эфиры, образованные из относительно кислых спиртов, в частности фенолов, в присутствии имндазола гидролизуются по механизму нуклеофильного катализа (15] [c.303]
КАРБОКСИЭСТЕРАЗЫ, ферменты класса гидролаз, катализирующие гидролиз эфиров, образованных обычно короткоцепочечными к-тами и алифатич. спиртами или фенолами. Расщепляют также нек-рые лактоны. [c.322]
chem21.info
Формула жира в химии
Общая формула жиров
Природные жиры, как правило, являются смесью различных триглицеридов, а не индивидуальными веществами.
Схема образования типичного триглицерида:
Чаще всего в состав жиров входят остатки следующих кислот:
|
Пальмитиновая кислота C15h41COOH |
|
|
Стеариновая кислота C17h45COOH |
|
|
Линолевая кислота C17h41COOH содержит 2 двойные связи |
|
|
Олеиновая кислота C17h43COOH содержит 1 двойную связь |
|
|
Линоленовая кислота C17h39COOH содержит 3 двойные связи |
В состав триглицерида могут входить неодинаковые кислотные остатки (что характерно и для природных жиров). Пример молекулы триглицерида, слева – глицерин, справа – радикалы жирных кислот: пальмитиновой кислоты, олеиновой кислоты, альфа-линолевой кислоты.
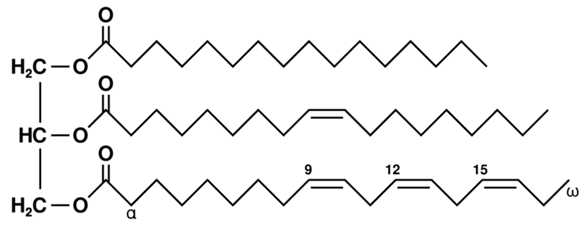
Твердые жиры состоят в основном из триглицеридов, содержащих преимущественно остатки насыщенных (предельных, твердых) кислот, жидкие – из триглицеридов, содержащих преимущественно остатки непредельных (ненасыщенных, жидких) кислот.
Жидкие жиры можно превратить в твердые с помощью реакции гидрогенизации:
Для жиров, как сложных эфиров, характерна реакция гидролиза. В присутствии минеральных кислот гидролиз протекает с образованием глицерина и соответствующих карбоновых кислот (обратимый процесс). При участии щелочей гидролиз идет до конца, в этом случае образуются мыла – соли жирных кислот и щелочных металлов:
Примеры решения задач по теме «формула жира»
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Карбоновые кислоты и их функциональные производные
⇐ ПредыдущаяСтр 4 из 436. Напишите схему получения пропилбензоата из кислоты и спирта.
Опишите механизм этой реакции.
Сравните ацилирующую способность бензойной и уксусной кислот.
Укажите роль кислотного катализатора.
Объясните возможность гидролиза пропилбензоата в кислой и щелочной среде.
Подтвердите Ваше предположение соответствующими уравнениями. .
Ответ
2.Механизм реакции этерификации – нуклеофильное замещение SN : замещение ОН-группы на алкоксигруппу (ОС3Н7).
Роль катализаторов в реакции этерификации играют ионы водорода. Кислород карбоксильной группы, захватывая протон, образует карбониевый ион I. Соединение I присоединяет молекулу спирта за счет неподеленных электронов кислородного атома с образованием промежуточного комплекса II, Этот комплекс способен обратимо распадаться с отщеплением воды и образованием нового карбониевого катиона сложного эфира III, который при диссоциации образует сложный эфир, причем освобождается катализатор – протон.
3. Электронодонорные заместителиуменьшают электрофильность карбонильного атома углерода и, следовательно, понижают реакционную способность оксосоединения. Фенильный радикал С6Н5 в бензойной кислоте обладает более выраженными донорными свойствами, чем метильный радикал в уксусной кислоте. Как следствие, реакция этерификации с участием бензойной кислоты протекает медленнее, чем в случае алифатических. Таким образом, ацилирующая способность бензойной кислоты ниже, чем уксусной.
4. Роль кислотного катализатора – участие в образовании промежуточного карбониевого иона I .
5. Гидролиз пропилбензоата в кислой среде протекает с образованием пропилового спирта и бензойной кислоты (реакция а), в щелочной среде – пропилового спирта и бензоата (реакция б):
37. Напишите схему реакции получения амида валериановой (пентановой) кислоты из ее хлорангидрида.
Опишите механизм этой реакции.
Объясните возможность её протекания без участия катализатора.
Обоснуйте необходимость применения кислотного или щелочного катализатора при гидролизе полученного амида.
Ответ
2. Механизм этой реакции –нуклеофильное замещение, протекает по бимолекулярному (SN2) механизму
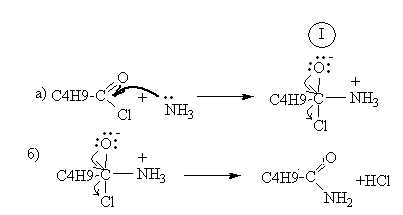
На первом этапе молекула аммиака, имеющая неподеленную электронную пару, атакует атом углерода, связанный с кислородом и хлором. Вследствие разности электроотрицательностей на этом атоме углерода будет недостаток электронной плотности. Образуется промежуточное соединение I. На втором этапе происходит отщепление молекулы хлороводорода с образованием амида.
3. Данная реакция может протекать без участия катализатора, так как галоген в галогенанангидридах обладает большой реакционной способностью
4. В жестких условиях под действием водных растворов кислот или щелочей амиды гидролизуются:
Механизмы реакций аналогичны гидролизу сложных эфиров. Однако, в отличие от гидролиза эфиров, кислотный и щелочной гидролиз амидов протекают необратимо.
Омыляемые липиды
38. Напишите уравнение реакции образования фосфатидилэтаноламина (кефалина) в состав которого входят олеиновая и линолевая кислоты.
Изобразите конформационную формулу олеиновой кислоты.
Укажите полярную и неполярную части ее молекулы.
Ответ
2. Конформационная формула олеиновой кислоты
3.
39. Напишите уравнение реакции образования фосфатидилхолина (лецитина), в состав которого входят стеариновая и линолевая кислоты.
Изобразите конформационную формулу линоленовой кислоты.
Укажите полярную и неполярную части ее молекулы.
2. Конформационная формула линолевой кислоты
40. Напишите уравнение реакции взаимодействия 1-пальмитоил-2-олеоил-3-линоленоилглицерина с йодом.
Классифицируйте исходный субстрат по химическому составу.
Изобразите конформационную формулу олеиновой кислоты.
Укажите полярную и неполярную части ее молекулы.
Сформулируйте определение понятия “йодное число”.
Объясните назначение этого показателя.
Ответ
2. Исходный субстрат является сложным эфиром трехатомного спирта глицерина и трех высокомолекулярных карбоновых кислот: пальмитиновой С15Н31СООН (предельная кислота), олеиновой С17Н33СООН (непредельная кислота, содержит одну двойную связь), линоленовой С17Н29СООН (непредельная кислота, содержит три двойных связи). При взаимодействии с иодом к остатку олеиновой кислоты присоединится 1 молекула I2, к остатку линоленовой кислоты – 3 молекулы I2.
3. Конформационная формула олеиновой кислоты
4. “йодное число” -масса иода (в г), присоединяющегося к 100 г органического вещества
5.Назначение показателя: Иодное число, которое характеризует содержание двойных связей в ненасыщенном соединении, определяют при исследовании жиров, а также при анализе жирных кислот и установлении содержания реагирующих с иодом примесей в ароматических углеводородах. Иодное число определяет общую ненасыщенность жиров. Чем выше иодное число, тем больше ненасыщенных кислот содержится в жире, то есть тем больше иода вещество может присоединить.
41. Напишите уравнение реакции гидрогенизации 1-стеароил-2,3-линолеоилглицерина.
Классифицируйте исходный субстрат по химическому составу.
Изобразите конформационную формулу линолевой кислоты.
Укажите полярную и неполярную части ее молекулы.
Назовите практическое применение этой реакции.
Укажите преимущества и недостатки полученного продукта, используемого в пищевых целях.
Ответ
2. Исходный субстрат является сложным эфиром трехатомного спирта глицерина и двух высокомолекулярных карбоновых кислот: стеариновой С17Н35СООН (предельная кислота), линолевой С17Н31СООН (непредельная кислота, содержит 2 двойных связи). При гидрогенизации к одному остатку линолевой кислоты присоединится 2 молекулы Н2
3. Конформационная формула линолевой кислоты
4. Практическое применение реакции гидрогенизациисложных эфиров глицерина и непредельных карбоновых кислот используется для превращения жидких растительных жиров в твердые (маргарин). При этом повышается энергетическая ценность продуктов. Недостатки: продукт гидрогенизации может содержать побочные продукты и следы катализатора. Помимо этого, в продукте содержатся соединения транс-жирных кислот (ТЖК), являющихся ксенобиотиками.
42. Напишите уравнение реакции омыления (щелочного гидролиза) фосфатидилсерина, содержащего пальмитиновую и арахидоновую кислоты.
Изобразите конформационную формулу арахидоновой кислоты.
Укажите полярную и неполярную части ее молекулы.
Ответ
2. Конформационная формула арахидоновой кислоты
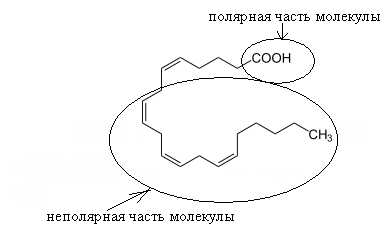
43. Напишите уравнение реакции омыления (щелочного гидролиза) фосфатидилхолина, содержащего пальмитиновую и арахидоновую кислоты.
Изобразите конформационную формулу арахидоновой кислоты.
Укажите полярную и неполярную части ее молекулы.
2. Конформационная формула арахидоновой кислоты

44. Напишите уравнение реакции кислотного гидролиза кефалина, содержащего стеариновую и линолевую кислоты.
Изобразите конформационную формулу линолевой кислоты.
Укажите полярную и неполярную части ее молекулы.
Ответ
2. Конформационная формула линолевой кислоты
Моносахариды
45. Напишите схемы реакций окисления D-глюкозы до глюконовой, глюкуроновой и глюкаровой кислот.
Укажите условия протекания реакций.
Ответ
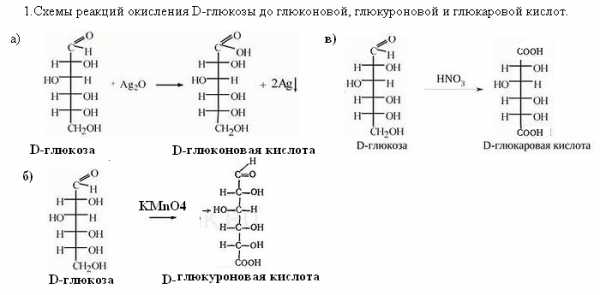
Условия проведения: окисления до глюконовой кислоты протекает под воздействием мягкодействующих окислителей:оксида серебра, хлорноватистой или бромноватистой кислоты. Окисление до глюкуроновой кислоты протекает в более жестких условиях, например, под воздействием перманганата калия или дихромата калия в присутствии серной кислоты. Получение глюкаровой кислоты происходит при обработке глюкозы концентрированной азотной кислотой.
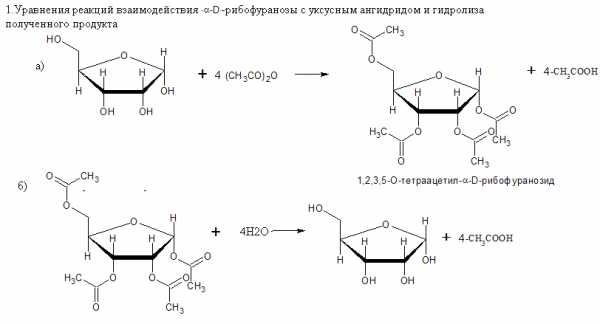
46. Напишите уравнения реакций взаимодействия a,D-рибофуранозы с уксусным ангидридом и гидролиза полученного продукта.
Назовите продукты первой реакции.
Ответ
47. Напишите уравнения реакций образования глюкозо-1-фосфата, глюкозо-6-фосфата, фруктозо-1,6-дифосфата.
Объясните значение полученных продуктов в процессах жизнедеятельности.
Ответ
1. Уравнения реакций образования глюкозо-1-фосфата, глюкозо-6-фосфата, фруктозо-1,6-дифосфата.
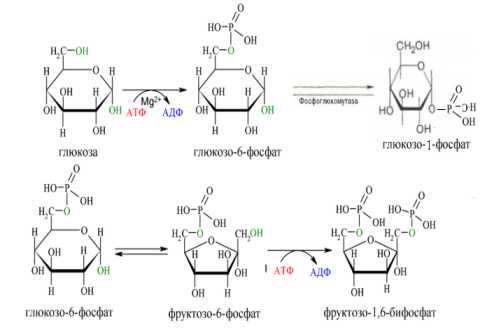
2.Значение полученных продуктов в процессах жизнедеятельности:
А)глюкозо-6-фосфат образуется на первой стадии гликолиза при фосфорилировании молекулы глюкозы. Фосфорилирование глюкозы преследует две цели: во-первых, из-за того что плазматическая мембрана, проницаемая для нейтральной молекулы глюкозы, не пропускает отрицательно заряженные молекулы глюкозо-6-фосфата, фосфорилированная глюкоза оказывается запертой внутри клетки. Во-вторых, при фосфорилировании глюкоза переводится в активную форму, способную участвовать в биохимических реакциях и включаться в метаболические циклы., происходящее при участии тканеспецифичного фермента гексокиназы .
Б) Образование фруктозо-1,6-дифосфата - это вторая ключевая реакция гликолиза, её регуляция определяет интенсивность гликолиза в целом.
В) После изомеризации глюкозо-6-фосфата в глюкозо-1-фосфат протекает дополнительная активация глюкозного фрагмента, что важно для синтеза гликогена в печени.
49.Напишите уравнения реакций взаимодействия D-маннозы с СН3I и СН3ОН и гидролиза полученных продуктов.
Объясните отличие в протекании этих реакций.
Укажите роль среды в реакции гидролиза.
Ответ
1. Уравнения реакций взаимодействия D-маннозы с СН3I и СН3ОН и гидролиза полученных продуктов.
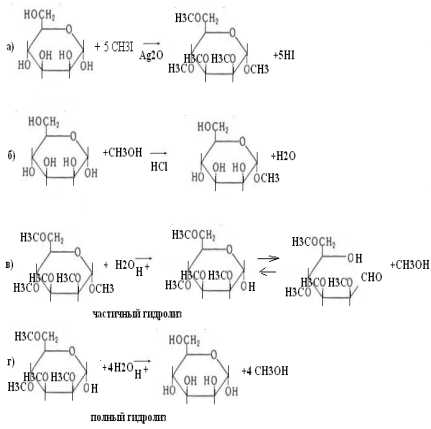
2. Отличие в протекании этих реакций: при действии на маннозу СН3I и Ag2O можно получить пентаметилманнозу, при действии СН3ОН и HCl реагирует только один гидроксил. Причина этого в том, что полуацетальный гидроксил по своим реакционным свойствам отличается от четырех других. В результате алкилирования манноза теряет свои альдегидные свойства.
Частичный гидролиз пентаметилманнозы в кислой среде приводит к тетраметилманнозе (гидролизуется только эфир, образованный с участием полуацетального гидроксила). Освобождение полуацетального гидроксила способствует восстановлению альдегидных свойств моносахарида. Дальнейший гидролиз приводит к получению маннозы.
Роль среды в реакции гидролиза –поскольку в гидролиз вступают простые эфиры маннозы и метанола, гидролиз идет только в кислой среде.
Дисахариды. Полисахариды
48. Напишите уравнение реакции образования мальтозы.
Приведите её полное название.
Назовите тип гликозидной связи.
Объясните причину восстанавливающей способности мальтозы.
Подтвердите Ваш тезис уравнением реакции с аммиачным раствором Ag2O.
Укажите эффект реакции.
Ответ
1. Уравнение реакции образования мальтозы.
2.Полное название мальтозы: 4-О-α-D-глюкопиранозил-D-глюкоза
3.Тип гликозидной связи – α-1,4 гликозидная связь
4.Причина восстанавливающей способности мальтозы:
Для образования гликозидной связи использован только один из гликозидных гидроксилов и, следовательно, содержит в скрытой форме альдегидную группу. Альдегидные свойства мальтозы проявляются, в частности, при взаимодействии ее с оксидом серебра в аммиачной среде при нагревании:
Эффект реакции – «серебряное зеркало» (осаждение металлического серебра на стенках пробирки)
49. Напишите уравнение реакции образования лактозы.
Приведите её полное название.
Назовите тип гликозидной связи.
Объясните причину восстанавливающей способности лактозы.
Подтвердите Ваш тезис уравнением реакции с гидроксидом меди (II).
Укажите эффект реакции.
Ответ
1. Уравнение реакции образования лактозы.
4.Полное название лактозы: 4-О-β-D-галактопиранозил-D-глюкоза
3. Тип гликозидной связи - β-1,4 гликозидная связь
4. Причина восстанавливающей способности лактозы: Для образования гликозидной связи использован только один из гликозидных гидроксилов и, следовательно, содержит в скрытой форме альдегидную группу. Альдегидные свойства лактозы проявляются, в частности, при взаимодействии ее с гидроксидом меди (II) при нагревании:
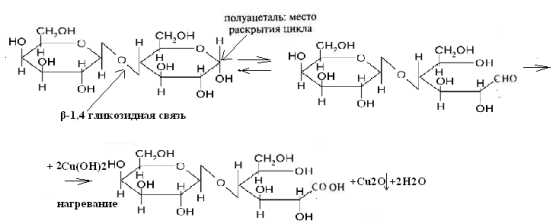
Эффект реакции – выпадение красного осадка закиси меди Сu2O
50. Напишите уравнение реакции образования сахарозы.
Приведите её полное название.
Укажите тип гликозидной связи.
Объясните причину отсутствия у сахарозы восстанавливающей способности.
Ответ
1. Уравнение реакции образования сахарозы.
2.Полное название сахарозы: α-D-глюкопиранозил-β-D-фруктофуранозид
5.Тип гликозидной связи: α-1,2 - гликозидная связь
6.Причина отсутствия у сахарозы восстанавливающей способности – в образовании гликозидной связи участвуют обе гликозидные гидроксильные группы. Таким образом, отсутствует возможность их раскрытия и превращения в альдегидные
7.
51. Напишите формулы фрагментов молекул амилозы и амилопектина.
Назовите моносахаридные и дисахаридные звенья.
Укажите типы гликозидной связи.
Объясните отсутствие восстановительной способности у крахмала.
Перечислите отличия гликогена от амилопектина, способствующие выполнению его биологической роли.
Ответ
1.Формулы фрагментов молекул амилозы и амилопектина
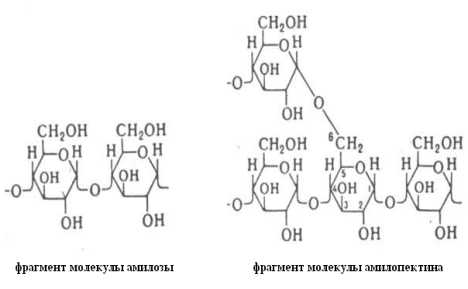
2.Моносахаридные звенья и у амилозы, и у амилопектина – α -D-глюкопираноза. Дисахаридным фрагментом амилозы является мальтоза. При гидролизе амилопектина наряду с мальтозой образуется небольшое количество изомальтозы
.
3.. Типы гликозидной связи: у амилозы – α- 1,4- гликозидная связь, у амилопектина - α- 1,4 и α- 1,6 - гликозидные связи.
4.Отсутствие восстановительной способности у крахмала объясняется тем, что в образовании гликозидной связи участвуют все гликозидные гидроксильные группы. Таким образом, отсутствует возможность их раскрытия и превращения в альдегидные.
5.Отличия гликогена от амилопектина, способствующие выполнению его биологической роли:
А) По строению гликоген подобен амилопектину, но имеет еще большее разветвление цепей. Условно можно сказать, что разветвленность макромолекулы гликогена вдвое больше, чем амилопектина. Сильное разветвление способствует выполнению гликогеном энергетической функции, так как только при множестве концевых остатков можно обеспечить быстрое отщепление нужного количества молекул глюкозы.
Б)Молекулярная масса гликогена больше, чем у амилопектина и достигает 100 млн. Такой размер макромолекул содействует выполнению функции резервного углевода.
52. Напишите формулы дисахаридных фрагментов молекул хондроитинсульфата и гиалуроновой кислоты.
Назовите типы гликозидной связи внутри дисахаридных фрагментов и между ними.
Укажите биологическую роль перечисленных гетерополисахаридов.
Ответ
1. Формулы дисахаридных фрагментов молекул хондроитинсульфата и гиалуроновой кислоты.
2.Типы гликозидной связи внутри дисахаридных фрагментов – β-1,3 гликозидная связь, между фрагментами - β-1,4 гликозидная связь.
3.Биологическая роль :
А) Гиалуроновая кислота является главным компонентом синовиальной жидкости, отвечающим за её вязкость. Гиалуроновая кислота — важный компонент суставного хряща, в котором присутствует в виде оболочки каждой клетки (хондроцита). Гиалуроновая кислота входит в состав кожи, где участвует в регенерации ткани. Гиалуроновая кислота играет важную роль в гидродинамике тканей, участвует в процессе развития опухолей.
Б) Хондроитинсульфат стимулирует синтез гиалуроновой кислоты, укрепляя соединительнотканные структуры: хряща, сухожилий, связок, кожи. Оказывает анальгетическое и противовоспалительное действие, является хондропротектором, способствует активной регенерации хряща. Особенностью хондроитина является его способность сохранять воду в толще хряща в виде водных полостей, создающих хорошую амортизацию и поглощающих удары, что в итоге повышает прочность соединительной ткани. Важным действием хондроитина является его способность угнетать действие специфических ферментов, разрушающих соединительную ткань.
Аминокислоты. Пептиды
53. Напишите проекционные формулы Фишера для всех изомеров треонина.
Объясните, почему эта аминокислота существует в виде четырех пространственных изомеров.
Укажите стереоизомер треонина, входящий в состав белков.
Назовите другие аминокислоты, содержащиеся в белках, имеющие два хиральных центра.
Ответ
1. Проекционные формулы Фишера для всех изомеров треонина
2.Треонин существует в виде четырех пространственных изомеров, так как у него имеется два хиральных центра: атом углерода, связанный с аминогруппой и атом углерода, связанный с гидроксильной группой.
3. В состав белков входит L-треонин.
4. Содержащиеся в белках аминокислоты, имеющие два хиральных центра:
изолейцин, треонин, гидроксипролин, 5-гидроксилизин и цистин
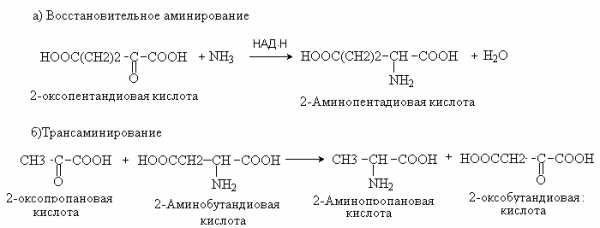
54. Напишите уравнения реакций восстановительного аминирования с участием a-кетоглутаровой кислоты и трансаминирования с участием аспарагиновой и пировиноградной кислот.
Назовите все органические соединения, участвующие в реакции, по ЗН ИЮПАК.
Ответ
Восстановительное аминирование – метод синтеза a -аминокислот из a -оксокислот при участии кофермента НАД Н в качестве восстанавливающего реагента.
Трансаминирование – основной путь биосинтеза аминокислот. При трансаминировании происходит взаимообмен двух функциональных групп – аминной и карбонильной между аминокислотой и кетокилотой. Реакция осуществляется при участии ферментов трансаминаз и кофермента пиридоксальфосфата.
55. Напишите уравнения реакций окислительного дезаминирования глутаминовой кислоты (in vivo) и неокислительного дезаминирования лейцина (in vivo, in vitro).
Назовите все участвующие в реакции вещества по ЗН ИЮПАК.
Укажите биологическое значение реакции дезаминирования.
Ответ
1. Уравнение реакции окислительного дезаминирования глутаминовой кислоты (in vivo) .
Окислительное дезаминирование происходит при участии ферментов оксидаз и кофермента НАД+, который выступает в качестве окислителя. В результате выделяется аммиак и образуется соответствующая кетокислота.
2. Уравнение реакции неокислительного дезаминирования лейцина (in vivo).
Неокислительное дезаминирование происходит путем отщепления аммиака под действием ферментов с образованием , -непредельных кислот.
3. Уравнение реакции неокислительного дезаминирования лейцина (in vitro).
Аминокислоты содержат первичную аминогруппу и подобно первичным аминам взаимодействуют с азотистой кислотой с выделением азота. При этом происходит замещение аминогруппы на гидроксильную. Реакция используется для количественного определения аминокислот по объему выделившегося азота (метод Ван-Слайка).
4. Биологическое значение реакции дезаминирования: с помощью реакций дезаминирования снижается избыток аминокислот в организме.
56. Напишите уравнения реакций солеобразования валина, декарбоксилирования тирозина, гидроксилирования фенилаланина.
Назовите все участвующие в реакции вещества по ЗН ИЮПАК.
Укажите значение этих реакции.
Ответ
1. Уравнения реакций
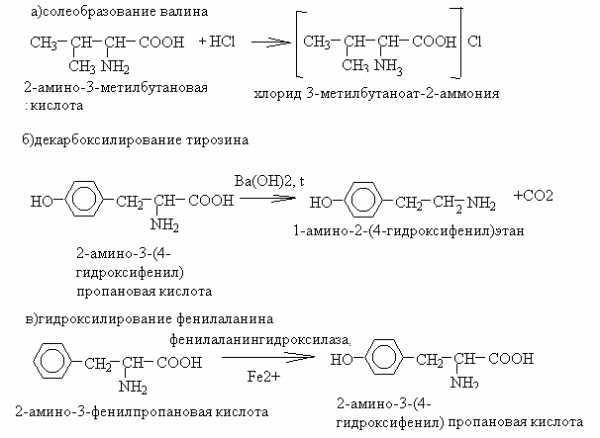
2. Значение реакций: реакции солеобразования используют для защиты аминогруппы при пептидном синтезе, декарбокислирование – один из способов получения биогенных аминов, гидроксилирование фенилаланина – первый этап его метаболизма.
57. Напишите уравнение реакции образования трипептида Три – Сер – Мет.
Выделите пептидные связи.
Назовите незаменимые аминокислоты, входящие в состав трипептида.
Укажите, в какой среде находится ИЭТ трипептида.
Объясните роль серина в формировании пространственной структуры пептидов и белков.
Ответ
1. Уравнение реакции образования трипептида Три – Сер – Мет
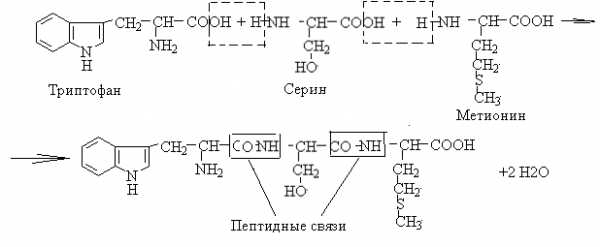
2.В состав трипептида входят незаменимые аминокислоты триптофан и метионин
3.Изоэлектрическая точка пептида находится в среде, близкой к нейтральной, поскольку входящие в него аминокислоты содержат неполярные радикалы (триптофан и метионин) и полярный неионогенный радикал (серин). Предположительно, ИЭТ пептида =5,7-5,8.
4. Роль серина в формировании пространственной структуры пептидов и белков определяется наличием гидроксогруппы, способной образовывать водородные связи. Водородные связи участвуют в формировании вторичной, третичной и четвертичной структур белков.
4. Нуклеиновые кислоты. Нуклеотидные коферменты
58. Напишите строение гуанина, урацила и комплементарных им оснований.
Продемонстрируйте варианты образования водородных связей.
Объясните механизм их возникновения.
Ответ
1. Строение гуанина, урацила и комплементарных им оснований.
Урацил комплементарен аденину , гуанин –цитозину. На схемах указаны варианты образования водородных связей между основаниями.
2. Механизм возникновения водородных связей: атомы водорода, на которых, вследствие разности электроотрицательностей водорода и азота, формируется частичный положительный заряд, притягиваются к атомам кислорода, входящим в состав карбонильных групп и атомам азота, входящим в состав гетероциклов. На атомах О и N сформирована избыточная электронная плотность. Электростатическое притяжение противоположно заряженных частиц приводит к образованию водородной связи.
59. Напишите схемы полного и неполного гидролиза аденозин-5'-фосфата.
Выделите сложноэфирную и гликозидную связи.
Назовите продукты реакций.
Укажите механизм реакций.
Ответ
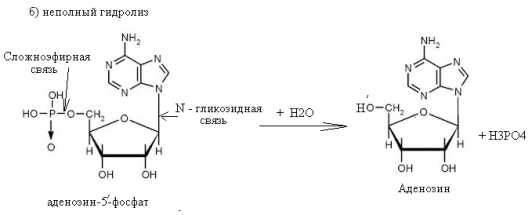
Аденозин-5'-фосфат легко гидролизуется под влиянием слабых кислот при нагревании. При этом образуется аденозин, рибоза и фосфорная кислота. При неполном гидролизе могут образовываться различные продукты, в том числе аденозин и ортофосфорная кислота.
60. Напишите схему взаимодействия АТФ с a-аланином (образование аминоациладенилатного комплекса).
Назовите биологическую роль этого процесса.
Ответ
1. Схема взаимодействия АТФ с a-аланином (образование аминоациладенилатного комплекса).
2. Биологическая роль этого процесса –активирование аминокислоты для реакции биосинтеза.
61. Напишите строение антикодона в т-РНК, соответствующего кодону УГУ в и-РНК.
Ответ
Антикодоны тРНК комплементарны кодонам иРНК. Т.о. антикодон будет представлен последовательностью нуклеотидов, комплементарных урацилу, гуанину, урацилу. Таковыми нуклеотидами, соотвественно, являются: аденин (А), цитозин(Ц) и аденин (А). т.о., строение антикодона -АЦА
62. Напишите схему превращения яблочной (гидроксибутандиовой) кислоты в щавелевоуксусную (оксобутандиовую) кислоту с участием кофермента НАД+.
Укажите биологическое значение реакции.
Покажите строение НАД+.
Ответ
1. Схема превращения яблочной (гидроксибутандиовой) кислоты в щавелевоуксусную (оксобутандиовую) кислоту с участием кофермента НАД+.
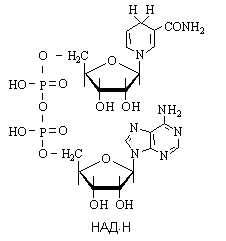
2. Биологическое значение реакции: данная реакция входит в цикл Кребса, в ходе которого осуществляется биологическое окисление субстратов до воды и углекислого газа.
3. Строение НАД+ (окисленная форма никотинамидадени́ндинуклеоти́да)
63. Напишите схему реакции превращения пировиноградной кислоты в молочную с участием кофермента НАДН.
Объясните возможность протекания обратного процесса.
Покажите строение НАДН.
Ответ
1. Схема реакции превращения пировиноградной кислоты в молочную с участием кофермента НАДН.
2. Процесс превращения пировиноградной кислоты в молочную протекает в анаэробных условиях. Возможность протекания обратного процесса обусловлена действием фермента лактатдегидрогеназы.
3. Строение НАДН (восстановленная форма никотинамидадени́ндинуклеоти́да)
Рекомендуемые страницы:
lektsia.com
Олеиновая кислота [LifeBio.wiki]
Систематическое название: (9Z)-октадец-9-еновая кислота
Другие названия: (9Z)-октадеценовая кислота, (Z)-октадец-9-еновая кислота, цис-9-октадеценовая кислота, цис-Δ9-октадеценовая кислота, 18:1 цис-9
Молекулярная формула: C18h44O2
Молярная масса: 282.46 г•моль−1
Внешний вид: Светло-желтая или коричневато-желтая жидкость с характерным запахом сала
Плотность: 0.895 г/мл Точка плавления: 13 °C (55 °F; 286 K)
Точка кипения: 360 °C (680 °F; 633 K)1)
Растворимость в воде: Нерастворим
Растворимость в спирте: Растворим
Олеиновая кислота - это жирная кислота, которая встречается в составе животных и растительных жиров и масел. Масло не имеет запаха и цвета, но коммерческие экземпляры могут иметь желтоватый оттенок. Олеиновая кислота классифицируется как мононенасыщенная омега-9 жирная кислота или 18:1 цис-9. Ее формула - Ch4(Ch3)7CH=CH(Ch3)7COOH. Термин «олеиновая» означает «относящаяся к или полученная из масла оливы», масла, который является основным компонентом олеиновой кислоты.
Где встречается
Жирные кислоты (или их соли) не часто встречаются сами по себе в биологической системе. Вместо этого жирные кислоты, такие как олеиновая кислота, встречаются как эфиры, обычно триглицериды, которые представляют собой жирное составляющее многих натуральных масел. Жирные кислоты могут быть извлечены с помощью процесса сапонификации. Триглицериды олеиновой кислоты - основное составляющее оливкового масла, хотя их содержание может упасть до 2% в форме свободной кислоты в натуральном оливковом масле, при более высокой концентрации оливковое масло становится несъедобным. В масле пекана содержится 59-75% олеиновой кислоты,2) 61% в масле канолы, 36-67% в арахисовом масле, в 60% масле ореха макадамии, 20-85% в подсолнечном масле (последнее значение - наибольшее возможное), 15-20% в масле виноградной косточки,облепиховом масле и кунжутном масле, а также 14% в маковом масле. В большом количестве содержится в животном жире, составляет от 37 до 56% жира в курятине и индейке и от 44 до 47% свиного сала. В большом количестве олеиновая кислота содержится в человеческой адипозной ткани.3)
Феромон насекомых
Олеиновая кислота выделяется из разлагающихся трупов некоторых насекомых, например пчел и муравьев, и заставляет других насекомых выносить тела трупов из улья. Если живая пчела или муравей измазаны олеиновой кислотой, их также могут вынести из улья или муравейника, словно они мертвые. Запах олеиновой кислоты также может ассоциироваться с опасностью для живых насекомых, побуждая их избегать тех, кто подвергся болезни, или избегать места, где прячутся хищники.4)
Производство и химические свойства
Биосинтез олеиновой кислоты включает действие фермента стеароил-CoA9-десатуразы, воздействующего на стеароил CoA. Стеариновая кислоты дегидронизируется для производства мононенасыщенной олеиновой кислоты. Олеиновая кислоты подвергается реакциям карбоновых кислот и алкенов. Она растворима в водной основе, создавая олеаты. К двойной связи добавляется йод. Гидрирование двойной связи выделяет насыщенные производные стеариновой кислоты. Окисление двойной связи происходит медленно, этот процесс известен как прогоркание или сушка. Уменьшение гидроксильной группы кислот свособствует выделению олеилового спирта. Озонолиз олеиновой кислоты - важный процесс для азелаиновой кислоты. Побочным продуктом процесса является нонановая кислота:5) h27C8CH=CHC7h24CO2H + 4»O» → h27C8CO2H + HO2CC7h24CO2H Эфиры азелаиновой кислоты находят применение в смазке и пластификации. Транс изомеры олеиновой кислоты называются элаидовые кислоты (реакция, которая преобразует олеиновую кислоту в элаидовую, называется элаидинизация). Изомер олеиновой кислоты, который встречается в природе, называется петросиленовая кислота. В процессе химического анализа жирные кислоты разделяются с помощью газовой хромотографии эфиров метила; отделение ненасыщенных изомеров возможно благодаря тонкослойной хроматографии.
Использование
Олеиновая кислота (в форме триглицерида) должна быть включена в рацион человека. Олеиновая кислота в форме натриевой соли является главным компонентом мыла (как эмульгатор). Также используется как смягчающее средство. Олеиновая кислоты в небольших количествах используется как эмульгатор или растворяющее средство в аэрозоли.6) С помощью олеиновой кислоты вызывают повреждения легких у некоторых видов животных для последующего тестирования новых препаратов от заболеваний легких. Внутривенное введение олеиновой кислоты вызывает острое повреждение легких у овец с последующим отеком легких. Такие исследования оказались наиболее полезны для недоношенных новорожденных, для которых особо важным является лечение слаборазвитых легких (и сопутствующих повреждений). Олеиновая кислота используется как паяльный флюс при работе с витражами.7)
Влияние на здоровье
Олеиновая кислота - основная мононенасыщенная жирная кислота в рационе человека. Потребление мононенасыщенных кислот снижает Х-ЛПНП, и повышает Х-ЛПВП. Но способность олеиновой кислоты поднимать уровень ЛПВП все еще оспаривается. Олеиновая кислота может замедлить прогрессирование адренолейкодистрофии (АЛД), смертельного заболевания, которое поражает мозг и надпочечные железы.8) Олеиновая кислота может лежать в основе гипотензивных (снижение кровяного давления) свойств оливкового масла.Также отмечались побочные эффекты. Повышенный уровень мононенасыщенных кислот и олеиновой кислоты в мембране красных кровяных телец связан с повышением риска развития рака молочной железы, хотя считается, что употребление олеата изоливкового масла связано с понижением риска развития рака молочной железы.9)
:Tags
Читать еще: Алоин , Норэпинефрин (норадреналин) , Сельдерей (Экстракт семян) , Синдром Тёрнера (Синдром Шерешевского — Тёрнера) , Тренболон ацетат ,
Список использованной литературы:
1) Young, Jay A. (2002). «Chemical Laboratory Information Profile: Oleic Acid». Journal of Chemical Education 79: 24. Bibcode:2002JChEd..79…24Y. doi:10.1021/ed079p24. 2) Villarreal-Lozoya, Jose E.; Lombardini, Leonardo; Cisneros-Zevallos, Luis (2007). «Phytochemical constituents and antioxidant capacity of different pecan Carya illinoinensis (Wangenh.) K. Koch] cultivars». Food Chemistry 102 (4): 1241. doi:10.1016/j.foodchem.2006.07.024. 3) Kokatnur, MG; Oalmann, MC; Johnson, WD; Malcom, GT; Strong, JP (1979). «Fatty acid composition of human adipose tissue from two anatomical sites in a biracial community». The American Journal of Clinical Nutrition 32 (11): 2198–205. PMID 495536. 4) Walker, Matt (2009-09-09). «Ancient 'smell of death' revealed». BBC - Earth News. Retrieved 2009-09-13. 5) Cornils, Boy; Lappe, Peter (2000). «Dicarboxylic Acids, Aliphatic». Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a08_523. ISBN 3-527-30673-0. 6) Smolinske, Susan C. (1992). Handbook of Food, Drug, and Cosmetic Excipients. pp. 247–8. ISBN 978-0-8493-3585-3. 7) Duncan, Alastair (2003). The Technique of Leaded Glass. p. 77. ISBN 0-486-42607-6. 8) Teres, S.; Barcelo-Coblijn, G.; Benet, M.; Alvarez, R.; Bressani, R.; Halver, J. E.; Escriba, P. V. (2008). «Oleic acid content is responsible for the reduction in blood pressure induced by olive oil». Proceedings of the National Academy of Sciences 105 (37): 13811–6. Bibcode:2008PNAS..10513811T. doi:10.1073/pnas.0807500105. JSTOR 25464133. PMC 2544536. PMID 18772370. 9) Martin-Moreno, Jose M.; Gorgojo, Lydia; Banegas, Jose R.; Rodriguez-Artalejo, Fernando; Fernandez-Rodriguez, Juan C.; Maisonneuve, Patrick; Boyle, Peter et al. (1994). «Dietary fat, olive oil intake and breast cancer risk». International Journal of Cancer 58 (6): 774. doi:10.1002/ijc.2910580604.олеиновая_кислота.txt · Последние изменения: 2015/09/25 17:53 (внешнее изменение)
lifebio.wiki
Лабораторное занятие № 7,8. Тема: Липиды. Омыляемые
Documents войти Загрузить ×- Бизнес
- Менеджмент
- Управление проектами
Related documents

Ситуационные задачи по теме «Обмен и функции липидов

Уважаемые ученики,отправляйте,пожалуйста,ответы на

Ситуационные задачи по теме «Обмен и функции липидов
Промежуточный обмен липидов

prod-3103-vvedeniex - Исследования в Гимназии №1505

Контрольная работа № 1 1. 2.

Михеев В.В.

Химия профильный уровень 10 класс

- BioFact

Круглогодичная олимпиада. 9класс Декабрь Задание 1. Навеску

Дюсебаева М.А.

ЗАДАНИЯ для первого (заочного) тура по химии Прикаспийской межрегиональной олимпиады школьников 10 класс

КОНТРОЛЬНАЯ РАБОТА №1 для слушателей заочной Школы Юного Химика (9 класс)
studydoc.ru















