Содержание
Образование сложных эфиров
Образование сложных эфиров
Спирты взаимодействуют с органическими и неорганическимиHO–NO2, (HO)2SO2, (HO)3P=O и т.п. гидроксилсодержащими кислотами, образуя сложные эфиры. Этот процесс называется реакцией этерификации (от древ.греч. αἰθήρ — эфир и лат. facio — делаю).
В реакции с органической кислотой спирт выступает как нуклеофил,Нуклеофил (любящий ядро) — реагент, имеющий неподелённую пару электронов на внешнем электронном уровне и способный предоставить эту пару для образования новой химической связи. отдавая неподелённую электронную пару атома кислорода на связь с электронодефицитным атомом углерода Сδ+ в молекуле кислоты.
Катализатор – сильная кислота (например, конц. H2SO4).
Механизм реакции
Аналогично происходит нуклеофильная атака молекулами спирта электронодефицитных атомов (N, S, P) в молекулах неорганических кислот.
Реакционная способность спиртов при этерификации убывает с увеличением числа и размеров углеводородных радикалов. Первичные спирты активнее вторичных. Третичные и многие вторичные спирты в условиях кислотного катализа вступают в реакции элиминирования (отщепления H2O) с образованием алкенов.
Взаимодействие кислот и спиртов протекает обратимоДля смещения равновесия реакции в сторону образования эфира используют водоотнимающие средства и/или отгоняют образующийся эфир (т.кип. эфира ниже, чем у исходных спирта и кислоты из-за отсутствия ассоциирующих водородных связей). (обратный процесс – гидролиз сложных эфиров).
При использовании вместо кислот их более реакционноспособных производных – галогенангидридовГалогенангидриды — производные кислот, в которых гидроксильные группы заменены атомами галогена. или ангидридовАнгидриды органических кислот RCOOH – продукты (RCO)2O, образующие-ся при отщеплении одной молекулы воды от двух молекул кислоты.
Ангидриды неорганических кислот – кислотные оксиды, которые, присоединив воду, превращаются в кислоту. – реакция образования сложных эфиров практически необратима (пример).
Некоторые сложные эфиры, в особенности сложные эфиры третичных спиртов, получают действием хлорангидридов или ангидридов на алкоголяты.
Название сложного эфира строится по названию углеводородного радикала в молекуле спирта (метил, этил и т.д.) с добавлением названия анионного остатка кислоты (ацетат, нитрат, сульфат, фосфат, карбонат и т.п.).
Часто сложные эфиры называют как спиртовые производные кислот, используя тривиальные названия последних. Например:
CH3O–СOCH3 – метиловый эфир уксусной кислоты (метилацетат),
C2H5O–NO2 – этиловый эфир азотной кислоты (этилнитрат) и т.п.
- Сложные эфиры органических кислот подробнее представлены в разделе «Карбоновые кислоты».

- Среди сложных эфиров неорганических кислот важное значение имеют нитраты, сульфаты, фосфаты и карбонаты.
Нитраты получают действием на спирты азотной кислотой или нитрующей смесьюНитрующая смесь — смесь концентрированных азотной и серной кислот, при взаимодействии которых образуется активная нитрующая частица NO2+ (катион нитрония):
.
Для фенолов реакция идёт в другом направлении — как замещение в бензольном кольце с образованием нитрофенолов.
Эфиры азотной кислоты являются взрывчатыми веществами (BB). На этом основано их использование во взрывотехнике, в производстве компонентов твёрдого ракетного топлива и бездымного пороха. Препараты из группы органических нитратов применяются в медицине как сосудорасширяющие средства при ишемической болезни сердца и стенокардии.
Наибольшее значение в производстве ВВ имеют нитраты многоатомных спиртов – глицерина, целлюлозы, пентаэритрита и т.п.
- Глицерин, в зависимости от условий проведения реакции и соотношения реагентов, может вступать в реакцию с азотной кислотой одной, двумя или тремя ОН-группами и образовывать моно-, ди- и тринитраты.
- Нитраты целлюлозы и пентаэритрита
Целлюлоза (клетчатка) – полимер β-глюкозы
Спиртовые группы ОН выделены красным цветом
(зелёным отмечен полуацетальный гидроксил)., в каждом звене которого содержится 3 ОН-группы, при действии нитрующей смесью (HNO3+H2SO4) образует нитроцеллюлозу:В зависимости от условий проведения реакции и соотношения реагентов могут быть получены мононитрат, динитрат или тринитрат целлюлозы.
Нитроцеллюлоза — крупнотоннажный продукт в производстве бездымного пороха, ранее применялась для получения целлулоида и нитроэмалей.Пентаэритрит (четырёхатомный спирт) при действии 5-ти кратным избытком 93-99% азотной кислоты, свободной от оксидов азота, образует тетранитрат пентаэритрита (пентаэритриттетранитрат, ТЭН).

Пентаэритриттетранитрат (ТЭН) используется в качестве инициирующего (детонирующие шнуры, детонаторы) и бризантного (в кумулятивных снарядах) взрывчатого вещества
Тривиальное название «нитроглицерин» даёт неверное представление о строении этого вещества, так как приставка «нитро» используется в названиях нитросоединений R-NO2 (например, CH3NO2 — нитрометан, C6H5NO2 — нитробензол).
Для устранения опасности самопроизвольного взрыва тринитрат глицерина наносится на твёрдый мелкопористый инертный носитель. Таким способом получают динамит. Создателем и основателем производства этого взрывчатого вещества был знаменитый шведский инженер-химик А. Нобель.
Нобель.
Сульфаты. Серная кислота
, являясь двухосновной, образует со спиртами сложные эфиры двух типов: кислыеКислые эфиры, сохраняющие кислотные функции (группу О-Н), называют также соответствующими кислотами. – алкилсульфаты (алкилсерные кислоты) и средние – диалкилсульфаты.
Алкилсульфаты малостабильны и существуют в виде равновесной смеси:
Равновесие смещается вправо путём отгонки диалкилсульфата.
Сульфаты образуют прежде всего первичные спирты. Для вторичных и третичных спиртов более характерны реакции дегидратации с образованием алкенов.
Для получения сульфатов вместо серной кислоты обычно используют более активные её производные: SO3 (серный ангидрид), SO2Cl2 (хлорангидрид серной кислоты, сульфурилхлорид), HSO3Cl (монохлорангидрид серной кислоты, хлорсульфоновая кислота).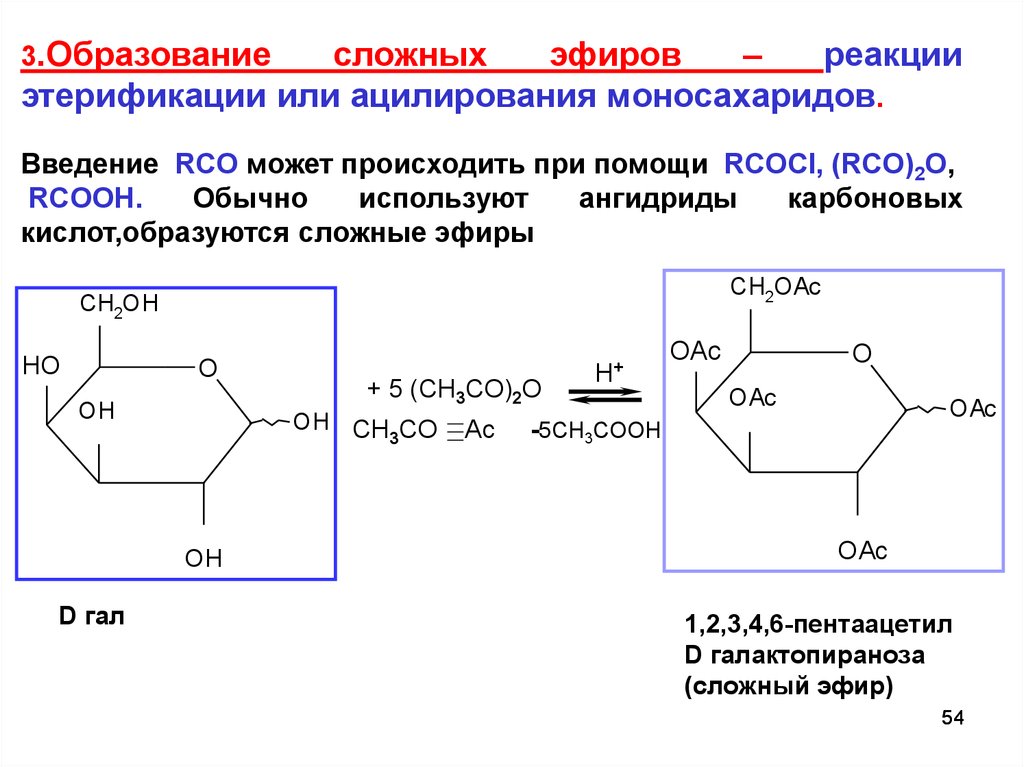
Алкилсульфаты применяются в органическом синтезе как алкилирующие агенты (для введения алкильной группы).
Практическое значение имеют соли высших алкилгидросульфатов (алкилсерных кислот) в качестве поверхностно-активных веществ (ПАВ) различного назначения: моющие средства, эмульгаторы при полимеризации, смачиватели в производстве целлюлозы, мягчители шелка, антистатики полимеров и т.п. Один из наиболее известных представителей ПАВ — лаурилсульфат натрия
(додецилДодецил -С12Н25 — радикал алкана додекан С12Н26 (от греч.числительного додека — 12). В названии радикала заменяется глухая согласная «к» на «ц». сульфат натрия) CH3(CH2)11OSO3Na, который входит в состав большинства моющих средств, шампуней, зубных паст и др. Это соль лаурилсерной кислоты, образованной взаимодействием лаурилового спирта (додеканола-1) и хлорсульфоновой кислоты (монохлорангидрида серной кислоты):
Природные органические сульфаты входят в группу биополимеров соединительных тканей животных.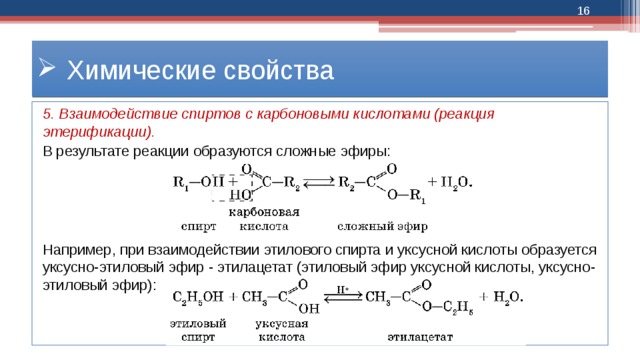 К ним относятся сульфаты полисахаридовПолисахариды — высокомолекулярные углеводы, полимеры моносахаридов (например, полисахарид целлюлоза состо-ит из звеньев моносахарида глюкозы).: хиндроитинсульфаты (например, хондроитин-6-сульфат), гепаритинсульфат (структурный элемент стенок кровеносных сосудов),
К ним относятся сульфаты полисахаридовПолисахариды — высокомолекулярные углеводы, полимеры моносахаридов (например, полисахарид целлюлоза состо-ит из звеньев моносахарида глюкозы).: хиндроитинсульфаты (например, хондроитин-6-сульфат), гепаритинсульфат (структурный элемент стенок кровеносных сосудов),
гепарин (антикоагулянт крови, содержится в печени, лёгких, стенках сосудов).
Фосфаты — сложные эфиры трёхосновной фосфорной кислоты H3PO4 трёх видов: кислые RОРО(OН)2, (RО)2РО(OН) и полные (RО)3РО.
Cинтез фосфатов основан на реакции хлорангидрида фосфорной кислоты POCl3 со спиртами или фенолами:
Атомы Cl в POCl3 можно последовательно замещать на различные группы RO. Образующиеся первоначально хлорфосфаты при гидролизе превращаются в кислые фосфаты.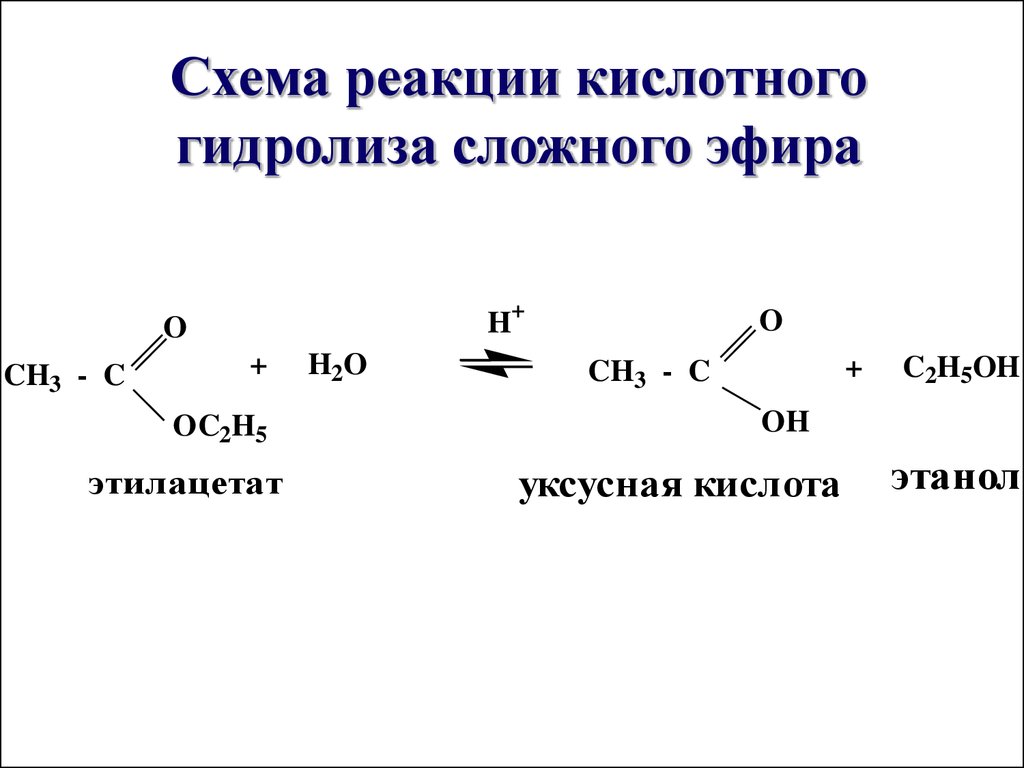
Многоатомные спирты способны вступать в реакцию поликонденсации и образовывать сложные полиэфиры фосфорной кислоты (фосфорорганические полимеры):
Применение. Органические фосфаты широко используются в качестве добавок для модификации пластмасс: пластификаторы, антипирены (для повышения огнестойкости) и др.; применяются как экстрагенты радиоактивных элементов из отработанного ядерного горючего и редко-земельных элементов из минерального сырья, флотореагенты, биологически безвредные ингибиторы коррозии металлов, лекарственные средства, пестициды и др. Некоторые фосфаты токсичны, а такие из них как зарин, табун и зоман относятся к нервно-паралитическим ядам. Фосфорорганические полиэфиры применяются как полимеры, обладающие высокой огнестойкостью, хорошей адгезией к металлам, стеклу и др. материалам.
Роль в природе. Исключительно важное значение имеют фосфаты углеводов (сахаров), являющихся многоатомными спиртами. Фосфаты сахаров содержатся во всех растительных и животных организмах. Они участвуют в биохимических процессах фотосинтеза и обмена веществ. Универсальным источником энергии для реакций, протекающих в живых системах, служит аденозинтрифосфат (АТФ)
Фосфаты сахаров содержатся во всех растительных и животных организмах. Они участвуют в биохимических процессах фотосинтеза и обмена веществ. Универсальным источником энергии для реакций, протекающих в живых системах, служит аденозинтрифосфат (АТФ)
АТФ — аккумулятор и переносчик химической энергии в живых клетках..
Фосфаты рибозы и дезоксирибозы входят в состав нуклеотидов
Нуклеотиды — мономерные звенья и промежуточные продукты
биосинтеза нуклеиновых кислот (ДНК, РНК) и нуклеотидкоферментов., которые при участии ферментов путём поликонденсации образуют полинуклеотиды (нуклеиновые кислоты
ДНК и РНКДНК — дезоксирибонуклеиновая кислота,
РНК — рибонуклеиновая кислота.). При этом взаимодействуют спиртовая ОН-группа одного нуклеотида с фосфатной группой другого. В результате образуется сахарофосфатная цепь макромолекул ДНК и РНК, состоящая из чередующихся остатков фосфорной кислоты и углевода (рибозы в РНК и дезоксирибозы в ДНК).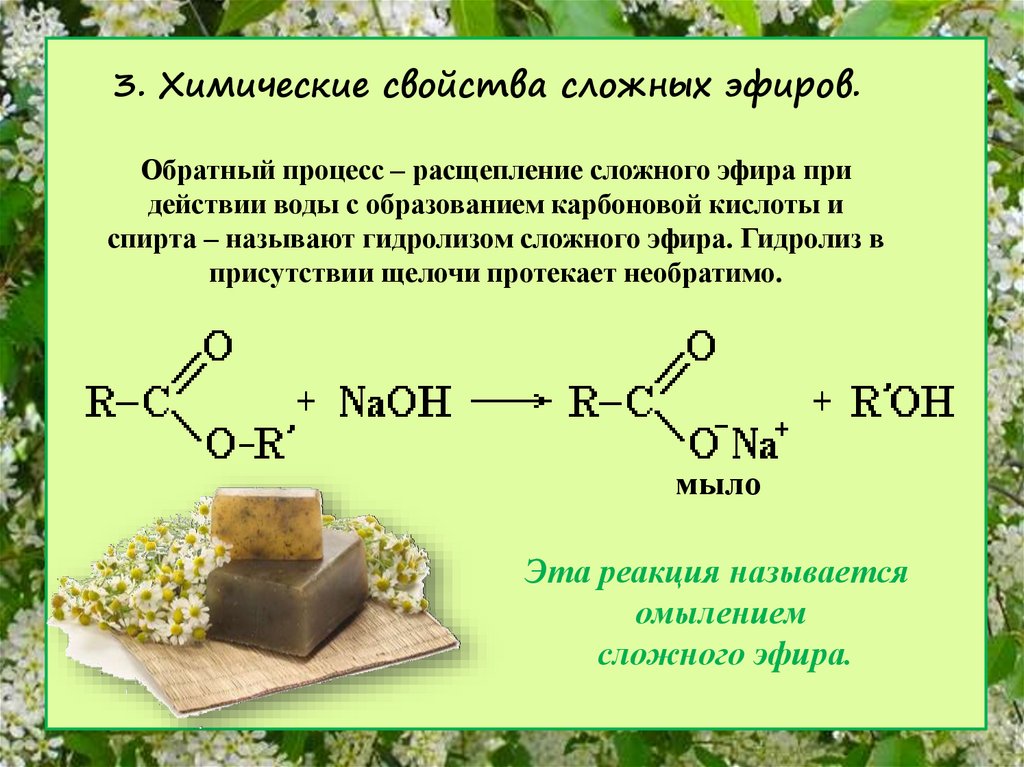 Таким образом, все макромолекулы нуклеиновых кислот имеют единый сахарофосфатный остов,
Таким образом, все макромолекулы нуклеиновых кислот имеют единый сахарофосфатный остов,
а уникальность структур и функций этих биополимеров определяется набором и последовательностью
азотистых оснований
Азотистые основания — N-содержащие гетероциклические соединения: аденин, гуанин, цитозин, входящие в состав ДНК и РНК; тимин содержится только в ДНК, а урацил — только в РНК (подробнее см. Часть IV, «Гетероцикличес-кие соединения»). — боковых заместителей в главной цепи
(схема).
Схематически структуру макромолекул нуклеиновых кислот можно представить формулой:
— Азотистые основания: аденин, гуанин, тимин, цитозин, урацил, связанные с главной цепью как заместители.
О-сахар-О — остаток рибозы в РНК или дезоксирибозы в ДНК.
В живых клетках при рН≈7 фосфатные группы ионизированы.
Карбонаты — сложные эфиры угольной кислоты — образуются при взаимодействии фосгена COCl2 (полного хлорангидрида угольной кислоты) со спиртами или фенолами при повышенных температурах.
Практическое значение имеет производство поликарбонатовПоликарбонаты — сложные полиэфиры угольной кислоты и двухатомных фенолов или спиртов с общей формулой
(-O-R-O-CO-)n.
, получаемых
при поликонденсации бисфенола АСистематическое название бисфенола А:
2,2-бис(4-гидроксифенил)пропан.
Часто употребляется техническое название – дифенилолпропан. (дианаДиан – название бисфенола А, данное в честь русского химика Александра Дианина, впервые получившего это соединение (1891 г.).) и фосгена:
Поликарбонат отличается высокой светопроницаемостью, ударопрочностью и термостойкостью.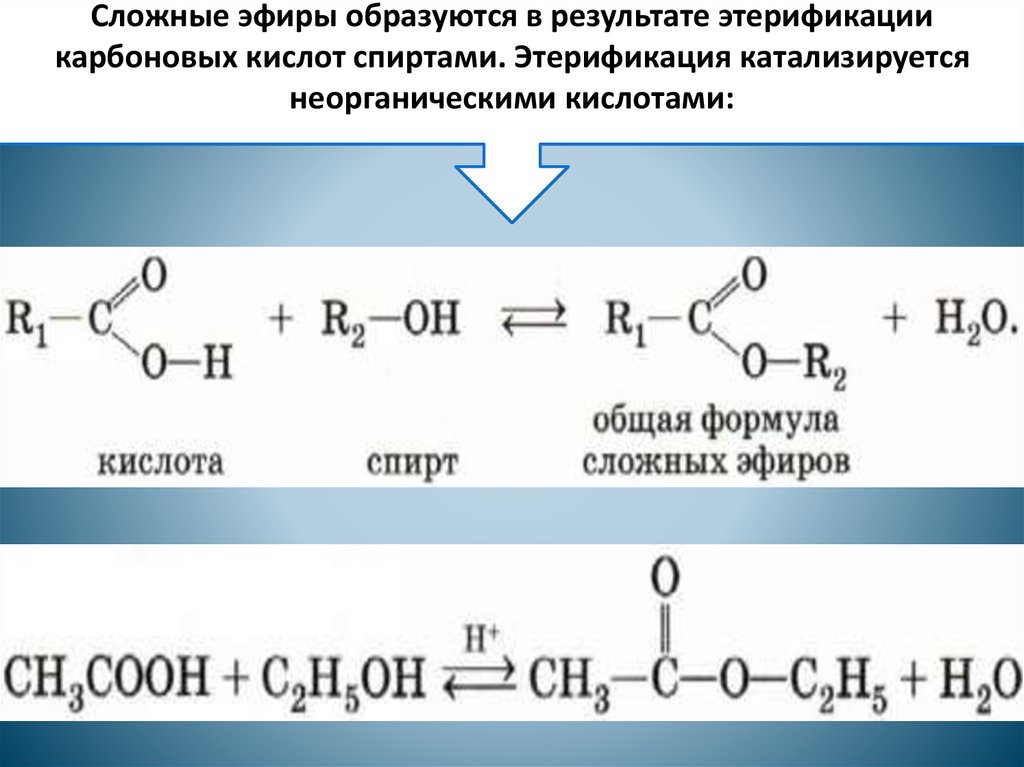 Благодаря сочетанию этих свойств, данный полимерный материал нашел широкое применение в строительстве и других отраслях народного хозяйства
Благодаря сочетанию этих свойств, данный полимерный материал нашел широкое применение в строительстве и других отраслях народного хозяйства
Поликарбонат — инновационный материал, который, благодаря своим исключительным характеристикам, (высокая светопроницаемость, ударопрочность и термостойкость), нашел широкое применение в строительной сфере, в производстве светотехнических и оптических изделий и т.п.
Наиболее популярный в России формат применения — листовой поликарбонат: ячеистый (сотовый поликарбонат) и сплошной (монолитный поликарбонат). Листовой поликарбонат применяется в качестве светопрозрачного материала в строительстве, а также там, где требуется повышенная теплоустойчивость. Это могут быть светопрозрачные вставки в кровлю и фасадные конструкции, теплицы, навесы, шумовые ограждения дорог и так далее.
Разнообразность применения листового поликарбоната связана с уникальным комплексом свойств: прозрачность, легкость, прочность, долговечность (при наличии УФ защитного слоя).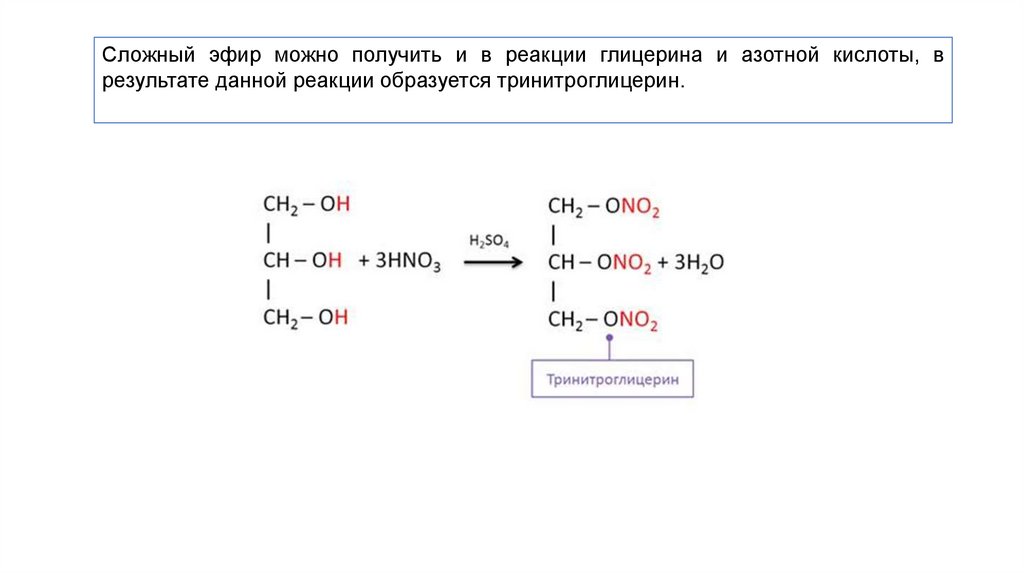
Благодаря высокой прочности и ударной вязкости (250-500 кдж/м2), поликарбонат применяется в качестве конструкционного материала в различных отраслях промышленности, используется при изготовлении защитных шлемов для экстремальных дисциплин вело- и мотоспорта. При этом для улучшения механических свойств применяются и наполненные стекловолокном композиции.
Важным фактором является экономичность и технологичность производства поликарбоната на основе диана, получаемого из доступных исходных веществ — фенола и ацетона — продуктов кумольного метода.
Технологический процесс получения фенола и ацетона из бензола и пропилена через кумол (кумольный метод) разработан Р.Ю. Удрисом, П.Г. Сергеевым, Б.Д. Кружаловым и М.С. Немцовым (1942-1946 гг.). В 1949 году в г. Дзержинске впервые в мире была запущена промышленная установка, реализующая этот процесс.
Синтез простых и сложных эфиров ацетиленовых спиртов
АННОТАЦИЯ
В данной работе изучен синтез различных эфиров ацетиленовых спиртов.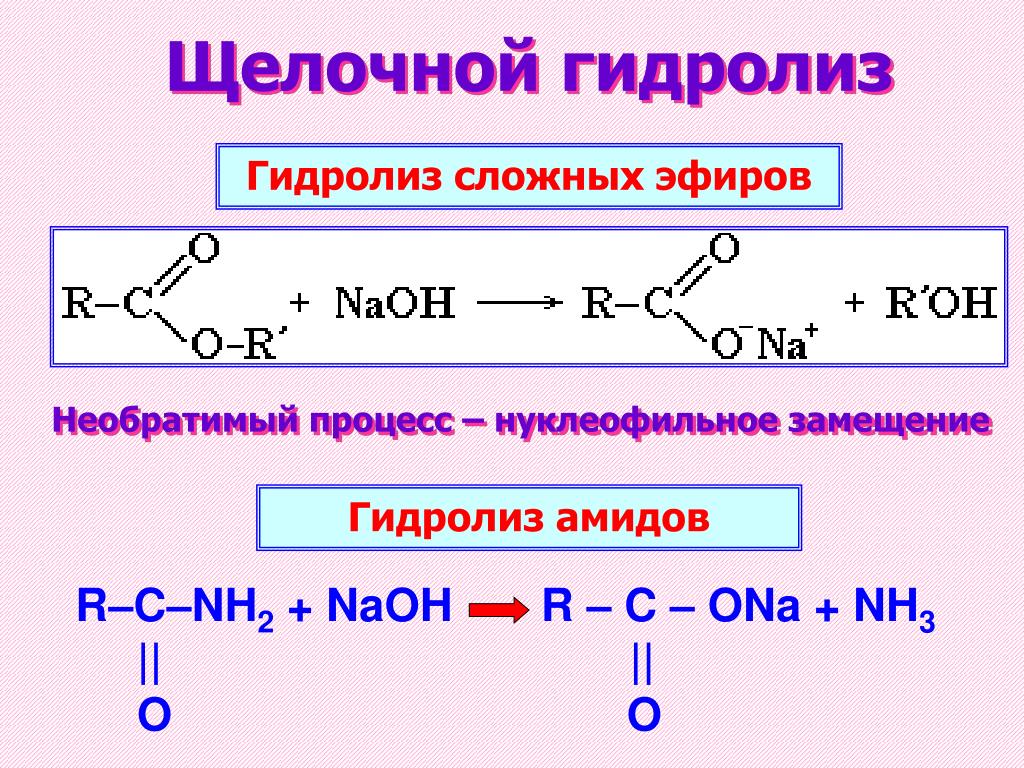 Изучено влияние температуры, молярного соотношения активных веществ и присутствия катализаторов на выход и реакцию образования этих сложных эфиров. Изучено влияние природы ацетиленового спирта и бензоилхлорида на выход сложных эфиров. На основании полученных результатов было обнаружено, что гексен-4-ин-1-ол-3 более активен, чем 3-метилпентин-1-ол-3 в реакции образования эфиров ацетиленовых спиртов. Выходы эфиров ацетиленовых спиртов, полученных реакцией с акрилонитрилом, хлористым бензилом и бензоилом- β-цианэтилового, бензилового и бензоилового эфиров, были несколько выше. Изучены физико-химические константы синтезированных эфиров ацетиленовых спиртов. Структура и состав полученных соединений подтверждены методами ИК-, ПМР-спектроскопии.
Изучено влияние температуры, молярного соотношения активных веществ и присутствия катализаторов на выход и реакцию образования этих сложных эфиров. Изучено влияние природы ацетиленового спирта и бензоилхлорида на выход сложных эфиров. На основании полученных результатов было обнаружено, что гексен-4-ин-1-ол-3 более активен, чем 3-метилпентин-1-ол-3 в реакции образования эфиров ацетиленовых спиртов. Выходы эфиров ацетиленовых спиртов, полученных реакцией с акрилонитрилом, хлористым бензилом и бензоилом- β-цианэтилового, бензилового и бензоилового эфиров, были несколько выше. Изучены физико-химические константы синтезированных эфиров ацетиленовых спиртов. Структура и состав полученных соединений подтверждены методами ИК-, ПМР-спектроскопии.
ABSTRACT
In this work, the synthesis of various esters of acetylenic alcohols has been studied. The effect of temperature, molar ratio of active substances and the presence of catalysts on the yield and reaction of the formation of these esters has been studied.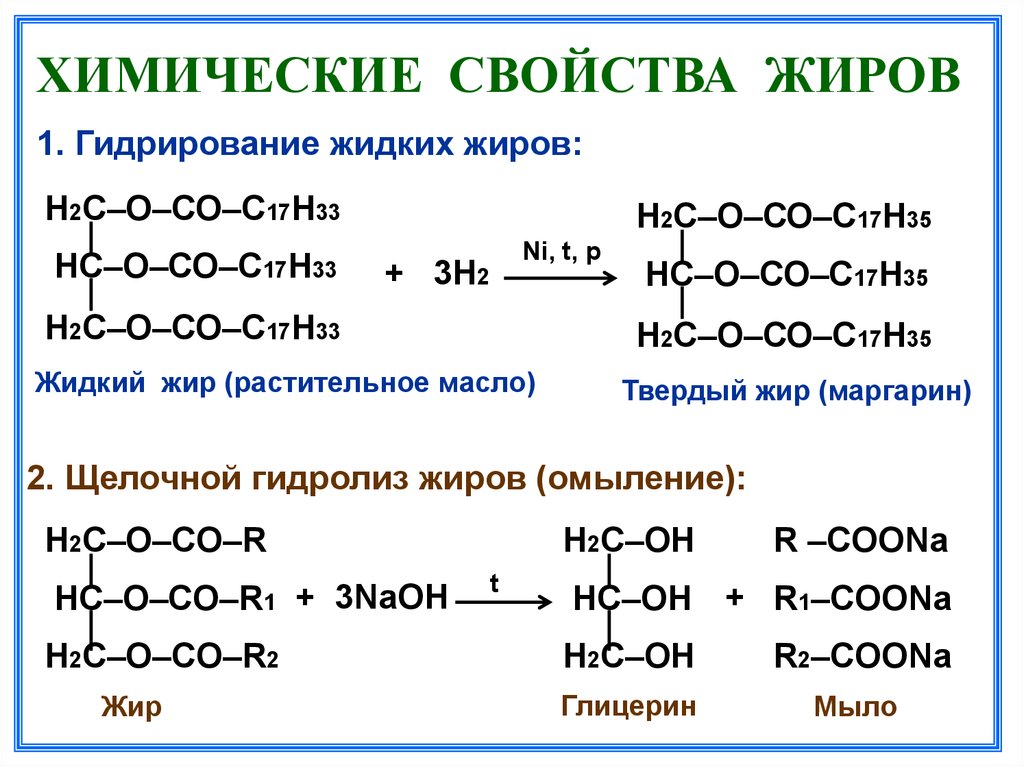 The effect of the nature of acetylene alcohol and benzoyl chloride on the yield of esters has been studied. Based on the results obtained, it was found that hexene-4-yn-1-ol-3 is more active than 3-methylpentin-1-ol-3 in the reaction of formation of esters of acetylenic alcohols. The yields of acetylenic alcohol esters obtained by their reaction with acrylonitrile, benzyl and benzoyl chloride— β-cyanoethyl, benzyl, and benzoyl esters — were slightly higher. The physicochemical constants of the synthesized esters of acetylene alcohols have been studied. The structure and composition of the obtained compounds were confirmed by IR and PMR spectroscopy.
The effect of the nature of acetylene alcohol and benzoyl chloride on the yield of esters has been studied. Based on the results obtained, it was found that hexene-4-yn-1-ol-3 is more active than 3-methylpentin-1-ol-3 in the reaction of formation of esters of acetylenic alcohols. The yields of acetylenic alcohol esters obtained by their reaction with acrylonitrile, benzyl and benzoyl chloride— β-cyanoethyl, benzyl, and benzoyl esters — were slightly higher. The physicochemical constants of the synthesized esters of acetylene alcohols have been studied. The structure and composition of the obtained compounds were confirmed by IR and PMR spectroscopy.
Ключевые слова: ацетилен, кротоновый альдегид, акрилонитрил, хлористый бензил, хлористый бензоил, пиридин, ацетиленовый спирт, цианэтилирование, эфиры ацетиленовых спиртов, β-цианэтиловый эфир.
Keywords: acetylene, croton aldehyde, acrylonitrile, benzyl chloride, benzoyl chloride, pyridine, acetylene alcohol, cyanethilation, ethers of acetylenic alcohols β-cyan ethylene ether.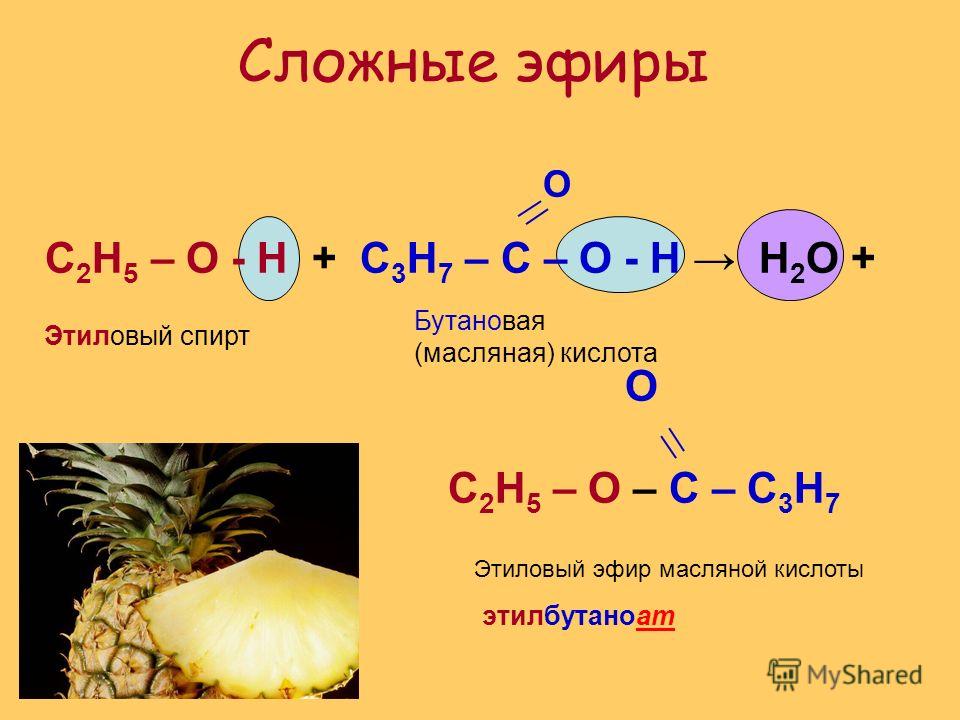
Ацетиленовые спирты (АС) и многие их производные используются как биологически активные вещества в сельском хозяйстве, болеутоляющие и седативные средства в медицине, в органическом синтезе и в химической промышленности, ингибиторы химической и биохимической коррозии, высококачественные растворители в радиотехнике и в других областях [1- 6].
В данной работе изучены реакции ранее синтезированных ацетиленовых спиртов с акрилонитрилом, бензилхлоридом и бензоилхлоридом с получением простых и сложных эфиров. Прежде всего, использованные ацетиленовые спирты — 2-метилбутин-3-ол-2, 3-метилпентин-1-ол-3 и гексен-4-ин-1-ол-3, необходимые для синтеза сложных эфиров, получены на основе методов [7-11]. Реакции этих спиртов с акрилонитрилом, хлористым бензилом и хлористым бензоилом привели к синтезу β-цианэтиловых эфиров, бензиловых и бензоиловых эфиров соответственно. В этом случае синтез 2-метилбутин-3-ол-2 и 3-метилпентин-1-ол-3 осуществлены реакцией диметилкетона и метилэтилкетона с ацетиленом, гексен-4-ин-1-ол-3 получен на основе промышленного отхода- кротоновой фракции, синтез β-цианэтиловых эфиров этих ацетиленовых спиртов осуществлен с помощью акрилонитрила в водном растворе в присутствии катализатора КОН. Реакции цианэтилирования спиртов протекали согласно схеме:
Реакции цианэтилирования спиртов протекали согласно схеме:
Также реакцией синтезированных гексен-4-ин-1-ол-3, 2-метилбутин-3-ол-2 и 3-метилпентин-1-ол-3 с хлористым бензилом в растворе бензола в присутствии пиридина в качестве катализатора были синтезированы их бензиловые эфиры:
Аналогичным образом, действием хлористого бензила на соответствующие ацетиленовые спирты в присутствии катализатора пиридина были синтезированы бензоиловые эфиры с высокими выходами согласно схеме:
Изучено влияние количества реагентов на реакцию образования эфиров ацетиленовых спиртов. Ацетиленовый спирт и хлористый бензоил использовали в мольных соотношениях 5:1-1:5. Температура процесса выбрана равной 700С, а продолжительность реакции составляла 5 часов. Полученные результаты представлены в таблице 1. Как показано в таблице, выход продукта увеличивался по мере изменения концентрации реагентов. Например, выход бензоиловых эфиров 3-метилпентин-1-ола-3 и гексен-4-ин-1-ол-3 составляли 75,3 и 81,0% при соотношении исходных веществ 5:1 и 76,5 и 85,0% при 1:5 соответственно. Изучено влияние молярных соотношений и продолжительности реакции на выход бензоилового эфира 3-метилпентин-1-ола-3. Согласно этому, когда мольное содержание 3-метилпентин-1-ол-3 и хлористого бензоила 1:1 и 1:5, выход продукта увеличивался от 32,0 до 58,5% в течение 3 часов реакции, а при продолжительности реакции 5 часов выход продукта изменился от 45,1 до 81,0%.
Изучено влияние молярных соотношений и продолжительности реакции на выход бензоилового эфира 3-метилпентин-1-ола-3. Согласно этому, когда мольное содержание 3-метилпентин-1-ол-3 и хлористого бензоила 1:1 и 1:5, выход продукта увеличивался от 32,0 до 58,5% в течение 3 часов реакции, а при продолжительности реакции 5 часов выход продукта изменился от 45,1 до 81,0%.
Изучено влияние природы ацетиленового спирта и хлористого бензоила на выход сложных эфиров ацетиленовых спиртов. Результаты показали, что выход бензоилового эфира 3-метилпентин-1-ола-3 выше, чем в случае эфира гексен-4-ин-1-ола-3.
Выходы β-цианэтиловых, бензиловых и бензоиловых эфиров ацетиленовых спиртов, полученных в результате указанных реакций составляли 70-85%. Некоторые их физико-химические константы (I-IX) представлены в таблице 2.
Структура и состав синтезированных эфиров ацетилена подтверждены физическо-химическими методами исследования, а также ИК- и ПМР-спектрами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.
ИК-спектры синтезированных простых и сложных эфиров ацетиленовых спиртов сняты на приборе Nicolet-450, IR Tracer-100. Для записи 1H-ЯМР спектров применены растворители CD3OD, CDСl3 при частотах 400 МГц на приборе Unity+400 (Varian). Внутренним стандартом служил ГМДС. Хромато-масс спектры сняты на спектрометре Agilent 6420 Triple Quad LC/MS.
В ИК-спектре синтезированных эфиров ярко проявляются поглощения С≡С и С-О эфирной связи в соответствующих областях и кроме этого отчетливо проявляются сдвиги в ПМР Н1, характерные для сложных и простых эфиров.
Таблица 1.
Влияние соотношения исходных веществ на выход простых эфиров АС(температура 700С, продолжительность реакции 5 часов)
|
АС:
С6Н5СОСl
|
Выход бензоилового эфира 3-метилпентин-1-ола-3, %
|
Выход бензоилового эфира гексен-4-ин-1-ола-3, %
|
|
5:1
|
75.
|
76.5
|
|
4:1
|
69.5
|
70.0
|
|
3:1
|
64.4
|
63.3
|
|
2:1
|
56.7
|
57.2
|
|
1:1
|
45.1
|
49.4
|
|
1:2
|
54.5
|
58.4
|
|
1:3
|
64.3
|
65.3
|
|
1:4
|
71.
|
73.4
|
|
1:5
|
81.0
|
85.0
|
Синтез 2-метилбут-3-ин-2-илоксипропаннитрила. Водный раствор гидроксида калия добавляют в трехгорлую колбу с необходимым оборудованием и смешивают с 8,4 г (0,1 моль) 2-метилпентин-3-ола-2 и 5,3 г (0,1 моль) акрилонитрила. При этом реакционная смесь сильно нагревается, так что сосуд охлаждается ледяной водой. Через 15-20 минут нагревание прекращается. Для завершения реакции реакционную смесь нагревают на водяной бане при 95–100°С в течение 4 часов при перемешивании.
Таблица 2.
Некоторые физико-химические константы эфиров ацетиленовых спиртов
|
№
|
Структурная формула эфиров
|
Название и брутто-формула
|
Выход, %
|
Т.
|
|
|
|
I
|
|
2-метилбут-3-ин-2-илокси-пропаннитрил C8Н11NО
|
71
|
144-145/10
|
1.4420
|
1.1215
|
|
II
|
|
3-метилпент-1-ин-3-илокси-пропаннитрил C9Н13NО
|
73.4
|
156-157/10
|
1.4275
|
1.1290
|
|
III
|
|
Гекс-4-ен-1-ин-3-илокси-пропаннитрил С9Н11NО
|
70
|
141/10
|
1.
|
1.0875
|
|
IV
|
|
2-метилбут-3-ин-2-илокси-бензил С12Н14О
|
68
|
151-153/10
|
1.3725
|
1.2750
|
|
V
|
|
3-метилпент-1-ин-3-илокси-бензил С13Н16О
|
69.5
|
165-166/10
|
1.3590
|
1.1855
|
|
VI
|
|
Гекс-4-ен-1-ин-3-илокси-бензил
С13Н14О
|
76
|
144/10
|
1.
|
1.0950
|
|
VII
|
|
2-метилбут-3-ин-2-илокси-бензоил
С12Н12О2
|
81
|
145-147/10
|
1,3650
|
1,1745
|
|
VIII
|
|
3-метилпент-1-ин-3-илокси-бензоил
С13Н14О2
|
83,2
|
148-150/10
|
1,4025
|
1,1795
|
|
IX
|
|
Гекс-4-ен-1-ин-3-илокси-бензоил С13Н12О2
|
85
|
147/10
|
1,5285
|
1,0985
|
Затем реакционную смесь оставляют при комнатной температуре на один день.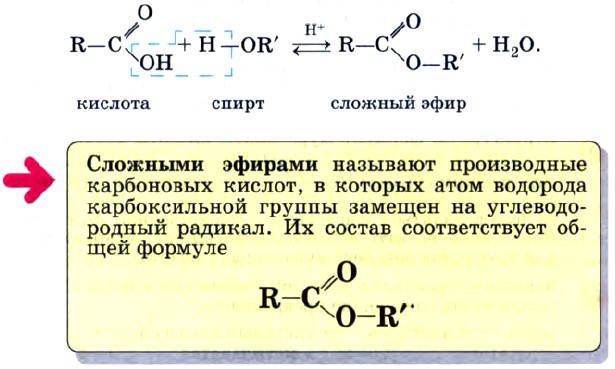 На следующий день органическую часть отделяют, а водную часть трижды экстрагируют бензолом. Органическую часть и экстракт смешивают и сушат хлоридом кальция (СаCl2).
На следующий день органическую часть отделяют, а водную часть трижды экстрагируют бензолом. Органическую часть и экстракт смешивают и сушат хлоридом кальция (СаCl2).
На следующий день растворитель и непрореагировавший акрилонитрил удаляют, а остаток выделяют фракционированием в вакууме. Полученный β-цианэтиловый эфир перегоняют при давлении 10 мм ртутного столбца. и температуре 144-1450С. Выход продукта 71,0% (97,98 грамм).
Результаты показывают, что показатель преломления и плотность полученного β-цианэтилового эфира ацетиленового спирта составили = 1,4420 и =1,1215 г / см3 соответственно.
Используя выше описанный метод, реакцией 9,8 грамма (1 моль) 3-метилпентин-1-ола-3 с 5,3 грамма (0,1 моль) акрилонитрила получают 11,16 грамма (73,4%) 3-метилпент-1-ин-3-илоксипропаннитрила. Некоторые константы полученного ацетиленового эфира: t кип. = 156-1570С при давлении 10 мм ртутного столбца,=1,4275 и =1,1290 г/см3. Из 9,6 г (1 моль) гексен-4-ин-1-ола-3 и 5,3 г (0,1 моль) акрилонитрила был синтезирован гекс-4-ен-1-ин-3-илоксипропаннитрил в количестве 10,43 г (70%), который был выделен при температуре 1410С при 10 мм ртутного столбца показатель преломления =1,5230 и плотность =1,0875 г/см3.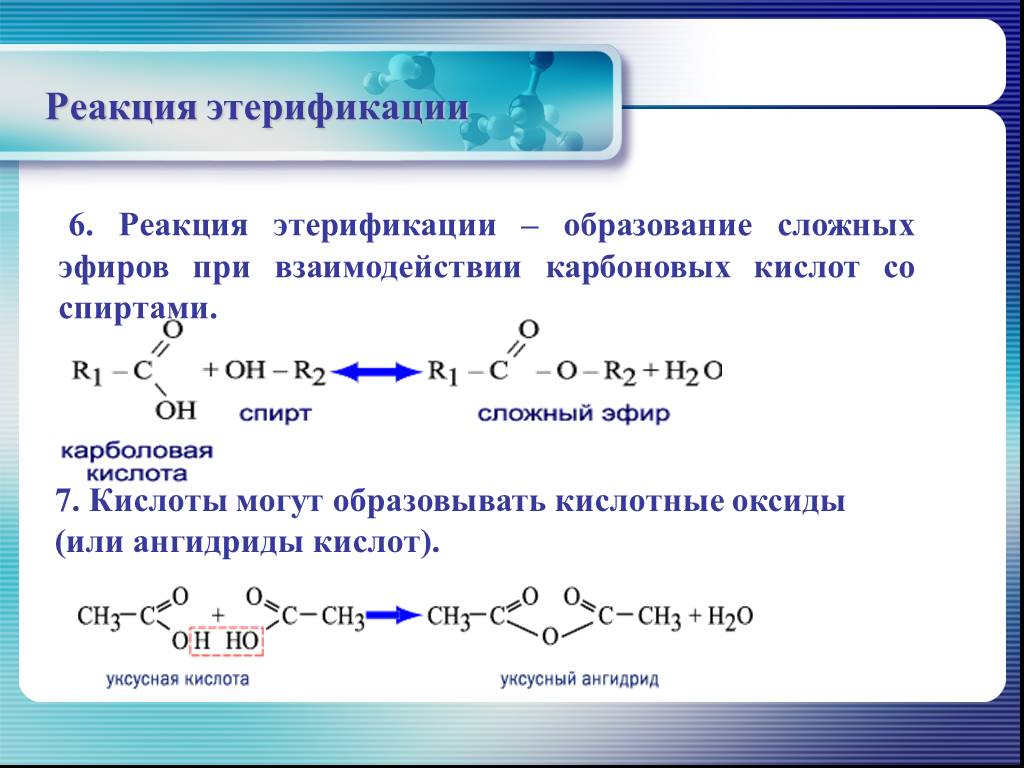
Синтез 2-метилбут-3-ин-2-илоксибензила. В трехгорлую колбу, оснащенную необходимым оборудованием и объемом 200 мл, вводят 10% водный раствор гидроксида калия, 50 мл бензола, 8,4 г (0,1 моль) 2-метилбутин-3-ола-2. Содержимое перемешивают и нагревают на водяной бане в течение 1 часа и к нему по каплям добавляют 12,15 г (0,1 моль) раствора хлористого бензила в 100 мл бензоле. Затем реакционную смесь оставляют при комнатной температуре на один день и на следующий день реакционную смесь нейтрализуют 10%-ным раствором серной кислоты, органическую часть отделяют с помощью делительной воронки, а водную часть экстрагируют трижды диэтиловым эфиром. Органическую часть и экстракт смешивают и сушат над карбонатом калия (K2СO3). На следующий день растворители эфир и бензол отгоняют, а остаток выделяют перегонкой в вакууме. Полученный эфир ацетиленового спирта выделяли при температуре 151-1530С и давлении 10 мм рт.ст. с выходом 68,0% (11,9 г).
Полученный ацетиленовый эфир имеет показатель преломления =1,3725 и плотность =1,2750 г/см3.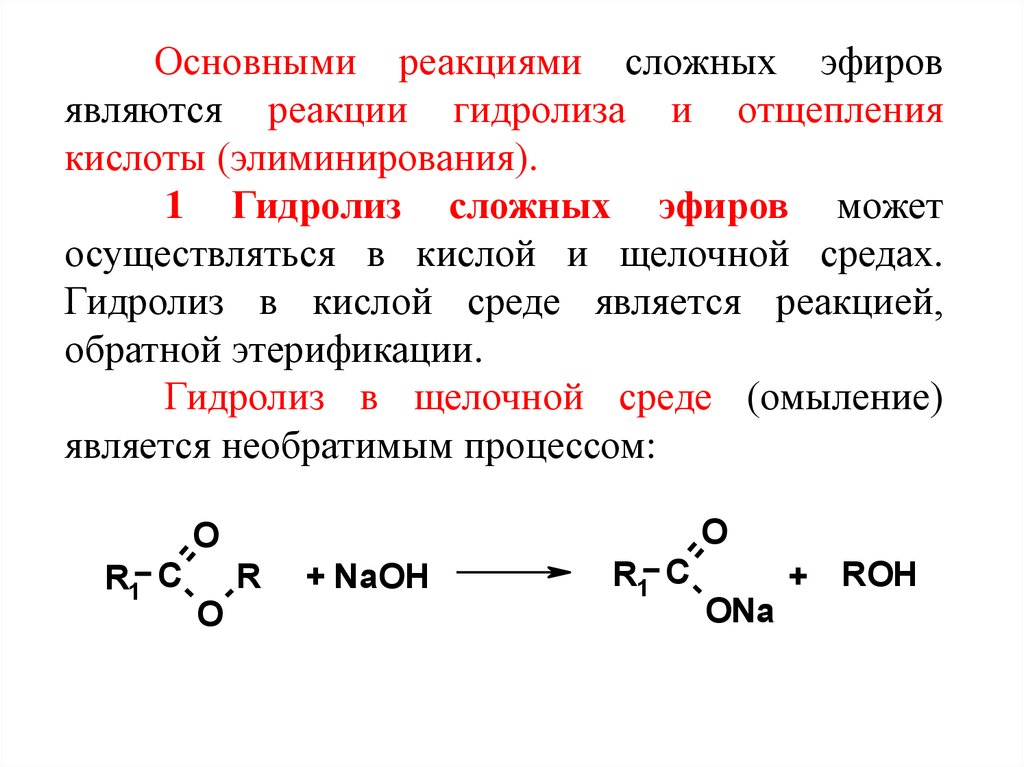
С помощью этого метода из 9,8 г (1 моль) 3-метилпентин-1-ола-3 и 12,65 г (0,1 моль) хлористого бензила получают 13,14 г (69,5%) 2-метилпент-3-ин-2-илоксибензила. Полученный бензиловый эфир ацетиленового спирта кипит при 165-1660С при давлении 10 мм рт. ст., = 1,3590, =1,1855 г/см3. Аналогично вышеописанному из 9,6 г (1 моль) гексен-4-ин-1-ола-3 и 12,15 г (0,1 моль) хлористого бензила синтезирован 14,14 г (76%) гексен-4-ен-1-ин-3-илоксибензил, который выделяют при 1440С и давлении 10 10 мм ртутного столбца, = 1,5245 и = 1,0950 г/см3.
Синтез 2-метилбут-3-ин-2-илоксибензоила. В трехгорлую колбу, оснащенную необходимым оборудованием и объемом 200 мл, вводят 8,4 г (0,1 моль) 2-метилбутин-3-ола-2 в 100 мл бензола, добавляют (0,1 моль) 13,0 г хлористого бензоила и 9,5 г (0,12 моль) пиридина. Содержимое нагревают на водяной бане до температуры 500С в течение 2 часа и реакционную смесь оставляют при комнатной температуре на два дня.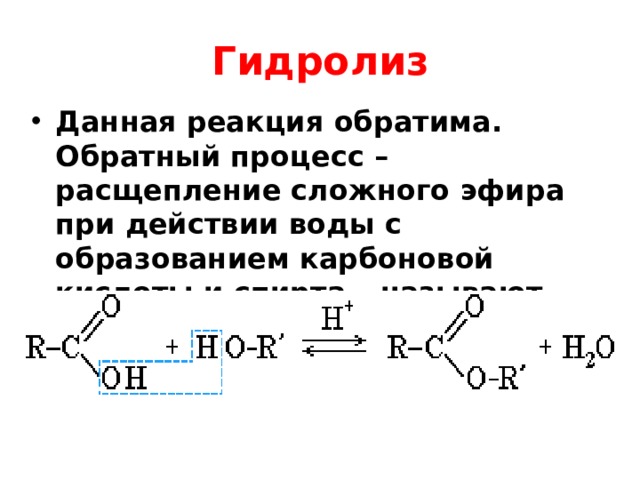 Затем реакционную смесь нейтрализуют 10%-ным раствором серной кислоты, органическую часть отделяют с помощью делительной воронки, а водную часть экстрагируют трижды диэтиловым эфиром. Органическую часть и экстракт смешивают и сушат над карбонатом калия (K2СO3). На следующий день растворитель, эфир и бензол удаляют, а оставшуюся густую массу перегоняют при температуре 145-1470С при 10 мм ртутного столбца выделяют бензоиловый эфир с выходом 81,0% (15,23 г).
Затем реакционную смесь нейтрализуют 10%-ным раствором серной кислоты, органическую часть отделяют с помощью делительной воронки, а водную часть экстрагируют трижды диэтиловым эфиром. Органическую часть и экстракт смешивают и сушат над карбонатом калия (K2СO3). На следующий день растворитель, эфир и бензол удаляют, а оставшуюся густую массу перегоняют при температуре 145-1470С при 10 мм ртутного столбца выделяют бензоиловый эфир с выходом 81,0% (15,23 г).
Полученный сложный эфир ацетиленового спирта имеет показатель преломления =1,3650 и плотность =1,1745 г/см3.
Этим методом реакцией 9,8 г (1 моль) 3-метилпентин-1-ола-3 и 14,8 г (0,1 моль) хлористого бензоила синтезировано 16,89 г (83,2%) 3-метилпент-1-ин-3-илоксибензоил с температурой кипения 148-1500С при давлении 10 мм ртутного столбца, =1,4025 и =1,1795 г/см3. Аналогично синтезирован гексен-4-ен-1-ин-3-илоксибензоил из 9,6 г (0,1 моль) гексен-4-ин-1-ола-3 и 14,0 г (0,1 моль) хлористого бензоила с выходом 17,0 г (85%), который выделяют при 1470С при 10 мм ртутного столбца с показателем преломления =1,5285 и плотностью =1,0985 г/см3.
Список литературы:
- Дикусар Е.А., Козлов Н.Г., Мойсейчук К.Л., Поткин В.И. Третичные ацетиленовые спирты на основе 1-октадецина // ЖОрХ, 2002, №38. – С. 1144-1149.
- Поткин В.И., Дикусар Е.А., Козлов Н.Г. Третичные ацетиленовые спирты и диолы на основе фенилацетилена и 2-метил-3-бутин-2-ола// ЖОрХ, 2002, №9. – С. 1320-1322.
- Ammal S. Ch., Yoshikai N., Inada Y., Nishibayashi Y., Nakamura E. Synergistic Dimetallic Effects in Propargylic Substitution Reaction Catalyzed by Thiolate-Bridged Diruthenium Complex // J. Am. Chem. Soc. — 2005. — V. 127, № 26. — P. 9428-9438.
- Tyrrell E. Asymmetric Alkynylation. Reactions of Aldehydes Using a Zn(OTf)2-Chiral Ligand-Base System // Curr. Org. Chem. — 2009. — V. 13, № 15.-P. 1540-1552.
- Тургунов Э. Синтез сложных эфиров арилацетиленовых спиртов. //Узб. хим. ж. -2009. -№ 5. -С.31-33.
- Содиков М.К., Туpгyнов Э., Шарипов Ш.Р., Кучкарова С.А., Аминодиены-полифункциональные мономеры.
 Материалы респ. конф. с международным участием «Зеленая химия в интересах устойчивого развития». Самарканд. – 2012. – С.287.
Материалы респ. конф. с международным участием «Зеленая химия в интересах устойчивого развития». Самарканд. – 2012. – С.287. - Тургунов Э., Содиков М.К., Файзуллаева М.Ф., Сирлибаев Т.С., Рахматова С.Р. Новый способ синтеза ениновых соединений. //Хим.прир.соед. (специальный выпуск)-1997.-С.65-67.
- С.Э.Нурманов, М.М.Кучкарова, М.К.Содиков, В.Г.Калядин, Т.С.Сирлибаев. Реакция винилирования диметилэтинилкарбинола.// Журн.УзХим. 2004.№4. С.18-23.
- Тургунов Э., Сирлибаев Т.С., Зиядуллаев О.Э., Садиков М.К., Нурмонов С.Э. Синтез ацетиленовых спиртов методом разложения диазосоединений. //ЎзМУ хабарлари, -2009. -№3. -С.85-87.
- Тургунов Э., Садиков М.К., Парманов А.Б., Шодиева Г. Синтез винилацетиленового спирта на основе кротонового альдегида. Материалы респуб. конф. с международным участием «Зеленая химия в интересах устойчивого развития». Самарканд. – 2012. – С.284.
- Patent RUz. Нурманов С.Э., Мавлоний М.Э., Зиядуллаев О.Э.
 , Тургунов Э. Способ получения ацетиленовых спиртов. Пат. РУз IAP 20110321. Ташкент. – Официальный бюллетень. -2013. -№ 1(141). С.20.
, Тургунов Э. Способ получения ацетиленовых спиртов. Пат. РУз IAP 20110321. Ташкент. – Официальный бюллетень. -2013. -№ 1(141). С.20.
Реакции сложных эфиров: объяснение, примеры и образование
Давайте рассмотрим реакции сложных эфиров . Мы начнем с изучения этерификации и гидролиза и того, как мы можем изменить условия реакции в пользу того или другого. Затем мы рассмотрим некоторые области применения сложных эфиров, в том числе в качестве биодизеля, масел и мыл.
Сложные эфиры реагируют по-разному.
- Образуются в реакциях этерификации между спиртом и карбоновой кислотой.
- Они также могут образовываться в реакциях ацилирования между спиртами и либо ацилхлоридами, либо ангидридами кислот.
- Они разлагаются в реакциях гидролиза с использованием либо основания, либо кислоты в качестве катализатора. Базовый гидролиз также известен как омыление .

Что такое сложные эфиры?
Этилацетат, систематически известный как этилэтаноат, является одним из наиболее распространенных сложных эфиров. Если понюхать, то пахнет характерно фруктово, как грушевые леденцы. Мы используем его по-разному: в качестве растворителя и разбавителя, для удаления кофеина из кофейных и чайных листьев, в качестве ароматизатора и в туалетных принадлежностях. Он обычно встречается в парфюмерии, так как он довольно летуч и легко испаряется с кожи, оставляя после себя приятный запах.
Сложные эфиры представляют собой органические молекулы с функциональной группой -COO-.
Сложные эфиры получают из карбоновых кислот и имеют общую формулу RCOOR’ , как показано ниже:
Рис. 1 – Общая структура сложного эфира. Группы R могут быть алкильными или арильными группами
Сложные эфиры могут быть получены различными способами, но чаще всего из карбоновых кислот и спиртов. Мы называем их, используя названия, основанные на этих спиртах и карбоновых кислотах.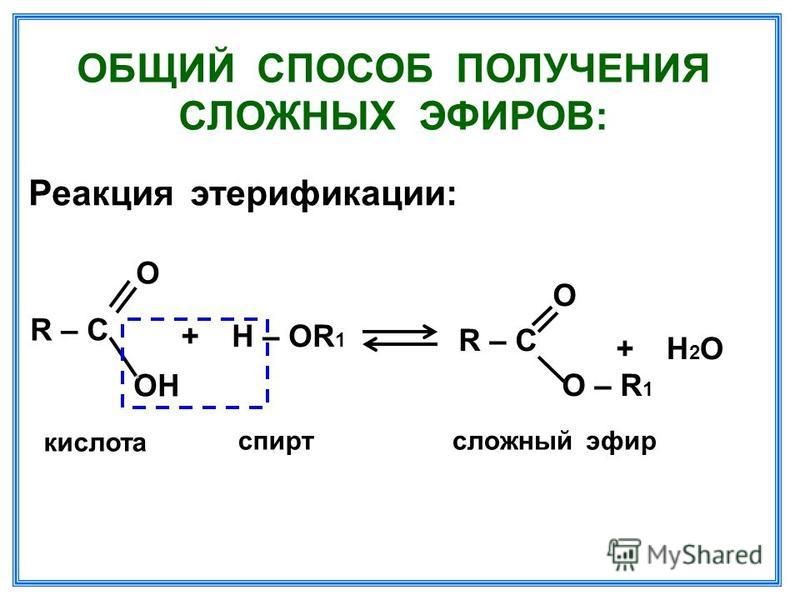 Сначала идет название, полученное от спирта, а затем название, полученное от карбоновых кислот. Все сложные эфиры заканчиваются на суффиксе -оат . Например, мы называем сложный эфир, полученный из пропанола и метановой кислоты , пропилметаноатом .
Сначала идет название, полученное от спирта, а затем название, полученное от карбоновых кислот. Все сложные эфиры заканчиваются на суффиксе -оат . Например, мы называем сложный эфир, полученный из пропанола и метановой кислоты , пропилметаноатом .
Рис. 2 — Пропилметаноат. Пропил получен из пропанола, показан зеленым, а метаноат получен из метановой кислоты, показан фиолетовым
Давайте рассмотрим, как мы производим сложные эфиры.
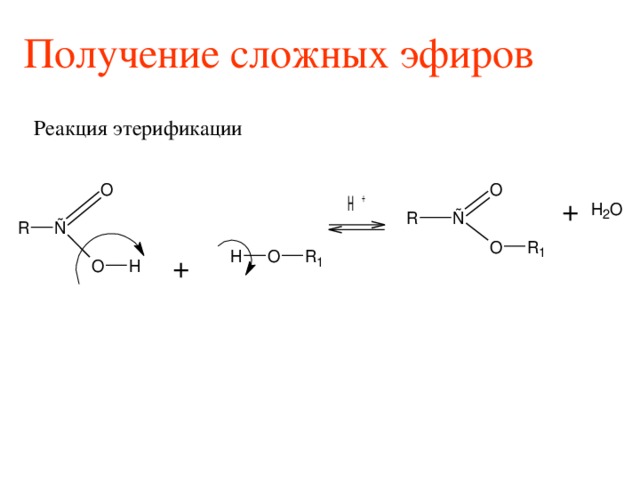
Этерификация
Этерификация — это тип реакции, при которой образуется сложный эфир. В этом случае мы реагируем на карбоновую кислоту со спиртом, чтобы получить сложный эфир и воду. это обратимая реакция, означает, что и прямая реакция, и обратная реакция происходят одновременно в состоянии динамического равновесия .
Рис. 3 – Этерификация. Вы снова увидите эту диаграмму позже в статье
Чтобы узнать больше об обратимых реакциях, взгляните на Equilibria
Получение сложных эфиров в лаборатории
Получение сложных эфиров — обычный практический эксперимент, который вы можете провести в классе.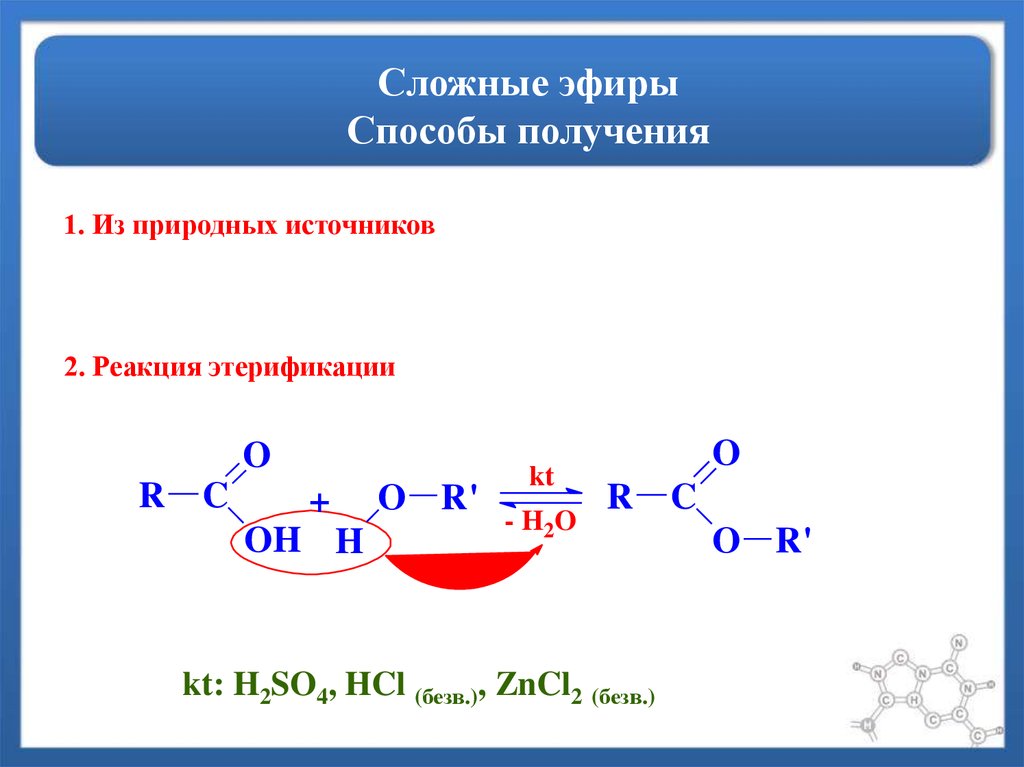
Чтобы получить сложные эфиры в масштабе пробирки, используйте водяную баню, чтобы осторожно нагреть 10 капель карбоновой кислоты с 10 каплями спирта и 2 каплями сильного кислотного катализатора, такого как серная кислота. Вы бы не стали делать это прямо над открытым огнем, потому что используемые органические жидкости легко воспламеняются.
Поскольку эта реакция обратима, вы получите только небольшое количество эфира. Чтобы почувствовать его запах, налейте раствор в стакан с водой. Сложные эфиры с более длинной цепью растворимы, поэтому они образуют слой на поверхности воды, в то время как непрореагировавшая кислота и спирт легко растворяются. Если вы повеете воздухом над верхушкой стакана, вы сможете почувствовать запах эфира. В то время как эфиры с короткой цепью, такие как метилэтаноат, широко известный как метилацетат, пахнут растворителями или клеем, сложные эфиры с более длинной цепью имеют фруктовый и ароматический запах.
Рис. 4. Диаграмма, показывающая производство сложного эфира в пробирке
Давайте напишем уравнение.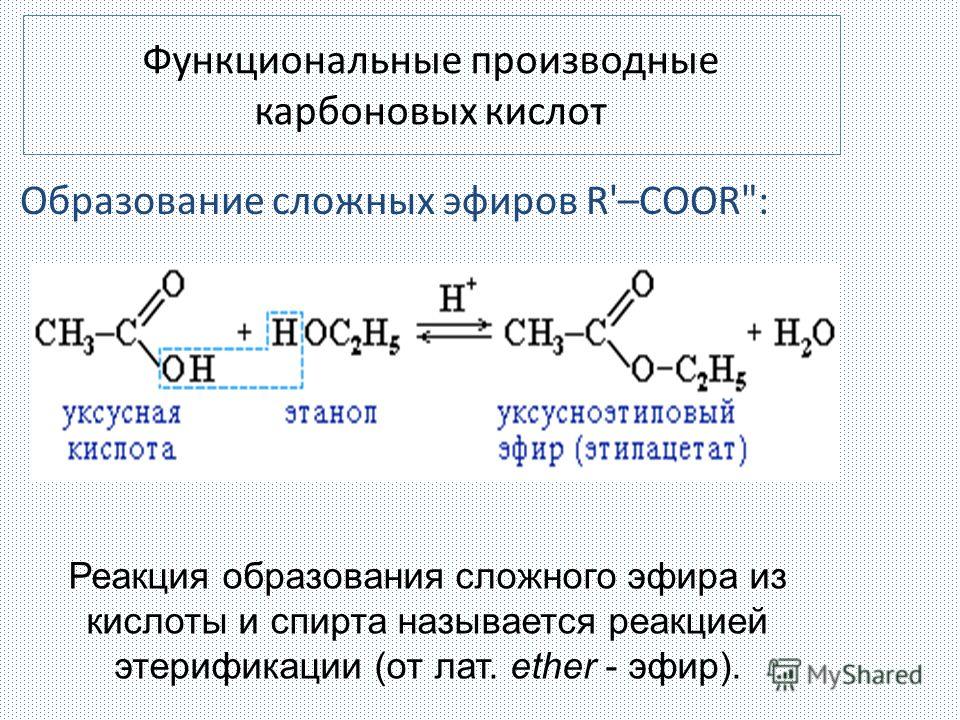 Например, при взаимодействии этановой кислоты с бутанолом образуется бутилэтаноат, который пахнет малиной.
Например, при взаимодействии этановой кислоты с бутанолом образуется бутилэтаноат, который пахнет малиной.
этановая кислота бутанол бутилэтанолат вода
Рис. 5 — Бутилэтаноат. В этом сложном эфире R происходит от этановой кислоты, показанной красным цветом, в то время как R’ происходит от бутанола, показанного зеленым цветом
Крупномасштабное производство эфира немного отличается от производства эфира в пробирке и зависит от типа эфира, который вы хотите создать. Чтобы получить эфиры с короткой цепью, такие как этилэтаноат, Ch4COOCh3Ch4, нагревают этанол и этановую кислоту с сильным концентрированным кислотным катализатором и отгоняют продукт, т. е. сложный эфир. Сложный эфир имеет самую низкую температуру кипения из всех участвующих веществ, потому что он не может образовывать водородные связи сам с собой, в отличие от спиртов и карбоновых кислот. Отгонка продукта также сдвигает наше равновесие вправо, увеличивая выход реакции.
Однако, если мы хотим получить эфиры с более длинной цепью, мы должны использовать кипячение.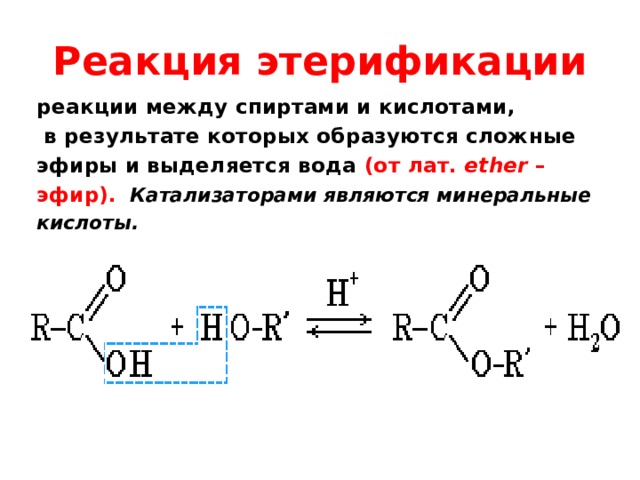 Рефлюкс включает нагревание реакционной смеси в герметичном контейнере. Это означает, что любые летучие компоненты, которые испаряются, конденсируются и падают обратно в реакционную смесь, предотвращая их испарение до того, как они смогут вступить в реакцию. Затем продукты можно разделить фракционной перегонкой.
Рефлюкс включает нагревание реакционной смеси в герметичном контейнере. Это означает, что любые летучие компоненты, которые испаряются, конденсируются и падают обратно в реакционную смесь, предотвращая их испарение до того, как они смогут вступить в реакцию. Затем продукты можно разделить фракционной перегонкой.
Рис. 6 – Устройство для этерификации с обратным холодильником
Другие методы получения сложных эфиров
Мы также можем получать сложные эфиры другими способами, такими как:
- Реакция спиртов с ацилхлоридами.
- Реакция спиртов с ангидридами кислот.
Мы рассмотрим оба этих типа реакции более подробно в разделе Ацилирование .
Гидролиз сложных эфиров
Сложные эфиры можно расщепить двумя аналогичными способами, используя в качестве катализатора либо кислоту, либо основание. Эти реакции известны как реакции гидролиза .
Кислотный гидролиз
Выше мы упоминали, что этерификация представляет собой обратимая реакция .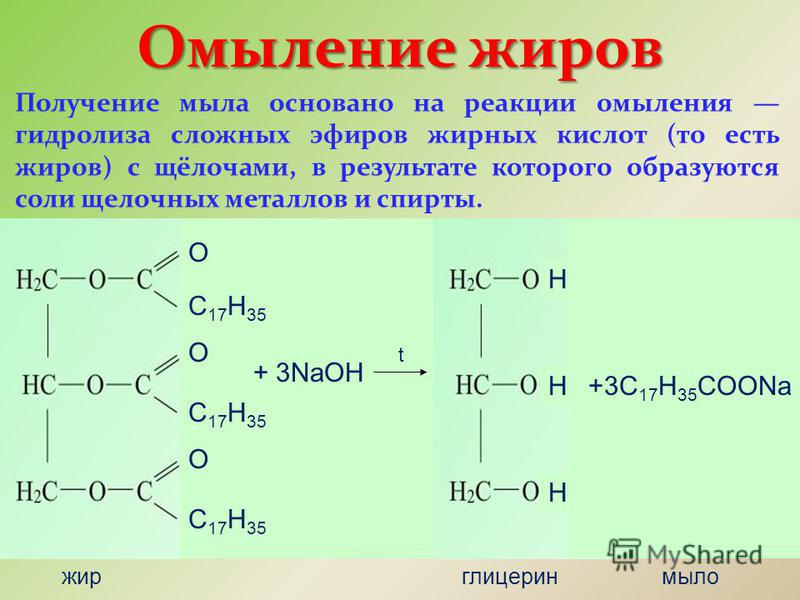 Если вы смешаете карбоновую кислоту и спирт с кислотным катализатором, в конце концов раствор достигнет состояния динамического равновесия . Это просто означает, что молекулы постоянно меняют форму, некоторые объединяются в сложный эфир и выделяют воду, а некоторые возвращаются обратно в спирт и карбоновую кислоту. В равновесии скорость прямой реакции этерификации такая же, как и обратной реакции: мы называем эту обратную реакцию гидролизом.
Если вы смешаете карбоновую кислоту и спирт с кислотным катализатором, в конце концов раствор достигнет состояния динамического равновесия . Это просто означает, что молекулы постоянно меняют форму, некоторые объединяются в сложный эфир и выделяют воду, а некоторые возвращаются обратно в спирт и карбоновую кислоту. В равновесии скорость прямой реакции этерификации такая же, как и обратной реакции: мы называем эту обратную реакцию гидролизом.
Рис. 7 – Этерификация и гидролиз – две стороны одной реакции
Чтобы гидролизовать сложные эфиры, смешайте их с горячей водной кислотой при температуре кипения с обратным холодильником. В этом случае вода из водной кислоты действует как нуклеофил , который, как вы помните, является донором электронной пары.
Благоприятный гидролиз
Возможно, вы знаете (см. Равновесия ), что мы можем изменить условия обратимой реакции, чтобы способствовать той или иной реакции. Принцип Ле Шателье говорит нам, что изменение этих условий приведет к смещению равновесия в противоположном направлении, противодействующем изменению. Так как же увеличить скорость обратной реакции, т. е. гидролиза?
Принцип Ле Шателье говорит нам, что изменение этих условий приведет к смещению равновесия в противоположном направлении, противодействующем изменению. Так как же увеличить скорость обратной реакции, т. е. гидролиза?
Ну, одним из реагентов является вода. Следовательно, просто увеличивая количество используемой воды, мы можем способствовать обратной реакции. Равновесие сдвинется влево, чтобы «израсходовать» дополнительную воду, которую мы добавили. Мы делаем это, используя избыток разбавленного кислотного катализатора. По этой же причине мы используем концентрированную кислоту для катализа прямой реакции этерификации — использование минимального количества воды сдвигает равновесие вправо и увеличивает выход сложного эфира.
Хотя мы можем сместить положение равновесия, кислотный гидролиз никогда не даст нам 100-процентного выхода, потому что это половина обратимой реакции.
Базовый гидролиз
Выше мы упоминали, что кислотный гидролиз никогда не доходит до конца — это обратимая реакция.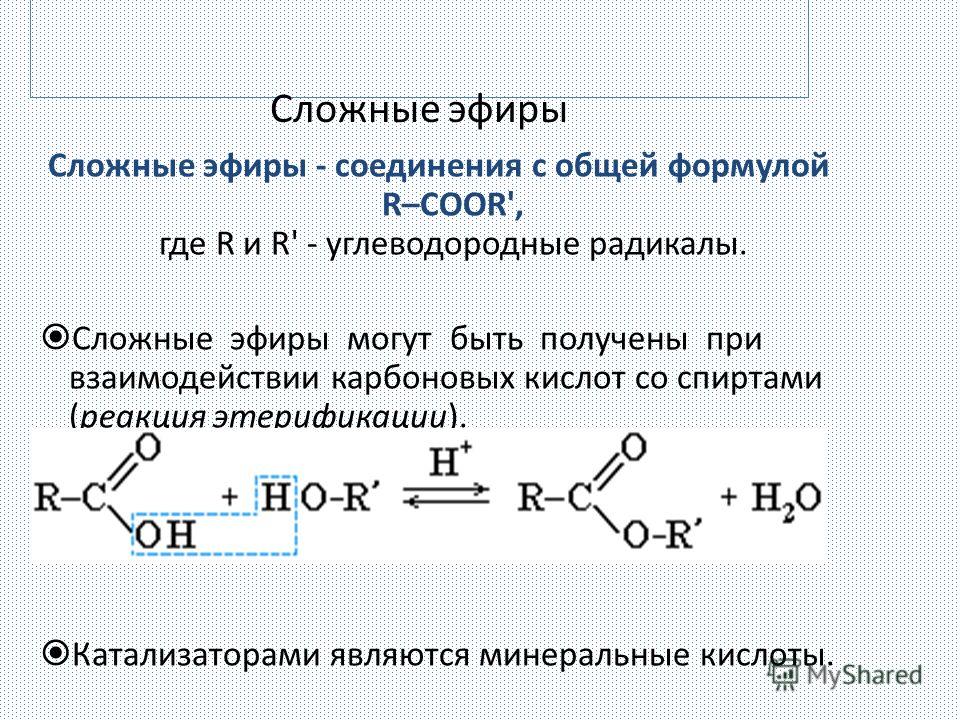 Вместо этого мы можем гидролизовать сложные эфиры, используя основание в качестве катализатора. Эта реакция идет до конца. При нагревании горячего водного основания, такого как гидроксид, со сложным эфиром с обратным холодильником образуется карбоксилатная соль 9.0004 и спирт.
Вместо этого мы можем гидролизовать сложные эфиры, используя основание в качестве катализатора. Эта реакция идет до конца. При нагревании горячего водного основания, такого как гидроксид, со сложным эфиром с обратным холодильником образуется карбоксилатная соль 9.0004 и спирт.
Соль представляет собой соединение, образующееся при ионном связывании отрицательно заряженных ионов с положительно заряженными катионами. Они образуют гигантскую решетчатую структуру.
Например, реакция метилэтаноата с раствором гидроксида натрия дает метанол и этаноат натрия:
Этаноат натрия является нашей карбоксилатной солью. Он состоит из положительных ионов натрия и отрицательных ионов этаноата, связанных ионными связями.
Рис. 8 – Структура этаноата натрия
Но что, если нам нужна чистая карбоновая кислота вместо карбоксилатной соли? Мы можем сделать следующее:
- Отогнать спирт.
- Добавьте избыток сильной кислоты, такой как серная кислота или соляная кислота.
 Это дает избыток ионов.
Это дает избыток ионов. - Ионы собираются карбоксилат-ионами в растворе, образуя карбоновую кислоту.
- Отделить карбоновую кислоту от раствора дальнейшей перегонкой.
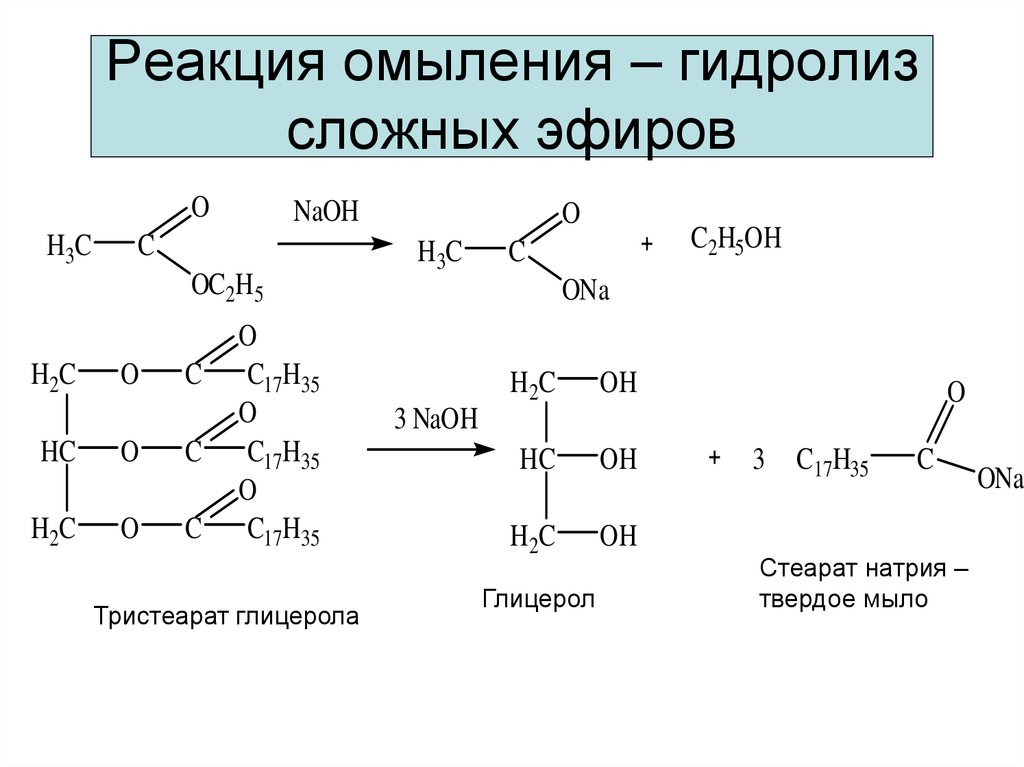
Базовый гидролиз также известен как омыление . Взгляните на этот термин, и вы сможете догадаться, для чего используются определенные карбоксилатные соли — мыло! Мы делаем мыло из животных жиров и растительных масел, которые мы рассмотрим позже.
Сравнение кислотного и щелочного гидролиза
Следующая таблица поможет вам обобщить ваши знания о кислотном и щелочном гидролизе.
Рис. 9. Таблица сравнения кислотного и щелочного гидролиза сложных эфиров
Предсказание продуктов
Попробуйте ответить на следующий вопрос.
Пропилэтаноат можно расщепить серной кислотой или гидроксидом натрия. Для каждой реакции напишите уравнение и назовите образующиеся продукты.
Сначала вытащим пропилэтанолат. Это поможет нам увидеть его структуру и выяснить составные части.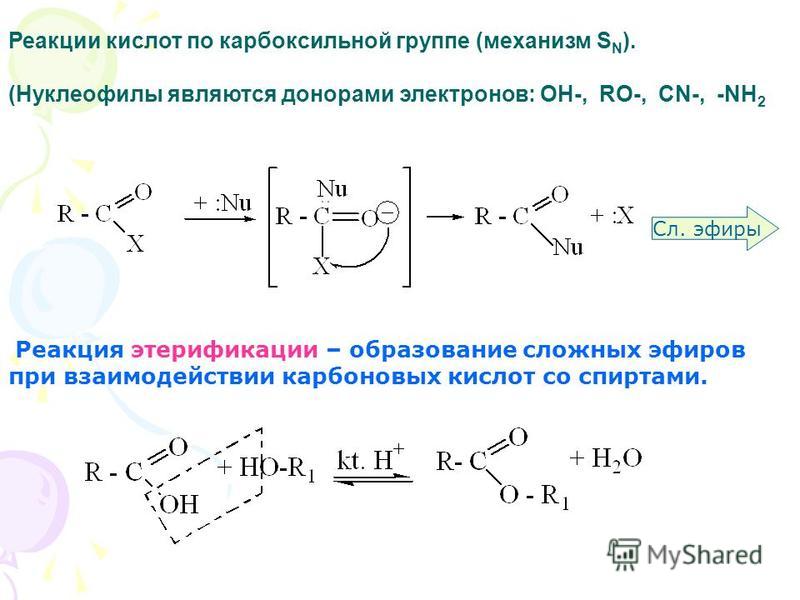
Рис. 10 – Пропилэтаноат
Помните, что сложные эфиры образуются из карбоновых кислот. Этаноат говорит нам, что часть молекулы, которая исходит от кислоты, основана на этановой кислоте. Другая часть имени, пропил говорит нам, что остальная часть молекулы основана на пропиловой цепи. При расщеплении эфира образуется пропанол.
Теперь рассмотрим, как пропилэтаноат расщепляется кислотой. Помните, что это обратимая реакция – до завершения она не доходит. Продуктами являются этановая кислота и пропанол.
Кислотный гидролиз пропилэтанолата дает этановую кислоту (справа) и пропанол (слева). StudySmarter Originals
Если мы используем основание, реакция идет до конца, но вместо карбоновой кислоты образуется карбоксилатная соль. Поскольку мы использовали гидроксид натрия, образовавшаяся соль представляет собой этаноат натрия.
Омыление
Выше мы упоминали, что мы можем делать мыло из различных жиров и масел. Это известно как омыление .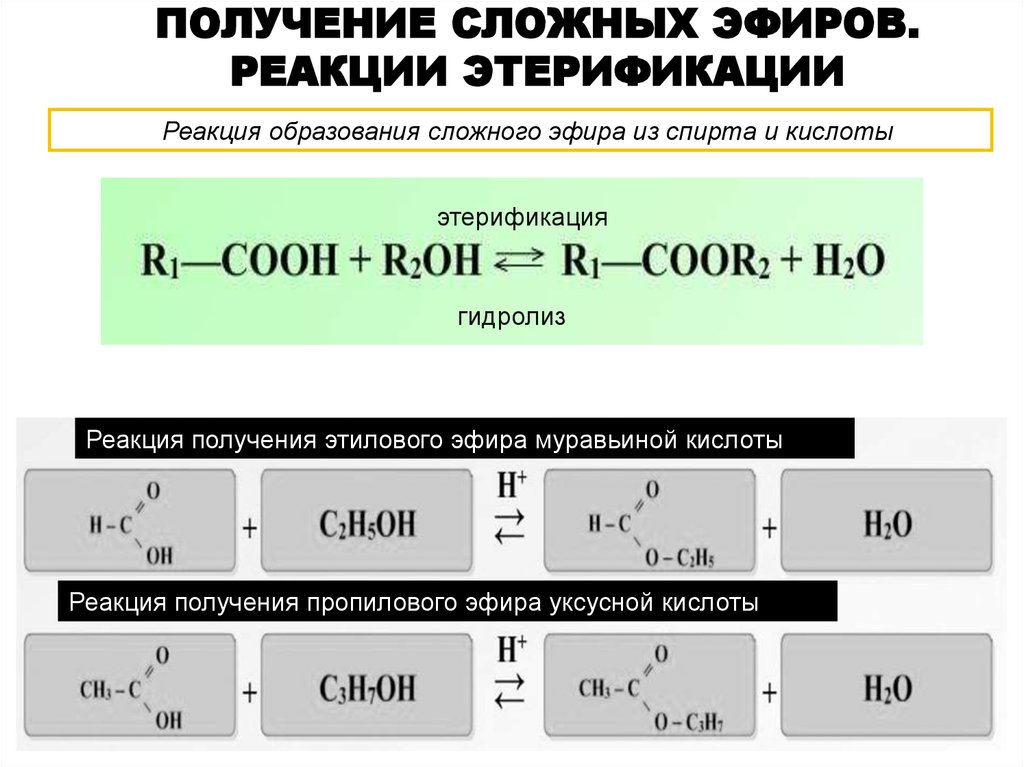
Жиры и масла, известные под общим названием липиды , также называются триглицеридами . Это потому, что они основаны на спирте глицерине . Глицерин имеет три группы -ОН. В триглицеридах каждая группа -ОН образует связь с карбоновой кислотой, имеющей длинный углеводородный хвост. Гидролиз триглицерида с помощью основания снова расщепляет его до глицерина, который мы используем в медицине или для улучшения результатов спортсменов; и карбоксилатные соли, которые мы используем в качестве мыла.
Рис. 11. Триглицерид (слева) при омылении распадается на глицерин (вверху) и карбоксилат-ион (внизу). Ион карбоксилата образует соль
Как работает мыло?
Карбоксилатные соли ионные . В растворе они диссоциируют с образованием положительного иона металла и отрицательного карбоксилат-иона. Карбоксилат-ион содержит полярный конец с группой -COO и неполярный углеводородный хвост. Полярный конец связывается с водой, в то время как неполярный конец связывается с другими неполярными молекулами, такими как липиды, помогая жирам, таким как пена и жир, смешиваться с водой и вымываться.
Полярный конец связывается с водой, в то время как неполярный конец связывается с другими неполярными молекулами, такими как липиды, помогая жирам, таким как пена и жир, смешиваться с водой и вымываться.
Рис. 12. Карбоксилатная соль
Биодизель
В 2006 г. маршрутный автобус Йельского университета был успешно переоборудован для работы на 100% биодизеле – виде возобновляемого топлива, полученного из растений. Это был важный шаг на пути к снижению воздействия транспортной отрасли на окружающую среду. Прежде чем мы закончим, давайте быстро рассмотрим, что такое биодизель на самом деле.
Биодизель производится из сложных эфиров триглицеридов растительных культур, таких как рапсовое масло. Когда мы реагируем с метанолом, используя щелочной катализатор, мы получаем метиловые эфиры с длинной цепью . Мы можем сжигать их вместо ископаемого топлива. Фактически, до 10 процентов дизельного топлива или бензина, используемого в автомобилях, можно заменить биодизелем, не затрагивая их двигатели.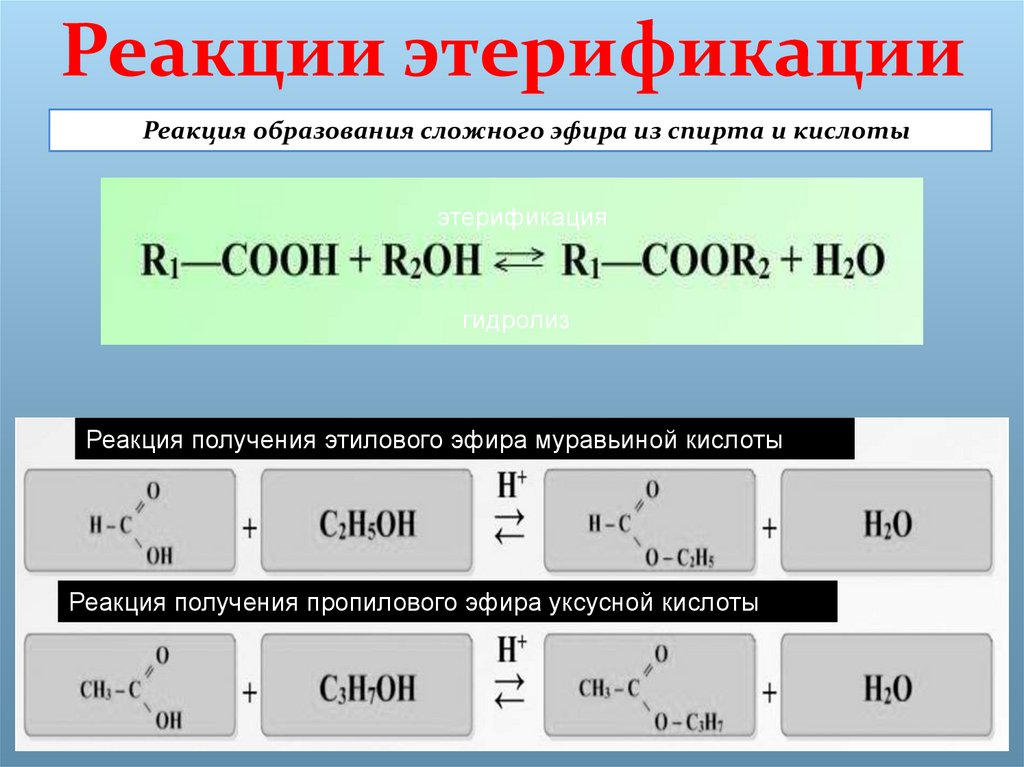 Поскольку биодизельное топливо получают из быстрорастущих растений, оно углеродно-нейтрально и является гораздо более экологичным выбором, чем топливо, полученное из сырой нефти.
Поскольку биодизельное топливо получают из быстрорастущих растений, оно углеродно-нейтрально и является гораздо более экологичным выбором, чем топливо, полученное из сырой нефти.
Рис. 12 – Метиловый эфир, такой же, как и в биодизельном топливе.
Реакции сложных эфиров – основные выводы
Сложные эфиры представляют собой органические молекулы с функциональной группой -COO-.
Сложные эфиры получают в реакциях этерификации. Это обратимые реакции между спиртом и карбоновой кислотой с использованием сильной кислоты в качестве катализатора.
Сложные эфиры можно гидролизовать с использованием кислоты или основания. Кислотный гидролиз протекает в обратном направлении по отношению к этерификации и поэтому не доходит до конца. Основной гидролиз дает 100-процентный выход, но вместо карбоновой кислоты образуется карбоксилатная соль.
Основной гидролиз сложных эфиров также известен как омыление.
 Когда триглицериды гидролизуются, они производят глицерин и длинноцепочечные карбоксилатные соли, которые обычно используются в качестве мыл.
Когда триглицериды гидролизуются, они производят глицерин и длинноцепочечные карбоксилатные соли, которые обычно используются в качестве мыл.Биодизель производится из растительных триглицеридов и метанола. Это экологически чистый выбор топлива по сравнению с сырой нефтью.
2.10: Реакции сложных эфиров — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 227645
Цели обучения
- Описать типичную реакцию, происходящую с эфирами.
- Определите продукты кислотного гидролиза сложного эфира.
- Определите продукты основного гидролиза сложного эфира.
Гидролиз сложных эфиров
Сложные эфиры являются нейтральными соединениями, в отличие от кислот, из которых они образуются.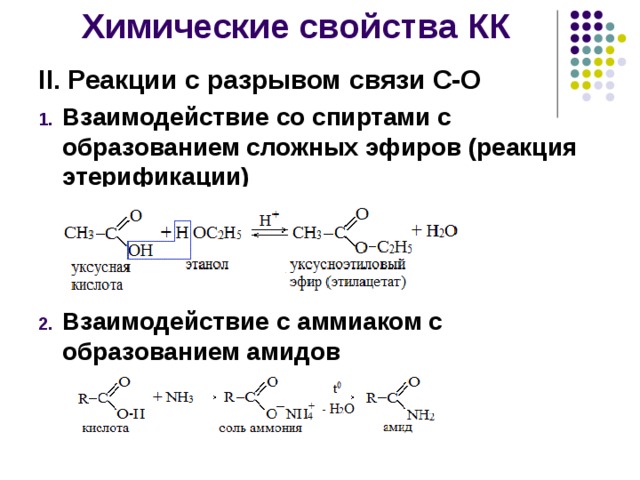 В типичных реакциях алкоксигруппа (OR’) сложного эфира заменяется другой группой. Одной из таких реакций является гидролиз, буквально «расщепление водой». Гидролиз сложных эфиров катализируется либо кислотой, либо основанием.
В типичных реакциях алкоксигруппа (OR’) сложного эфира заменяется другой группой. Одной из таких реакций является гидролиз, буквально «расщепление водой». Гидролиз сложных эфиров катализируется либо кислотой, либо основанием.
Кислотный гидролиз представляет собой обратную этерификацию. Эфир нагревают с большим избытком воды, содержащей сильнокислотный катализатор. Подобно этерификации, реакция обратима и не идет до конца. Продукты карбоновые и спиртовые.
В качестве конкретного примера, бутилацетат и вода реагируют с образованием уксусной кислоты и 1-бутанола. Реакция обратима и не идет до конца.
Пример \(\PageIndex{1}\)
Напишите уравнение кислотного гидролиза этилбутирата (CH 3 CH 2 CH 2 COOCH 2 CH 9 903) и назовите продукты .
Раствор
Помните, что при кислотном гидролизе вода (HOH) расщепляет эфирную связь. H HOH присоединяется к атому кислорода в OR части исходного эфира, а OH HOH присоединяется к карбонильному атому углерода:
Продукты масляная кислота (бутановая кислота) и этанол.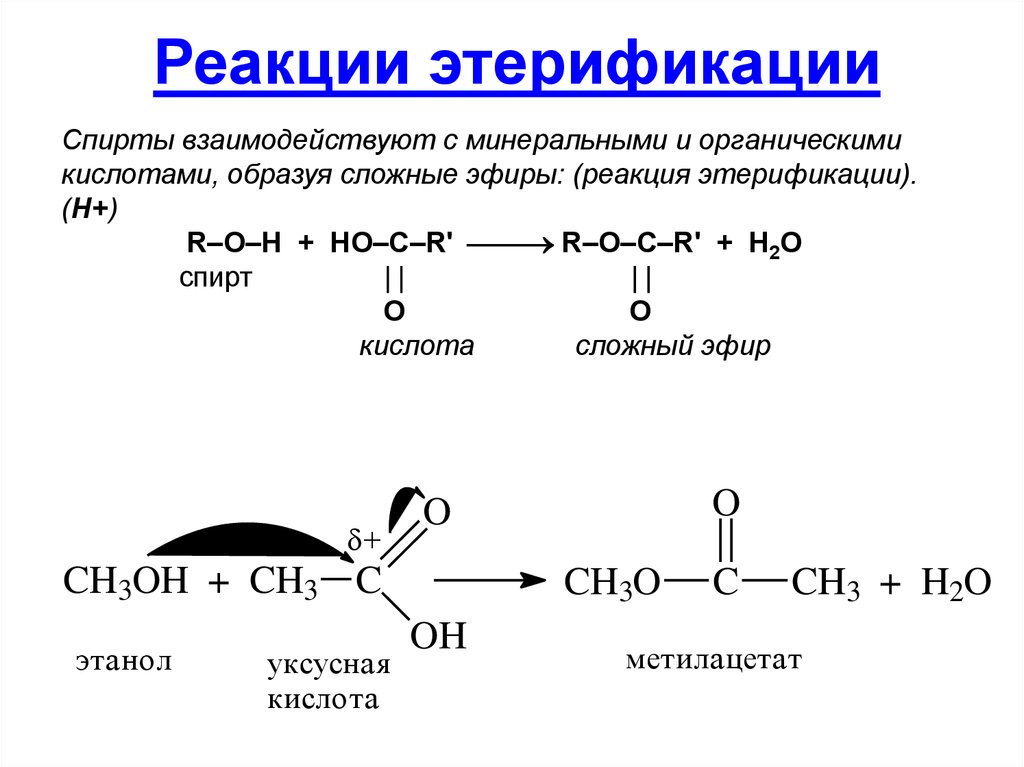
Упражнение \(\PageIndex{1}\)
Напишите уравнение кислотного гидролиза метилбутаноата и назовите продукты.
Основной гидролиз или омыление
Когда для гидролиза сложного эфира используется основание (такое как гидроксид натрия [NaOH] или гидроксид калия [KOH]), продукты представляют собой карбоксилатную соль и спирт. Поскольку мыла получают щелочным гидролизом жиров и масел, щелочной гидролиз сложных эфиров называется омылением (лат. 9).0037 sapon , что означает «мыло», и facere , что означает «делать»). В реакции омыления основание является реагентом, а не просто катализатором. Реакция завершается:
В качестве конкретного примера, этилацетат и NaOH реагируют с образованием ацетата натрия и этанола:
Реакция называется омылением, потому что она используется при производстве мыла. Мыла представляют собой натриевые или калиевые соли длинных карбоновых кислот, называемых жирными кислотами.
Стеарат натрия, типичный ингредиент кускового мыла. Изображение предоставлено Smokefoot, CC BY-SA 3.0, с Wikimedia Commons.
Изображение предоставлено Smokefoot, CC BY-SA 3.0, с Wikimedia Commons.
Раствор
При основном гидролизе молекула основания расщепляет эфирную связь. Кислотная часть сложного эфира превращается в соль кислоты (в данном случае соль калия). Спиртовая часть сложного эфира превращается в свободный спирт.
Упражнение \(\PageIndex{2}\)
Напишите уравнение гидролиза этилпропаноата в растворе гидроксида натрия.
Резюме
Гидролиз является наиболее важной реакцией сложных эфиров. Кислотный гидролиз сложного эфира дает карбоновую кислоту и спирт. Основной гидролиз сложного эфира дает карбоксилатную соль и спирт.
Упражнения по обзору концепции
Чем различаются кислотный гидролиз и основной гидролиз сложного эфира с точки зрения
- продукты получены?
- степень реакции?
Что такое омыление?
Ответы
- кислотный гидролиз: карбоновая кислота + спирт; основной гидролиз: карбоксилатная соль + спирт
- основной гидролиз: завершение; кислотный гидролиз: незавершенная реакция
основной гидролиз сложного эфира
Упражнения
Напишите уравнение катализируемого кислотой гидролиза этилацетата.



 3
3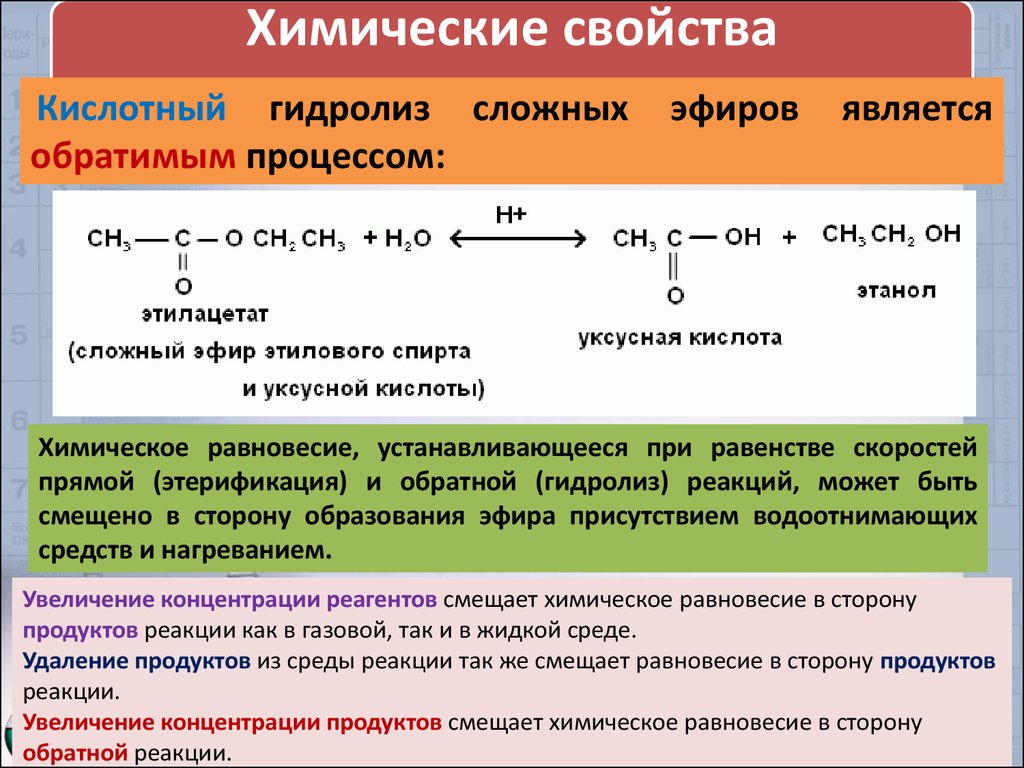 8
8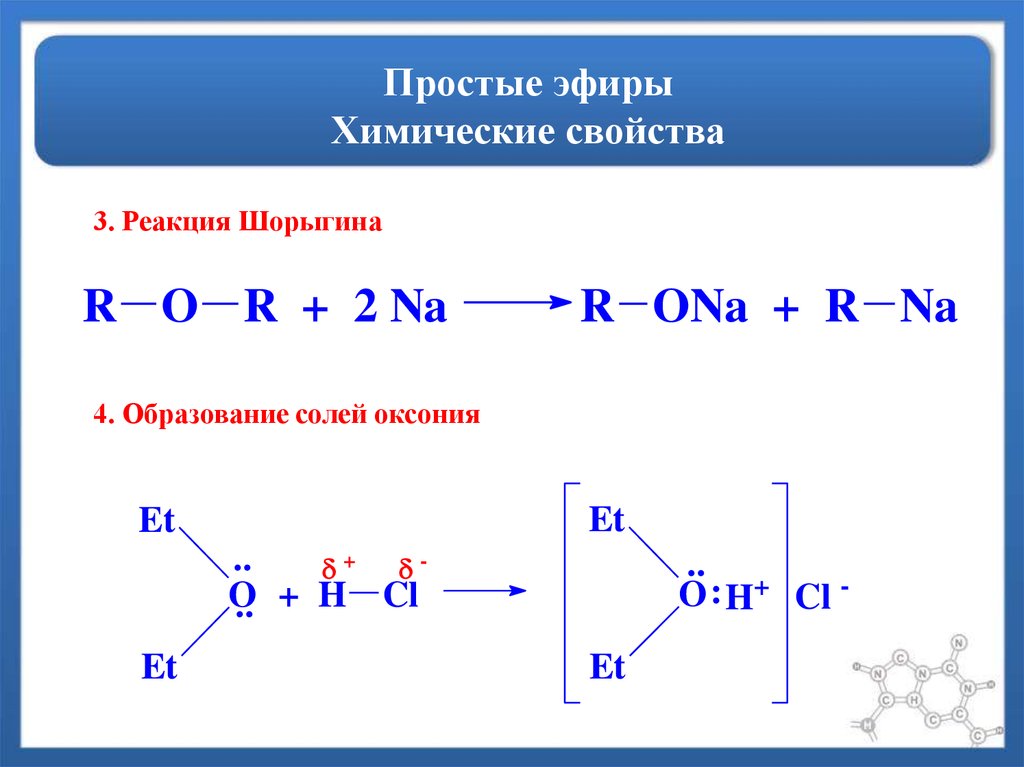 кип./0С мм рт.ст.
кип./0С мм рт.ст.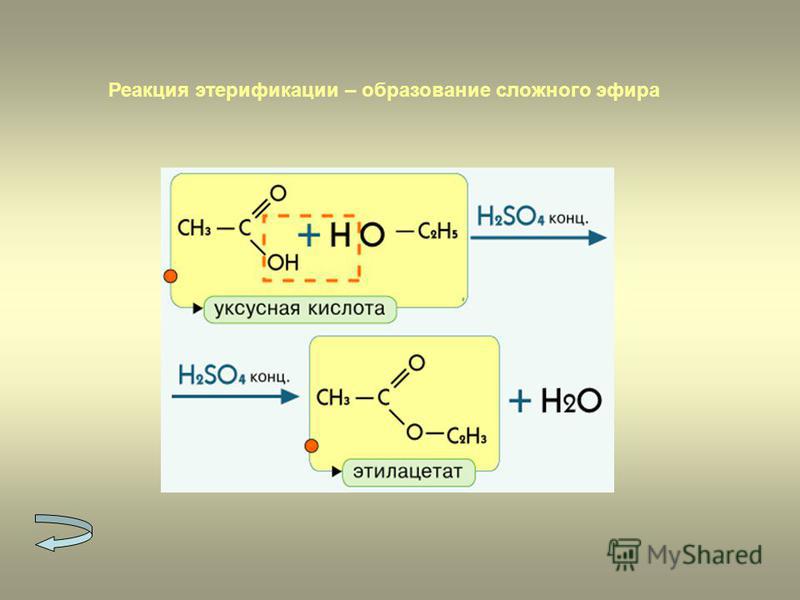 5230
5230 5245
5245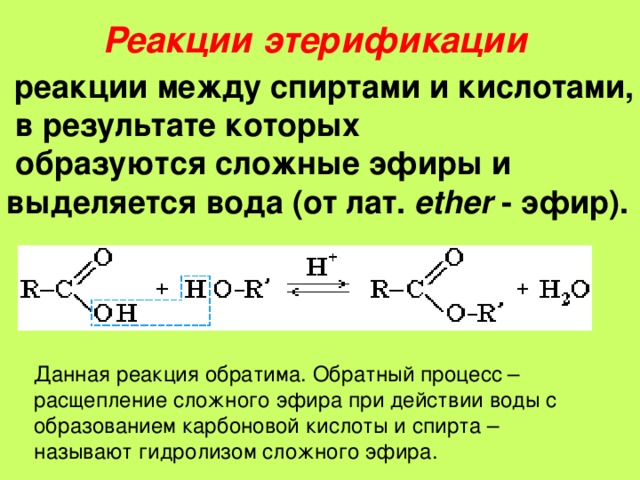 Материалы респ. конф. с международным участием «Зеленая химия в интересах устойчивого развития». Самарканд. – 2012. – С.287.
Материалы респ. конф. с международным участием «Зеленая химия в интересах устойчивого развития». Самарканд. – 2012. – С.287.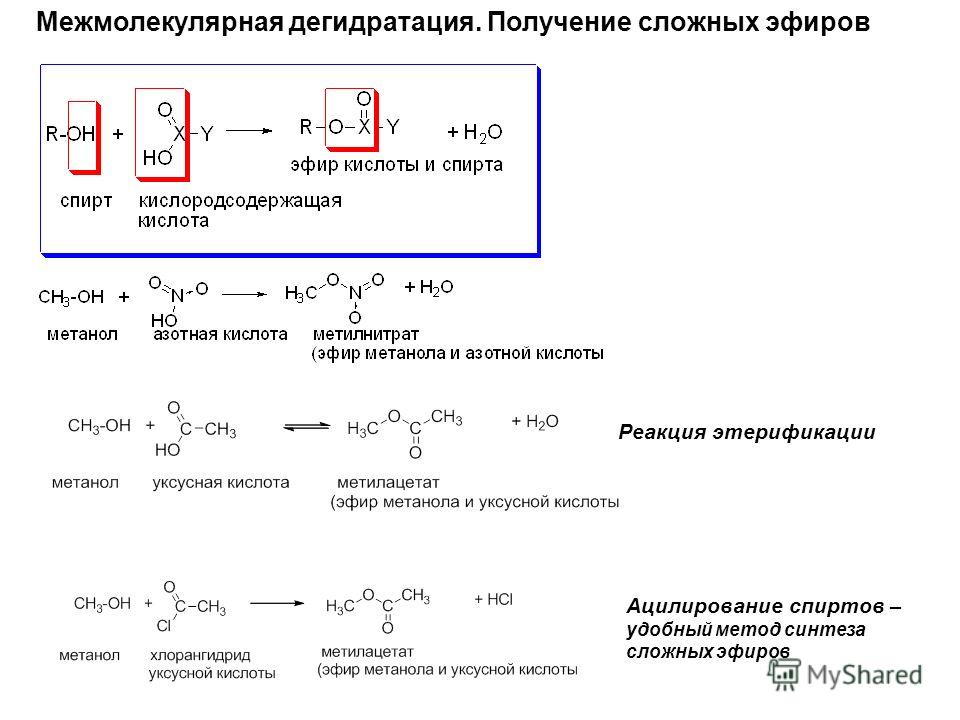 , Тургунов Э. Способ получения ацетиленовых спиртов. Пат. РУз IAP 20110321. Ташкент. – Официальный бюллетень. -2013. -№ 1(141). С.20.
, Тургунов Э. Способ получения ацетиленовых спиртов. Пат. РУз IAP 20110321. Ташкент. – Официальный бюллетень. -2013. -№ 1(141). С.20.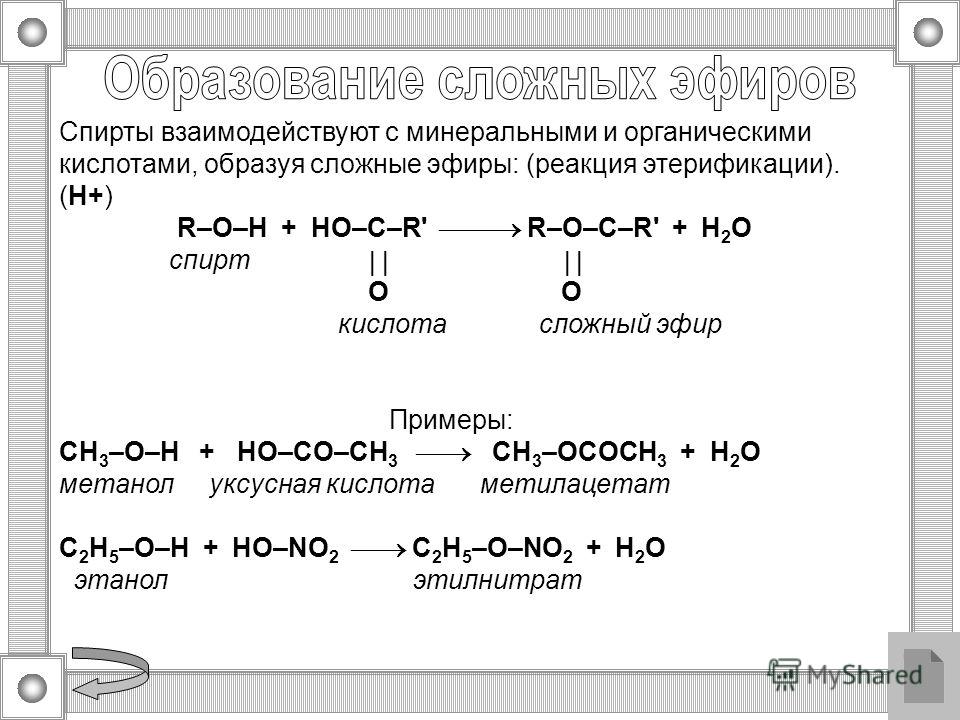
 Это дает избыток ионов.
Это дает избыток ионов.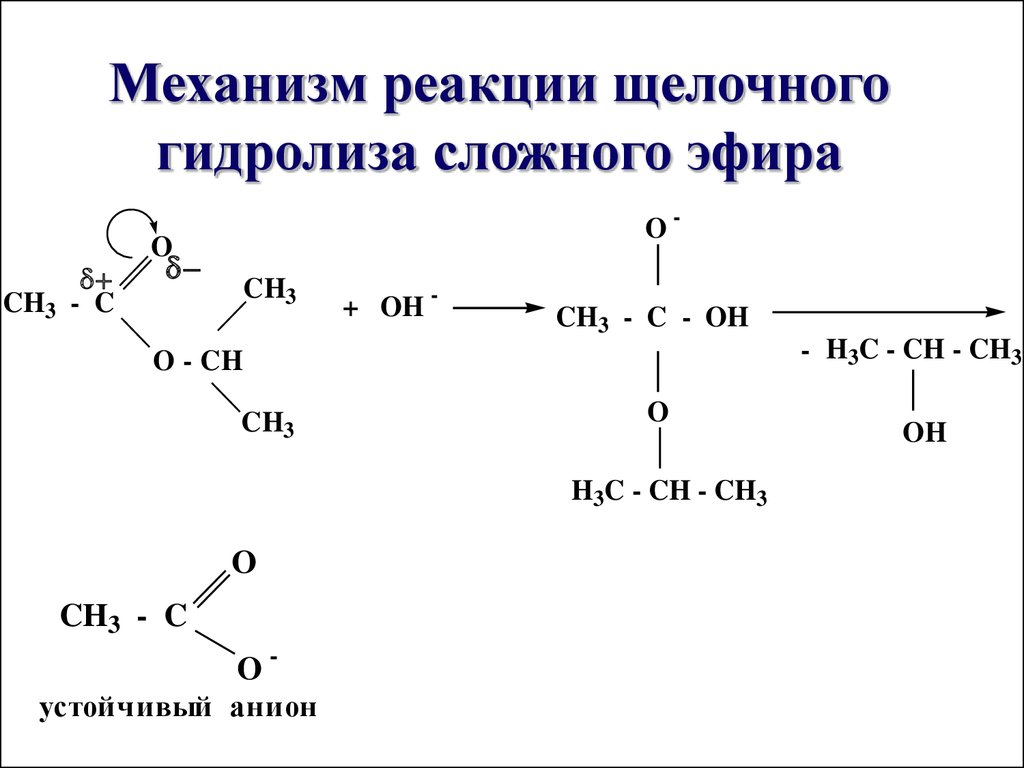 Когда триглицериды гидролизуются, они производят глицерин и длинноцепочечные карбоксилатные соли, которые обычно используются в качестве мыл.
Когда триглицериды гидролизуются, они производят глицерин и длинноцепочечные карбоксилатные соли, которые обычно используются в качестве мыл.