Химическая термодинамика. Тепловые эффекты химических реакций. Направление биохимических процессов, страница 3. Рассчитайте тепловой эффект реакции получения этилового эфира
Химическая термодинамика. Тепловые эффекты химических реакций. Направление биохимических процессов, страница 3
С(СН3СООН) . С(ОН-) Кw
Кгидр. = =
С(СН3СОО-) Ка
МАТЕРИАЛЫ ДЛЯ САМОПОДГОТОВКИ СТУДЕНТОВ:
1. Вычислите тепловой эффект биохимического процесса брожения глюкозы: C6h22O6 6 2 C2H5OH + 2 CO2(г), если теплоты сгорания глюкозы и этилового спирта соответственно равны: -2816 кДж/моль и -1236 кДж/моль.
Решение: в соответствии со следствием из закона Гесса тепловой эффект реакции равен:
ΔrH = ΔкрH(C6h22O6) - 2ΔкрH(C2H5OH) = -2816 - 2(-1236) = -314 (кДж)
Данная реакция является экзотермической, т.е. протекает с выделением тепла.
2. Рассчитайте тепловой эффект реакции получения этилового эфира аминобензойной кислоты (полупродукта при получении анестезина) при стандартных условиях по уравнению реакции:
4 С2H5OCOC6h5NO2(ж) + 9 Fe + 4 h3O(ж) → 4 C2H5OCOC6h5Nh3(ж) + 3 Fe3O4,
если известны стандартные теплоты образования участников реакции:
Вещество: DfHo298, кДж/моль
C9H9O4N(ж) -463,2
h3O(ж) -273,2
C9h21NO2(ж) -1759,0
Fe3O4 -1068,0
3. Теплота сгорания бензойной кислоты C6H5COOH равна -3227,5 кДж/моль. Теплоты образования воды и диоксида углерода при тех же условиях соответственно равны -285,8 и -393,5 кДж/моль. Вычислите теплоту образования C6H5COOH.
4. Дайте заключение о возможности самопроизвольного протекания химической реакции при Т = 298 К.
фермент
Н3С - СH - COOH h4C – C - COOH + h3,
ОН О
по следующим данным:
Вещество: ΔfHo298, кДж/моль So298, кДж/моль
h4C-CH-COOH
-673 192
OН
(молочная к-та)
h4C-C-COOH
-586 179
O
(пировиноградная к-та)
Н2 - 130
Решение: 1) Рассчитаем ΔrHо298 по следствию из закона Гесса:
ΔrHo298 = ΔfHo298 (h4C-C-COOH) - ΔfHo298 (h4C-CH-COOH) =
O OH
= -586 - (-673) = 87 (кДж) (Реакция эндотермична)
2) Рассчитываем энтропийный фактор реакции (DrSo298)
ΔrSo298 = So298(h4C-C-COOH) + So298(h3) - So298 (h4C-CH-COOH) =
O OH
= 179 + 130 - 192 = 117 Дж/К = 0,117 кДж/К
3) Рассчитаем ΔrGo298 по уравнению: ΔG = ΔH - ТΔS
ΔrGo298 = 87 - 298 (0,117) = 52 кДж (ΔG > 0)
Данная реакция в стандартных условиях самопроизвольно не протекает.
5. Не производя вычислений, установите знак DS следующих процессов:
а) 2 Nh4(г) → N2(г) + 3 h3(г)
б) CO2(тв) → CO2(г)
в) 2 NO(г) + O2(г) → 2 NO2(г)
г) 2 h3S(г) + 3 O2(г) → 2 h3O(ж) + 2 SO2(г)
д) 2 Ch4OH(г) + 3 O2(г) → 4 h3O(г) + 2 CO2(г)
6. Недавними измерениями величин ΔH и ΔG для гидролиза АТФ было показано, что при 36оС и физиологических значениях рН они равны соответственно -4800 и -7000 ккал/моль. Вычислите величину ΔS для тех же условий. Каков смысл того, что ΔS имеет положительное значение?
7. Как повлияет повышение давления на равновесие в следующих обратимых реакциях, протекающих в газовой фазе:
1) N2O4 ↔ 2 NO2 4) 2 SO2 + O2 ↔ 2 SO3
2) 2 NO + O2 ↔ 2 NO2 5) N2 + 3 h3 ↔ 2 Nh4
3) h3 + I2 ↔ 2 HI 6) CO + SO3 ↔ CO2 + SO2
МАТЕРИАЛЫ УИРС:
Расчет термодинамических характеристик (ΔrH, ΔrS, ΔrG) биохимических реакций.
ЛИТЕРАТУРА
ОСНОВНАЯ:
1. Конспект лекций;
2. Общая химия. Под ред. Ю.А. Ершова М., "Высшая школа" 1993 г., с. 10-42;
3. А.С. Ленский "Введение в бионеорганическую и биофизическую химию", М., 1989, с. 6-54;
ДОПОЛНИТЕЛЬНАЯ:
1. Практикум по общей химии. Под. ред. Ю.А. Ершова М., "Высшая школа", 1993 г., с. 17-31;
2. К.Н. Зеленин "Химия" СПб "Специальная литература", 1997 г., с. 107-126;
3. В. Уильямс, Х. Уильямс "Физическая химия для биологов", М., 1976, с. 58-123.
vunivere.ru
1. Практическая часть
1.1.Ситуационные задачи (№№ с 1 по 7)с алгоритмами их решений, эталонами ответов и с комментариями.
Вычисление значение внутренней энергии, теплоты и работы
Задача №1.Рассчитайте значение работы, проделанной реакцией открытия мышьяка в биологическом материале (слюне):
Решение.
В этой реакции на 1 моль
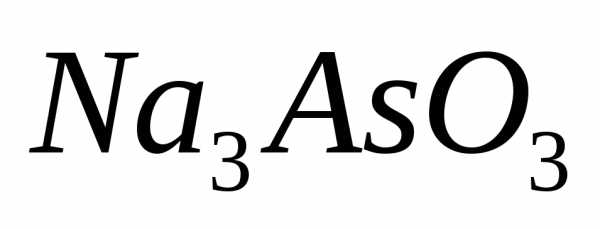 выделяется I моль газообразного
выделяется I моль газообразного 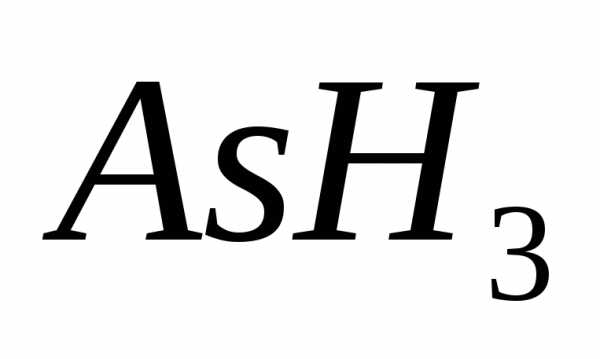 . Газ оттесняет окружающую атмосферу и производит работу, равную
. Газ оттесняет окружающую атмосферу и производит работу, равную 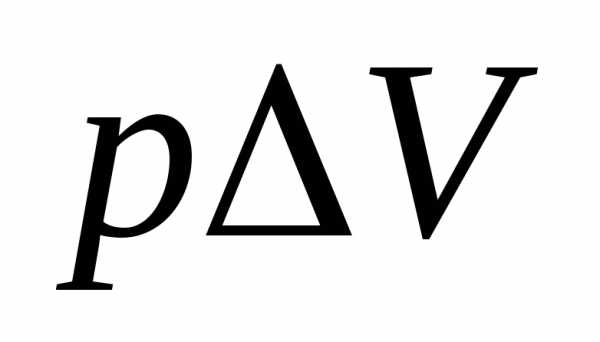 . Рассматривая этот газ как идеальный и пренебрегая объемом исходных веществ, можно
. Рассматривая этот газ как идеальный и пренебрегая объемом исходных веществ, можно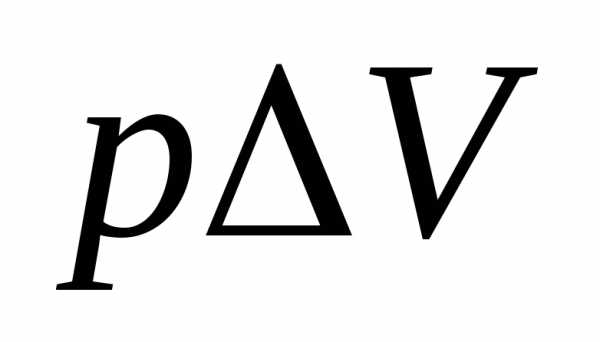 приравнять
приравнять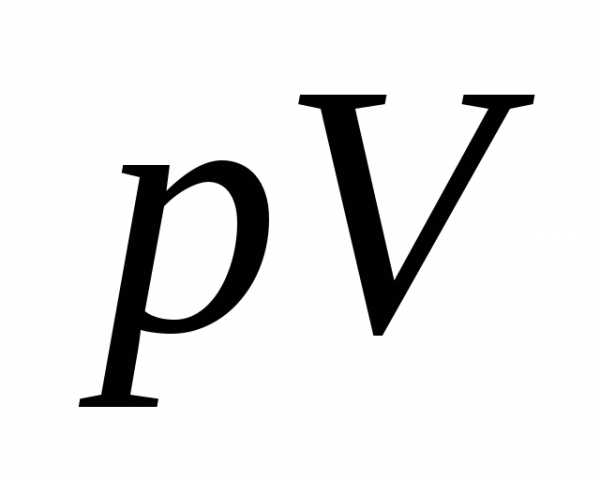 , a
, a 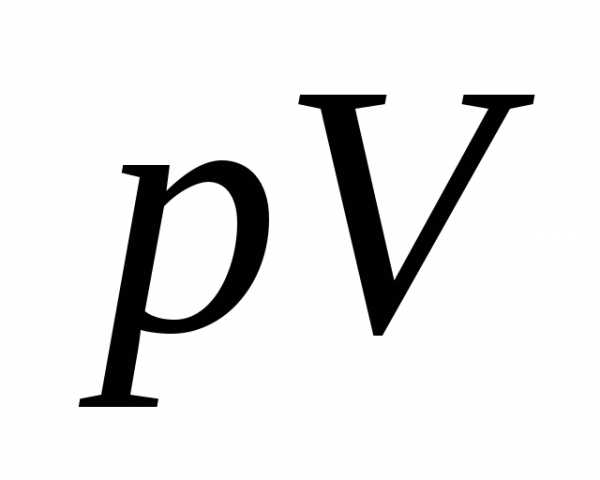 =
= .
.Если прореагировал 1 моль
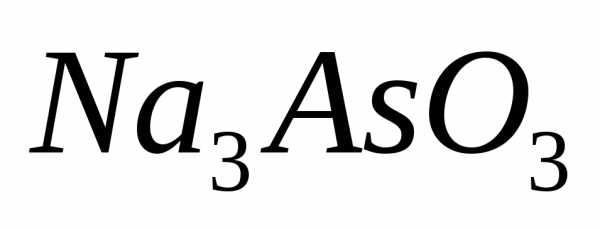 , то работа, произведенная реакцией: =1 моль
, то работа, произведенная реакцией: =1 моль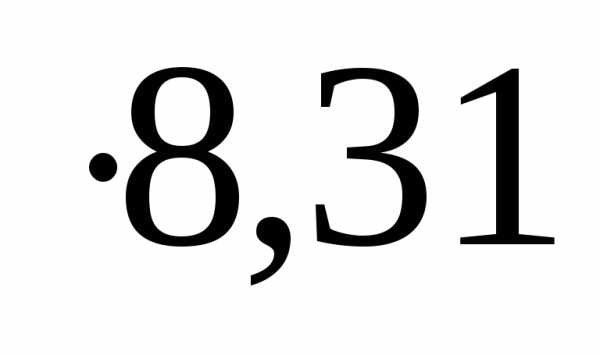 К= 2496,4 Дж или2,5 кДж.
К= 2496,4 Дж или2,5 кДж.Если реакцию проводят в плотно закрытой колбе, то W=0, так как объем не может увеличиваться. Работа производится только в том случае, когда изменяется объем системы.
Ответ.  = 2496,4 Дж или 2,5 кДж.
= 2496,4 Дж или 2,5 кДж.
Задача №2. Чему равно изменение внутренней энергии  при испарении воды массой 100 г при 20°С, если принять, что водяной пар подчиняется законам идеальных газов, а объемом жидкости, который незначителен по сравнению с объемом пара, можно пренебречь. Удельная теплота парообразования воды
при испарении воды массой 100 г при 20°С, если принять, что водяной пар подчиняется законам идеальных газов, а объемом жидкости, который незначителен по сравнению с объемом пара, можно пренебречь. Удельная теплота парообразования воды  Дж/г.
Дж/г.
Решение.
Из формулы расчета внутренней энергии:и с учетом того, что
 и
и , получаем:кДж.
, получаем:кДж.
Ответ. Внутренняя энергия увеличилась на 230,97 кДж.
Вычисление значение теплового эффекта и определение теплоты образования и сгорания
Задача №3. Определите тепловой эффект реакции образования воды: при постоянном давлении и температуре 298 К, если тепловой эффект при постоянном объеме равен -284,2 кДж/моль.
Решение.
В химических реакциях изменение числа молей равно разности стехиометрических коэффициентов /
 / в уравнении, поэтому, то
/ в уравнении, поэтому, то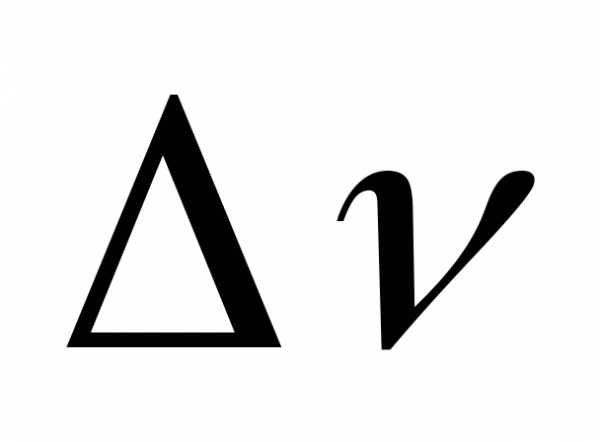 =.Примечание! Если в реакции участвуют твердые и жидкие вещества, то при вычислении
=.Примечание! Если в реакции участвуют твердые и жидкие вещества, то при вычислении  они во внимание не принимаются.
они во внимание не принимаются.Отсюда согласно формуле: = Дж/моль или 291,6 кДж/моль.
Ответ. 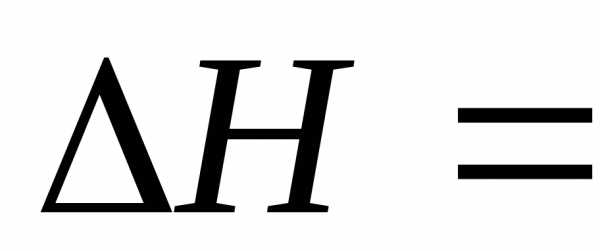 Дж/моль или 291,6 кДж/моль.
Дж/моль или 291,6 кДж/моль.
Задача №4. Определите теплоту образования  по реакции:
по реакции:
Решение.
В основе термохимических расчетов лежит следствие из закона Гесса: . Согласно данному уравнению, тепловой эффект данной реакции является теплотой образования
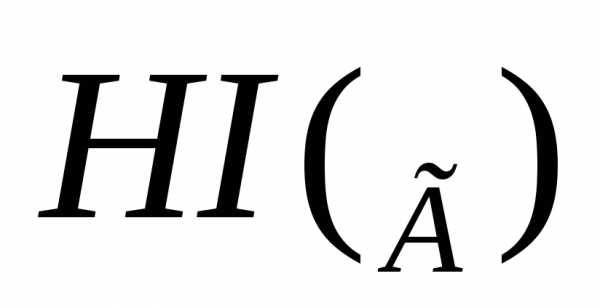 .
.Так как
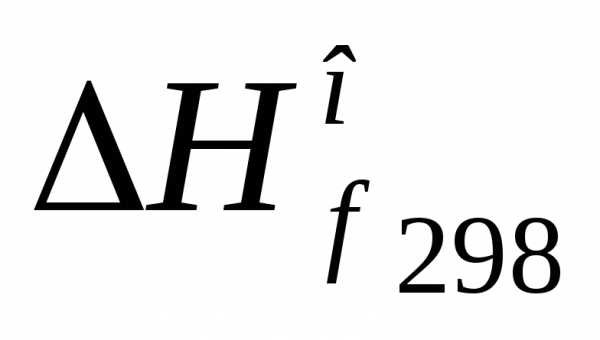
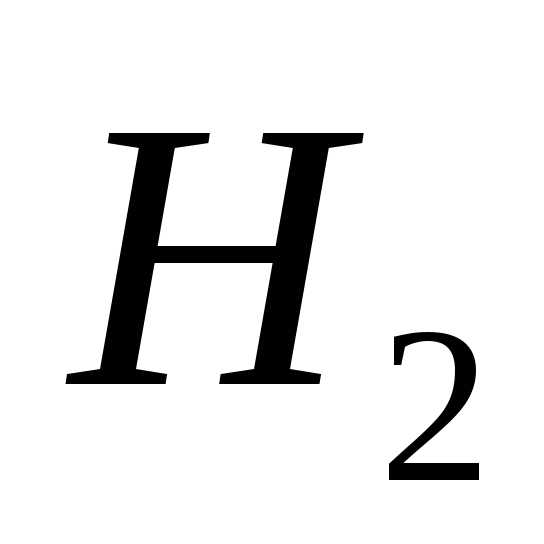 и
и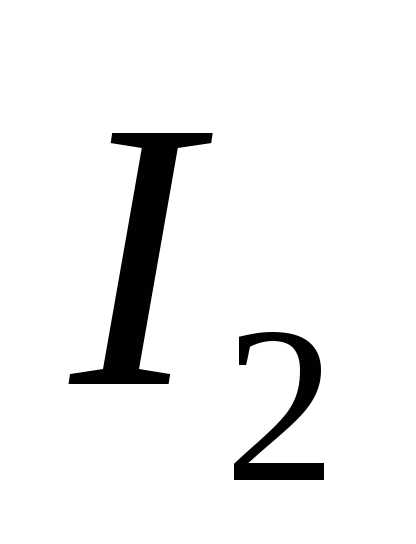 равны нулю, акДж/моль (табличные данные), то, следовательно,кДж/моль.
равны нулю, акДж/моль (табличные данные), то, следовательно,кДж/моль.
Ответ.кДж/моль.
Задача №5. Рассчитайте стандартный тепловой эффект реакции:постандартным теплотам сгорания.
Решение.
В основе термохимических расчетов лежит следствие из закона Гесса: Тогда:
Из таблиц находят
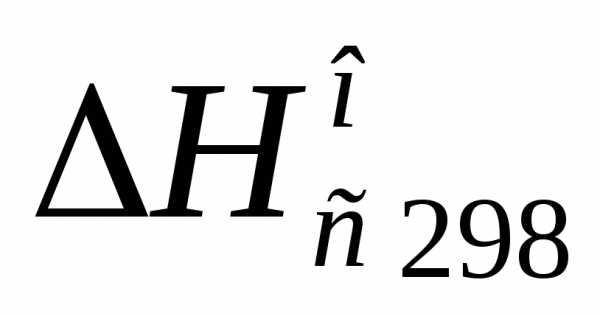 для каждого из участников реакции (в кДж/моль):
для каждого из участников реакции (в кДж/моль):
=-802,32;
Подставляя данные, получим: кДж/моль (реакция эндотермическая).
Ответ.кДж/моль.
Вычисление изменения стандартной энтропии и энергии Гиббса
Задача №6.Предскажите знак изменения энтропии /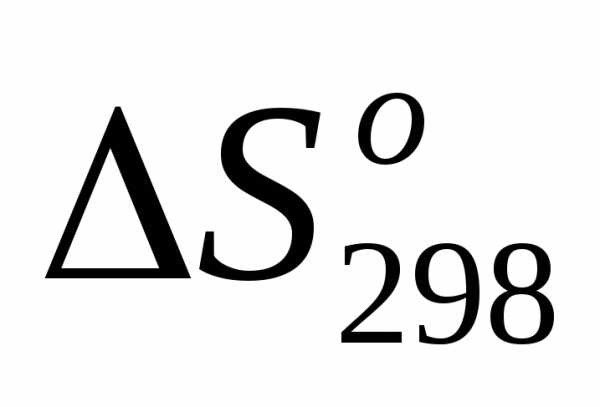 / в каждой из ниже предполагаемых реакций и проверьте правильность сделанных выводов расчетом
/ в каждой из ниже предполагаемых реакций и проверьте правильность сделанных выводов расчетом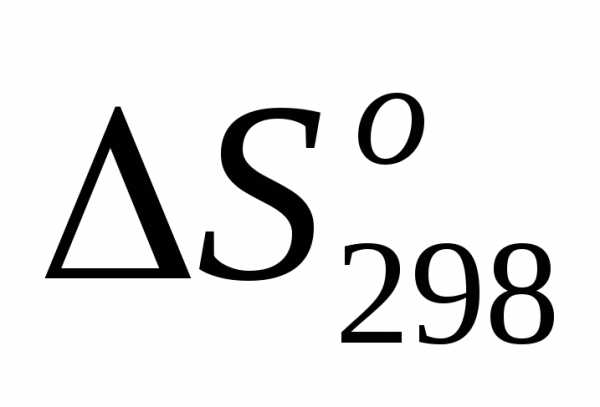 соответствующих реакций, пользуясь справочными данными.
соответствующих реакций, пользуясь справочными данными.
| Реакции | Выводы | |
| 1. |
| |
| 2. |
| |
| 3. |
| |
| 4. | Вероятно, | |
| 5 |
|
Решение.
Выпишем из таблицы (см. приложение) значения
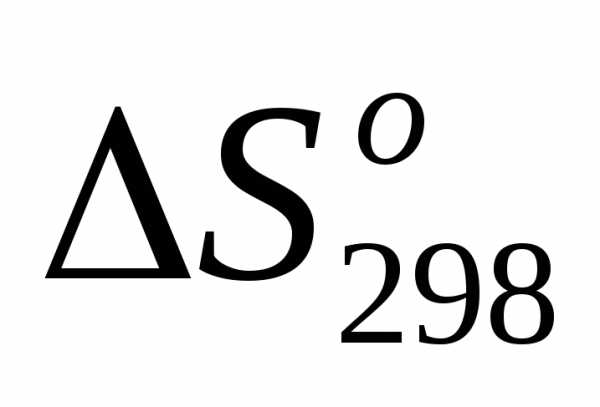 соответствующих веществ и подпишем их под формулами в уравнениях 1- 5 и для данных реакции вычисляем
соответствующих веществ и подпишем их под формулами в уравнениях 1- 5 и для данных реакции вычисляем 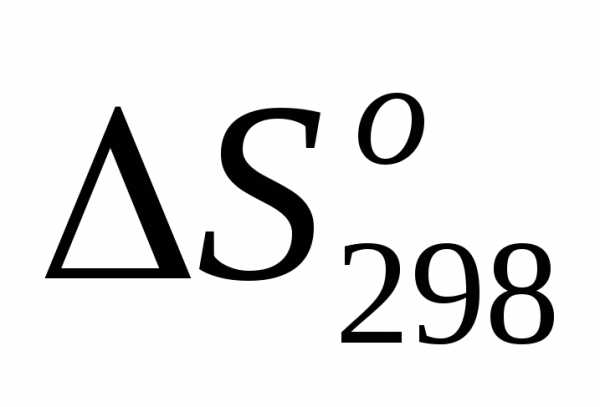 по формуле:.
по формуле:.
1)
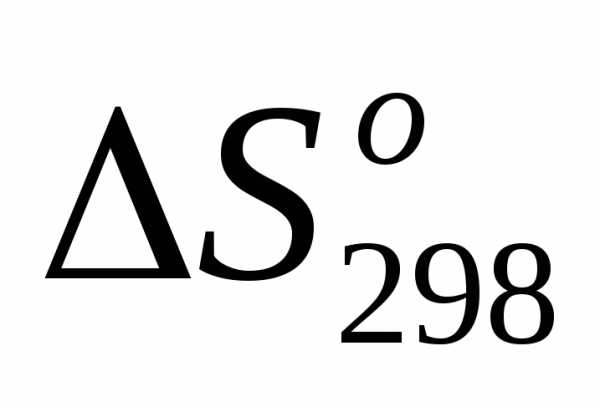 .
.
2)
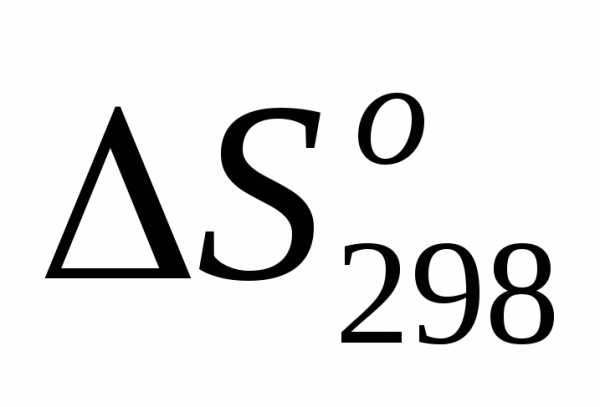 =.
=.
3)
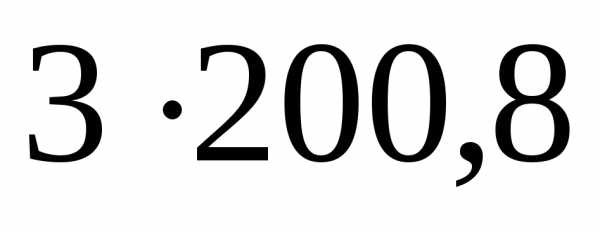
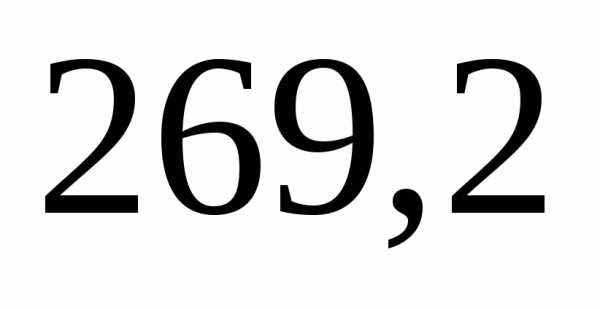
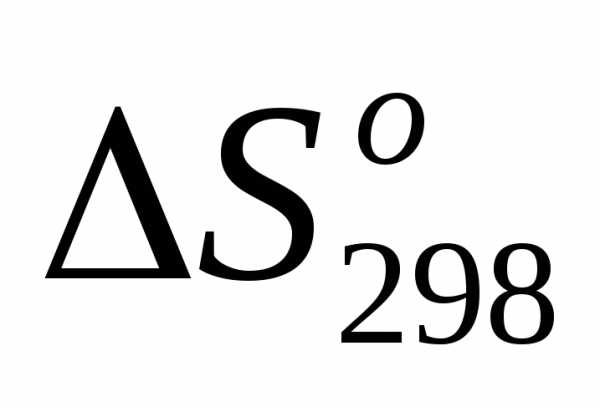 =.
=.
4)
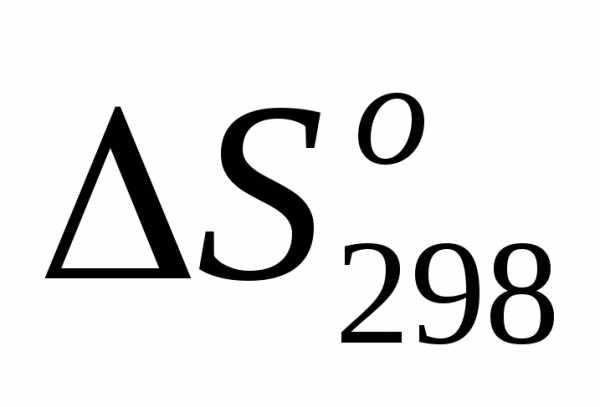 =.
=.
5)
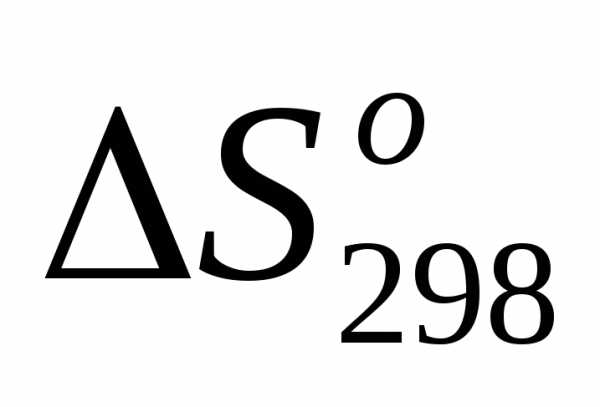 =.
=.
Ответ. Таким образом, результаты вычисления 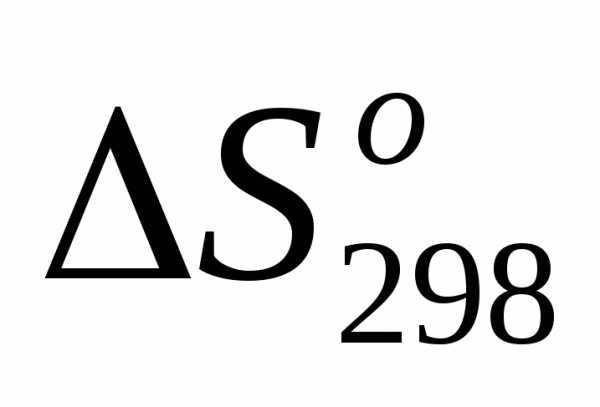 реакций подтвердили выводы, сделанные ранее, т.е.:
реакций подтвердили выводы, сделанные ранее, т.е.:
1)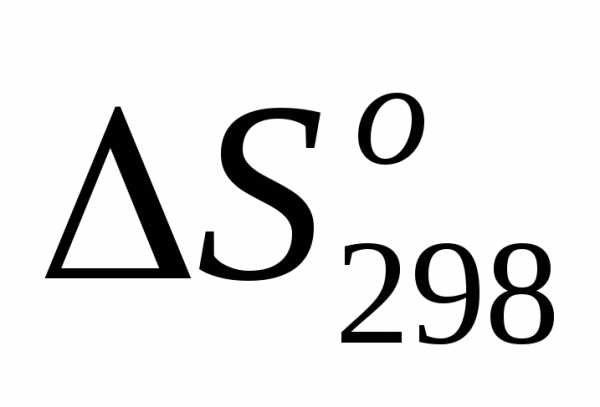 =,т.е.
=,т.е.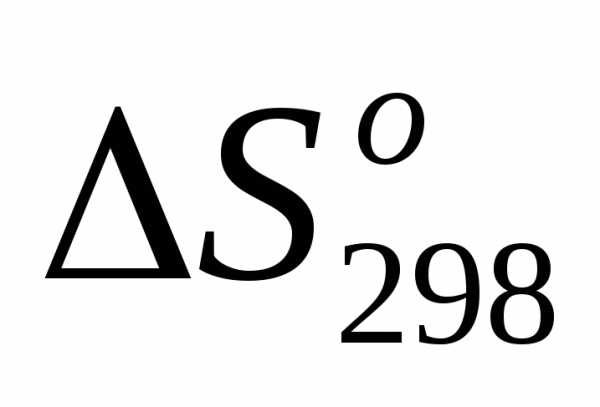 >0;
>0;
2)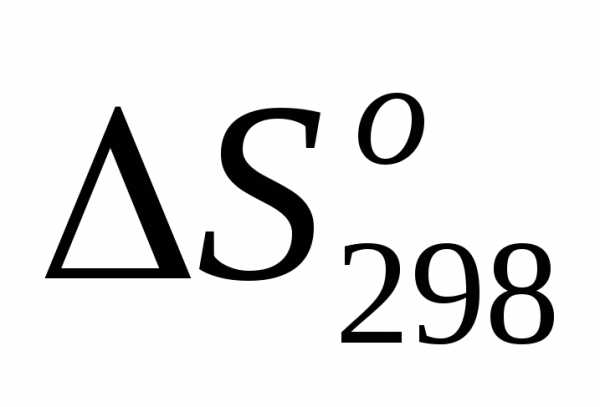 =, т.е.
=, т.е.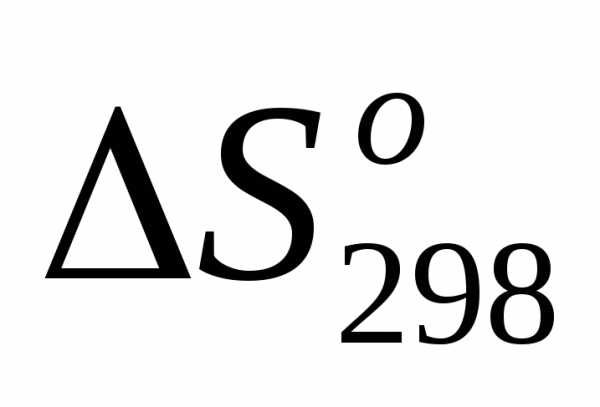 <0;
<0;
3)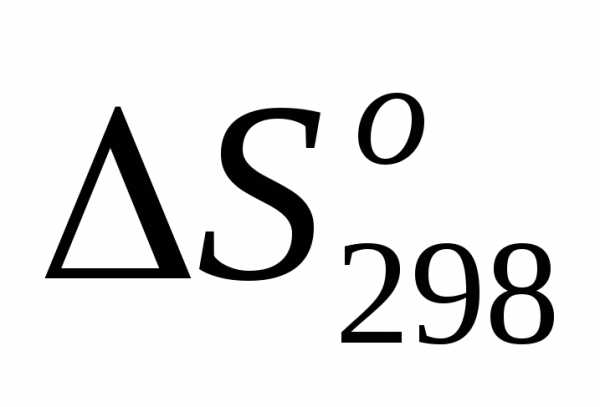 =,т.е.
=,т.е.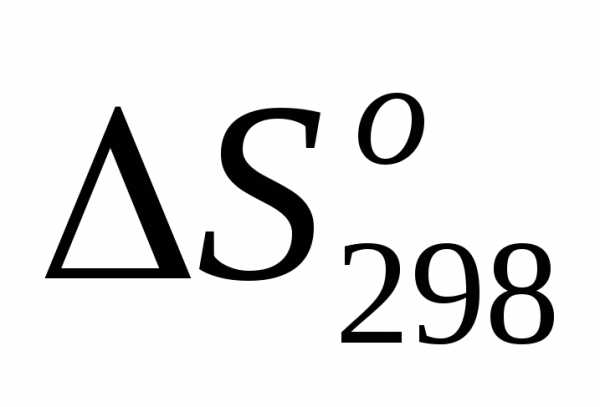 <0;
<0;
4) 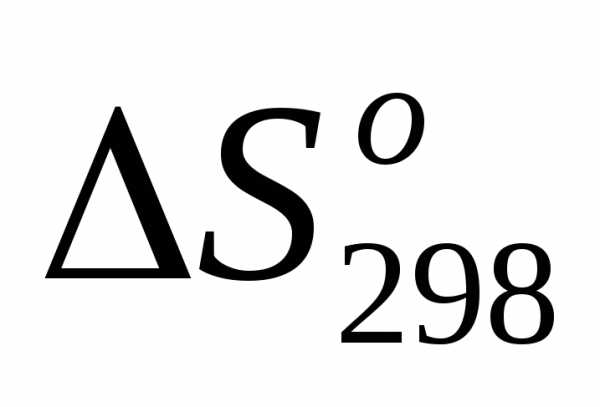 =, т.е.
=, т.е.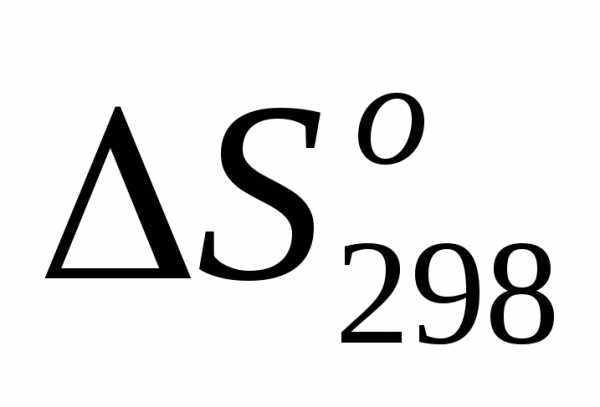 >0;
>0;
5)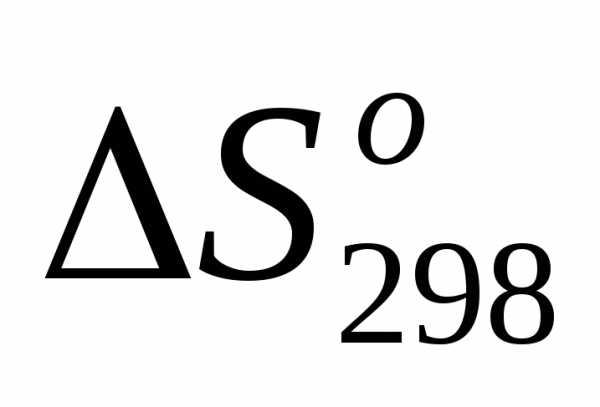 =, т.е.
=, т.е.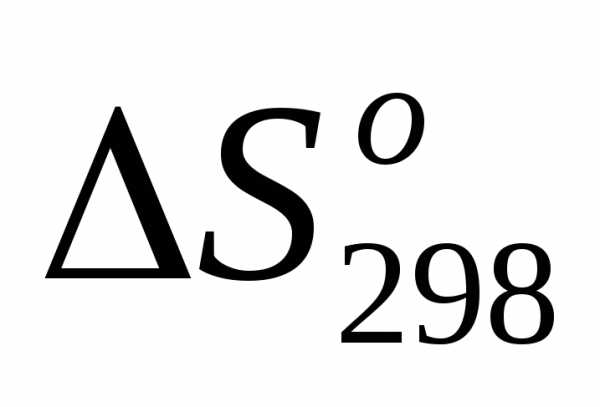 <0.
<0.
Задача №7. Какие из реакций, перечисленных в задаче №6, протекают самопроизвольно при стандартных условиях?
Решение.
По выше найденным данным вычисляем изменения изобарно-изотермического потенциала или свободной энергии Гиббса /
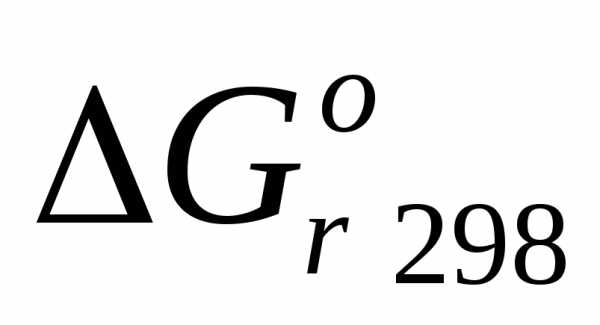 /:
/:Из таблицы выпишем
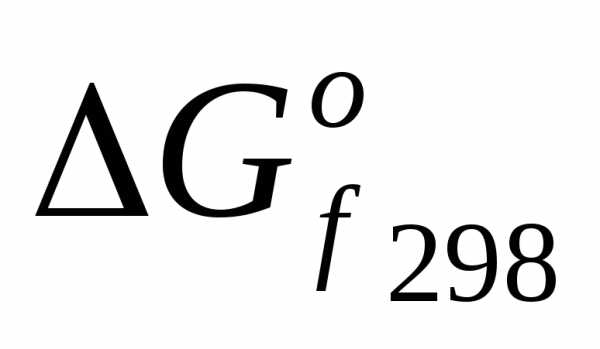 образования соединений и подставляем эти данные для выше соответствующих реакций:
образования соединений и подставляем эти данные для выше соответствующих реакций:
1) 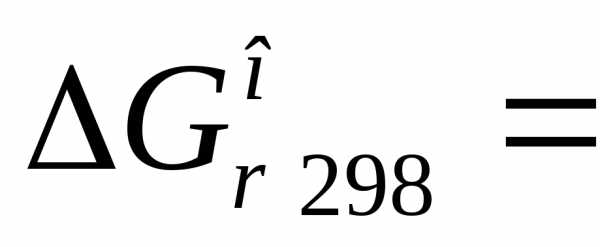 кДж.
кДж.
2) 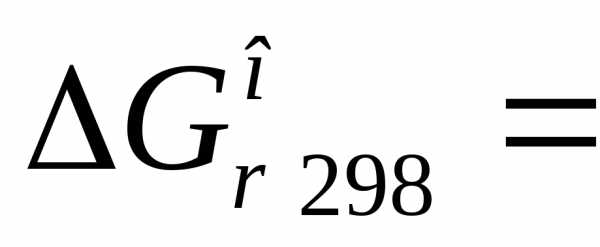 кДж.
кДж.
3) 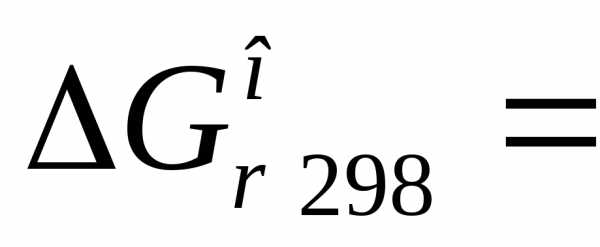 кДж.
кДж.
4) 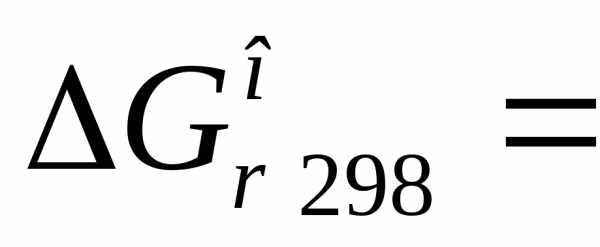 кДж.
кДж.
5) 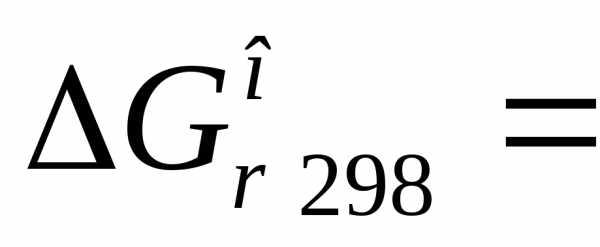 кДж.
кДж.
Ответ. Полученные результаты говорят о том, что реакции 1, 3 и 5 могут протекать в стандартных условиях самопроизвольно до установления равновесия, а реакции 2 и 4 в этих условиях протекать в указанном направлении не могут.
1.2. Ситуационные задачи №№ с 8 по 20 для закрепления материала (выполнить в протокольной тетради).
Задача № 8. Рассчитайте изменение внутренней энергии при испарении 20 г спирта при температуре его кипения, если удельная теплота парообразования спирта 858,95 Дж/г, а удельный объем пара 607 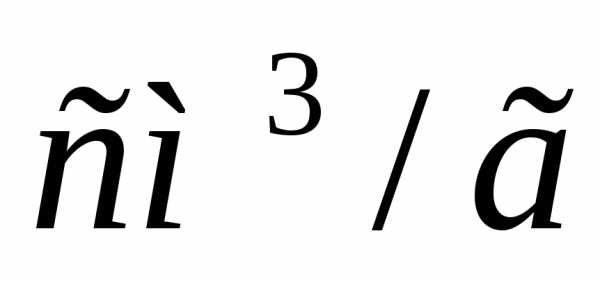 (объем жидкости пренебречь).
(объем жидкости пренебречь).
Задача №9. Определите работу изотермического обратимого расширения 3 моль водяного пара от до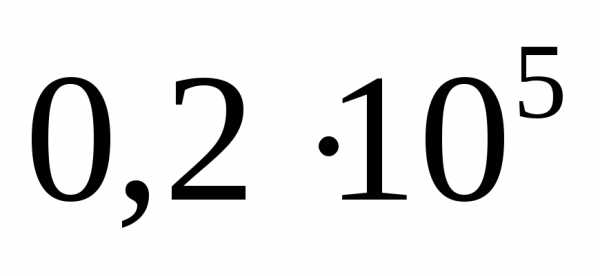 Па при стерилизации ампул с раствором глюкозыпри 330 К.
Па при стерилизации ампул с раствором глюкозыпри 330 К.
Задача № 10. Какая масса ядер грецких орехов может компенсировать половину суточной потребности человека в энергии, равной 6276 кДж, если известно, что в орехах массовая доля жира 64,4%, белка 15.6% и углеводов 12%?
Задача №11. Какое количество работы совершает человек весом 75 кг, взбираясь на памятник Вашингтону высотой 555 футов (1 фут=0,3048 м)? Сколько килокалорий необходимо для этого получить с пищей, если принять, что в механическую работу мышц может быть превращено 25% энергии, выделяющейся при окислении пищи в организме?
Задача №12. Энтальпия сгорания углеводов в организме человека составляет -17,55 кДж/г, белков – 16,72 кДж/г, жиров – 39,29 кДж/г. Среднесуточная потребность в белках, жирах и углеводах для студентов – мужчин составляет соответственно 113 г, 106 г, 451 г, для студентов – женщин 96 г, 90 г, 383 г. Какова среднесуточная потребность студентов в энергии?
Задача №13. Используя значение энтальпий сгорания белков, жиров и углеводов (см. задачу №12) рассчитать энергетическую ценность перловой каши (67 г крупы). В 100 г крупы содержится 9,3 г белков, 1,1 г жиров и 73,7 г углеводов.
Задача №14.Вычислите стандартную энтальпию биохимического брожения глюкозы: , если стандартные энтальпии сгорания глюкозы и этилового спирта равны соответственно -2801,69 и -1366,6 кДж/моль. Определить знак .
.
Задача №15. Рассчитайте тепловой эффект реакции получения этилового эфира аминобензойной кислоты (полупродукта при получении анестезина) при стандартных условиях по уравнению реакции:
если известны стандартные теплоты образования участников реакции:
| Вещество |
|
| -463,2 | |
|
| -273,2 |
| -1759,0 | |
|
| -1068,0 |
|
| 0 |
Задача №16. Рассчитайте тепловой эффект реакции получения газообразного диэтиламиноэтанола (полупродукта при синтезе новокаина) при стандартных условиях по реакции:если известны стандартные теплоты образования участников реакции:
| Вещество |
|
| -81,6 | |
| -48,8 | |
| -341,0 | |
Задача №17. Возможно ли в стандартных условиях реакция: Рассчитайте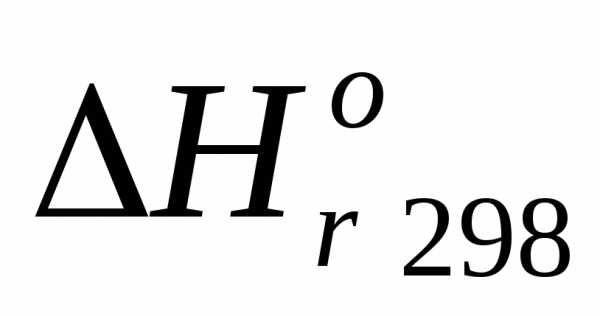 ,
,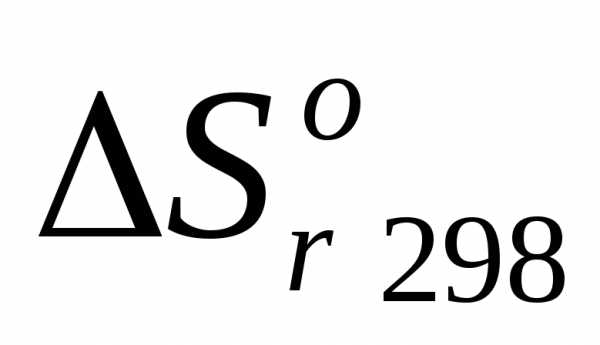 ,
,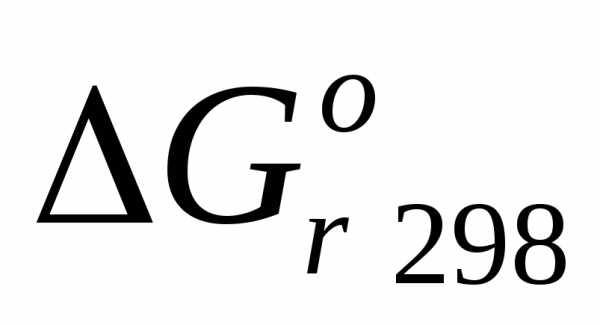 для данной реакции.
для данной реакции.
Задача №18. Возможно ли осуществление процесса восстановления металлического железа из оксида 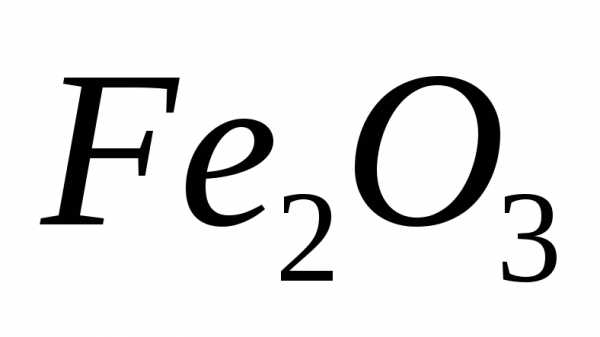 действием водорода при стандартных условиях:
действием водорода при стандартных условиях:
Задача № 19. Как влияет температура на направление реакций 1-5 (см. задачу №6)?
studfiles.net
1. Практическая часть
1.1.Ситуационные задачи (№№ с 1 по 7)с алгоритмами их решений, эталонами ответов и с комментариями.
Вычисление значение внутренней энергии, теплоты и работы
Задача №1.Рассчитайте значение работы, проделанной реакцией открытия мышьяка в биологическом материале (слюне):
Решение.
В этой реакции на 1 моль
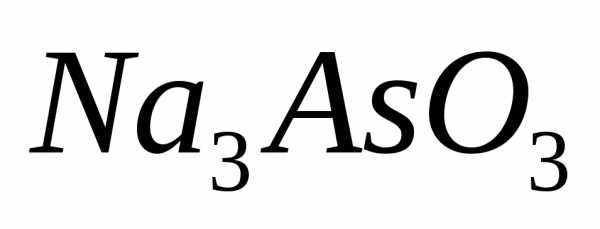 выделяется I моль газообразного
выделяется I моль газообразного 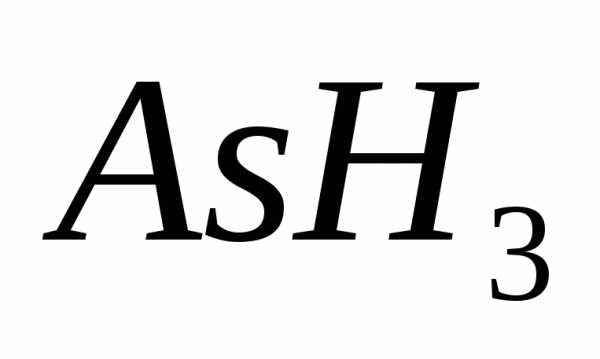 . Газ оттесняет окружающую атмосферу и производит работу, равную
. Газ оттесняет окружающую атмосферу и производит работу, равную 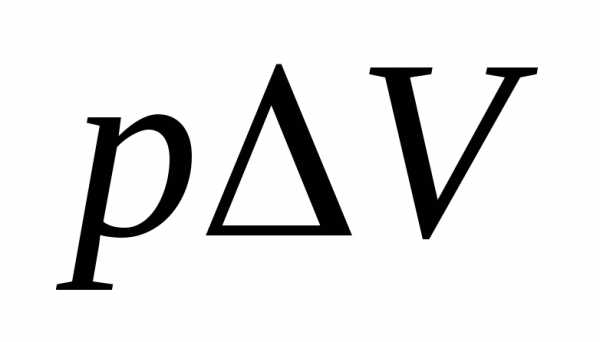 . Рассматривая этот газ как идеальный и пренебрегая объемом исходных веществ, можно
. Рассматривая этот газ как идеальный и пренебрегая объемом исходных веществ, можно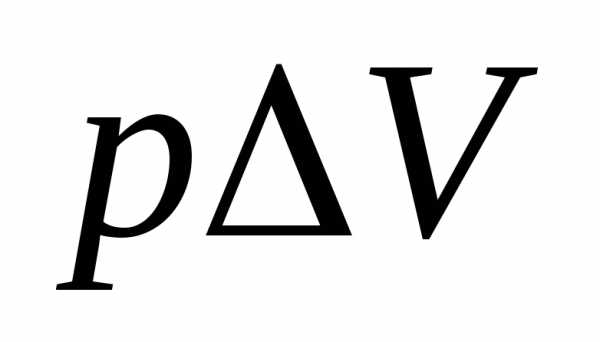 приравнять
приравнять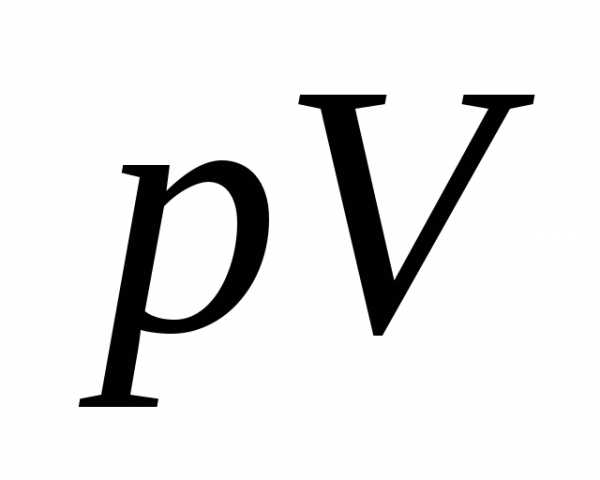 , a
, a 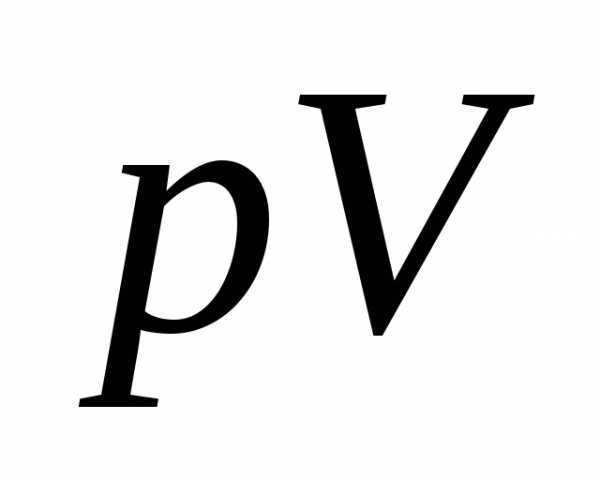 =
= .
.Если прореагировал 1 моль
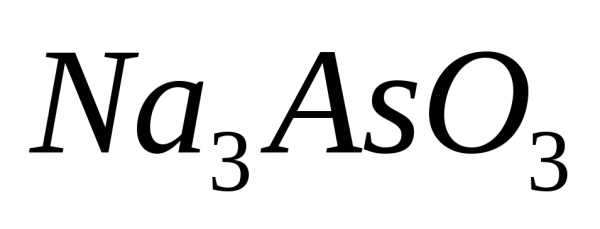 , то работа, произведенная реакцией: =1 моль
, то работа, произведенная реакцией: =1 моль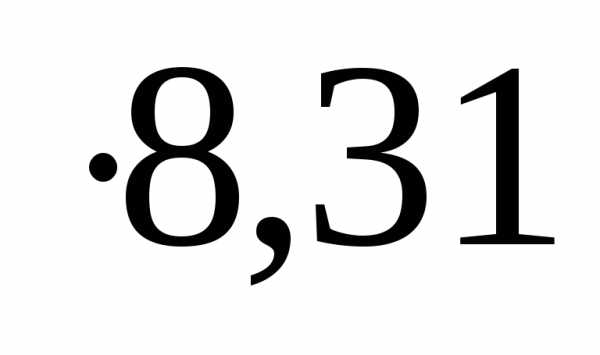 К= 2496,4 Дж или2,5 кДж.
К= 2496,4 Дж или2,5 кДж.Если реакцию проводят в плотно закрытой колбе, то W=0, так как объем не может увеличиваться. Работа производится только в том случае, когда изменяется объем системы.
Ответ.  = 2496,4 Дж или 2,5 кДж.
= 2496,4 Дж или 2,5 кДж.
Задача №2. Чему равно изменение внутренней энергии  при испарении воды массой 100 г при 20°С, если принять, что водяной пар подчиняется законам идеальных газов, а объемом жидкости, который незначителен по сравнению с объемом пара, можно пренебречь. Удельная теплота парообразования воды
при испарении воды массой 100 г при 20°С, если принять, что водяной пар подчиняется законам идеальных газов, а объемом жидкости, который незначителен по сравнению с объемом пара, можно пренебречь. Удельная теплота парообразования воды 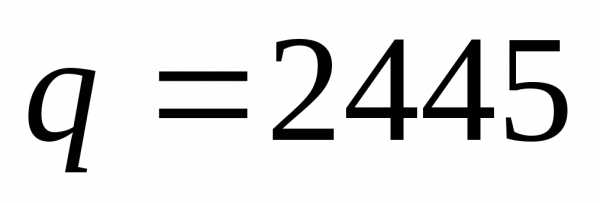 Дж/г.
Дж/г.
Решение.
Из формулы расчета внутренней энергии:и с учетом того, что
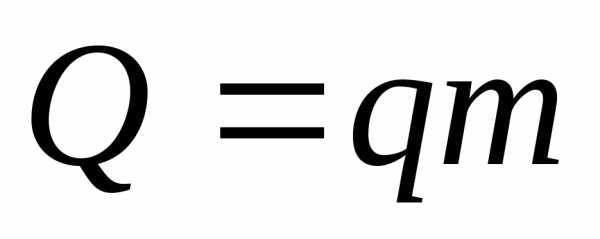 и
и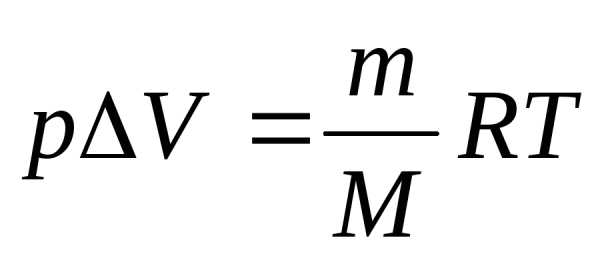 , получаем:кДж.
, получаем:кДж.
Ответ. Внутренняя энергия увеличилась на 230,97 кДж.
Вычисление значение теплового эффекта и определение теплоты образования и сгорания
Задача №3. Определите тепловой эффект реакции образования воды: при постоянном давлении и температуре 298 К, если тепловой эффект при постоянном объеме равен -284,2 кДж/моль.
Решение.
В химических реакциях изменение числа молей равно разности стехиометрических коэффициентов /
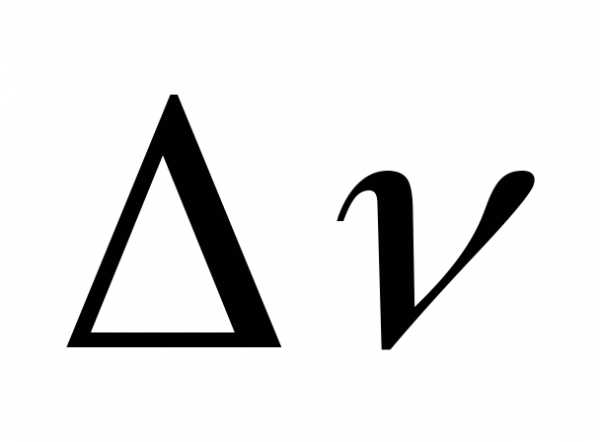 / в уравнении, поэтому, то
/ в уравнении, поэтому, то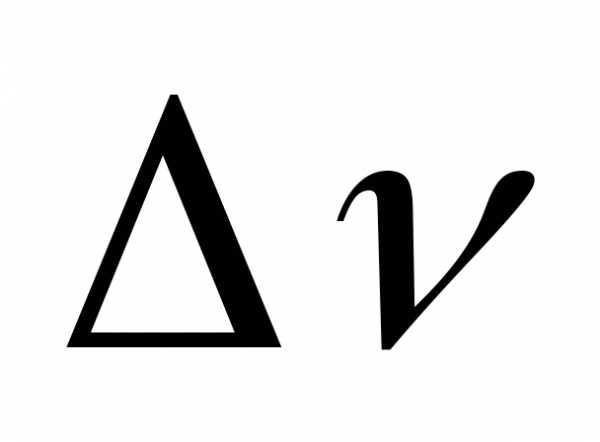 =.Примечание! Если в реакции участвуют твердые и жидкие вещества, то при вычислении
=.Примечание! Если в реакции участвуют твердые и жидкие вещества, то при вычислении  они во внимание не принимаются.
они во внимание не принимаются.Отсюда согласно формуле: = Дж/моль или 291,6 кДж/моль.
Ответ. 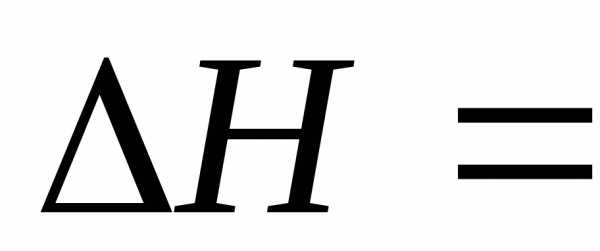 Дж/моль или 291,6 кДж/моль.
Дж/моль или 291,6 кДж/моль.
Задача №4. Определите теплоту образования  по реакции:
по реакции:
Решение.
В основе термохимических расчетов лежит следствие из закона Гесса: . Согласно данному уравнению, тепловой эффект данной реакции является теплотой образования
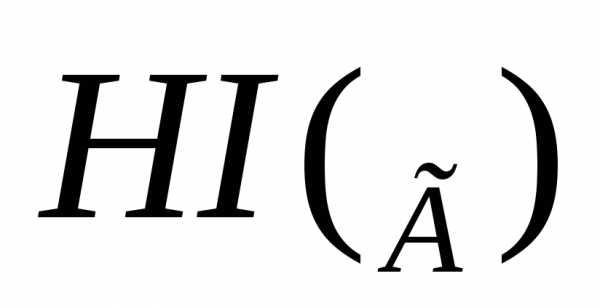 .
.Так как
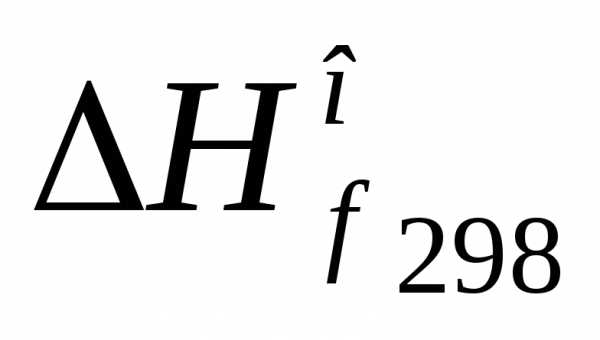
 и
и равны нулю, акДж/моль (табличные данные), то, следовательно,кДж/моль.
равны нулю, акДж/моль (табличные данные), то, следовательно,кДж/моль.
Ответ.кДж/моль.
Задача №5. Рассчитайте стандартный тепловой эффект реакции:постандартным теплотам сгорания.
Решение.
В основе термохимических расчетов лежит следствие из закона Гесса: Тогда:
Из таблиц находят
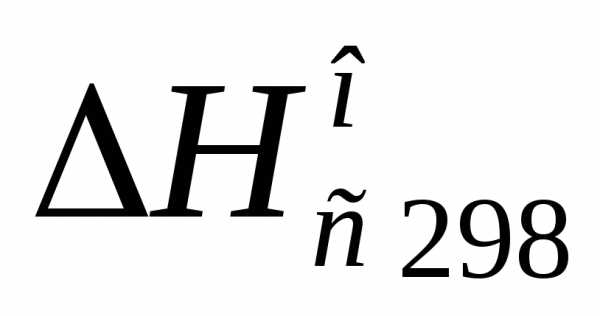 для каждого из участников реакции (в кДж/моль):
для каждого из участников реакции (в кДж/моль):
=-802,32;
Подставляя данные, получим: кДж/моль (реакция эндотермическая).
Ответ.кДж/моль.
Вычисление изменения стандартной энтропии и энергии Гиббса
Задача №6.Предскажите знак изменения энтропии /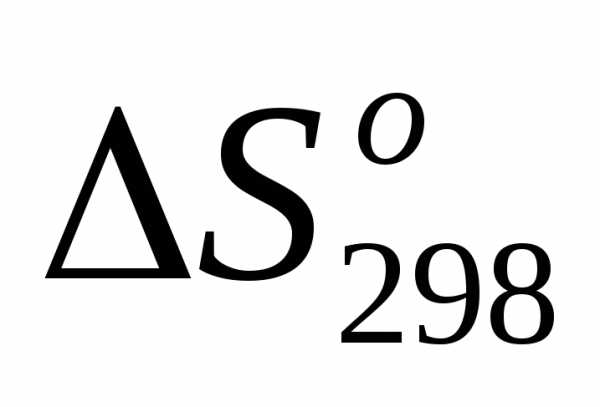 / в каждой из ниже предполагаемых реакций и проверьте правильность сделанных выводов расчетом
/ в каждой из ниже предполагаемых реакций и проверьте правильность сделанных выводов расчетом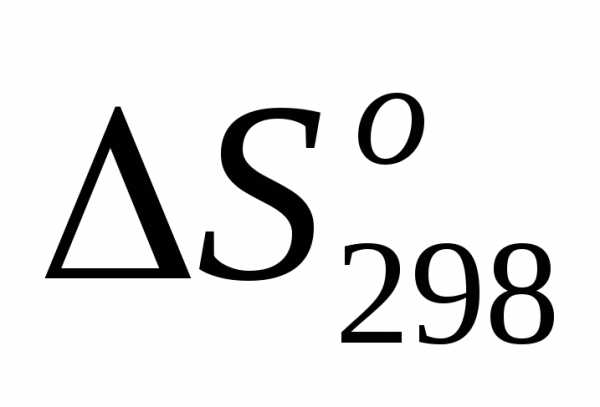 соответствующих реакций, пользуясь справочными данными.
соответствующих реакций, пользуясь справочными данными.
| Реакции | Выводы | |
| 1. |
| |
| 2. |
| |
| 3. |
| |
| 4. | Вероятно, | |
| 5 |
|
Решение.
Выпишем из таблицы (см. приложение) значения
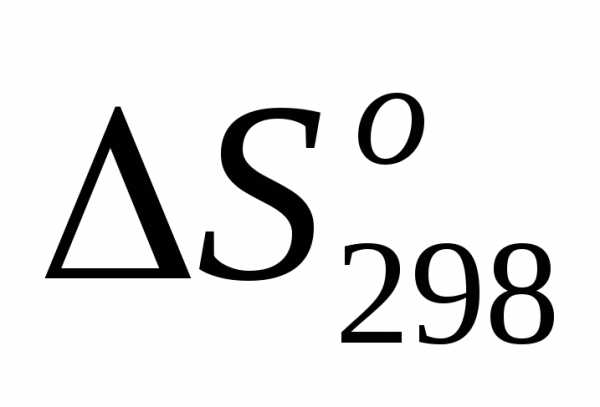 соответствующих веществ и подпишем их под формулами в уравнениях 1- 5 и для данных реакции вычисляем
соответствующих веществ и подпишем их под формулами в уравнениях 1- 5 и для данных реакции вычисляем 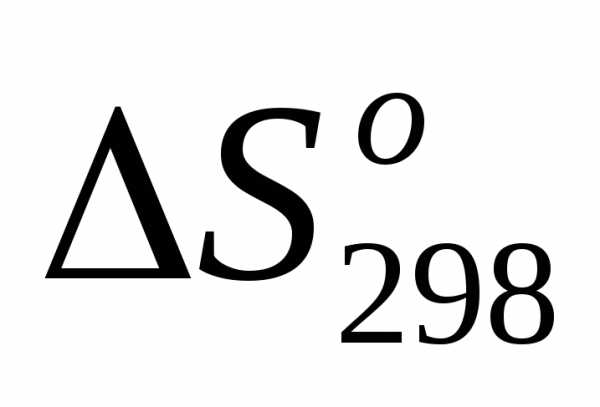 по формуле:.
по формуле:.
1)
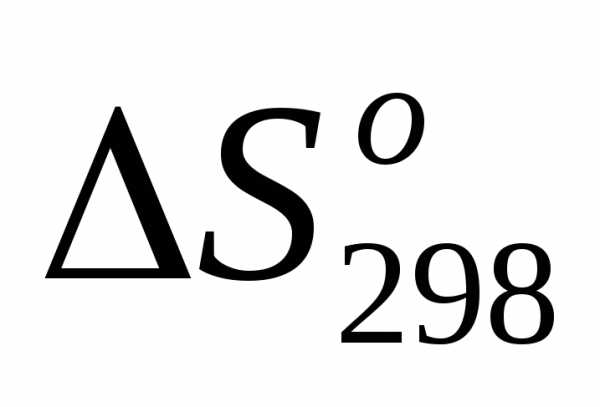 .
.
2)
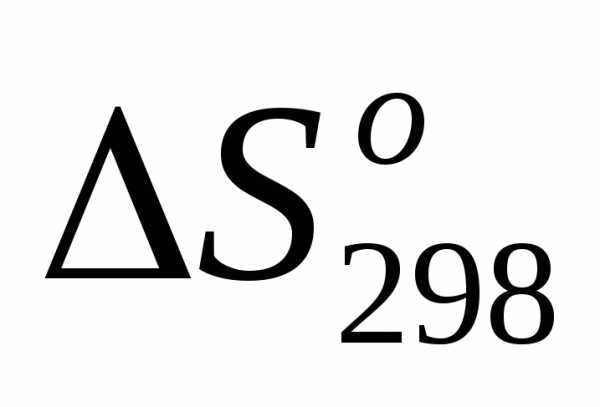 =.
=.
3)
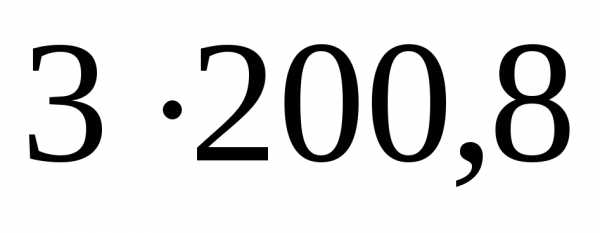
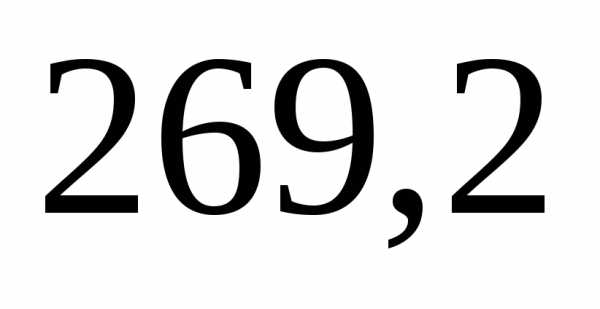
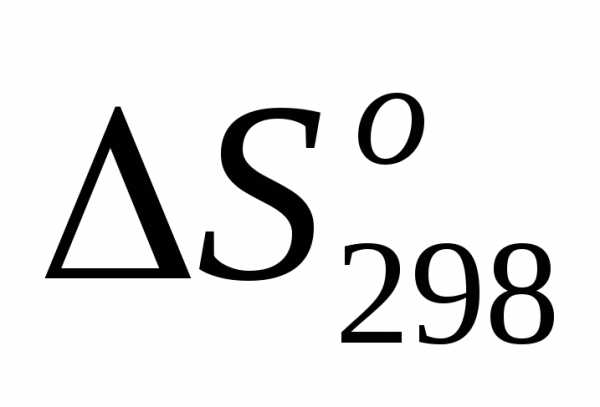 =.
=.
4)
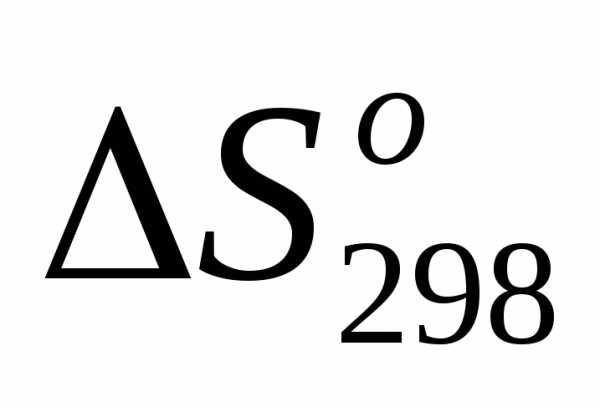 =.
=.
5)
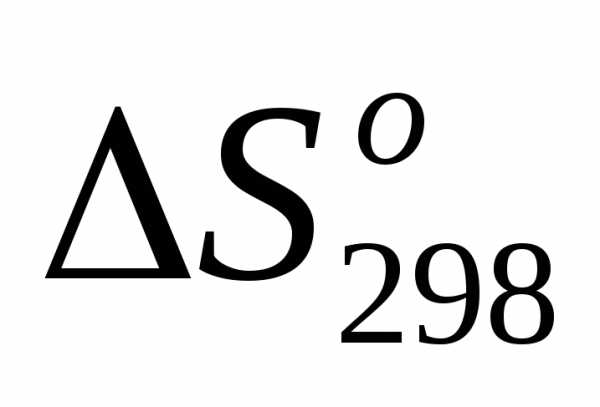 =.
=.
Ответ. Таким образом, результаты вычисления 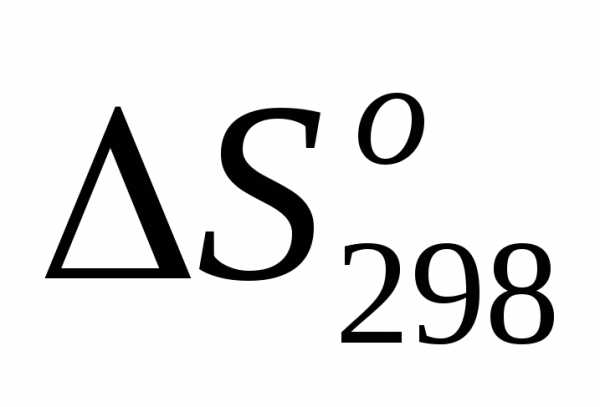 реакций подтвердили выводы, сделанные ранее, т.е.:
реакций подтвердили выводы, сделанные ранее, т.е.:
1)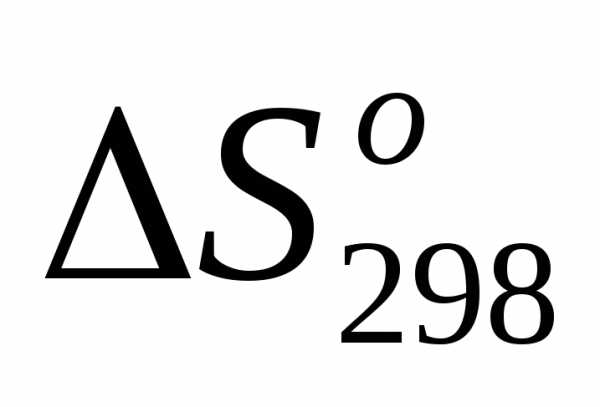 =,т.е.
=,т.е.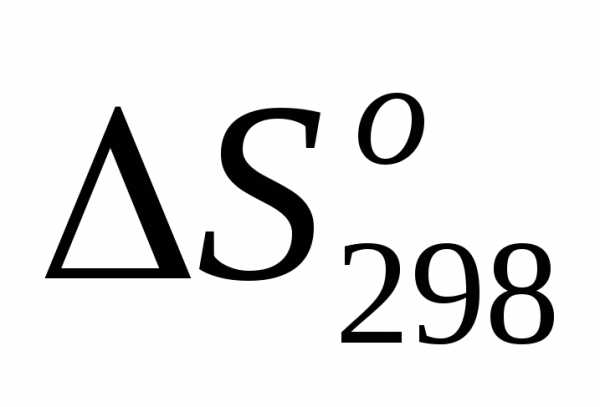 >0;
>0;
2)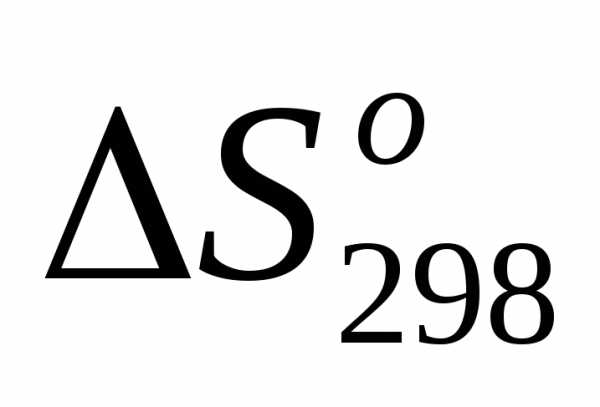 =, т.е.
=, т.е.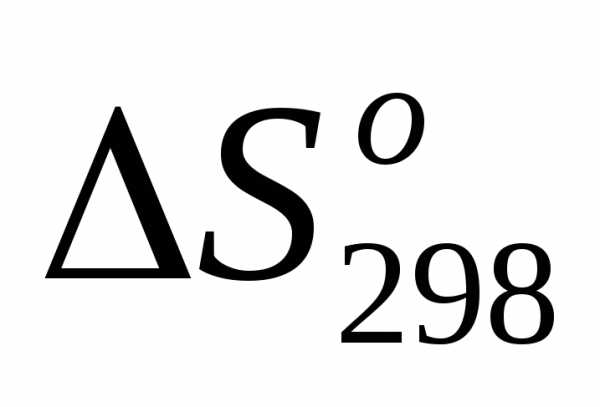 <0;
<0;
3)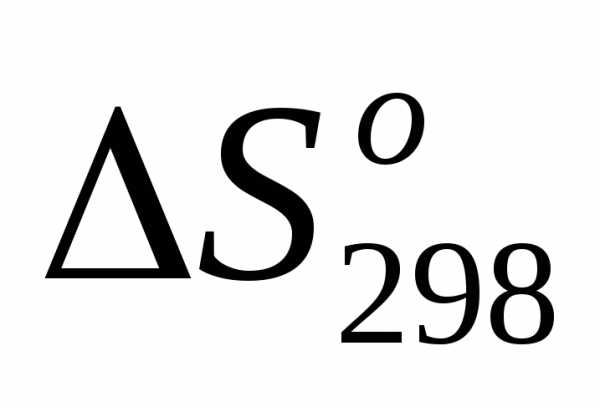 =,т.е.
=,т.е.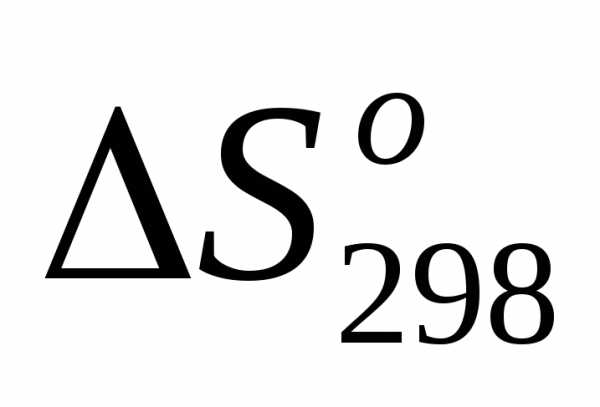 <0;
<0;
4) 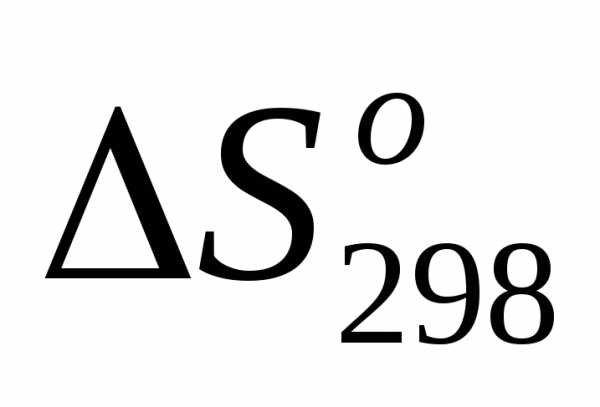 =, т.е.
=, т.е.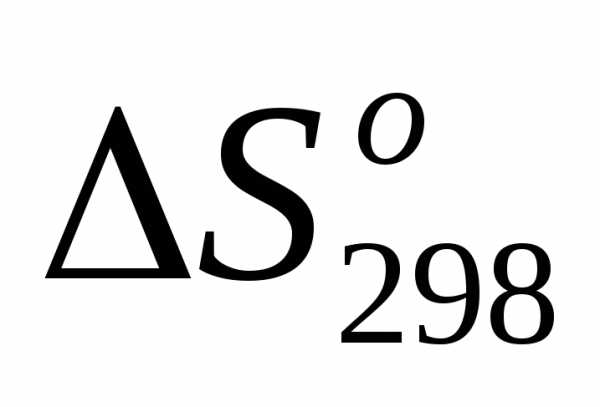 >0;
>0;
5)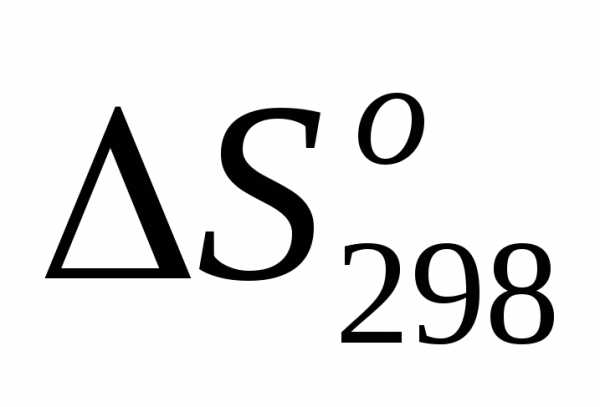 =, т.е.
=, т.е.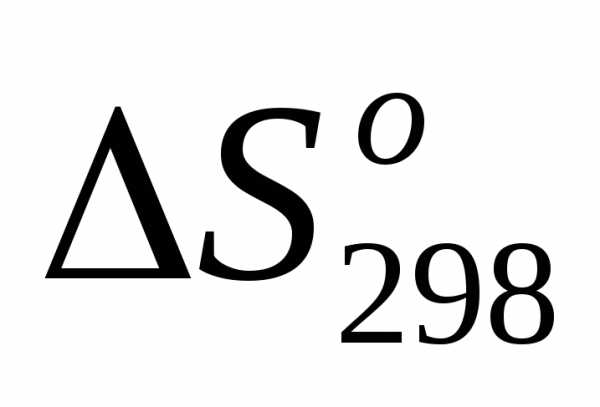 <0.
<0.
Задача №7. Какие из реакций, перечисленных в задаче №6, протекают самопроизвольно при стандартных условиях?
Решение.
По выше найденным данным вычисляем изменения изобарно-изотермического потенциала или свободной энергии Гиббса /
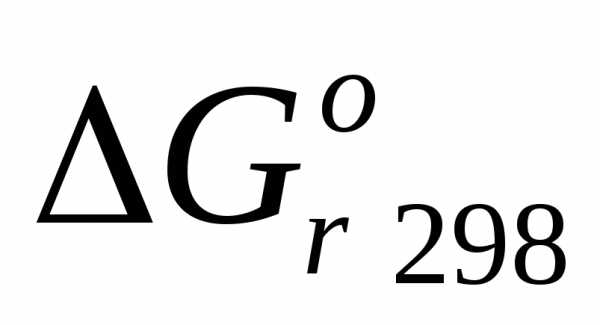 /:
/:Из таблицы выпишем
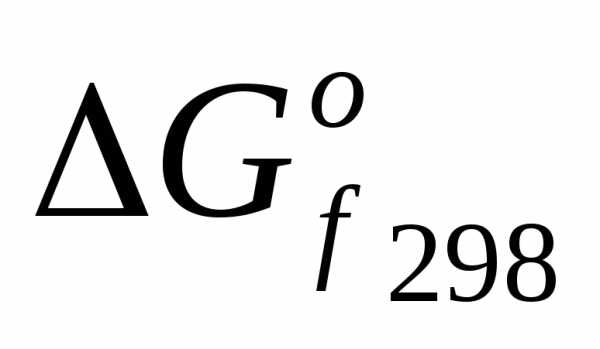 образования соединений и подставляем эти данные для выше соответствующих реакций:
образования соединений и подставляем эти данные для выше соответствующих реакций:
1) 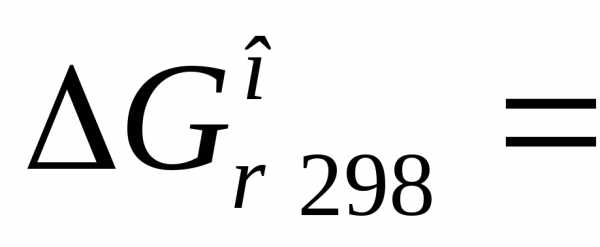 кДж.
кДж.
2) 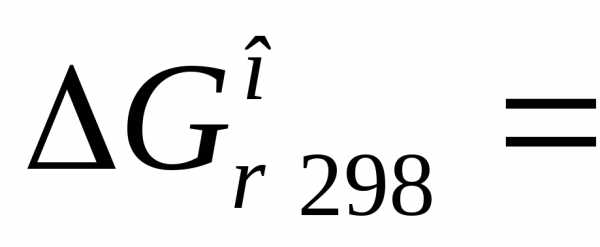 кДж.
кДж.
3) 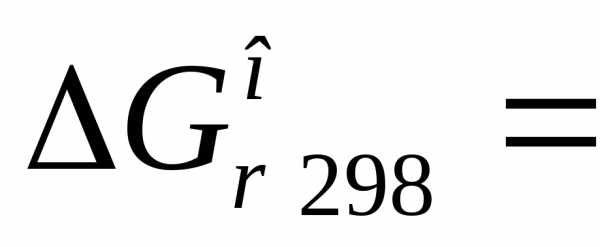 кДж.
кДж.
4) 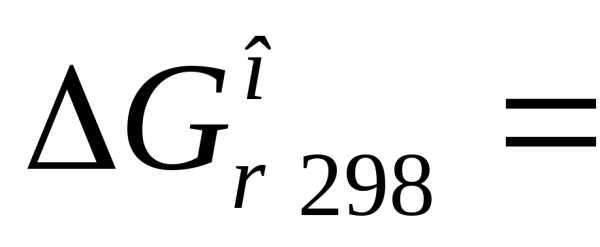 кДж.
кДж.
5) 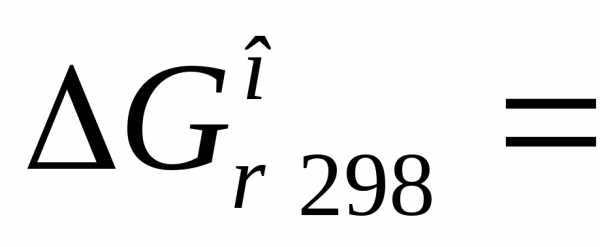 кДж.
кДж.
Ответ. Полученные результаты говорят о том, что реакции 1, 3 и 5 могут протекать в стандартных условиях самопроизвольно до установления равновесия, а реакции 2 и 4 в этих условиях протекать в указанном направлении не могут.
1.2. Ситуационные задачи №№ с 8 по 19 для закрепления материала (выполнить в протокольной тетради).
Задача № 8. Рассчитайте изменение внутренней энергии при испарении 20 г спирта при температуре его кипения, если удельная теплота парообразования спирта 858,95 Дж/г, а удельный объем пара 607 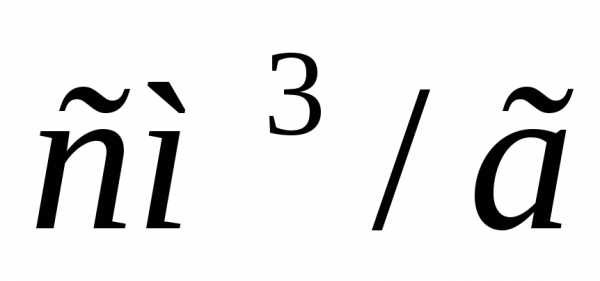 (объем жидкости пренебречь).
(объем жидкости пренебречь).
Задача №9. Определите работу изотермического обратимого расширения 3 моль водяного пара от 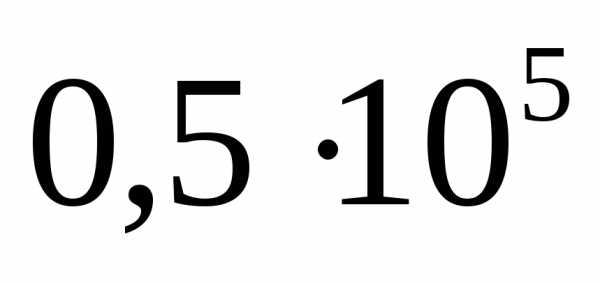 до
до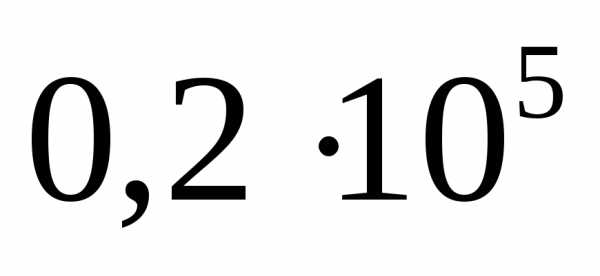 Па при стерилизации ампул с раствором глюкозыпри 330 К.
Па при стерилизации ампул с раствором глюкозыпри 330 К.
Задача № 10. Какая масса ядер грецких орехов может компенсировать половину суточной потребности человека в энергии, равной 6276 кДж, если известно, что в орехах массовая доля жира 64,4%, белка 15.6% и углеводов 12%?
Задача №11. Какое количество работы совершает человек весом 75 кг, взбираясь на памятник Вашингтону высотой 555 футов (1 фут=0,3048 м)? Сколько килокалорий необходимо для этого получить с пищей, если принять, что в механическую работу мышц может быть превращено 25% энергии, выделяющейся при окислении пищи в организме?
Задача №12. Энтальпия сгорания углеводов в организме человека составляет -17,55 кДж/г, белков – 16,72 кДж/г, жиров – 39,29 кДж/г. Среднесуточная потребность в белках, жирах и углеводах для студентов – мужчин составляет соответственно 113 г, 106 г, 451 г, для студентов – женщин 96 г, 90 г, 383 г. Какова среднесуточная потребность студентов в энергии?
Задача №13. Используя значение энтальпий сгорания белков, жиров и углеводов (см. задачу №12) рассчитать энергетическую ценность перловой каши (67 г крупы). В 100 г крупы содержится 9,3 г белков, 1,1 г жиров и 73,7 г углеводов.
Задача №14.Вычислите стандартную энтальпию биохимического брожения глюкозы: , если стандартные энтальпии сгорания глюкозы и этилового спирта равны соответственно -2801,69 и -1366,6 кДж/моль. Определить знак .
.
Задача №15. Рассчитайте тепловой эффект реакции получения этилового эфира аминобензойной кислоты (полупродукта при получении анестезина) при стандартных условиях по уравнению реакции:
если известны стандартные теплоты образования участников реакции:
| Вещество |
|
| -463,2 | |
|
| -273,2 |
| -1759,0 | |
|
| -1068,0 |
|
| 0 |
Задача №16. Рассчитайте тепловой эффект реакции получения газообразного диэтиламиноэтанола (полупродукта при синтезе новокаина) при стандартных условиях по реакции:если известны стандартные теплоты образования участников реакции:
| Вещество |
|
| -81,6 | |
| -48,8 | |
| -341,0 | |
Задача №17. Возможно ли в стандартных условиях реакция: Рассчитайте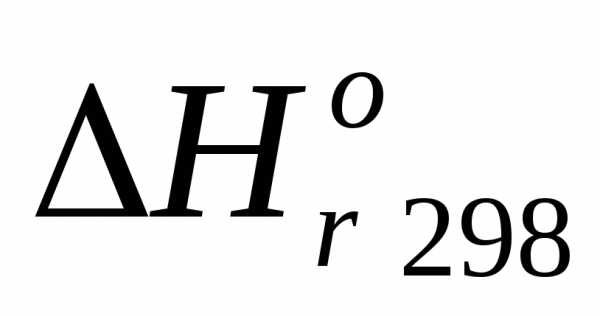 ,
,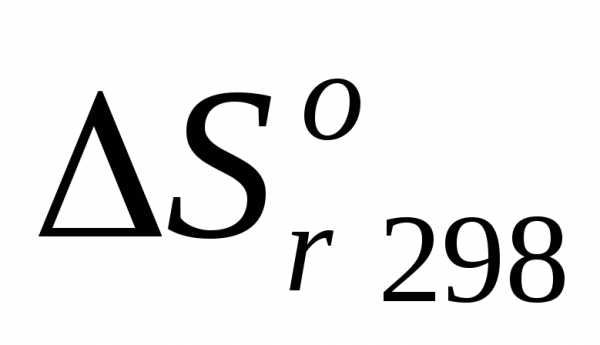 ,
,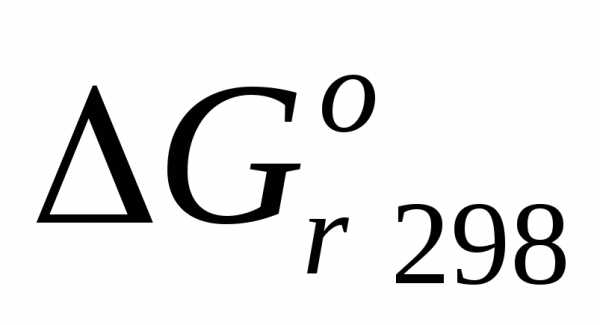 для данной реакции.
для данной реакции.
Задача №18. Возможно ли осуществление процесса восстановления металлического железа из оксида 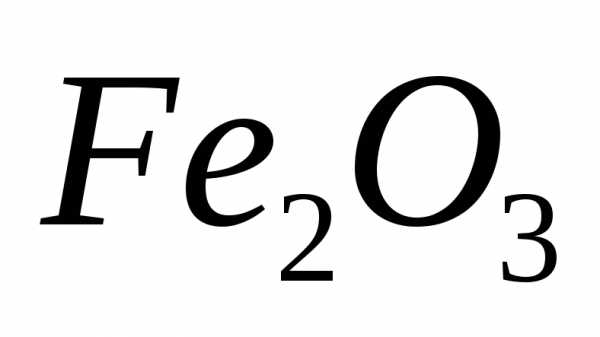 действием водорода при стандартных условиях:
действием водорода при стандартных условиях:
Задача № 19. Как влияет температура на направление реакций 1-5 (см. задачу №6)?
studfiles.net
Примеры решения задач
Пример 1.
В результате реакции, термохимическое уравнение которой:
4NO2 + O2 = 2N2O5 + 109,4 кДж
выделилось 27350 Дж теплоты. Рассчитать массу затраченного кислорода и объем израсходованного оксида азота (IV) (при н.у.).
Решение:
Выделение или поглощение теплоты в ходе реакции происходит в строго эквивалентных количествах, поэтому:
При участии 4 моль NO2 выделяется 109400 кДж теплоты,
А при участии х моль NO2 - 27350 кДж теплоты:
Отсюда х равен: х = 4∙27350/109400 = 1 моль.
Объем оксида азота (IV) при н.у. может быть найден по формуле: V = ∙ Vm.
V(NO2) = 1 ∙ 22,4 = 22,4 л.
Составим пропорцию для нахождения массы кислорода:
1 моль О2 – 109400 кДж теплоты;
х моль О2 – 27350 кДж теплоты.
Отсюда: х = 1 ∙ 27350 / 109400 = 0,25 моль.
Масса кислорода: m(O2) = ∙ M = 0,25 ∙ 32 = 8 г.
Ответ: Масса затраченного кислорода равна 8 г, а объем оксида азота 22,4 л.
Пример 2.
Рассчитать стандартную энтальпию сгорания этанола, если известно, что при сгорании 4,6 г спирта выделяется 137 кДж теплоты.
Решение:
Тепловой эффект реакции (теплота) и энтальпия равны по значению, но притивоположны по знаку, следовательно, энтальпия сгорания 4,6 г спирта составляет -137 кДж.
По определению, стандартная энтальпия сгорания, это энтальпия сгорания 1 моль вещества. Определим, сколько моль составляет 4,6 г спирта:
= m / M = 4,6 / 46 = 0,1 моль.
Составим пропорцию:
Энтальпия сгорания 0,1 моль составляет -137 кДж;
А энтальпия сгорания 1 моль - х кДж;
Отсюда: х = 1 ∙ (-137) / 0,1 = -1370 кДж.
Ответ: - 1370 кДж/моль.
Пример 3.
При образовании 134 г СО2 выделилось 787 кДж теплоты. Определить стандартную энтальпию сгорания углерода.
Решение:
Образование углекислого газа и сгорания углерода до высшего оксида – это одна и та же реакция:
С + О2 = СО2,
энтальпия которой и является стандартной энтальпией сгорания С и стандартной энтальпией образованияСО2.
Поэтому определим по имеющимся данным стандартную энтальпию образования СО2, т.е. энтальпию образования 1 моль СО2. Учтем, что энтальпия и тепловой эффект реакции равны по величине, но противоположны по знаку.
Рассчитаем количество вещества СО2: = m / M = 134 / 44 = 3 моль.
Составим пропорцию:
Энтальпия образования 3 моль СО2 составляет -787 кДж,
а энтальпия образования 1 моль СО2 – х кДж;
Отсюда: х = 1 ∙ (-787) / 3 = -262,3 кДж.
Ответ: Энтальпия сгорания С равна - 262,3 кДж/моль.
Пример 4.
Определить тепловой эффект реакции синтеза диэтилового эфира, применяемого в медицине для наркоза, при 298К;
2С2Н5ОН(ж) = С2Н5ОС2Н5(ж) + Н2О (ж),
если известны стандартные энтальпии сгорания веществ, участвующих в реакции:
ΔН0с (С2Н5ОС2Н5(ж)) = -2727 кДж/моль;
ΔН0с (С2Н5ОН(ж)) = -1371 кДж/моль;
ΔН0с (Н2О(ж)) = 0 кДж/моль.
Решение:
Используя второе следствие из закона Гесса, получим:
ΔН0r = [2ΔН0с (С2Н5ОН(ж))] - [ΔН0с (С2Н5ОС2Н5(ж)) + ΔН0с (Н2О(ж))] = [2(-1371)] - [(-2727) + 0] = - 15 кДж/моль.
Ответ:ΔН0r= - 15 кДж/моль – процесс экзотермический.
Пример 5.
Вычислить энергию Гиббса тепловой денатурации трипсина при 50С, еслиН0298= 283 кДж/моль,S0298= 288 Дж/моль∙К. Протекает ли эта реакция в данных условиях? Считать, что энтальпия и энтропия в данном интервале температур являются постоянными.
Решение:
Согласно уравнению Гиббса – Гельмгольца: G0T=Н0T-TS0T:
G0323= 283 кДж/моль - 323∙288∙10-3кДж/моль = 190 кДж/моль.
Ответ:G0323= 190 кДж/моль > 0, реакция самопроизвольно не протекает.
studfiles.net
Расчет стандартных тепловых эффектов химических реакций по стандартным теплотам образования веществ, участвующих в реакции
Стандартной теплотой образования (энтальпией образования) вещества называется энтальпия реакции образования 1 моля этого вещества из элементов (простых веществ, то есть состоящих из атомов одного вида), находящихся в наиболее устойчивом стандартном состоянии. Стандартные энтальпии образования веществ 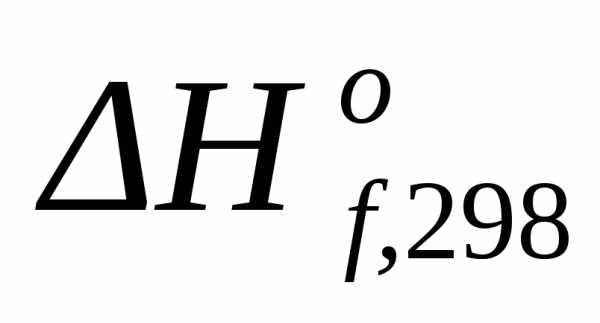 (кДж/моль) приводятся в справочниках. При использовании справочных значений необходимо обращать внимание на фазовое состояние веществ, участвующих в реакции. Энтальпия образования наиболее устойчивых простых веществ равна 0.
(кДж/моль) приводятся в справочниках. При использовании справочных значений необходимо обращать внимание на фазовое состояние веществ, участвующих в реакции. Энтальпия образования наиболее устойчивых простых веществ равна 0.
Следствие из закона Гесса о расчете тепловых эффектов химических реакций по теплотам образования: стандартный тепловой эффект химической реакции равен разности теплот образования продуктов реакции и теплот образования исходных веществ с учетом стехиометрических коэффициентов (количества молей) реагентов:
. (1.17)
П р и м е р 1.2. Рассчитать стандартный тепловой эффект и изменение внутренней энергии при прохождении следующей реакции при P = const:
Ch5 + 2 CO = 3 C(графит) + 2 h3O.
газ газ тв. газ
Теплоты образования веществ в указанных фазовых состояниях приведены в табл. 1.2.
Таблица 1.2
Теплоты образования веществ
| Вещество | Ch5 (газ) (метан) | CO (газ) | C (графит) | h3O (газ) |
| Количество молей | 1 | 2 | 3 | 2 |
| | –74,85 | –110,53 | 0 | –241,81 |
Р е ш е н и е
Так как реакция проходит при P = const, то стандартный тепловой эффект находим в виде изменения энтальпии по известным теплотам образования по следствию из закона Гесса (формула (1.17):
ΔНо298 = { 2 · (–241,81) + 3·0} – {–74,85 + 2 · (–110,53)} = –187,71 кДж = = –187710 Дж.
ΔНо298 < 0, реакция является экзотермической, протекает с выделением теплоты.
Изменение внутренней энергии находим на основании уравнения (1.16):
ΔUо298 = ΔHо298 – Δν · RT.
Для данной реакции изменений числа молей газообразных веществ за счет прохождения химической реакции Δν = 2 – (1 + 2) = –1; Т = 298 К, тогда
ΔUо298 = –187710 – (–1) · 8,314· 298 = –185232 Дж.
Расчет стандартнвх тепловых эффектов химических реакций по стандартным теплотам сгорания веществ, участвующих в реакции
Стандартной теплотой сгорания (энтальпией сгорания) вещества называется тепловой эффект полного окисления 1 моля данного вещества (до высших оксидов или специально указываемых соединений) кислородом при условии, что исходные и конечные вещества имеют стандартную температуру. Стандартные энтальпии сгорания веществ 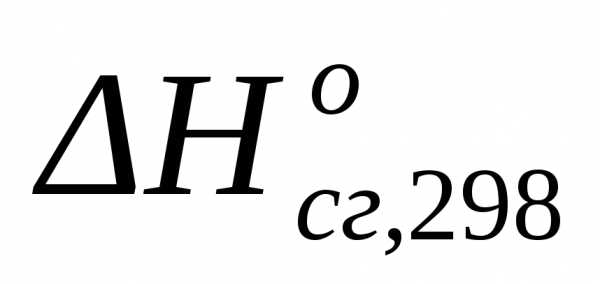 (кДж/моль) приводятся в справочниках. При использовании справочной величины необходимо обратить внимание на знак величины энтальпии реакции сгорания, которая всегда является экзотермической (ΔH <0 ), а в таблицах указаны величины .
(кДж/моль) приводятся в справочниках. При использовании справочной величины необходимо обратить внимание на знак величины энтальпии реакции сгорания, которая всегда является экзотермической (ΔH <0 ), а в таблицах указаны величины . Энтальпии сгорания высших оксидов (например, воды и диоксида углерода) равны 0.
Энтальпии сгорания высших оксидов (например, воды и диоксида углерода) равны 0.
Следствие из закона Гесса о расчете тепловых эффектов химических реакций по теплотам сгорания: стандартный тепловой эффект химической реакции равен разности теплот сгорания исходных веществ и теплот сгорания продуктов реакции с учетом стехиометрических коэффициентов (количества молей) реагентов:
. (1.18)
П р и м е р 1.3. Рассчитать стандартный тепловой эффект реакции получения этилового спирта гидратацией этилена по теплотам сгорания веществ, участвующих в данной реакции (P=const):
C2h5 + h3O = С2Н5ОН.
газ ж ж
studfiles.net
Занятие 4
Министерство здравоохранения Республики Беларусь
Учреждение образования
«Гомельский государственный медицинский университет»
Кафедра общей и биоорганической химии
Обсуждено на заседании кафедры 31.08.2016 Протокол № 11
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
для проведения занятия со студентами I курса
лечебного факультета и ФПСЗС по общей химии
Тема: Химическая термодинамика и биоэнергетика
Время: 3 часа
1. УЧЕБНЫЕ И ВОСПИТАТЕЛЬНЫЕ ЦЕЛИ:
ознакомить с выполнением термодинамических расчетов важнейших термодинамических функций: ΔH, ΔS, ΔG; а также термохимических расчетов тепловых эффектов по стандартным теплотам образования и сгорания веществ;
научить применять термодинамические методы для определения калорийности пищевых продуктов и составления диет и оценивать возможность самопроизвольного протекания процессов;
научить рассчитывать константы химического равновесия: Кс, Кр, Ка, Кb, Кгидр.
МОТИВАЦИЯ ДЛЯ УСВОЕНИЯ ТЕМЫ:
Химическая термодинамика представляет раздел физической химии, изучающий законы взаимных превращений различных видов энергии, связанных с переходом энергии между телами в форме теплоты и работы. Она является теоретической основой биоэнергетики – науки о превращениях энергии в живых организмах и специфических особенностях превращения одних видов энергии в другие в процессе жизнедеятельности.
В живом организме существует тесная связь между процессами обмена веществ и энергии. Обмен веществ является источником энергии всех жизненных процессов. Осуществление любых физиологических функций (движение, поддержание постоянства температуры тела, выделение пищеварительных соков и т.д.) требует затраты энергии. Источником всех видов энергии в организме являются питательные вещества (белки, жиры, углеводы), потенциальная химическая энергия которых в процессе обмена веществ превращается в другие виды энергии. Применение термодинамических методов дает возможность количественно оценить энергетику структурных превращений белков, нуклеиновых кислот, липидов и биологических мембран.
В практической деятельности врача термодинамические методы наиболее широко используются для определения интенсивности основного обмена при различных физиологических и патологических состояниях организма, а также для определения калорийности пищевых продуктов.
ТРЕБОВАНИЯ К ИСХОДНОМУ УРОВНЮ ЗНАНИЙ:
а) понятие о теплоте химических реакций;
б) экзо- и эндотермические реакции.
В результате проведения занятия студент должен:
1) знать:
основные понятия термодинамики: термодинамические системы и их классификации, термодинамические параметры и процессы, энергия и работа;
формулировку и математическое выражение первого закона термодинамики для различных типов термодинамических систем;
понятие об энтальпии, и ее физический смысл;
понятие о тепловых эффектах химических реакций, теплотах образования и сгорания химических соединений, закон Гесса как следствие первого закона термодинамики;
калорийность питательных веществ (белков, жиров, углеводов), понятие о диетологии;
понятие о самопроизвольных и несамопроизвольных, обратимых и необратимых процессах;
второй закон термодинамики: постулаты и математическую формулировку (неравенство Клаузиуса), понятие об энтропии и энтропийном факторе реакции;
понятие о свободной энергии Гиббса как критерии равновесия и возможности самопроизвольного протекания процесса, способы расчета ΔrG;
понятие о химическом равновесии, константах равновесия (Кс и Кр), связь константы равновесия со стандартным изменением свободной энергии Гиббса; принцип смещения химического равновесия Ле Шателье.
2) уметь:
решать расчетные задачи, используя первый и второй законы термодинамики;
решать расчетные задачи, используя закон Гесса.
2. СВЯЗЬ СО СМЕЖНЫМИ ДИСЦИПЛИНАМИ:
Полученные знания, умения и навыки потребуются студентам лечебного факультета при изучении курсов биохимии, фармакологии и физиологии. Кроме того, они будут востребованы при изучении ряда клинических дисциплин. Умение выполнять термохимические и термодинамические расчеты может быть использовано при изучении медицинской физики, основ здорового образа жизни и питания (диетологии).
3. КОНТРОЛЬНЫЕ ВОПРОСЫ ПО ТЕМЕ ЗАНЯТИЯ:
3.1 Термодинамическая система. Термодинамические параметры состояния. Первый закон термодинамики. Внутренняя энергия системы. Теплота и работа. Энтальпия.
3.2 Термохимия. Тепловые эффекты химических реакций. Закон Гесса как следствие первого закона термодинамики. Теплоты образования химических соединений. Стандартные теплоты образования. Теплоты сгорания. Стандартные теплоты сгорания. Калорийность питательных веществ. Термохимия как основа диетологии.
3.3 Характеристики процессов: самопроизвольные и несамопроизвольные; обратимые и необратимые. Второй закон термодинамики: формулировки и математическое выражение (неравенство Клаузиуса). Энтропия. Термодинамическое и статистическое толкование энтропии. Уравнение Больцмана.
3.4 Свободная энергия Гиббса как критерий равновесия и возможности самопроизвольного протекания процессов в закрытых системах в изобарно-изотермических условиях. Способы расчета ΔrG.
4. ХОД ЗАНЯТИЯ:
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Математические формулировки Частные случаи I-го закона
I-го закона
1. Для изолированных систем: 1. Процесс протекает при
Δu = Q (1) T, V = const
где u – внутренняя энергия, кДж/моль – QV = Δu (4)
функция состояния 2. Процесс протекает при
T, p = const
2. Для закрытых систем: Qp = ΔH (5)
Δu = Q – pΔV – A´ (2) Н – энтальпия, кДж/моль –
Q – теплота, кДж/моль функция состояния.
pΔV – работа расширения Физический смысл энтальпии:
А´ – полезная работа, кДж/моль а) внутренняя энергия расширен-
функции процесса ной системы
3. Для открытых систем: б) теплосодержание
Δu = Q – pΔV – A´ + μΔν (3) в) ΔН – тепловой эффект изобар-
μ – химический потенциал ной реакции
Δν – количество вещества, вводимого
в систему
Термохимия
ΔгН – теплота реакции aA + bB → cC + dD
ΔгНо298 – стандартная теплота реакции ΔrH= (сΔfH(C) + dΔfH(D) –
ΔfHo298 – стандартная теплота образо- – (aΔfH(A) + bΔfH(B)) (6)
вания химического соединения ΔrН= (aΔсгH(A) + bΔсгH(B)) –
ΔсгHo298 – стандартная теплота – (cΔсгH(C) + dΔсгH(D))
сгорания
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Математические формулировки Свободная энергия Гиббса
II закона
Неравенство Клаузиуса ΔrG– свободная энергия химической реакции
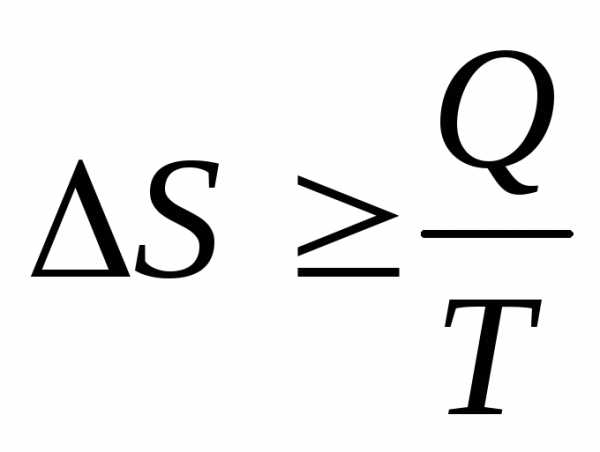 (1) ΔfG – свободная энергия образования
(1) ΔfG – свободная энергия образования
S – энтропия, Дж/моль.К химических веществ, кДж/моль
So298 – стандартная энтропия ΔfGo298 – стандартная свободная энер-
2. Формула Больцмана гuя образования, кДж/моль
S = klnW (2) Вычисления ΔгG химических реакций:
3. Расчет энтропийного фактора 1) ΔrG = ΔrH– T ΔrS
химической реакции: 2) Для условной реакции:
аА + bB → cC + dD ΔrG=cΔfG(C)+dΔfG(D)–aΔfG(A)–bΔfG(B)
ΔrS= (cS(C) + dS(D)) – (aS(A) + bS(B))
5. вопросы ДЛЯ САМОконтроля знаний:
1. Вычислите тепловой эффект биохимического процесса брожения глюкозы:
C6h22O6 → 2 C2H5OH + 2 CO2(г),
если теплоты сгорания глюкозы и этилового спирта соответственно равны:
–2816 кДж/моль и –1236 кДж/моль.
Решение: в соответствии со следствием из закона Гесса тепловой эффект реакции равен:
ΔrH = ΔкрH(C6h22O6) – 2ΔкрH(C2H5OH) = –2816 –2(–1236) = –314 (кДж)
Данная реакция является экзотермической, т.е. протекает с выделением тепла.
2. Рассчитайте тепловой эффект реакции получения этилового эфира аминобензойной кислоты (полупродукта при получении анестезина) при стандартных условиях по уравнению реакции:
4 С2H5OCOC6h5NO2(ж) + 9 Fe + 4 h3O(ж) → 4 C2H5OCOC6h5Nh3(ж) + 3 Fe3O4,
если известны стандартные теплоты образования участников реакции:
Вещество: ΔfHo298, кДж/моль
C9H9O4N(ж) –463,2
h3O(ж) –273,2
C9h21NO2(ж) –1759,0
Fe3O4 –1068,0 Ответ: –7294,4 кДж
3. Теплота сгорания бензойной кислоты C6H5COOH равна –3227,5 кДж/моль. Теплоты образования воды и диоксида углерода при тех же условиях соответственно равны –285,8 и –393,5 кДж/моль. Вычислите теплоту образования C6H5COOH.
Ответ: –384,4 кДж/моль
4. Дайте заключение о возможности самопроизвольного протекания химической реакции при Т = 298 К.
молочная кислота пировиноградная кислота
по следующим данным:
Вещество: ΔfHo298, кДж/моль So298, Дж/К·моль
молочная кислота –673 192
пировиноградная кислота –586 179
Н2 – 130
Решение: 1) Рассчитаем ΔrHо298 по следствию из закона Гесса:
(Реакция эндотермична)
2) Рассчитываем энтропийный фактор реакции (ΔrSo298):
(Рост беспорядка в системе)
3) Рассчитаем ΔrGo298 по уравнению: ΔG = ΔH – ТΔS
ΔrGo298 = 87 – 298 (0,117) = 52 кДж (ΔG > 0)
Ответ: данная реакция в стандартных
условиях самопроизвольно не протекает
5. Не производя вычислений, установите знак ΔS следующих процессов:
а) 2 Nh4(г) → N2(г) + 3 h3(г)
б) CO2(тв) → CO2(г)
в) 2 NO(г) + O2(г) → 2 NO2(г)
г) 2 h3S(г) + 3 O2(г) → 2 h3O(ж) + 2 SO2(г)
д) 2 Ch4OH(г) + 3 O2(г) → 4 h3O(г) + 2 CO2(г)
6. Недавними измерениями величин ΔH и ΔG для гидролиза АТФ было показано, что при 36оС и физиологических значениях рН они равны соответственно –4800 и –7000 ккал/моль. Вычислите величину ΔS для тех же условий. Каков смысл того, что ΔS имеет положительное значение?
Ответ: 7,12 ккал/моль К
6. ЛИТЕРАТУРА
ОСНОВНАЯ:
1. Конспект лекций;
2. Ершов, Ю.А. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для мед. спец. вузов /Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др.; под ред. Ю.А. Ершова. – М.: Высш. шк., 2005. – С. 10–42;
3. Барковский, Е.В. Введение в химию биогенных элементов и химический анализ: учеб. пособие для мед. вузов / Е.В. Барковский; под ред. Е.В. Барковского. – Мн., 1997.– С. 6–54.
ДОПОЛНИТЕЛЬНАЯ:
1. Ершов, Ю.А. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов/ Ю.А. Ершов, В.А. Попков; под ред. Ю.А. Ершова. – М.: Высшая школа, 1993. – С. 17–31;
2 Суворов, А.В., Общая химия: Учебное пособие для вузов / А.В. Суворов, Никольский А.Б.– СПб: Химия, 1994. – С. 107–126;
3. Уильямс, В. Физическая химия для биологов/ В. Уильямс, Х. Уильямс – М., 1976 г. – С. 58–123.
Авторы: Зав. кафедрой, доцент, к.х.н. Лысенкова А.В., доцент, к.х.н. Филиппова В.А., ст. преподаватели Чернышева Л.В., Одинцова М.В., Довнар А.К., ассистенты Перминова Е.А., Прищепова И.В., Зыкова Е.Л.
31.08.2016
6
studfiles.net
Задачи для самостоятельной работы
Поиск Лекций1. Сжигание 1 моль глюкозы при 298 К и 101,325 кПа дает 2801,69 кДж тепла.
C6h22O6(т) + 6O2(г) 6CO2(г) + h3O(г)
Рассчитать стандартную теплоту образования глюкозы, т.е. тепловой эффект реакции
6C(гр) + 6h3 + 3O2 C6h22O6
2. При сгорании 1 г бензойной кислоты в калориметре постоянного объема по данным эксперимента, выделилось 26,4 кДж теплоты:
2C6H5COOH(т) + 15O2(г) 14CO2(г) + h3O(ж)
Определить мольную теплоту сгорания бензойной кислоты при 300 К и 101,325 кПа.
3. Теплота сгорания сахарозы по реакции (1) 5650 кДж/моль
C12h32O11(т) + 12O2(г) 12CO2(г) + 11h3O(г) (1)
Теплота сгорания водорода (2) 393 кДж/моль
h3 + 0,5O2 h3O(ж) (2)
Вычислить теплоту образования сахарозы. Вывести общую формулу расчета теплот образования из теплот сгорания.
4. По тепловым эффектам реакций определить расход теплоты на разложение 5 кг карбоната натрия на оксид натрия Na2O и оксид углерода CO2:
Na2O3 + SiO2 = Na2SiO3 + CO2; ΔH0298 = 81,3кДж
Na2O + SiO2 = Na2SiO3 ΔH0298 = –243,5 кДж
5. Интегральная теплота растворения соли Nh5Cl ΔHраств=15,11 кДж/моль. При растворении 1,473 г соли в 528,5 г воды температура понизилась на 0,174 0. Удельная теплоемкость раствора 4,11 Дж/г·град. Определить тепловую константу калориметра.
6. Интегральная теплота растворения MgSO4 для 0,14 моляльного раствора ΔH0раств = –85,06 кДж/моль. Теплота гидратации соли по уравнению
MgSO4 + 7h3O = MgSO4·7h3O
Составляет ΔH0гидр = –101,2 кДж/моль. Определить теплоту растворения кристаллогидрата.
7. Рассчитать тепловой эффект получения этилового эфира аминобензойной кислоты (полупродукта при получении анестезина) при стандартных условиях по уравнению реакции
4C2H5O–CO–C6h5NO2 + 9Fe + 4h3О = 4C2H5O–CO–C6h5Nh3 + 3Fe3O4
| ΔH, кДж/моль | |||
| C9H9NO4 | h3O(ж) | C9h21NO2 | Fe3O4 |
| -463,2 | -285,8 | -1759,0 | -1068 |
8. Константа равновесия ферментативного превращения L-аспартата с образованием фумарата и иона аммония при 39 °С равна 1,6·10–2, а при 29 °С равна 0,74·10–2. Вычислите ΔH0 и ΔG0 реакции в этом температурном интервале.
9. Определить тепловой эффект химической реакции при 323 К, приняв, что теплоемкость участников реакции не зависит от температуры (ΔCp= const = ΔC298).
4Nh4(г)+3O2(г)=2N2(2)+6h3O(г)
10. Рассчитать изменение изобарно-изотермического потенциала при 500 К в трех приближениях для реакции:
CO(г) + 3h3(г) = Ch5(г) + h3O (г)
11. Для реакции гидролиза АТФ при 36 °С и физиологических значениях рН ΔH0 = 2,01·103 кДж/моль, ΔG0 = 29,33·103 кДж/моль. Вычислите ΔS0 для тех же условий. Каков смысл того, что ΔS0 имеет положительное значение?
12. Константа равновесия реакции (1) при 500 К равна Kp = 2,96·105 (н/м2)–3. Определить степень диссоциации при этой температуре, если общее давление равно 8,14·10-5 н/м2.
PCl3 + Cl2 PCl5
13. Константа диссоциации N2O4 по уравнению
N2O4 2NO2
при 50 °С равна 0,797·105 н/м2. Определить направление процесса при следующих значениях парциальных давлений компонентов. Р= 1,013·105 н/м2. .Р= 1,013·105 н/м2.
Варианты заданий для домашней контрольной работы
| Вариант | Реакция | Т1, К | Т2, К | Т3, К |
| СО(г) + 2Н2(г) = СН3ОН(г) | ||||
| 4НС1 + О2 = 2Н2О(г) + 2Сl2 | ||||
| 2C2H5OH = C4H6(г) + 2Н2O(г) + h3 | ||||
| 2N2 + 6Н2О(г) = 4NН3 + 3O2 | ||||
| Ch5 + Nh4 = HCN + 3h3 | ||||
| 4NO + 6h3O = 4Nh4 + 5O2 | ||||
| С6Н6(г) +3Н2 = C6h22 | ||||
| 2NO2 = 2NO + O2 | ||||
| Ch4CHO(г) + h3 = C2H5OH(г) | ||||
| 2SО2 + O2 = 2SО3 | ||||
| SO2 + Cl2 = SОCl2(г) | ||||
| СО(г) + 3Н2(г) = СН4(г) + Н2О(г) | ||||
| СО(г) + Сl2(г) = СОС12(г) | ||||
| СO2(г) + Н2(г) = СО + Н2О(г) | ||||
| CO2(г) + 4h3(г) = Сh5(г) + 2Н2O(г) | ||||
| 2Н2(г) + 2СO2(г) = 2СO(г) + 2Н2O(г) | ||||
| СН4(г) + СO2(г) =2СО+2Н2 | ||||
| С2Н6(г) = С2Н4 + Н2 | ||||
| C2H5OH(г) = C2h5(г)+ h3O(г) | ||||
| СО2(г) + 3Н2(г) = СН3ОН(г) + Н2O(г) |
Методики лабораторных работ
Лабораторная работа №1
Определение интегральной теплоты растворения соли
Рекомендуемые страницы:
poisk-ru.ru

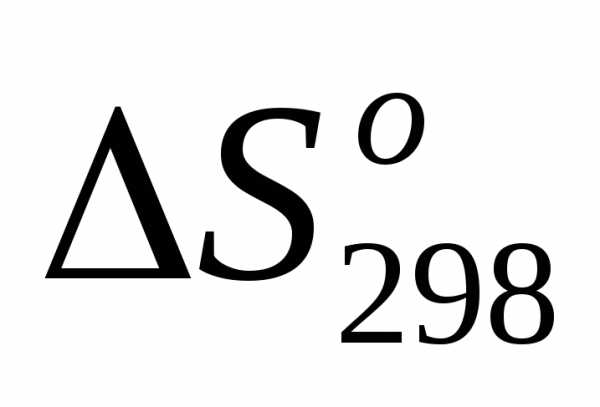 первой реакции больше нуля /
первой реакции больше нуля /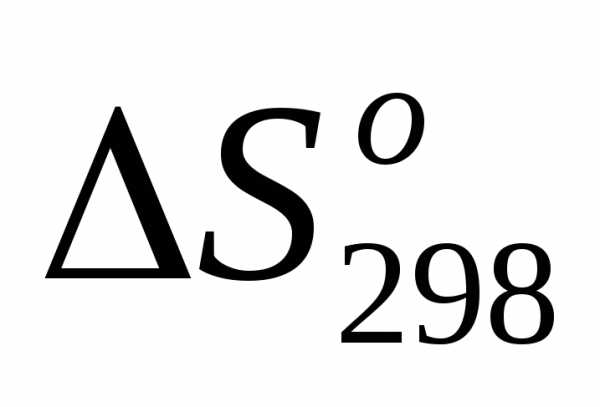 >0/. Энтропия системы как мера неупорядоченности растет при увеличении количества молей вещества (числа молей), тем более что полученные вещества находятся в газообразном состоянии.
>0/. Энтропия системы как мера неупорядоченности растет при увеличении количества молей вещества (числа молей), тем более что полученные вещества находятся в газообразном состоянии.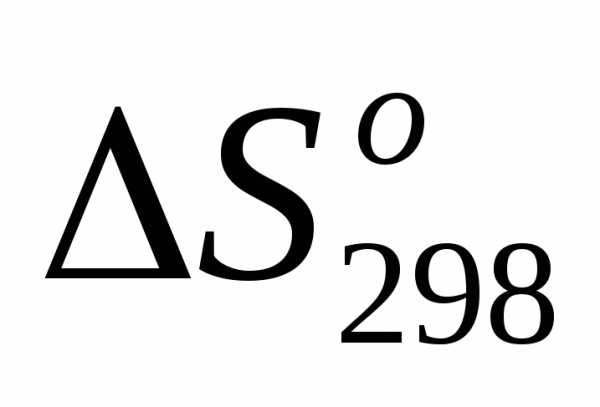 <0, так как в реакцию вступают три объема газов, а получаются два, т.е. число частиц газообразных веществ уменьшается, в системе растет 4порядоченность.
<0, так как в реакцию вступают три объема газов, а получаются два, т.е. число частиц газообразных веществ уменьшается, в системе растет 4порядоченность.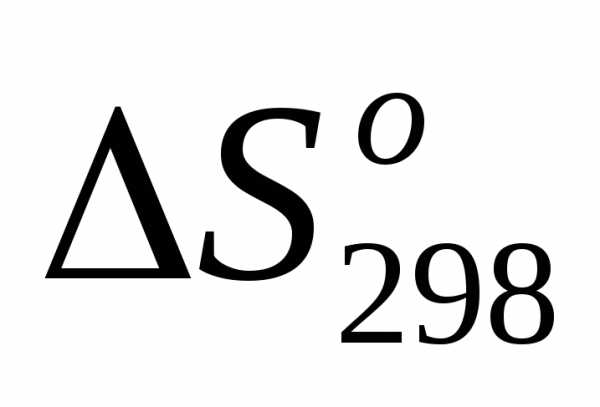 <0 по той же причине, что и в случае 2.
<0 по той же причине, что и в случае 2.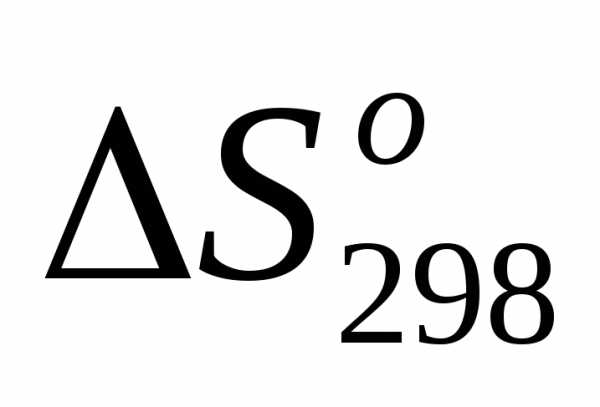 >0, так как усложнился состав молекул газа (
>0, так как усложнился состав молекул газа (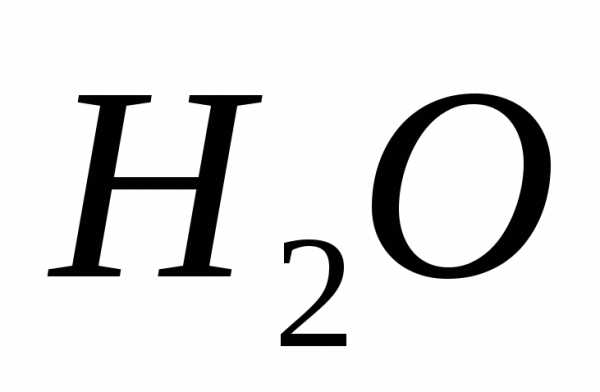 вместо
вместо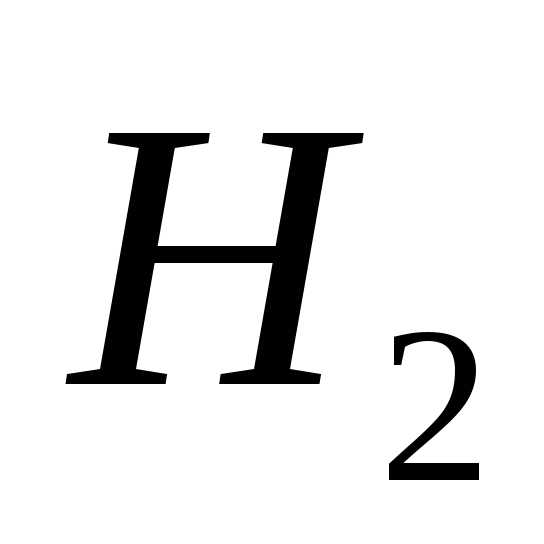 ), хотя в результате реакции число молей и не изменилось (в том числе и газообразных веществ).
), хотя в результате реакции число молей и не изменилось (в том числе и газообразных веществ).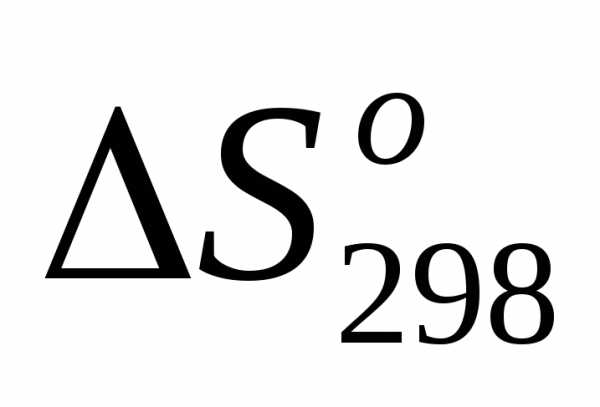 <0. Ионы
<0. Ионы 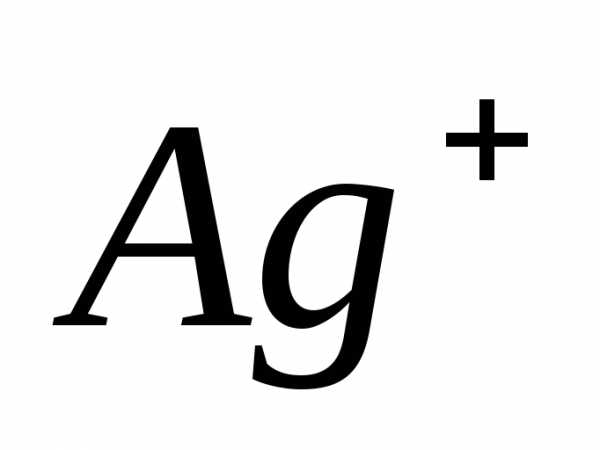 и
и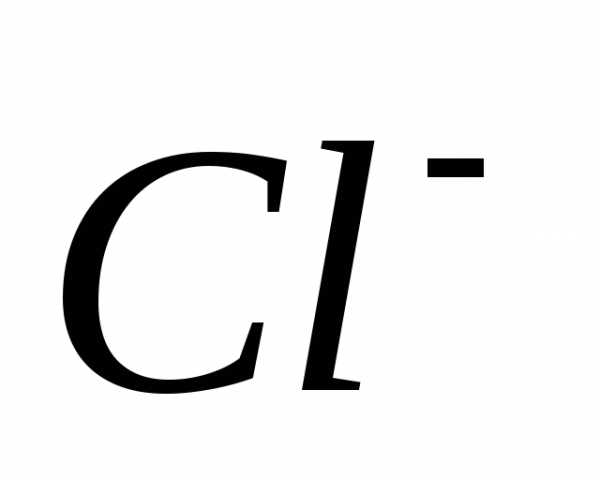 , находящиеся в растворе, переходят в осадок, т. е. в системе растет упорядоченность.
, находящиеся в растворе, переходят в осадок, т. е. в системе растет упорядоченность.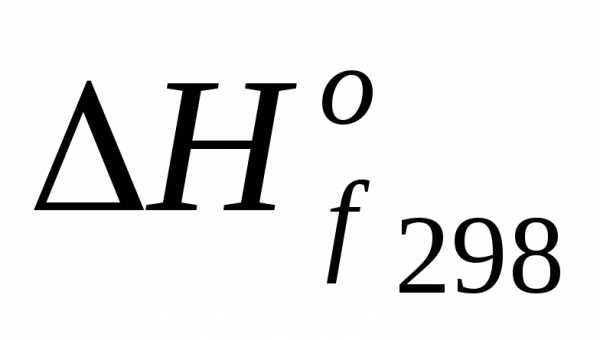 , кДж/моль
, кДж/моль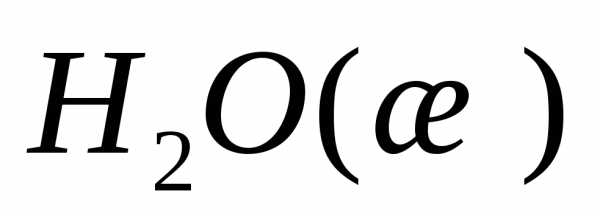
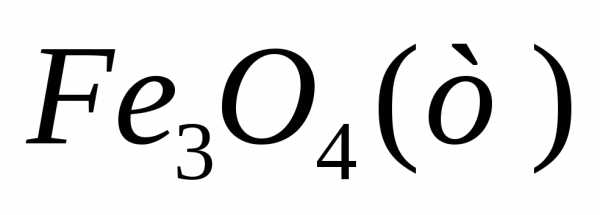
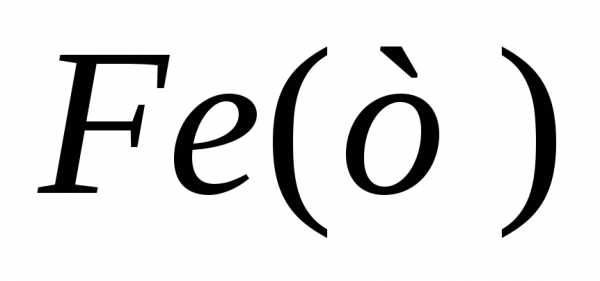
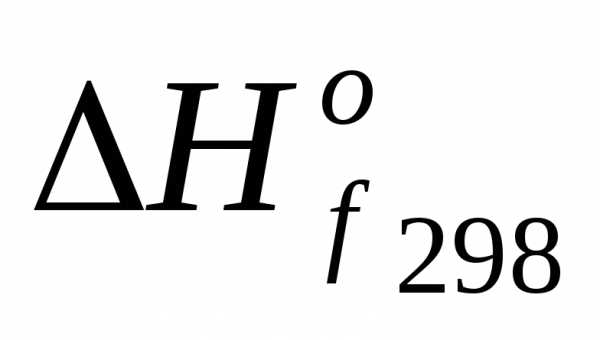 , кДж/моль
, кДж/моль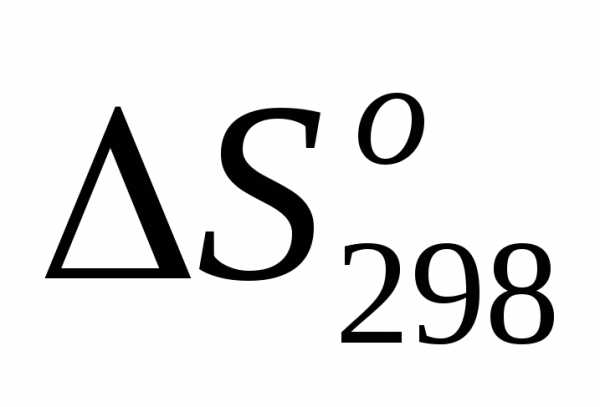 первой реакции больше нуля />0/. Энтропия системы как мера неупорядоченности растет при увеличении количества молей вещества (числа молей), тем более что полученные вещества находятся в газообразном состоянии.
первой реакции больше нуля />0/. Энтропия системы как мера неупорядоченности растет при увеличении количества молей вещества (числа молей), тем более что полученные вещества находятся в газообразном состоянии.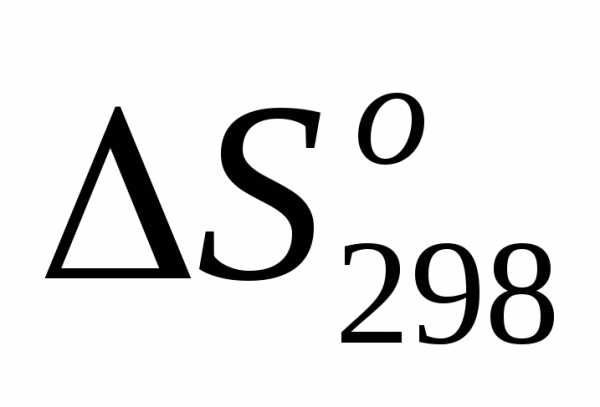 <0, так как в реакцию вступают три объема газов, а получаются два, т.е. число частиц газообразных веществ уменьшается, в системе растет упорядоченность.
<0, так как в реакцию вступают три объема газов, а получаются два, т.е. число частиц газообразных веществ уменьшается, в системе растет упорядоченность.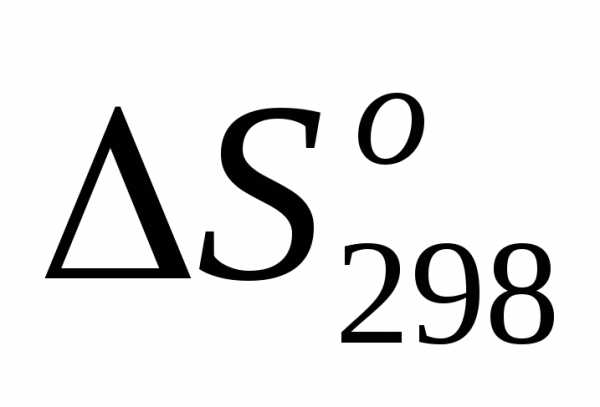 <0 по той же причине, что и в случае 2.
<0 по той же причине, что и в случае 2.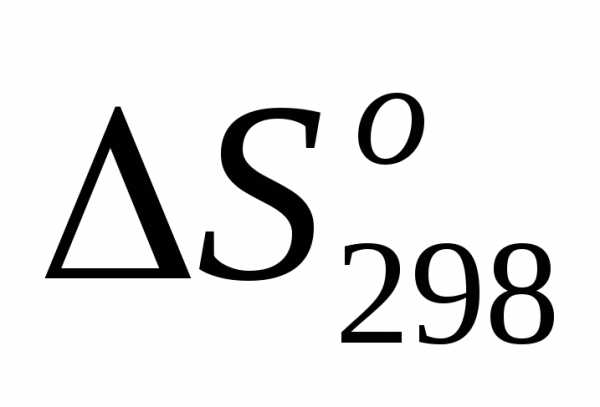 >0, так как усложнился состав молекул газа (
>0, так как усложнился состав молекул газа (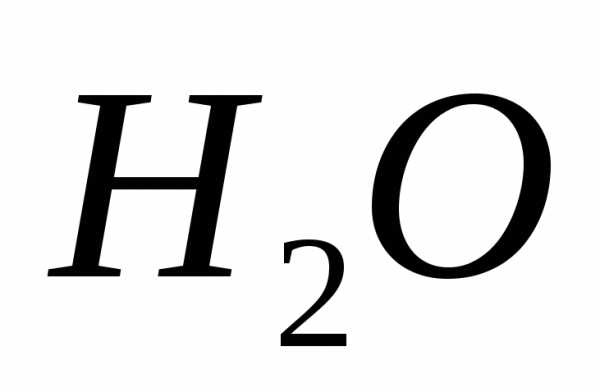 вместо
вместо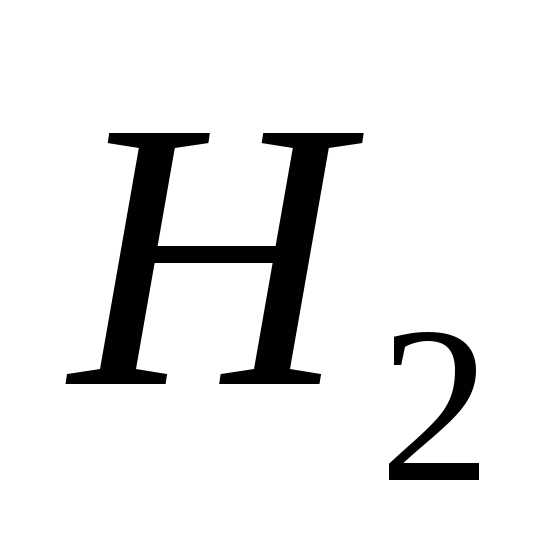 ), хотя в результате реакции число молей и не изменилось (в том числе и газообразных веществ).
), хотя в результате реакции число молей и не изменилось (в том числе и газообразных веществ).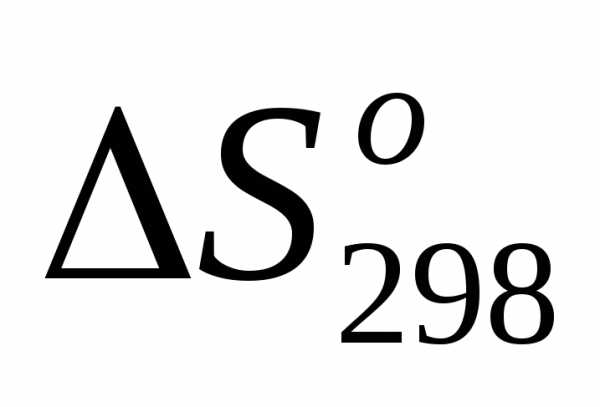 <0. Ионы
<0. Ионы 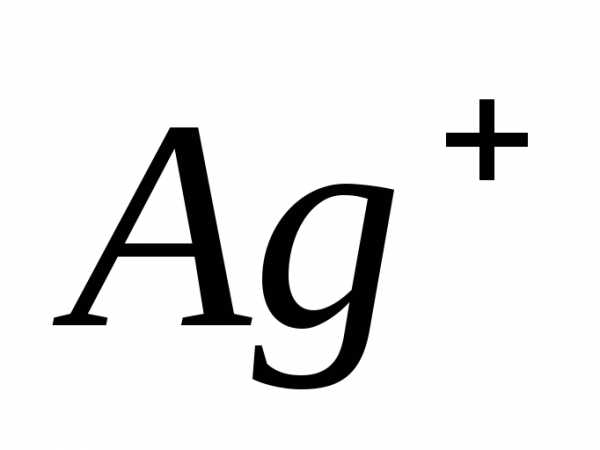 и
и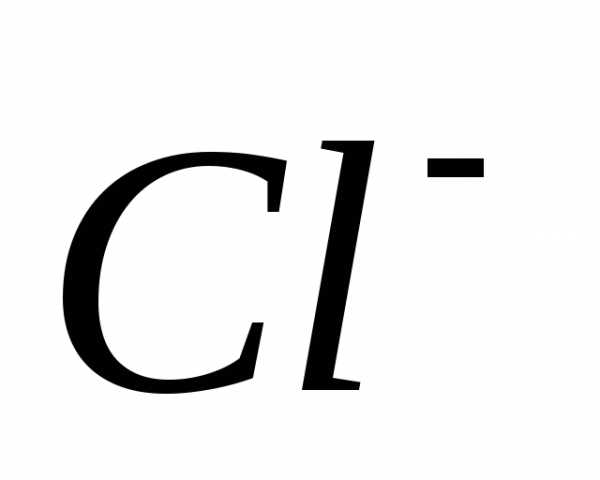 , находящиеся в растворе, переходят в осадок, т. е. в системе растет упорядоченность.
, находящиеся в растворе, переходят в осадок, т. е. в системе растет упорядоченность.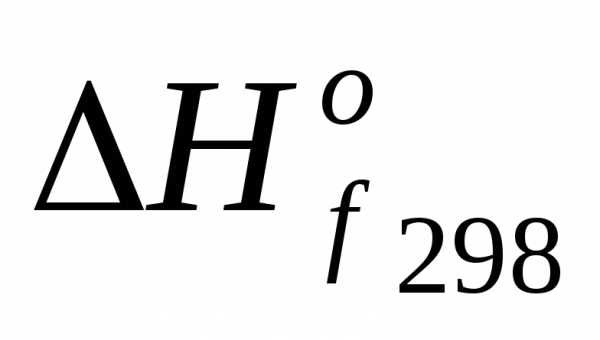 , кДж/моль
, кДж/моль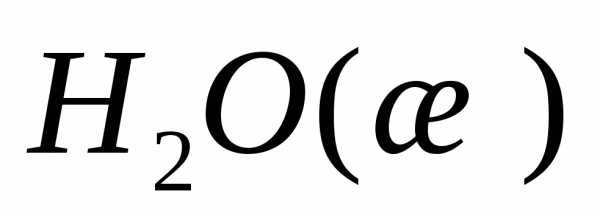
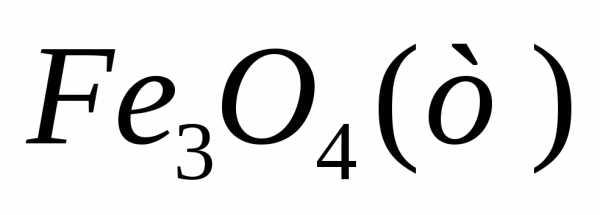
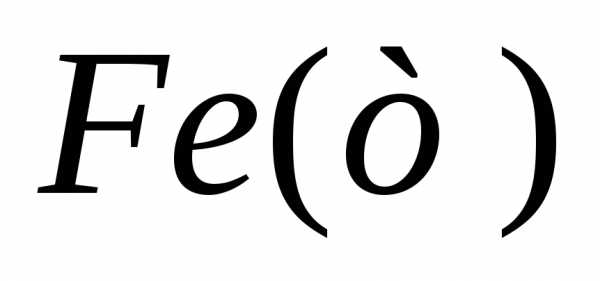
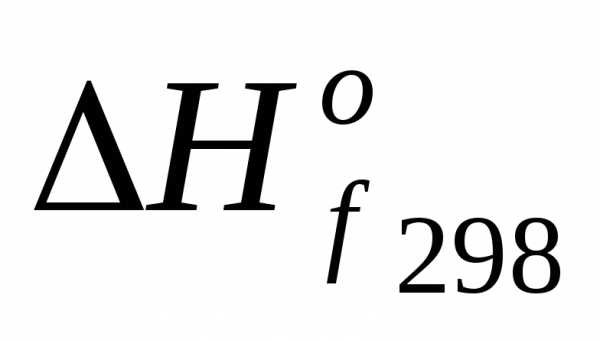 , кДж/моль
, кДж/моль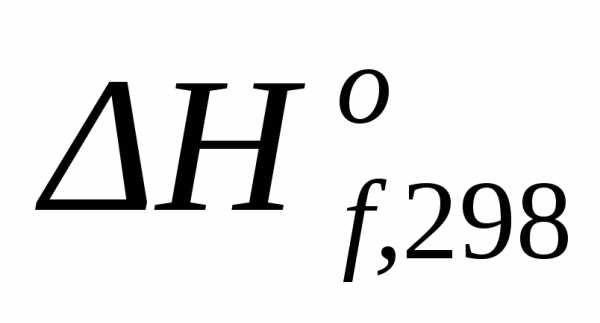 , кДж/моль
, кДж/моль



















