Содержание
3.4. Простые насыщенные эфиры
в
молекулах насыщенных простых эфиров
два углеводородных радикала соединены
через атом кислорода: R—O—R.
Другими
словами, их можно рассматривать как
органические производные воды, в молекуле
которой оба атома водорода замещены
предельными углеводородными радикалами.
Если эти углеводородные радикалы
неодинаковы (R
R),
то такие эфиры называют смешанными.
3.4.1. Номенклатура и изомерия
для
названия простых эфиров применяются
обычно радикало-функциональная и
заместительная номенклатуры ИЮПАК, но
могут применяться и другие виды
номенклатур (например, «а»-номенклатура
— гл. 1.5.3).
Название
соединения по радикало-функциональной
номенклатуре состоит из прилагательного,
образованного от названий углеводородных
радикалов, и существительного «эфир».
Например:
CH3-О-СН3 | — | диметиловый |
C2H5-О-СН3 | — | метилэтиловый |
В
заместительной номенклатуре в качестве
родоначальной структуры выбирается
одна из двух углеродных цепей, связанных
с атомом кислорода (подробнее о выборе
родоначальной структуры — гл. 1.5.1). Атом
кислорода с другим углеводородным
радикалом (-О-R)
является заместителем, название которого
присутствует в названии эфира в виде
приставки. Названия таким заместителям
даются по общим правилам заместительной
номенклатуры. Примеры:
СН3CH2-ОCН3 | — | метоксиэтан, |
— | 2-метил-1-пропоксипропан, | |
— | 3-метил-2-метоксибутан. |
Из
тривиальных названий для широко
распространённых насыщенных эфиров с
одной эфирной группой общеупотребительными
являются тривиальные названия только
одного из них. Это серный, или медицинский,
эфир С2Н5ОС2Н5.
Среди ди- и полиэфиров используются
следующие тривиальные названия:
СН3ОСН2СН2ОСН2СН2ОСН3
— диглим
(диметиловый эфир диэтиленгликоля), а
моноэфиры этиленгликоля имеют общее
название — целлозольвы
(метилцеллозольв СН3ОСН2СН2ОН,
этилцеллозольв
С2Н5ОСН2СН2ОН).
Все
виды изомерии, характерные для
рассмотренных выше соединений с
—связями,
существуют и для насыщенных простых
эфиров.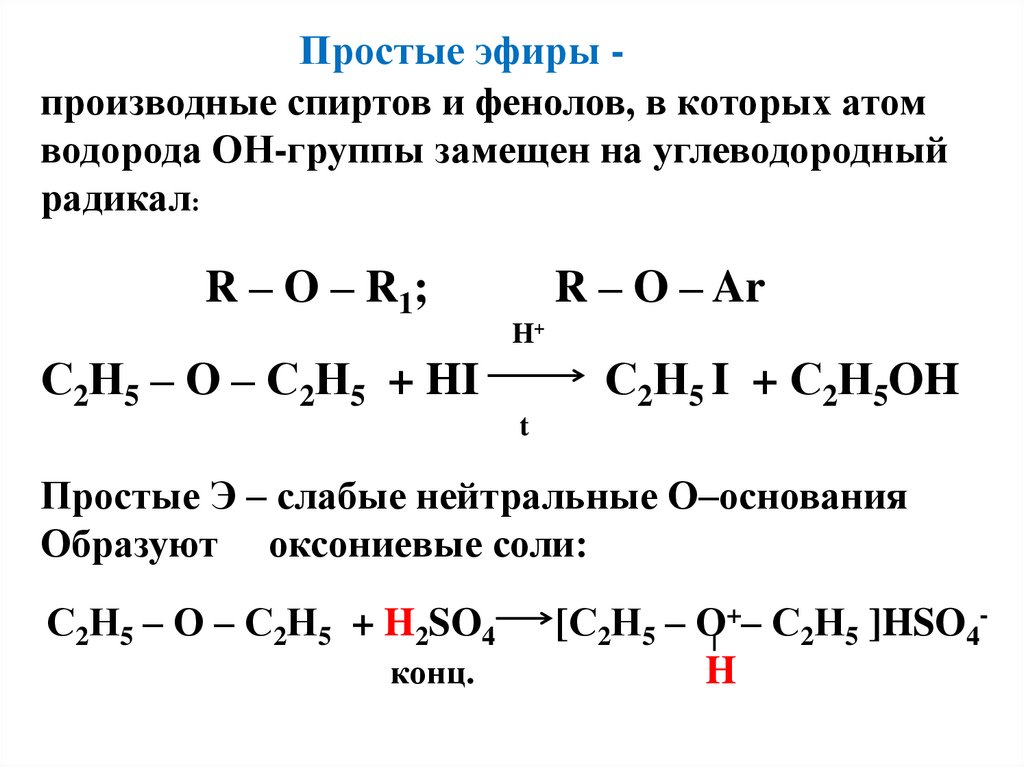 Кроме того, здесь встречается
Кроме того, здесь встречается
метамерия
— разновидность межклассовой структурной
изомерии. Другими словами, простые эфиры
изомерны одноатомным спиртам. (Их
брутто-формулы одинаковы — СnН2n+2О).
Так, диметиловый эфир СН3ОCН3
изомерен этиловому спирту, а упомянутый
выше 2-метокси-3-метилбутан изомерен
гексиловым спиртам С6Н13ОН.
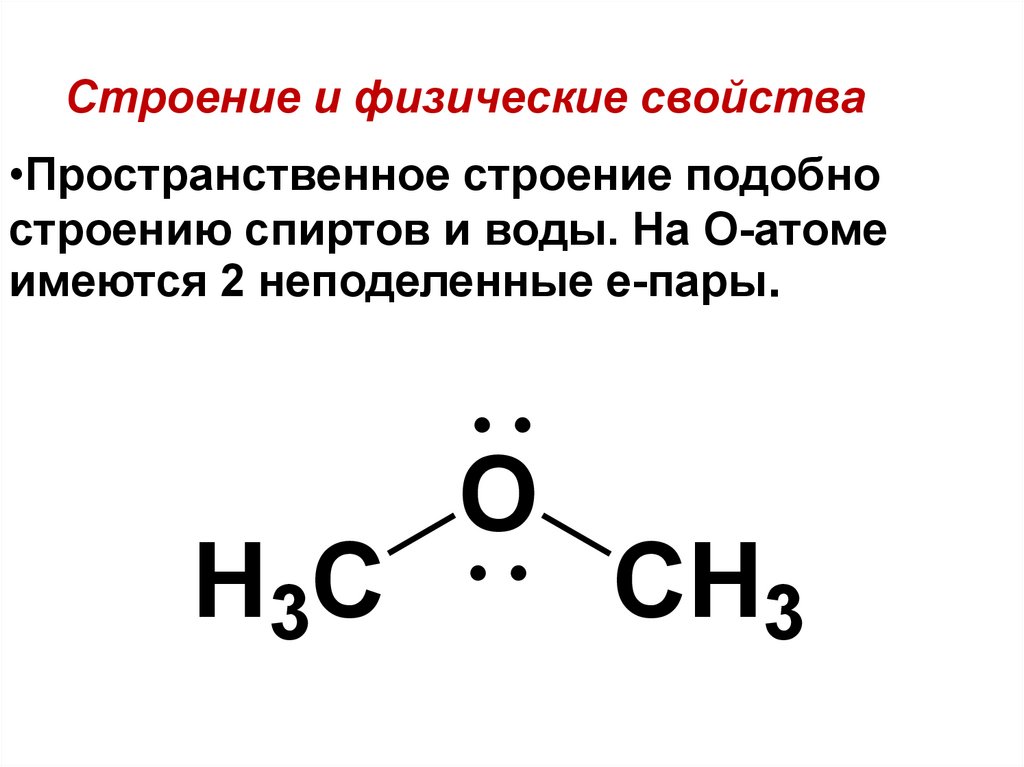
3.4.2. Физические и химические свойства
простые
эфиры — полярные соединения. Валентный
угол СОС
составляет 109—112.
Это влияет на их растворимость в воде
— простые эфиры значительно лучше
растворимы, чем незамещённые углеводороды.
Это объясняется и возможностью образования
водородных связей между молекулами
эфира и воды:
.
Но
температуры кипения их мало отличаются
от температур кипения соответствующих
углеводородов, так как водородные связи
между самими молекулами эфира невозможны
(нет подвижных атомов водорода).
простые
эфиры в обычных условиях — инертные
химические соединения. Но они могут в
жёстких условиях вступать в реакции
нуклеофильного замещения (ацидолиз
простых эфиров):
при повышенном давлении и высокой
температуре простые эфиры расщепляются
под действием H2SO4,
HBr,
HI:
R-O-R
+ HI
R-I + R-OH
Если
один из углеводородных радикалов R
— третичный, то образуется третичный
алкилйодид, механизм реакции — SN1:
В
остальных случаях реакция протекает
преимущественно по SN2-механизму,
и, значит, при ацидолизе метилалкиловых
эфиров образуется йодометан и
соответствующий спирт:
При этом
йодоводородная кислота значительно
реакционноспособнее, чем бромоводородная,
а хлороводородная для этих целей не
применяется вовсе из-за её низкой
активности.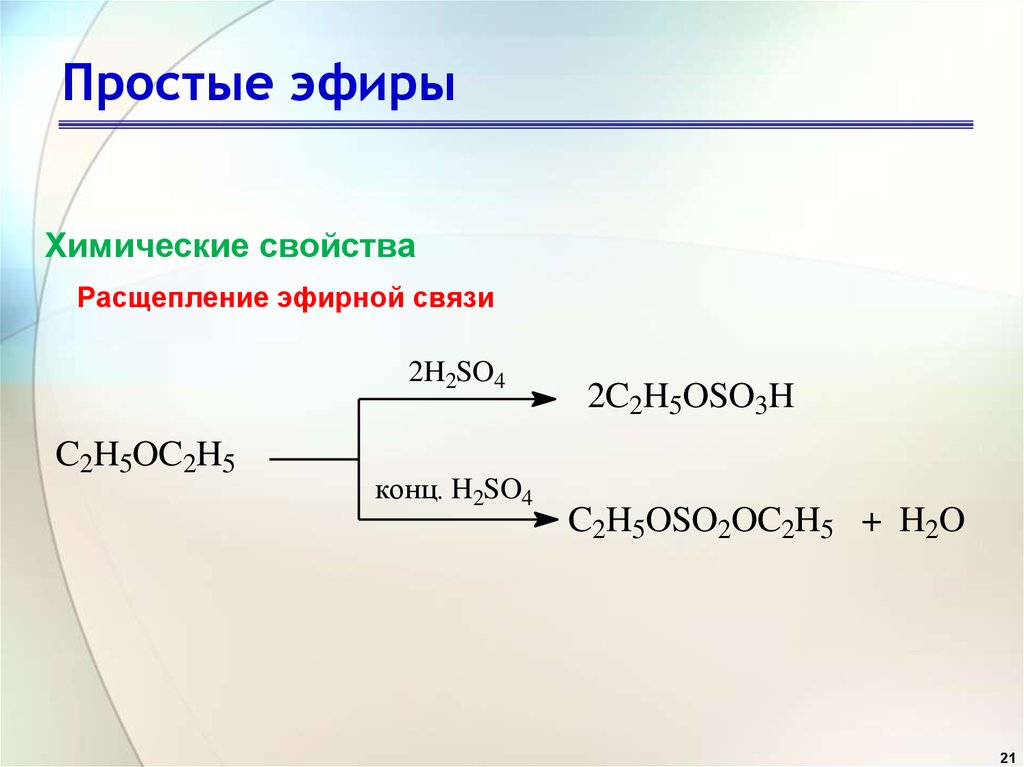 Реакцию с йодоводородной
Реакцию с йодоводородной
кислотой проводят в среде ледяной
уксусной кислоты.
Расщепление
метил- и этилалкиловых эфиров посредством
HI
используют для количественного
определения метокси- и этоксигрупп
(метод
Цейзеля*).
Для этого алкоксиалкан нагревают с
концентрированной йодоводородной
кислотой до 373 К
— образуется CH3I
или C2H5I.
Метод основан на определении йода либо
по количеству осаждённого AgI
при пропускании йодметана (или йодэтана)
через раствор AgNO3,
либо по количеству выделившегося I2
при окислении. Метод используют для
определения алкоксигрупп в углеводах
и алкалоидах.
Среди
реакций расщепления связи C–О,
кроме ацидолиза, можно отметить ещё и
взаимодействие со щелочными металлами:
R-О-R
+ 2Na
R-O-Na + R-Na
Механизм
реакции, скорее всего, радикальный.
Так
же как и спирты, простые эфиры обладают
оснóвными
свойствами
— могут
образовывать с кислотами оксониевые
соли:
хлорид диалкилоксония
При
этом электронодонорные свойства у
эфиров выражены сильнее, чем у спиртов
из-за электронодонорного действия двух
алкильных групп при атоме кислорода.
Но в целом эфиры, как и спирты, — основания
слабые, и поэтому оксониевые соли в
присутствии воды полностью гидролизованы.
Например, диэтиловый эфир начинает
протонироваться в ощутимых количествах
только в растворе 30—50%-й серной кислоты.
Простые
эфиры могут вступать в радикальные
реакции по -углеродному
атому. Это
могут быть реакции хлорирования. Но
более значимы для практики реакции
окисления:
инициирующая
частица
Свободные
алкоксиалкильные радикалы более
стабильны, чем алкильные, вследствие
делокализации неспаренного электрона
при взаимодействии с неподелённой
электронной парой кислорода. И так как
И так как
в молекулах простых эфиров имеется два
-углеродных
атома (с разных сторон от атома кислорода),
то реакция идёт по тому направлению,
которое приводит к образованию более
стабильного радикала.
Продуктами
окисления являются гидропероксиды —
нестабильные и взрывчатые соединения.
При хранении диалкиловых эфиров с
доступом воздуха, особенно на солнечном
свету в прозрачных бутылках, всегда
образуется примесь гидропероксидов.
Гидропероксиды представляют собой
малолетучие маслянистые жидкости с
острым запахом. Поэтому перед использованием
эфиров необходимо делать пробу на
наличие в них пероксидных соединений,
добавляя сульфат железа (II)
и роданид калия (или аммония). Пероксидные
соединения разрушают (за счёт
восстановления) при обработке эфиров
натрием, солями железа (II)
или марганца (II).
Эфиры простые и сложные. Фармацевтический анализ эфиров : Farmf
Эфиры простые и сложные. Фармацевтический анализ эфиров
Глава 5. Анализ лекарственных средств группы алифатических алканов, их галогено- и кислородсодержащих соединений.
Анализ лекарственных средств группы алифатических алканов, их галогено- и кислородсодержащих соединений.
ПРОСТЫЕ ЭФИРЫ
Простые эфиры — производные спиртов и фенолов, в которых атом водорода гидроксильной группы заменен на углеводородный радикал. Простые эфиры имеют общую формулу: R-O-R.
Медицинскими препаратами алифатического простого эфира — диэтилового — являются эфир медицинский и эфир для наркоза (табл. 8).
Простые эфиры представляют собой бесцветные жидкости, плотность которых меньше плотности воды. Простые эфиры кипят при более низких температурах, чем соответствующие спирты, несмотря на то, что они содержат удвоенное количество атомов углерода. Например, температура кипения этанола 78 °С, а эфира диэтилового — 36 °С. Это различие объясняется неспособностью простых эфиров образовывать водородные связи. По той же причине плотность эфиров меньше, чем соответствующих спиртов.
Основные свойства
Простые эфиры проявляют свойства оснований за счёт наличия в молекуле атома кислорода, имеющего неподеленную электронную пару.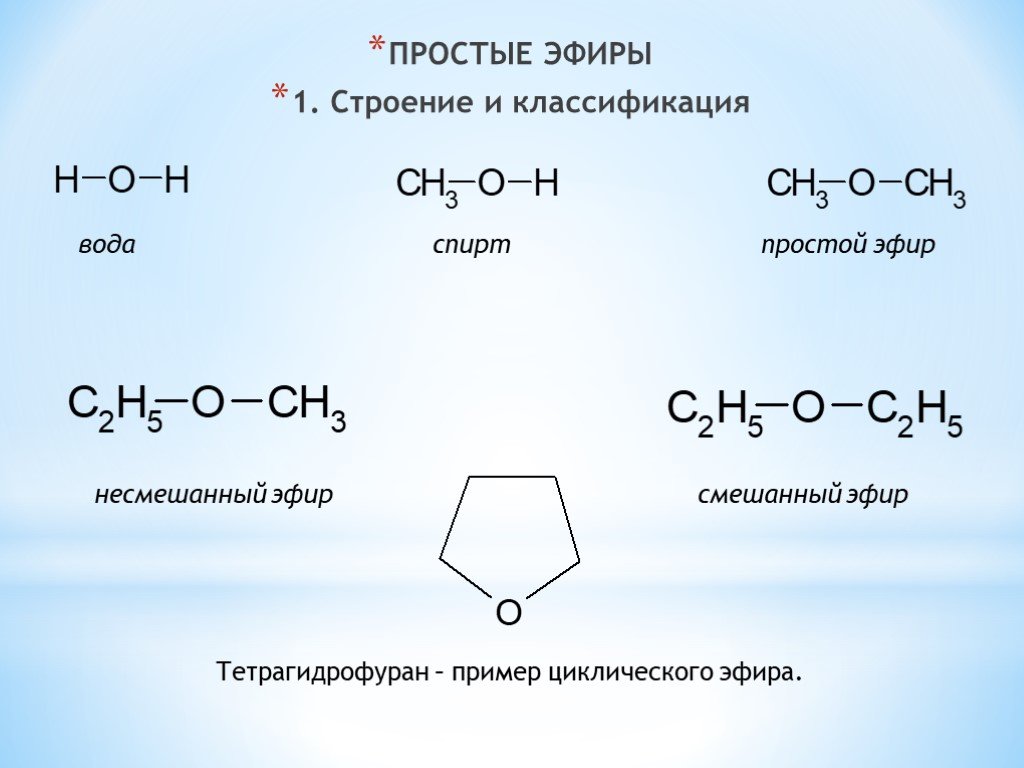 Основные свойства у алифатических простых эфиров выражены сильнее, чем у спиртов. Алифатические эфиры — более сильные основания, чем ароматические. Поэтому при действии минеральных кислот на простые эфиры образуются оксониевые соли:
Основные свойства у алифатических простых эфиров выражены сильнее, чем у спиртов. Алифатические эфиры — более сильные основания, чем ароматические. Поэтому при действии минеральных кислот на простые эфиры образуются оксониевые соли:
Оксониевые соли легко гидролизуются при действии воды.
Расщепление простых эфиров
Простые алифатические эфиры и арилалифатические эфиры (в отличие от диариловых) расщепляются при действии бромоводородной или йодоводородной кислот. В результате получаются соответствующие
Окисление простых эфиров
При хранении, особенно на свету, простые эфиры медленно окисляются кислородом воздуха с образованием пероксидов и гидропероксидов:
Способность эфира медицинского к окислению необходимо учитывать при работе с ним. Проба на наличие пероксидных соединений проводится с раствором калия йодида. Если в эфире содержатся перекисные соединения, они окисляют калия йодид до свободного йода, окрашивающего и эфирный, и водный слои в жёлтый цвет:
Во время проведения анализа поблизости не должно находиться источников огня.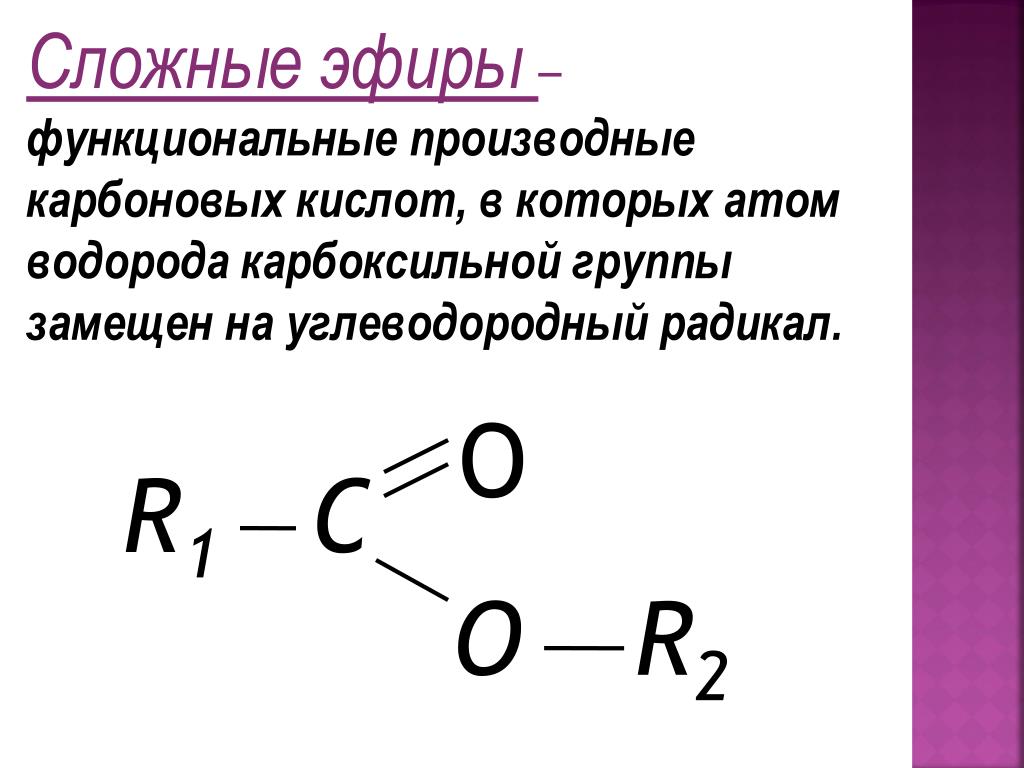
При определении температуры кипения и нелетучего остатка эфир следует предварительно проверить на содержание перекисей. При наличии перекисей указанные определения проводить нельзя.
Кроме пероксидов, в эфире медицинском проверяют присутствие примесей альдегидов (их наличие также обусловлено процессом окисления эфира). При добавлении к пробе эфира медицинского реактива Несслера допускаются возникновение жёлто-бурой окраски, а также помутнение нижнего слоя, но не должно быть образования осадка:
При анализе на эту же примесь эфира для наркоза добавление реактива Несслера не должно вызывать ни окраски, ни помутнения реактива.
Допускается слабая опалесценция.
У эфира медицинского и эфира для наркоза определяют такие показатели, как плотность, кислотность, нелетучий остаток, содержание воды.
Содержание n-фенилендиамина в эфире для наркоза определяют с помощью метода УФ-спектрофотометрии.
Хранят препараты эфира по списку Б в герметически укупоренных склянках оранжевого стекла в защищенном от света месте, вдали от огня.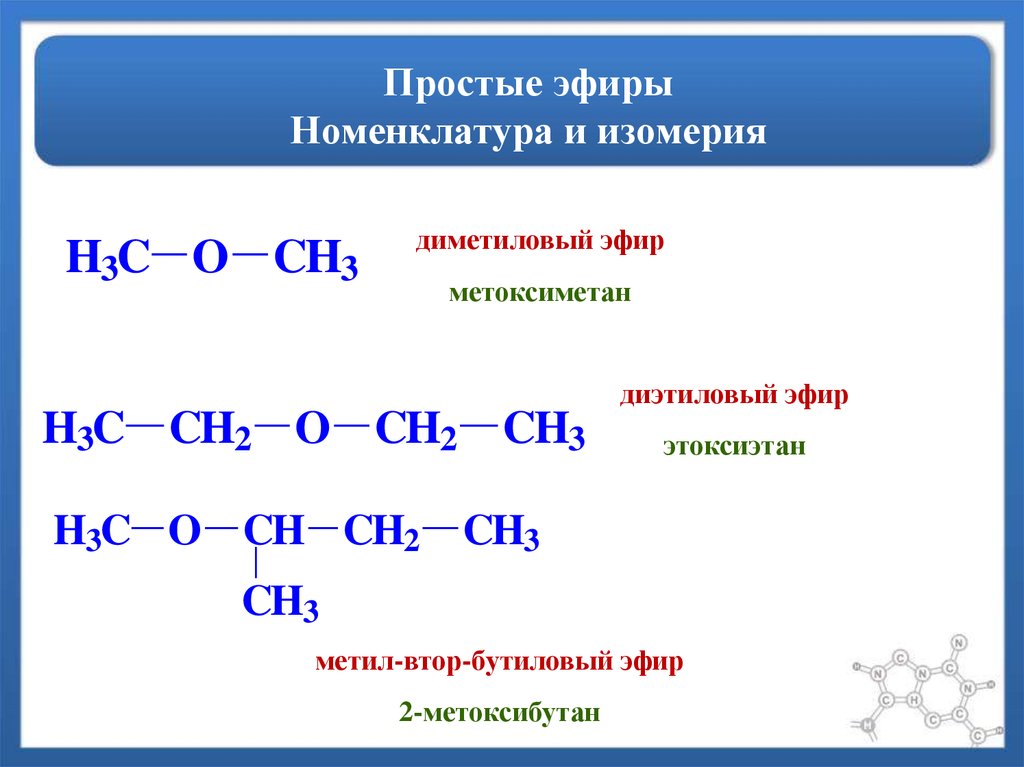
СЛОЖНЫЕ ЭФИРЫ (АЛИФАТИЧЕСКИЕ)
К данной группе относятся нитроглицерин и его препараты (табл. 9), а также эринит (пентаэритрита тетранитрат).
Нитроглицерин применяется в различных лекарственных формах:
- пероральных: таблетки нитрогранулонга мите — 2,9 мг и форте ~ 5,2 мг; нигрокор — 6,5 мг в микрокапсулах, сустак миге и форте -соответственно 2,6 и 6,4 мг, сустонит по 2,6; 6,5 и 15 мг, нитронг мите и форте ~ соответственно 2,6 и 6,5 мг, нитро-мак ретард — капсулы по 2,5 и 5 мг;
- трансдермальных: нитро 2% мазь, мазь нитронг, пластыри и диски — депонит по 16 или 32 мг, нитродерм ТГБ по 25 и 50 мг, нитродиск, нитро-дур, трансдерм-яитро;
- буккальные: тринитролонг по 1; 2 и 4 мг, сусадрин и сускард по 1; 2; 3 и 5 мг;
- аэрозольные: нитролингвал-аэрозоль.
Соприкосновение с кожей даже малого количества препарата может вызвать сильную головную боль.
Обращаться с осторожностью при переливании, отвешивании, хранении, так как препарат взрывоопасен.
Подлинность нитроглицерина (спиртового раствора) доказывают по образованию акролеина. Для этого 10 мл препарата смешивают с 1 мл раствора натрия гидроксида и выпаривают на водяной бане до полного удаления спирта, остаток смешивают с 1,5 г измельчённого калия гидросульфата и нагревают до вспенивания и начинающегося обугливания; появляется острый характерный запах акролеина:
Нитроглицерин даёт также характерную реакцию на нитраты (см. е. 89).
Чистота. В препарате определяют предел кислотности, неорганические нитраты, сопутствующие вещества.
Количественное определение нитроглицерина в его препаратах можно проводить с помощью физико-химических и титриметрических методов.
Так. нитроглицерин в спиртовом растворе определяют в присутствии пиридина титрованием стандартным раствором тетрабутил- аммония гидроксида. Конец титрования определяют потенциометрически (Британская фармакопея, 2001).
Спектрофотометрически нитроглицерин определяют после гидролиза в присутствии кислоты уксусной с последующим взаимодействием образовавшейся кислоты азотной с реактивом — кислотой фенолдисульфоновой:
В кислой среде окраска продукта менее интенсивна, чем в щелочной.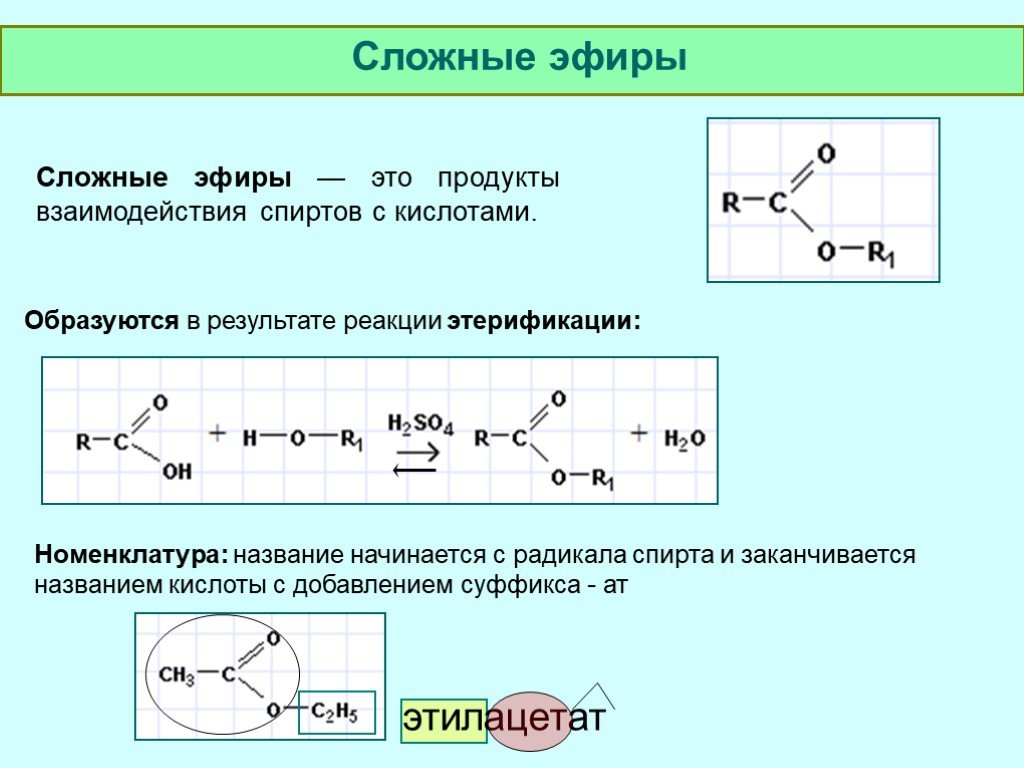 Поэтому добавление избытка аммиака при водит к перегруппировке с образованием более интенсивно окрашенной аци-формы:
Поэтому добавление избытка аммиака при водит к перегруппировке с образованием более интенсивно окрашенной аци-формы:
Оптическую плотность полученного раствора, окрашенного в жёлтый цвет, измеряют при длине волны 410 нм.
Хранение. Список Б. Небольшими количествами, в хорошо укупоренных склянках, в прохладном, защищённом от света месте, вдали от огня.
Определение, номенклатура, свойства и химические реакции
Произведенные от латинского слова «эфир», простые эфиры относятся к классу органических соединений, содержащих атом кислорода между двумя алкильными группами. Из общего определения простого эфира ясно, что они имеют формулу R-O-R, R-O-Ar, R-O-R’, Ar-O-Ar, где R – алкильные группы, а Ar – арильные группы. Атом кислорода связан с двумя одинаковыми или разными арил/алкильными группами. Эти группы воспламеняются при комнатной температуре и высоком давлении.
Номенклатура простых эфиров
По значению простых эфиров понятно, что простые эфиры называются по названиям двух алкильных или арильных групп, присоединенных к одному атому кислорода. Кроме того, две алкильные/арильные группы записаны в алфавитном порядке.
Кроме того, две алкильные/арильные группы записаны в алфавитном порядке.
Пример: Ch4 – O – C2H5 представляет собой этилметиловый эфир
Если в названии эфира указана только одна алкильная/арильная группа, это означает, что две подобные группы связаны с кислородом.
Пример: Ch4 – O – Ch4 представляет собой диэтиловый эфир
Номенклатура ИЮПАК для наименования простых эфиров
Согласно Номенклатуре ИЮПАК более сложная группа называется корнем или названием алканового основания, а меньшая группа называется алкоксизаместителем. Таким образом, чтобы определить названия эфиров в соответствии с системами IUPAC, рассматривайте простые эфиры как алкоксиалканы.
Пример: Ch4 – O – Ch4 – это этоксиэтан
Правила присвоения имен эфирам IUPAC
Необходимо выбрать самую длинную углеродную цепь и назвать ее корневой.
Измените название меньшей углеводородной группы, оканчивающейся на «ил», на «окси».

Поместите алкоксигруппу с номером локатора перед корневой или базовой цепью.
Пример:
Ch4 – Ch3 – O – Ch3 – Ch3 – Ch4 представляет собой 1-этоксибутан
Простые эфиры – Общая классификация
В зависимости от группы заместителей, связанных с атомом кислорода, простые эфиры можно разделить на две основные категории :
Пример: Ch4 – Ch3 – O – Ch3 – Ch4
Асимметричные эфиры: Из значения эфира ясно, что две группы, связанные с одним атомом кислорода, могут быть идентичными или разными. Если к одному атому кислорода присоединены две разные группы, такие как R-O-R’ или R-O-Ar, то это относится к асимметричному эфиру.
Пример: Ch4 – Ch3 – O – Ch3 – Ch3 – Ch3 – Ch4
Как получают эфиры?
Из определения эфира видно, что существуют разные способы получения эфиров. Некоторые из распространенных промышленных методов синтеза эфиров включают:
Некоторые из распространенных промышленных методов синтеза эфиров включают:
Дегидратация спиртов:
В присутствии протонных кислот, таких как фосфорная или серная кислота, спирт подвергается дегидратации. Он дает простые эфиры и алкены в качестве продуктов реакции в различных условиях. Например:
2Ch4Ch3-OH+h3SO4 —-> Ch4Ch3-O-Ch3Ch4 + h3O
Этанол дегидратируется до этилена при взаимодействии с серной кислотой при температуре 443K. Наоборот, этанол обезвоживается с образованием этоксиэтана при обработке серной кислотой при 413К.
[Изображение скоро будет загружено]
Реакция представляет собой нуклеофильную бимолекулярную реакцию.
Williamson Синтез:
Согласно определению эфира, существует два типа эфиров, и эта реакция широко используется для их получения в лабораториях. Алкилгалогенид типа R-X реагирует с R-ONa с образованием эфира.
Например:
Na+C2H5O- + C2H5Cl → C2H5OC2H5 + Na+Cl-
Реакция следует за SN2-атакой иона ONa- на C2H5Cl.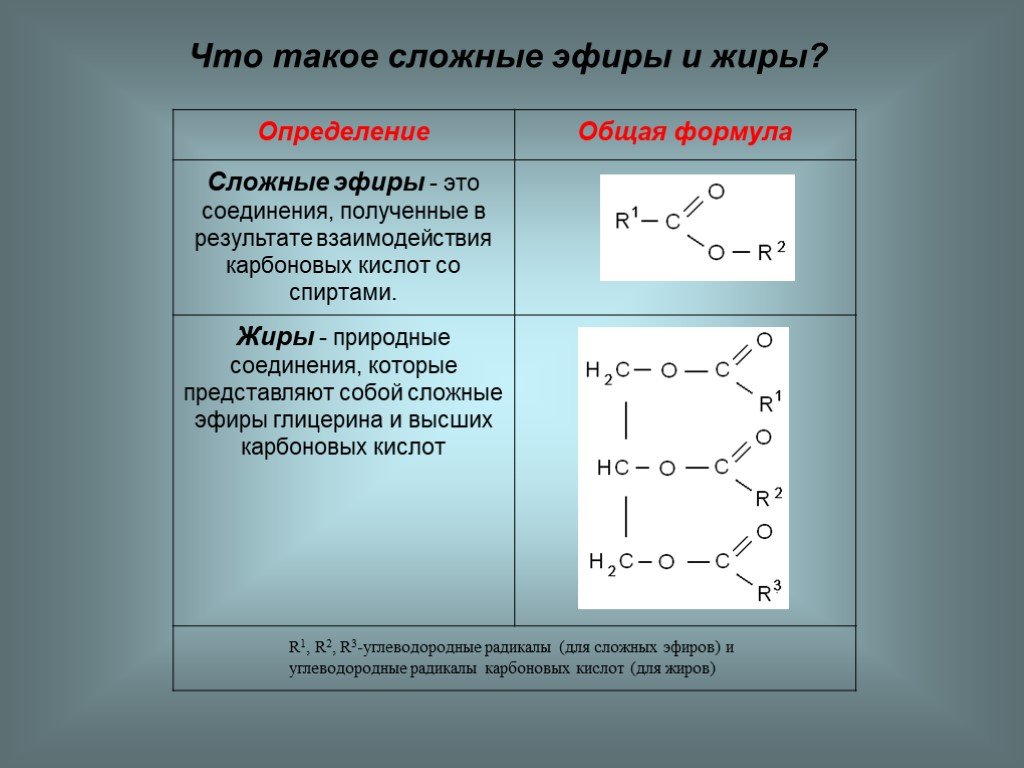
Другие реакции:
Когда алкилгалогенид (R-X) реагирует с сухим оксидом серебра (Ag2O), образуется эфир. Например:
Ag23O + 2Ch4Cl → 2AgCl + Ch4OCh4
Физические свойства эфиров
Внешний вид: Все эфиры представляют собой бесцветные летучие жидкости с приятным запахом при комнатной температуре, за исключением диметилового эфира и этилметилового эфира, которые представляют собой газы.
Температура кипения: Молекулы эфира имеют более низкую температуру кипения по сравнению со спиртами, но сравнимы с алканами.
Полярность: Атом кислорода, окруженный двумя алкильными/ арильными группами, не способен участвовать в образовании водородной связи, поэтому простые эфиры обладают меньшей полярностью.
Растворимость: Согласно определению эфира, эти молекулы растворимы в воде. Однако, поскольку присутствующие атомы кислорода имеют тенденцию образовывать водородные связи с молекулой h3O, растворимость уменьшается с относительным увеличением углеводородной цепи.
Гибридизация: в эфире атом кислорода находится в состоянии sp3-гибридизации и имеет валентный угол 109.5 градусов.
Химические реакции:
Образование пероксидов: Когда эфир подвергается воздействию воздуха в присутствии солнечного света, он образует пероксидную связь.
[Изображение будет загружено в ближайшее время]
Приведенная выше реакция показывает две реакции образования перекиси из эфира в присутствии кислорода.
Электрофильные реакции: Эфиры подвергаются различным типам электрофильных реакций, таких как галогенирование, реакция Фриделя-Крафтса, нитрование и другие.
[Изображение скоро будет загружено]
На приведенной выше диаграмме показана реакция электрофильного замещения эфира.
Эфир – важные области применения
При низких температурах в качестве растворителя используется диметиловый эфир.

Диэтиловый эфир действует как обычный ингредиент анестезии и растворитель для камедей, масел, смол и т.д.
Фениловый эфир имеет высокую температуру кипения и поэтому может использоваться в качестве теплоносителя.
Что такое ПФАС? Определение пер- и полифторалкилэфирных кислот
Что такое «вечные химикаты»?
Определение того, что квалифицируется как пер- и полифторалкильные вещества, или ПФАС, важно для обнаружения, изучения и регулирования этих вечных химических веществ.
Пер- и полифторалкилэфирные кислоты, или ПФЭА, представляют собой подмножество соединений ПФАС, многие из которых были введены для замены других ПФАВ, таких как ПФОК и ПФОС. Эти химические вещества [1] включают хорошо известный PFAS GenX и менее известные соединения, такие как хлорированные перфторэфиры, недавно выявленные в штате Нью-Джерси.
Следующий анализ фокусируется на подмножестве PFEA, которые не считаются PFAS согласно некоторым определениям.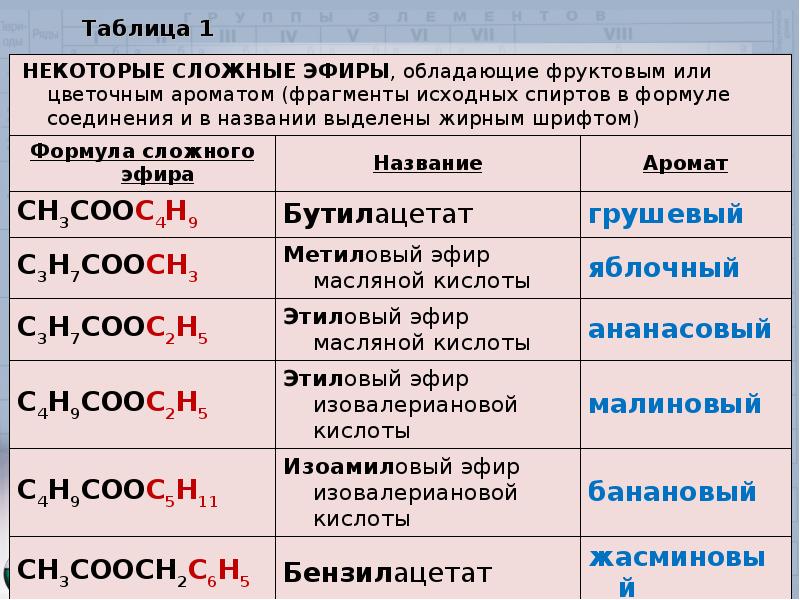 Среди ПФЭА, высвобождаемых при производстве фторсодержащих химикатов и использовании продуктов, находятся перфтор-2-метоксиуксусная кислота (PFMOAA), перфтор(3,5-диоксагексановая) кислота (PFO2HxA), перфтор-3,5,7-триоксаоктановая кислота (PFO3OA), перфтор- 3,5,7,9-бутаоксадекановая кислота (PFO4DA), перфтор-3,5,7,9,11-пентаоксадодекановая кислота (PFO5DoA).
Среди ПФЭА, высвобождаемых при производстве фторсодержащих химикатов и использовании продуктов, находятся перфтор-2-метоксиуксусная кислота (PFMOAA), перфтор(3,5-диоксагексановая) кислота (PFO2HxA), перфтор-3,5,7-триоксаоктановая кислота (PFO3OA), перфтор- 3,5,7,9-бутаоксадекановая кислота (PFO4DA), перфтор-3,5,7,9,11-пентаоксадодекановая кислота (PFO5DoA).
Эти специфические PFEA были обнаружены в питьевой воде, морепродуктах, атмосферных выбросах от профессионального вощения полов и воздействии на человека из различных источников.
Первоначальное исследование выявило статистически значимые сдвиги в популяциях иммунных клеток и потребовало дополнительных исследований потенциальных последствий для здоровья от воздействия PFMOAA.
Отдельное исследование PFO3OA, PFO4DA, PFO5DoDA показало, что нарушение гормонов щитовидной железы влияет на рыбок данио, включая развитие и вздутие плавательного пузыря, при этом авторы пришли к выводу, что эти PFEA «не являются более безопасными альтернативами PFOA».
Питьевая вода ниже по течению от завода Chemours, ранее принадлежавшего DuPont в Фейетвилле, Северная Каролина, по-прежнему имеет уровни PFMOAA выше 100 частей на триллион, или частей на триллион, а уровни ранее измерялись более чем 100 000 частей на триллион.
При тестировании сыворотки в 2017 и 2018 годах PFO4DA был обнаружен в 99 процентах образцов, PFO5DoA был обнаружен в 88 процентах образцов, а PFO3OA был обнаружен в 28 процентах образцов. Из-за высоких уровней фона методы анализа ПФМОАА не разрабатывались.
Многие из этих карбоновых кислот перфторалкилового эфира имеют длительный период полураспада в организме человека, то есть они остаются в нашем организме в течение месяцев или лет после воздействия. В подгруппе жителей, протестированных через 6 месяцев после прекращения воздействия, уровни PFO5DoA снизились на 28 процентов, а уровни PFO4DA снизились на 65 процентов.
У каждого человека, участвовавшего в исследовании почти тысячи жителей, проживающих рядом с фторхимическим заводом в Китае, в образцах сыворотки обнаруживались карбоновые кислоты перфторалкилового эфира, такие как PFMOAA. В среднем эти соединения составляли 7 процентов от общего количества PFAS в организме жителей. Если исключить ПФОК, эти химические вещества составляют почти 30 процентов содержания ПФАВ в организме.
В среднем эти соединения составляли 7 процентов от общего количества PFAS в организме жителей. Если исключить ПФОК, эти химические вещества составляют почти 30 процентов содержания ПФАВ в организме.
При исследовании водных организмов в устье реки Сяоцин в Китае на ПФМОАА приходилось 32,5% общего количества ПФАВ, измеренного в организмах. Расчетные значения ежедневного потребления для сельских жителей были в 6,7 раза выше для ПФМОАА, чем для любых других соединений ПФАВ.
Воздействие этих перфторэфирных соединений может не ограничиваться только участками ниже по течению от заводов. Исследование выбросов в атмосферу при нанесении воска на пол в Северной Каролине показало, что ПФМОАА является одним из пяти соединений ПФАС, выбрасываемых в воздух в постоянно более высоких концентрациях.
Регулирование этих соединений может сводиться к определению того, какие химические вещества входят в обширный и разнообразный химический класс, определяемый как PFAS.
Организация экономического сотрудничества и развития, или ОЭСР, межправительственная экономическая организация, в 2021 году пересмотрела свое определение ПФАВ, добавив: «за некоторыми отмеченными исключениями, любое химическое вещество, по крайней мере, с перфторированной метильной группой (–CF3) или перфторированная метиленовая группа (-CF2-) представляет собой PFAS».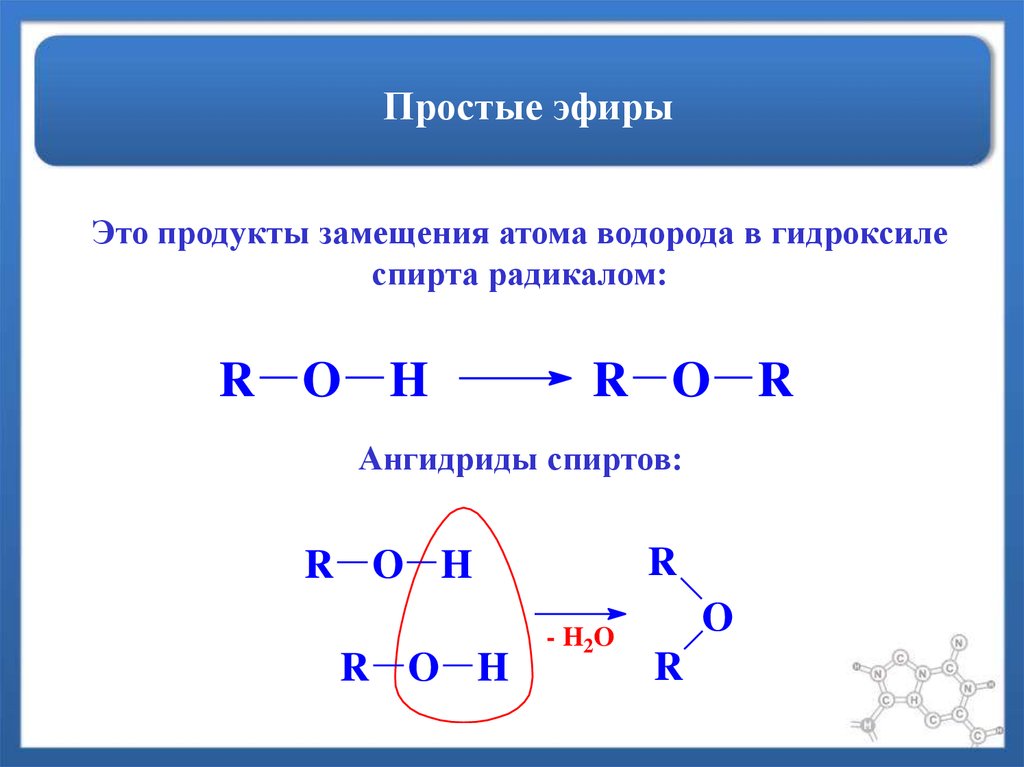
Это определение ОЭСР, наряду с определением «полностью фторированного атома углерода», используемым в США в Законе о государственной обороне 2019 г. и в многочисленных законах штатов, а также определением, используемым Glüge et al. все они будут включать PFEA как вечные химические вещества.
Однако предыдущее определение ОЭСР от 2018 года Buck et al. определение от 2011 года и недавнее определение Агентства по охране окружающей среды США исключают PFEA.
Текущее определение PFAS в Агентстве по охране окружающей среды США, используемое Управлением исследований и разработок агентства и определенное в Законе о контроле за токсичными веществами или TSCA, раздел 8 (a) (7), предлагаемое правило, а также национальная стратегия тестирования PFAS Агентства по охране окружающей среды. , представляет собой: «структуру, содержащую единицу R-CF2-CF(R’)(R»), где R, R’ и R» не равны «H», а связь углерод-углерод является насыщенной ( примечание: включены разветвления, гетероатомы и циклические структуры).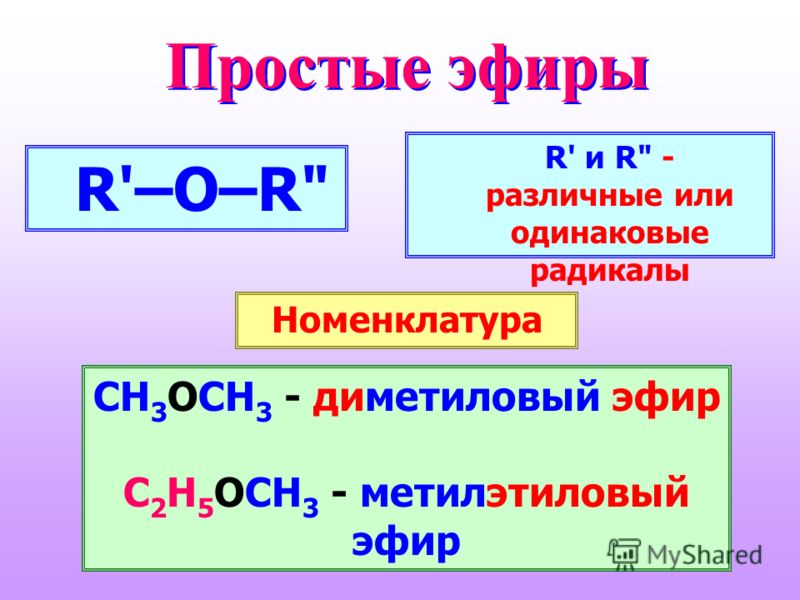
Три примера ПФЭА, которые могут быть исключены с использованием некоторых определений ПФАВ не подлежат испытательному заказу в соответствии с TSCA. Вполне возможно, что стратегия тестирования EPA и правила отчетности будут собирать некоторую информацию о выбросах и токсичности этих соединений, если производители сообщают о выбросах в виде примесей или побочных продуктов производства. Включение этих PFAS в отношении промышленных сбросов, загрязнения питьевой воды или оценки токсичности PFAS является более актуальным.
Это исключение многочисленных перфторалкиловых эфиров карбоновых кислот из ограничений и нормативного контроля, основанное на ожидании их разложения, уже имело место раньше, что имело вредные последствия для здоровья человека и окружающей среды.
GenX — это перфторэфирный состав DuPont/Chemours, который заменил ПФОК. Заменители Solvay для PFNA, карбоксилаты перфторполиэфира и сульфонаты хлорперфторэфира (PFPESA), как теперь известно, обладают способностью к биоаккумуляции и невероятно токсичны.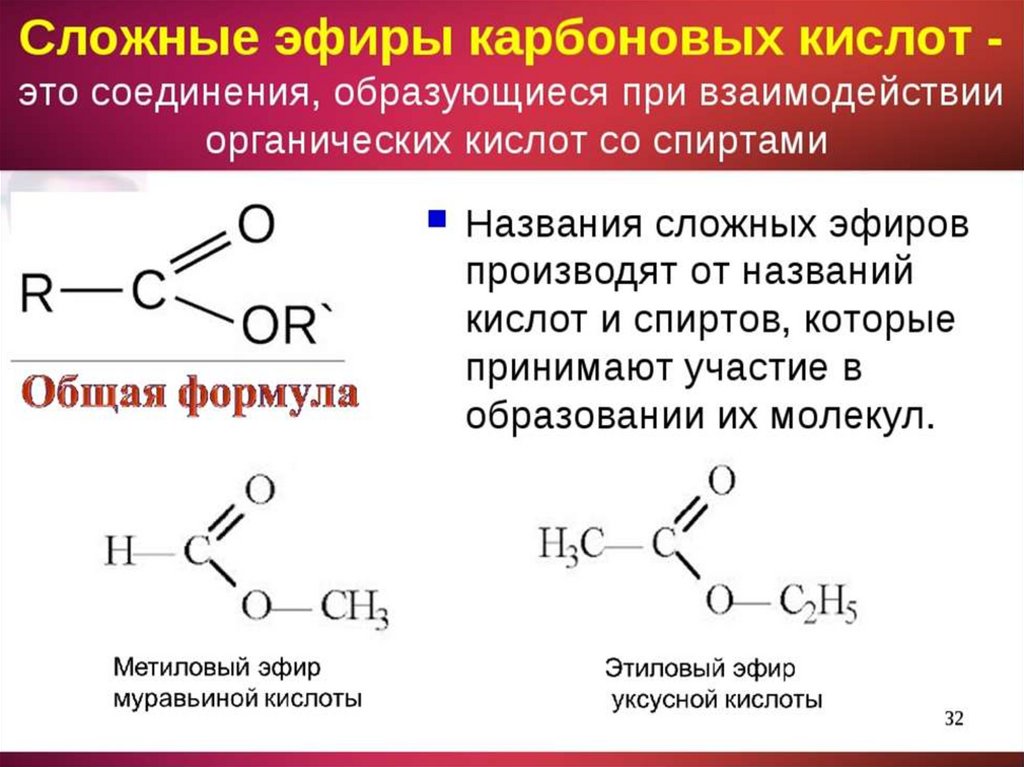 EWG обратилась в EPA с просьбой оштрафовать Solvay за сокрытие исследований, показывающих токсичность этих заменителей PFAS. Токсичность этих эфирных соединений очевидна во Временных критериях качества грунтовых вод, опубликованных в Нью-Джерси для хлорперфторполиэфиркарбоксилатов в количестве 2 частей на триллион в воде, что ниже государственных пределов для ПФОК, ПФОС или ПФНК.
EWG обратилась в EPA с просьбой оштрафовать Solvay за сокрытие исследований, показывающих токсичность этих заменителей PFAS. Токсичность этих эфирных соединений очевидна во Временных критериях качества грунтовых вод, опубликованных в Нью-Джерси для хлорперфторполиэфиркарбоксилатов в количестве 2 частей на триллион в воде, что ниже государственных пределов для ПФОК, ПФОС или ПФНК.
PFMOAA и эти перфторированные эфиры относятся к этому классу PFAS, который подлежит регулированию.
Вместе с более чем дюжиной коллег я был соавтором публикации, призывающей к использованию широкого определения и классового подхода для рассмотрения и лечения PFAS.
EWG поддержала законодательство по использованию определения PFAS, которое включает все соединения с фторированным атомом углерода. И мы присоединились к другим ученым и организациям в письме в EPA, организованном Earthjustice, с просьбой использовать новое определение ОЭСР. Оба определения будут включать перфторалкиловые эфиры карбоновых кислот, обнаруженные у людей и в окружающей среде.