Содержание
Простые эфиры. Номенклатура, получение, свойства
Сегодня урок по химии 37 – Простые эфиры. Номенклатура, получение, свойства
Простыми эфирами называются продукты замещения атома водорода в гидроксиле спирта на углеводородный радикал. Общая формула R- О – R1 где R и R1 — радикалы.
Называют простые эфиры по радикалам, входящим в их состав. По международной номенклатуре простые эфиры обозначают как производные углеводородов, в которых атом водорода замещен алкоксигруппой (RО -). Например:
СН3 – О – СН3 диметиловый эфир, метоксиметан
Способы получения простых эфиров.
1. Из спиртов в присутствии водоотнимающих средств (например, Н2SО4) при 140 оС
С2Н5ОН + ННSО4 → С2Н5SО4Н + Н2О
С2Н5SО4Н + НОС2Н5 → С2Н5 – О – С2Н5 + Н2SО4
2. Реакцией алкоголятов с галоидными алкилами
Реакцией алкоголятов с галоидными алкилами
СН3ОК + СIС2Н5 → СН3 – О – С2Н5 + КСI
Химические свойства простых эфиров.
В отличие от спиртов и сложных эфиров, простые эфиры являются химически стойкими веществами. На них не действует едкие щелочи и большинство кислот за исключением концентрированной серной и йодистоводородной кислот.
1. Реакция с конц. серной кислотой
С2 Н5 – О – С2Н5 + Н2SО4 → С2Н5ОSО3Н + С2Н5ОН
2. Реакция с йодистоводородистой кислотой
С2Н5 – О – С2Н5 + НI → С2Н5ОН + С2Н5I
3. Окисление с образованием пероксидных и гидропероксидных соединений
[O]
С2Н5 – О – С2Н5 → С2Н5 – О – О – С2Н5 + С2Н5 – О – О — Н
4. Расщепление металлическим натрием при нагревании (реакция Шорыгина П.П.):
Расщепление металлическим натрием при нагревании (реакция Шорыгина П.П.):
С2Н5 – О – С2Н5 + 2Nа → С2Н5 – ОNа + С2Н5Nа
Простые эфиры хорошо растворяют многие органические вещества и поэтому часто используются как растворители. К важнейшим простым эфирам относятся и гетероциклические кислородсодержащие соединения – этиленоксид (эпоксид) и диоксан.
Это был урок по химии 37 – Простые эфиры. Номенклатура, получение, свойства
Поделитесь этим постом со своими друзьями:
↑Как установить такие кнопки?↑
Подружитесь со мной:
Простые эфиры — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
(Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Простые эфиры
Простые эфиры — органические вещества,
имеющие формулу R-O-R1, где R и R1 —
углеводородные радикалы.
Простые эфиры -ангидриды спиртов, так
как их можно получить, отняв одну
молекулу воды от двух молекул спирта
R-OH — h3O
R-OH
R
O R
3. Номенклатура
1 способ: по названию радикалов, которые
входят в их состав.
Ch4-O-Ch4
диметиловый эфир
Ch4-O-C2H5
метилэтиловый эфир
Ch4-Ch3-Ch3 –Ch3- O-Ch4
C6H5-O –C6H5
C6H5-O- C8h27
Ch4-Ch3-Ch3 –Ch3- O-C-(Ch4 )3
5. 2. сп. По международной номенклатуре ИЮПАК
простые эфиры обозначают как
производные углеводородов, в которых
атом водорода замещен
алкоксигруппой ( RO-),
метоксигруппой Ch4O-.
Ch4OCh4 – метоксиметан,
C2H5OCh4– метоксиэтан.
6. (Ch4)3 CO- Ch3Ch4
7. Изомерия
1. Структурная изомерия
(изомерии радикалов, которые могут
иметь прямую или разветвленную
цепь)
2. метамерия — разновидность
метамерия — разновидность
структурной изомерии, которая
обусловлена длиной цепи радикала.
Ch4-Ch3- O — Ch3- Ch4
Ch4-Ch3-Ch3 –O-Ch4
ПОЛУЧЕНИЕ
ПРОСТЫХ ЭФИРОВ
Дегидратация
спиртов
(ОТЩЕПЛЕНИЕ h3O
ОТ 2-Х
МОЛЕКУЛ СПИРТА)
ВЗАИМОДЕЙСТВИЕ
ГАЛОГЕНПРОИЗВОД
НЫХ
С АЛКОГОЛЯТАМИ
1й способ получения: межмолекулярная
дегидратация спиртов
C3H7 -OH + HO-C3H7 t, к. h3SO4 C3H7-O-C3H7
— h3O
пропоксипропан
2й способ: реакции Вильямсона
( взаимодействие алкоксидов с
галогеналканами)
C2H5ONa + I-C2H5
этоксид натрия
С2H5-O-C2H5 + NaI
этоксиэтан
3-ий способ
Взаимодействие спиртов с алкенами в
присутствии кислотных катализаторов.
Протекает по правилу Марковникова.
(Ch4)2C=Ch3 + Ch4OH → (Ch4)3C-O- Ch4
изобутен
трет- бутилометиловый
эфир
13. Физические свойства
Первые два представителя эфиров – диметиловый эфир
Ch4OCh4 и этилметиловый эфир Ch4-O-C2H5 газообразные вещества.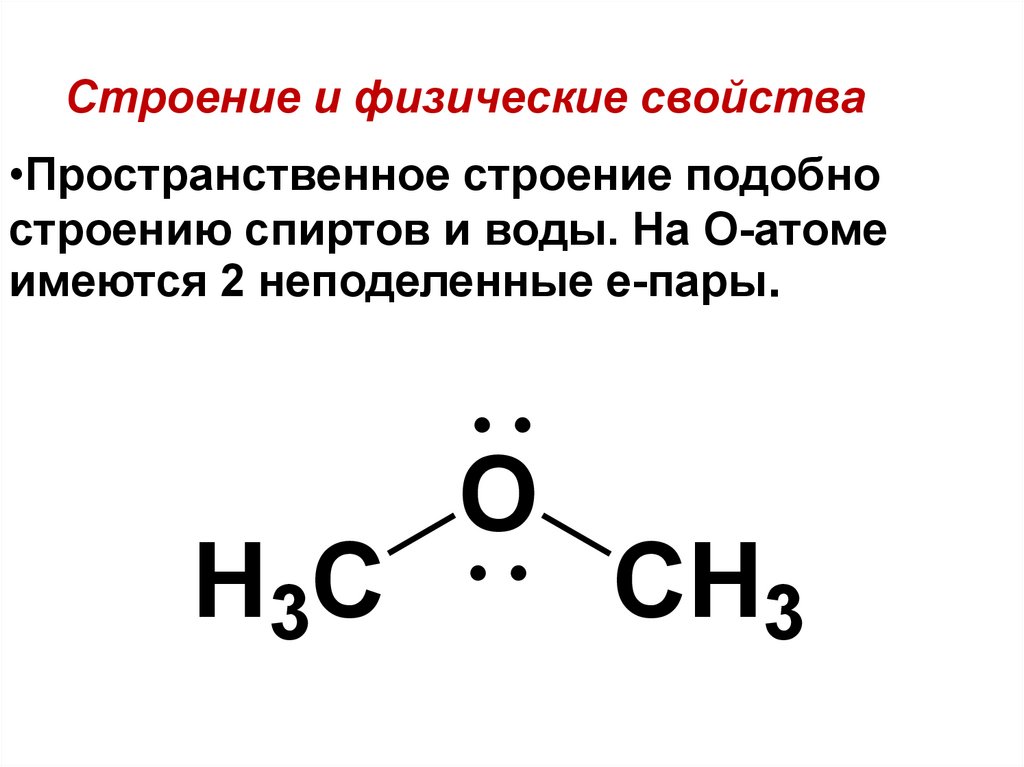
Начиная с диэтилового эфира C2H5-O-C2H5 вещества
-бесцветные, легкоподвижные жидкости.
Простые эфиры легче воды и почти не растворяются в
ней. В органических растворителях эфиры растворяются
легко и сами растворяют многие органические вещества.
14. Химические свойства
IV
Не подвергаются гидролизу
ХИМИЧЕСКИЕ СВОЙСТВА
I
РЕАКЦИИ
РАЗЛОЖЕНИЯ
h3SO4
II
III
ОБРАЗОВАНИЕ
СОЛЕЙ
ОКСОНИЯ
РЕАКЦИИ
ОКИСЛЕНИЯ
HI
Na
перекиси
16. Концентрированная серная кислота разлагает простые эфиры, с образованием сложного эфира серной кислоты и спирта.
C2H5 – O–C2H5 + h3SO4 →
C2H5 – O- SO3H + C2H5OH
Этилсерная кислота
Этанол
17. Реакции разложения
при нагревании концентрированными HBr или
HI с образованием галогеналканов.
Ch4 – O–C2H5 + HI → Ch4I + C2H5I + h3O
18. На холоду иодоводородная кислота разлагает с образованием галогеналкана и спирта
Ch4 – O–C2H5 + HI → Ch4I + C2H5ОН.
C2H5-O-C2H5 + 2Na
этоксиэтан
C2H5ONa + C2H5Na
этоксид натрия
натрийорганическое соединение
20. Образование оксониевых солей.
C2H5→O←C2H5 + h3SO4 →
[(C2H5)2→O: H]+ HSO4 гидросульфат диэтилоксония.
21. 3.Реакции окисления.
22. Окисление в α-положении к эфирному кислороду образуются гидроперекиси эфиров.
Окисление в α-положении к
эфирному кислороду образуются
гидроперекиси эфиров.
23. Небольшое количество иода обнаруживают, добавив в пробу раствор крахмального клейстера, который образует с иодом соединение
синего цвета
R-O-O-H + 2KI + h3O → R-OH + I2 + 2 KOH
Диэтиловый эфир
Эфир для наркоза (Aether anaestheticus
seu Aether pro narcosi) Положительными сторонами эфира является хорошее
расслабляющее действие на скелетную мускулатуру.
• Эфир медицинский (Aether medicinalis)— применяется наружно. В смеси 1:1
с этиловым спиртом применяется для обработки очагов поражения при
красной волчанке и красных угрях, а также в производстве коллодия
• В стоматологической практике — местно, для
обработки кариозных полостей и корневых
каналов зуба при подготовке к пломбированию.
Дифенгидрамина гидрохлорид (Diphenhydramine
hydrochloride)
Названия препаратов — Бенадрил, Грандим, Димедрол, Псило-бальзам.
Фармакодинамика и фармакокинетика:
Дифенгидрамина гидрохлорид – блокатор гистаминовых Н1-рецепторов.
Вещество обладает ярко выраженное антигистаминной активностью.
Средство оказывает местное обезболивающее действие, расслабляет
гладкомышечную мускулатуру, блокирует в умеренной степени
холинорецепторы нервных узлов. Препарат устраняет различные,
вызванные гистамином эффекты, повышает проницаемость капилляров,
снимает отечность, гиперемию и зуд.
Диэтиловый эфир –для наркоза при хирургических
операциях.
Димедрол – противогистаминный препарат,
(крапивница, отек Квинке и др.)
Бутилвиниловый эфир
поливинилбутиловый эфир входит в состав «Винилин»
или «Бальзам Шостаковского».
Фармакологическое действие: Обладает противомикробным действием, способствует
очищению ран, регенерации тканей и эпителизации.
При приеме внутрь действует как обволакивающее, противовоспалительное и
бактериостатическое средство.
Показания к применению:
Наружно: фурункулы, карбункулы, трофические язвы, гнойные раны, мастит, ранения
мягких тканей, ожоги и обморожения.
Внутрь: в комплексном лечении эрозивно-язвенных заболеваний желудка и 12-перстной
кишки, обострение хронических гастритов с повышенной секреторной функцией желудка.
Способ получения бутилвинилового эфира
HC≡CH + HOCh3Ch3Ch3Ch4 →
Ацетилен
бутанол-1
h3C=CH -OCh3Ch3Ch3Ch4
бутилвиниловый эфир
nh3C=CH –OC4H9 → [-h3C-CH –]n
OC4H9
English
Русский
Правила
Эфиры — Alfa Chemistry
Эфиры
Введение
Рис. 1 Структура эфира
Эфиры представляют собой класс органических соединений, которые содержат эфирную группу — атом кислорода, связанный с двумя алкильными или арильными группами. Они могут быть получены из спиртов, в которых атомы Н гидроксила заменены алкильными группами.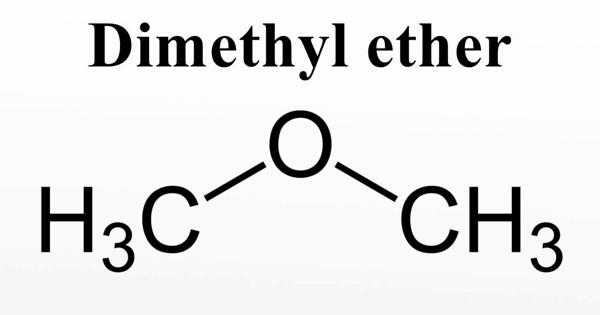 Простые эфиры имеют общую формулу R–O–R’ и могут существовать в виде атомов углерода с прямой цепью или в составе углеродного кольца. Эфиры можно разделить на две разновидности: если алкильные группы одинаковы по обе стороны от атома кислорода, то это простой или симметричный эфир, а если алкильные группы разные, то эфиры называются смешанными или несимметричными эфирами. Простые эфиры распространены в органической химии и еще более распространены в биохимии, поскольку они являются обычными связями в углеводах и лигнине.
Простые эфиры имеют общую формулу R–O–R’ и могут существовать в виде атомов углерода с прямой цепью или в составе углеродного кольца. Эфиры можно разделить на две разновидности: если алкильные группы одинаковы по обе стороны от атома кислорода, то это простой или симметричный эфир, а если алкильные группы разные, то эфиры называются смешанными или несимметричными эфирами. Простые эфиры распространены в органической химии и еще более распространены в биохимии, поскольку они являются обычными связями в углеводах и лигнине.
Свойства
Диметиловый эфир и этилметиловый эфир представляют собой газы при обычной температуре, а другие их гомологи обычно представляют собой бесцветные летучие жидкости с характерным эфирным запахом. Связи С-О в эфире полярны, поэтому простые эфиры лишь немного более полярны, чем алкены, но не настолько полярны, как спирты, сложные эфиры или амиды сопоставимой структуры. Молекулы эфира не могут образовывать водородные связи друг с другом, что приводит к относительно низким температурам кипения по сравнению с аналогичными спиртами. Большинство эфиров нерастворимы в воде, так как их атомы кислорода окружены в молекулах, что затрудняет образование водородных связей с водой. Но циклические эфиры, такие как тетрагидрофуран и 1,4-диоксан, смешиваются с водой из-за более открытого атома кислорода для водородных связей по сравнению с линейными алифатическими эфирами. Эфиры заметно растворимы в органических растворителях, таких как спирт, бензол, ацетон и т. д. Эфиры, как правило, очень нереакционноспособны по своей природе. При добавлении к эфиру избытка галогеноводорода происходит разрыв связи С-О, что приводит к образованию алкилгалогенидов.
Большинство эфиров нерастворимы в воде, так как их атомы кислорода окружены в молекулах, что затрудняет образование водородных связей с водой. Но циклические эфиры, такие как тетрагидрофуран и 1,4-диоксан, смешиваются с водой из-за более открытого атома кислорода для водородных связей по сравнению с линейными алифатическими эфирами. Эфиры заметно растворимы в органических растворителях, таких как спирт, бензол, ацетон и т. д. Эфиры, как правило, очень нереакционноспособны по своей природе. При добавлении к эфиру избытка галогеноводорода происходит разрыв связи С-О, что приводит к образованию алкилгалогенидов.
R-O-R + HX → RX + R-OH
Применение
Реагенты или растворители: Эфиры могут использоваться в качестве превосходных растворителей, реагентов или экстрагентов, применяемых во многих химических реакциях. Они считаются неполярными и поэтому могут растворять неполярные вещества. Кроме того, эфиры являются прекрасными растворителями жиров, восков, масел, отдушек, алкалоидов и камедей.

Топливо на основе диметилового эфира: Диметиловый эфир был испытан в качестве транспортного топлива, поскольку он относительно нетоксичен и имеет более высокое цетановое число, чем дизельное топливо. Более высокое цетановое число означает, что диметиловый эфир сгорает чище и полнее, чем дизельное топливо, что оптимизирует энергоэффективность автомобиля.
Применение полиэтиленгликоля (ПЭГ): Полиэтиленгликоль (ПЭГ) представляет собой класс длинноцепочечных соединений, содержащих эфирные связи, с химической структурой H-(O-CH 2 -CH 2 ) н -ОН. Низкомолекулярные цепи ПЭГ можно использовать в качестве слабительных средств, кремов для кожи, смазок, диспергаторов в зубных пастах, загустителей и связующих веществ в таблетках и формах. Цепи PEG с более крупными молекулами часто используются в качестве упаковочных материалов для пищевых продуктов, связующих веществ и загустителей для красок, а также полярных неподвижных фаз для газовой хроматографии.

Применение краун-эфиров: Краун-эфиры представляют собой циклические химические соединения, состоящие из кольца, содержащего несколько эфирных групп. Краун-эфиры могут прочно связывать определенные катионы, образуя комплексы. Атомы кислорода хорошо расположены для координации с катионом, расположенным внутри кольца, тогда как внешняя часть кольца гидрофобна. Образующиеся катионы часто образуют соли, растворимые в неполярных растворителях, и по этой причине краун-эфиры полезны в межфазном катализе.
Рис. 2 Полиэтиленгликоль (ПЭГ)
Рис. 3 Структуры обычных краун-эфиров
Спирты и простые эфиры
Спирты и простые эфиры
Спирты и эфиры
| Наименование спиртов | Проверка уровня алкоголя в крови | Растворимость спиртов | Первичный, вторичный и третичный Спирты | Фенолы |
| Температуры кипения спиртов | Спирты в виде кислот и оснований | Получение спиртов | Эфиры | Спирты против эфиров |
Наименование спиртов
Спирты содержат группу ОН, присоединенную к насыщенному углероду. Общие названия спиртов
Общие названия спиртов
по названию алкильной группы.
| CH 3 OH | Спирт метиловый | ||
| CH 3 CH 2 OH | Спирт этиловый | ||
| СН 3 СНОНСН 3 | Изопропиловый спирт |
Систематическая номенклатура спиртов добавляет окончание -ol к названию спирта.
исходный алкан и использует число для идентификации углерода, несущего группу ОН. Систематическое название для
изопропиловый спирт, например, представляет собой 2-пропанол.
| CH 3 OH | Метанол | ||
| CH 3 CH 2 OH | Этанол | ||
| СН 3 СНОНСН 3 | 2-пропанол |
| Практическое задание 6: Более 50 органических соединений имеют Нажмите здесь, чтобы проверить свой ответ на |
Метанол, или метиловый спирт, также известен как древесный спирт , потому что он был
Первоначально производился путем нагревания древесины до дистиллированной жидкости. Метанол очень токсичен и
многие люди ослепли или умерли от его употребления. Этанол, или этиловый спирт, является
алкоголь, связанный с «алкогольными» напитками. Это сделано как минимум
6000 лет, добавляя дрожжи в растворы, богатые сахаром или крахмалом.
дрожжевые клетки получают энергию в результате катализируемых ферментами реакций, превращающих сахар или крахмал в
этанол и CO 2 .
C 6 H 12 O 6 ( aq ) 2 CH 3 CH 2 OH( aq )
+ 2 CO 2 ( г )
Когда концентрация спирта достигает 10-12% по объему, дрожжевые клетки погибают.
Бренди, ром, джин и различные виды виски с более высокой концентрацией алкоголя
получают путем перегонки спирта, полученного в результате этой реакции брожения. Этанол не
так же токсичен, как метанол, но все же опасен. Большинство людей опьянены кровью
содержание алкоголя около 0,1 г на 100 мл. Повышение уровня алкоголя в
крови до 0,4–0,6 г/100 мл может привести к коме или смерти.
Определение уровня алкоголя в крови
Предпочтительным методом определения того, находится ли человек в нетрезвом состоянии за рулем в нетрезвом состоянии или в состоянии алкогольного опьянения, является алкотестер, патент на который был выдан Р.
Ф. Боркенштейн в 1958 году. Химия алкотестера основана на реакции
между алкоголем в выдыхаемом воздухе и ионами хромата или дихромата.
3 CH 3 CH 2 OH( г ) + 2 Cr 2 O 7 2- ( aq )
+ 16 H + ( водный раствор ) 3 CH 3 CO 2 H ( водный раствор ) + 4 Cr 3+ ( водный раствор )
+ 11 Н 2 О( л )
Прибор содержит две ампулы с небольшими образцами бихромата калия.
растворяется в серной кислоте. Одна из этих ампул используется в качестве эталона. Другой открыт
и в эту ампулу добавляют анализируемый образец дыхания. Если алкоголь присутствует в
дыхание, уменьшает желто-оранжевый Cr 2 O 7 2- ион к
зеленый Cr 3+ ион. Степень, в которой цветовой баланс между двумя ампулами
нарушен, является прямым показателем количества алкоголя в образце дыхания.
Измерения содержания алкоголя в выдыхаемом воздухе затем преобразуются в оценки
концентрации алкоголя в крови, принимая, что 2100 мл воздуха выдыхается из
в легких содержится столько же алкоголя, сколько в 1 мл крови.
Измерения, проведенные с помощью алкотестера, представлены в процентах содержания алкоголя в крови.
концентрация (BAC). В большинстве штатов BAC 0,10% достаточно для DUI или DWI.
убеждение. (Это соответствует концентрации алкоголя в крови 0,10 г алкоголя).
на 100 мл крови.)
Этанол окисляется до CO 2 и H 2 O алкогольдегидрогеназой
ферментов в организме. В результате этой реакции выделяется 30 кДж на грамм, что делает этанол
лучший источник энергии, чем углеводы (17 кДж/г), и почти такой же хороший источник
энергия в виде жира (38 кДж/г). Унция спиртного напитка крепостью 80 может обеспечить до 3% алкоголя.
среднесуточное потребление калорий, а употребление алкоголя может способствовать ожирению. Много
однако алкоголики недоедают из-за отсутствия витаминов в калориях
они получают из алкогольных напитков.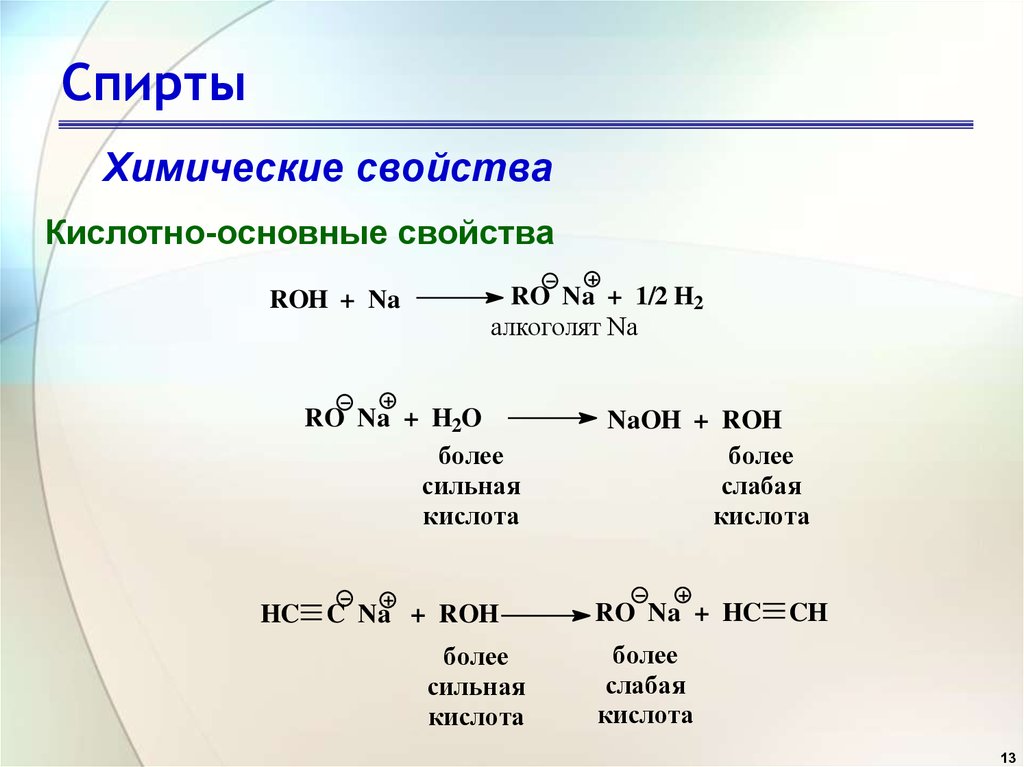
Растворимости спиртов
Как правило, полярные или ионные вещества растворяются в полярных растворителях; неполярный
вещества растворяются в неполярных растворителях. В результате углеводороды не растворяются в
вода. Часто говорят, что они не смешиваются (буквально «не смешиваются») с водой.
Спирты, как и следовало ожидать, обладают свойствами между крайними значениями углеводородов и
вода. Когда углеводородная цепь короткая, спирт растворим в воде. Здесь нет
ограничение на количество метанола (СН 3 ОН) и этанол (СН 3 СН 2 ОН),
например, то, что может раствориться в данном количестве воды. Как углеводородная цепь
становится длиннее, спирт становится менее растворимым в воде, как показано в таблице ниже.
Один конец молекулы спирта настолько неполярен, что считается гидрофобным.
(буквально «ненавидящий воду»). На другом конце находится группа -ОН,
может образовывать водородные связи с соседними молекулами воды и поэтому считается, что гидрофильный
(буквально «водолюбивый»). Чем длиннее углеводородная цепь, тем
Чем длиннее углеводородная цепь, тем
увеличивается гидрофобность молекулы и растворимость спирта в
воды постепенно уменьшается, пока не станет практически нерастворимым в воде.
Растворимость спиртов в воде
| Формула | Наименование | Растворимость в Вода (г/100 г) | ||
| CH 3 OH | метанол | бесконечно растворимый | ||
| CH 3 CH 2 OH | этанол | бесконечно растворимый | ||
| CH 3 (CH 2 ) 2 ОХ | пропанол | бесконечно растворимый | ||
| CH 3 (CH 2 ) 3 OH | бутанол | 9 | ||
| CH 3 (CH 2 ) 4 OH | пентанол | 2,7 | ||
| СН 3 (СН 2 ) 5 ОН | гексанол | 0,6 | ||
| CH 3 (CH 2 ) 6 OH | гептанол | 0,18 | ||
| CH 3 (CH 2 ) 7 OH | октанол | 0,054 | ||
| CH 3 (CH 2 ) 9 OH | деканол | нерастворим в воде |
Первичные, вторичные и третичные спирты
Спирты классифицируются как первичные (1), вторичные (2) или третичный
(3) на основе их структур.
Этанол является первичным спиртом, так как к нему присоединена только одна алкильная группа.
углерод, несущий ОН
заместитель. Структуру первичного спирта можно обозначить как RCH 2 OH,
где R обозначает алкильную группу. Изопропиловый спирт, содержащийся в медицинском спирте, является
вторичный спирт, который имеет две алкильные группы на атоме углерода с заместителем ОН (R 2 СНОН).
Примером третичного спирта (R 3 COH) является трет -бутил (или t -бутил).
спирт или 2-метил-2-пропанол.
Фенолы
Другим классом спиртов являются фенолы , в которых группа ОН присоединена к ароматической
кольцо, как показано на рисунке ниже. Фенолы являются сильнодействующими дезинфицирующими средствами. Когда антисептик
методы были впервые представлены в 1860-х годах Джозефом Листером, это был фенол (или карболовая
кислота, как ее тогда называли), которая использовалась. Производные фенола, такие как или -фенилфенол,
Производные фенола, такие как или -фенилфенол,
до сих пор используются в коммерческих дезинфицирующих средствах, таких как Lysol.
Температуры кипения спиртов
Вода имеет необычно высокую температуру кипения из-за водородных связей.
между молекулами H 2 O. Спирты могут образовывать аналогичные водородные связи, как показано
на рисунке ниже.
В результате температуры кипения спиртов намного выше, чем у алканов с
близкие молекулярные массы. Температура кипения этанола, например, составляет 78,5°С, тогда как
пропан с примерно такой же молекулярной массой кипит при -42,1°С.
Спирты как кислоты и основания
Спирты – кислоты Бренстеда в водном растворе.
CH 3 CH 2 OH( водный ) + H 2 O( л )
H 3 O + ( водный )
+ CH 3 CH 2 O — ( aq )
Таким образом, спирты реагируют с металлическим натрием с образованием солей натрия соответствующих
сопряженное основание.
2 Na( с ) + 2 CH 3 OH( l ) 2 Na + ( алк )
+ 2 CH 3 O — ( алк ) + H 2 ( г )
Сопряженное основание спирта известно как алкоксид .
| [Na + ][CH 3 O — ] | [На + ][CH 3 CH 2 O — ] | ||
| метоксид натрия | этоксид натрия |
Приготовление спиртов
Спирты можно получить добавлением воды к алкену в присутствии сильной кислоты.
Например, концентрированная серная кислота. Эта реакция включает добавление H 2 О
молекулы через двойную связь С=С. Поскольку эти реакции подчиняются правилу Марковникова, продукт реакции равен
часто сильно замещенный 2 или 3 спирт.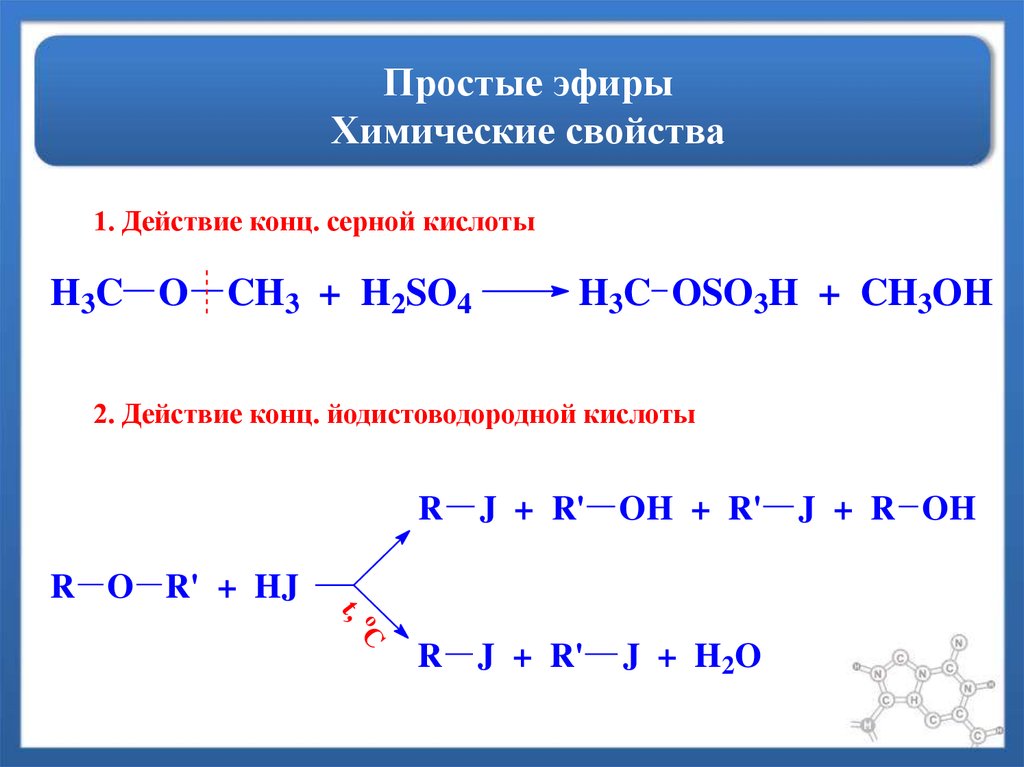
Менее замещенные 1 спирты могут быть получены реакциями замещения, которые происходят, когда
первичному алкилгалогениду позволяют реагировать с ионом ОН — .
CH 3 CH 2 CH 2 Br + OH — CH 3 СН 2 СН 2 ОН
+Бр —
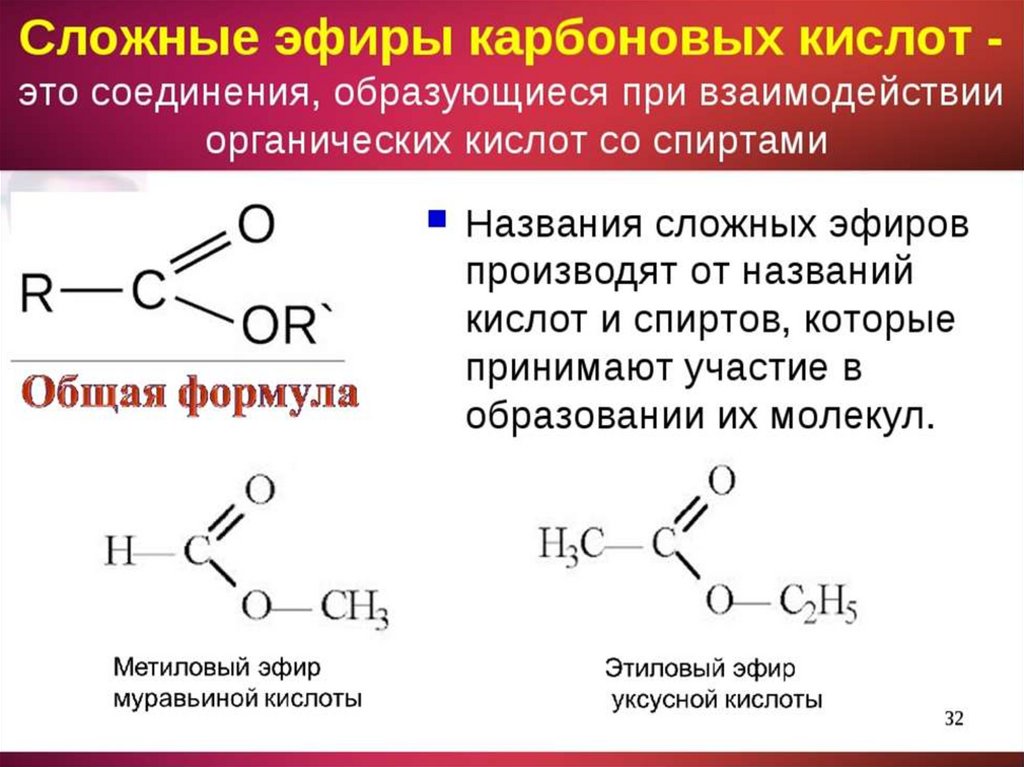
Эфиры
Спирты (ROH) можно рассматривать как производные воды, в которых один из атомов водорода
атомы заменены алкильной группой. Если заменить оба атома водорода на
алкильных групп, получаем эфир (РОР). Эти соединения названы добавлением
слово эфир к названиям алкильных групп.
| CH 3 CH 2 OCH 2 CH 3 | диэтиловый эфир |
Диэтиловый эфир, часто известный под общим названием «эфир», когда-то использовался
широко используется как анестетик.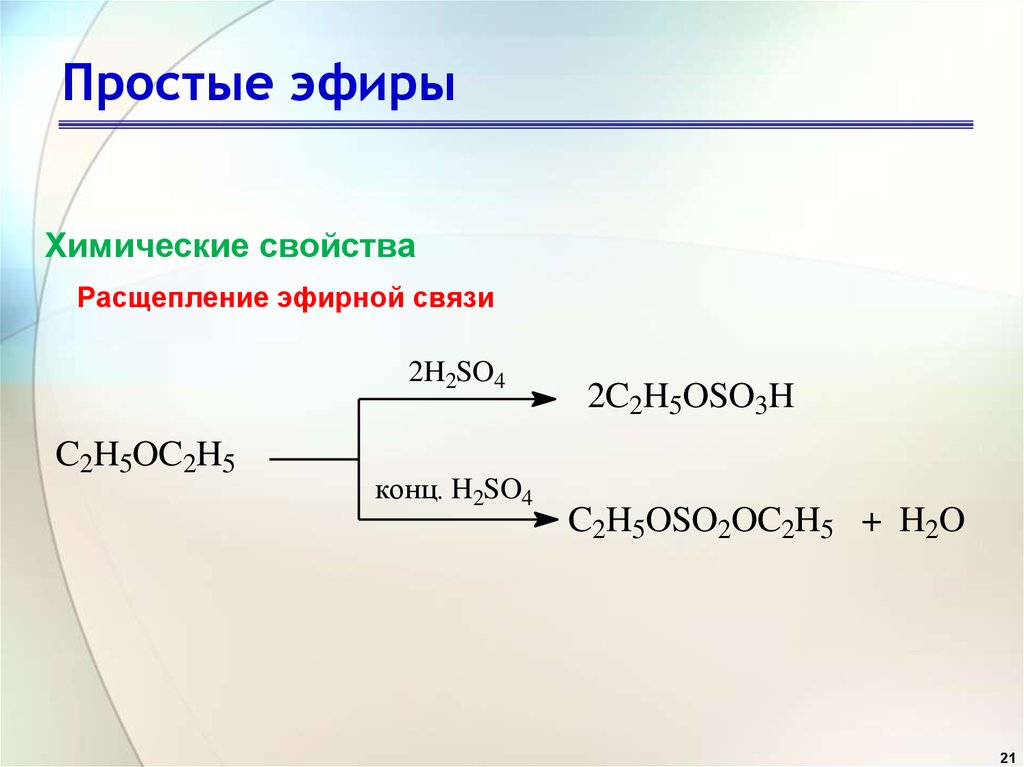 Так как смеси диэтилового эфира и воздуха взрываются в
Так как смеси диэтилового эфира и воздуха взрываются в
наличие искры, эфир был заменен более безопасными анестетиками.
Спирты против эфиров
Существуют важные различия как между физическими, так и химическими свойствами
спирты и эфиры. Рассмотрим, например, диэтиловый эфир и 1-бутанол, которые
структурные изомеры с формулой C 4 H 10 O.
| СН 3 СН 2 ОСН 2 СН 3 | CH 3 CH 2 CH 2 CH 2 OH | |||
| ВР = 34,5С | ВР = 117,2С | |||
| d = 0,7138 г/мл | d = 0,8098 г/мл | |||
| не растворим в воде | растворим в воде |
Формы этих молекул очень похожи, как показано на рисунке ниже.
Принципиальным отличием этих соединений является наличие в спирте ОН-групп, которые
отсутствует в эфире. Поскольку водородные связи не могут образовываться между молекулами в
эфира, температура кипения этого соединения более чем на 80°С ниже, чем у соответствующего
алкоголь. Поскольку водородные связи для организации структуры жидкости отсутствуют,
эфир значительно менее плотный, чем соответствующий спирт.
Эфиры могут действовать как акцепторы водородных связей, как показано на рисунке ниже. Но они
не могут выступать в качестве доноров водородных связей. В результате эфиры менее растворимы в
воды, чем спирт с той же молекулярной массой.
Отсутствие группы ОН в
эфир также имеет важные последствия для его химических свойств. В отличие от спиртов,
эфиры практически инертны к химическим реакциям. Они не реагируют с большинством окислителей.
или восстановители, и они устойчивы к большинству кислот и оснований, за исключением высоких
температуры. Поэтому они часто используются в качестве растворителей для химических реакций.
Поэтому они часто используются в качестве растворителей для химических реакций.
Соединения, которые являются потенциальными источниками иона H + , или
протона, часто описываются как протонные . Этанол, например, является протонным
растворитель.
CH 3 CH 2 OH( водный ) + H 2 O( л )
H 3 O + ( водный )
+ CH 3 CH 2 O — ( aq )
Вещества, которые не могут служить источником протона, называются апротонный .
Потому что они не содержат ОН
группа, эфиры апротонные растворители.
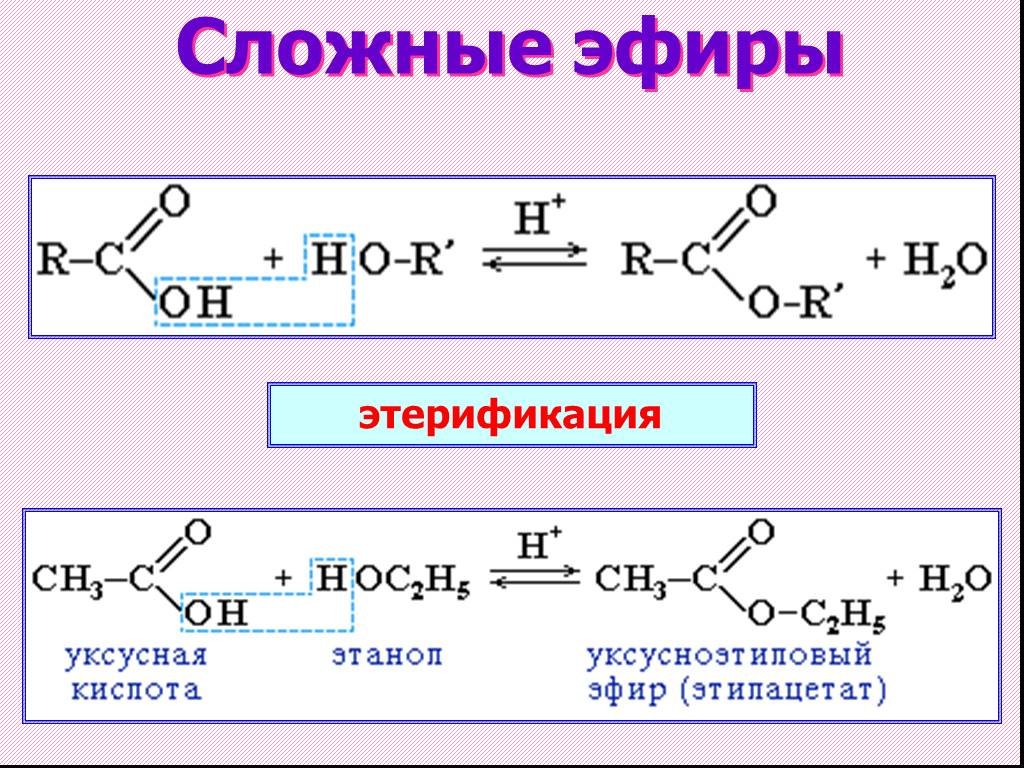
Эфиры можно синтезировать, расщепляя молекулу воды между двумя спиртами в
наличие тепла и концентрированной серной кислоты.
| Н + | ||||
| 2 CH 3 CH 2 ОХ | CH 3 CH 2 OCH 2 CH 3 |
Они также могут быть образованы реакцией первичного алкилгалогенида с ионом алкоксида.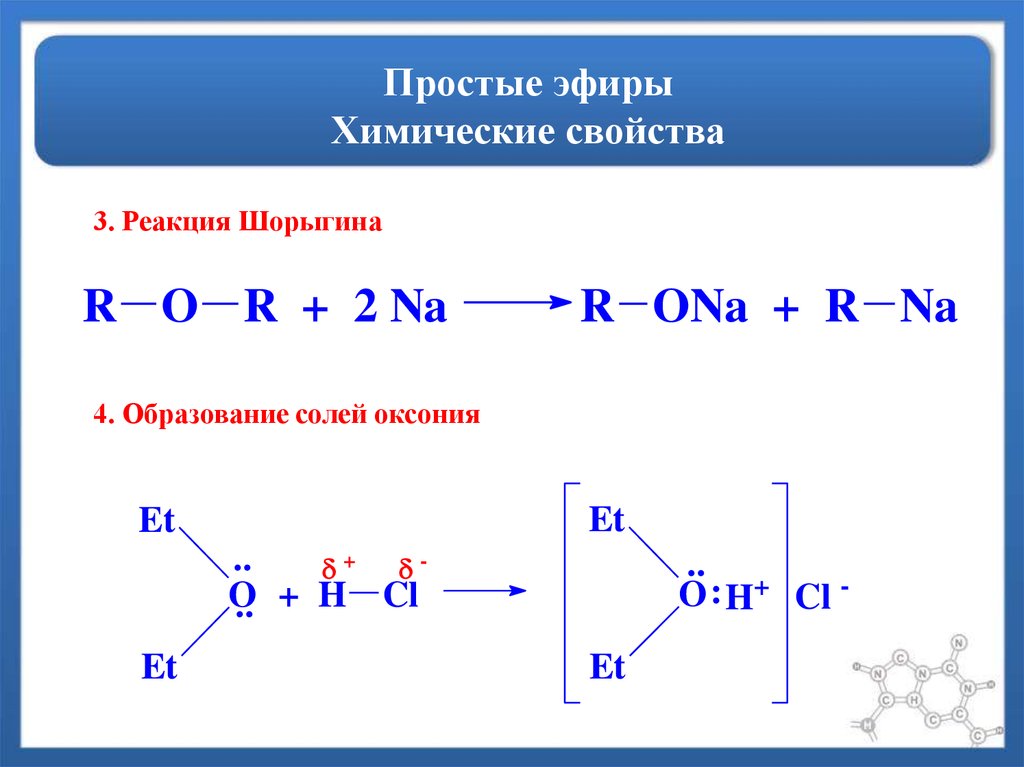

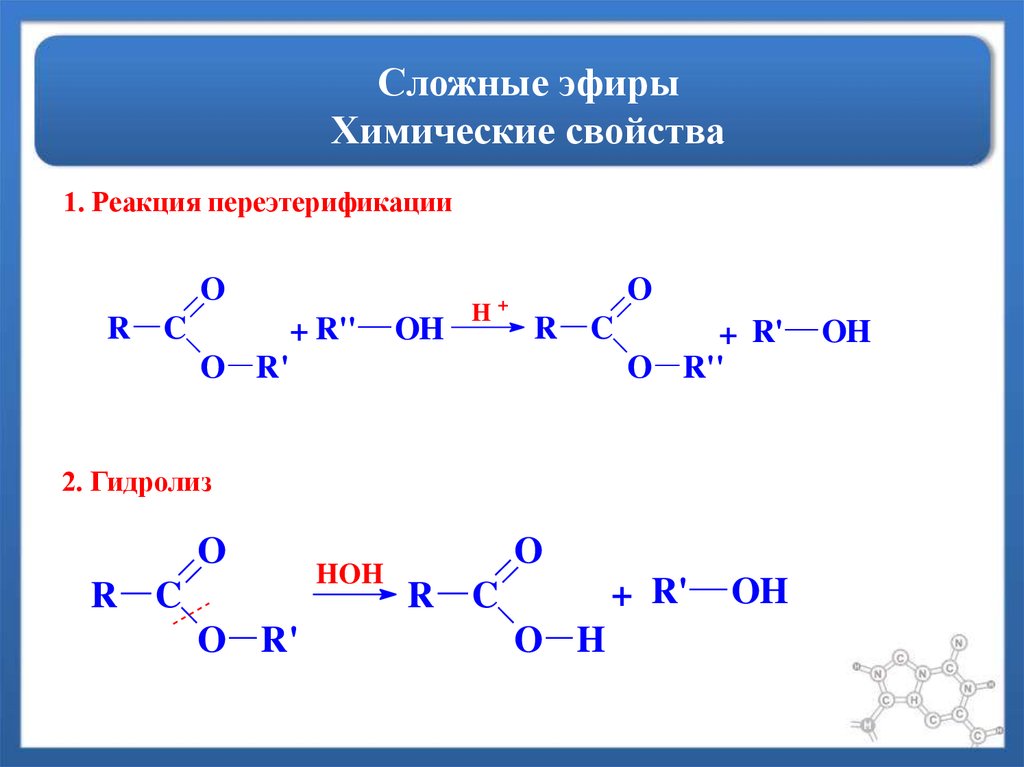 Один из
Один из