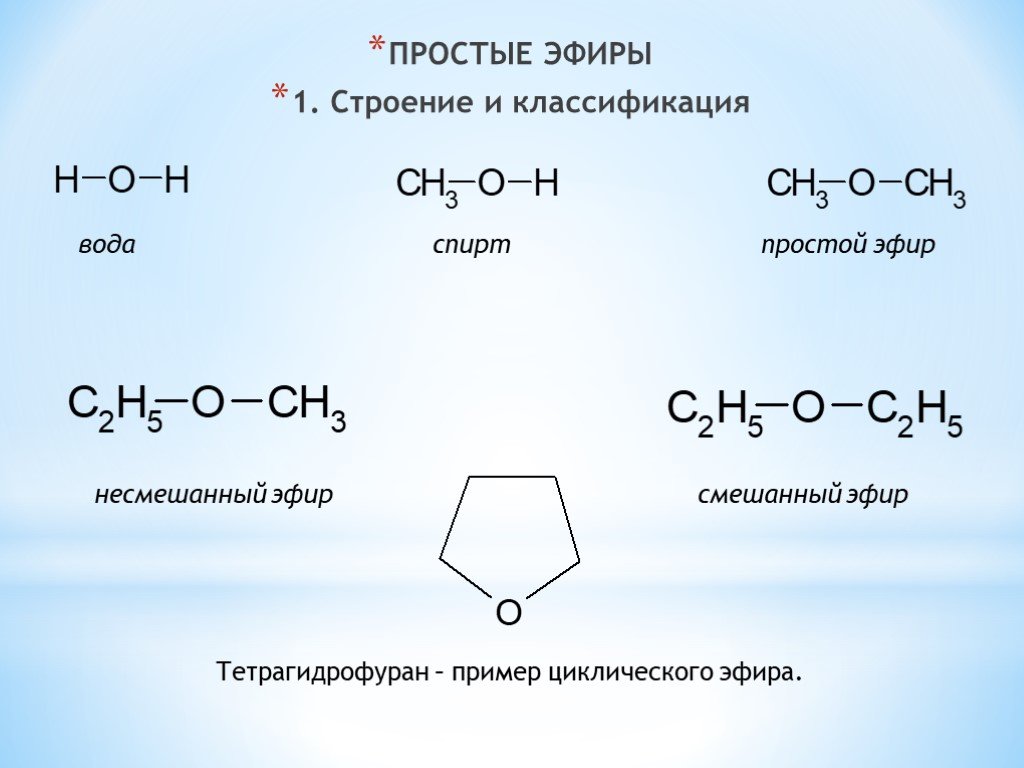
Содержание
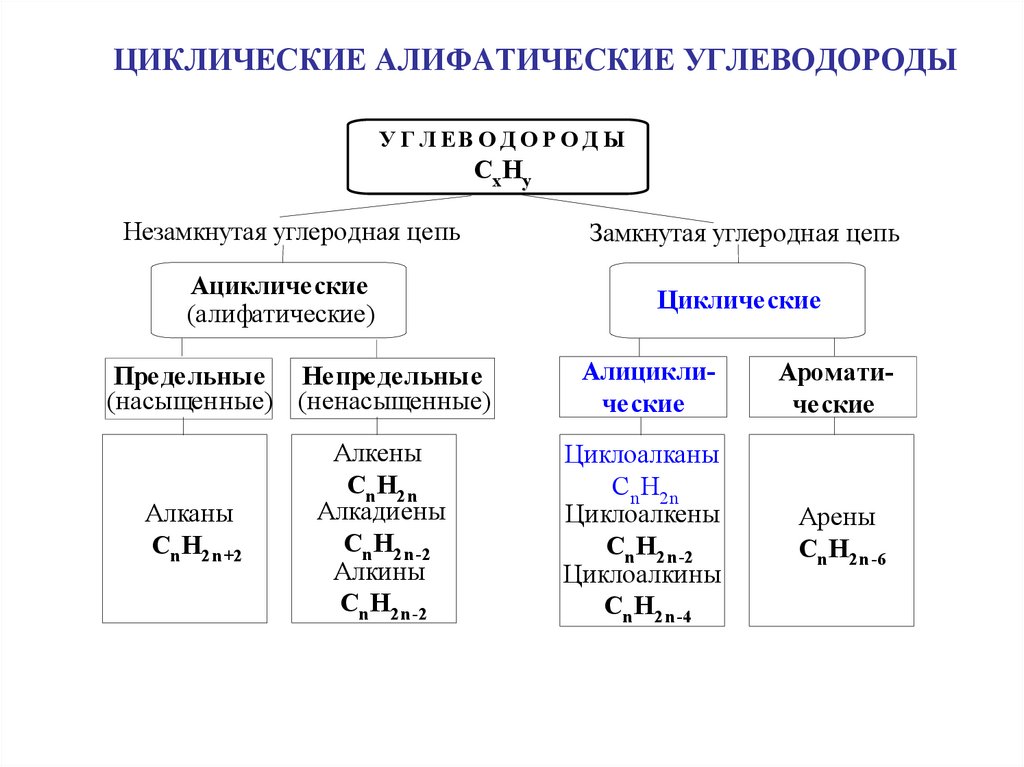
Эфиры с открытой цепью и циклические эфиры
Эфирами
называют кислородсодержащие органические
соединения, в которых
две атомные группировки (органические
или органическая и неорганическая)
связаны кислородным атомом.
Эфиры
могут быть простыми (I)
и сложными (II):
В
зависимости от характера радикала,
связанного с атомом кислорода,
эфиры могут быть предельными и
непредельными:
Эфиры
с
открытой цепью (простые
эфиры) можно рассматривать либо
как ангидриды спиртов, либо
как диалкилпроизводные воды. Это
значительно менее реакционноспособные
соединения,
чем спирты, ближайшими производными
которых они являются.
Простые
эфиры (оксиды
алкилов)—
это органические соединения, в которых
два углеводородных
радикала связаны между собой атомом
кислорода (кислородным мостиком).
Общая
формула простых эфиров R–О–R
Строение.
Простые
эфиры можно рассматривать как продукты
замещения двух водородных атомов в
молекуле воды на углеводородные
радикалы:
или
замещение гидроксильного водорода в
молекуле спирта на один
радикал:.
Простые
эфиры изомерны спиртам. Например,
молекулярной формуле
С2Н6О
соответствуют простой эфир — диметиловый
СН3–О–СН3
и этиловый
спирт С2Н5ОН.
Электронное
строение диметилового эфира можно
представить формулой:
Номенклатура.
Названия
простых эфиров обычно связывают с
названиями
радикалов, соединенных с атомом кислорода;
По
систематической номенклатуре вначале
называют алкоксигруппу (R—О—),
а затем углеводород, с которым она
связана:
Если
два радикала, связанные с кислородом,
одинаковые, то приставку
ди-
опускают.
Например, диметиловый эфир называют
метиловым,
диэтиловый — этиловым.
Изомерия.
Структурная
изомерия простых эфиров зависит от
изомерии
углеводородных радикалов, связанных с
кислородом:
Получение.
Простые
эфиры в природе не встречаются. Их
получают
синтетическим путем:
1.
Дегидратацией
спиртов
под влиянием минеральных кислот.
Механизм
этой реакции заключается в следующем.
Протон присоединяется к
электронной паре атома кислорода.
Образуется оксониевое соединение:
От
неустойчивого оксониевого соединения
отщепляется молекула воды и образуется
карбкатион:
Этот
карбкатион электрофильно атакует вторую
молекулу спирта, которая предоставляет
электронную пару для образования связи
О—С:
Реакция заканчивается
отщеплением протона:
2. |
Физические
свойства. Диметиловый
и метилэтиловый эфиры — газы,
начиная с диэтилового — бесцветные,
легкоиспаряющиеся горючие
жидкости.
Высшие
простые эфиры — твердые вещества.
Простые эфиры
плохо растворяются в воде. Служат
хорошими растворителями для
органических веществ. Из-за отсутствия
водородных связей между молекулами
эфира их температуры кипения гораздо
ниже, чем у соответствующих
спиртов.
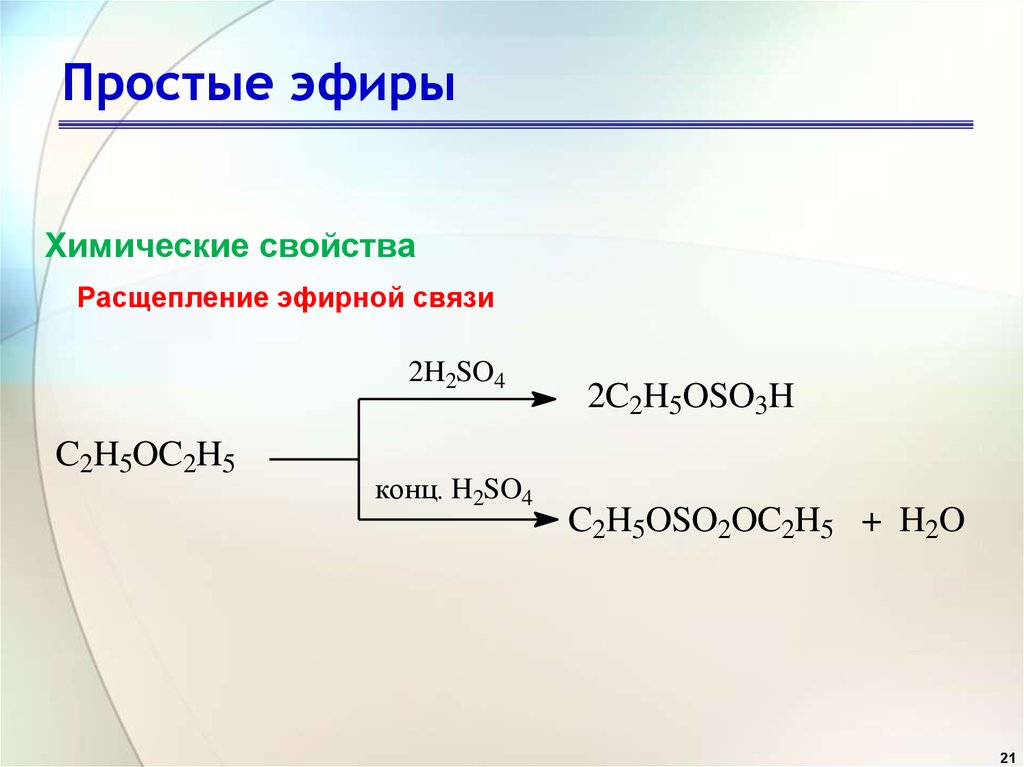
Химические
свойства. Простые
предельные эфиры — довольно инертные
соединения. В отличие от сложных эфиров
они не гидролизуются (не омыляются).
Однако концентрированная серная кислота
разлагает
эти эфиры:
Металлический
натрий при нагревании также расщепляет
простые эфиры:
При
взаимодействии эфира с концентрированным
HI
образуются спирт
и йодистый алкил:
Непредельные
простые эфиры (в отличие от предельных)
легко гидролизуются в кислой среде:
Диэтиловый
эфир, или этиловый эфир С2Н5–О–С2Н5
— очень подвижная, крайне огнеопасная
жидкость с сильным «эфирным»
запахом.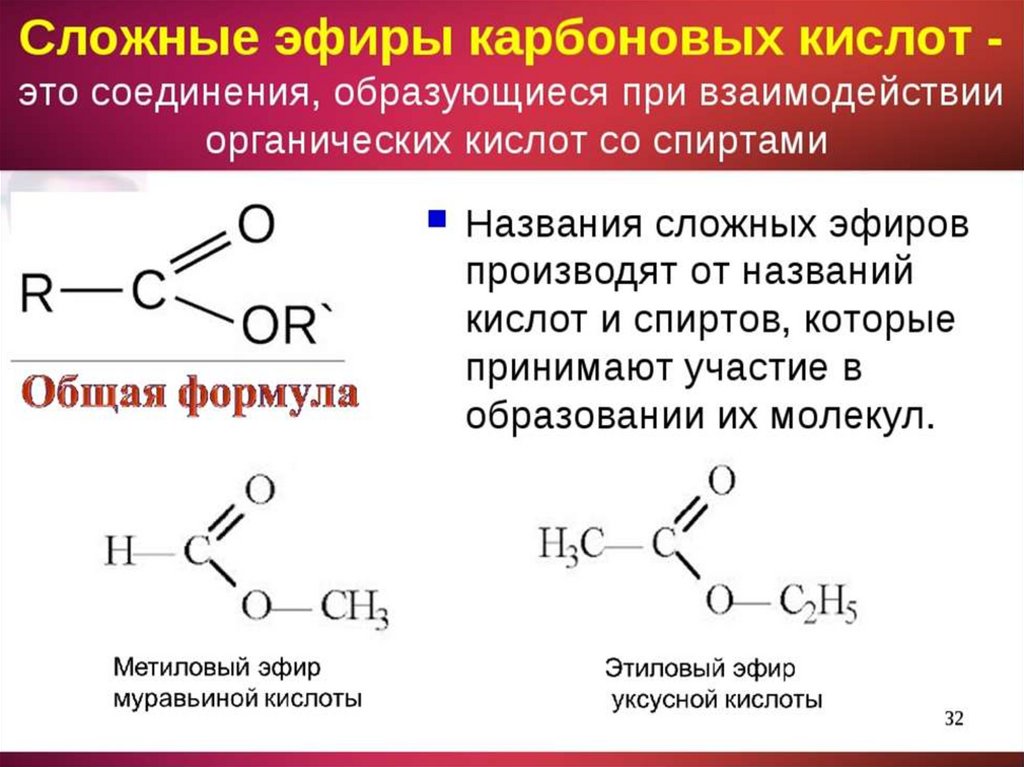 Т. кип. 34,5°С. Пары эфира
Т. кип. 34,5°С. Пары эфира
в 2,5 раза тяжелее воздуха, поэтому они
способны «стелиться» по
поверхности и могут воспламеняться от
малейшей искры даже на расстоянии.
С воздухом эфир образует взрывоопасную
смесь. Окисляясь
(особенно на свету), он образует
гидропероксид, который разлагается
со взрывом.
Чтобы
избавиться от гидропероксида, достаточно
взболтать
эфир с раствором едкой щелочи или
железного купороса. Для
проведения некоторых синтезов часто
требуется не только чистый, но и
безводный эфир (абсолютный).
Для
получения такого эфира
необходимо вначале проверить его на
отсутствие гидропероксидов, а
затем взболтать с водой для устранения
следов спирта. Затем воду отделяют
на делительной воронке, а ее следы
удаляют с помощью металлического натрия.
Этиловый
эфир применяют в качестве растворителя,
в производстве бездымного пороха,
искусственного шелка. Широко
используют в медицине.
Винилбутиловый
эфир
СН2=СН—О–С4Н9
— жидкость с т. кип.
кип.
94,1°С, плохо растворима в воде. Получают
взаимодействием ацетилена
с бутиловым спиртом. Используют для
получения некоторых
сополимеров, а также для синтеза
поливинилбутиловою
эфира:
Этот
полиэфир известен как бальзам
Шостаковского, который
применяют
при лечении ран и язв.
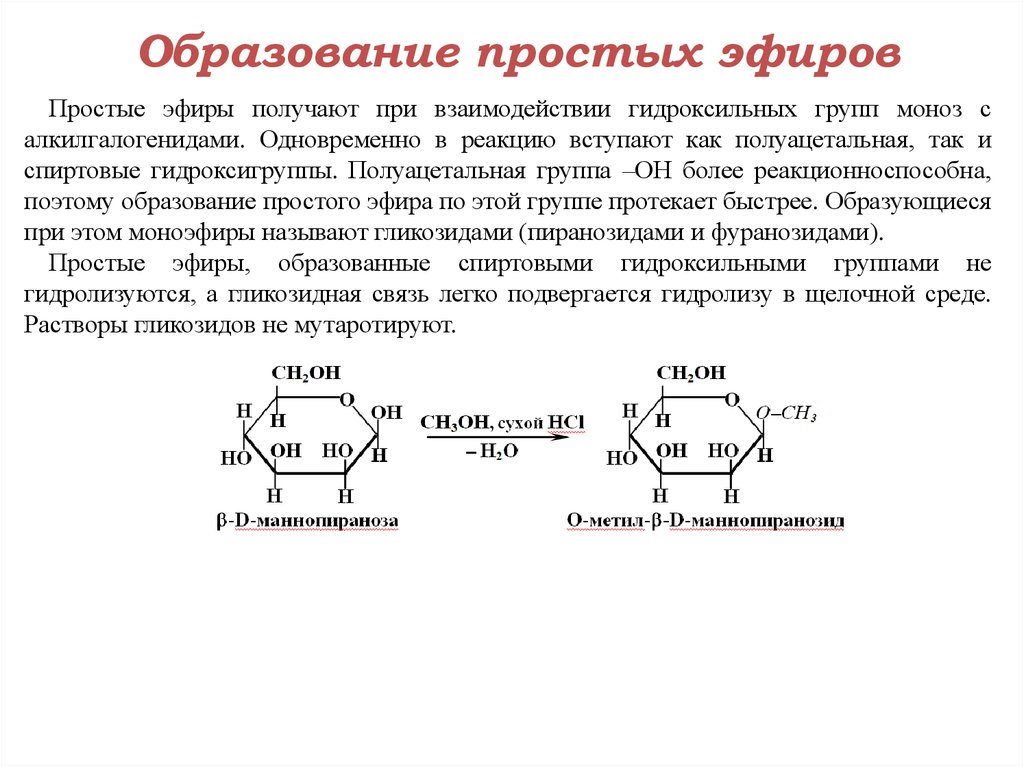
Образование
простых и сложных эфиров. Взаимодействуя
со спиртами
или кислотами (органическими или
неорганическими), гликоли
образуют простые и сложные эфиры:
Реакция
Вильямсона синтез–получение
простых эфиров (обычно
несимметричных) производят алкилированием
алкоголятов или
фенолятов алкилгалогенидами:
Для
синтеза алифатических эфиров смесь
алкоголята с алкилгалогенидом RHal
кипятят
без растворителя или в растворителе,
индифферентном к реагентам
(например, в эфире, толуоле, ксилоле).
Используют также
спиртовые растворы КОН или алкоголятов.
Для
синтеза алкилариловых эфиров кипятят
смесь небольшого
избытка AlkHal
и фенолята в спиртовом растворе. В
качестве растворителя используют также
воду, ацетон, этилацетат,
диоксан, толуол, ксилол, хлорбензол.
Углеводы О-метилируют
в жидком NH3
действием Na,
затем СН3I.
Растворитель
часто оказывает решающее влияние на
выход продуктов
реакции. Например, высокий выход эфиров
из орто-и
паро-гидроксибифенилов достигается
при проведении реакции в ацетоне; в
спирте же выходы крайне низкие. Обычно
выходы арилалкиловых эфиров с первичными
и вторичными
алкильными радикалами составляют
80-90%. Как диалкиловые, так и алкилариловые
эфиры часто удобно синтезировать
в условиях межфазного катализа. Для
повышения скорости
реакции при использовании RBr
и RCI
в реакционную
смесь добавляют NaI
в количестве 0,1-0,2 эквивалента.
В
качестве побочных продуктов в реакции
образуются олефины:
Их
количество возрастает в зависимости
от структуры AlkHal
в
ряду: первичные < вторичные < третичные.
Поэтому при получении
эфира, содержащего разветвленный
радикал, следует выбирать такую комбинацию
реагентов, чтобы разветвленный радикал
входил в состав молекулы алкоголята.
Для уменьшения выхода олефинов
целесообразно также
снижение температуры реакции и
использование менее реакционноспособных
алкоголятов (напр., магниевых) и
алкилгалогенидов
(хлоридов и бромидов вместо иодидов).
Получение
алкилариловых эфиров часто сопровождается
алкилированием
бензольного кольца (С-алкилирование).
Эта
реакция особенно характерна для
многоосновных фенолов,
содержащих ОН-группы в мета-положениях.
Направление этой реакции
существенным образом зависит от
растворителя:
в спирте, ацетоне, преобладает
О-алкилирование
(т.е. образование простых эфиров), в
водных растворах,
а также в менее полярных растворителях,
таких, как бензол,
толуол,-С-алкилирование. Для уменьшения
доли продукта
С-алкилирования реакцию проводят в
слабощелочной среде.
Синтез
осуществляется обычно по механизму
бимолекулярного
нуклеофильного замещения. В случае
В случае
третичных RHal
преобладает
мономолекулярное нуклеофильное замещение
и элиминирование.
В
модификациях синтеза в качестве
алкилирующих агентов применяют
диалкилсульфаты, что особенно удобно
для алкилирования
реакционноспособных спиртов (напр.,
бензилового,
аллилового, коричного), углеводов и
фенолов. Из др.
алкилирующих агентов используют эфиры
муравьиной кислоты,
ортоэфиры и эфиры арил- и алкилсульфокислот,
соли триалкилоксония. Для алкилирования
гидроксикислот применяют
алкилиодиды в присутствии Ag2O
или ВаО. Реакция
открыта А. Вильямсоном в 1851.
Интересным
свойством сложных эфиров малоновой
кислоты является
подвижность водородных атомов метиленовой
группы, заключенной
между двумя карбонилами:
кетонная форма
енольная форма
малонового
эфира
Действуя
на этот эфир металлическим натрием,
можно заместить подвижный
атом водорода (в метиленовой группе) на
натрий. Образуется
Образуется
натриймалоновый
эфир:
Натриймалоновый
эфир используют в органическом синтезе
для получения
различных одноосновных и двухосновных
карбоновых кислот.
Сложные
эфиры органических кислот можно
рассматривать как производные этих
кислот, в которых атом водорода
карбоксильной группы замещен на
углеводородный радикал:
В
образовании этих эфиров могут принимать
участие низшие и высшие,
предельные и непредельные карбоновые
кислоты и спирты.
Названия
сложных эфиров составляют из названий
кислот
и спиртов, остатки которых входят в
состав молекулы эфира. По
систематической номенклатуре сложные
эфиры называют, прибавляя в качестве
приставки название спиртового радикала
к названию кислоты, в которой окончание
-овая
заменяют
на –оат:
муравьинометиловый
эфир,
или метилформиат,
или метилметаноат
уксуснометиловый
эфир,
или метил-ацетат,
или метилэтаноат
маслянопропиловый
эфир
Структурная
изомерия определяется изомерией
углеводородных
радикалов кислот и спиртов, участвующих
в образовании сложных
эфиров:
изомасляноизопропиловый
эфир
Обычно
сложные эфиры органических кислот
получают реакцией
этерификации —
взаимодействием кислот со спиртами в
присутствии катализатора — минеральной
кислоты (например, конц. H2S04):
H2S04):
Доказано,
что выделение молекулы воды при реакции
этерификации происходит
за счет гидроксила карбоксильной группы
и атома водорода
гидроксильной группы спирта.
Механизм
реакции этерификации. Протон
минеральной кислоты (катализатор)
связывается с кислородом карбонильной
группы. Образуется карбкатион (I),
который
подвергается нуклеофильной атаке со
стороны молекулы спирта. Возникшее
неустойчивое оксониевое соединение
(II),
теряя воду, превращается и
карбкатион (III).
Этот продукт при отщеплении протона
дает сложный эфир:
Реакция
этерификации обратима. Чтобы сместить
равновесие вправо, необходимо
связывать (удалять) образующуюся воду.
Химические
свойства. 1.
Реакция
гидролиза (омыление). Эта
реакция
обратна реакции этерификации. Протекает
она в кислой или щелочной
среде:
2.
Восстановление.
Реакция
приводит к образованию смеси двух
спиртов (восстановители — этилат натрия
или LiAlН4)
3.
Образование
амидов:
В
образовании сложных
эфиров
неорганических кислот чаще
принимают участие серная, азотная и
фосфорная
кислоты.
Из
эфиров серной кислоты наибольшее
значение имеют метил-,
этилсульфаты
(алкилсерные
кислоты). Это кислые эфиры:
При
действии дымящей серной кислоты на
избыток спирта образуются
средние эфиры:
Их
эфиров азотной кислоты практическое
значение имеют тринит-рат
глицерина (нитроглицерин) и
амилнитрат:
Многие
эфиры фосфорной кислоты обладают высокой
физиологической
активностью. Например, некоторые
производные диметилфосфата
используют
в качестве сильнейших инспектицидов.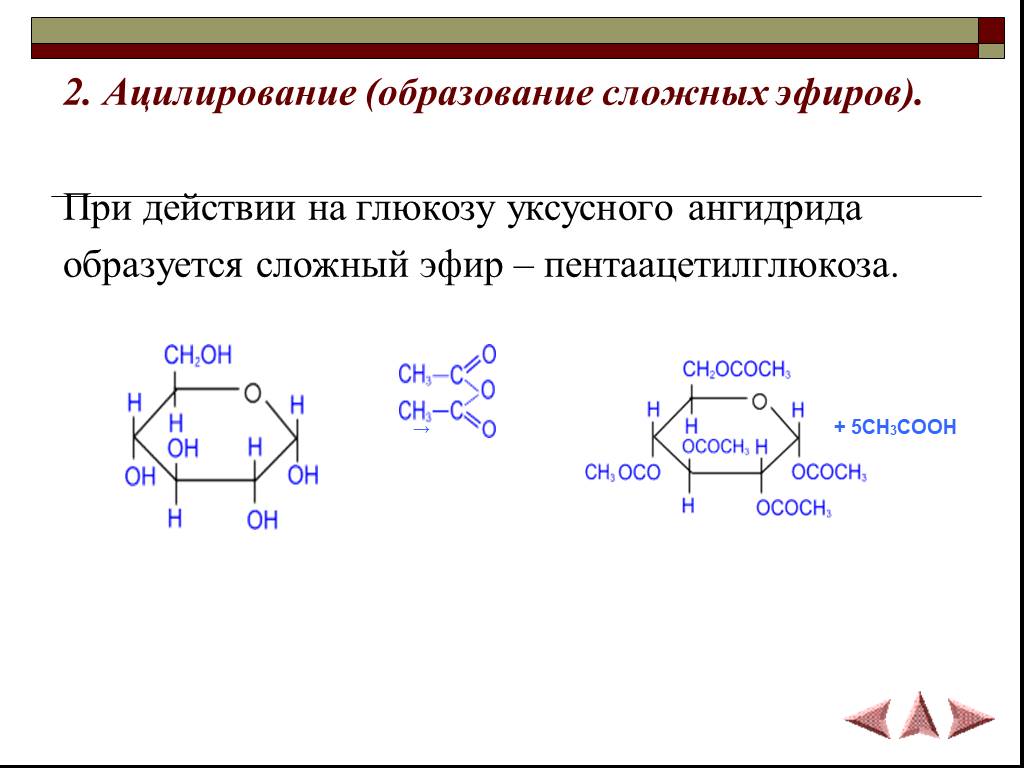
Одним из них является
хлорофос:
К
эфирам фосфорной кислоты относятся
нуклеиновые кислоты и фосфолипиды,
играющие важную роль в жизнедеятельности
организмов.
Еще
более инертными являются
диариловыке эфиры, расщепление эфирной
связи в которых протекает с большим
трудом. Наоборот, простые
эфиры многоатомных спиртов обладают
более высокой химической активностью.
Их производные
— целлозольвы и карбитолы
вырабатываются в промышленном масштабе
и применяются как растворители, сочетающие
свойства спирта и эфира,
например, в лакокрасочной промышленности.
Кроме того, некоторые производные
простых
эфиров
являются сильнодействующими отравляющими
веществами («иприт»).
В
противоположность эфирам
с
открытой цепью,
циклические
простые эфиры
(органические
окиси),
и
в первую очередь окись
этилена,
обладают высокой
химической активностью, чем и объясняется
широкое её использование в
промышленных синтезах
для получения уксусного альдегида,
диоксана, эфиров
моно-, ди- и полиэтиленгликоля, этаноламинов,
акрилонитрила, синтетических моющих
средств и т.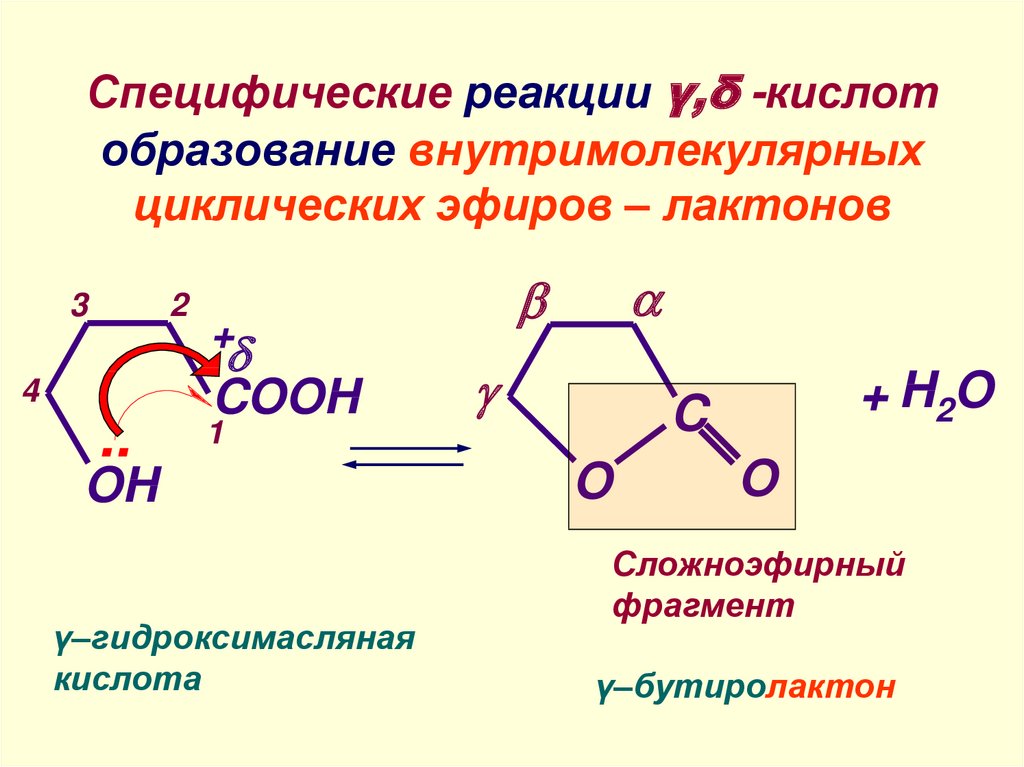 д.
д.
Этилформиат
(этилметаноат)
Н—СООС2Н5
— жидкость, растворимая в воде и спирте.
Т.кип.54,3
°С. Используют в качестве растворителя
нитрата и ацетата целлюлозы,
в производстве витамина Bi,
отдушки для мыла и как компонент
пищевых эссенций.
Этилацетат
(этилэтаноат)
СНз–СООС2Н5—
жидкость, кипящая
при 77,1°С. Применяют как растворитель
для эфиров целлюлозы,
хлоркаучука, жиров, восков. Используется
как отдушка для мыл.
Диметилсульфат
02S(0СНз)2
— жидкость с т.кип. 188,5°С. Применяют
в качестве метилирующего агента (введение
в молекулу метильной
группы) в органическом синтезе. Сильно
ядовит.
Амилнитрат
C5H11ONO2
— жидкость с т.кип. 157°С, плохо растворимая
в воде, но хорошо в спирте. Служит добавкой
к дизельному
топливу для улучшения его качества.
Раньше использовался в медицине.
Тринитрат
глицерина
(нитроглицерин)
— жидкость,
растворимая в ацетоне, бензоле, плохо
в воде. Мощное бризантное
Мощное бризантное
взрывчатое средство. Требует чрезвычайной
осторожности (очень
чувствителен к механическим воздействиям
и нагреванию). Входит
в состав динамитов
(смеси
нитроглицерина с порошкообразными
наполнителями) и баллиститных
порогов. Применяют
в медицине (сосудорасширяющее средство).
Ацетоуксусный
эфир существует в двух формах — кетонной
и
енолъной:
Сосуществование
двух изомерных форм, находящихся в
равновесии и способных
самопроизвольно переходить друг в
друга, называется динамической
изомерией или
таутомерией
(от
греч. tauto
— тот же самый
и meros
— часть). Переходящие при этом друг в
друга формы называются
таутомерами.
Кето-енольная
таутомерия относится к прототропной
таутомерии, так
как она сопровождается переносом
протона:
При
обычной температуре ацетоуксусный эфир
содержит 93 % кетонной
и 7 % енольной формы. Содержание енольной
Содержание енольной
формы может быть различным
в зависимости от характера растворителя.
Чем более полярен
растворитель, тем меньше в нем енольной
формы (например, в воде
ее содержание составляет 0,4 %, а в гексане
— 46,4 %).
Ацетоуксусный
эфир подобен «двуликому Янусу»: он
способен проявлять
свойства двух разных веществ. Для него
характерны реакции
как кетонной, так и енольной форм.
При
проведении реакций, характерных для
енольной формы, ее содержание
постепенно увеличивается за счет
перехода из кетонной формы.
Енольная
форма ацетоуксусного эфира дает
качественную реакцию с
хлоридом железа (III).
В этом случае происходит образование
окрашенной
в красный цвет комплексной соли.
Ацетоуксусный
эфир широко используют в органическом
синтезе для получения многих органических
веществ. Кроме этого эфир сыгpал
в свое время большую роль в развитии
теоретической органической
химии. На его примере было показано, что
На его примере было показано, что
некоторые органические вещества не так
просты, как это может показаться на
первый взгляд.
В зависимости от того, в какой форме они
находятся, вещества могут
проявлять различные химические свойства.
В
образовании сложных эфиров, входящих
в состав жиров, могут принимать участие
разные высшие жирные
кислоты, но из спиртов только один —
глицерин. Поэтому эти эфиры называют
глицеридами
(ацилглицеринами):
В
состав жиров в основном входят
триглицериды, но могут присутст-ковать
и
ди-
и моноглицериды:
Наиболее
распространенные остатки высших кислот,
содержащиеся в жирах,
содержат от 12 до 18 углеродных атомов. В
состав некоторых жиров
входят в небольшом количестве также
остатки кислот с С2–С10
Глицериды,
содержащие кислотные остатки (ацилы)
одинаковых кислот,
называют простыми,
а
если в состав глицеридов входят разные
ацилы, то — смешанными:
Вопросы:
1.
Напишите реакцию образования диэтилового
эфира дегидратацией
этилового спирта в присутствии серной
кислоты.
2.
Напишите реакцию Вильямсона образования
простых зфиров.
3.
Расскажите о способах получения окиси
этилена
в
промышленности.
4.
Подучите уксусный альдегид,
уксусную
кислоту и этиловый спирт
из окиси этилена.
5.
На основе окиси
этилена
получите моноэфиры ди- и полиэтиленгликоли.
6.
Приведите примеры реакций получения
сложных моноэфиров этиленгликоля,
ди- и полиэтиленгликоля.
7.
Охарактеризуйте химическую
активность линейных
простых эфиров
в реакциях со щелочными
металлами,
галогеноводородами, концентрированной
серной кислотой.
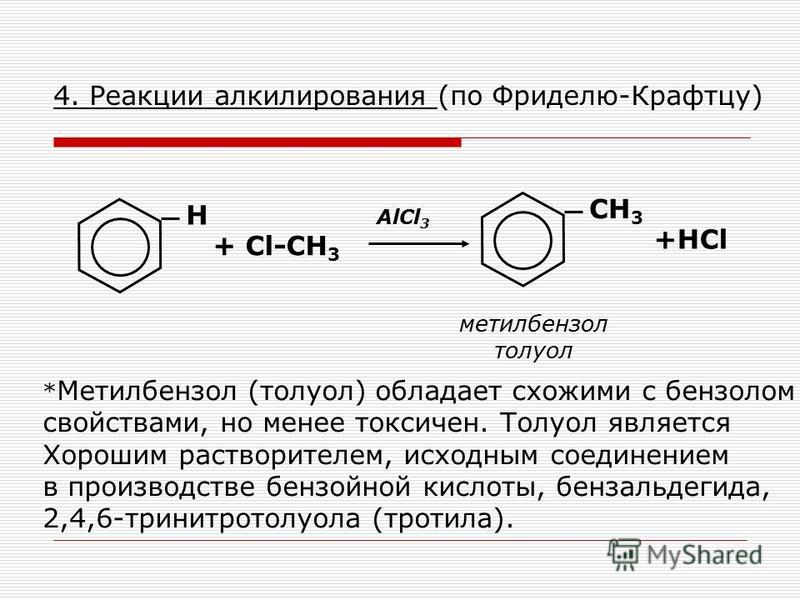
ЭфирСтруктура и склеивание а также Номенклатура
Простые эфиры представляют собой класс органических соединений, которые содержат эфирную группу — атом кислорода, связанный с двумя алкильными или арильными группами. Они имеют общую формулу R – O – R ‘, где R и R’ представляют собой алкильные или арильные группы. Эфиры снова можно разделить на две разновидности: если алкильные группы одинаковые по обе стороны от атома кислорода , то это простой или симметричный эфир, тогда как, если они разные, простые эфиры называются смешанными или несимметричными эфирами. [1] Типичным примером первой группы является диэтиловый эфир растворителя и анестетика. , обычно называемый просто «эфиром» ( CH 3 –CH 2 –O – CH 2 –CH 3 ). Простые эфиры распространены в органической химии и еще более распространены в биохимии, поскольку они являются общими связями в углеводах и лигнине . [2]
Они имеют общую формулу R – O – R ‘, где R и R’ представляют собой алкильные или арильные группы. Эфиры снова можно разделить на две разновидности: если алкильные группы одинаковые по обе стороны от атома кислорода , то это простой или симметричный эфир, тогда как, если они разные, простые эфиры называются смешанными или несимметричными эфирами. [1] Типичным примером первой группы является диэтиловый эфир растворителя и анестетика. , обычно называемый просто «эфиром» ( CH 3 –CH 2 –O – CH 2 –CH 3 ). Простые эфиры распространены в органической химии и еще более распространены в биохимии, поскольку они являются общими связями в углеводах и лигнине . [2]
Общая структура эфира. R и R ‘представляют собой любой алкильный или арильный заместитель .
Структура и склеивание
В эфирах есть изогнутые связи C – O – C. В диметилового эфира , то угол связи составляет 111 ° , а расстояния С-вывода являются 141 ч . [3] Барьер для вращения вокруг связей C – O низкий. Связь кислорода в простых эфирах, спиртах и воде аналогична. Говоря языком теории валентных связей , гибридизация по кислороду имеет вид sp 3 .
[3] Барьер для вращения вокруг связей C – O низкий. Связь кислорода в простых эфирах, спиртах и воде аналогична. Говоря языком теории валентных связей , гибридизация по кислороду имеет вид sp 3 .
Кислород более электроотрицателен, чем углерод, поэтому альфа-атомы водорода по отношению к эфирам более кислые, чем в простых углеводородах. Однако они намного менее кислые, чем атомы водорода от альфа до карбонильных групп (например, в кетонах или альдегидах ).
Эфиры могут быть симметричными типа ROR или несимметричными типа ROR ‘. Примерами первых являются диэтиловый эфир , диметиловый эфир , дипропиловый эфир и т.д. Иллюстративными несимметричными эфирами являются анизол (метоксибензол) и диметоксиэтан .
Номенклатура
В системе номенклатуры ИЮПАК простые эфиры названы с использованием общей формулы «алкоксиалкан» , например, CH 3 –CH 2 –O – CH 3 представляет собой метоксиэтан . Если эфир является частью более сложной молекулы, он описывается как алкокси-заместитель, поэтому -OCH 3 будет считаться « метокси -» группой. Более простой алкильный радикал написан впереди, поэтому CH 3 –O – CH 2 CH 3 будет дан как метокси (CH 3 O) этан (CH 2 CH 3 ).
Более простой алкильный радикал написан впереди, поэтому CH 3 –O – CH 2 CH 3 будет дан как метокси (CH 3 O) этан (CH 2 CH 3 ).
Банальное имя
Для простых эфиров часто не соблюдаются правила IUPAC. Тривиальные названия простых эфиров (то есть тех, которые не содержат или не содержат других функциональных групп) представляют собой смесь двух заместителей, за которыми следует «эфир». Например, этилметиловый эфир (CH 3 OC 2 H 5 ), дифениловый эфир ( C 6 H 5 OC 6 H 5 ). Что касается других органических соединений, очень распространенные эфиры получили названия до того, как были формализованы правила номенклатуры. Диэтиловый эфир называют просто «эфиром», но когда-то его называли сладким купоросным маслом . Метилфениловый эфир — это анизол , потому что он изначально был найден в анисе . В ароматические простые эфиры включают фураны . Ацетали (α-алкоксиэфиры R – CH (–OR) –O – R) — еще один класс простых эфиров с характерными свойствами.
Ацетали (α-алкоксиэфиры R – CH (–OR) –O – R) — еще один класс простых эфиров с характерными свойствами.
Полиэфиры
Полиэфиры обычно представляют собой полимеры, содержащие простые эфирные связи в их основной цепи. Термин гликоль обычно относится к полиэфирполиолам с одной или несколькими функциональными концевыми группами, такими как гидроксильная группа. Термин «оксид» или другие термины используются для полимера с высокой молекулярной массой, когда концевые группы больше не влияют на свойства полимера.
Краун-эфиры — это циклические полиэфиры. Некоторые токсины, вырабатываемые динофлагеллятами, такие как бреветоксин и сигуатоксин, имеют чрезвычайно большие размеры и известны как циклические или лестничные полиэфиры.
| Название полимеров с молярной массой от низкой до средней | Название полимеров с высокой молярной массой | Подготовка | Повторяющийся блок | Примеры торговых наименований |
|---|---|---|---|---|
| Параформальдегид | Полиоксиметилен (ПОМ) или полиацеталь или полиформальдегид | Шаг роста полимеризации из формальдегида | –CH 2 O– | Делрин от DuPont |
| Полиэтиленгликоль (ПЭГ) | Полиэтиленоксид (PEO) или полиоксиэтилен (POE) | Полимеризации с раскрытием кольца из окиси этилена | –CH 2 CH 2 O– | Carbowax от Dow |
| Полипропиленгликоль (PPG) | Оксид полипропилена (PPOX) или полиоксипропилен (POP) | анионная полимеризация с раскрытием кольца пропиленоксида | –CH 2 CH (CH 3 ) O– | Аркол из Ковестро |
| Политетраметиленгликоль (PTMG) или политетраметиленэфиргликоль (PTMEG) | Политетрагидрофуран (ПТГФ) | Катализируемая кислотой полимеризация тетрагидрофурана с раскрытием цикла | –CH 2CH 2CH 2CH 2O– | Тератан от Invista и PolyTHF от BASF |
Полимеры фенилового эфира представляют собой класс ароматических простых полиэфиров, содержащих ароматические циклы в их основной цепи: полифениловый эфир (PPE) и поли ( п- фениленоксид) (PPO).
Родственные соединения
Многие классы соединений со связями C – O – C не считаются простыми эфирами: сложные эфиры (R – C (= O) –O – R ′), полуацетали (R – CH (–OH) –O – R ′), карбоновые кислоты. ангидриды (RC (= O) –O – C (= O) R ′).
Физические свойства
Эфиры имеют температуры кипения, аналогичные температурам кипения аналогичных алканов . Простые эфиры обычно бесцветны.
| Избранные данные о некоторых алкиловых эфирах | |||||
|---|---|---|---|---|---|
| Эфир | Состав | т.пл. (° C) | т.кип (° C) | Растворимость в 1 литре H 2 O | Дипольный момент ( D ) |
| Диметиловый эфир | СН 3 –О – СН 3 | -138,5 | -23,0 | 70 г | 1,30 |
| Диэтиловый эфир | СН 3 СН 2 –О – СН 2 СН 3 | −116,3 | 34,4 | 69 г | 1.14 |
| Тетрагидрофуран | О (СН 2 ) 4 | -108,4 | 66,0 | Смешиваемый | 1,74 |
| Диоксан | О (С 2 Н 4 ) 2 О | 11,8 | 101,3 | Смешиваемый | 0,45 |
Реакции
Структура полимерного пероксида диэтилового эфира
Связи CO, которые составляют простые эфиры, прочны. Они не реагируют на все, кроме самых сильных. Хотя обычно они имеют низкую химическую активность , они более активны, чем алканы .
Они не реагируют на все, кроме самых сильных. Хотя обычно они имеют низкую химическую активность , они более активны, чем алканы .
Специализированные простые эфиры, такие как эпоксиды , кетали и ацетали, являются нерепрезентативными классами простых эфиров и обсуждаются в отдельных статьях. Важные реакции перечислены ниже. [4]
Расщепление
Хотя простые эфиры сопротивляются гидролизу, они расщепляются бромистоводородной кислотой и иодистоводородной кислотой . Хлороводород очень медленно расщепляет эфиры. Метиловые эфиры обычно дают метилгалогениды:
- ROCH 3 + HBr → CH 3 Br + ROH
Эти реакции протекают через ониевые промежуточные соединения, то есть [RO (H) CH 3 ] + Br — .
Некоторые эфиры быстро расщепляются трибромидом бора ( в некоторых случаях используется даже хлорид алюминия ) с образованием бромистого алкила. [5] В зависимости от заместителей, некоторые простые эфиры можно расщеплять различными реагентами, например сильным основанием.
Образование перекиси
При хранении в присутствии воздуха или кислорода простые эфиры имеют тенденцию к образованию взрывоопасных пероксидов , таких как гидропероксид диэтилового эфира . Реакцию ускоряют свет, металлические катализаторы и альдегиды . В дополнение к предотвращению условий хранения, которые могут привести к образованию пероксидов, при использовании простого эфира в качестве растворителя рекомендуется не перегонять его досуха, поскольку любые пероксиды, которые могли образоваться, будучи менее летучими, чем исходный эфир, станут концентрированными. в последние несколько капель жидкости. Присутствие пероксида в старых образцах простых эфиров может быть обнаружено путем встряхивания их со свежеприготовленным раствором сульфата двухвалентного железа с последующим добавлением KSCN. Появление кроваво-красного цвета свидетельствует о наличии перекисей. Опасные свойства пероксидов эфиров являются причиной того, что диэтиловый эфир и другие пероксидообразующие простые эфиры, такие как тетрагидрофуран (THF) или диметиловый эфир этиленгликоля (1,2-диметоксиэтан), избегаются в промышленных процессах.
Базы Льюиса
Структура VCl 3 (thf) 3 . [6]
Эфиры служат базами Льюиса . Например, диэтиловый эфир образует комплекс с трифторидом бора , то есть диэтиловым эфиром (BF 3 · OEt 2 ). Эфиры также координируются с центром Mg в реактивах Гриньяра . Циклический эфир является более основным, чем ациклические простые эфиры. Образует комплексы со многими галогенидами металлов.
Альфа-галогенирование
Эта реакционная способность аналогична тенденции простых эфиров с альфа-атомами водорода к образованию пероксидов. Реакция с хлором дает альфа-хлорэфиры.
Синтез
Эфиры могут быть получены множеством способов. Обычно простые алкиловые эфиры образуются легче, чем ариловые эфиры, а для более поздних видов часто требуются металлические катализаторы. [7]
Синтез диэтилового эфира реакцией этанола и серной кислоты известен с 13 века. [8]
Обезвоживание спиртов
Дегидратации из спиртов дает простые эфиры: [9]
- 2 R – OH → R – O – R + H 2 O при высокой температуре
Эта реакция прямого нуклеофильного замещения требует повышенных температур (около 125 ° C). Реакция катализируется кислотами, обычно серной кислотой. Этот метод эффективен для получения симметричных простых эфиров, но не несимметричных простых эфиров, поскольку любой ОН может быть протонирован, что приведет к образованию смеси продуктов. Этим методом из этанола получают диэтиловый эфир. При таком подходе легко образуются циклические эфиры. Реакции элиминации конкурируют с обезвоживанием алкоголя:
Реакция катализируется кислотами, обычно серной кислотой. Этот метод эффективен для получения симметричных простых эфиров, но не несимметричных простых эфиров, поскольку любой ОН может быть протонирован, что приведет к образованию смеси продуктов. Этим методом из этанола получают диэтиловый эфир. При таком подходе легко образуются циклические эфиры. Реакции элиминации конкурируют с обезвоживанием алкоголя:
- R – CH 2 –CH 2 (OH) → R – CH = CH 2 + H 2 O
Путь обезвоживания часто требует условий, несовместимых с хрупкими молекулами. Существует несколько более мягких методов производства эфиров.
Синтез эфира Вильямсона
Нуклеофильное замещение из алкилгалогенидов с помощью алкоксидов
- R – ONa + R′ – X → R – O – R ′ + Na X
Эта реакция называется синтезом эфира Вильямсона . Он включает обработку исходного спирта сильным основанием с образованием алкоксида с последующим добавлением соответствующего алифатического соединения, несущего подходящую уходящую группу (R – X). Подходящие уходящие группы (X) включают йодид , бромид или сульфонаты . Этот метод обычно не работает для арилгалогенидов (например, бромбензола , см. Конденсацию Ульмана ниже). Точно так же этот метод дает лучший выход только для первичных галогенидов. Вторичные и третичные галогениды склонны к элиминированию E2 под воздействием основного алкоксидного аниона, используемого в реакции, из-за стерических препятствий со стороны больших алкильных групп.
Подходящие уходящие группы (X) включают йодид , бромид или сульфонаты . Этот метод обычно не работает для арилгалогенидов (например, бромбензола , см. Конденсацию Ульмана ниже). Точно так же этот метод дает лучший выход только для первичных галогенидов. Вторичные и третичные галогениды склонны к элиминированию E2 под воздействием основного алкоксидного аниона, используемого в реакции, из-за стерических препятствий со стороны больших алкильных групп.
В родственной реакции алкилгалогениды подвергаются нуклеофильному замещению феноксидами . R – X нельзя использовать для реакции со спиртом. Однако фенолы можно использовать для замены спирта при сохранении галогенида алкила. Поскольку фенолы кислые, они легко реагируют с сильным основанием, таким как гидроксид натрия, с образованием ионов феноксида. Затем ион феноксида замещает группу –X в алкилгалогениде, образуя эфир с присоединенной к нему арильной группой в реакции с механизмом S N 2 .
- C 6 H 5 OH + OH — → C 6 H 5 –O — + H 2 O
- C 6 H 5 –O — + R – X → C 6 H 5 ИЛИ
Конденсация Ульмана
Конденсации Ульмана аналогична методе Williamson , за исключением того , что субстрат представляет собой арильный галогенид. Для таких реакций обычно требуется катализатор, например медь.
Для таких реакций обычно требуется катализатор, например медь.
Электрофильное присоединение спиртов к алкенам
Спирты добавляют к электрофильно активированным алкенам .
- R 2 C = CR 2 + R – OH → R 2 CH – C (–O – R) –R 2
Для этой реакции требуется кислотный катализ . Часто, ртуть трифторацетат (Hg (OCOCF 3 ) 2 ) используются в качестве катализатора для реакции генерируя эфир с Марковниковым региохимией. Используя аналогичные реакции, тетрагидропираниловые эфиры используются в качестве защитных групп для спиртов.
Приготовление эпоксидов
Эпоксиды обычно получают окислением алкенов. Наиболее важным эпоксидом в промышленном масштабе является оксид этилена, который получают путем окисления этилена кислородом. Другие эпоксиды производятся одним из двух способов:
- Путем окисления алкенов пероксикислотой, такой как m- CPBA .
- Путем внутримолекулярного нуклеофильного замещения основания галогидрин.

Важные эфиры
| Окись этилена | Циклический эфир. Тоже самый простой эпоксид . | |||||||||||||||||||||
| Диметиловый эфир | Бесцветный газ, используемый в качестве пропеллента для аэрозольных баллончиков . Потенциально возобновляемое альтернативное топливо для дизельных двигателей с цетановым числом 56–57. | |||||||||||||||||||||
| Диэтиловый эфир | Бесцветная жидкость со сладким запахом. Обычный низкокипящий растворитель (точка кипения 34,6 ° C) и ранний анестетик . Используется как пусковая жидкость для дизельных двигателей. Также используется в качестве хладагента и при производстве бездымного пороха , а также в парфюмерии . | |||||||||||||||||||||
| Диметоксиэтан (DME) | Смешивающийся с водой растворитель, часто встречающийся в литиевых батареях (точка кипения 85 ° C): | |||||||||||||||||||||
| Диоксан | Циклический эфир и высококипящий растворитель (т.кип. 101,1 ° C). | |||||||||||||||||||||
| Тетрагидрофуран (THF) | Циклический эфир, один из самых полярных простых эфиров, который используется в качестве растворителя.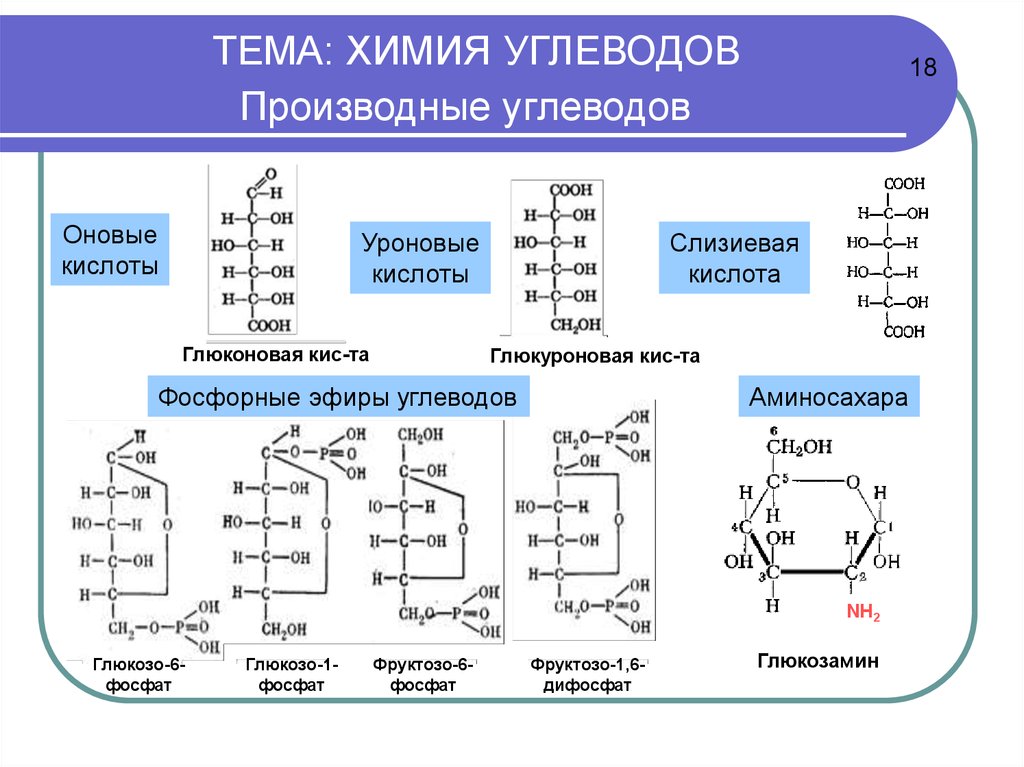 Клейден; Гривс; Уоррен (2001). Органическая химия . Издательство Оксфордского университета. п. 129 . ISBN 978-0-19-850346-0. Клейден; Гривс; Уоррен (2001). Органическая химия . Издательство Оксфордского университета. п. 129 . ISBN 978-0-19-850346-0.Эпоксиды Эпоксиды
Эпоксиды
Алкен
Эпоксидная смола-
Общие сведения о простых эфирах и эпоксидахКлючевые термины
Цели
В результате реакций конденсации мы можем образовывать простые эфиры из спиртов. Ниже показана основная реакция конденсации, проводимая в присутствии серной кислоты. Также обратите внимание, что тиолы — это соединения, структурно идентичные спиртам, за исключением того, что атом кислорода в гидроксильной группе заменен атомом серы. Точно так же сульфидов структурно идентичны простым эфирам, но они заменяют атом кислорода атомом серы, как показано ниже. Мы не будем подробно обсуждать сульфиды, но вы должны знать об этом типе молекул. Обратите внимание, что его химические свойства отличаются от свойств простых эфиров. Химическое соединение, очень похожее на эфир, представляет собой эпоксид. Эпоксиды содержат кислород и два атома углерода в трехатомной кольцевой структуре, как показано ниже. В то время как простые эфиры являются относительно стабильными молекулами, эпоксиды обладают высокой реакционной способностью. Номенклатура Основной функциональной группой для обозначения простых эфиров является алкоксигруппа, несколько примеров которой показаны ниже с соответствующими названиями. Обратите внимание, что названия очень похожи на названия аналогичных алкильных групп. Чтобы правильно назвать эфир в соответствии с правилами IUPAC, определите самую короткую алкильную цепь, присоединенную к атому кислорода, и примите эту часть за алкоксигруппу. Циклические эфиры имеют несистематические названия, поэтому мы не будем заострять внимание на этом аспекте номенклатуры, но ниже приведены названия ИЮПАК для нескольких циклических эфиров. Оксолан также известен под названием тетрагидрофуран. Для эпоксидов название функциональной группы эпоксид при использовании таким же образом, как, например, этил или метил (то есть в соответствии с правилами замещающей номенклатуры). При использовании в качестве, например, этилового спирта (номенклатура функционального класса) термин 9Используется оксид 0339 . В замещающем подходе префиксу эпоксидной смолы — предшествуют номера двух атомов углерода, с которыми связан кислород. Также обратите внимание, что из-за структуры эпоксидных смол эти молекулы могут проявлять стереоизомерию. Например, 3,4-эпоксигексан на самом деле может быть либо цис--3,4-эпоксигексаном, либо транс--3,4-эпоксигексаном, как показано ниже. Помимо циклических структур (таких как эпоксиды), простые эфиры могут включать несколько атомов кислорода в углеродную цепь. Например, так называемые краун-эфиры представляют собой циклические эфиры с несколькими атомами кислорода в кольце. Пример показан ниже вместе с его упрощенным названием (мы не будем обсуждать номенклатуру краун-эфиров). Хотите узнать больше? Почему бы не пройти онлайн-курс органической химии? Практическая задача: Определите название IUPAC для молекулы, показанной ниже. Решение: Эта молекула представляет собой эфир с двумя четырехуглеродными цепочками (бутильными группами), присоединенными к центральному атому кислорода. Раствор: Это соединение представляет собой 2,3-эпокси-5-метилгептан. Обратите внимание, что основная углеродная цепь пронумерована, как показано ниже. Синтез простых эфиров и эпоксидов Как упоминалось ранее, мы уже изучали катализируемый кислотой синтез простых эфиров из спиртов. Другим методом является синтез эфира Вильямсона, который включает реакцию между алкоксидом металла и алкилгалогенидом. Например, рассмотрим этоксид натрия и бромпропан. Общая реакция показана ниже. Механизм этой реакции включает диссоциацию металла от алкоксида и последующую нуклеофильную атаку (S N 2) на алкилгалогенид. Ион алкоксида действует как основание Льюиса по отношению к алкилгалогениду. Для эпоксидов один подход к синтезу в основном следует этому механизму, но включает единую молекулу, в которой гидроксильная группа и галогенид присоединены к соседним атомам углерода (эти функциональные группы считаются вициналь, , и этот конкретный тип молекулы называется вициналь галогенгидрином ). В присутствии основания (такого как ионы гидроксида) галогенгидрин отдает протон (кислотно-основная реакция), связанный с атомом кислорода. Рассмотрим приведенный ниже случай 3-иодобутанола. Оставшаяся молекула может затем диссоциировать йодид-ион следующим образом, создавая эпоксид. Продуктом в данном случае является 2,3-эпоксибутан. Стереоизомер продукта зависит от конфигурации исходной молекулы. Другим методом синтеза эпоксидной смолы является эпоксидирование алкена. Рассмотрим пример циклогексена. В присутствии пероксиуксусной кислоты следующая реакция дает 1,2-эпоксициклогексан и уксусную кислоту. Реакции эфиров и эпоксидов Рассмотрим пару реакций, в которых участвуют эфиры и эпоксиды: в частности, расщепление эфиров галогеноводородами и катализируемое кислотой раскрытие цикла эпоксидов (две похожие реакции). Первая реакция, расщепление простых эфиров галогеноводородами, приведена (в целом) ниже для случая этоксипропана и бромистого водорода.
Механизм реакции в этом случае протекает в две стадии с образованием алкилгалогенида и спирта. Следующим шагом является расщепление, которое в этом несимметричном случае может дать два немного отличающихся результата.
или Однако, принимая во внимание условия реакции (которые, вероятно, включают эфир), спирт (в любом случае) претерпевает S N 2 реакция с бромистым водородом с образованием другого алкилгалогенида и воды. Эпоксиды могут подвергаться раскрытию цикла в присутствии бромистого водорода в реакции, очень похожей на показанную выше. Механизм проиллюстрирован ниже для 1,2-эпоксибутана. На первом этапе диссоциированный бромид-ион атакует менее замещенный углерод, связанный с атомом кислорода. Протон (возникший в результате диссоциации атомов водорода и брома в бромистом водороде) затем связывается с кислородом с образованием 1-бром-2-бутанола. Практическая задача: Опишите взаимосвязь между расщеплением простых эфиров в бромистом водороде и катализируемым кислотой раскрытием цикла эпоксидов в бромистом водороде. Решение: В каждом случае разрывается кислород-углеродная связь, и эту разорванную связь заменяет ион галогенида. Атом кислорода также связан с водородом в обоих случаях. Эти стадии происходят в другом порядке для эпоксидов по сравнению с простыми эфирами. Begin typing your search term above and press enter to search. Press ESC to cancel. Back To Top
|

 схему выше). Их реактивность такова, что они
схему выше). Их реактивность такова, что они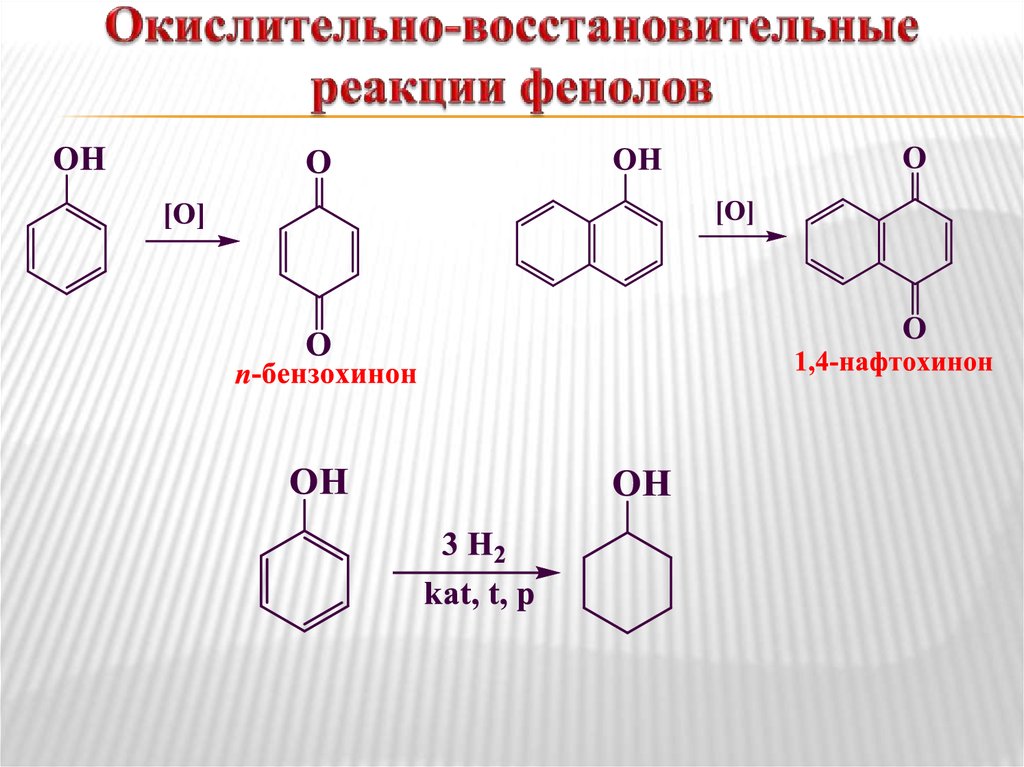
 Ян Хант,
Ян Хант,
 Затем следуйте обычным правилам именования молекул, где алкоксигруппа является заместителем алкана. Другая приемлемая процедура именования состоит в том, чтобы написать названия двух алкильных групп, за которыми следует слово «эфир» (аналогично тому, как мы называли спирты, такие как этиловый спирт). Например, рассмотрим две молекулы ниже и их приемлемые названия IUPAC.
Затем следуйте обычным правилам именования молекул, где алкоксигруппа является заместителем алкана. Другая приемлемая процедура именования состоит в том, чтобы написать названия двух алкильных групп, за которыми следует слово «эфир» (аналогично тому, как мы называли спирты, такие как этиловый спирт). Например, рассмотрим две молекулы ниже и их приемлемые названия IUPAC.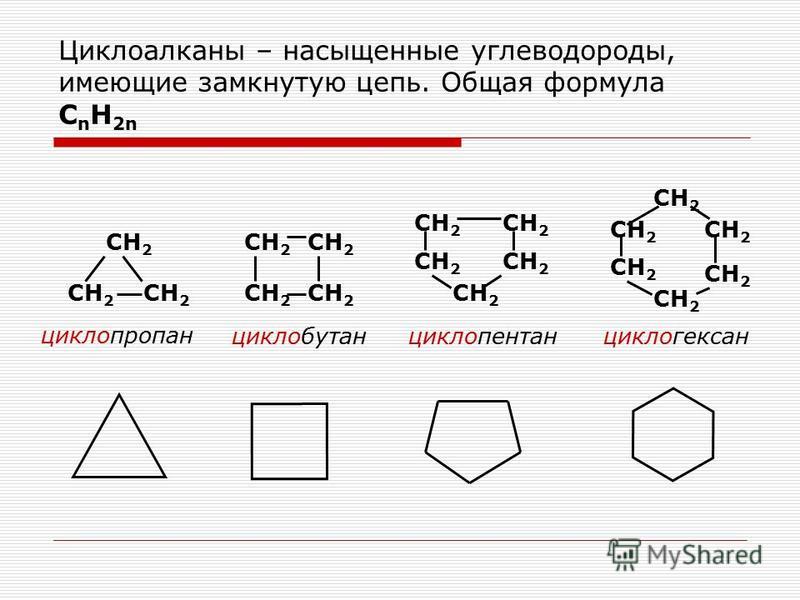 Таким образом, следующие приемлемые названия IUPAC для нескольких эпоксидов.
Таким образом, следующие приемлемые названия IUPAC для нескольких эпоксидов. Таким образом, его можно с полным правом называть либо дибутиловым эфиром, либо бутоксибутаном. Практическая задача : Определите название IUPAC для молекулы, показанной ниже.
Таким образом, его можно с полным правом называть либо дибутиловым эфиром, либо бутоксибутаном. Практическая задача : Определите название IUPAC для молекулы, показанной ниже. Опять же, обратите внимание, что эта реакция представляет собой нуклеофильное замещение с участием двух молекул (S N 2).
Опять же, обратите внимание, что эта реакция представляет собой нуклеофильное замещение с участием двух молекул (S N 2). В реакции участвует пероксикислота, общий пример которой показан ниже.
В реакции участвует пероксикислота, общий пример которой показан ниже. Таким образом, в данном случае конечными продуктами реакции являются бромистый этил, бромистый пропил и вода.
Таким образом, в данном случае конечными продуктами реакции являются бромистый этил, бромистый пропил и вода.