Содержание
Сложные эфиры: строение, изомерия и номенклатура
1 Сложные эфиры карбоновых кислот: Строение
2 Сложные эфиры карбоновых кислот: Классификация
3 Сложные эфиры карбоновых кислот: Изомерия и номенклатура
3.1 Изомерия сложных эфиров карбоновых кислот
3.2 Номенклатура сложных эфиров карбоновых кислот
3.3 Примеры названий сложных эфиров карбоновых кислот:
Сложные эфиры карбоновых кислот: Строение
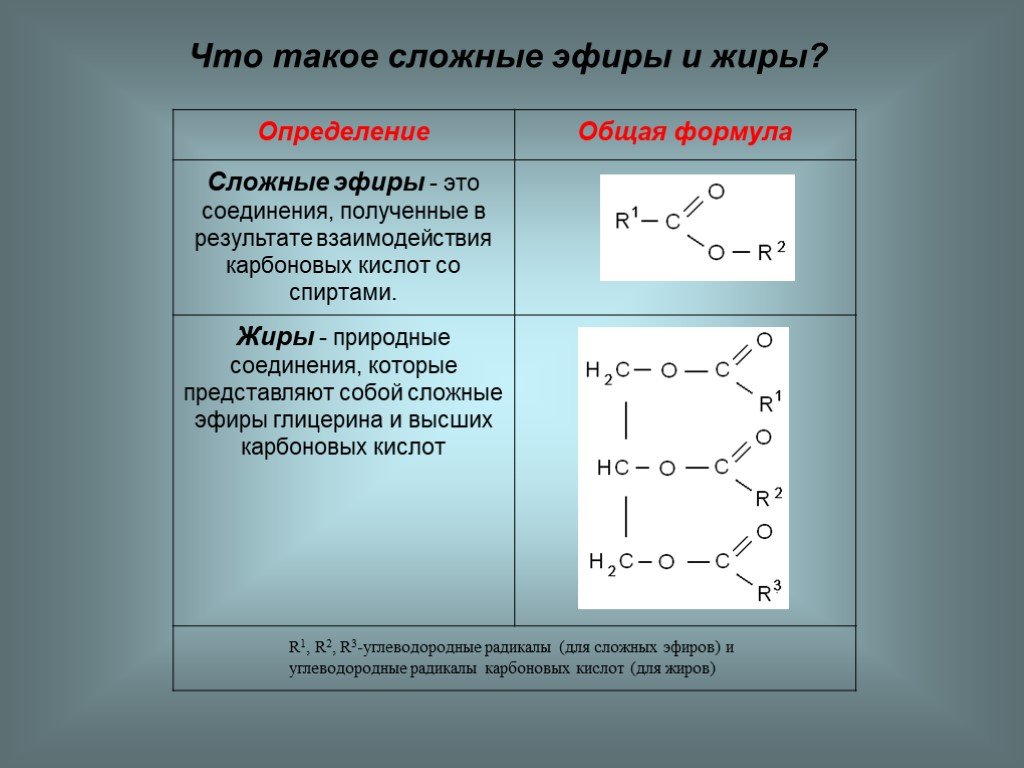
Сложные эфиры являются производными карбоновых кислот, в молекулах которых группа -ОН (в карбоксильной группе) замещена на спиртовый остаток –O-R:
Общая формула сложных эфиров карбоновых кислот R–COOR’, где R и R’ — углеводородные радикалы. В сложных эфирах муравьиной кислоты R – это атом водорода.
Общая формула сложных эфиров предельных одноосновных карбоновых кислот, имеющих в качестве спиртового остатка предельные одноатомные спирты совпадает с общей формулой карбоновых кислот: CnH2nO2 или СnH2n+1-COO-СnH2n+1
Например, молекула метилацетата выглядит следующим образом:
Сложные эфиры карбоновых кислот: Классификация
Сложные эфиры карбоновых кислот можно разделить на три группы.
- Сложные эфиры, образованные низшими карбоновыми кислотами и спиртами. Например, этилацетат, метилпропионат, пропилформиат:
- Сложные эфиры, образованные высшими карбоновыми кислотами и высшими одноосновными спиртами (воски).
Воски делятся на:
- Растительные, например, пальмовый воск, японский воск
- Животные, например, пчелиный воск, шерстяной (шерстный) воск –
ланолин, кожное сало, ушная сера. - Ископаемые, например, торфяной
воск, буроугольный воск (монтан-воск) горный, воск (озокерит). - Синтетические, например, канифоль — хрупкая стекловидная прозрачная масса.
Например, пчелиный воск – сложный эфир пальмитиновой кислоты и мирицилового спирта; кашалотовый воск (спермацет) сложный эфир пальмитиновой кислоты и цетилового спирта:
- Сложные эфиры, образованные трехатомным спиртом глицерином и высшими карбоновыми кислотами (жиры). См.
 раздел Жиры: Строение, получение, химические свойства
раздел Жиры: Строение, получение, химические свойства
Сложные эфиры карбоновых кислот: Изомерия и номенклатура
Изомерия сложных эфиров карбоновых кислот
Для сложных эфиров характерны изомерия углеродной цепи, положения сложноэфирной группировки, и межклассовая виды изомерии. Для сложных эфиров, образованных непредельной кислотой или непредельным спиртом, возможна пространственная изомерия (цис- , транс-изомерия) и изомерия положения кратной связи.
- Изомерия углеродной цепи может наблюдаться по кислотному остатку, начиная с бутановой кислоты, и по спиртовому остатку, начиная с пропилового спирта. Например, сложный эфир с брутто формулой С5H10O2 может иметь такие изомеры, как: метиловый эфир бутановой (масляной) кислоты, бутирату, метиловый эфир изобутановой (изомасляной) кислоты, пропиловый эфир уксусной кислоты и изопропиловый эфир уксусной кислоты изомерны метилизобутират, пропилацетат и изопропилацетат.

- Изомерия положения сложноэфирной группировки наблюдается у сложных эфиров, состоящих не мене чем из 4 атомов углерода, например этиловый эфир пропановой кислоты и метиловый эфир бутановой (масляной) кислоты.
- Межклассовая изомерия. Сложные эфиры изомерны карбоновым кислотам, например, изомерами являются метиловый эфир уксусной кислоты (метилацетат) и пропановая кислота.
- Изомерия положения кратной связи. Например, метиловый эфир 2-пентеновой кислоты и метиловый эфир 3-пентеновой кислоты:
- Пространственная цис-, транс-изомерия. Например, метиловый эфир цис-2-бутеновой кислоты и метиловый эфир транс-2-бутеновой кислоты:
Номенклатура сложных эфиров карбоновых кислот
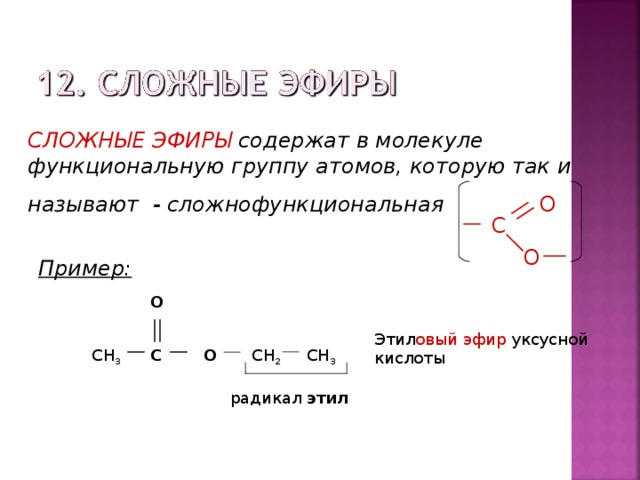
Согласно систематической номенклатуры ИЮПАК названия сложных эфиров строятся исходя из названий двух остатков: спиртового и кислотного.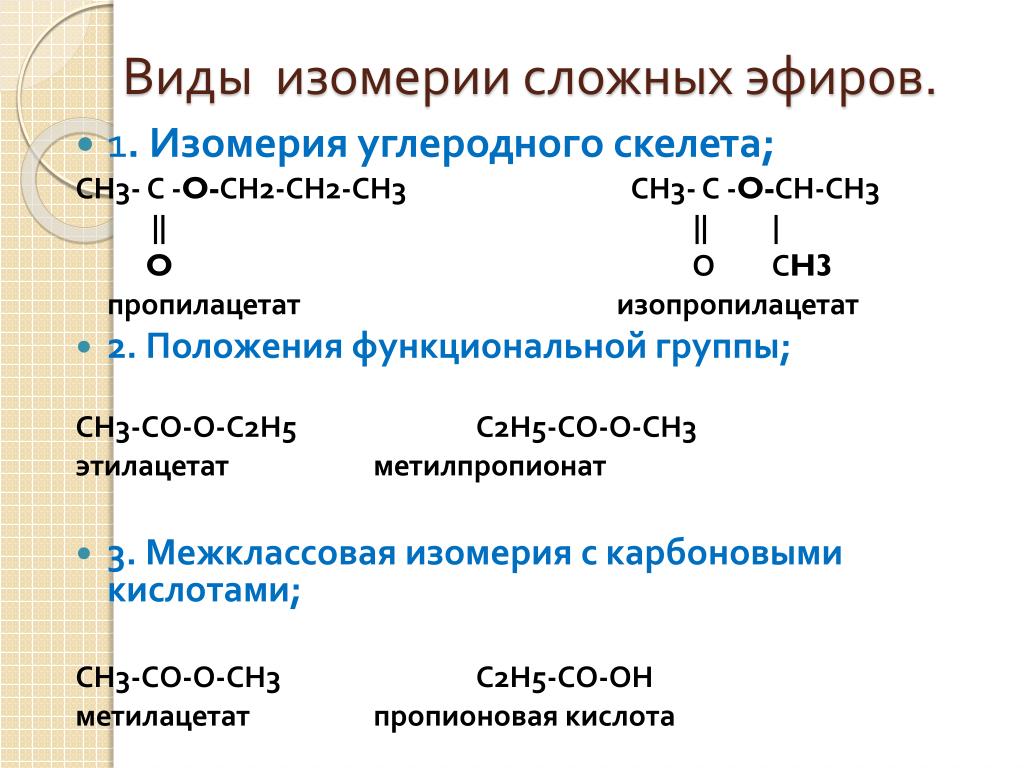 К названию спиртового остатка прибавляют название кислотного остатка и суффикс –оaт, например:
К названию спиртового остатка прибавляют название кислотного остатка и суффикс –оaт, например:
Согласно тривиальной номенклатуры названия сложных эфиров строятся исходя из названий образующих его кислот и спиртов с добавлением слова эфир. Например:
Кроме этого, название сложного эфира может быть построено из названий кислотной и спиртовой частей, добавляя окончание «ый» и слово «эфир». Например, приведенное в примере соединение по этому правилу можно назвать маслянопропиловый эфир.
Примеры названий сложных эфиров карбоновых кислот:
Категории Карбоновые кислоты и сложные эфиры, ОРГАНИЧЕСКАЯ ХИМИЯ
Сложные эфиры, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
15.5: Сложные эфиры – структуры и названия
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 16029
- Анонимный
- LibreTexts
Цели обучения
- Определите общую структуру сложного эфира.
- Используйте общепринятые названия для обозначения сложных эфиров.
- Назовите сложные эфиры по системе IUPAC .
Сложные эфиры имеют общую формулу RCOOR’, где R может быть атомом водорода, алкильной группой или арильной группой, а R’ может быть алкильной или арильной группой, но не атомом водорода. (Если бы это был атом водорода, соединение было бы карбоновой кислотой.) На рисунке \(\PageIndex{1}\) показаны модели двух распространенных эфиров.
(Если бы это был атом водорода, соединение было бы карбоновой кислотой.) На рисунке \(\PageIndex{1}\) показаны модели двух распространенных эфиров.
Рисунок \(\PageIndex{1}\): Структура сложных эфиров. Сложные эфиры имеют двойную связь углерод-кислород, которая также одинарно связана со вторым атомом кислорода, который затем присоединяется к алкильной или арильной группе. Показанные здесь сложные эфиры представляют собой этилацетат (а) и метилбутират (б).
Сложные эфиры широко распространены в природе. В отличие от карбоновых кислот сложные эфиры обычно имеют приятный запах и часто ответственны за характерные ароматы фруктов и цветов. После химического анализа цветка или плода химики-ароматизаторы могут попытаться воспроизвести естественный запах или вкус. Как натуральные, так и синтетические сложные эфиры используются в парфюмерии и в качестве ароматизаторов.
Жиры и растительные масла представляют собой сложные эфиры длинноцепочечных жирных кислот и глицерина. Эфиры фосфорной кислоты имеют огромное значение для жизни.
Названия сложных эфиров
Хотя сложные эфиры являются ковалентными соединениями, а соли — ионными, названия сложных эфиров аналогичны тем, которые используются для названий солей. Название группы алкильной или арильной части дается первой, а за ней следует название кислотной части. Как в общей номенклатуре, так и в номенклатуре Международного союза теоретической и прикладной химии (IUPAC) — ic окончание исходной кислоты заменяется суффиксом — ate (Таблица \(\PageIndex{1}\)).
| Краткая структурная формула | Общее имя | Название ИЮПАК |
|---|---|---|
| HCOOCH 3 | метилформиат | метилметаноат |
| СН 3 СООЧ 3 | метилацетат | метилэтаноат |
| CH 3 COOCH 2 CH 3 | этилацетат | этилэтанолат |
| CH 3 CH 2 COOCH 2 CH 3 | этилпропионат | этилпропаноат |
| CH 3 CH 2 CH 2 COOCH(CH 3 ) 2 | изопропилбутират | изопропилбутаноат |
| этилбензоат | этилбензоат |
Пример \(\PageIndex{1}\)
Дайте общее название и название IUPAC для каждого соединения.
Solution
Алкильная группа, присоединенная непосредственно к атому кислорода, представляет собой бутильную группу (обозначена зеленым цветом).
Часть молекулы карбоновой кислоты (выделена красным) имеет три атома углерода. Он называется пропионат (общий) или пропаноат (IUPAC). Таким образом, сложный эфир представляет собой бутилпропионат или бутилпропаноат.
- Алкильная группа (зеленая) присоединена непосредственно к атому кислорода через его средний атом углерода; это изопропильная группа. Часть, полученная из кислоты (то есть бензольное кольцо и карбонильная группа, выделены красным), представляет собой бензоат. Таким образом, сложный эфир представляет собой изопропилбензоат (как общепринятое название, так и название IUPAC).
Упражнение \(\PageIndex{1}\)
Дайте общее название и название IUPAC для каждого соединения.
Пример \(\PageIndex{2}\)
Нарисуйте структуру этилпентаноата.
Решение
Начните с порции кислоты. Сначала нарисуйте группу пентаноата (пять атомов углерода); имея в виду, что последний атом углерода является частью карбоксильной группы.
Затем присоедините этильную группу к связи, которая обычно удерживает атом водорода в карбоксильной группе.
Упражнение \(\PageIndex{2}\)
Изобразите структуру фенилпентаноата.
Key Takeaway
- Сложный эфир имеет группу OR, присоединенную к атому углерода карбонильной группы.
Эта страница под названием 15.5: Сложные эфиры — структуры и имена распространяется под лицензией CC BY-NC-SA 3.0 и была создана, изменена и/или курирована Anonymous с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами LibreTexts. Платформа; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Аноним
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Программа OER или Publisher
- Издатель, имя которого нельзя называть
- Показать страницу TOC
- № на стр.

- Теги
- source@https://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological
Номенклатура сложных эфиров — химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 5922
Сложные эфиры известны своим характерным запахом и обычно используются для придания аромата и аромата пищевым продуктам. Общая формула сложного эфира RCOOR’.
Введение
Сложные эфиры образуются в результате реакций между кислотой и спиртом с удалением воды. Примером этого является реакция уксусной кислоты со спиртом, которая дает уксусный эфир и воду.
Примером этого является реакция уксусной кислоты со спиртом, которая дает уксусный эфир и воду.
Часть, обведенная красным кружком, представляет этильную группу спирта, а часть, обведенную зеленым прямоугольником, представляет ацетатную группу кислоты.
Сложные эфиры можно назвать в несколько шагов
Сложные эфиры названы так, как будто алкильная цепь спирта является заместителем. Этой алкильной цепи не присвоен номер. Далее следует название исходной цепи из карбоновой кислоты в сложном эфире с удалением –е и заменой на окончание –оат .
Пример
Сложные эфиры образуются в результате реакции между кислотой и спиртом с удалением воды. Пример
1. Сначала идентифицируйте кислород, который является частью непрерывной цепи и связан с углеродом с обеих сторон. (С одной стороны от этого кислорода будет присутствовать карбонил, а с другой стороны его не будет.)
2. Во-вторых, начните нумеровать углеродные цепи по обе стороны от кислорода, указанного на шаге 1.
3. Затем используйте следующий формат: [алкил на стороне дальше от карбонила] (пробел) [алкан на стороне с карбонилом] — (В данном случае: [метил] [метан])
4. Наконец, изменить окончание алкана на той же стороне, что и карбонил, с -е на -оат. (В данном случае: метилметаноат)
Когда сложноэфирная группа присоединена к кольцу, сложный эфир называется заместителем в кольце.
Бензолкарбоновая кислота (Бензойная кислота)
Другие заместители, которые существуют по обе стороны сложного эфира, названы так же, как и в обычных алкановых цепях. Единственное, в чем вы должны убедиться, это поместить название заместителя в ту часть имени, которая соответствует стороне сложного эфира, на которой он находится.
1-хлорметилэтаноат
метил 2-хлорэтаноат
CH 3 COOCH 2 CH 3
метил пропаноат
CH 3 COOCH 2 CH 2 CH 2 CH 2 CH CH 2 CH 2 CH CH 2 CH 2 CH CH 2 2 Ch
2 Ch
2 Ch
2 .
октилэтаноат
Ссылки
- Leigh, G.J., H. Favre, and Val Metanomski. Принципы химической номенклатуры Руководство по рекомендациям IUPAC (Серия химических данных IUPAC) . Молден: Блэквелл Сайенс, 1998.
- Макнот, А. Д. и А. Уилкинсон. Сборник химической терминологии . 2-е изд. Блэквелл Сайенс, 1997.
- Фоллхардт, К. Питер С. и Нил Э. Шор. Органическая химия Структура и функции . Нью-Йорк: WH Freeman, 2007.
.
.
Внешние ссылки
- http://en.wikipedia.org/wiki/Esters
- http://en.wikipedia.org/wiki/IUPAC_n…emistry#Esters
Проблемы
Назовите следующее:
Ответ: пропилотаноат
Ответ: 3-бромпентил 2-хлорбутаноат
Ответ: этил гексаноат
Ответ: этил 3-бромопентанат
Ответ: 4-nitrobenzenecarbylic aciscodinoate
.
Nomenclature of Esters распространяется по незадекларированной лицензии и был создан, изменен и/или курирован LibreTexts.

 раздел Жиры: Строение, получение, химические свойства
раздел Жиры: Строение, получение, химические свойства