Содержание
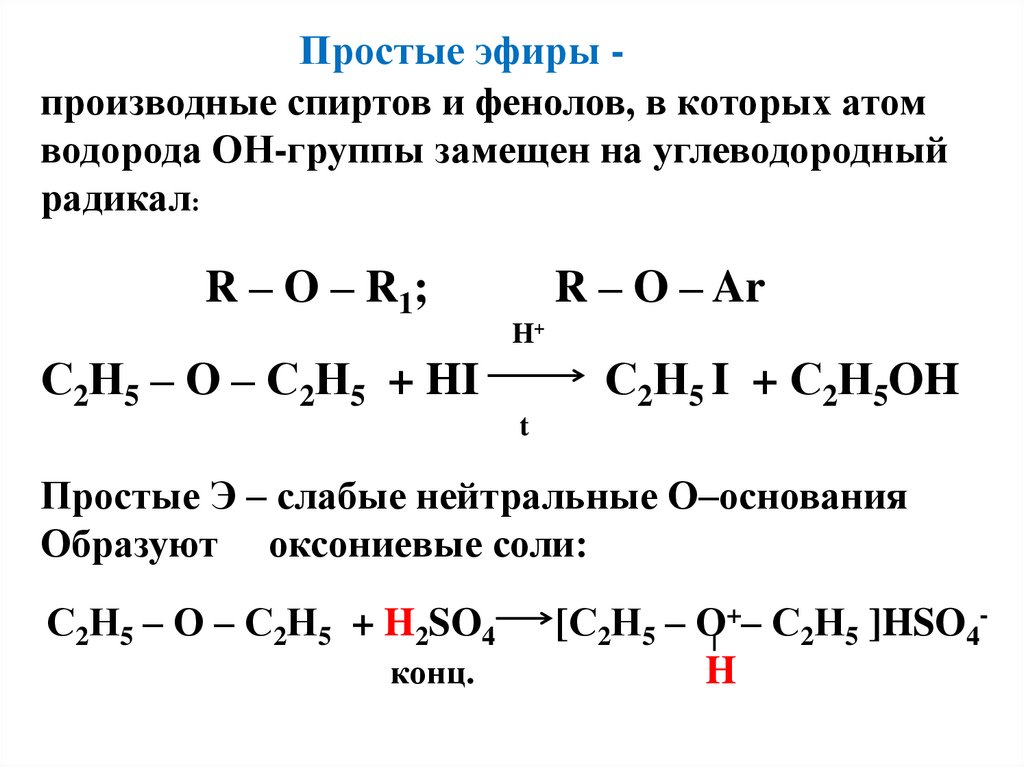
Получение, физические и химические свойства простых эфиров
1 Получение простых эфиров
1.1 Физические свойства
1.2 Химические свойства простых эфиров
Некоторые способы получения простых эфиров были рассмотрены при изучении галогеналканов, алкенов, одноатомных спиртов. В данном разделе подробнее рассмотрим получение, физические и химические свойства простых эфиров .
- Реакция Вильямсона – взаимодействие галогенированных углеводородов с алкоголятами:
При этом способе получения используются первичные реагирующие соединения.
- Межмолекулярная дегидратация спиртов протекает под действием окиси алюминия и температуре 300°С или серной кислоты как дегидратирующего агента. В результате получают симметричные простые эфиры, например, по этому принципу получают серный эфир (диэтиловый эфир):
Его получение происходит в 2 стадии. Сначала, при взаимодействии этанола с избытком серной кислоты, получается этилсерная кислота, которая, затем реагирует с новой порцией этанола с образованием диэтилового эфира:
- Каталитическое присоединение спиртов к олефинам или алкинам:
При присоединении спиртов к алкинам образуются виниловые эфиры:
- Оксимеркурирование алкенов протекает в несколько стадий.
 Сначала при действии на алкены ацетата ртути в водном растворе тетрагидрофурана (ТГФ) или в водной уксусной кислоте при 20°С образуется ртутьорганические соединения. При этом присоединение ацетата ртути к алкену происходит согласно правилу Марковникова. Далее при воздействии таких растворителей как спирты, уксусная кислота, ацетонитрил и др. получаются простые эфиры:
Сначала при действии на алкены ацетата ртути в водном растворе тетрагидрофурана (ТГФ) или в водной уксусной кислоте при 20°С образуется ртутьорганические соединения. При этом присоединение ацетата ртути к алкену происходит согласно правилу Марковникова. Далее при воздействии таких растворителей как спирты, уксусная кислота, ацетонитрил и др. получаются простые эфиры:
Физические свойства
Простые эфиры — это прозрачные бесцветные жидкости, обладающие характерным «эфирным» запахом. Они являются легколетучими и пожароопасными.
Растворимость простых эфиров
Простые эфиры растворимы в протонных кислотах, что связано с основными свойствами эфирного кислорода. Этот кислород имеет две свободные электронные пары, которые не могут использоваться для проявления обычной валентности и принять электроны. Однако для осуществления связи кислород может предоставить свою электронную пару в общее пользование:
В зависимости от строения эфира, они могут иметь хорошую растворимость в воде или вовсе не растворяться (см.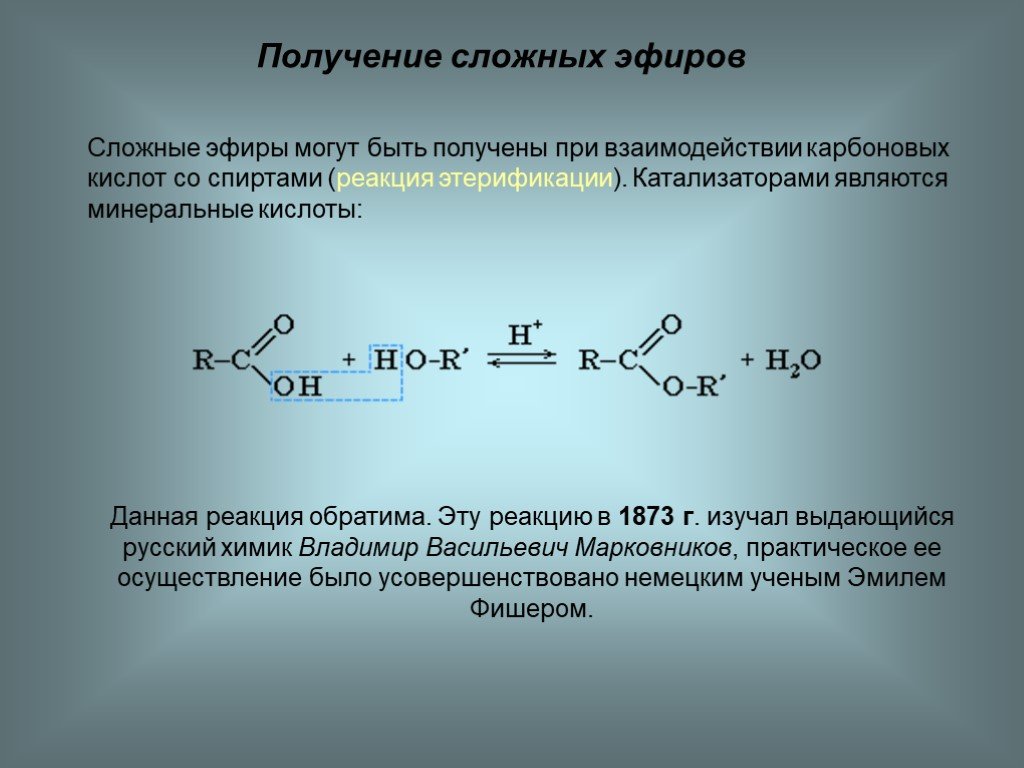 таблицу ниже). В большинстве органических растворителей простые эфиры хорошо растворимы.
таблицу ниже). В большинстве органических растворителей простые эфиры хорошо растворимы.
Точки плавления и кипения простых эфиров
Простые эфиры кипят при гораздо более низких температурах, чем соответствующие спирты. Например, метиловый спирт кипит при +65°С, а метиловый эфир – при -23,7°С. Это связано с тем, что эфиры, в отличие от спиртов, лишены гидроксильного водорода и поэтому не имеют возможности образовывать водородные связи, объединяющие одну молекулу с другой. Т.е. простые эфиры не способны к ассоциации молекул.
Химические свойства простых эфиров
Простые эфиры – малореакционноспособная группа органических соединений, проявляющие слабоосновные свойства. Они могут расщепляются лишь некоторыми веществами при нагревании (концентрированной йодистоводородной кислотой или воздействием металлического натрия). Водные растворы кислот и щелочей не действуют на простые эфиры.
- Образование оксониевых солей при воздействии сильных кислот:
- Образование комплексных соединений с солями (Меервейн Г.
 Л.):
Л.): - Расщепление простых эфиров:
Под действием концентрированных йодоводородной или бромоводородной кислот:
Под действием активных металлов при повышенной температуре (Шорыгин П.П.):
Под действием серной кислоты:
- Окисление простых эфиров происходит с образованием перекисных соединений (автоокисление):
Простые эфиры при хранении легко окисляются кислородом воздуха с образованием перекисей. При использовании простых эфиров, особенно при перегонке их необходимо хорошо очистить от накопленных перекисей, которые могут стать причиной взрыва.
Категории ОРГАНИЧЕСКАЯ ХИМИЯ, Простые эфиры
Реакция Вильямсона
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Номенклатура эфиров — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 824
- Уильям Ройш
- Университет штата Мичиган
Простые эфиры представляют собой соединения, имеющие две алкильные или арильные группы, связанные с атомом кислорода, как в формуле R 1 –O–R 2 . Эфирная функциональная группа не имеет характерного номенклатурного суффикса ИЮПАК, поэтому ее необходимо обозначить как заместитель. Для этого обычным алкокси-заместителям даются названия, производные от их алкильного компонента (ниже):
.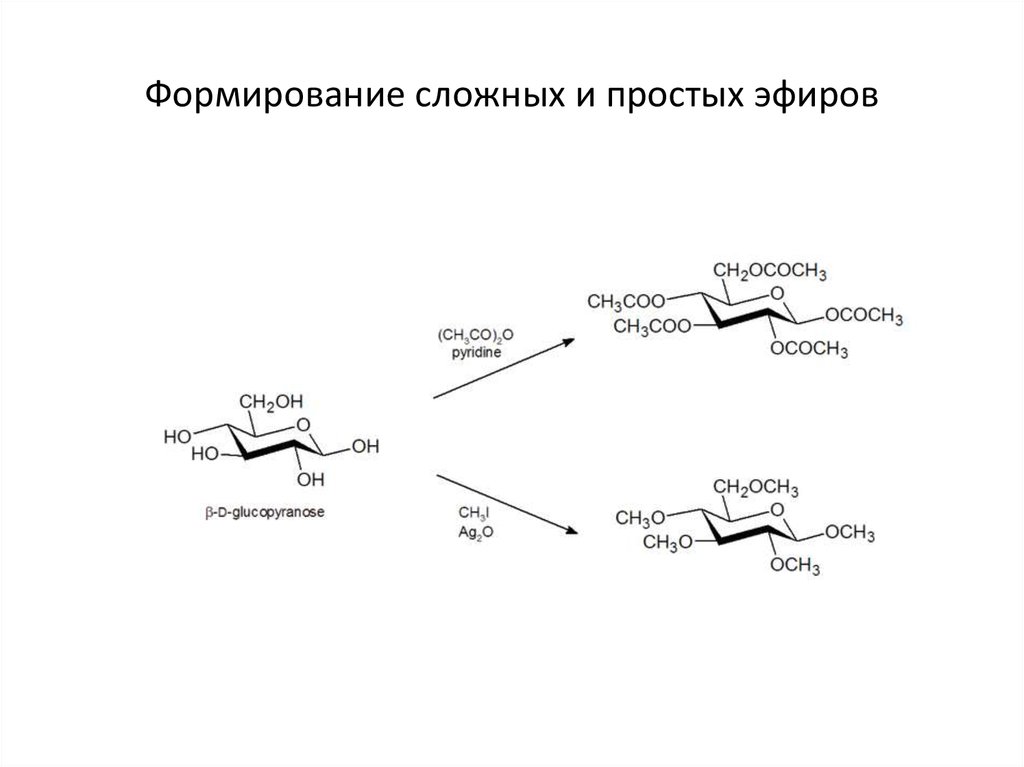
| Алкильная группа | Имя | Алкоксигруппа | Имя | |
|---|---|---|---|---|
| СН 3 – | Метил | СН 3 О– | Метокси | |
| CH 3 CH 2 – | Этил | СН 3 СН 2 О– | Этокси | |
| (CH 3 ) 2 CH– | Изопропил | (CH 3 ) 2 CHO– | Изопропокси | |
| (CH 3 ) 3 C– | трет-бутил | (CH 3 ) 3 CO– | трет-Бутокси | |
| С 6 Н 5 – | Фенил | С 6 Н 5 О– | Фенокси |
Эфиры можно назвать, назвав каждую из двух углеродных групп отдельным словом, за которым следует пробел и слово эфир. Группа -OR также может быть названа заместителем, используя название группы, алкокс
Группа -OR также может быть названа заместителем, используя название группы, алкокс
.
Пример \(\PageIndex{1}\)
CH 3 -CH 2 -O-CH 3 называется этилметиловым эфиром или метоксиэтаном.
Меньшая и более короткая алкильная группа становится алкоксизаместителем. Более крупная и длинная сторона алкильной группы становится названием основания алкана. Каждая алкильная группа по обе стороны от кислорода пронумерована отдельно. Приоритет нумерации отдается углероду, ближайшему к кислороду. Сторона алкокси (более короткая сторона) имеет «-окси», оканчивающуюся соответствующей алкильной группой. Например, CH 3 CH 2 CH 2 CH 2 CH 2 -O-CH 2 CH 2 CH 3 представляет собой 1-пропоксипентан. Если есть цис- или транс-стереохимия, применяется то же правило.
Примеры \(\PageIndex{2}\)
- \(CH_3CH_2OCH_2CH_3\), диэтиловый эфир (иногда называемый просто эфиром)
- \(CH_3OCH_2CH_2OCH_3\), диметиловый эфир этиленгликоля (глим).

Упражнения \(\PageIndex{2}\)
Попробуйте назвать следующие соединения, используя эти соглашения:
J
J
Попробуйте нарисовать структуры следующих соединений:
- 2-пентил-1-пропиловый эфир J
- 1-(2-пропокси)циклопентен J
Общие названия
Простым эфирам даются общие названия, в которых алкильные группы, связанные с кислородом, названы в алфавитном порядке, после чего следует слово «эфир». В верхнем левом примере общее имя показано синим цветом под названием IUPAC. Многие простые эфиры симметричны в том смысле, что два алкильных заместителя одинаковы. Они называются «диалкиловыми эфирами».
- анизол (попробуйте назвать анизол по двум другим соглашениям. J )
- оксиран
1,2-эпоксиэтан, этиленоксид, диметиленоксид, оксациклопропан,
- фуран (это соединение ароматическое)
тетрагидрофуран
оксациклопентан, 1,4-эпоксибутан, тетраметиленоксид,
- диоксан
1,4-диоксациклогексан
Упражнение \(\PageIndex{2}\)
Попробуйте нарисовать структуры следующих соединений:
- 3-броманизол J
- 2-метилоксиран J
- 3-этилфуран J
Гетероциклы
В циклических эфирах (гетероциклах) один или несколько атомов углерода замещены кислородом. Часто это называют гетероатомами, когда углерод заменяется кислородом или любым другим атомом, кроме углерода или водорода. В этом случае основу называют оксациклоалканом, где приставка «окса-» указывает на замену углерода на кислород в кольце. Эти соединения пронумерованы, начиная с кислорода и продолжая по кольцу. Например,
Часто это называют гетероатомами, когда углерод заменяется кислородом или любым другим атомом, кроме углерода или водорода. В этом случае основу называют оксациклоалканом, где приставка «окса-» указывает на замену углерода на кислород в кольце. Эти соединения пронумерованы, начиная с кислорода и продолжая по кольцу. Например,
Если заместителем является спирт, спирт имеет более высокий приоритет. Однако, если заместитель представляет собой галогенид, эфир имеет более высокий приоритет. Если есть и спиртовая группа, и галогенид, спирт имеет более высокий приоритет. Нумерация начинается с конца, наиболее близкого к заместителю с более высоким приоритетом. Существуют простые эфиры, содержащие несколько эфирных групп, которые называются циклическими полиэфирами или краун-эфирами. Они также названы с использованием системы IUPAC.
Сульфиды
Сернистые аналоги простых эфиров (R–S–R’) называются сульфидами , например, (CH 3 ) 3 C–S–CH 3 – трет-бутилметилсульфид.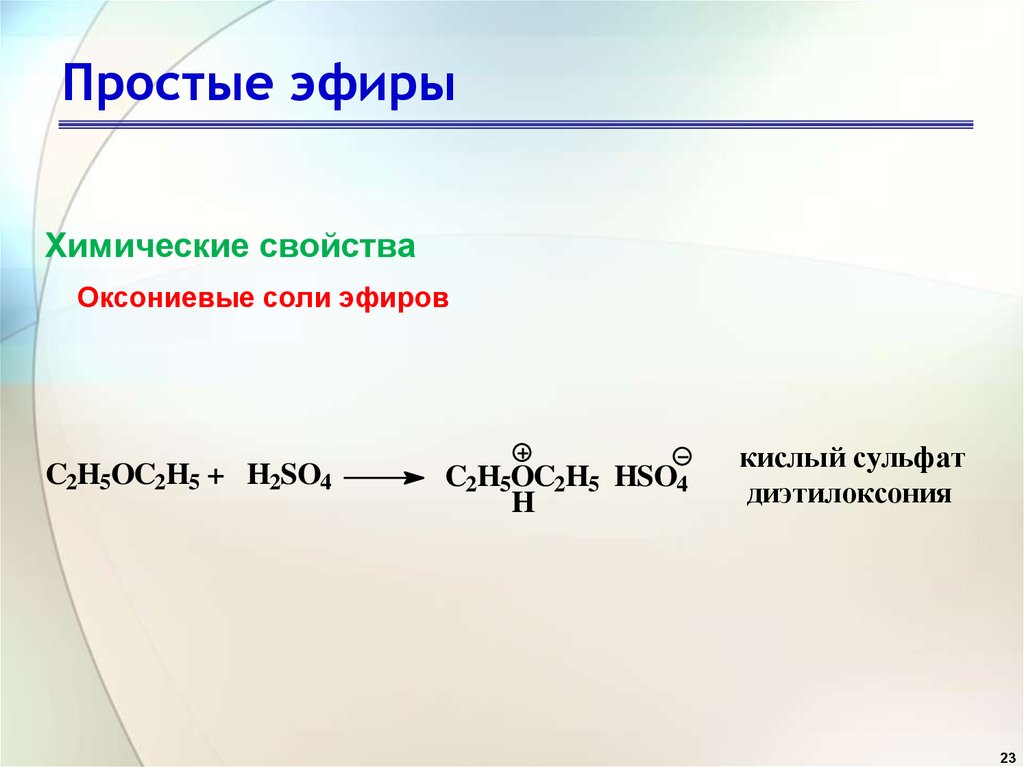 Сульфиды химически более активны, чем простые эфиры, что отражает большую нуклеофильность серы по отношению к кислороду.
Сульфиды химически более активны, чем простые эфиры, что отражает большую нуклеофильность серы по отношению к кислороду.
Ссылки
- Шор, Нил Э. и Фоллхардт, К. Питер К. Органическая химия: структура и функции . Нью-Йорк: Блейер, Бреннан, 2007.
- Зима, Артур. Органическая химия для чайников . Хобокен, Нью-Джерси: Wiley, 2005.
- Пеллегрини, Франк. Краткий обзор Cliffs Organic Chemistry II . Фостер-Сити, Калифорния: Wiley, 2000
.
.
Задачи
Назовите следующие эфиры:
(Ответы на приведенные выше задачи: 1. диэтиловый эфир; 2. 2-этокси-2-метил-1-пропан; 3. цис-1-этокси-2-метоксициклопентан. 4. 1-этокси-1-метилциклогексан 5. оксациклопропан 6. 2,2-диметилоксациклопропан)
Упражнение \(\PageIndex{3}\)
Как бы вы назвали
(CC-BY; Дэн Джонсон через Twitter)
- Ответить
Одноглазый однорогий летающий пропиловый эфир людей
Авторы
Уильям Ройш, почетный профессор (Университет штата Мичиган), Виртуальный учебник органической химии
Ричард Бэнкс (Государственный университет Бойсе)
Эта страница под названием «Номенклатура эфиров» распространяется по незаявленной лицензии, автором, ремиксом и/или куратором которой является Уильям Ройш.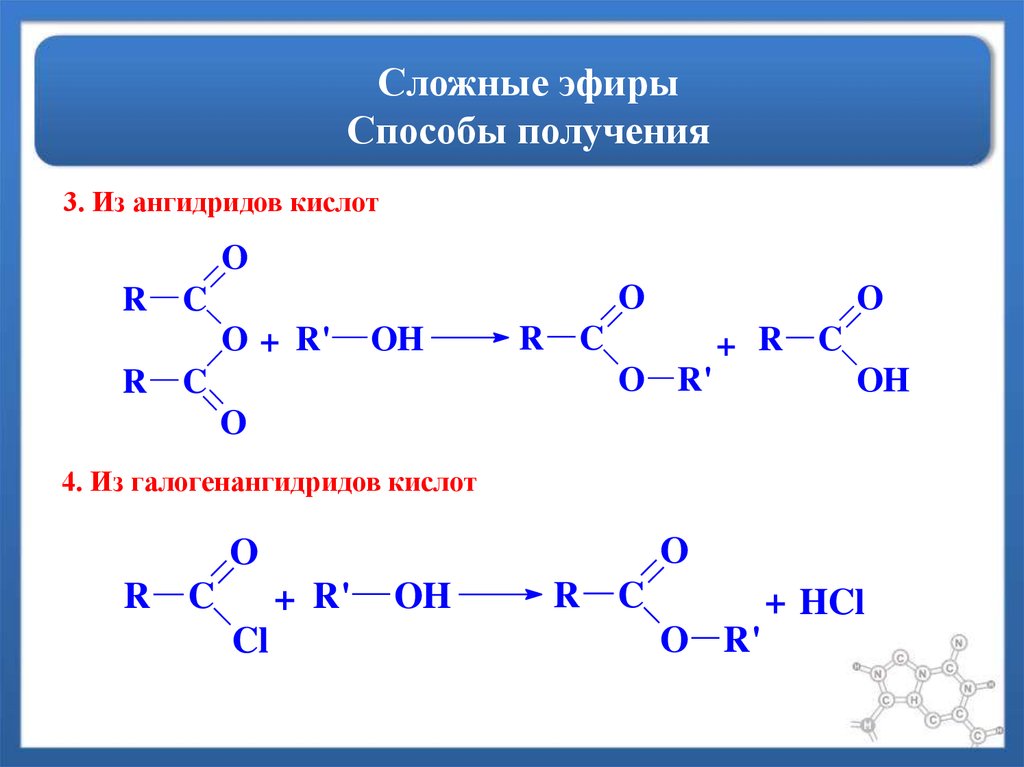
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Глава
- Автор
- Уильям Ройш
- Показать страницу TOC
- № на стр.
- Теги
Функциональная группа эфира | ChemTalk
Учебные пособия по органической химии
- Сообщение от
Макс Фейгельсон
27
Jul
Основные концепции
Это руководство посвящено функциональной группе эфира.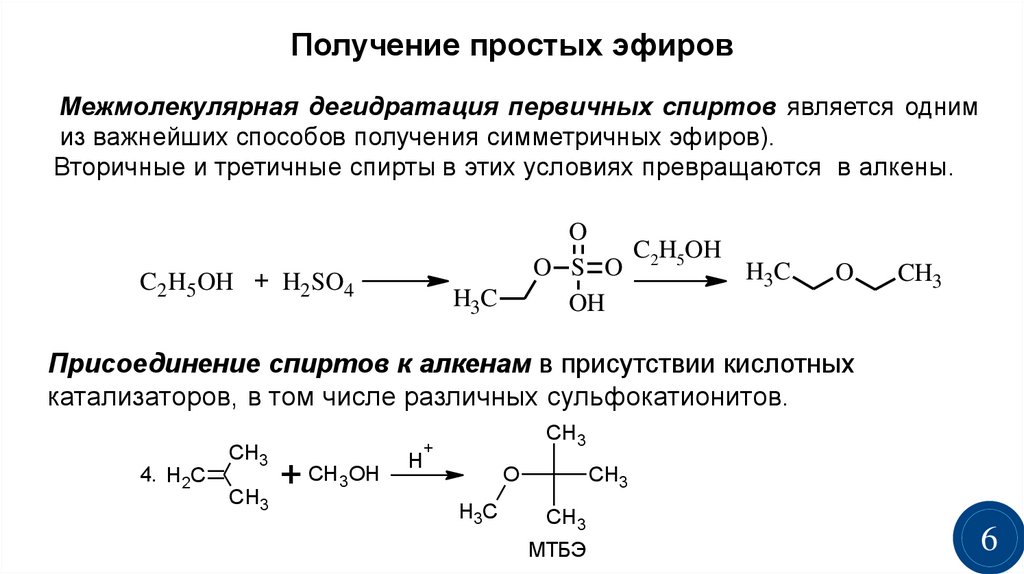 Он будет охватывать структуру эфирной группы и реакции, в которых они участвуют.
Он будет охватывать структуру эфирной группы и реакции, в которых они участвуют.
Темы, освещенные в других статьях
- Функциональные группы
- Эфирная функциональная группа
- Аминофункциональная группа
Что такое эфирная функциональная группа?
Эфирная группа состоит из атома кислорода с группой R, одинарно связанной с каждой стороны. Эти R-группы могут быть одинаковыми, однако не всегда.
В эфире кислород должен быть связан с углеродом с обеих сторон. Если одна из групп R представляет собой атом водорода, то соединение представляет собой спирт.
Краткие сведения о эфирной группе
- Структура: одинарная связь кислорода с двумя алкильными группами.
- Формула: R-O-R’
- Атомный вес: ≥46,07 г/моль
- pH: обычно основной. Эфиры могут действовать как основания Льюиса из-за неподеленных пар на кислороде
- pKa: при протонировании эфиры имеют pKa около -3
- Диэтиловый эфир является распространенным растворителем
Соглашения об именах
Называть простые эфиры довольно просто. Две группы R названы в алфавитном порядке, после чего следует суффикс «-эфир». Если обе группы R одинаковы, префикс «di-» ставится перед названием группы R. Ниже приведены несколько примеров эфиров с их названиями.
Две группы R названы в алфавитном порядке, после чего следует суффикс «-эфир». Если обе группы R одинаковы, префикс «di-» ставится перед названием группы R. Ниже приведены несколько примеров эфиров с их названиями.
Диметиловый эфир Этилизобутиловый эфир 3-хлорпропилэтиловый эфир
Реакции эфирных групп
Эфиры участвуют в многочисленных реакциях, чаще в качестве растворителей, чем реагентов. Простые эфиры, как правило, не вступают в реакцию из-за сложности разрыва одинарных связей CO. Наиболее известной реакцией с участием эфиров является синтез эфира Вильямсона, в котором алкоксид реагирует с алкилгалогенидом с образованием эфира.
Помимо синтеза, простые эфиры реагируют только при определенных обстоятельствах. Например, эпоксиды представляют собой тип эфира, в котором кислород и атомы углерода, непосредственно связанные с ним, образуют трехчленное кольцо. Поскольку валентные углы малы, кольцо натянуто и может разорваться как в кислой, так и в щелочной среде.
Williamson Ether Synthesis
Когда первичный или вторичный алкилгалогенид реагирует с алкоксидом, продуктом реакции является эфир. Одна сторона эфира представляет собой алкильную цепь алкилгалогенида, а другая сторона представляет собой алкильную цепь, полученную из алкоксида. Алкоксидом является любая группа RO – .
Одна сторона эфира представляет собой алкильную цепь алкилгалогенида, а другая сторона представляет собой алкильную цепь, полученную из алкоксида. Алкоксидом является любая группа RO – .
Алкилгалогенид должен быть первичным или вторичным, поскольку синтез протекает как реакция S N 2. Чтобы нуклеофильный алкоксид мог атаковать алкилгалогенид с обратной стороны, должно быть достаточно места. Это означает, что третичные алкилгалогениды не могут подвергаться синтезу эфира Вильямсона.
Образование и раскрытие эпоксидов
Эпоксиды представляют собой разновидность эфира. Это гетероциклические соединения, содержащие кислород и два атома углерода. Одним из способов образования эпоксидов является добавление основания и нагревание к галогенгидрину. Галогенидрин представляет собой соединение, содержащее как группу ОН, так и галогенид.
После депротонирования группы OH группа O атакует другую группу C, запуская Br.
Эпоксиды также образуются, когда алкен реагирует с мета-хлорпербензойной кислотой или m-CPBA.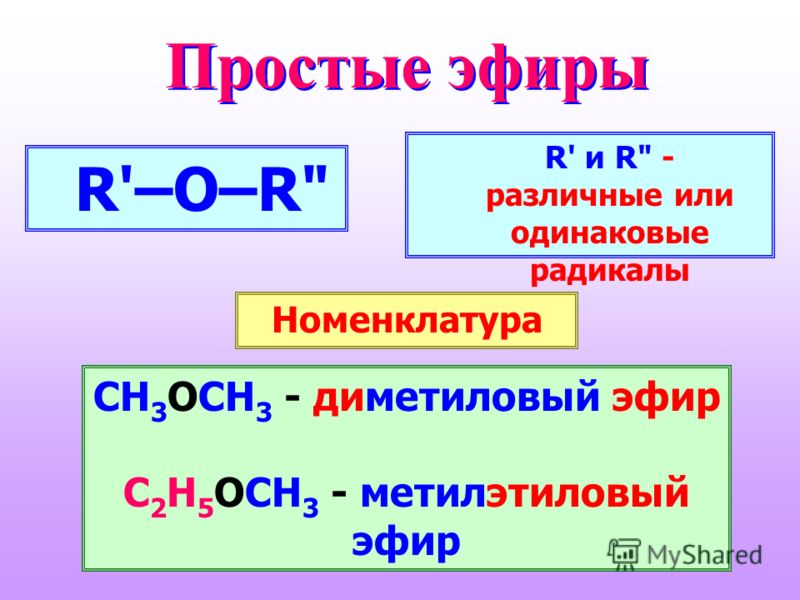
Кольца эпоксида могут открываться как в кислой, так и в щелочной среде. В кислых условиях нуклеофил атакует кольцо с более замещенной стороны. Стереохимия меняется на электрофильный углерод.
В основных условиях нуклеофил атакует кольцо с менее замещенной стороны.
Эфиры как растворители
Эфиры служат растворителями в различных органических реакциях. Они умеренно полярны и апротонны. Это означает, что простые эфиры могут принимать только водородные связи.
Диэтиловый эфир
Одним из наиболее известных примеров этой функциональной группы является диэтиловый эфир. Диэтиловый эфир является полезным растворителем для различных реакций. Исторически он использовался в качестве анестетика. Однако из-за его воспламеняемости более распространены альтернативы диэтиловому эфиру. В современной промышленности циклический эфир тетрагидрофурана более распространен, чем диэтиловый эфир из-за его горючести.
Диэтиловый эфир очень летуч. Несмотря на то, что он имеет температуру кипения 34,6 ° C, диэтиловый эфир быстро испаряется, если оставить его в открытом контейнере.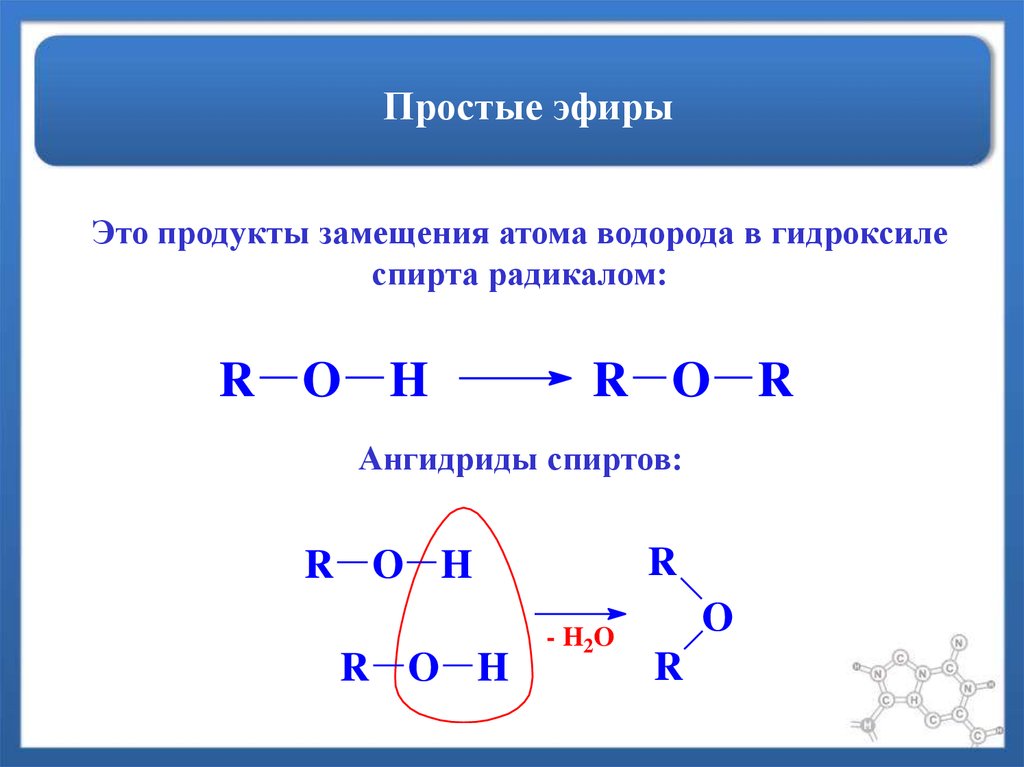

 Сначала при действии на алкены ацетата ртути в водном растворе тетрагидрофурана (ТГФ) или в водной уксусной кислоте при 20°С образуется ртутьорганические соединения. При этом присоединение ацетата ртути к алкену происходит согласно правилу Марковникова. Далее при воздействии таких растворителей как спирты, уксусная кислота, ацетонитрил и др. получаются простые эфиры:
Сначала при действии на алкены ацетата ртути в водном растворе тетрагидрофурана (ТГФ) или в водной уксусной кислоте при 20°С образуется ртутьорганические соединения. При этом присоединение ацетата ртути к алкену происходит согласно правилу Марковникова. Далее при воздействии таких растворителей как спирты, уксусная кислота, ацетонитрил и др. получаются простые эфиры: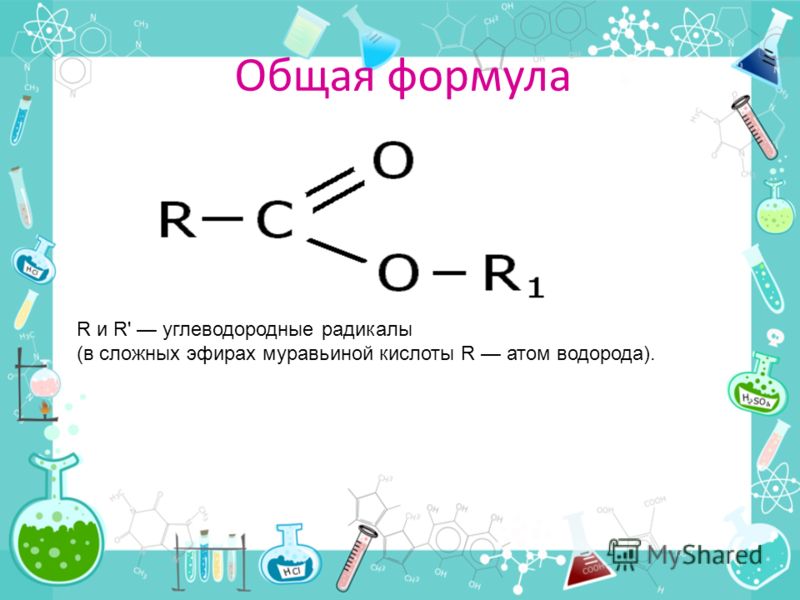 Л.):
Л.):