Содержание
Сложные эфиры: общая характеристика и применение
Сложные эфиры — продукты замещения атомов водорода гидроксильной группы карбоновых и минеральных кислот на карбоновый радикал. Различают моно-, ди- и полиэфиры. Для одноосновных кислот существуют моноэфиры, двух- и многоосновных кислот — полные и кислые эфиры. Название эфира состоит из названия кислоты и спирта, участвующих в его образовании. Для наименования эфиров часто используют тривиальную или историческую номенклатуру. Согласно номенклатуре ИЮПАК названия эфиров образуются так: берут в виде радикала название спирта, добавляют наименование кислоты как углеводорода и окончание -оат. Например, структурные формулы эфиров (изомеры и метамеры), соответствующие молекулярной формуле С4Н802, по разным номенклатурам называются так: пропилформиат (пропилметаноат), изопропилформиат (изоприпилметаноат), этилацетат (этилетаноат), мелпропионат (метилпропаноат).
Получение сложных эфиров. Данные соединения широко распространены в природе. Так, эфиры низкомолекулярных и средних карбоновых кислот гомологического ряда являются частью эфирных масел многих растений (например, уксусноизоамиловый эфир, или «грушевая эссенция», которая входит в состав груш и многих цветов), а эфиры глицерола и высших жирных кислот – химической основой всех жиров и масел. Некоторые сложные эфиры получают синтетическим путем.
Так, эфиры низкомолекулярных и средних карбоновых кислот гомологического ряда являются частью эфирных масел многих растений (например, уксусноизоамиловый эфир, или «грушевая эссенция», которая входит в состав груш и многих цветов), а эфиры глицерола и высших жирных кислот – химической основой всех жиров и масел. Некоторые сложные эфиры получают синтетическим путем.
Реакция этерификации происходит в результате взаимодействия карбоновых (и минеральных) кислот со спиртами. В качестве катализатора выступает сильная минеральная кислота (чаще всего используют h3S04). Катализатор активирует молекулу карбоновые кислоты.
Скорость реакции этерификации зависит также и от того, с каким атомом углерода связана ОН-группа (первичным, вторичным или третичным), от химической природы кислоты и спирта, а также структуры углеводородной цепи, которая связана с карбоксилом.
Гидролиз сложных эфиров. Реакция гидролиза (омыления) сложных эфиров – это оборотная реакция этерификации. Проходит она медленно. Если добавить к реакционной смеси смесь минеральных кислот или щелочей, ее скорость увеличивается. Омыление щелочами происходит в тысячу раз быстрее, чем кислотами. Сложные эфиры гидролизируются в щелочной среде, а простые эфиры – в кислой.
Проходит она медленно. Если добавить к реакционной смеси смесь минеральных кислот или щелочей, ее скорость увеличивается. Омыление щелочами происходит в тысячу раз быстрее, чем кислотами. Сложные эфиры гидролизируются в щелочной среде, а простые эфиры – в кислой.
При нагревании сложных эфиров со спиртами в присутствии сульфатной кислоты или алкоголятов (в щелочной среде) происходит обмен алкоксигруппами. При этом образуется новый эфир, а в реакционную среду возвращается спирт, который раньше входил в виде остатков в состав молекулы эфира.
Сложные эфиры: реакция восстановления. Восстановителями чаще всего бывают алюмогидраты лития, натрия в кипящем спирте. Высокую стойкость эфиров к действию разных окислителей используют в химическом синтезе или анализе для защиты спиртовых и фенольных групп.
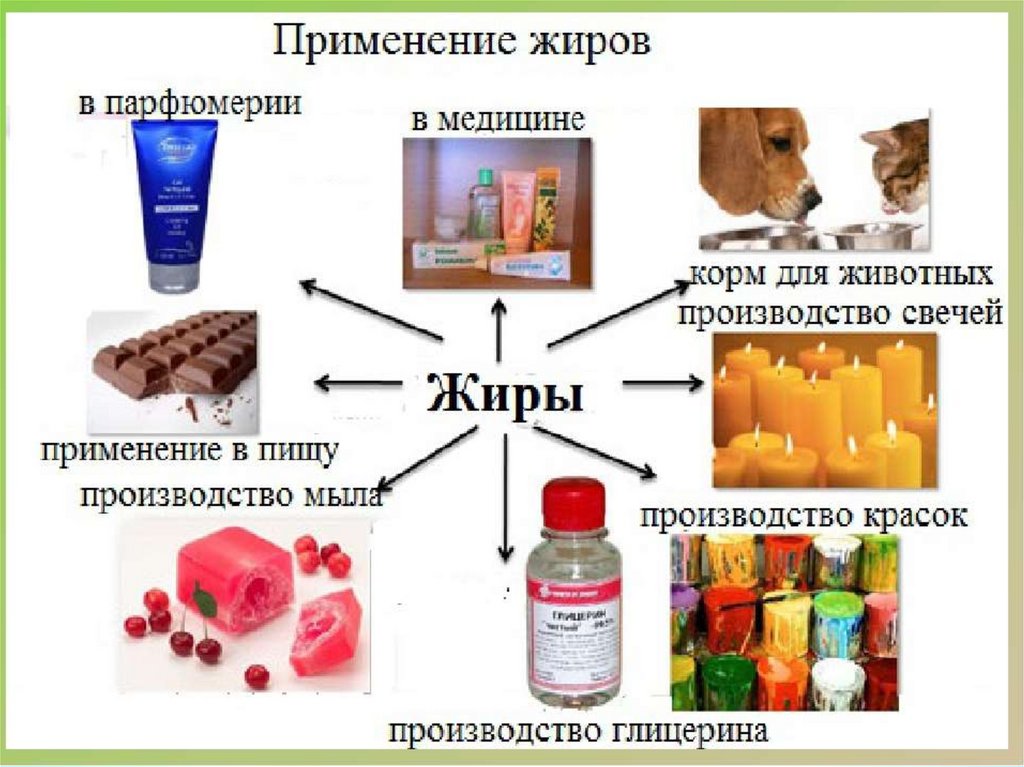
Сложные эфиры: основные представители. Этилэтаноат (уксусноэтиловый эфир) получают вследствие реакции этерификации ацетатной кислоты и этанола (катализатор сульфатная кислота).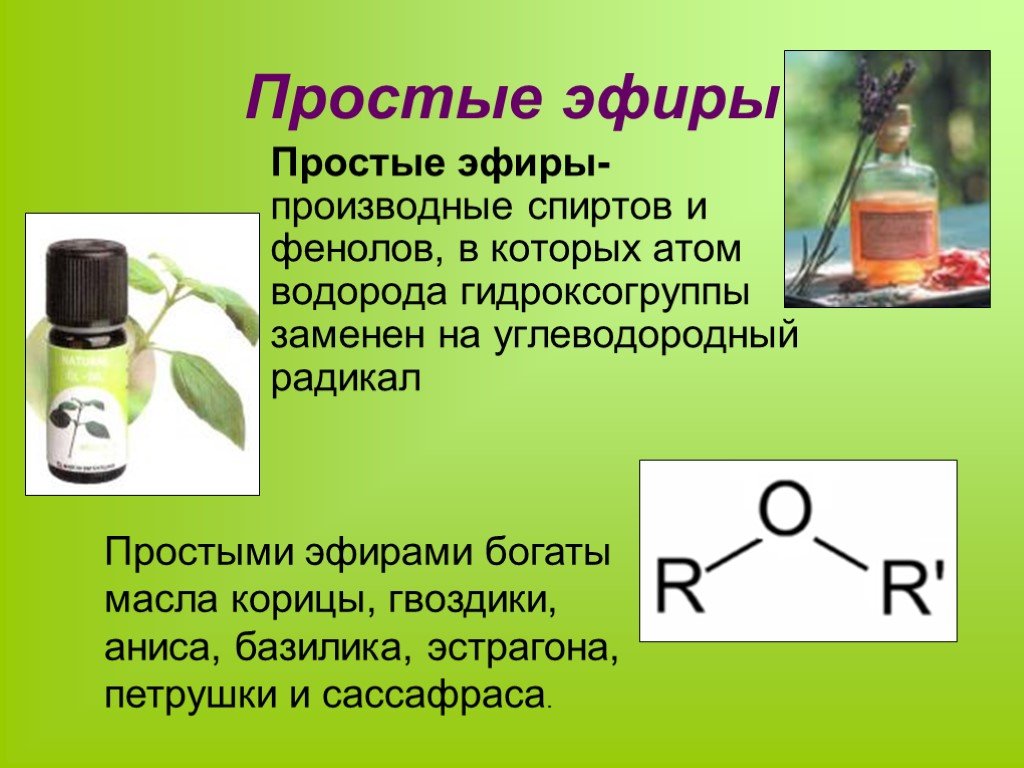 Этилэтаноат используют в качестве растворителя нитрата целлюлозы в производстве бездымного пороха, фото- и кинопленки, компонент фруктовых эссенций для пищевой промышленности.
Этилэтаноат используют в качестве растворителя нитрата целлюлозы в производстве бездымного пороха, фото- и кинопленки, компонент фруктовых эссенций для пищевой промышленности.
Изоамилэтаноат (уксусноизоамиловый эфир, «грушевая эссенция») хорошо растворим в этаноле, диэтиловом эфире. Получают этерификацией ацетатной кислоты и изоамилового спирта. Изоамилметилбутаноат используют в качестве ароматического компонента в парфюмерии и как растворитель.
Изоамилизовалериат («яблочная» эссенция, изовалериановоизоамиловый эфир) получают реакцией этерификации изовалериановой кислоты и изоамилового спирта. Указанный эфир используется в качестве фруктовой эссенции в пищевой промышленности.
Сложные эфиры — свойства, получение и применение
Содержание
- Сложные эфиры карбоновых кислот
- Синтез
- Свойства и реакционная способность
- Применение
- Применение в медицине
- Сложные эфиры неорганических кислот
Сложные эфиры, или эстеры» title=»Эфир»>эфир»), — производные оксокислот, имеющих общую формулу RkE(=O)l(OH)m, где l ≠ 0, формально являющиеся продуктами замещения атомов водорода в гидроксилах —OH кислотной функции на углеводородный остаток; рассматриваются также как ацилпроизводные спиртов. В номенклатуре IUPAC к сложным эфирам относят также ацилпроизводные халькогенидных аналогов спиртов.
В номенклатуре IUPAC к сложным эфирам относят также ацилпроизводные халькогенидных аналогов спиртов.
У слова «Эстер» есть и другие значения; см. Эстер.
Отличаются от простых эфиров (этеров), у которых два углеводородных радикала соединены атомом кислорода (R1—O—R2).
Сложные эфиры карбоновых кислот
В случае эфиров карбоновых кислот выделяются два класса сложных эфиров:
- собственно сложные эфиры карбоновых кислот общей формулы R1—COO—R2, где R1 и R2 — углеводородные радикалы.
- ортоэфиры карбоновых кислот общей формулы R1—C(OR2)3, где R1 и R2 — углеводородные радикалы. Ортоэфиры карбоновых кислот являются функциональными аналогами кеталей и ацеталей общей формулы R—C(OR′)2—R″ — продуктов присоединения спиртов к карбонильной группе кетонов или альдегидов.
Циклические сложные эфиры оксикислот называются лактонами и выделяются в отдельную группу соединений.
Синтез
Основные методы получения сложных эфиров:
- Этерификация — взаимодействие кислот и спиртов в условиях кислотного катализа, например получение этилацетата из уксусной кислоты и этилового спирта:
- Частным случаем реакции этерификации является реакция переэтерификации сложных эфиров спиртами, карбоновыми кислотами или другими сложными эфирами:
- Реакции этерификации и переэтерификации обратимы, сдвиг равновесия в сторону образования целевых продуктов достигается удалением одного из продуктов из реакционной смеси (чаще всего — отгонкой более летучих спирта, эфира, кислоты или воды; в последнем случае при относительно низких температурах кипения исходных веществ используется отгонка воды в составе азеотропных смесей).
- взаимодействие ангидридов или галогенангидридов карбоновых кислот со спиртами, например получение этилацетата из уксусного ангидрида и этилового спирта:
- Алкоголиз нитрилов в присутствии кислот:
- Алкилирование карбоновых кислот арилиакилтриазенами:
Свойства и реакционная способность
Сложные эфиры низших карбоновых кислот и простейших одноатомных спиртов — летучие бесцветные жидкости с характерным, зачастую фруктовым запахом. Сложные эфиры высших карбоновых кислот — бесцветные твердые вещества, температура плавления зависит как от длин углеродных цепей ацильного и спиртового остатков, так и от их структуры.
Сложные эфиры высших карбоновых кислот — бесцветные твердые вещества, температура плавления зависит как от длин углеродных цепей ацильного и спиртового остатков, так и от их структуры.
В ИК-спектрах сложных эфиров присутствуют характеристические полосы карбоксильной группы — валентных колебаний связей C=O на 1750—1700 см−1 и С—О на 1275—1050 см−1.
Атом углерода карбонильной группы сложных эфиров электрофилен, вследствие этого для них характерны реакции замещения спиртового остатка с разрывом связи ацил-кислород:
который далее реагирует с водой (гидролиз) или спиртом (переэтерификация). Гидролиз сложных эфиров в условиях кислотного катализа является обратимым, гидролиз же в щелочной среде необратим из-за образования карбоксилат-ионов RCOO−, не проявляющих электрофильных свойств.
Низшие сложные эфиры реагируют с аммиаком, образуя амиды, уже при комнатной температуре: так, например, этилхлорацетат реагирует с водным аммиаком, образуя хлорацетамид уже при 0 °C, в случае высших сложных эфиров аммонолиз идет при более высоких температурах.
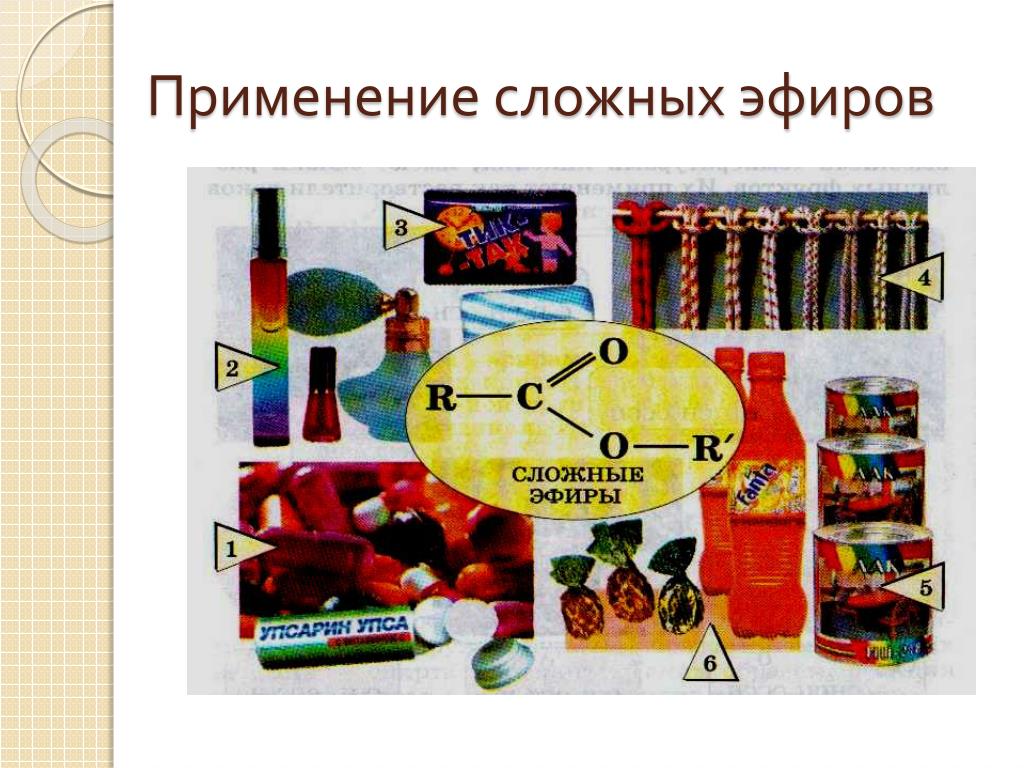
Применение
Сложные эфиры широко используются в качестве растворителей, пластификаторов, ароматизаторов.
Эфиры муравьиной кислоты:
- HCOOCH3 — метилформиат, tкип = 32 °C; растворитель жиров, минеральных и растительных масел, целлюлозы, жирных кислот; ацилирующий агент; используют в производстве некоторых уретанов, формамида.
- HCOOC2H5 — этилформиат, tкип = 53 °C; растворитель нитрата и ацетата целлюлозы; ацилирующий агент; отдушка для мыла, его добавляют к некоторым сортам рома, чтобы придать ему характерный аромат; применяют в производстве витаминов B1, A, E.
- HCOOCH2CH(CH3)2 — изобутилформиат несколько напоминает запах ягод малины.
- HCOOCH2CH2CH(CH3)2 — изоамилформиат (изопентилформиат) растворитель смол и нитроцеллюлозы.
- HCOOCH2C6H5 — бензилформиат, tкип = 202 °C; имеет запах жасмина; используется как растворитель лаков и красителей.

- HCOOCH2CH2C6H5 — 2-фенилэтилформиат имеет запах хризантем.
Эфиры уксусной кислоты:
- CH3COOCH3 — метилацетат, tкип = 58 °C; по растворяющей способности аналогичен ацетону и применяется в ряде случаев как его заменитель, однако он обладает большей токсичностью, чем ацетон.
- CH3COOC2H5 — этилацетат, tкип = 78 °C; подобно ацетону растворяет большинство полимеров. По сравнению с ацетоном его преимущество в более высокой температуре кипения (меньшей летучести).
- CH3COOC3H7 — н-пропилацетат, tкип = 102 °C; по растворяющей способности подобен этилацетату.
- CH3COOCH(CH3)2 — изопропилацетат, tкип = 88 °C; по растворяющим свойствам занимает промежуточное положение между этил- и пропилацетатом.
- CH3COOC5H11 — н-амилацетат (н-пентилацетат), tкип = 148 °C; напоминает по запаху грушу, применяется как растворитель для лаков, поскольку он испаряется медленнее, чем этилацетат.

- CH3COOCH2CH2CH(CH3)2 — изоамилацетат (изопентилацетат), используется как компонент грушевой и банановой эссенций.
- CH3COOC8H17 — н-октилацетат имеет запах апельсинов.
Эфиры масляной кислоты:
- C3H7COOCH3 — метилбутират, tкип = 102,5 °C; по запаху напоминает ранет.
- C3H7COOC2H5 — этилбутират, tкип = 121,5 °C; имеет характерный запах ананасов.
- C3H7COOC4H9 — бутилбутират, tкип = 166,4 °C;
- C3H7COOC5H11 — н-амилбутират (н-пентилбутират) и C3H7COOCH2CH2CH(CH3)2 — изоамилбутират (изопентилбутират) имеют запах груш, а также служат растворителями в лаках для ногтей.
Эфиры изовалериановой кислоты:
- (CH3)2CHCH2COOCH2CH2CH(CH3)2 — изоамилизовалерат (изопентилизовалерат) имеет запах яблока.

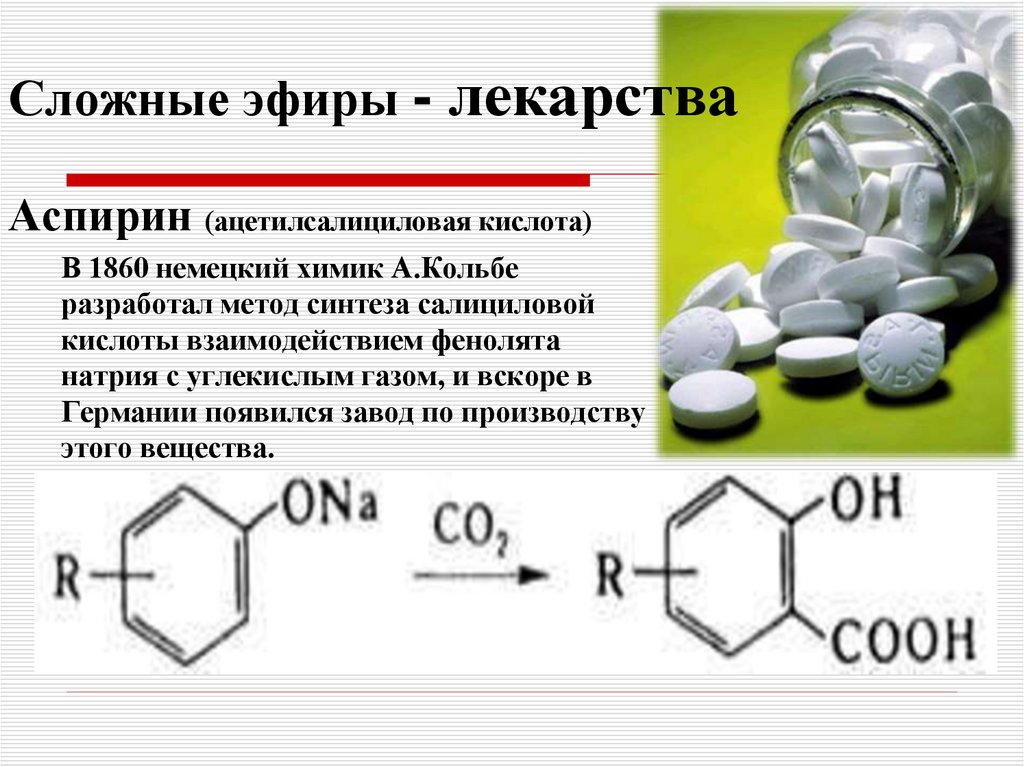
Применение в медицине
В конце XIX — начале XX века, когда органический синтез делал свои первые шаги, множество сложных эфиров было синтезировано и испытано фармакологами. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
Сложные эфиры неорганических кислот
В сложных эфирах неорганических (минеральных) кислот углеводородный радикал (например, алкил) замещает один или несколько атомов водорода неорганической оксокислоты, таким образом эфиры неорганических кислот могут быть как средними, так и кислыми.
По строению эфиры напоминают соли кислот. Так, эфирами фосфорной, азотной, серной и др. кислот являются органические фосфаты, нитраты, сульфаты и др. соответственно.
Ниже приведены примеры эфиров неорганических кислот:
| Кислота | Сложные эфиры | ||||
| Название | Формула | Название | Общая формула | Примеры | |
| Молекулярная | Структурная | ||||
| Фосфорная кислота | H3PO4 | Фосфорные эфиры (фосфаты) | (RO)nP(=O)(OH)3-n, где n = 1-3 | (случай n = 3) |
|
| Азотная кислота | HNO3 | Нитратные эфиры (нитраты) | (RО)N(=O)O |
| |
| Азотистая кислота | HNO2 | Нитритные эфиры (нитриты) | (RO)N(=O) |
| |
| Серная кислота | H2SO4 | Сульфатные эфиры (сульфаты) | (R1O)S(=O)2(OR2) |
| |
| Сернистая кислота | H2SO3 | Сульфитные эфиры (сульфиты) | (R1O)S(=O)(OR2) | ||
| Угольная кислота | H2CO3 | Угольные эфиры (карбонаты) | (R1O)C(=O)(OR2) |
| |
| Борная кислота | H3BO3 | Борные эфиры (бораты) | (RO)3B |
| |
В таблице, в общих молекулярных формулах эфиров символом =О обозначена оксогруппа.
[18F]Фторирование арилборонового эфира с использованием [18F]селектфторбис(трифлата): применение к 6-[18F]фтор-1-ДОФА
[
18 F]Фторирование арилборного эфира с использованием [ 18 F]селектфтор бис(трифлата): применение к 6-[ 18 F]фтор-1-ДОФА†
Ида С. Р.
Стенхаген, ‡ и
Анна К.
Кирявайнен,‡ б
Сарита Дж.
Форсбак, б
Шарлотта Г.
Йоргенсен, и
Эдвард Г.
Робинс, c
Саджиндер К.
Лутра, c
Олоф
Солин б
а также
Вероник
Губернатор* a
Принадлежности автора
*
Соответствующие авторы
и
Лаборатория химических исследований, Оксфордский университет, 12 Мэнсфилд-роуд, Оксфорд, Великобритания
Электронная почта:
veronique.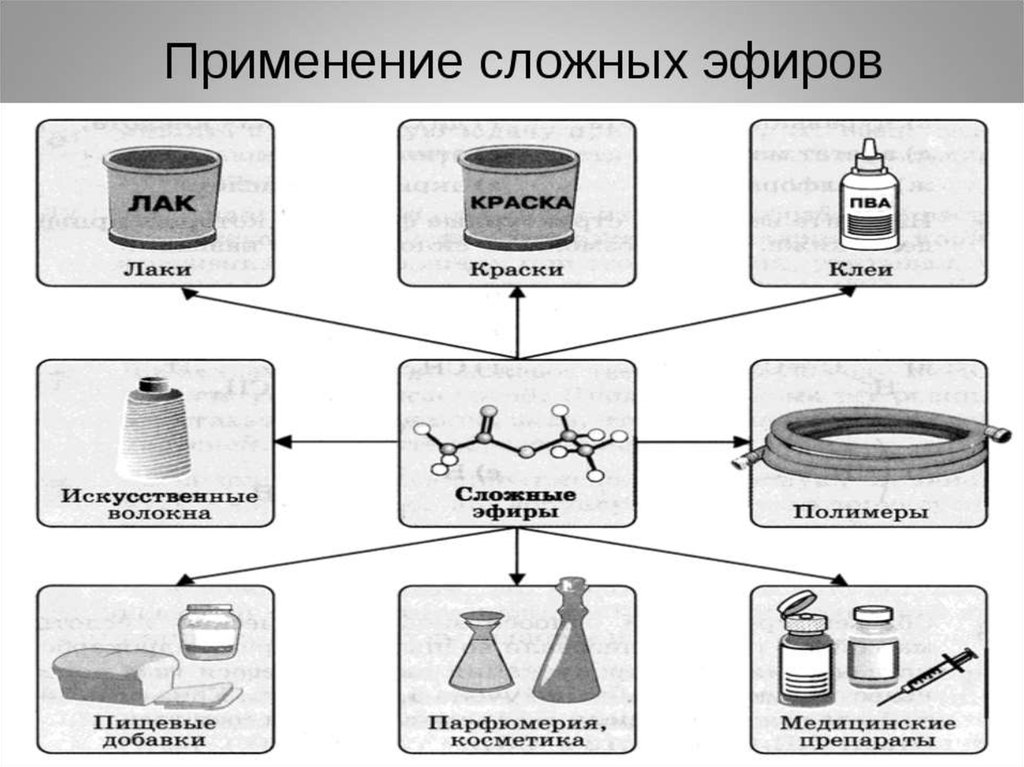 [email protected]
[email protected]
Факс: +44 (0)1865 285002
Тел.: +44 (0)1865 276544
б
Центр ПЭТ в Турку, Лаборатория радиофармацевтической химии, Kiinamyllynkatu 4-8, FIN-20520 Турку, Финляндия
с
The Grove Centre, White Lion Road, Амершам, Великобритания
Аннотация
Ag-опосредованная электрофильная [ 18 F] фторирование эфира арилборной кислоты.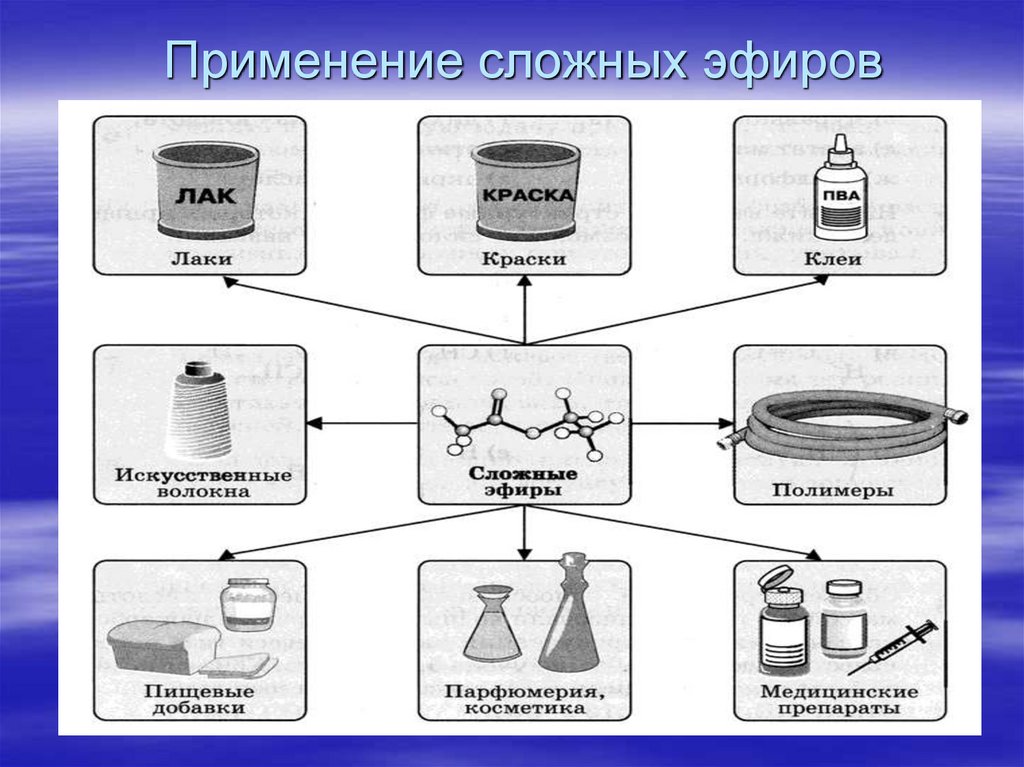 В этом новом радиохимическом преобразовании используется [ 18 F]селектфторбис(трифлат) в ацетоне. Процесс дал 6-[ 18 F]фтор- L -DOPA с RCY 19 ± 12% и удельной активностью 2,6 ± 0,3 ГБк мкмоль -1 .
В этом новом радиохимическом преобразовании используется [ 18 F]селектфторбис(трифлат) в ацетоне. Процесс дал 6-[ 18 F]фтор- L -DOPA с RCY 19 ± 12% и удельной активностью 2,6 ± 0,3 ГБк мкмоль -1 .
Приложение для упаковки | Эстер
Полиэфирные пленки
Закрытие торгового окна
Итоги заседания Совета директоров, состоявшегося 6 января 2022 г.
Сообщение о проведении заседания Совета директоров 3 февраля 2022 г.
Телефонная конференция для инвесторов и аналитиков
Итоги заседания Совета директоров, состоявшегося 3 февраля 2022 г.
Пресс-релиз о результатах за квартал и период, закончившиеся 31 декабря 2021 года.

Закрытие торгового окна
Повышение кредитного рейтинга
Предприятие по продаже инженерного пластика (EP) в условиях резкого спада
Сообщение о внеочередном общем собрании
Пресс-релиз — Окончательное соглашение о продаже своего бизнеса по производству инженерных пластмасс компании Radici Plastics India Private Limited.
Уведомление о внеочередном общем собрании
Публикация в газете Уведомления о внеочередном общем собрании акционеров, которое состоится 10 июня 2022 года.
Сообщение о проведении заседания Совета директоров 20 мая 2022 г.
Телефонная конференция для инвесторов и аналитиков
Итоги заседания Совета директоров, состоявшегося 20 мая 2022 г.

Финансовые результаты
Пресс-релиз по итогам квартала и года, закончившегося 31 марта 2022 г.
Протокол внеочередного общего собрания, состоявшегося 10 июня 2022 года
Результаты голосования вместе с отчетом наблюдателя внеочередного общего собрания, состоявшегося 10 июня 2022 г.
Закрытие торгового окна
Пресс-релиз «Выпуск акций Эстер, заложенных учредителем»
Сообщение о проведении заседания Совета директоров 10 августа 2022 г.
Конференц-связь для инвесторов и аналитиков
Итоги заседания Совета директоров, состоявшегося 10 августа 2022 г.
Пресс-релиз о финансовых результатах за квартал, закончившийся 30 июня 2022 года
Газета Публикация финансовых результатов за квартал, закончившийся 30 июня 2022 года
Отставка финансового директора
Завершение продажи подразделения инженерных пластмасс
Протокол годового общего собрания, состоявшегося 28 сентября 2022 г.

Результаты голосования вместе с отчетом наблюдателя для ежегодного общего собрания, состоявшегося 28 сентября 2022 года
Закрытие торгового окна
Полиэтилентерефталат, широко известный как ПЭТ, прозрачен, прозрачен, имеет малый вес, обладает хорошими газонепроницаемыми свойствами, пригоден для вторичной переработки и подходит для пищевых продуктов и упаковки. Это свойство ПЭТ повлияло на его использование и распространило свое присутствие от кухни до многопрофильных больниц. В настоящее время ПЭТ-материалы используются во всех секторах.
Бутылки для воды, соков, газированных безалкогольных напитков (CSD), ПЭТ-бутылки используются во многих формах и для различных целей. Впервые пластиковые бутылки были использованы в коммерческих целях в 1947 году, и до начала 1960-х годов использование таких бутылок оставалось сравнительно дорогим. Почти через одно десятилетие, в начале 1970-х годов, в обиход вошла первая ПЭТ-бутылка, и теперь она стала нарицательным.