Содержание
Применение — простой эфир — Большая Энциклопедия Нефти и Газа, статья, страница 1
Cтраница 1
Применение простых эфиров ( тетра-бутоксититана и тетраизопропоксититана) исследовано при этери-фикации алифатических кислот фенолами.
[1]
Применение простых эфиров в качестве растворителей реактивов Гриньяра возможно благодаря устойчивости их к действию этих реагентов. Однако эфиры аллильного типа легко расщепляются при действии магнийорганических соединений.
[2]
Применение простых эфиров ( тетра-бутоксититана и тетраизопропоксититана) исследовано при этерификации алифатических кислот фенолами. При этом образуются ари-ловые эфиры алифатических кислот.
[3]
| Температуры кипения и плотности простейших эфиров гликолей.
[4] |
Области применения простых эфиров гликоля чрезвычайно-разнообразны. Однако количество изученных простых эфиров гликолей очень незначительно.
[5]
При применении простого эфира уменьшается расход ацетамидина, так как при конденсации последнего с простым эфиром не образуется кислота, а потому можно применять ацетамидин в эквимолекулярном количестве.
[6]
| Показатели процесса экстракции при применении диэтиленгликоля ( ДЭГ в качестве экстрагента.
[7] |
Этот процесс основан на применении простых эфиров этиленгликоля ( преимущественно диэтиленгли-коля) в качестве растворителя. Обычно все вновь предлагаемые растворители оцениваются преимущественно путем сравнения с диэтиленгли-колем.
[8]
Как показали результаты исследований, применение простых эфиров ортотитановой кислоты в качестве катализаторов этерификации ароматических окси — и поликарбоновых кислот или катализаторов переэтерификации их алифатических эфиров не всегда приводит к получению индивидуально чистых ариловых эфиров. Простые эфиры ортотитановой кислоты легко взаимодействуют с ароматическими окси — и поликарбоновыми кислотами, а также их алифатическими эфирами с образованием ацилатных производных, нерастворимых в реакционной среде. Это способствует протеканию гетерогенного катализа при этерификации и обуславливает необходимость проведения реакции при температурах, превышающих ранее указанный предел 150 — 200 С.
Простые эфиры ортотитановой кислоты легко взаимодействуют с ароматическими окси — и поликарбоновыми кислотами, а также их алифатическими эфирами с образованием ацилатных производных, нерастворимых в реакционной среде. Это способствует протеканию гетерогенного катализа при этерификации и обуславливает необходимость проведения реакции при температурах, превышающих ранее указанный предел 150 — 200 С.
[9]
Как показали результаты исследований, применение простых эфиров ортотитановой кислоты в качестве катализаторов этерификации ароматических окси — и поликарбоновых кислот или катализаторов переэтерификации их алифатических эфиров не всегда приводит к получению индивидуально чистых ариловых эфиров. Простые эфиры ортотитановой кислоты легко взаимодействуют с ароматическими окси — и поликарбояовыми кислотами, а также их алифатическими эфирами с образованием ацилатных производных, нерастворимых в реакционной среде. Это способствует протеканию гетерогенного катализа при этерификации и обуславливает необходимость проведения реакции при температурах, превышающих ранее указанный предел 150 — 200 С.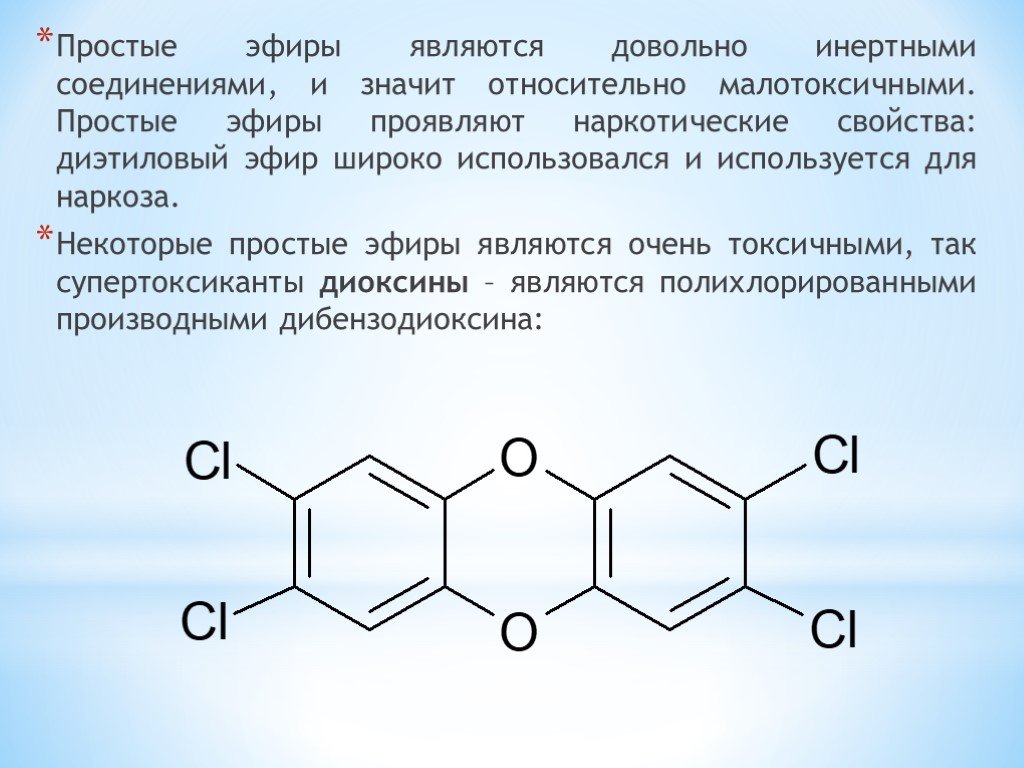
[10]
В связи с результатами алкилироваиия ароматических углеводородов метил-вщор-бутиловым эфиром [23] потребовалось внести некоторые изменения в предложенный выше механизм, по крайней мере для опытов с применением вторичных простых эфиров.
[11]
| Наркотическое действие диметилового эфира.
[12] |
Несмотря на то, что эфиры устойчивы к действию разбавленных кислот и сильных оснований, диэтиловый эфир, например, легко хлорируется в темноте при комнатной температуре. Поэтому применение простых эфиров в качестве пропеллентов требует тщательных испытаний в каждом отдельном случае.
[13]
Этот процесс, разработанный совместно фирмами Доукемикл и Юниверсл ойл продактс, основан на применении простых эфиров гликоля в качестве растворителя и включает многочисленные новые усовершенствования, которые значительно расширили возможности применения и улучшили экономические показатели экстракционных процессов как метода производства индивидуальных углеводородов из смесей по сравнению с ранее применявшимися процессами.
[14]
Эфирам, образующимся при взаимодействии целлюлозы с а, р-ненасыщенными соединениями, прежде всего с акрилонитрилом, в последнее десятилетие было посвящено большое число исследований. Эти эфиры будут описаны в разд. IV, В, а сшитые простые зфиры целлюлозы — в разд. Сведения о новых областях применения простых эфиров целлюлозы содержатся также в разд.
[15]
Страницы:
1
2
Простые эфиры
Простые эфиры
Простыми эфирами называют органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных атомом кислорода: R–O–R’, где R и R’ – различные или одинаковые радикалы.
Простые эфиры рассматриваются как производные спиртов. Названия этих соединений состоят из названий радикалов и слова эфир (название класса). Для симметричных эфиров ROR используется приставка ди перед названием радикала, а в названиях несимметричных эфиров ROR’ радикалы указываются в алфавитном порядке.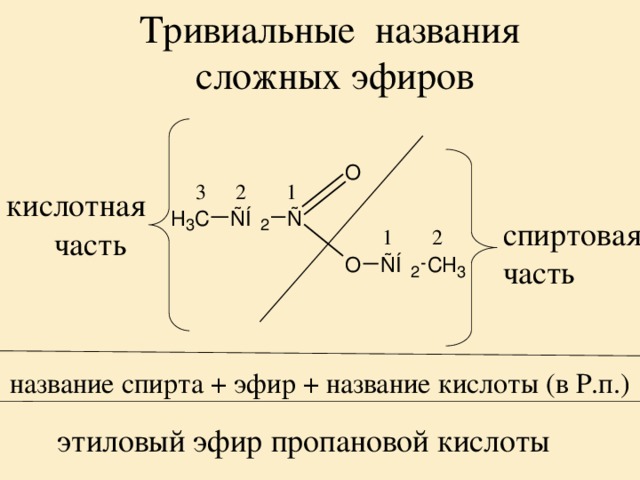 Например, CH3OCH3 – диметиловый эфир; C2H5OCH3 – метилэтиловый эфир.
Например, CH3OCH3 – диметиловый эфир; C2H5OCH3 – метилэтиловый эфир.
Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов.
При этом в одной молекуле спирта разрывается связь О–Н, а в другой – связь С–О. Реакцию можно рассматривать как нуклеофильное замещение группы HО– (в одной молекуле спирта)
на группу RO– (от другой молекулы).
Эфиры несимметричного строения R–O–R’ образуются при взаимодействии алкоголята и галогенуглеводорода (синтез Вильямсона).
Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана:
C2H5O– Na+ + CH3Cl C2H5OCH3 + NaCl
В этой реакции происходит нуклеофильное замещение галогена (Cl–) на алкоксигруппу (C2H5O–).
Простые эфиры получают также присоединением спиртов и фенолов к ненасыщенным углеводородам.
- Присоединение к алкенам:
- Присоединение к алкинам с образованием виниловых эфиров (реакция винилирования):
- разложение под действием концентрированных иодоводородной или бромоводородной кислот
R–O–R’ + HI ROH + R’I - образование нестойких солей оксония (подобных солям аммония) в результате взаимодействия с сильными кислотами
R2O + HCl [R2OH]+Cl— - диоксан
Диоксан (т. кип. 101 °С) – хороший растворитель, смешивается как с водой, так и с углеводородами. За эти качества его назвали «органической водой». Достаточно токсичен. Значительно более опасны галогенсодержащие дибензопроизводные диоксана.
 Например, печально известный диоксин (2,3,7,8-тетрахлордибензо-п-диоксин).
Например, печально известный диоксин (2,3,7,8-тетрахлордибензо-п-диоксин). - эпоксиды — соединения, содержащие эпоксидную группу, отличающиеся от других простых эфиров высокой реакционной способностью вследствие напряжённости трёхчленного цикла и играющие важную роль в органическом синтезе и производстве эпоксидных смол.
Для получения эпоксидов используются:- — реакции окисления алкенов
Каталитическое окисление этилена
Окисление алкенов пероксикислотами в инертных растворителях (реакция Прилежаева)
- — дегидрогалогенирование галогенгидринов (галогеноспиртов) под действием оснований
Этот процесс идёт как внутримолекулярный синтез Вильямсона, где гидроксид-ион играет роль нуклеофильного агента, а галоген — уходящей группы
Реакция идет по правилу Марковникова (электрофильный механизм). Роль катализатора BF3 – образование электрофила H+ в составе комплекса H+[CH3OBF3]–, получаемого при взаимодействии спирта и трифторида бора.
Присоединение фенолов к алкенам происходит в более жестких условиях и сопровождается побочными реакциями (алкилирование ароматического кольца).
Механизм реакции – нуклеофильное присоединение по тройной связи. Нуклеофил – феноксид-анион ArO– (или алкоксид-анион RO–), образующийся из фенола (или спирта) под действием щелочи.
Простые эфиры имеют более низкие температуры кипения и плавления, чем изомерные им спирты. Эфиры практически не смешиваются с водой. Это объясняется тем, что простые эфиры не образуют водородных связей, так как в их молекулах отсутствуют полярные связи О–Н.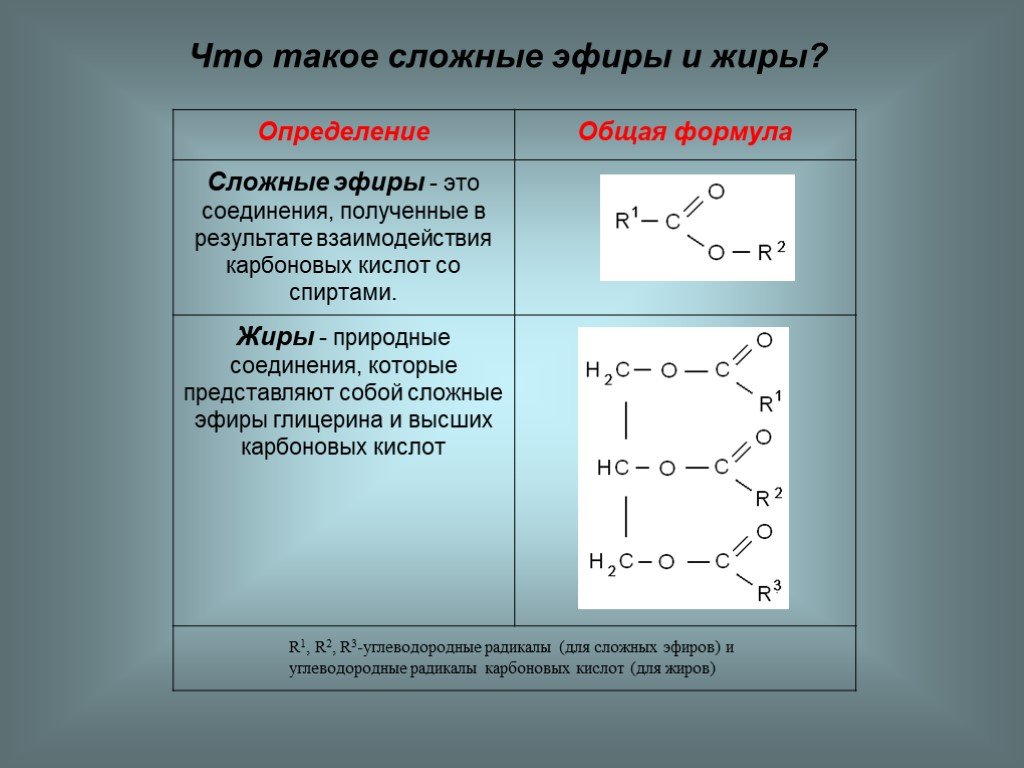
Простые эфиры – малоактивные соединения, они значительно менее реакционноспособны, чем спирты. Хорошо растворяют многие органические вещества и поэтому часто используются как растворители. Наиболее характерные реакции простых эфиров:
К важнейшим простым эфирам относятся также гетероциклические кислородсодержащие соединения:
Использование простых эфиров в здравоохранении
Эфир представляет собой разновидность органических соединений, содержащих эфирную группу с атомом кислорода, соединяющим две алкильные или арильные группы. Эти эфиры можно разделить на 2 класса, если органическая группа по обе стороны от атома кислорода одинакова, то их называют легкими или симметричными эфирами. В случае, если они различны, эфиры называются смешанными или несимметричными. Эфир — чрезвычайно огнеопасное химическое вещество и был одним из первых анестетиков. Хранить их нужно в бутылке темно-коричневого цвета, чтобы можно было предотвратить взаимодействие дневного света с химикатом. Это в некотором роде предотвращает любой химический процесс, который может вызвать пожар.
Эти эфиры можно разделить на 2 класса, если органическая группа по обе стороны от атома кислорода одинакова, то их называют легкими или симметричными эфирами. В случае, если они различны, эфиры называются смешанными или несимметричными. Эфир — чрезвычайно огнеопасное химическое вещество и был одним из первых анестетиков. Хранить их нужно в бутылке темно-коричневого цвета, чтобы можно было предотвратить взаимодействие дневного света с химикатом. Это в некотором роде предотвращает любой химический процесс, который может вызвать пожар.
Физические свойства:
Эфир представляет собой летучую, бесцветную, воспламеняющуюся жидкость, состоящую примерно на 96 процентов из абсолютного этилоксида и примерно на 4 процента из спирта, содержащего небольшое количество воды. Его удельный вес колеблется от 0,725 до 0,728 при 59°F, поэтому он легче воды, но его пары тяжелее воздуха, с которым он образует взрывоопасную смесь.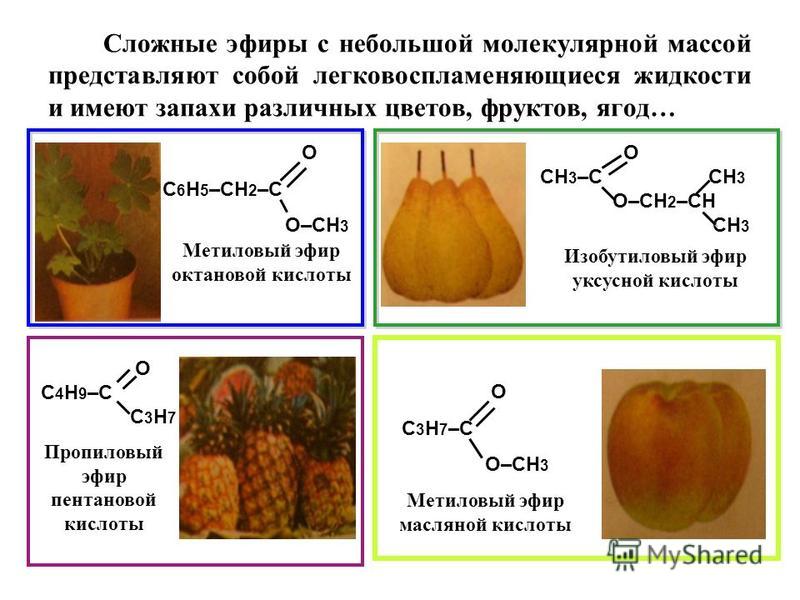 Он быстро испаряется на открытом воздухе, создавая эффект прохлады. Его запах крепкий и характерный, его стиль горячий и острый. Он растворяет масла, жиры, смолы, каучук, большинство органических алкалоидов и множество различных веществ. Лучше всего его назначать в виде духа эфира, который легко смешивается с водой.
Он быстро испаряется на открытом воздухе, создавая эффект прохлады. Его запах крепкий и характерный, его стиль горячий и острый. Он растворяет масла, жиры, смолы, каучук, большинство органических алкалоидов и множество различных веществ. Лучше всего его назначать в виде духа эфира, который легко смешивается с водой.
Химические свойства и применение
Диэтиловый эфир (C4h20O) обычно используется в лаборатории в качестве растворителя. Он имеет ограниченную растворимость в воде (6,05 г/100 кубических сантиметров при 25 градусах Цельсия). Его высокая летучесть наряду с ограниченной растворимостью делает его идеальным для использования в качестве неполярного растворителя в жидкостно-жидкостной экстракции. Поскольку он имеет более низкую плотность по сравнению с водой, он образует слой на воде при смешивании с последней. В основном это стандартный растворитель для реакции Гриньяра в дополнение к альтернативным реакциям с участием металлоорганических реагентов.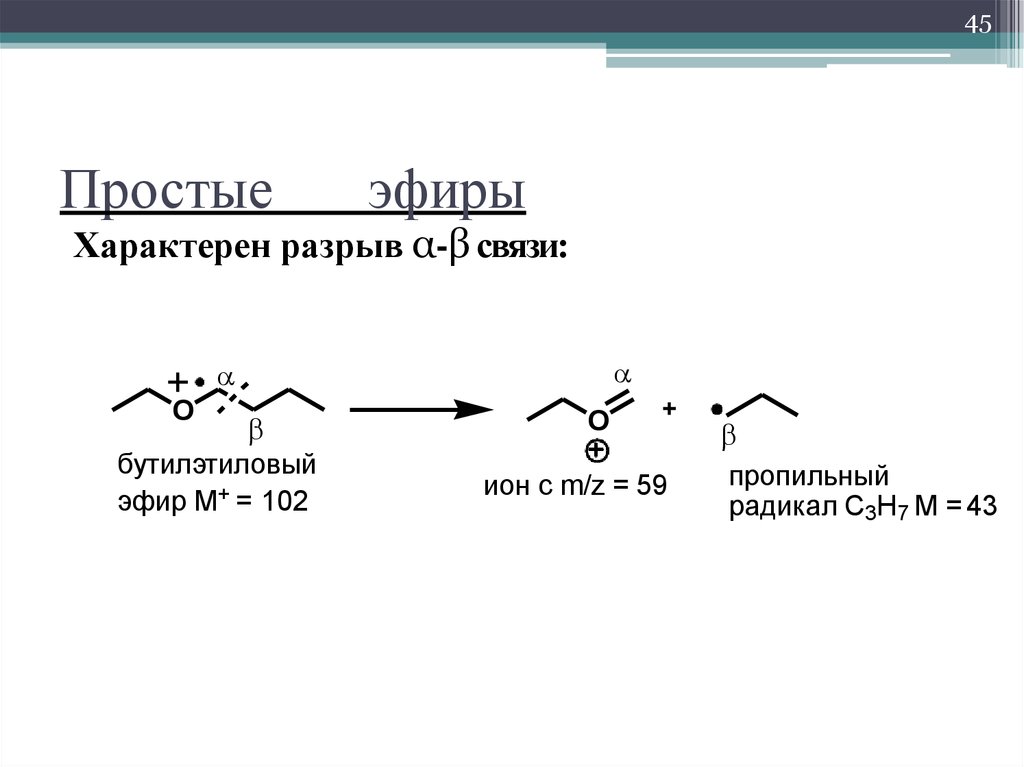 Из-за его применения в производстве незаконных веществ он внесен в список в соответствии с Конвенцией Организации Объединенных Наций о борьбе с незаконным оборотом наркотических средств и веществ, расширяющих сознание, кроме того, как вещества, такие как пропанон, толуол и серная кислота.
Из-за его применения в производстве незаконных веществ он внесен в список в соответствии с Конвенцией Организации Объединенных Наций о борьбе с незаконным оборотом наркотических средств и веществ, расширяющих сознание, кроме того, как вещества, такие как пропанон, толуол и серная кислота.
а) Обезболивающие: Даже в фармакологической медицине и медицине, особенно при использовании анестетиков, эфир играет важную роль. Метоксиметан, или иначе называемый противокашлевым средством, является хорошим болеутоляющим средством и основным ингредиентом морфина. Этиловый эфир (или просто эфир) был одним из первых анестетиков, используемых для хирургических процедур в 1800-х годах. Однако эфир легко воспламеняется, и его в основном заменили другими менее воспламеняющимися анестетиками, такими как закись азота и галотан. Эфир когда-то использовался в фармацевтических препаратах. Смесь спирта (ROH) и эфира (ROR), содержащая одну часть диэтилового эфира и три части этанола, была известна как «спирт эфира», болеутоляющее средство Хоффмана или капли Хоффмана. В Соединенных Штатах эта смесь была удалена из медицинских магазинов в какой-то момент, поскольку было обнаружено, что существуют различия в рецептуре, которые можно найти между предпринимателями, между международными фармацевтическими компаниями и оригинальным рецептом Хоффмана.
В Соединенных Штатах эта смесь была удалена из медицинских магазинов в какой-то момент, поскольку было обнаружено, что существуют различия в рецептуре, которые можно найти между предпринимателями, между международными фармацевтическими компаниями и оригинальным рецептом Хоффмана.
Сложный эфирный спирт или обезболивающее Хоффмана имеет специфический запах, которым он обязан эфирному маслу. По стилю он высоко ценится, острый и несколько сладковатый. Он должен полностью испаряться при нагревании и быть нерастворимым в кислой реакции; и при смешивании с водой должен иметь несколько молочный вид из-за отделения масла.
Действие болеутоляющего средства Гофмана чем-то похоже на действие эфира, но несколько модифицировано винным маслом, чтобы приблизить его к категории нервных стимуляторов. Эфир в малых дозах, недостаточных, чтобы воздействовать, в частности, на мозговые центры, на самом деле является нервным стимулятором; и, если бы он употреблялся только желудком, возможно, его можно было бы причислить к этой группе лекарств; потому что он редко дается таким образом из-за его наркотических эффектов.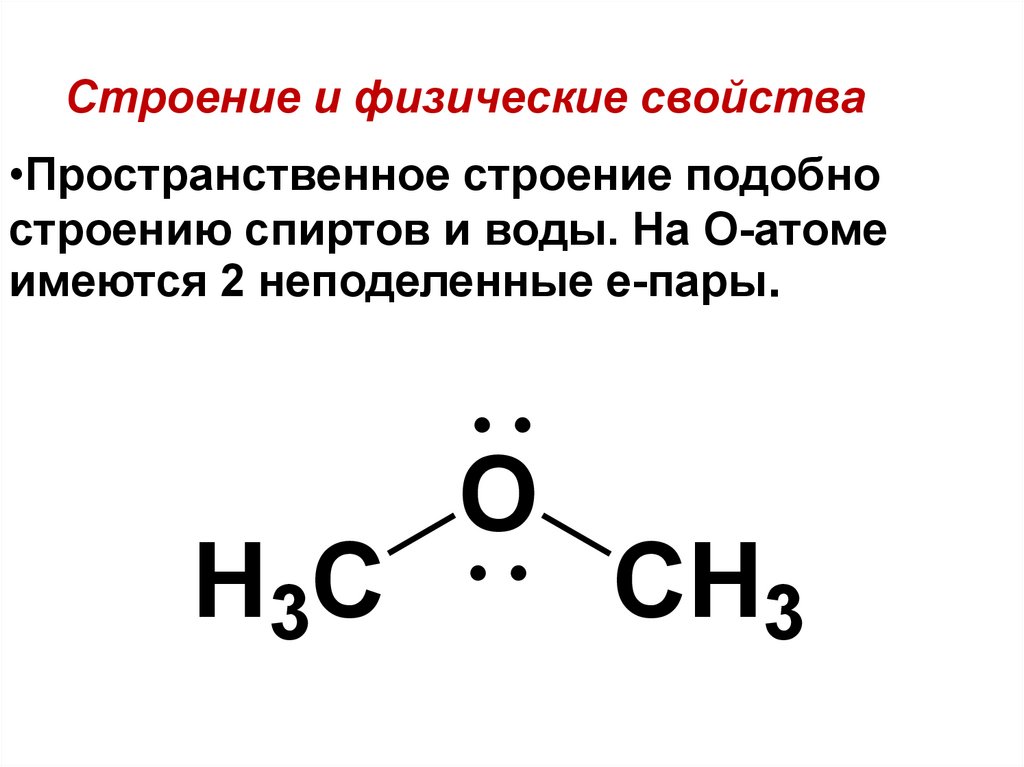 Но используемый, поскольку в настоящее время он вдыхается, очевидно, как церебральный стимулятор и, следовательно, близок по своим эффектам, как поэтому вводимый, с алкоголем и опиумом, он не мог быть надлежащим образом исключен из этой связи.
Но используемый, поскольку в настоящее время он вдыхается, очевидно, как церебральный стимулятор и, следовательно, близок по своим эффектам, как поэтому вводимый, с алкоголем и опиумом, он не мог быть надлежащим образом исключен из этой связи.
Анадин Гофмана используется для воздействия на нервную стимуляцию в ее многочисленных формах. Среди альтернативных эффектов — влияние на цикл сна, что приводит к увеличению продолжительности сна; таким образом, он действует на мозг окольным путем как наркотик, но лишь как общий стимулятор системы, уравновешивая ее действия и таким образом устраняя причину бодрствования. Судя по его общему названию, предполагается, что он обладает необычайной способностью облегчать боль. Если его давать в огромных количествах, он, возможно, мог бы вызвать этот эффект напрямую, как это делает пар эфира при вдыхании, делая мозговые центры нечувствительными к фрустрациям, сопровождающимся болью. Однако, как это обычно бывает, он действует не таким образом, а только успокаивая раздражение, от которого может зависеть боль; и, когда это выходит за рамки его сил, он сам не действует как болеутоляющее. Следовательно, в случае сильной боли это иногда приносит облегчение; при болях во время хирургической операции и при болях, зависящих от воспаления или даже при активном застое, редко или никогда в любой обычной дозе. Легкие спазматические состояния довольно часто уступают ему.
Следовательно, в случае сильной боли это иногда приносит облегчение; при болях во время хирургической операции и при болях, зависящих от воспаления или даже при активном застое, редко или никогда в любой обычной дозе. Легкие спазматические состояния довольно часто уступают ему.
Он широко используется при лихорадочных заболеваниях для успокоения беспокойства и общего недомогания, для устранения нервных подергиваний и вздрагиваний, которые часто встречаются у детей. При легких проявлениях истерии, обмороках, плохом настроении, учащенном сердцебиении и т. д., а также при аналогичных заболеваниях у мужчин болеутоляющее средство Гофмана часто является предпочтительным лекарством для врача, пока не достигается крайняя стадия, когда требуются более сильные лекарства. быть реализованы.
С помощью этого органического соединения также можно лечить метеоризм и желудочные расстройства.
Обычно это простое, быстрое и экономичное средство для лечения нервной головной боли.
Его можно было бы использовать в очень больших дозах для получения тех более сильных эффектов при спазматических заболеваниях, для которых назначается сам эфир; но пропорция алкоголя, который он содержит, всегда должна приниматься во внимание, прежде чем давать дозу пациентам.
Когда настойка опиума вызывает тошноту или головную боль, воздействие обычно можно предотвратить, дав вместе с ней болеутоляющее средство Гофмана.
Его умеренная доза иногда вызывает ужасно приятные эффекты при беспокойстве, в дозе от тридцати до шестидесяти капель. Его следует давать в стакане воды, подслащенной или нет, по желанию пациента. Доза также непрерывная каждый час или 2, если это необходимо. Его часто полезно сочетать с раствором сульфата морфия или другим препаратом опиума при заболеваниях, при которых показаны оба лекарства.
б) Для анестезии: Диэтиловый эфир в основном вытеснил использование хлороформа в качестве анестетика из-за дополнительного благоприятного терапевтического индекса эфира, то есть большего различия между эффективной дозой и потенциально токсичной дозой.
Диэтиловый эфир угнетает сердечную мышцу и увеличивает трахеобронхиальную секрецию. Ингаляционный анестетик, как правило, может даже смешиваться с различными анестезирующими агентами, такими как хлороформ, для образования смеси СЕ, или хлороформ и спирт для образования АСЭ. смесь, которая считается историческим анестетиком. Но в современной медицинской практике эфир используется редко. Использование горючего эфира было вытеснено негорючими анестетиками из фторорганических соединений. Галотан был первым разработанным таким анестетиком, а различные используемые в настоящее время ингаляционные анестетики, такие как ингаляционный анестетик, десфлуран и севофлуран, представляют собой галогенированные эфиры. Было обнаружено, что диэтиловый эфир имеет неблагоприятные побочные эффекты, такие как рвота и тошнота после анестезии. Современные анестетики уменьшают эти побочные эффекты.
смесь, которая считается историческим анестетиком. Но в современной медицинской практике эфир используется редко. Использование горючего эфира было вытеснено негорючими анестетиками из фторорганических соединений. Галотан был первым разработанным таким анестетиком, а различные используемые в настоящее время ингаляционные анестетики, такие как ингаляционный анестетик, десфлуран и севофлуран, представляют собой галогенированные эфиры. Было обнаружено, что диэтиловый эфир имеет неблагоприятные побочные эффекты, такие как рвота и тошнота после анестезии. Современные анестетики уменьшают эти побочные эффекты.
До 2005 года он обязательно входил в Список основных лекарственных средств Организации здравоохранения планеты для использования в качестве анестетика.
Эфир менее активен, но более безопасен, чем хлороформ, потому что он никогда не парализует здоровое сердце. Однако у него есть своя некрология, несколько смертей, несомненно, были вызваны им, помимо многих, которые произошли через несколько часов после его физиологического состояния. Эфир следует вдыхать в как можно более концентрированной форме, и тогда через 3–8 минут вы потеряете чувствительность. Если в области находится легкий груз, он должен быть намного выше пациента. Колосниковая печь или газовая плита по соседству чрезвычайно опасны.
Эфир следует вдыхать в как можно более концентрированной форме, и тогда через 3–8 минут вы потеряете чувствительность. Если в области находится легкий груз, он должен быть намного выше пациента. Колосниковая печь или газовая плита по соседству чрезвычайно опасны.
c) Использование в качестве терапевтического средства: При разбавлении алкоголем, как и в духе, эфир легко смешивается с водой и может приниматься внутрь при следующих состояниях: рыбьего жира.

Местная анестезия эфирным спреем — обеспечивает хорошее облегчение при повреждении поверхностных нервов, люмбаго, хорее, раздражении позвоночника, а также при небольших хирургических операциях. Это важный метод, но теперь вытесненный кокаином.
эфиров | Университет Эдинбурга
Эфир (диэтиловый эфир, этиловый эфир) является чрезвычайно распространенным растворителем, который обычно используется в различных количествах в лабораторных процедурах в университете.
Однако это вещество представляет чрезвычайную физическую опасность, осознание которой всегда должно быть приоритетом при планировании даже самых простых процедур, а использование наилучшей лабораторной практики всегда имеет первостепенное значение для обеспечения его безопасного использования.
Взрывопожароопасность
Из-за своей летучести и крайне низкой температуры воспламенения -40oC диэтиловый эфир представляет собой одну из самых опасных пожароопасных веществ, обычно встречающихся в лаборатории; он классифицируется в соответствии с Правилами Великобритании о химических веществах (Информация об опасности и упаковка для поставки) 2002 г. (CHIP) как чрезвычайно легковоспламеняющийся (F +) и ему присвоены следующие фразы безопасности ЕС :
(CHIP) как чрезвычайно легковоспламеняющийся (F +) и ему присвоены следующие фразы безопасности ЕС :
- S9 Хранить контейнер в хорошо проветриваемом месте
- S16 Хранить вдали от источников воспламенения
- S29 Не сливать в канализацию
- S33 Примите меры предосторожности против статических разрядов
и следующие ЕС фразы риска:
- R12 Легко воспламеняется
- R19 Может образовывать взрывоопасные оксиды
- R22 Вреден при проглатывании
- R66 Многократное воздействие может вызвать сухость или растрескивание кожи
- R67 Пары могут вызывать сонливость и головокружение
Эфиру не требуется источник воспламенения, такой как открытое пламя или искра, чтобы инициировать горение.
Пары эфира могут воспламениться от горячих поверхностей, таких как плиты, паровые трубы, электрические лампы и разряды статического электричества, и, поскольку пары тяжелее воздуха, они могут перемещаться на значительное расстояние до источника воспламенения и возвращаться обратно. Когда большое количество эфира переливается из одного сосуда в другой, может накопиться статическое электричество, достаточное для инициирования мгновенного воспламенения. Пары эфира образуют с воздухом взрывоопасные смеси при концентрациях от 1,9% до 36% (по объему). Для тушения эфирных пожаров следует использовать углекислотные или сухие порошковые огнетушители. Эфиры поглощают и реагируют с кислородом воздуха в присутствии света, образуя нестабильные пероксиды, которые могут детонировать с чрезвычайной силой, когда они концентрируются в результате испарения или перегонки и разрушаются под воздействием тепла, удара или трения.
Когда большое количество эфира переливается из одного сосуда в другой, может накопиться статическое электричество, достаточное для инициирования мгновенного воспламенения. Пары эфира образуют с воздухом взрывоопасные смеси при концентрациях от 1,9% до 36% (по объему). Для тушения эфирных пожаров следует использовать углекислотные или сухие порошковые огнетушители. Эфиры поглощают и реагируют с кислородом воздуха в присутствии света, образуя нестабильные пероксиды, которые могут детонировать с чрезвычайной силой, когда они концентрируются в результате испарения или перегонки и разрушаются под воздействием тепла, удара или трения.
Токсичность
Острый: вреден при вдыхании в высоких концентрациях, которые могут вызвать опьянение, седативный эффект, потерю сознания и паралич дыхания. Диэтиловый эфир раздражает глаза, органы дыхания и кожу, но эти эффекты обычно обратимы при устранении воздействия. Частично, возможно, из-за высокой летучести жидкость не легко впитывается через кожу, однако повторный контакт может удалить натуральные масла с кожи и вызвать сухость, растрескивание кожи и другие кожные заболевания.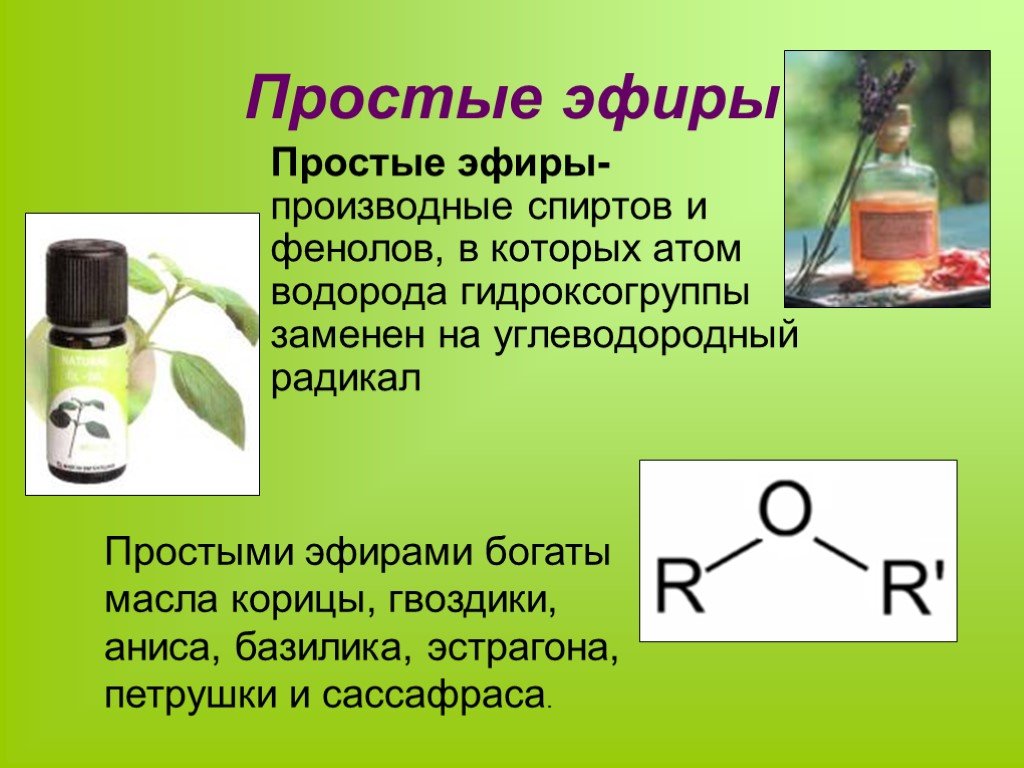
Хронический: нет данных о канцерогенных или тератогенных эффектах, связанных с использованием диэтилового эфира. Однако известно, что хроническое воздействие паров может привести к истощению, сонливости, головокружению и другим расстройствам центральной нервной системы, а также к потере аппетита.
Обработка и контроль воздействия
Диэтиловый эфир (этиловый эфир, простой эфир) должен обрабатываться в лаборатории с использованием только передовых методов, которые дополняются дополнительными мерами предосторожности при использовании легковоспламеняющихся веществ.
Хранение
Эфиры следует хранить в плотно закрытых емкостях в правильно маркированных огнестойких металлических шкафах или баках, а также на поддонах. Они должны храниться отдельно от окислителей. Контейнеры с растворителями, такими как эфиры, должны быть возвращены в хранилище как можно скорее после использования, и вам следует напомнить о требовании Части 5 (3. 9) Политики Университета по охране труда и технике безопасности «Чтобы свести к минимуму риск серьезного лабораторного пожара, максимальное количество легковоспламеняющихся реагентов и растворителей и т. д., хранящихся в одной лаборатории, не должно превышать пятидесяти литров». Объемы свыше пятидесяти литров должны храниться в правильно сконструированном и обвалованном складе легковоспламеняющихся веществ.
9) Политики Университета по охране труда и технике безопасности «Чтобы свести к минимуму риск серьезного лабораторного пожара, максимальное количество легковоспламеняющихся реагентов и растворителей и т. д., хранящихся в одной лаборатории, не должно превышать пятидесяти литров». Объемы свыше пятидесяти литров должны храниться в правильно сконструированном и обвалованном складе легковоспламеняющихся веществ.
Разлив
Из-за его чрезвычайно легковоспламеняющейся природы при разливе эфира необходимо соблюдать особую осторожность. Все источники воспламенения должны быть удалены и подняты как можно быстрее с помощью фирменной подушки для разлива, абсорбирующего мата или инертного материала, такого как песок (никогда не используйте опилки). Материал, содержащий абсорбированный эфир, следует поместить в подходящий герметичный контейнер и утилизировать разрешенными способами. Проливание больших количеств или в маленьком помещении может привести к опасности при вдыхании; в этом случае следует связаться с группой реагирования на разливы вашей школы, чтобы устранить разлив с помощью полнолицевых респираторов, оснащенных фильтрами органических паров.

 Например, печально известный диоксин (2,3,7,8-тетрахлордибензо-п-диоксин).
Например, печально известный диоксин (2,3,7,8-тетрахлордибензо-п-диоксин).