Получение диметилового эфира дегидратацией метанола на Аlpo4 sio2 катализаторах. Получить из метанола диметиловый эфир
Получение диметилового эфира дегидратацией метанола на АlPO4 +SiO2 катализаторах
7. Физико-химические показатели и свойства ДМЭ
Физико-химические показатели ДМЭ [3]
Результаты выполненных исследований различных аспектов применения ДМЭ в качестве альтернативного моторного топлива для дизелей дают основания для следующих выводов.
1. ДМЭ обладает целым рядом преимуществ по сравнению с другими альтернативными топливами и даже дизельным топливом по следующим показателям:
Химическим:
- отсутствием валентных углеродно-углеродных связей, что понижает склонность к сажеобразованию при горении,
- содержанием порядка 35% связанного кислорода, что практически полностью устраняет дымность выпускных газов,
- хорошей самовоспламеняемость в условиях цилиндра дизеля (цетановое число ЦЧ=55=60 по сравнению с ЦЧ=45-50 для дизельного топлива, не говоря уж об альтернативных топливах типа метанола и этанола, а также природных газах, имеющих плохую воспламеняемость), что делает его идеальным в качестве моторного топлива дизелей:
Физическим:
- хорошей испаряемостью, что приводит к быстрой газификации впрыскиваемых в цилиндры топливных струй, способствуя совершенствованию процесса смесеобразования и улучшению экономичности при понижении требуемого уровня давлений впрыскивания и, следовательно, повышению надежности работы топливовпрыскивающей аппаратуры и снижению ее уровня шума.
2. Результаты моторных испытаний дизелей на ДМЭ показали возможность значительного улучшения следующих характеристик:
Экологическим:
- снижение уровня выброса вредных выбросов с выпускными газами по окислам азота- в 3-4 раза при практически бездымном выхлопе на всех режимах работы;
- ДМЭ является экологически чистым продуктом, не наносящим никакого вреда окружающей среде.
Экономическим:
- сохранение или даже улучшение (до 5%) экономичности дизеля по сравнению с работой на дизельном топливе.
Эксплуатационным:
- снижение динамики цикла и давлений сгорания, что повышает надежность работы двигателей и снижает шумность на 10 дБ(А), открывая возможность конвертирование в дизели, работающие на ДМЭ, обычных карбюраторных двигателей, а также возрождения с улучшением экологических характеристик широко распространенных, например, в дорожно-строительных машинах безнаддувных дизелей.
3. Конвертирование обычных дизелей для работы на ДМЭ состоит только в модернизации их топливоподающей аппаратуры, направленной на увеличение объемной подачи топлива и уплотнения линии низкого давления для приспособления ее к работе на повышенных порядка 10-20 бар давлениях, а также в замене топливных баков на баллоны низкого давления, используемые для работы с сжиженными природными газами.
К недостаткам следует отнести пониженную вязкость ДМЭ по сравнению с дизельным топливом, что может потребовать доводки топливоподающей аппаратуры для обеспечения ее противозадирных качеств и повышения долговечности.
4. Существуют отработанный (через получение метанола), а также более эффективный новый (через получение синтез-газа) технологические способы массового производства ДМЭ на базе природного газа. ДМЭ может также производиться на базе каменного угля, углеродосодержащих продуктов (битумов), а также биомассы, что позволяет считать его возобновляемым видом топлива.
5. Технико-экономический анализ применения диметилового эфира в качестве альтернативного моторного топлива для дизелей свидетельствует о возможности сбыта его по ценам, приблизительно равным ценам на дизельное топливо.
6. Из описанных результатов исследования можно заключить, что диметиловый эфир по своим физико-химическим показателям и данным моторных испытаний может стать в XXI-м веке основным видом моторного топлива во всем мире, над внедрением которого в настоящее время интенсивно работают многие ведущие фирмы и государственные организации за рубежом.[22,23-24]
По существу, речь, по-видимому, может идти о глобальной отработке новой прогрессивной технологии преобразования природного газа (и других видов сырья), обеспечивающего только умеренный экологический эффект, в идеальное моторное топлива, отвечающее всем самым жестким экологическим и экономическим нормам наступающего века.
Результаты проведенных исследований свидетельствуют, что по целому ряду экологических, эксплуатационных и технико-экономических показателей диметиловый эфир может стать в 21-м веке одним из основных видов моторного топлива для дизелей во всем мире, что дает основание рекомендовать всемерную поддержку и развитие соответствующих НИОКР, которые должны способствовать ускорению массового внедрения в нашей стране диметилового эфира в качестве альтернативного моторного топлива.
Одним из самых важных положительных факторов использования ДМЭ в качестве моторного топлива является отсутствие необходимости строительства специальных АЗС. Так как по своим физико-химическим свойствам (за исключением цетанового числа) ДМЭ аналогичен пропан-бутану для заправки автомобильного транспорта ДМЭ можно использовать существующие АГНС.
В этом случае АГНС становится двухтопливной заправкой (пропан-бутана и ДМЭ), по аналогии с действующими АЗС (бензин + дизельное топливо).
8. Транспортировка ДМЭ, разгрузка, хранение
Диметиловый эфир физически сходен с LPG. Свойства ДМЭ сходны со свойствами пропана и бутана, двух основных компонентов LPG. Для морских перевозок могут использоваться обычные LPG танкеры. Разгрузка и хранение ДМЭ может производиться оборудованием, похожим на оборудование для LPG.
Устройства для разгрузки ДМЭ должны быть спроектированы с расчетом на танкеры с тоннажем от 35000 до 78000 м3 .ДМЭ разгружают при температуре -25°С.
Хранилища ДМЭ должны быть снабжены системой пожаротушения, включающей в себя емкости с водой. Также должна быть техническая вода, азот и резервный генератор энергии [25].
9. Производство ДМЭ из метанола
Пошел второй год, как на новомосковском "Азоте" работает единственная на территории СНГ действующая установка для получения диметилового эфира из метанола сырца. Диметиловый эфир, ценный хладагент, заменитель фреонов и дизельных топлив, является вторичным продуктом аммиачного производства.
Аммиак на Новомосковском химическом комбинате производили со дня основания предприятия - с 1933 года. Первоначально его получали из древесины. По мере разрастания предприятия были введены в эксплуатацию три новых цеха комплекса "Аммиак", с технологией получения аммиака из природного газа. Соответственно, получать аммиак из древесины стало не рентабельно. Буквально в то же время возрос спрос на метанол. На "Азоте" к тому моменту был только один цех получения метанола - "М-100", и руководство предприятия приняло решения перепрофилировать "старое" производство аммиака на производство метанола, назвав его - "Производство аммиака и метанола" (ПАМ).
В январе 1981 года на ПАМе был получен первый метанол. Поскольку страна остро нуждалась в этом продукте, средняя выработка тогда составляла ни много ни мало, 20 т/ч. Но в 1991 году спрос упал, и средняя выработка резко упала - до 10-15 т/ч.
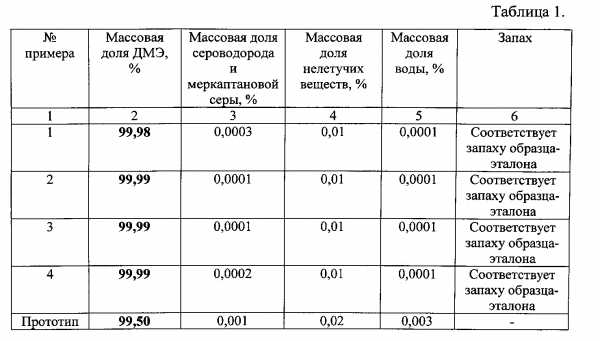
Состав метанола-сырца, вырабатываемого на ПАМе, приведён в табл. 1 (курсивом выделены полезные составляющие метанола).
Вырабатываемый метанол передают в "М-100", где ректификат отправляют потребителю, а эфиры отдуваются и сжигаются. Ввиду того, что из всех полезных составляющих только диметиловый эфир (ДМЭ) содержится в количестве, достаточном для выделения, было принято решение организовать производство по получению ДМЭ из метанола-сырца.
И в апреле 2001 года, полтора года назад, в цехе "Синтез" ПАМ была смонтирована ректификационная колонна получения диметилового эфира из метанола-сырца.
В Новомосковске находится единственная в СНГ функционирующая установка получения диметилового эфира. Ещё две находятся в Новгороде и в Северодонецке, но они в данный момент не работают.
ДМЭ является родоначальником класса простых алифатических эфиров. Быстро деградирует в атмосфере и поэтому может применяться как хладагент - заменитель фреонов. На международном Конгрессе-выставке в г. Детройте, прошедшем весной 1995 г., ДМЭ фигурировал под названием "дизельное топливо ХХI". Хотя по энергоёмкости ДМЭ в 1,5 раза уступает традиционному дизельному топливу, по основным показателям его превосходство несомненно: цетановое число - 55-60 ед., температура воспламенения Т=235 °С.
Главное же преимущество ДМЭ как дизельного топлива - экологически чистый выхлоп. Японские исследователи показали, что при крупных масштабах производства применение ДМЭ в качестве топлива для газотурбинных установок более экономично, чем сжиженного газа. Учитывая "веяние времени", установку оснастили АСУТП на базе двухкаркасного программируемого логического контроллера "multiTREI%5B". В состав АСУТП входит несколько устройств (см. рис. 1).
АСУТП - это железо + программа. Без АСУТП установка работать не может. Конструктивно контроллер представляет собой настенный шкаф во взрывозащищённом исполнении. Технически контроллер состоит из двух процессоров (мастермодулей), модулей УСО, двух концентраторов сети (хабов). Два мастер-модуля используются для повышения надежности системы. Один мастер-модуль всегда является рабочим, а второй с частотою примерно 10 Гц считывает с рабочего всю информацию (большая частота при этом никак не влияет на стабильность системы). Переключение с основного на резервный модуль происходит автоматически при отсутствии отклика от основного в течение 1,6 сек.
mirznanii.com
СПОСОБ ПОЛУЧЕНИЯ ДИМЕТИЛОВОГО ЭФИРА ИЗ МЕТАНОЛА
Область техники
Данное изобретение относится к химической промышленности, конкретно к области получения диметилового эфира (ДМЭ), применяемого в качестве хладагента и газа вытеснителя аэрозольных упаковок.
Качество очистки газа вытеснителя определяет его использование в тех отраслях, где очень высоки требования к газу по содержанию меркаптанов и влаги (парфюмерно-косметическая продукция, медицинские аэрозоли, производство автокосметики, монтажной пены, лакокрасочной продукции).
Уровень техники
Известно достаточно много процессов, в которых ДМЭ получают дегидратацией метанола с использованием различных катализаторов.
Согласно патенту [1] [патент RU 2459799, С2, дата публикации 27.08.2012 г.] в качестве катализаторов могут использоваться молекулярные сита цеолитного и/или нецеолитного типов. В качестве молекулярных сит используются одно или несколько сит, с FAU структурой, выбранных из группы, состоящей из цеолитов Y-типа, которые имеют большие поры. Молекулярное сито нецеолитного типа может быть силикоалюмофосфатным.
К недостаткам указанного способа следует отнести высокую склонность к косообразованию катализаторов при температуре реакции.
В патенте [2] [патент RU 2282613, С2, дата публикации 27.08.2006 г.] дегидратацию метанола проводят в присутствии сульфоионитного катализатора при повышенной температуре и давлении в совмещенном реакционно-ректификационном аппарате.
Наиболее близким по своей технической сущности и достигаемому техническому результату является изобретение «Способ получения диметилового эфира» [3], [патент RU №2256645, С2, дата публикации 20.07.2005 г.]. Согласно данному изобретению метанолсодержащий поток контактирует с дегидратирующим катализатором в одной или нескольких реакционных зонах. Компоненты реакционной смеси с помощью дистилляции и/или ректификации разделяют с возвращением непрореагировавшего метанола в реакционную зону. Дегидратацию метанола и образование эфира проводят в жидком и/или парожидкостном состоянии в присутствии кислого катионита при температуре 100-460°C и поддерживают концентрацию воды в возвращаемом реакционную зону метанольном потоке менее 12% масс, предпочтительно менее 5% масс.
Основными недостатками прототипа являются:
- применение двухреакторной схемы для дегидратации;
- применение водной отмывки выделенного потока диметилового эфира от метанола и подача воднометанольной смеси в зону ректификации от воды;
- применение реакционно-ректификационного аппарата приведет к усложнению технологической схемы.
Задача предлагаемого способа заключается в создании экологически чистой технологии получения ДМЭ дегидратацией метанола на молекулярном сите цеолитного типа, которая позволит получить продукцию необходимого качества для использования ее в качестве газа вытеснителя аэрозольных упаковок и значительно снизить эксплуатационные и капитальные затраты на реализацию и проведение процесса.
Раскрытие изобретения
Поставленная задача достигается тем, что в способе получения диметилового эфира из метанола, путем его контактирования с дегидратирующим катализатором в реакционной зоне и разделении компонентов реакционной смеси с помощью ректификации с возвращением непрореагировавшего метанола в реакционную зону, при котором дегидратацию метанола проводят в присутствии катализатора при повышенной температуре, в отличие от прототипа, в качестве катализатора применяют молекулярные сита цеолитного типа с крупными порами, выбранные из группы, состоящей из цеолитов структуры FAU, являющихся цеолитами типа X и их модификациями, дегидратацию осуществляют в газообразном состоянии при температуре в реакционной зоне 280÷380°C и давлении 17÷22 атм, в первой ректификационной колонне отгоняют от воды фракцию, состоящую из метанола и диметилового эфира, во второй ректификационной колонне отгоняют от непрореагировавшего метанола диметиловый эфир и возвращают метанол в реакционную зону. Предлагаемый способ получения диметилового эфира осуществляется на установке, которая представлена на чертеже, где приведена принципиальная схема установки.
Для получения ДМЭ используют метанол концентрации не менее 99,5%, массовая доля серы не более 0,0001%, массовая доля воды не более 0,05%, массовая доля альдегидов и кетонов не более 0,003%.
Согласно схемы установки на чертеже метанол поступает по линии 1. Его смешивают с рециркулируемым метанольным потоком 11, поступающим из куба колонны 14, подогревают в теплообменнике до температуры 300-350°C и по лини 2 направляют в реакционную зону реактора 12, содержащую цеолит типа X. Из реакционной зоны реактора 12 по линии 3 выводят реакционную смесь, которую подают в отгонную зону колонны 13 по линии 3. Отгонная зона колонны 13 представляет собой ректификационную колонну.
Сверху ректификационной колонны 13 по линии 5 выводят паровой поток, содержащий преимущественно ДМЭ и метанол. Далее поток охлаждается в конденсаторе дефлегматоре и поступает в колонну 14 по линии 7. Часть сконденсированного потока по линии 6 возвращают в колонну 13 в виде флегмы. Снизу колонны 13 по линии 4 выводят поток, содержащий преимущественно воду. Ректификационная колонна 14 предназначена для разделения ДМЭ от метанола. Сверху ректификационной колонны 14 по линии 8 выводят паровой поток, содержащий ДМЭ. Далее поток охлаждается в конденсаторе дефлегматоре и поступает по линии 10 на склад. Часть сконденсированного потока по линии 9 возвращают в колонну 14 в виде флегмы. Снизу колонны 14 по линии 11 выводят поток, содержащий преимущественно метанол.
Примеры 1-4 показывают реализацию настоящего изобретения по способу получения диметилового эфира, путем контактирования его с дегидратирующими катализаторами с использованием различных вариантов загрузки в реакционную зону молекулярных сит цеолитного типа с крупными порами, выбранных из группы, состоящей из цеолитов структуры FAU, являющихся цеолитами типа X.
Пример 1. Данный пример иллюстрирует реализацию по способу получения диметилового эфира с применением в качестве катализатора молекулярного сита цеолитного типа с крупными порами, выбранного из группы, состоящей из цеолитов структуры FAU, являющееся цеолитом NaX.
Способ получения ДМЭ реализован на установке см.чертеж.
Согласно схемы установки на чертеже метанол в количестве 463,3 кг/ч поступает по линии 1. Его смешивают с рециркулируемым метанольным потоком 11, поступающим из куба колонны 14, подогревают в теплообменнике преимущественно до температуры 310°C и по лини 2 направляют в реакционную зону реактора 12, содержащую цеолит типа NaX, размер гранул 1,8÷2,2 мм, в количестве 0,5 м3. Реактор представляет собой аппарат адиабатического типа. Реакция дегидратации осуществляется при температуре 300°C и давлении 2,0 МПа. Конверсия метанола за проход 90%. Из реакционной зоны по линии 3 выводят реакционную смесь. Реакционную смесь из реактора 12 в количестве 1000 кг/ч подают в ректификационную колонну 13 по линии 3. Поток 3 содержит 32,31% ДМЭ; 53,67% метанола и 14,02% воды. Процесс ректификации осуществляют при абсолютном давлении в кубе колонны 13 равном 0,37 МПа, верха колонны 13 равном 0,32 МПа. Температуры: куба - 140°C; тарелки питания - 55°C; верха - 40°C.
Сверху ректификационной колонны 13 по линии 5 выводят паровой поток, содержащий ДМЭ и метанол. Далее поток охлаждается в конденсаторе дефлегматоре и поступает в колонну 14, по линии 7 выводится 859,8 кг/ч продукта, содержащего 37,60% ДМЭ и 62,40% метанола. Часть сконденсированного потока по линии 6 возвращают в колонну 13 в виде флегмы. Снизу колонны 13 по линии 4 выводится поток, содержащий преимущественно воду в количестве 140,2 кг/ч. Ректификационная колонна 14 предназначена для разделения ДМЭ от метанола. Сверху ректификационной колонны 14 по линии 8 выводится паровой поток, содержащий ДМЭ. Далее поток охлаждается в конденсаторе дефлегматоре и поступает по линии 10 на склад в количестве 323,1 кг/ч. Часть сконденсированного потока по линии 9 возвращается в колонну 14 в виде флегмы. Снизу колонну 14 по линии 11 выводится поток, содержащий преимущественно метанол в количестве 536,7 кг/ч.
Пример 2. Данный пример иллюстрирует реализацию по способу получения диметилового эфира аналогично примеру 1, отличающемуся тем, что в качестве катализатора применяют молекулярное сито цеолитного типа с крупными порами, выбранное из группы, состоящей из цеолитов структуры FAU, являющееся цеолитом НХ.
Пример 3. Данный пример иллюстрирует реализацию по способу получения диметилового эфира аналогично примеру 1, отличающийся тем, что в качестве катализатора применяют молекулярное сито цеолитного типа с крупными порами, выбранное из группы, состоящей из цеолитов структуры FAU, являющихся цеолитом LiX.
Пример 4. Данный пример иллюстрирует реализацию по способу получения диметилового эфира аналогично примеру 1, отличающемуся тем, что в качестве катализатора применяют молекулярное сито цеолитного типа с крупными порами, выбранное из группы, состоящей из цеолитов структуры FAU, являющихся цеолитом HLiX.
Показатели качества полученных диметиловых эфиров приведены в таблице 1.
Достигаемый технический результат
Преимуществом заявляемой установки перед прототипом являются:
- получение ДМЭ высокой концентрации 99,99% и выше без постороннего запаха, что позволит его использовать в качестве газа вытеснителя аэрозольных упаковок;
- получение ДМЭ высокого качества с низким содержанием воды до 0,0001%;
- получение ДМЭ с низким содержанием сернистых соединений до 0,0001%;
- предложен катализатор дегидратации метанола в виде молекулярных сит цеолитного типа с крупными порами, выбранных из группы, состоящей из цеолитов структуры FAU, являющихся цеолитами типа X и их модификациями, который позволил увеличить конверсию ДМЭ до 90% и выше.
Способ получения диметилового эфира из метанола, путем его контактирования с дегидратирующим катализатором в реакционной зоне и разделении компонентов реакционной смеси с помощью ректификации с возвращением непрореагировавшего метанола в реакционную зону, при котором дегидратацию метанола и образование эфира проводят в присутствии катализатора при повышенной температуре, отличающийся тем, что в качестве катализатора применяют молекулярные сита цеолитного типа с крупными порами, выбранные из группы, состоящей из цеолитов структуры FAU, являющихся цеолитами типа X и их модификациями, дегидратацию осуществляют в газообразном состоянии при температуре в реакционной зоне 280÷330°C и давлении 17÷22 атм, в первой ректификационной колонне отгоняют от воды фракцию, состоящую из метанола и диметилового эфира, во второй ректификационной колонне отгоняют от непрореагировавшего метанола диметиловый эфир и возвращают метанол в реакционную зону.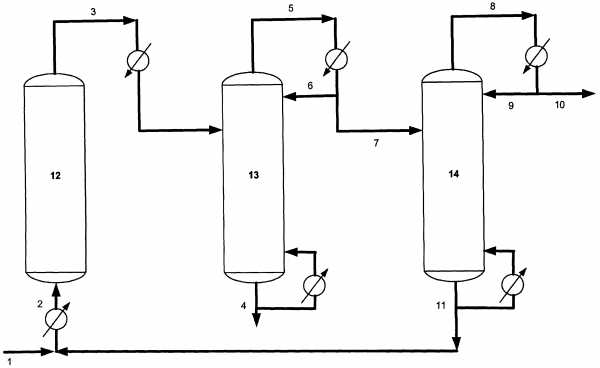
edrid.ru
Получение диметилового эфира дегидратацией метанола на Аlpo4 sio2 катализаторах
1. Сырье для топлива
Основным сырьем для производства топлива является нефть. Качество топлива зависит от исходного сырья и от технологии переработки.
Состав топлива должен быть подобран так, чтобы оно обладало свойствами, которые обеспечивают легкий запуск двигателя, полное сгорание, максимальное использование энергии топлива, отсутствие чрезмерного износа отдельных элементов двигателя, стабильность в ходе хранения. Критериями оценки качества топлива в общем случае являются следующие физико-химические параметры: цетановые или октановое число, фракционный состав, вязкость, содержание серы, остаток после коксования, остаток после озоления, температура воспламенения, кислотность, низкотемпературные свойства, содержание воды и механических загрязнений, а часто также плотность и теплотворная способность[2].
Главной проблемой применения дизельных топлив является эмиссия оксидов азота и специфических веществ, в первую очередь сажи. Эмиссия оксидов азота особенно не желательна. Она приводит к выпадению кислотных дождей, образованию приземного слоя озона в городских зонах и истощению озонового слоя атмосферы.
По содержанию оксидов азота, монооксида углерода, углеводородов и сажи в выхлопных двигателей внутреннего сгорания предъявляются жесткие требования. К настоящему времени технологически оформлено и запущено в промышленном варианте производство таких альтернативных топлив, выгодно отличающихся с экологической точки зрения от современного топлива, как метанол, этанол, сжиженный газ, синтетическое жидкое топливо на основе метанола, диметиловый эфир [3].
2. Получение метанола
Метанол является одним из важнейших по значению и масштабам производства органическим продуктом, выпускаемым химической промышленностью. Способы его получения могут быть различны: сухая перегонка древесины, каталитическое неполное окисление метана, каталитическое гидрирование моно- и диоксида углерода, термическое разложение формиатов, гидрирование метилформиата, омыление метилхлорида и др.
До промышленного освоения каталитического способа метанол получали основном сухой перегонкой древесины, в настоящее время этот метод практически не имеет промышленного значения. По причинам технического и, главным образом, экономического характера промышленное развитие получил метод синтеза метанола из монооксида углерода и водорода. Этот метод, с применением оксидов металлов или металлических катализаторов, известен давно, с начала двадцатых годов. При этом довольно быстро стало известно, что в катализаторе не должно присутствовать железо, поскольку образование углеродных отложений дезактивирует катализатор и приводит к образованию метана вместо метанола [4].
С первых лет промышленного производства и приблизительно до конца 1950-х годов лучшим катализатором считался цинк-хромовый. Реакцию проводили при давлении 250-300 атм. и температуре 300-400 С. Ещё давно отмечалось, что медьсодержащие катализаторы позволяют проводить синтез при значительно более низких давлении и температуре, однако медные катализаторы чрезвычайно чувствительны к примесям серы в исходных газах. Так, например цинк- хромовый катализатор ещё может работать при содержании сероводорода до 3.10-3 %, тогда как для медьсодержащих катализаторов содержание сероводорода должно быть менее 1.10-4%. Настоящий успех в синтезе с использованием медьсодержащих катализаторов был обусловлен существенным улучшением процесса очистки синтез-газа. Современные методы очистки позволяют уменьшить содержание сероводорода до 1.10-5%, что гарантирует срок службы катализатора более трёх лет.
Для получения оптимальных результатов медьсодержащий катализатор требует присутствия в исходной газовой смеси около 2% СО2 [5]. Было установлено, что активным центром катализатора является одновалентная медь Сu(1) [6]. При концентрациях СО2 меньше 2% катализатор дезактивируется вследствие дальнейшего восстановления, а при более высоких концентрациях CO2 адсорбируется, что затрудняет синтез. С точки зрения энергетических затрат предпочтительнее проводить синтез с использованием Cu/Zn-катализатора при низком давлении (50-100 атм.) и температуре 220-270оС. Однако высокое давление требуется в тех случаях, когда газ загрязнён серой или другими примесями [6]. Суммарная реакция получения метанола сильно экзотермична (-90.8кДж/моль):
СО+2Н2=СН3ОН (1)
Максимум конверсии ограничен положением равновесия, которое определяется температурой. Проводить процесс при относительно низких температурах, предпочтительных с точки зрения равновесной конверсии, можно только с использованием высокоактивного медьцинкового катализатора.
Ещё одной каталитической системой для производства метанола из синтез-газа являются гомогенные кобальтовые или родиевые катализаторы. Однако, хотя эти контакты широко исследуются, по-видимому, в ближайшем будущем они не приобретут промышленного значения в основном вследствие того, что полученный метанол всегда содержит сопутствующие продукты, такие как метилформиат и гликолевый альдегид, а также продукты их вторичных превращений. В отличие от них гетерогенные катализаторы, напротив, высокоселективны.
Тем не менее, для выяснения механизма реакции синтеза метанола представляют интерес и гомогенные катализаторы и катализаторы на основе благородных металлов, хотя они и неконкурентоспособны со стойким к отравлению ZnO/Cr2O3 и высокоактивным CuO/ZnO катализаторами.
3. Использование метанола
На основании лабораторных и дорожных испытаний было установлено, что метанол представляет собой перспективное «чисто» сгорающее автомобильное топливо. При работе на метаноле возникают небольшие проблемы, которые могут быть легко преодолены. Ряд автомобилей, производимых фирмой «Фольксваген» был переведен на метанол, На основании испытаний установлено, что при работе на метаноле достигалась большая мощность вследствие более высокой скрытой теплоты испарения метанола, что позволяло охлаждать горючую смесь в большей степени, чем при испарении бензина. Благодаря этому можно увеличить плотность топливно-воздушной смеси, а, следовательно, и массовый расход. Выигрыш в мощности при работе на метаноле достигает примерно 10 % [7].
При эксплуатации автомобиля на метаноле возникает необходимость в использовании вспомогательного устройства для холодного запуска, если окружающая температура ниже 8°С, однако дальнейшие испытания автомобилей на метаноле показали приемлемую способность к движению при низких температурах.
Топливная экономичность определялась наряду с анализом отработавших газов, а также исследованием способности автомобилей на метаноле к движению и определением удельного расхода топлива. В связи с тем, что энергоемкость метанола меньше чем у бензина, при работе на нем удельный расход топлива значительно больший, чем при работе на бензине. Это означает, что метанол сгорает более эффективно, чем бензин.
Эксплуатация двигателей на метаноле дает возможность снизить содержание загрязнений в отработавших газах, а, следовательно, и загрязнение окружающего воздуха. Содержание монооксида углерода в отработавших газах при работе на метаноле примерно такое же, как и при работе на бензине, но опыты на автомобилях фирмы «Фольксваген» показали возможность снижения содержания СО в отработавших газах после метанола особенно при малой частоте вращения двигателя [7].
На метаноле удаётся значительно снизить в отработавших газах содержание окислов азота (NOX). Кроме того, в отработавших газах наблюдалась значительно меньшее содержание и несгоревших углеводородов. В выхлопах автомобилей было обнаружено всего около 10% данных загрязнителей. Таким образом, метанол как автомобильное топливо с экологической точки зрения по содержанию в отработавших газах СН вполне приемлем.
Содержание альдегидов в отработавших газах при одинаковых степенях сжатия двигателя, работающего на метаноле, значительно выше, чем на бензине. Однако содержание альдегидов может быть снижено путём увеличения степени сжатия двигателя и ограничением процесса горения путем добавления к метанолу до 10% воды.
Содержание в отработавших газах полициклических ароматических углеводородов, в том числе канцерогенных, при работе на метаноле более чем на порядок меньше, чем на бензине.
Спиртовые топлива целесообразно использовать главным образом в двигателях с искровым зажиганием. Организация работы дизеля на данном виде топлива затруднительна из-за низкого значения цетанового числа ( на уровне 10) [8].
Наиболее выгодно использовать смесь бензина с 4,75% метанола и таким же количеством сольвента, необходимого для предотвращения фазового разделения смеси в присутствии воды, в которой метанол хорошо растворим [9].
Отличная детонационная стойкость метанола дает возможность увеличить степень сжатия двигателя до 14 против 10 для бензина. При этом достигается улучшение расхода топлива и коэффициента полезного действия, а также снижение содержания в отработавших газах NOX и альдегидов.
Таким образом, спиртовые топлива превосходят бензиновые с точки зрения экологической безопасности и до настоящего времени не получили распространения лишь из-за двух основных причин: более высокой стоимости спиртов по сравнению с бензином и отсутствием технических или экономических преимуществ, компенсирующих эту высокую стоимость. К тому же метанол сильно ядовит.
Что касается дизельных двигателей, то в них можно использовать продукт разложения метанола – ДМЭ.
4. Получение диметилового эфира дегидратацией метанола
Дегидратация метанола с получением диметилового эфира-исторически первый путь проведения данного синтеза. Этому процессу ещё с 1960-х годов было посвящено множество работ советских и зарубежных учёных [10, 13 - 16]. Реакция дегидратации метанола на -АL2О3 широко использовалась для исследования состояния поверхности катализатора в условиях реакции. Установлено [13], что основные компоненты реакционной среды - метанол, вода, ДМЭ - адсорбируются на поверхности диссоциативно с образованием метилированных и гидроксилированных центров. В связи с разработкой процесса получения компонентов моторных топлив из метанола эта реакция в последнее время приобрела промышленное значение, и вновь появился интерес к кинетике и механизму ее протекания [11, 16 - 17].
В работе [16] изучение кинетики проводилось путем варьирования объемной скорости подачи метанола. Проведенные по результатам кинетических измерений на катализаторе -А12О3 (195-285°С) расчеты показали, что кинетика реакции (2):
2СН3ОН = СНзОСНз + Н2О (2)
на изученном катализаторе описывается уравнением второго порядка:
W=k*P2CHз0H
Постоянные уравнения Аррениуса имели следующие значения:В=2.4*108; Е=21800 ккал/моль (91342 кДж/моль)
На основании данных о бимолекулярности реакции, полученных в [16] и других результатов, авторы [13] провели исследование механизма дегидратации метанола методом ИК спектроскопии. В работах [13 - 14] была подробно изучена адсорбция метанола и ДМЭ на поверхности окиси алюминия в интервале температур 20-450°С, причем поверхность адсорбента в зависимости от обработки была гидратированной или дегидратированной.
На основании проведенных исследований были сделаны выводы о том, что при повышении температуры имеют место различные виды адсорбции как для ДМЭ (адсорбция на связанных водородной связью гидроксильных группах поверхности; взаимодействие с образованием координационной связи; образование структур с активацией водорода метильной группы поверхностью и образование карбонатно-карбоксилатных структур), так и для метанола (адсорбция на связанных водородной связью гидроксильных группах поверхности, адсорбция с образованием поверхностного метилата, комплекса с координационной связью и карбонатно-карбоксилатных структур).
На основании сравнения спектральных данных в совокупности с полученными ранее термодесорбционными результатами [18], авторы пришли к выводу, что протекание реакции дегидратации метилового спирта до диметилового эфира идет с образованием поверхностного метилата и комплекса с координационной связью. Карбонатно-карбоксилатные структуры не являются промежуточными соединениями при дегидратации спирта, но ответственны за протекание побочных реакций. Кроме того, авторы пришли к выводу о том, что «свободные» гидроксилы поверхности не принимают участия в адсорбции, а также что адсорбция ДМЭ на дегидратированной поверхности А12О3 протекает с отщеплением воды, дегидратирующей поверхность практически без энергии активации.
продолжениеcoolreferat.com