Содержание
Окисление сложных эфиров и их коррозийные свойства
Окисление сложных эфиров и их коррозийные свойства
11.10.2012
Многие из сложных эфиров двухосновных кислот и эфиров гликолей обладают весьма благоприятным сочетанием ряда свойств, характеризующих эти эфиры как очень ценные смазочные материалы. Однако все эти эфиры при нагревании выше 100С при доступе воздуха заметно окисляются, образуют осадки и кислоты, вызывающие коррозию большинства металлов. Поэтому естественно, что изучению условий окисления эфиров и подбору антиокислителей было уделено значительное внимание. Были испытаны на одном из эфиров, ди-2-этилгексиловом эфире себациновой кислоты, различные антиокислители группы аминов, фенолов, фентиазинов, эфиров и соединений, содержащих серу, фосфор, металлы и некоторые другие элементы.
Этот эфир был выбран как типичный, по своим свойствам наиболее подходящий в качестве смазки для многих объектов. Уже при 100С без добавки антиокислителей эфир заметно окислялся, увеличивалась его вязкость, появлялись значительная кислотность и ощутимая коррозия меди и дюраля, при 125С эти изменения выражались уже более резко.
Из большого числа испытанных антиокислителей наиболее эффективными оказались фентиазин и некоторые его производные при температурах до 175С, хотя уже при 163С в их присутствии наблюдается некоторое лакообразование на стенках сосуда и на испытуемых металлических пластинках. Антиокислительное действие производных фентиазина изучалось на большом числе эфиров.
Из группы аминов наиболее эффективным при температурах до 163С является фенил-1-нафтиламин и из других антиокислителей диалкилселениды, полученные из первичных спиртов нормального строения.
Пленка сложного эфира, как и пленка чистого минерального масла на поверхности металла, не предохраняет последний от окисления при попадании в эфир воды. Поэтому при использовании сложных эфиров в качестве смазывающих материалов, если возможность попадания влаги и эфир не исключена, необходимо искусственно предотвратить неизбежную при этом коррозию металла. Это может быть достигнуто, как и при применении минеральных смазочных масел, введением в эфир антикоррозийных присадок.
Присадки, эффективные для минеральных смазочных масел, как привило, эффективны и для эфиров, если только они достаточно хорошо растворимы в этих эфирах.
Отмечается антикоррозийное действие солей цинка, бария, стронция, кальция и магния различных арилстеариновых кислот (фенил-, феноксифенил-, фенилфенилен- и додецилфенилстеариновой кислоты), фенилундекановой кислоты и ряда нафтеновых кислот молекулярного веса от 300 до 600. Все перечисленные соли, добавленные к эфирам в количествах от 0,2 до 0,5% вес., в достаточной мере предотвращали коррозию стали.
Из других антикоррозийных присадок к смазочным маслам на основе сложных эфиров заслуживает внимания применявшийся в Германии мезульфоль-2-соединение (С5Н11-О-С-SS-СН2)2, получающееся при взаимодействии амилксантогената натрия с хлористым этиленом.
Кроме антикоррозийного действия, мезульфоль-2 действует и как антиокислитель, он уменьшает загустевание масла и пригорание колец.
Другая присадка КSE (Korrosinsschutzester) получается путем многоступенчатого синтеза; исходный продукт — углеводороды (фракция 220-330С). KSE находил применение в качестве антиокислительной присадки для многих синтетических смазочных масел, в том числе и для сложных эфиров карбоновых кислот.
Автоокисление сложных эфиров двухоосновных карбоновых кислот
Автоокисление сложных эфиров двухоосновных карбоновых кислот
12.10.2012
Вопросам химизма и механизма окисления сложных эфиров двухосновных кислот посвящены несколько работ, дающих возможность представить общую картину этого процесса.
Наибольшее применение в качестве смазочных масел имеют эфиры адипиновой, метиладипиновой и себациновой кислот, а также сложные эфиры триметилолэтана и триметилолпропана. Поэтому некоторые из этих классов и были прежде всего подвергнуты более или менее тщательному исследованию. Изучена кинетика автоокисления сложных эфиров себациновой кислоты кислородом в интервале температур 125-150С; показано, что окисление сложных эфиров себациновой и некоторых других двухосновных карбоновых кислот имеет резко выраженный автокаталитический характер во всем изученном температурном интервале.
Авторами изучена также кинетика автоокисления сложных эфиров себациновой кислоты, а также кинетика автоокисления сложных эфиров себациновой кислоты, а также сложного эфира 1,10-декандиола и 2-этилгексановой кислоты, обладающего строения, аналогичным строению ди-(2-этилгексил) себацината.
Энергии активации реакций автоокисления изученных диэфиров, рассчитанные из кинетических данных. имели следующие значения:
Энергия, Эфир активации, ккал/моль
Ди-(1-метилгептил) себацинат. ……………………………………………………32,0
……………………………………………………32,0
Ди-(3,5,5 триметилгексил) себацинат……………………………………………31,4
1,10-декандиол-ди(2-этилгексаноат)…………………………………………….27,8
Ди-(н-октил) себацинат………………………………………………………………27,8
Ди-(3-метилбутил) себацинат………………………………………………………25,8
Ди-(2-этилгексил) глутарат…………………………………………………………25,7
Ди-(2-этилгексил)-0-фталат………………………………………………………..24,5
Ди-(2-этилгексил) себацинат……………………………………………………….22,5
Ди-(1,3-диметилгексил) себацинат……………………………………………….19,5
Из сравнения приведенных величин следует, что на устойчивость диэфира к окислению большое влияние оказывает удаленность разветвления в спиртовом радикале от карбонильной группы.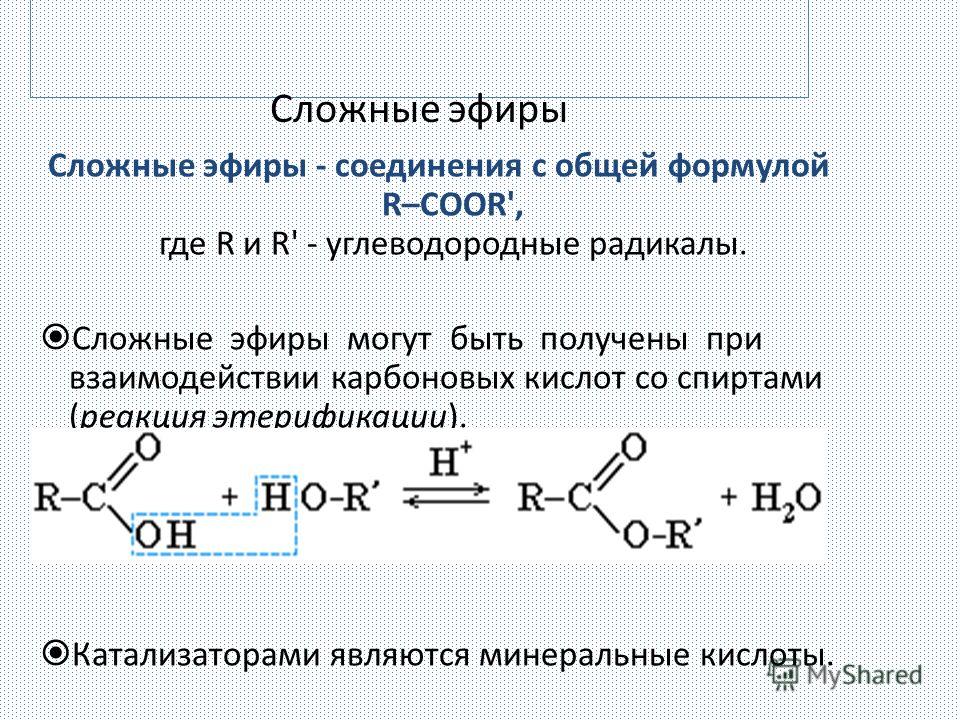 Ди-(1-метилгексил) себацинат значительно более устойчив, чем ди-(3-метилгексил) себацинат. Авторы считают, что это является результатом индукционного эффекта, проявляемого карбонильной группой.
Ди-(1-метилгексил) себацинат значительно более устойчив, чем ди-(3-метилгексил) себацинат. Авторы считают, что это является результатом индукционного эффекта, проявляемого карбонильной группой.
Хотя авторам и не удалось выделить продукты окислениия, однако, исходя из полученных данных, можно предпологать, что в сложных эфирах автоокисление также сводится к преимущественной атаке кислородом ослабленной С-Н связи третичного углеродного атома.
Последующее изучение окисляемости сложных эфиров адипиновой кислоты, проведенное Ригом с сотрудниками, подтвердило изложенные выше выводы о влиянии структуры спиртового радикала на окисляемость диэфиров.
Скорости автоокисления сложных эфиров двухосновных
карбоновых кислот при 110С
Наименование эфира Скорость окисления,
моль О2/моль эфира-сек.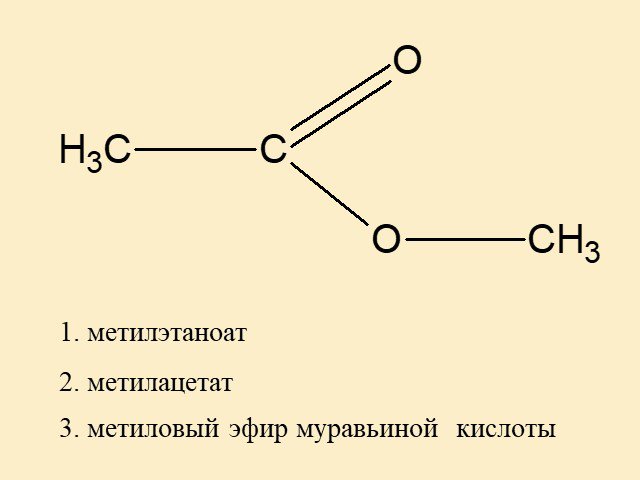 107
107
Ди-(1-метилбутил) адипинат………………………………………1,38
Ди-(2-метилбутил) адипинат………………………………………2,70
Ди-(3-метилбутил) адипинат………………………………………8,18
Ди-(1-этилпропил) адипинат………………………………………2,15
Ди-(2-метилпентил) адипинат…………………………………….4,95
Ди-(2-этилбутил) адипинат………………………………………..3,97
Ди-(3-диметилбутил) адипинат…………………………………..11.3
Диэтиладипинат………………………………………………………1,98
Ди-(н-пентил) адипинат……………………………………………..2,20
Ди-(н-гексил) адипинат…………………………….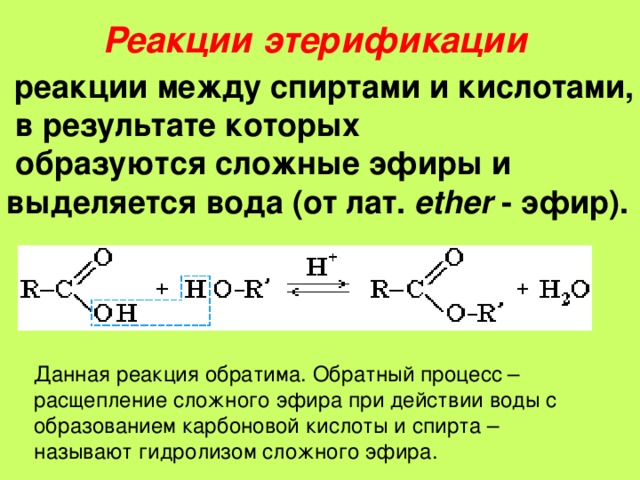 ……………….2,97
……………….2,97
Диэтилазелаинат……………………………………………………..4,62
Из этих данных также следует, что атом углерода в у-положении уже не испытывает практически никакого защитного действия карбонильной группы. Кроме того, можно сделать дополнительно вывод о том, что скорость окисления эфиров адипиновой кислоты лишь незначительно увеличивается (в 1,5 раза) при увеличении длины спиртового радикала в 3 раза.
Влияние длины цепи кислотного радикала диэфира на его окисляемость изучали Марфи с сотрудниками, которые проводили окисление ди-(2-этилгексиловых) эфиров адипиновой, азелаиновой и себациновой кислот при 100С в течение 168 час. При этом не было замечено большого различия в окисляемости взятых эфиров. Однако ограниченное количество данных в этой области не дает возможности сделать окончательные выводы о зависимости стабильности диэфира от длины цепи кислоты.
Из приведенного материала можно также сделать вывод о том, что механизм автоокисления сложных эфиров двухосновных карбоновых кислот, по-видимому, мало отличается от механизма автоокисления углеводородов, изложенного ранее.
органическая химия — степени окисления сложных эфиров?
спросил
Изменено
6 лет, 11 месяцев назад
Просмотрено
2к раз
$\begingroup$
Как узнать степень окисления сложного эфира?
Моя главная проблема заключается в том, чтобы найти числа для сложноэфирных групп.
/О\
- ||
Р -- О -- С -- Р'
-
Мне нужны степени окисления этих двух атомов O и атома C.
- органическая химия
- степень окисления
- сложные эфиры
$\endgroup$
$\begingroup$
$\ce{CO2}$ и производные (например, карбонаты и их сложные эфиры, мочевина, гуанидин, $\ce{CCl4}$) формально являются C(+4), полностью окисленными. Тогда карбоксилаты представляют собой C (+3) (но, конечно, не сложный эфир хлорформиевой кислоты).
Тогда карбоксилаты представляют собой C (+3) (но, конечно, не сложный эфир хлорформиевой кислоты).
$\endgroup$
3
$\begingroup$
Находя степени окисления, систематический способ состоит в том, чтобы перейти от элемента с самой высокой электроотрицательностью к самой низкой. Также всегда учитывайте соседние атомы.
В представленном случае произвольного эфира $\ce{R\bond{-}O\bond{-}(C\bond{=}O)\bond{-}R’}$ это будет кислород. Также группы $\ce{R}$ относятся к алкильному или арильному типу, поэтому они связаны с углеродом.
Теперь присвойте $-2$ всем кислородам, предполагая, что они образуют полную валентную оболочку (что является требованием для степеней окисления). Теперь учтите, что электроны между двумя атомами углерода будут распределены поровну. Поэтому вы можете игнорировать $\ce{R’}$, что означает, что вы присваиваете общей группе значение $0$. Есть один кислород, связанный с углеродом и с $\ce{R}$, его влияние степени окисления будет разделено в обоих направлениях. Поэтому карбоксильный углерод будет «чувствовать» только $-1$. Сложите все степени окисления вокруг карбоксильного углерода ($-3$). Поскольку это нейтральное соединение, степень окисления углерода должна отражать его окружение — поэтому значение равно $+3$.
Есть один кислород, связанный с углеродом и с $\ce{R}$, его влияние степени окисления будет разделено в обоих направлениях. Поэтому карбоксильный углерод будет «чувствовать» только $-1$. Сложите все степени окисления вокруг карбоксильного углерода ($-3$). Поскольку это нейтральное соединение, степень окисления углерода должна отражать его окружение — поэтому значение равно $+3$.
Всегда помните, что степени окисления — это только формальные числа. Они не отражают фактический заряд атома. Они все равно дадут вам представление о полярности молекулы.
$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя адрес электронной почты и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
Oxidation Ladders — Master Organic Chemistry
Как только вы разберетесь с окислением и восстановлением, вы можете начать замечать, что с некоторыми молекулами эти реакции могут протекать в последовательностях .
Например, если вы начинаете с алкана с группой Ch4,
- алкан может быть окислен до первичного спирта.
- Спирт может быть окислен до альдегида
- Альдегид может быть окислен до карбоновой кислоты.
(Конечно, все обратные реакции будут восстановлением)
Каждая из этих реакций включает постепенное увеличение степени окисления углерода. Если вы расположите эти реакции с возрастанием степени окисления по оси y, вы получите паттерны, которые часто называют лестницами окисления , , и они являются чрезвычайно полезным способом организации реакций. (Можно было бы проделать обратные реакции и назвать это «лестницей восстановления» — почему-то прижилось название «лестница окисления»).
Вот почему мы часто говорим, что окисляем спирт «вверх» до альдегида и восстанавливаем альдегид «вниз» до спирта.
Точно так же, если вы начинаете с алкана со вторичным углеродом:
- вторичный углерод может быть окислен до вторичного спирта
- вторичный спирт может быть окислен до кетона
- Кетон может даже быть окислен до сложный эфир
Вот «лестница окисления» для этой последовательности.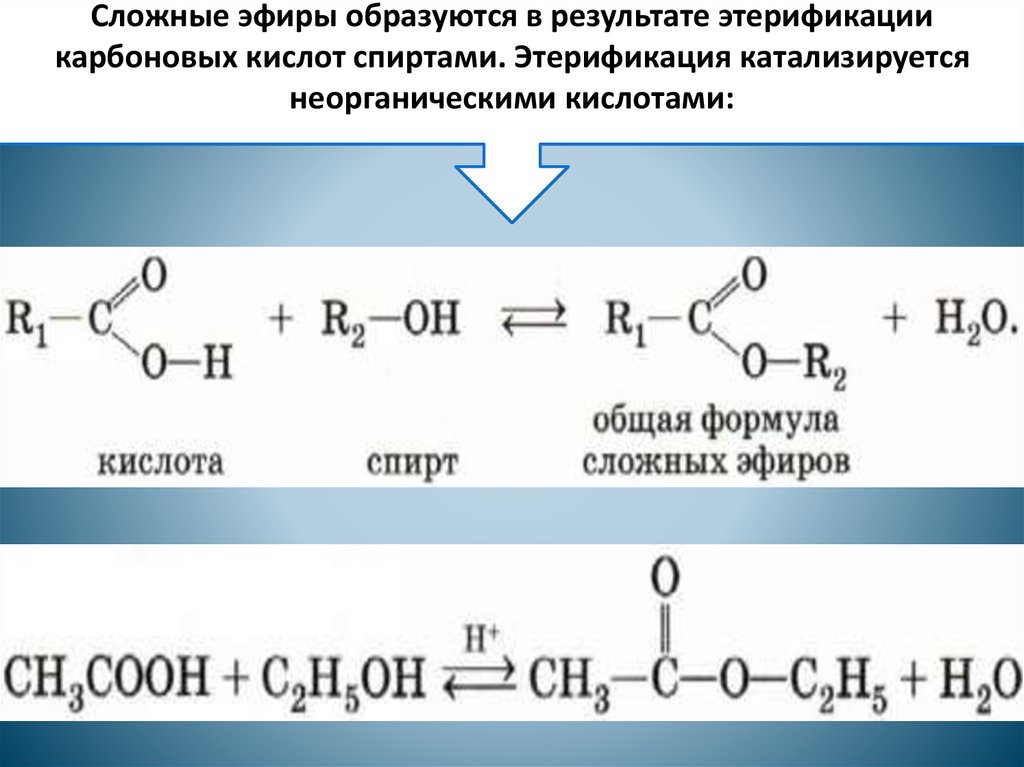
Наконец, вы также можете подумать о лестницах окисления, включающих двойные связи.
- Алканы могут быть окислены до алкенов.
- Алкены могут быть окислены в алкины
- Некоторые алкины могут быть даже дополнительно окислены в инолы, интересный, но несколько экзотический вид, о котором я не буду говорить.
Это также полезная концепция для организации реакций, которые не включают подъем или спуск по лестнице окисления. Например, алкены можно превратить в первичные или вторичные спирты, в зависимости от выбора реагента, и любой из них можно превратить обратно в алкены. Точно так же алкины могут быть преобразованы либо в альдегиды, либо в кетоны, в зависимости от выбора реагента, и ни одно из этих преобразований не считается окислением или восстановлением.
В целом можно представить себе два типа реакций: «вертикальные» реакции, в которых изменяется степень окисления молекулы, и «горизонтальные» реакции, в которых происходит взаимное превращение функциональных групп.