Регуляция активности гидроксиметилглутарил-s-КоА-редуктазы. Образование эфира хс с олеиновой кислотой
21. Обмен и функции стероидов
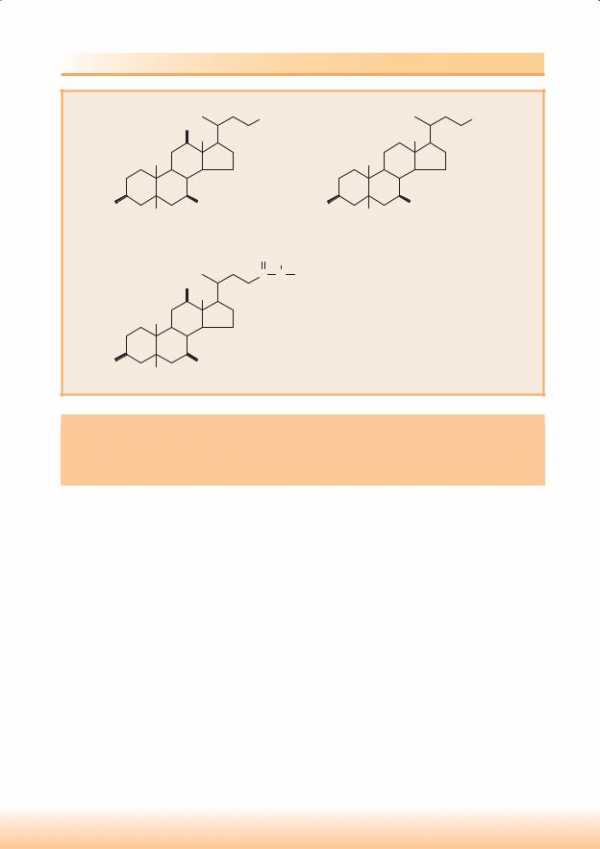
Основным стероидом организма человека является холестерин. Он выполняет в клетках структурную функцию, входя в состав клеточных мембран, а также является предшественником при синтезе желчных кислот, кортикостероидов, половых гормонов и витамина Д. В теле взрослого человека содержится содержится около 140 г ХС (2 мг ХС на 1 г массы тела).
Наиболее богаты ХС нервная ткань (миелиновые мембраны) и кора надпочечников. Часть ХС тканей этерифицирована высшими жирными кислотами, обычно олеиновой кислотой. Эфиры холестерина – это, как правило, депонированная или транспортная форма ХС. Например, 75% ХС ЛП крови этерифицировано, 83% ХС этерифицировано в надпочечниках, где ЭХС депонируется в форме капель в цитоплазме. В большинстве других органов ЭХС составляет меньшую часть всего ХС. Например, в нервной ткани, где сосредоточено 20-25% всего ХС, почти 100% приходится на НЭХС.
С возрастом в плазме крови, в соединительной ткани, жировой ткани, коже, интиме артерий происходит увеличение содержания ХС, преимущественно за счет ЭХС.
Фонд ХС организма создается за счет ХС пищи и его синтеза в самом организме. При питании растительной пищей, в которой ХС мало, главное значение имеет синтез ХС.
21.1. Биосинтез холестерола
В принципе синтез ХС осуществляется в клетках почти всех органов и тканей, однако в значительных количествах – в печени (80%), стенке тонкой кишки (10%) и коже (5%).
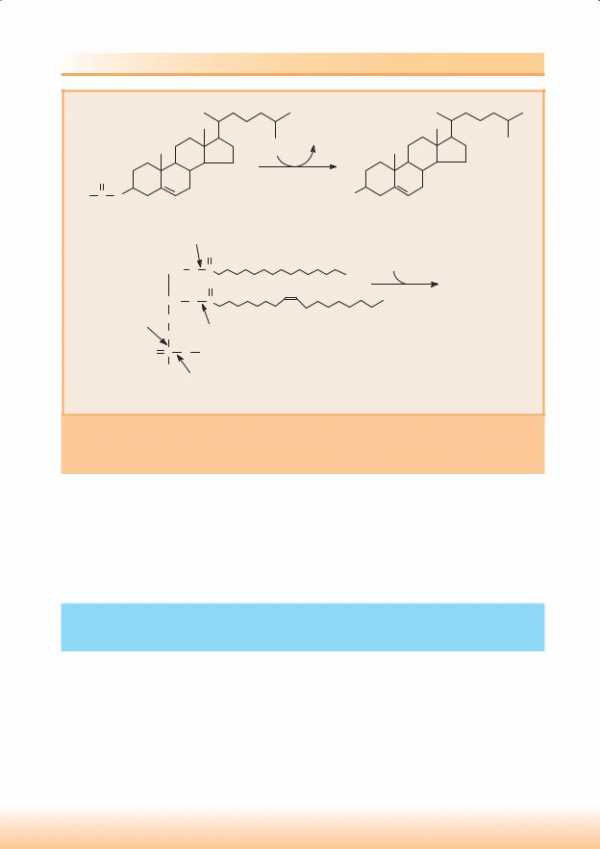
Биосинтез ХС можно разделить на 3 стадии: 1 – биосинтез мевалоновой кислоты; 2 – образование сквалена из мевалоновой кислоты; 3 – циклизация сквалена и образование ХС.
Образование мевалоновой кислоты
Молекула мевалоновой кислоты в печени образуется из ацетильных остатков ацетил-КоА.
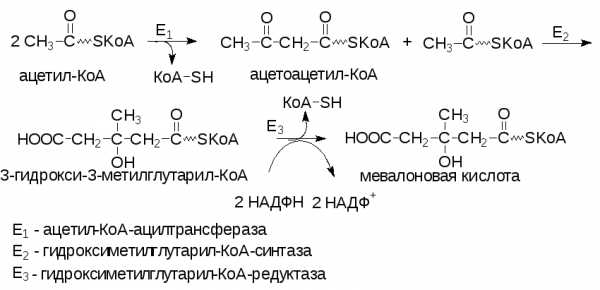
Общее количество ХС, синтезируемого в организме человека за сутки, достигает 500 мг.
Регуляция синтеза хс
Скорость синтеза ХС регулируется по механизму отрицательной обратной связи. Основным пунктом регуляции является реакция образования мевлоновой кислоты – первая специфическая реакция пути синтеза ХС: ХС ингибирует ГМГ-КоА-редуктазу и подавляет ее синтез. При содержании 2-3 г ХС в суточной пище человека синтез собственного ХС почти полностью прекращается.
21.2. Транспорт холестерола
Как было указано выше, ХС синтезируется в клетках печени, кишечника и кожи. Другие органы и ткани получают его с кровью, поглощая ЛПНП путем эндоцитоза. Предотвращение избыточного накопления ХС в клетках обеспечивают ЛПВП. ЛПВП выступают в роли “уборщиков” свободного холестерола с поверхности клеток. Поступая в ЛПВП холестерол этерифицируется под действием ЛХАТ:
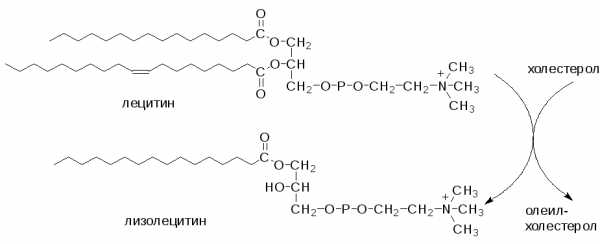
Образовавшиеся эфиры холестерола погружаются внутрь частицы. Вследствие этого концентрация холестерола в поверхностном слое уменьшается и освобождается место для поступления холестерола из других клеток. Т.о. гомеостаз холестерола в клетках разных органов поддерживается путем обмена холестерола между клетками и липопротеинами.
21.3. Биосинтез желчных кислот
В печени часть холестерола превращается в желчные кислоты. В гепатоцитах из холестерола образуются хенодезоксихолевая и холевая кислоты – первичные желчные кислоты. Их образование включает реакции введения гидроксильных групп при участии гидролаз и реакции частичного окисления боковой цепи ХС.
После выведения желчи в кишечник под действием ферментов кишечной флоры из первичных желчных кислот образуются вторичные желчные кислоты – литохолевая и дезоксихолевая кислоты. Они всасываются из кишечника, с кровью воротной вены попадают в печень, а затем в желчь.
В желчи содержатся в основном конъюгированные желчные кислоты, т.е. их комплексы с глицином или таурином. Боковая цепь с остатком глицина или таурина гидрофильна, в то время как другой конец молекулы (циклическая группировка) гидрофобна. Амфифильная природа желчных кислот обусловливает их поверхностно-активные свойства и участие в переваривании жиров.
Концентрация желчных кислот в желчи равна примерно 1%. В желчи содержатся также фосфолипиды (фосфатидилхолины, 0,5%), холестерин (0,5%), а также билирубин и минеральные соли. Следует отметить, что концентрация отдельных компонентов желчи непостоянна.
studfiles.net
Регуляция активности гидроксиметилглутарил-s-КоА-редуктазы
3. Скорость биосинтеза холестерола также зависит от концентрации специфического белка-переносчика, обеспечивающего связывание и транспорт гидрофобных промежуточных метаболитов синтеза.
Холестерол используется как переносчик полиненасыщенных жирных кислот
Транспорт холестерола и его эфиров осуществляется липопротеинами низкой и высокой плотности.
Липопротеины высокой плотности
Общая характеристика
образуются в печени de novo, в плазме крови при распаде хиломикронов, некоторое количество в стенке кишечника,
в составе частицы примерно половину занимают белки, еще четверть фосфолипиды, остальное холестерин и ТАГ (50% белка, 7% ТАГ, 13% эфиров ХС, 5% свободного ХС, 25% ФЛ),
основным апобелком является апо А1, содержат апоЕ и апоСII.
Функция
Транспорт свободного ХС от тканей к печени.
Фосфолипиды ЛПВП являются источником полиеновых кислот для синтеза клеточных фосфолипидов и эйкозаноидов.
Метаболизм
1. Синтезированный в печени ЛПВП (насцентный или первичный) содержит в основном фосфолипиды и апобелки. Остальные липидные компоненты накапливаются в нем по мере метаболизма в плазме крови.
2. В ЛПВП активно протекает реакция при участии лецитин:холестерол-ацилтрансферазы (ЛХАТ-реакция). В этой реакции остаток полиненасыщенной жирной кислоты переносится от ФХ на свободный ХС с образованием лизофосфатидилхолина (лФХ) и эфиров ХС.
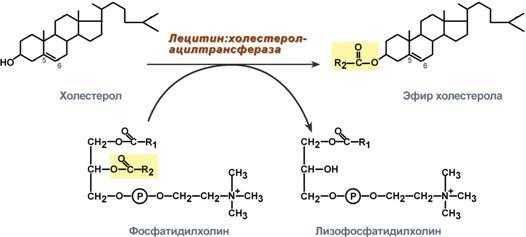
Реакция лецитин:холестерол-ацилтрансферазы
3. Взаимодействует с ЛПНП и ЛПОНП, которые являются источником свободного ХС для ЛХАТ-реакции, в обмен ЛПВП отдают эфиры ХС.
4. Взаимодействуя с ЛПОНП и ХМ, получают ТАГ и отдают им апоЕ- и апоСII-белки.
5. При посредстве специфических транспортных белков получают свободный ХС из клеточных мембран.
6. Взаимодействует с мембранами клеток, отдает часть фосфолипидной оболочки, доставляя таким образом полиеновые жирные кислоты в клетки.
7. Накопление свободного ХС, ТАГ, лизоФХ и утрата фосфолипидной оболочки преобразует ЛПВП3 (условно его можно назвать "зрелый") в ЛПВП2 ("остаточный"). Последний захватывается гепатоцитами при помощи апоА-1-рецептора.
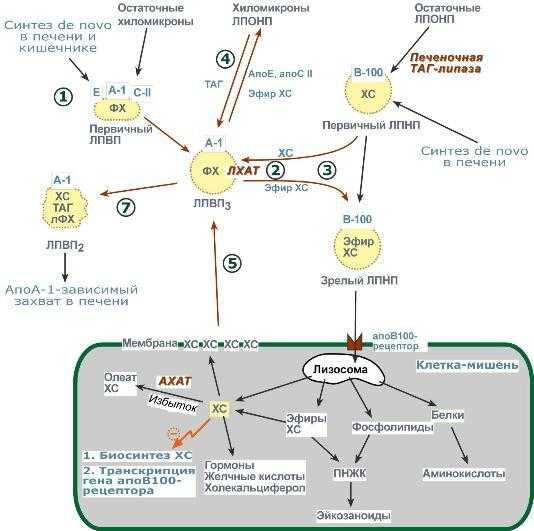
Транспорт холестерола и его эфиров в организме Липопротеины низкой плотности Общая характеристика
образуются в гепатоцитах de novo и в сосудистой системе печени под воздействием печеночной ТАГ-липазы из ЛПОНП,
в составе преобладают холестерол и его эфиры, около половины занимают белки и фосфолипиды (25% белки, 7% триацилглицеролы, 38% эфиров ХС, 8% свободного ХС, 22% фосфолипидов),
основным апобелком является апоВ-100,
нормальное содержание в крови 3,2-4,5 г/л,
самые атерогенные.
Функция
1. Транспорт холестерола в клетки, использующие его для реакций синтеза половых гормонов (половые железы), глюко- и минералокортикоидов (кора надпочечников), холекальциферола (кожа), утилизирующие ХС в виде желчных кислот (печень).
2. Транспорт полиеновых жирных кислот в виде эфиров ХС в некоторые клетки рыхлой соединительной ткани (фибробласты, тромбоциты, эндотелий, гладкомышечные клетки), в эпителий гломерулярной мембраны почек, в клетки костного мозга, в клетки роговицы глаз, в нейроциты, в базофилы аденогипофиза.
Клетки рыхлой соединительной ткани активно синтезируют эйкозаноиды. Поэтому им необходим постоянный приток полиненасыщенных жирных кислот (ПНЖК), что осуществляется либо переходом фосфолипидов от оболочки ЛПВП в мембраны клеток либо поглощением ЛПНП, которые несут ПНЖК в виде эфиров холестерола. Особенностью всех этих клеток является наличие лизосомальных кислых гидролаз, расщепляющих эфиры ХС. У других клеток таких ферментов нет.
Обмен
1. В крови первичные ЛПНП взаимодействуют с ЛПВП, отдавая свободный ХС и получая этерифицированный. В результате в них происходит накопление эфиров ХС, увеличение гидрофобного ядра и "выталкивание" белка апоВ-100 на поверхность частицы. Таким образом, первичный ЛПНП переходит в зрелый.
2. На всех клетках, использующих ЛПНП, имеется высокоафинный рецептор, специфичный к ЛПНП – апоВ-100-рецептор. При взаимодействии ЛПНП с рецептором происходит эндоцитоз липопротеина и его лизосомальный распад на составные части – фосфолипиды, белки (и далее до аминокислот), глицерол, жирные кислоты, холестерол и его эфиры.
ХС превращается в гормоны или включается в состав мембран,
излишки мембранного ХС удаляются с помощью ЛПВП,
при невозможности удалить ХС часть его этерифицируется с олеиновой кислотой ферментом ацил-SКоА:холестерол-ацилтрансферазой (АХАТ),
принесенные с эфирами ХС ПНЖК используются для синтеза эйкозаноидов или фосфолипидов.
Около 50% ЛПНП взаимодействуют с апоВ-100-рецепторами гепатоцитов и примерно столько же поглощаются клетками других тканей.
studfiles.net
Северин бх - Стр 21

Раздел 9
Обмен липидов
Липиды — разнообразные по химической структуре вещества, объединенные в один класс из-засходствафизико-химическихсвойств. Все представители этого класса — гидрофобные или амфифильные (содержащие гидрофильные
игидрофобные участки) соединения, выполняющие разнообразные функции.
•Триацилглицеролы (ТАГ) и жирные кислоты являются долговременными поставщиками энергии для организма.
•Фосфолипиды, гликолипиды и холестерол благодаря амфифильности молекул участвуют в образовании клеточных мембран.
•Производные полиненасыщенных жирных кислот: простагландины, тромбоксаны и лейкотриены, являются тканевыми гормонами, участвующими в регуляции концентрации цАМФ, вазо- и бронходилятации и констрикции, свертывании крови, воспалительных и аллергических реакциях.
•Холестерол — не только структурный компонент мембран, но и предшественник стероидных гормонов, желчных кислот и витамина D3.
9.1. Строение основных липидов организма
Жиры илиТАГ представляют собой сложные эфиры глицерола и высших жирных кислот (рис. 9.1). У человека жирные кислоты имеют четное число углеродных атомов. Среди них различают:
•насыщенные, общая структура которых может быть записана следующим
образом: СН3-(СН2)n–СООН.Нумерация атомов идет отСООН-группы,углеродныйатом,входящийвконцевуюСН3-группу,называютω-углеродныматомом. Основными представителями этой группы являются пальмитиновая (С16:0), содержание которой в жирах человека составляет23–30%,и стеариновая (С18:0) кислоты. Для краткой записи жирных кислот обычно вводят следующие символы: Сn — число углеродных атомов, через двоето-

202 | Биологическая химия |
чие — число двойных связей, а в скобках с дефисом ∆ – номера углеродных атомов, при которых находятся двойные связи;
•мононенасыщенные: пальмитоолеиновая (С16:1 (∆9) и олеиновая С18:1 (∆9) кислоты. В ТАГ человека содержание олеиновой кислоты составляет20–25%;
•Полиненасыщенные (или полиеновые) кислоты почти не синтезируются в организме и являютсянезаменимыми или эссенциальными пищевыми
факторами. Запись этих кислот осуществляют двояким способом, используя нумерацию от ω-атомас указанием номера атома, при котором находится двойная связь, или отСООН-группы,как указывалось выше. Совокупность основных эссенциальных высших жирных кислот обозначают каквитамин F. К ним относятся:
–линолевая (ω 6) кислота — С18:2 (∆9, 12), содержание которой в липидах человека составляет 10–15%,хотя в тканях она совсем не синтезируется;
–линоленовая (ω 3) кислота — С18:3 (∆9, 12, 15), способная синтезироваться в организме животных в очень малых количествах;
–эйкозаполиеновые кислоты, включающие 20 углеродных атомов.
Основной представитель — арахидоновая (ω 6) кислота — С20:4 (∆5, 8, 11, 14), частично синтезирующаяся в организме из линолевой кислоты. Ее содержание в составе липидов составляет около 8% от количества всех жирных кислот человека. В рыбьем жире, растительных маслах встречается эйкозапентаеновая (ω 3) кислота с пятью двойными связями.
Триацилглицеролы являются высококонцентрированной формой энергии. При окислении 1 г жира выделяется 9,3 ккал,что почти в два раза больше, чем при окислении такого же количества белков или углеводов. Чаще всего ТАГ содержат разные жирные кислоты в α- и β- положениях, самая ненасыщенная кислота, как правило, присоединяется в β-положениемолекулы. В названиях жиров первоначально перечисляются жирные кислоты с заменой окончания-атна-или указанием спирта — глицерола. Например, ТАГ, включающий в α положениях пальмитиновую и стеариновую кислоты, а вβ-положенииолеиновую кислоту, будет называтьсяпальмитоил-олеил-стеароилглицерол.
Фосфо- и гликолипиды, холестерол являются основными компонентами мембран и их строение было описано ранее в разделе 4.
9.2. Переваривание липидов
Суточная потребность человека в жирах составляет 70–80г, хотя в пищевом рационе их содержание может колебаться от 80 до 130 г. У взрослых людей расщепление пищевых жиров начинается в двенадцатиперстной кишке.

Раздел 9. Обмен липидов | 203 |
|
|
|
|
Рис. 9.1. Строение основных липидов тканей человека
Обязательным условием переваривания является эмульгирование — снижение поверхностного натяжения на границе раздела вода — жир, так как жиры гидрофобны и содержатся в клетках в виде безводных капель. Основную роль в этом процессе играют желчные кислоты, входящие в состав желчи (рис. 9.2). Будучи амфифильными молекулами, они окружают каплю жира и способствуют ее дроблению на множество мелких капелек. Таким образом молекулы жира становятся доступными для действия липаз, содержащихся в соке поджелудочной железы. В эмульгировании пищевого жира помимо мицелл желчи, в состав
204 |
|
| Биологическая химия |
| COO- |
| COO- |
| OH |
|
|
| Ch4 |
| Ch4 |
| h4C |
| h4C |
HO | OH | HO | OH |
| H |
| H |
| Холевая кислота | Хенодезоксихолевая кислота | |
O H
C N Ch3COO-
OH
Ch4
h4C
H
Гликохолевая кислота
Рис. 9.2. Строение желчных кислот
Гидрофильный участок в молекулах образуют –ОН-группыв 3, 7 положениях полициклической структуры иСОО-группабокового радикала, а в конъюгированных производных — весь участок, начиная с карбонильной группы бокового радикала
которых входят фосфолипиды: желчные кислоты: холестерол в соотношении 1 : 12,5 : 2, участвуют ионы К+, Na+, соли высших жирных кислот, СО2, бикарбонаты панкреатического сока и перистальтика кишечника. Желчные кислоты, синтезированные в печени, на 2/3 конъюгированы, т.е. образуют производные с молекулами глицина и таурина, что усиливает эмульгирующие свойства этих соединений.
Впросвете кишечника происходит активация панкреатической липазы за счет присоединения к ферментубелка-активатораколипазы, который тоже синтезируется в поджелудочной железе и поступает в кишечник в составе панкреатического сока. Образование комплекса липазы и колипазы изменяет конформацию фермента, активирует его и смещает рН действия с 9,0 до 6,0. Панкреатическая липа-
за — гидролаза, отщепляющая с высокой скоростью жирные кислоты из α-положениймолекулы, поэтому основными продуктами гидролиза ТАГ являются моноацилглицеролы(2-МАГ)и жирные кислоты (рис. 9.3).
Всоставе сока поджелудочной железы присутствуют и другие гидролазы, участвующие в расщеплении липидов пищи. Это — холестеролэстераза, катализирующая расщепление эфиров холестерола до высших жирных кислот и сво-

Раздел 9. Обмен липидов |
|
|
|
|
|
|
|
|
|
| 205 | ||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| O |
| 2 Жирные |
|
|
|
|
|
|
|
| |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| кислоты |
|
|
|
|
|
|
|
| |
|
| O |
|
|
| CH |
|
| O |
| C |
| R |
| 2 h3O |
| O |
|
|
| CH | OH | |||
|
|
|
|
| |||||||||||||||||||||
R2 |
|
|
|
|
|
|
| 2 |
|
|
|
|
| 1 |
|
|
|
|
|
|
|
| 2 |
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||
| C |
| O |
|
| CH |
|
|
|
| O |
|
| R2 |
| C |
| O |
|
| CH |
| |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Панкреатическая |
|
|
|
|
|
|
|
| |
|
|
|
|
|
| Ch3 |
| O |
| C |
| R3 |
|
|
|
|
| Ch3OH | |||||||
|
|
|
|
|
|
|
|
| липаза |
|
|
|
|
| |||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
|
| Триацилглицерол |
|
| Моноацилглицерол | ||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 9.3. Гидролиз ТАГ панкреатической липазой
бодного холестерола, и набор фосфолипаз, расщепляющих фосфолипиды на высшие жирные кислоты, глицерол, остаток фосфорной кислоты и азотистое основание: холин, серин или этаноламин (рис. 9.4).
Переваривание ТАГ молока у грудных детей и детей младшего возраста
В состав ТАГ молока входят жирные кислоты с короткой длиной цепи от 4 до 12 углеродных атомов. В секреторных железах языка и желудка синтезируется липаза, работающая при рН 7,0. Она отщепляет в желудке остаток одной жирной кислоты из α-положенияТАГ молока. Освободившаяся жирная кислота всасывается в желудке или кишечнике, а диацилглицерол (ДАГ) поступает в кишечник и подвергается гидролизу панкреатической липазой до МАГ и жирной кислоты.
9.3. Всасывание продуктов гидролиза липидов
Плохо растворимые в водной среде продукты гидролиза липидов: высшие жирные кислоты, 2-МАГ,холестерол, а также поступившие с пищей жирорастворимые витамины А, Д, Е, К включаются в мицеллы желчи, образуясмешанные мицеллы. В такой форме они всасываются клетками слизистой оболочки кишечника. При всасывании этот сложный надмолекулярный комплекс распадается. Желчные кислоты с током крови поступают в печень, а оттуда через желчные протоки в желчный пузырь и затем в составе мицелл желчи снова изливаются в кишечник. Из кишечника около 5% желчных кислот выводится с калом, а основная масса всасывается, циркулируя из печени в желчный пузырь, кишечник и снова в печень. Этот кругооборот желчных кислот получил названиеэнтерогепатической циркуляции. Потери желчных кислот в кишечнике восполняются за счет синтеза в печени из холестерола. Глицерол, будучи веществом хорошо растворимым в водных средах, всасывается без участия желчи.
Нарушения, вызванные снижением поступления панкреатической липазы (при панкреатите) или желчи при недостаточном желчеобразовании или за-
206 |
|
|
|
|
|
| Биологическая химия |
A. |
|
|
|
|
|
|
|
|
|
|
|
|
| Жирная |
|
|
|
|
|
|
| кислота |
|
|
|
|
|
|
| h3O |
|
| O |
|
|
|
| Холестерол- |
|
|
|
|
|
|
|
| |
R | C | O |
|
|
| эстераза | HO |
|
|
|
| ||||
|
| Эфир холестерола | Холестерол | ||||
Б. |
| Фосфолипаза А1 | Глицерол | ||||
|
|
|
|
| O | + | |
|
|
|
|
|
| ||
|
|
| 1 | Ch3 | O | C | h3O |
|
|
|
| Жирные кислоты | |||
|
|
|
|
| |||
|
|
| 2 |
|
| O | + |
|
|
| CH | O | C |
| |
|
|
|
|
| |||
|
|
| 3Ch3 |
|
| Холин | |
Фосфолипаза С |
|
| + | ||||
O |
| Фосфолипаза А2 |
| ||||
|
|
|
| Ортофосфат | |||
|
|
|
|
|
| + |
|
|
| O |
| P O | Ch3Ch3N(Ch4)3 |
| |
|
|
| O- |
|
|
| |
|
|
|
| Фосфолипаза Д |
| ||
|
|
| Фосфатидилхолин |
| |||
Рис. 9.4. Гидролиз эфиров холестерола и фосфолипидов: | |||||||
А. — гидролиз эфиров холестерола Б. — гидролиз фосфолипида на примере фосфатидилхолина — лецитина
купорке желчных протоков (желчнокаменная болезнь), снижают скорость гидролиза липидов и сопровождаются стеатореей — появлением нерасщепленных жиров в составе фекалий. При этом снижается всасывание полиеновых жирных кислот и жирорастворимых витаминов: А, Д, Е, К, что приводит к развитию гиповитаминозов.
9.4.Ресинтез экзогенных ТАГ в клетках слизистой кишечника и их транспорт по крови
Из продуктов гидролиза жиров в клетках слизистой кишечника идет синтез ТАГ. Предварительно жирные кислоты активируются при участии ацил-КоА-синтетаз, специфичных к длине углеводородного радикала. Существует три вида ферментов: один активирует жирные кислоты, включающие2–3углеродных атома, другой специфичен к жирным кислотам со средней длиной цепи в4–12углеродных атомов, а третий превращает вацил-КоАдлинноцепочечные жирные кислоты, состоящие из12–24углеродных атомов.

Раздел 9. Обмен липидов | 207 |
|
|
|
|
Рис. 9.5. Ресинтез ТАГ в клетках слизистой кишечника
Ацил-КоА-синтетаза
R-COOH+HS-KoA+ ATФ————————→R-CO~S-KoA+ AМФ+Н4Р2О7.
Далее активированные жирные кислоты достраивают 2-МАГдо ТАГ при участии ферментов —трансацилаз илиацилтрансфераз (рис. 9.5).
Гидрофобные ТАГ включаются в водорастворимые надмолекулярные комплексы — хиломикроны (рис. 9.6), представляющие собой один из видов липопротеинов, обеспечивающих транспорт жиров по крови. Они являются сферическими частицами, внутреннее содержимое которых образуют ТАГ и эфиры холестерола, а наружную оболочку — фосфолипиды, холестерол и белки: инте-
Рис. 9.6. Строение липопротеинов.
Ядро частицы представлено неполярными липидами: ТАГ и эфирами холестерола. ЭХс — эфиры холестерола

208 | Биологическая химия |
гральные (пронизывающие фосфолипидный слой) и периферические (взаимодействующие с наружным слоем мембраны).
В составе хиломикронов (ХМ) экзогенные жиры через лимфатическую систему поступают в кровоток, где помимо ХМ, основной транспортной формы экзогенного жира, присутствуют и другие липопротеины (табл. 9.1). Так:
липопротеины очень низкой плотности (ЛПОНП) транспортируют синтезированные в печени эндогенные жиры и холестерол;
липопротеины промежуточной плотности (ЛППП) образуются из ЛПОНП под действием ЛП-липазы,расположенной на стенках сосудов, и являются предшественниками ЛПНП;
липопротеины низкой плотности (ЛПНП) переносят холестерол к тканям. Липопротеины высокой плотности (ЛПВП) обеспечивают доставку белков на другие липопротеины и перенос холестерола от тканей в печень.
|
|
|
|
| Таблица 9.1 | |
|
| |||||
Состав основных липопротеинов крови человека |
| |||||
Липопротеины | Хиломи- | ЛПОНП | ЛППП | ЛПНП | ЛПВП | |
(Состав в % ) | кроны | |||||
|
|
|
| |||
ТАГ | 85 | 55 | 26 | 7 | 3 | |
Белки | 2 | 10 | 11 | 22 | 50 | |
Фосфолипиды | 3 | 18 | 23 | 21 | 27 | |
Холестерол (Хс) | 2 | 7 | 8 | 8 | 4 | |
Эфиры Хс | 3 | 10 | 30 | 42 | 10 | |
В кровеносном русле ХМ контактируют с ЛПВП и между ними происходит обмен мембранными белками — аполипопротеинами. ХМ получают от ЛПВП Апо СII и Апо Е, а хиломикроны отдают на ЛПВП Апо А1. Получив Апо СII и Апо Е , ХМ из незрелой формы превращаются взрелые частицы, так как эти белки обеспечивают дальнейший метаболизм ХМ. Апо СII — активаторЛП-липазы,фермента, локализованного на эндотелии сосудов. С помощью Апо СIIХМ связываются сЛП-липазой,которая гидролизует находящиеся внутри частиц ТАГ на глицерол и высшие жирные кислоты (ВЖК). ХМ на85–90% состоят из ТАГ, поэтому, теряя жиры, они превращаются востаточные ХМ. Последние возвращают АпоСII на ЛПВП и удаляются из кровотока с помощью Апо Е. Рецепторы клеток печени связываются с этим белком и поглощают частицы по механизму эндоцитоза (рис. 9.7). В клетках печени эндосомы сливаются с лизосомами, и содержимое остаточных хиломикронов гидролизуют лизосомальные ферменты. Образующиеся продукты используются для внутренних нужд органа.

Раздел 9. Обмен липидов | 209 |
|
|
|
|
Рис. 9.7. Метаболизм хиломикронов
9.5. Эндогенный синтез жиров в период пищеварения
Вабсорбтивный период или период пищеварения часть энергоносителей, таких, как глюкоза и жирные кислоты, запасаются в виде ТАГ в специализированных клетках жировой ткани — адипоцитах. В этот период в крови повышается концентрация глюкозы и увеличивается инсулин/глюкагоновый индекс. Инсулин индуцирует синтез ЛП-липазыи ускоряет поступление экзогенных высших жирных кислот в адипоциты, где они используются на синтез ТАГ.
Утилизация глюкозы печенью, мышцами и жировой тканью активируется инсулином, так как он стимулирует включение переносчиков глюкозы ГЛЮТ-4
вмембраны жировой и мышечной тканей и таким образом делает их проницаемыми для глюкозы.
Впечени гормон индуцирует синтез глюкокиназы, фосфофруктокиназы и пируваткиназы, которые часть глюкозы, не использованной на синтез гликогена, окисляют в гепатоцитах до пирувата в процессе аэробного гликолиза. Процесс ускоряется не только за счет увеличения количества этих ферментов, но и благодаря тому, что инсулин, активируя специфическую фосфопротеинфосфатазу, переводит БИФ-ферменти пируваткиназу в дефосфорилированную форму. В этих условиях ускоряется синтезфруктозо-2,6-фосфата— мощного активатора фосфофруктокиназы и пирувата из фосфоенолпирувата (см. раздел 8).
Синтез высших жирных кислот
Пируват из цитозоля транспортируется в митохондрии, где частично подвергается окислительному декарбоксилированию ПДК комплексом с образованием ацетил-КоА,и карбоксилируется пируваткарбоксилазой с образованием оксалоацетата.
Оба продукта в реакции, катализируемой ферментом ЦТК — цитратсинтазой, превращаются в цитрат и с помощью соответствующей транслоказы покидают митохондрии (рис. 9.8). Утечка цитрата в цитозоль объясняется тем, что в аб-

210 | Биологическая химия |
сорбтивный период в митохондриях образуются большие количества АТФ и NADH, которые, являясь аллостерическими ингибиторами изоцитратдегидрогеназы и α-кетоглутаратдегидрогеназногокомплекса, снижают использование цитрата в цитратном цикле.
Рис. 9.8. Образование из глюкозы ацетил-КоА— субстрата синтеза ВЖК:
— индукция ферментов инсулином
В цитозоле цитрат распадается на оксалоацетат и ацетил-КоАпри участии ферментацитратлиазы. Ацетил-КоАвовлекается в синтез высших жирных кислот, а оксалоацетат под действиемцитоплазматической малатдегидрогеназы восстанавливается в малат, который либо с помощью соответствующей транслоказы возвращается в митохондрии, либо с помощьюмалик-ферментаподвергается окислению и декарбоксилированию с образованием пирувата иNADPH-донораводорода в реакциях восстановления при синтезе ВЖК.
Инсулин индуцируетсинтез цитратлиазы ималик-фермента.Реакция, катализируемая цитратлиазой, идет с затратой молекулы АТФ, энергия которой затрачивается на образование макроэргической связи между остатком ацетила и НS-КоА (рис. 9.9).
Основную регуляторную реакцию синтеза ВЖК катализирует биотинсодержащий фермент — ацетил-КоА-карбоксилаза, в ходе которойацетил-КоАпревращается вмалонил-КоА(рис. 9.10).
Благодаря ключевому положению этой реакции в синтезе ВЖК активность ацетил-КоА-карбоксилазыможет изменяться в широких пределах путем:
– ассоциации и диссоциации протомеров.Цитрат стимулирует ассоциацию и повышает активность фермента, а увеличение концентрации ацил-КоА ускоряет диссоциацию протомеров и снижает активность фермента;
studfiles.net
Биосинтез жирных кислот, триацилглицеролов и фосфолипидов. Липотропный эффект фосфолипидов
20.2.1. Биосинтез триацилглицеролов и глицерофосфолипидов происходит в цитоплазме клеток. Первые реакции этих метаболических путей совпадают и включают образование фосфатидной кислоты.
Предшественники фосфатидной кислоты - глицерол и жирные кислоты - вступают в реакцию в активной форме.
Образование активной формы глицерола (глицерол-3-фосфата может происходить двумя путями (рисунок 21.1).
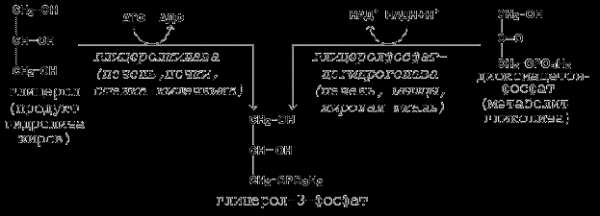
Рисунок 20.5. Пути образования глицерол-3-фосфата.
Активация жирных кислот идёт путём образования тиоэфиров коэнзима А – ацил-КоА (см. 19.3.1, рисунок 19.7).
20.2.2. Первая реакция ацилирования глицерол-3-фосфата осуществляется за счёт КоА-производного насыщенной жирной кислоты, например, пальмитиновой. Образуется сложноэфирная связь в 1-м положении (рисунок 20.6, реакция 1).
Вторая реакция ацилирования идёт, как правило, за счёт КоА-тиоэфира ненасыщенной жирной кислоты, например, олеиновой (рисунок 20.6, реакция 2).
В процессе синтеза триацилглицеролов происходит дефосфорилирование фосфатидной кислоты при помощи фосфатидатфосфатазы (рисунок 20.6, реакция 3).
В дальнейшем 1,2-диацилглицерол ацилируется третьей молекулой ацил-КоА, которая может содержать остаток как ненасыщенной, так и насыщенной жирной кислоты (рисунок 20.6, реакция 4).
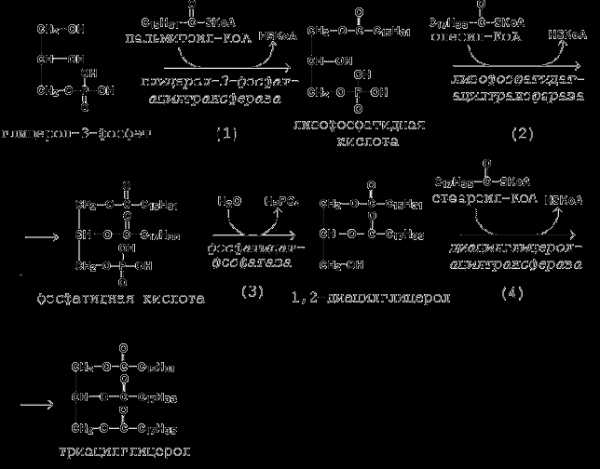
Рисунок 20.6. Реакции биосинтеза триацилглицеролов.
20.2.3. В организме здорового человека процессы биосинтеза и катаболизма триацилглицеролов взаимно уравновешены.
В тех случаях, когда углеводы, жиры или белки потребляются в количествах, превышающих энергетические потребности организма, излишки калорий запасаются в виде триацилглицеролов. Источником ацетил-КоА для биосинтеза жирных кислот могут служить как углеводы, так и углеродные цепи аминокислот. Накопленный избыток жиров может быть израсходован для получения энергии, например, при голодании.
Скорость биосинтеза триацилглицеролов регулируется гормонами. Инсулин стимулирует поступление глюкозы в клетки и, следовательно, превращение её в жиры. Глюкагон и гормоны надпочечников тормозят этот процесс.
dendrit.ru
Этиология и патогенез дислипидемии
Характеристика липидов плазмы крови
Основными липидами плазмы крови являются свободные, то есть неэтерифицированные жирные кислоты, ТГ, фосфолипиды и эфиры ХС.
Большая часть жирных кислот образуется в печени из углеводных предшественников. Лишь линолевая кислота и продукт ее метаболизма — арахидоновая кислота не синтезируются в организме и являются незаменимыми жирными кислотами. Свободные жирные кислоты циркулируют в крови в соединении с альбуминами. Они поступают в кровь из пищи или из жировой ткани, где содержатся в виде ТГ и со временем мобилизируются с помощью липопротеинлипазы. Окисление свободных жирных кислот — важный источник энергии, в частности в сердечной мышце. Скорость их обмена очень высока — каждую минуту утилизируется около 20–40% количества жирных кислот в плазме крови. Они играют важную роль в липидном обмене, этерифицируя ХС и глицерин. Выделяют насыщенные жирные кислоты (пальмитиновая, стеариновая), мононенасыщенные жирные кислоты (олеиновая) и полиненасыщенные жирные кислоты (линолевая, арахидоновая, эйкозапентаеновая, докозагексаеновая). Насыщенность зависит от числа двойных связей в составе жирных кислот. Незаменимые жирные кислоты не синтезируются в организме человека и должны поступать в составе пищевых продуктов. Насыщенные жирные кислоты преобладают в жирах животного происхождения, мононенасыщенные и полиненасыщенные жирные кислоты — в растительных маслах и рыбьем жире.
ТГ — это объединение 3 эфиров жирных кислот и глицерина, который является многоатом-ным спиртом. Экзогенные или «пищевые» ТГ ресинтизируются в клетках тонкой кишки из моноглицеридов и поступают в кровь в виде ХМ. Эндогенные ТГ синтезируются главным образом в печени из свободных жирных кислот, откуда транспортируются кровью преимущественно в составе ЛПОНП. После приема жирной пищи концентрация ТГ в крови быстро повышается, но в норме уже через 10–12 ч возвращается к исходному уровню. В данное время для оценки на-рушения обмена ТГ предложены тесты с пищевой нагрузкой жиром (сливочным маслом, сметаной). У больных сахарным диабетом, метаболическим синдромом и ожирением концентрация ТГ длительное время (>12 ч) не возвращается к норме. Этот феномен в мировой литературе обозначается термином «постпрандиальная дислипидемия». Больные с постпрандиальной дислипидемией более склонны к развитию атеросклероза.
Фосфолипиды — это сложные липиды, состоящие из глицерина, жирных кислот, фосфорной кислоты и азотсодержащих соединений. Синтезируются почти во всех тканях, более всего в печени. Как и ХС, являются составляющими клеточных мембран, а в плазме крови играют важную роль в обеспечении растворимости липопротеиновых частиц. Их содержание в крови не связано с риском развития ИБС, поэтому при назначении гиполипидемической терапии концентрация фосфолипидов в плазме крови, как правило, не принимается во внимание.
ХС относится к группе стероидов (как половые гормоны и желчные кислоты), поскольку содержит в своем составе циклические структуры. ХС находится в организме в виде свободного стерина и в виде его эфиров. Эфир ХС представлен соединением ХС с одной из жирных кислот. Функции ХС обусловлены тем, что он, наряду с фосфолипидами, входит в состав клеточных мембран, регулируя их проницаемость и активность мембранных ферментов, а также является предшественником некоторых биологически активных веществ (стероидных гормонов, витаминов группы D и желчных кислот). ХС частично поступает с пищей в составе ХМ (20–30%), но в основном синтезируется de novo (70–80%) в организме человека. Способностью синтезировать ХС обладает большинство клеток, но основной процесс осуществляется в печени, где формируются и основные метаболиты ХС — желчные кислоты. ХС, поступивший в просвет тонкого кишечника в составе желчных кислот, подвергается обратному всасыванию и снова поступает в печень (внутрипеченочный путь обмена ХС). Как уже отмечалось, ХС бывает свободным и этерифицированным. Свободный ХС метаболически активный, в то время как эфиры ХС являются его формой, которая транспортируется и депонируется. Этерифицированный ХС преобладает в составе коры надпочечников, в плазме крови, в атеросклеротических бляшках. В составе клеточных мембран ХС находится в свободном состоянии.
В плазме крови ХС и ТГ находятся в соединении с белками, образуя липопротеины. Данные соединения обеспечивают их транспорт и представляют собой сферические частицы разного размера, состоящие из свободного и этерифицированного ХС, ТГ, фосфолипидов и белков, количество которых варьирует. Внутри находится гидрофобное ядро из плотно расположенных молекул ТГ и эфиров ХС. Снаружи ядро покрыто слоем из фосфолипидов, обеспечивающих стабилизацию липопротеиновой частицы в растворенном состоянии, а также небольшим количеством свободного ХС и белков — аполипопротеинов или апобелков. Апобелки выполняют структурную и адресную функции. Благодаря высоко- специфическому взаимодействию между апобелками липопротеинов и белками-рецепторами на клеточной мембране осуществляется рецепторопосредованное связывание липопротеинов с клетками. Полярные части молекул апобелков, фосфолипидов и свободного ХС создают внешний, гидрофильный слой липопротеиновых частиц, в то время как эфиры ХС и ТГ составляют их гидрофобное ядро. Основными липопротеинами, в зависимости от их плотности, размеров и состава липидов (табл. 2.5), а также апобелков, являются ХМ, ЛПОНП, ЛППП, ЛПНП, ЛПВП.
Экзогенные липиды — ТГ и ХС (приблизительно 100 г и 1 г в сутки соответственно) попадают внутрь эпителиальных клеток кишечника, где они всасываются, инкорпорируясь в большие липопротеиновые частицы — ХМ, наибольшие по размерам и наиболее легкие липопротеиновые частицы. Их плотность составляет 0,95 г/мл. ХМ синтезируются в эпителиальных клетках тонкого кишечника из липидов экзогенного (пищевого) происхождения; через систему лимфатических сосудов ХМ поступают в грудной лимфатический проток и оттуда в кровь, где подвергаются липолизу под действием липопротеинлипазы плазмы крови. В состав ХМ входят ТГ, в меньшем количестве эфиры ХС, фосфолипиды и апобелки. В результате липолиза ХМ теряют значительную часть ТГ и превращаются в ремнанты (остатки) ХМ. Основными белками ремнант ХМ являются апобелки: апо-В-48, апо-Е и апо-С. Именно благодаря апо Е ремнанты связываются с рецепторами печени. Изолированную гиперхиломикронемию выявляют редко, последняя обычно свидетельствует о наследственном дефекте липопротеинлипазы. Гиперхиломикронемия не является биохимическим маркером атеросклероза, но сопутствующая ей гипертриглицеридемия может спровоцировать развитие острого панкреатита. Основной функцией ХМ является транспорт пищевых ТГ, из которых они состоят на 90%, и ХС через лимфу в плазму крови. Попадая в капилляры жировой ткани и мышц, ХМ взаимодействуют с липопротеинлипазой, которая связана с гликозаминогликанами на внешней поверхности эндотелия капилляров. В результате гидролиза ХМ освобождаются свободные жирные кислоты и моноглицериды, которые поступают в адипоциты и мышечные клетки, где метаболизируются, а ХМ превращаются в ремнанты, относительно бедные ТГ и богатые эфирами ХС. Ремнанты захватываются рецепторами печени, которые распознают апо-Е и поступают внутрь гепатоцита. Таким образом, в результате транспорта ХМ пищевые ТГ доставляются в жировую ткань, а ХС — в печень. В физиологических условиях ХМ присутствуют в крови только после приема пищи, содержащей жиры (до 12 ч), но не натощак. В печени ХС частично превращается в желчные кислоты, выделяющиеся с желчью в тонкую кишку, где, выступая в роли детергентов, облегчают всасывание алиментарных жиров.
Эндогенные липиды, представленные ТГ, синтезированными в печени из жирных кислот и глицерина, вместе с небольшим количеством этерифицированного ХС выделяются в кровь в составе ядра ЛПОНП. Основные структурно-функциональные белки ЛПОНП — апо-В-100, апо-Е и апо-С-I, C-II, C-III. ЛПОНП в основном состоят из эндогенных ТГ и в меньшей степени из эфиров ХС, поэтому их повышенное содержание в плазме крови проявляется гипертриглицеридемией и часто диагностируется у больных с инсулиннезависимым сахарным диабетом, гипотиреозом, ожирением. Гипертриглицеридемия в сочетании с низким уровнем ЛПВП служит фактором риска развития атеросклероза. В капиллярах жировой и мышечной ткани под влиянием липопротеинлипазы происходит гидролиз ТГ с отделением жирных кислот, которые поступают в ткани и используются для ресинтеза ТГ. В результате этого богатые ТГ ЛПОНП аналогично ХМ превращаются в богатые этерифицированные ХС их ремнанты — ЛППП. Основные транспортные и функциональные белки ЛППП — апо-В-100 и апо-Е. Благодаря этим белкам ЛППП связываются с соответствующими рецепторами печени. Плотность ЛППП — 1,006–1,019 г/мл. Повышенная концентрация в крови ЛППП определяется при гиперхолестеринемии и гипертриглицеридемии. Довольно редко в клинической практике отмечают изолированное повышение ЛППП, что связано с наследственным дефектом печеночной липопротеинлипазы и сопровождается прогрессирующим атеросклерозом. В норме ЛППП частично катаболизуются в печени путем рецепторопосредованного эндоцитоза с распознаванием апо-Е и апо-В, частично с помощью печеночной липазы превращаются в ЛПНП в результате изъятия из них большей части ТГ с увеличением относительного содержания эфиров ХС. При этом теряется большая часть апопротеинов.
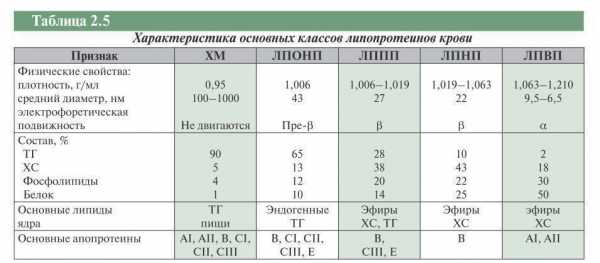
Таблица 2.5
Ядро новообразованного ЛПНП состоит преимущественно из эфиров ХС, а оболочка содержит только апо-В-100 и апо-Е. Поскольку в этих липопротеинах содержится всего 70% ХС плазмы крови, их основной функцией является транспорт ХС внепеченочным клеткам организма. Повышенное содержание в плазме крови ЛПНП четко связано с развитием атеросклероза коронарных, каротидных и периферических сосудов. Однако для того чтобы ЛПНП стали атерогенными, они должны модифицироваться. Причиной модификации чаще всего служит процесс перекисного окисления ЛПНП. Окисленные ЛПНП изменяют свои свойства в двух направлениях: сначала повышается их взаимодействие с рецепторами печени, затем они становятся активными хемоаттрактантами (раздражителями) для моноцитов. Активированные моноциты крови проникают в субэндотелиальное пространство сосудов, превращаясь в макрофаги, которые фагоцитируют модифицированные ЛПНП и превращаются в «пенистые» клетки, то есть клетки, переполненные эфирами ХС. Активированные макрофаги и пенистые клетки освобождают биологически активные вещества: факторы роста, противовоспалительные цитокины, молекулы адгезии. В результате в большей степени усиливаются процессы проницаемости эндотелия и роста атеросклеротической бляшки, что в конечном итоге ведет к сужению просвета сосуда и/ или разрыву покрышки бляшки с образованием внутрисосудистого тромба. Именно ХС ЛПНП, учитывая его важную роль в формировании атеросклеротической бляшки, представляют главную мишень гиполипидемической терапии.
Катаболизм ЛПНП осуществляется тремя путями: метаболизацией внепеченочными паренхиматозными клетками (основной путь), системой фагоцитирующих клеток (клетками-скэвенджерами или «мусорщиками») и печенью. В лизосомах периферических клеток из ЛПНП освобождается свободный ХС, который по механизму обратной связи регулирует синтез ХС внутри клетки путем ингибирования фермента ГМГ-КоА-редуктазы. Этот фермент катализирует преобразование ГМГ-КоА в мевалоновую кислоту — ключевой момент синтеза ХС. Клетки-скэвенджеры поглощают только модифицированные ЛПНП, которые изменили свои свойства вследствие процесса свободнорадикального окисления липидов и превращаются в вышеуказанные «пенистые» клетки.
Излишек ХС в составе ЛПНП поступает в печень, взаимодействуя со специфическими клеточными рецепторами, где он используется для образования желчных кислот. В патологических условиях атерогенные липопротеины, богатые ХС (ЛПНП, ЛППП, ЛПОНП), инициируют механизмы формирования атеросклеротической бляшки в артериальной стенке.
ЛПВП принято считать антиатерогенным фактором. Низкие концентрации ХС ЛПВП могут быть связаны не только с ранним развитием атеросклероза, но также с ухудшением прогноза для лиц, имеющих ССЗ. Отрицательные эффекты низкого содержания ХС ЛПВП зависят от множества медико-социальних причин и тесно связаны с общим риском ССЗ в урбанизованных обществах, где люди курят, ведут малоподвижный образ жизни, употребляют большое количество продуктов животного происхождения. Низкие концентрации ЛПВП метаболически связаны с высокими концентрациями ЛППП и ЛПОНП. Эксперименты на животных продемонстрировали антиатерогенную активность ЛПВП. Участие ХС ЛПВП в транспорте ХС от других органов к печени или «обратный транспорт ХС» — основной механизм, благодаря которому ХС ЛПВП может защитить стенку артерии. Существуют также многочисленные механизмы, объясняющие его прямой защитный эффект: стимуляция простациклина, блокада синтеза фактора активации тромбоцитов в эндотелиальных клетках, стимуляция антиоксидантной активности, ингибирование адгезии моноцитов к эндотелиальным клеткам на ранних стадиях атеросклеротического процесса и др. Как и для ТГ, не определены точные целевые уровни, до которых следует повышать концентрацию ХС ЛПВП. Однако ХС ЛПВП <1 ммоль/л (40 мг/дл) у мужчин и <1,2 ммоль/л (46 мг/дл) у женщин считают маркером повышенного сердечно-сосудистого риска. При выявлении этого врач должен обратить внимание пациента на необходимость изменения образа жизни, снижения высокого уровня ХС ЛПНП и нормализации АД.
Комбинацию умеренно повышенного уровня ТГ и низких концентраций ХС ЛПВП обычно отмечают у пациентов с ранним манифестированием атеросклеротического поражения. Выделяют так называемую «атерогенную дислипидемию» или «атерогенную триаду», которая включает повышение суммарной концентрации ХС ЛППП и ХС ЛПОНП, наличие маленьких плотных частиц ХС ЛПНП и низкую концентрацию ХС ЛПВП. Комбинация высокого уровня ТГ и низкого уровня ХС ЛПВП характерна не только для пациентов с сахарним диабетом ІІ типа, но также и для пациентов с абдоминальным ожирением и ассоциируется с высоким риском сердечно-сосудистой патологии.
Излишек свободного ХС, который накопился в периферических клетках, ЛПВП удаляют путем связывания апо-А со специфическими рецепторами. «Нагруженные» ХС ЛПВП частично транспортируют его назад из тканей в печень, где он катаболизируется с образованием желчных кислот, частично передают ХС ЛПОНП, в результате чего последние превращаются в ЛППП, а потом в ЛПНП. Таким образом замыкается круг преобразований ХС. Выделяют два подкласса ЛПВП: ЛПВП-2 и ЛПВП-3. ЛПВП-3 имеют дискоидную форму и именно они начинают активный захват ХС из периферических клеток и макрофагов, превращая в ЛПВП-2 сферические частицы, богатые эфирами ХС и фосфолипидами. Апобелки апо-А1 и апо-А2 представляют собой основные белки ЛПВП, с помощью которых последние связываются с рецепторами печени и клетками сосудистой стенки. Уровень ХС ЛПВП в плазме крови находится в обратной зависимости от развития атеросклероза: чем ниже содержание ХС ЛПВП, тем выше вероятность развития атеросклероза.
Гипертриглицеридемия также связана с риском развития атеросклероза, но эта связь не настолько важна, как при гиперхолестеринемии, и продолжает обсуждаться клиницистами. Мета анализ 17 популяционных исследований, включающих более 46 000 мужчин и более чем 10 000 женщин, показал, что риск ССЗ нарастал с увеличением уровня гипертриглицеридемии, но был более тесно связан с умеренной, чем с тяжелой гипертриглицеридемией. Это объясняется тем, что первая происходит путем накопления в плазме ХС ЛППП и маленьких частиц ХС ЛПОНП, тогда как последняя обусловлена накоплением большого количества ХС ЛПОНП и ХМ.
Связь гипертриглицеридемии с атеросклерозом в данное время объясняют тремя патогенетическими механизмами:
1. Подобно ХС ЛПВП, некоторые богатые ТГ липопротеины могут проникать в стенку артерии, где со временем накапливаются, вызывая атерогенное действие. Это касается маленьких частиц ХС ЛПОНП и ХС ЛППП.
2. Метаболизм богатых ТГ липопротеинов тесно связан с метаболизмом атерогенных ХС ЛПНП и ХС ЛППП. Маленькие плотные ЛПНП появляются в плазме при концентрации ТГ >1,4 ммоль/л. Высокие концентрации ТГ обычно отмечают у лиц с низкими концентрациями антиатерогенных ЛПВП.
3. Гипертриглицеридемия часто сочетается с другими факторами риска ССЗ, и такое сочетание может потенцировать раннее начало болезни. Перечень этих факторов включает метаболический синдром, сахарный диабет II типа, АГ, низкую физическую активность, ожирение, низкое потребление фруктов и овощей и т.д. При этом уровни ТГ >1,7 ммоль/л (150 мг/дл) считают маркером повышенного сердечнососудистого риска, однако концентрация ТГ <1,7 ммоль/л не рассматривается как целевой уровень терапии.
Сердечно-сосудистый риск опосредствован также, как указывалось, концентрацией белковых компонентов липопротеинов — апопротеинов. В настоящее время обсуждается роль 5 классов аполипопротеинов — А, В, С, Д и Е. Аполипопротеины или апопротеины выполняют три основные функции: 1) взаимодействуют с фосфолипидами, помогают солюбилизировать эфиры ХС и ТГ; 2) регулируют взаимодействие липидов с ферментами — липопротеинлипазой; 3) обеспечивают связывание липопротеинов со специфическими рецепторами клеточной мембраны в местах их взаимодействия. Так, апопротеин А (апо-А) — главный компонент белка ЛПВП. Низкие концентрации его субчастицы апо-А1, подобно низким концентрациям ХС ЛПВП, связаны с ухудшением прогноза ССЗ.
В противовес этому апопротеин B (aпo-В) — главный компонент белка ЛПНП, ЛППП, ЛПОНП и ХМ. Однако ХМ обычно не присутствуют в плазме крови натощак, и почти весь aпo-В находится в атерогенных липопротеинах. Концентрация aпo-В может служить маркером атерогенности липопротеинов плазмы крови, особенно у пациентов с гипертриглицеридемией и у людей с нормальными концентрациями ХС ЛПНП, так как отмечено, что уровни aпo-В >150 мг/дл тесно связаны с повышенным сердечно-сосудистым риском.
Большое значение для понимания патогенеза и лечения больных с первичными гипертриглицеридемиями послужило открытие особенностей метаболизма аполипопротеина Е (апо-Е) и мутаций гена липопротеиновой липазы. Апо-Е — один из ключевых регуляторов уровня липидов плазмы. Активность апо-Е-рецепторов печени, в частности, определяет степень катаболизма богатых ТГ частиц или ремнантов ЛПОНП и ЛППП. Большое клиническое значение в липидном обмене играют разные изоформы апо-Е. Изоформа апо-Е3 считается «нормальной». Наоборот, гомозиготность по аллели апо-Е2/апо-Е2 является причиной развития редкого типа гиперлипидемии — III типа.
Описано также участие в процессах атерогенеза липопротеина (а), который по физико-химическим свойствам похож на ЛПНП, но в дополнение имеет апо-а (читать как «эй» маленькое) и в свою очередь имеет структурное сродство с молекулой плазминогена. Липопротеин (а) имеет атерогенные и тромбогенные свойства, повышение его уровня в плазме крови >30 мг/дл тесно коррелирует с развитием и прогрессированием атеросклероза коронарных и каротидных артерий. Липопротеин (а) — это атерогенная липопротеиновая частица с плотностью 1,051–1,082 г/мл, со средним диаметром 26 нм, похожа на ЛПНП; основным отличием между ними служит наличие в составе липопротеина (а) молекулы уникального апобелка апо-а, ковалентно связанного с молекулой апо-В-100. Показано, что первичная структура активных участков апо-а имеет 98% гомологии с молекулой плазминогена. Это структурное сходство обеспечивает участие липопротеина (а) в процессах атеротромбогенеза путем прикрепления тромба на участках сосудистой стенки, богатых липопротеином (а). Концентрация липопротеина (а) в крови человека прямо зависит от степени атеросклеротических поражений коронарных, каротидных и периферических артерий. В данное время липопротеин (а) рассматривают как независимый биохимический маркер атеросклероза.
Степень атерогенности липопротеинов зависит не только от их концентрации, но и от их размера. Наименьшими из липопротеинов являются ЛПВП, они легко могут проникать в стенку артерии и покидать ее, не вызывая атеросклероз. В то же время ЛПНП, ЛППП и маленькиеЛПОНП имеют также небольшие размеры, что позволяет им проникнуть в стенку артерии, но при этом, будучи модифицированными в результате окисления, могут там задерживаться и постепенно инициировать атеросклеротический процесс. Наибольшие липопротеины ХМ и большие ЛПОНП не являются собственно атерогенными, однако высокие концентрации этих больших богатых ТГ липопротеинов могут вызвать заболевание поджелудочной железы.
Установлено, что большинство ХС в плазме крови обычно находится в виде ХС ЛПНП. За последние 25 лет можно определить несколько ключевых достижений в области исследований обмена липидов, которые тем или другим способом повлияли на клиническую практику. Одно из них — это открытие Мишелем Брауном и Джозефом Гольдштейном механизма генетических нарушений при наследственной гиперхолестеринемии. Расшифровка его в виде дефекта рецепторов к ЛПНП стала основанием для присуждения этим выдающимся ученым Нобелевской премии в 1985 г. и дала ключ к пониманию механизма атерогенности липопротеинов.
Выявлена положительная связь между уровнем общего ХС, а также ХС ЛПНП и риском ССЗ. Это относится как к пациентам без кардиальной патологии, так и к пациентам с установленной коронарной болезнью; к мужчинам и женщинам, хотя общий уровень риска у женщин ниже; распространяется на все возрастные группы. В то же время общий сердечно-сосудистый риск, согласно Рекомендациям Европейского общества кардиологов, зависит не только от уровня ХС, но и от целого ряда других факторов риска: возраста, пола, курения и АГ. Гипертриглицеридемия, низкий уровень ХС ЛПВП и сахарный диабет значительно ухудшают эффекты ХС ЛПНП даже при умеренно повышенных их концентрациях. Вместе с тем коронарную болезнь сердца выявляют довольно редко в популяциях с уровнем общего ХС <3–4 ммоль/л (115–155 мг/дл ), даже в присутствии других факторов риска. Напротив, коронарная болезнь сердца неминуема у пациентов, которым не проводилась терапия, с тяжелыми формами семейной гиперхолестеринемии даже при отсутствии других факторов риска, что подтверждает ведущую роль дислипидемий в атерогенезе. ХС ЛПНП может быть значительно повышенным у пациентов с обычной формой гетерозиготной семейной гиперхолестеринемии [7–12 ммоль/л (270–465 мг/ дл)] и очень высоким при редчайшей гомозиготной форме [12–20 ммоль/л (465–770 мг/дл)].
Подобно другим классам, ЛПНП неоднородные. Более всего атерогенны маленькие, плотные ЛПНП. Они появляются в плазме при концентрации ТГ >1,4 ммоль/л и связаны с ранним развитием коронарной болезни у лиц молодого возраста. Атерогенность ХС ЛПНП подтверждена результатами эпидемиологических и клинических исследований по ангиографическим или клиническим конечным точкам. Снижение ХС ЛПНП должно быть основной задачей как первичной, так и вторичной профилактики.
Е.И. Митченко "Дислипидемии: диагностика, профилактика, лечение"
medbe.ru
Эфир - олеиновая кислота - Большая Энциклопедия Нефти и Газа, статья, страница 2
Эфир - олеиновая кислота
Cтраница 2
Применяют в текстильной промышленности в качестве основы для получения лаков, покрытий, эмали, красок, а также в горной промышленности. Эфиры олеиновой кислоты являются пластификаторами. [16]
В жирах олеиновая кислота используется в пищу; в промышленности в виде зфиров различных спиртов, а также глицеридов ( одна или в смеси с другими кислотами) применяется в качестве основы для производства лаков, эмалей, олиф, различных других предохранительных покрытий, красок. При производстве пластмасс эфиры олеиновой кислоты используются как пластификаторы. Значительное применение в технике нашли соли олеиновой кислоты ( мыла), в частности для промывания шерсти, так как они лучше растворимы, чем мыла твердых ( предельных) кислот. [17]
Совершенно так же удается восстановление эфира олеиновой кислоты. [18]
Мнения о применимости продуктов этерификации олеиновой кислоты СН3 ( СН2) СН СН ( СН2) СООН в качестве пластификаторов очень разноречивы. В американской литературе часто встречаются указания, что эфиры олеиновой кислоты чаще используются при переработке каучука разных марок, реже при переработке виниловых полимеров. [19]
Большинство современных зубных паст содержит мягкие полирующие вещества, обычно осажденный мел, совместно с глицерином, сорбитом или другим связующим веществом, а также мыло или синтетическое моющее средство. Наиболее широкое применение имеют алкилсульфаты и сульфоэтерифицированные масла, эфиры олеиновой кислоты и моноглицериды жирных кислот, хотя успешно используются также лаурилсульфоацетат и некоторые другие соединения. Вещества, употребляемые в зубных пастах, подвергают специальной очистке. В качестве безвредных и вполне пригодных компонентов зубной пасты в США признаны алкилсульфаты. [20]
Для невысыхающих масел представляют ценность только те процессы изомеризации, которые приводят к повышению точки плавления ( застывания) масел. В этот тип реакций входит элаидиновая перегруппировка ( цис-гранопревращение) эфиров олеиновой кислоты и других мононенасыщенных жирных кислот. [21]
Восстановление по Буво - Блану имеет также и промышленное значение для получения жирных спиртов из эфиров жирных кислот ( см. стр. Так как в противоположность каталитическому гидрированию при этом не затрагиваются двойные олефиновые связи, то этот метод особенно пригоден для получения ненасыщенных спиртов, например из эфиров олеиновой кислоты или спермацета ( см. стр. [22]
Восстановление по Буво - Блану имеет также и промышленное значение для получения жирных спиртов из зфиров жирных кислот ( см. стр. Так как в противоположность каталитическому гидрированию при этом не затрагиваются двойные олефиновые связи, то этот метод особенно пригоден для получения ненасыщенных спиртов, например из эфиров олеиновой кислоты или спермацета ( см. стр. [23]
Смазка близка по кислотному составу к пальмовому маслу, но существенно отличается от него по составу спиртов. Если пальмовое масло состоит в основном из триглицеридов натуральных жирных кислот фракции Cis-Сп, главным образом олеиновой и пальмитиновой [1], то синтетическая смазка СТП-1 представляет смесь сложных эфиров двухосновного ( триэтилен-гликоля) и одноосновного спиртов ( изобутилового) и синтетических жирных кислот фракции Сп - С20 с добавкой триэтиленгли-колевого эфира олеиновой кислоты. [24]
Смазка близка по кислотному составу к пальмовому маслу, но существенно отличается от него по составу спиртов. Если пальмовое масло состоит в основном из триглицеридов натуральных жирных кислот фракции Cis-Сп, главным образом олеиновой и пальмитиновой [1], то синтетическая смазка СТП-1 представляет смесь сложных эфиров двухосновного ( триэтилен-гликоля) и одноосновного спиртов ( изобутюювого) и синтетических жирных кислот фракции Сп - С2о с добавкой триэтиленгли-колевого эфира олеиновой кислоты. [25]
Посредством кинетических и потенциальных кривых установлена последовательность в насыщении эфиров обеих кислот. Эфиры олеиновой кислоты гидрируются с меньшей скоростью при бол-ее высоком значении потенциала катализатора, чем эфиры более непредельной линолевой кислоты. [26]
Однако важно помнить, что на практике, как уже упоминалось, имеют дело с динамическими величинами поверхностного натяжения ( обычно измеряемые краевые углы также являются не совсем равновесными) и что равновесные величины редко достижимы в разумное время, особенно в случае вязких жидкостей, применяемых во многих процессах технологии пигментов ( растворы полимеров и пр. Кинетика адсорбции ( включающая скорость, с которой могут ориентироваться адсорбированные молекулы в поверхностном слое с образованием энергетически выгодной оптимальной структуры) - важная характеристика технических систем и смесей. Примерами эффективных смачивающих веществ могут служить ди-алкилсульфосукцинаты или сульфированные эфиры олеиновой кислоты. [27]
Для отмывки остатков инсектицидов, содержащих свинец, обычно пользуются 1 - 2 / 0-ными растворами соляной кислоты. По вопросу о том, полезны ли при этом добавки смачивателей и моющих средств, мнения расходятся, так как имеющихся к настоящему времени данных недостаточно для того, чтобы можно было прийти к окончательному решению о целесообразности таких добавок. Однако известно, что эффективно действующими добавками для этой цели являются суль-фоэтерифицированные эфиры олеиновой кислоты. [28]
Если реакцию проводят при очень высокой температуре, в течение слишком длительного времени или при наличии высокой концентрации перекиси водорода, то наряду с образованием эпоксидного цикла происходит также гидроксили-рование в результате раскрытия цикла. Обычно реакцию проводят в течение 4 - 6 ч при 20 - 25 С, повышая температуру к концу реакции до 50 - 60 С. Гринспен и Голл 70 эпоксидировали эфиры олеиновой кислоты, смеси кислот соевого и хлопкового масла. [29]
Эфиры олеиновой кислоты и низших алифатических спиртов по летучести паров вполне отвечают требованиям, предъявляемым к пластификаторам. Однако большие размеры молекул эфиров затрудняют их совместимость с полимерами, заметно ограничивая области применения. Они совмещаются лишь в небольших количествах с нитратом целлюлозы, этилцеллюлозой, ацетобутиратом целлюлозы, полистиролом, полиэтиленом, поливинилхлоридом и сополимерами хлористого винила и винил-ацетата. Ацетат целлюлозы нельзя совмещать с эфирами олеиновой кислоты и низших алифатических спиртов, хотя эти эфиры способствуют повышению водостойкости пленкообразующего вещества и блеска покрытия. Бутил - и амилолеаты хорошо растворяют копалы, кумарон и эфиры канифоли. По наблюдениям автора, бутилолеат не растворяет производные целлюлозы. Это подтверждается также данными Крауса 11в, который отметил быстрое выделение растворителя из пленок нитрата целлюлозы, содержавших 50 % бутилолеата. Поливинилхлорид растворяется в бутилолеате при 170 G. При медленном охлаждении 4 % - ные растворы поливинилхлорида в бутилолеате мутнеют и превращаются в гель при 85 - 75 С. [30]
Страницы: 1 2 3
www.ngpedia.ru
Большая Энциклопедия Нефти и Газа, статья, страница 1
Эпоксикислота
Cтраница 1
Эпоксикислоты чувствительны к реагентам, расщепляющим оксирановые циклы. Кислотный гидролиз эпоксикислот приводит к расщеплению эпоксидного кольца с образованием дигидроксиалкано-вых кислот, кислый алкоголиз дает алкоксигидроксикислоты, взаимодействие с аминами приводит к аминогидроксикислотам, реакция с алкановыми кислотами дает ацилоксигидроксикислоты. Последние реакции, в основном, не обладают селективностью. [1]
Природные эпоксикислоты, входящие в состав липидов, представлены в основном ds - соединениями, выделенными из растений. [2]
Некоторые эпоксикислоты обнаружены в природе. Наиболее известна из них верноловая кислота, представляющая собой продукт эпоксидирования линолевой кислоты по С - 12 - С-13 двойной связи. [3]
В жировых депо накапливаются эпоксикислоты. [4]
Процесс стереохимически протекает аналогично превращению эфира эпоксикислоты XI в бициклический эфир XIII. Таким образом, что у образующегося из кислоты хлорлактона XVI при метанолизе, с одной стороны, происходит этерификация карбоксильной группы, а с другой - раскрытие тетрагидрофуранового кольца, приводящее к образованию ацетальной группировки. [5]
Диазометан реагирует со сложными эфирами а-оксокарбоновых кислот, присоединяясь по кетонной карбонильной группе с образованием соответствующих сложных эфиров эпоксикислот. [6]
Наличие двойной связи в молекуле ненасыщенной кислоты объясняет особенности дальнейшего превращения гидроперекисей и образование различных соединений: кето -, окси-и эпоксикислот, альдегидов, моно - и дикарбоновых кислот, двуокиси углерода, полимерных и других продуктов. Из ненасыщенных кислот наиболее изученной является олеиновая, широко используемая в качестве модельного объекта при исследовании окисления растительных масел. [7]
Эпоксикислоты чувствительны к реагентам, расщепляющим оксирановые циклы. Кислотный гидролиз эпоксикислот приводит к расщеплению эпоксидного кольца с образованием дигидроксиалкано-вых кислот, кислый алкоголиз дает алкоксигидроксикислоты, взаимодействие с аминами приводит к аминогидроксикислотам, реакция с алкановыми кислотами дает ацилоксигидроксикислоты. Последние реакции, в основном, не обладают селективностью. [8]
Обсуждена реакция между НС1 и метиловыми эфираыи жирных эпоксикислот. [9]
Молекулы этих моноэпоксидов имеют два хиральных центра. Синтетические продукты являются рацемическими соединениями, тогда как природные эпоксикислоты ( см. разд. Температуры плавления изомерных ис-эпоксистеариновых кислот чередуются, однако в случае транс-изомеров это явление не обнаруживается. [10]
Состав продуктов сильно зависит от условий окисления олеиновой кислоты. Так, при 50 в присутствии стеарата кобальта [47] до 90 % всех продуктов составляют а, ( З - ненасыщенные кислоты и их димеры, около 5 % - эпоксикислоты. [12]
Кауфман и Ко [93] разделили длинноцепочечные кетоки-слоты, оксикислоты и лактоны на кизельгуре, пропитанном фракцией минерального масла с температурой кипения 240 - 250 С. Растворителем служила смесь уксусной кислоты и воды ( 4: 1), насыщенная на 80 % пропитывающей жидкостью. Кауфман и Макус [15] анализировали жирные эпоксикислоты и эписульфидоки-слоты на пропитанном ундеканом силикагеле с 80 % - ной уксусной кислотой в качестве подвижной фазы. [13]
Кислоты типа акриловой реагируют с надкислотами очень медленно. Реакция ускоряется при применении более энергичных окислителей ( над-трифторуксусная кислота) или более жестких условий. Это приводит к значительному снижению выходов соответствующих эпоксикислот и сильно ограничивает возможность использования этой реакции в препаративных целях. [14]
В таких случаях адсорбентом может служить кремневая кислота, а элюирующим растворителем - гексан или петролейный эфир с добавкой от 3 до 10 % диэтилового эфира, причем концентрация этой добавки зависит от характера анализируемых соединений. Обнаруживают соединения этой группы опрыскиванием 50 % - ной серной кислотой с последующим 15-минутным нагреванием при 105 - 110 С. В табл. 32.9 приведены величины Rf некоторых эпоксикислот. Кауфман и Макус [185] разделили несколько эпоксикислот на силикагеле G, пропитанном 15 % - ным раствором ундекана в петролейном эфире. Обнаруживающим реактивом в этом случае служила 96 % - ная уксусная кислота. [15]
Страницы: 1 2
www.ngpedia.ru


















