Содержание
Ацетоуксусный эфир — свойства, получение и применение
Содержание
- Свойства
- Синтез
- Применение
- Биологическое действие
Ацетоуксусный эфир , также этиловый эфир ацетоуксусной кислоты, этилацетоацетат — органическое соединение, сложный эфир, бесцветная подвижная жидкость со своеобразным нерезким запахом. Растворяется в воде, смешивается с этанолом и диэтиловым эфиром.
Свойства
Для ацетоуксусного эфира, как и для других 1,3-дикарбонильных соединений характерна кето-енольная таутомерия:
- ,
Согласно правилу Эльтекова енольные формы карбонильных соединений неустойчивы. Однако в ряде случаев енольные формы могут быть достаточно стабильными. Например, енольный таутомер стабилизирован за счет образования сопряжённой системы ( (H):О—C(CH3)=C(H) —C(:OC2H5)=O: ; см. 2-ю формулу енольной формы на рис., R — CH3, R’ — C2H5) и внутримолекулярной водородной связи между протоном и соседним карбонильным кислородом. Положение равновесия и, соответственно, соотношение таутомеров зависит от растворителя и температуры. Так, в чистом ацетоуксусном эфире при комнатной температуре концентрация енольной формы составляет 7,5 % (кетонной — 92,5 %). Равновесие сдвигается в сторону енольной формы при уменьшении полярности растворителя, так, при 18 °C доля енольной формы в водном растворе составляет 0,4 %, в диэтиловом эфире — 27,1 %, в циклогексане — 46,4 %.
Положение равновесия и, соответственно, соотношение таутомеров зависит от растворителя и температуры. Так, в чистом ацетоуксусном эфире при комнатной температуре концентрация енольной формы составляет 7,5 % (кетонной — 92,5 %). Равновесие сдвигается в сторону енольной формы при уменьшении полярности растворителя, так, при 18 °C доля енольной формы в водном растворе составляет 0,4 %, в диэтиловом эфире — 27,1 %, в циклогексане — 46,4 %.
Кетонная форма ацетоуксусного эфира может быть выделена из равновесной смеси вымораживанием, енольная — вакуумной перегонкой в кварцевой посуде. Скорость установления кето-енольного равновесия зависит от температуры и материала сосуда, чистые таутомеры хранятся в кварцевой посуде при низких температурах (-80°C — охлаждение сухим льдом).
Содержание енольной формы определяется бромометрически: бром практически мгновенно присоединяется по двойной связи енола, что сопровождается исчезновением желто-оранжевой окраски молекулярного брома.
Реакциями енольной формы также обусловлено O-ацилирование ацетоуксусного эфира хлорангидридами карбоновых кислот в пиридине, при этом образуются сложные эфиры β-гидроксикротоновой кислоты:
- CH3(HO)C=CHCOOC2H5 + ROCl CH3(ROO)C=CHCOOC2H5 + HCl
При взаимодействии с пентахлоридом фосфора гидроксил енольной формы ацетоуксусного эфира замещается на хлор с образованием этилового эфира β-хлоркротоновой кислоты:
- CH3(HO)C=CHCOOC2H5 + PCl5 CH3ClC=CHCOOC2H5 + POCl3 + HCl
С металлами ацетоуксусный эфир образует хелаты, в которых ацетилацетат-анион выступает в роли бидентантного лиганда, так, с солями трехвалентного железа ацетоуксусный эфир образует окрашенный в пурпурный цвет комплекс:
Под действием сильных оснований и щелочных металлов ацетоуксусный эфир депротонируется с образованием резонансно стабилизированного аниона:
Образование натриевой соли ацетилацетата (натрийацетоуксусного эфира) под действием алкоголята натрия — в том числе и под действием этилата натрия, образующегося in situ при действии металлического натрия на ацетоуксусный эфир — широко используется в синтетической практике вследствие высокой нуклеофильности аниона.
Ацетилацетат натрия в реакциях с мягкими электрофилами выступает в роли C-нуклеофила. Так, он легко алкилируется галогеналкилами с образованием соответствующих алкилацетоуксусных эфиров, из которых, в свою очередь, могут быть получены и затем проалкилированы натриевые производные:
- CH3COCH2COOC2H5 + EtONa CH3COCH—COOC2H5 Na+ + EtOH
- CH3COCH—COOC2H5 Na+ + RHal CH3COCHRCOOC2H5 + NaHal
В безводных условиях в присутствии бикарбоната натрия ацетоуксусный эфир самоконденсируется с образованием дегидроацетовой кислоты:
| 2 | → |
| Ацетоуксусный эфир | Дегидроацетовая кислота |
Под действием серной кислоты на ацетоуксусный эфир происходит самоконденсация двух молекул эфира с замыканием α-пиронового цикла, ведущая к образованию изодегидроацетовой кислоты.
Под действием водных кислот или разбавленных растворов щелочей ацетоуксусный эфир омыляется с образованием нестабильной ацетоуксусной кислоты, которая в мягких условиях декарбоксилируется с образованием ацетона:
- CH3COCH2COOC2H5 + H2O CH3COCH2COOH + C2H5OH
- CH3COCH2COOH CH3COCH3 + CO2 + H2O
Аналогичным образом ведут себя и моно- и дизамещенные ацетоуксусные эфиры, полученные алкилированием натрийацетоуксусного эфира (кетонное расщепление), эта реакция используется для синтеза замещенных метилкетонов.
Иначе протекает взаимодействие ацетоуксусного эфира с концентрированными растворами щелочей: в этом случае протекает отщепление ацетильной группы с образованием двух молекул уксусной кислоты (кислотное расщепление), эта реакция идет и с замещенными ацетоуксусными эфирами и используется для синтеза гомологов уксусной кислоты через алкилпроизводные ацетоуксусного эфира:
- CH3COCHRCOOC2H5 + OH— + H2O CH3COO— + RCH2COOH + C2H5OH
Синтез
Классическим методом синтеза ацетоуксусного эфира является сложноэфирная конденсация этилацетата в присутствии этанола под действием металлического натрия, катализатором конденсации является образующийся in situ этилат натрия. Образующийся натрийацетоуксусный эфир действием разбавленной минеральной кислоты переводят в ацетоуксусный эфир:
Образующийся натрийацетоуксусный эфир действием разбавленной минеральной кислоты переводят в ацетоуксусный эфир:
Ацетоуксусный эфир также может быть синтезирован ацилированием этанола дикетеном, этот метод является промышленным методом синтеза:
Применение
Ацетоуксусный эфир широко применяется в органическом синтезе.
Алкилирование натрийацетоуксусного эфира 2 с последующим кетонным либо кислотным расщеплением моно- и дизамещенных ацетоуксусныых эфиров 3 используется как препаративный метод синтеза метилкетонов 4 и замещенных уксусных кислот 5:
Будучи 1,3-дифункциональным реагентом, он применяется для синтеза гетероциклических соединений. В промышленности применяется в производстве фармацевтических препаратов (пирамидона, акрихина, витамина B1), ряда органических веществ.
В фотографии использовался как жёлтая диффундирующая цветообразующая компонента, образующая краситель в процессе цветного фотографического проявления.
Биологическое действие
Ацетоуксусный эфир малоядовит, ЛД50 для крыс около 3895 мг/кг.
В больших количествах может обладать кожнораздражающим действием. Всасывается через кожу. ПДК 10 мг/м³ по ГОСТ 12.1.007-76.
|
| |||||||||
|
| ||||||||
Claisen Condensation
Портал органической химии
Реакции >> Имя Реакции
Дополнительная информация
Литература
Родственные реакции
Конденсация Дикмана
Синтез β-кетоэфиров
основание, такое как этоксид натрия, дает β-кетоэфиры. Движущая сила
Движущая сила
является образование стабилизированного аниона β-кетоэфира. Если два
используются разные сложные эфиры, по существу статистическая смесь всех
обычно получается четыре продукта, и препарат не имеет
высокая синтетическая полезность.
Однако, если один из эфирных партнеров имеет енолизуемые α-водороды
а другой нет (например, ароматические сложные эфиры или карбонаты), смешанные
реакция (или перекрестная реакция Кляйзена) может быть синтетически полезной. Если кетоны или
нитрилы используются в качестве донора в этой реакции конденсации,
Получают соответственно β-дикетон или β-кетонитрил.
Использование более прочных оснований, т.е. амид натрия или гидрид натрия вместо
этоксид натрия часто увеличивает выход.
Внутримолекулярная версия известна как
Конденсация Дикмана.
Последняя литература
Общее, надежное и стереокомплементарное получение α,β-дизамещенных
α,β-ненасыщенные сложные эфиры
H. Nakatsuji, H. Nishikado, K. Ueno, Y. Tanabe, Org. лат. , 2009 ,
Nakatsuji, H. Nishikado, K. Ueno, Y. Tanabe, Org. лат. , 2009 ,
11 , 4258-4261.
Прямое образование углерод-углеродной связи посредством хемоселективной мягкой енолизации тиоэфиров: удивительно простая и универсальная реакция кросс-Клайзена, примененная к синтезу LY294002
Г. Чжоу, Д. Лим, Д. М. Колтарт, Org. лат. ,
2008 ,
10 , 3809-3812.
Мягкий и эффективный трифлат пентафторфениламмония (PFPAT) — катализируемый
C-Ацилирование енолсилиловых эфиров или кетенсилил(тио)ацеталей кислотой
Хлориды
А. Иида, Дж. Осада, Р. Нагасе, Т. Мисаки, Ю. Танабэ, Org. лат. , 2007 ,
9 , 1859-1862.
Мощная Ti-Crossed Claisen конденсация между кетенсилил ацеталями или
Тиоацетали и хлорангидриды или кислоты
А. Иида, С. Наказава, Т. Окабаяси, А. Хории, Т. Мисако, Ю. Танабэ, Org. лат. , 2006 ,
8 , 5215-5218.
Синтез трифторметилкетонов посредством тандемной конденсации Кляйзена и
Retro-Claisen C-C Bond-Cleavage Reaction
Д.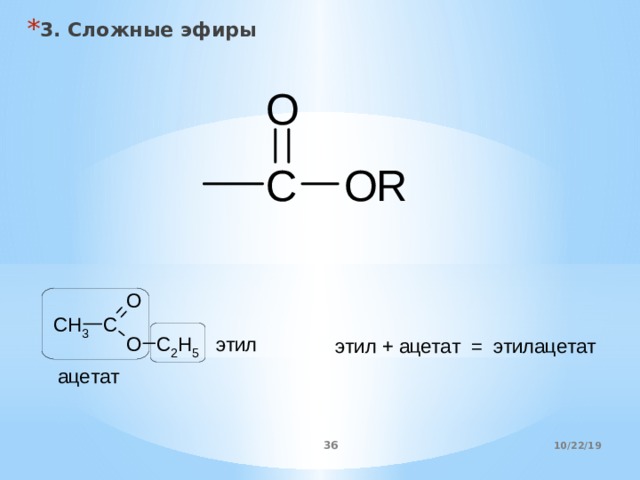 Ян, Ю. Чжоу, Н. Сюэ, Дж. Цюй, J. Org. хим. , 2013 ,
Ян, Ю. Чжоу, Н. Сюэ, Дж. Цюй, J. Org. хим. , 2013 ,
78 , 4171-4176.
Последовательный процесс Михаэля-Клайзена для производного циклогексан-1,3-диона (CDD)
Синтез из незамещенного и замещенного ацетона
Д. Шарма, Бандна, А.К. Шил, Б. Сингх, П. Дас, Synlett , 2012 , 23 ,
1199-1204.
«Однореакторный» синтез 4-замещенного 1,5-диарил-1 H -пиразол-3-карбоновой кислоты
Кислоты через стерически затрудненную конденсацию Кляйзена, опосредованную MeONa / LiCl-Knorr
Последовательность реакции-гидролиза
Ж.-А. Цзян, К.-Ю. Ду, К.-Х. Гу, Ю.-Ф. Джи, Синлетт , 2012 , 23 ,
2965-2968.
ЭТИЛАЦЕТОАЦЕТАТ — Ataman Kimya
№ CAS: 141-97-9
EC/LIST NO.: 205-516-1
Этилацетоацетат органического соединения (ЭАА) представляет собой этиловый эфир ацетоуксусной кислоты.
Этилацетоацетат представляет собой бесцветную жидкость.
Этилацетоацетат широко используется в качестве промежуточного химического вещества в производстве самых разных соединений.
Этилацетоацетат используется в качестве ароматизатора пищевых продуктов.
Этилацетоацетат получают в промышленных масштабах путем обработки дикетена этанолом.
Приготовление этилацетата представляет собой классическую лабораторную процедуру.
Этилацетоацетат получают конденсацией Кляйзена из этилового эфира ацетоацетата.
Два моля этилацетоацетата конденсируются с образованием по одному молю этилацетоацетата и этанола.
Этилацетоацетат двухосновный:
Ch4C(O)Ch3CO2Et + NaH → Ch4C(O)CH(Na)CO2Et + h3
Ch4C(O)CH(Na)CO2Et + BuLi → LiCh3C(O)CH(Na)CO2Et + BuH
Этилацетоацетат подвержен кето-енольной таутомерии.
В чистой жидкости при 33 °С енола содержится 15% от общего количества.
Этилацетоуксусная кислота является строительным блоком в органическом синтезе, поскольку протоны от альфа до карбонильных групп являются кислыми, и образующийся карбанион подвергается нуклеофильному замещению.
Этилацетоацетат часто используется в синтезе ацетоуксусного эфира, подобно диэтилмалонату в синтезе малонового эфира или конденсации Кнёвенагеля.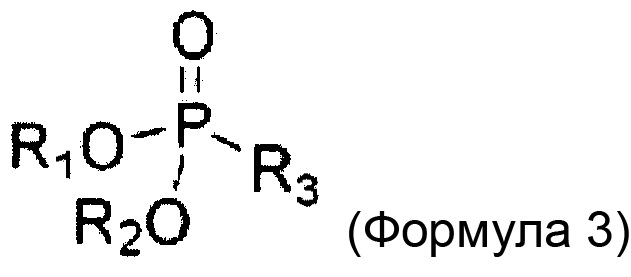
Также возможно последующее термическое декарбоксилирование.
Дианион этилацетоацетата также является полезным строительным блоком, за исключением того, что электрофил добавляется к концевому углероду.
Стратегию можно изобразить в следующем упрощенном виде:
LiCh3C(O)CH(Na)CO2Et + RX → RCh3C(O)CH(Na)CO2Et + LiX
Подобно поведению ацетилацетона, енолят этилацетоацетата также может служить бидентатным лигандом.
Например, он образует фиолетовые координационные комплексы с солями железа (III):
Этилацетоацетат переэтерифицируется с образованием бензилацетоацетата по механизму, включающему ацетилкетен.
Этиловый (и другие) ацетоацетаты нитрозата легко с эквимолярным нитритом натрия в уксусной кислоте с получением соответствующих сложных эфиров оксиминоацетоацетата.
Их восстановление растворением цинка в уксусной кислоте в присутствии кетоэфиров или бета-дикетонов представляет собой синтез пиррола Кнорра, полезный для получения порфиринов.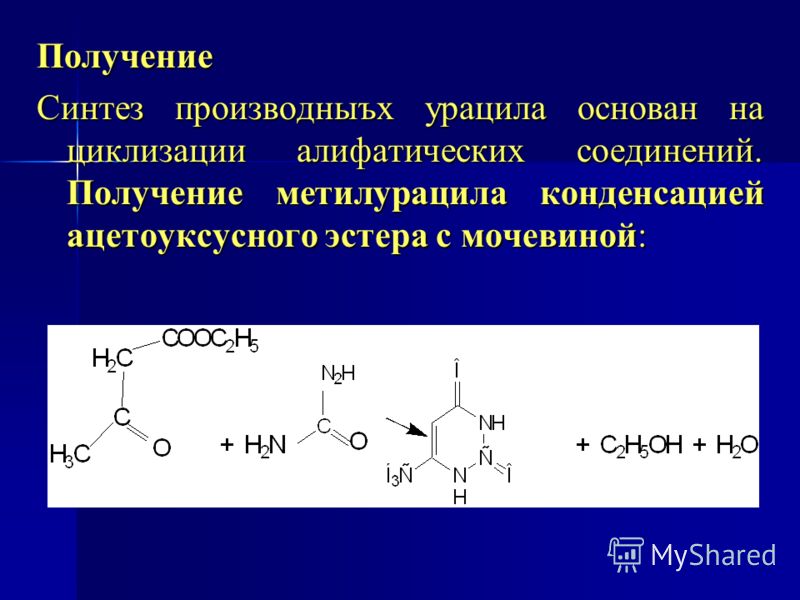
Этилацетоацетат (Ch4COCh3COOC2H5), также называемый ацетоуксусным эфиром, широко используемый в качестве промежуточного соединения в синтезе многих разновидностей органических химических соединений.
В промышленности он используется в производстве синтетических лекарств и красителей.
Сложный эфир получают главным образом путем самоконденсации этилацетата, вызванной металлическим натрием.
Этилацетоацетат легко образует производные натрия, которые можно алкилировать и диалкилировать.
Полученные сложные эфиры могут быть превращены в кетоны или карбоновые кислоты.
Этилацетоацетат легко вступает в реакции конденсации и используется в синтезе пиридинов, хинолинов, фуранов, пиразолов, пирролов и пуринов.
Чистый эфир представляет собой бесцветную ароматную жидкость, кипящую с легким разложением при 180,4 °C (356,7 °F).
Плотность : 1,03 г/см3 (20 °C)
Предел взрываемости: 1,0 — 54 %(V)
Температура вспышки : 73,5 °C
Температура воспламенения: 350 °C
Температура плавления: -53,3 °C
Значение pH: 4,0 (110 г/л, H₂O, 20 °C)
Давление паров: 0,26 гПа (20 °C)
Растворимость: 130,3 г/л
Этилацетоацетат используется в качестве промежуточного продукта в органическом синтезе и в качестве сопромотора для ненасыщенных полиэфирных смол.
Этилацетоацетат широко используется в производстве красителей, чернил, духов, пластмасс и ароматизаторов.
Этилацетоацетат является важным исходным материалом для синтеза альфа-замещенных эфиров ацетоуксусной кислоты и циклических соединений, таких как производные пиразола, пиримидина и кумарина.
Этилацетоацетат действует как промежуточное звено в синтезе витаминов и фармацевтических препаратов.
Этилацетоацетат находит применение в качестве поглотителя формальдегида.
Этилацетоацетат – растворитель с температурой кипения 77°C.
Давление пара при комнатной температуре 97 гПа.
Этилацетоацетат имеет химическую формулу C4H8O2.
Этилацетоацетат легко растворяется в ацетоне и спиртах, но плохо растворяется в воде (80 г на литр).
Этил ацетоацетат (ЭАА) представляет собой бесцветную жидкость с фруктовым запахом, которая используется в качестве промежуточного химического вещества.
Этиловый ацетоацетат используется потребителями и профессиональными работниками.
Этилацетоацетат можно использовать в производстве красителей, чернил, лаков, покрытий, парфюмерии, пластмасс и пигментов для желтых красок.
Этилацетоацетат используется в качестве сопромотора с низким уровнем окрашивания для ненасыщенных полиэфирных смол.
Из-за фруктового запаха и отсутствия цвета этиловый эфир ацетоацетата можно использовать в качестве растворителя в ароматизаторах или в качестве приправы для пищевых продуктов.
Потребители могут использовать этиловый эфир ацетоацетата в средствах по уходу за воздухом, чистящих средствах и средствах для мебели, средствах для стирки и мытья посуды и многом другом.
Этилацетоацетат представляет собой органическое соединение, представляющее собой этиловый эфир ацетоацетата.
Химическая формула этого соединения C6h20O3 или Ch4COOCh3COOC2H5.
Это соединение представляет собой бесцветную жидкость с фруктовым ароматом, которая используется в качестве пищевого ароматизатора.
Этилацетоацетат также используется в качестве промежуточного химического вещества для производства различных типов химических соединений.
Это соединение также используется в промышленности при производстве синтетических красителей и лекарств.
Этилацетоацетат представляет собой промышленное соединение.
Этилацетоацетатная структура получается при обработке этанола дикетеном.
Производство этого соединения в лаборатории является очень хорошо известной процедурой.
Это делается с помощью процесса конденсации Кляйзена этилового эфира ацетоацетата.
Реакция дает одну молекулу этилового эфира ацетоацетата и одну молекулу этанола в результате конденсации двух молекул этилового эфира ацетоацетата.
Ch4COOCh3COOC2H5 является основной частью синтеза ацетоацетатного эфира.
Теперь, когда у вас есть краткое представление об этом соединении и его производстве.
Давайте теперь узнаем о синтезе эфира ацетоацетата.
систематически известный как этил 3-оксобутаноат
продукт конденсации Кляйзена из этилэтаноата (т.е. этил ацетоацетата) Ch4CO2Ch3Ch4
пример активного метиленового соединения
имеет относительно кислый а-протон, pKa = 11, поэтому енолят легко образуется с этоксидом, EtO-
могут быть легко замещены, затем гидролизованы и декарбоксилированы с образованием замещенного кетона.
Алкилирование активного метиленолята
Гидролиз сложного эфира до карбоновой кислоты
Декарбоксилирование b-кетокислоты
Этот процесс эквивалентен взятию R-X и замене X на Ch4C(=O)Ch3-
.
По сути, ацильная группа сложного эфира использовалась для активации енолята кетона в направлении алкилирования, а затем была удалена.
Этилацетоацетат является растворителем, используемым во многих областях, включая печатные краски, лаки и химикаты для ухода за автомобилем, а также при производстве пластмасс и резины.
В пищевой промышленности этил ацетоацетат используется при производстве ароматизаторов и в фармацевтической промышленности в качестве экстракционного растворителя при производстве фармацевтических препаратов.
Этилацетоацетат также является распространенным компонентом косметики и средств для снятия лака с ногтей.
Этилацетоацетат считается одним из наименее вредных для окружающей среды органических растворителей.
Этилацетоацетат очень эффективен, поскольку он легко расщепляется как на воздухе, так и в воде.
Органическое соединение этилацетоацетат (ЭАА) представляет собой этиловый эфир ацетоуксусной кислоты.
Этилацетоацетат в основном используется в качестве промежуточного химического вещества при производстве самых разных соединений, таких как аминокислоты, анальгетики, антибиотики, противомалярийные средства, антипирин и аминопирин, а также витамин B1; а также производство красителей, чернил, лаков, духов, пластмасс и пигментов для желтых красок.
В одиночку он используется в качестве ароматизатора для пищи.
Этилацетоацетат представляет собой сложный эфир этанола и уксусной кислоты.
Этилацетоацетат обычно производят для использования в качестве растворителя в больших масштабах.
Этилацетоацетат представляет собой умеренно полярный, прозрачный, бесцветный жидкий растворитель с легким фруктовым запахом.
Этилацетоацетат, также известный как этилэтаноат, является широко используемым растворителем в органическом синтезе, который хорошо смешивается с обычными органическими растворителями.
Этилацетоацетат является экономичным, высокоэффективным и легко разрушается как на воздухе, так и в воде одновременно.
Этилацетоацетат можно смешивать с неполярными растворителями, а также использовать для экстракции.
Этилацетоацетат используется для экстракции не только в фармацевтической промышленности и в промышленных целях, но и в производстве продуктов питания и напитков.
Этилацетоацетат имеет сладкий запах, который используется для придания фруктового вкуса конфетам, выпечке, жевательной резинке и т. д.
Этиловый ацетоацетат также используется для извлечения табака из сигарет, чайных листьев без кофеина и кофе без кофеина.
Процесс удаления кофеина из кофе может занять до десяти часов, зеленые кофейные зерна промывают раствором этилового эфира ацетоацетата, чтобы удалить из них кофеин.
Погружение зеленых кофейных зерен в воду размягчает зерна и растворяет кофеин.
Этилацетоацетат добавляется в воду, и кофеин связывается с химическим веществом из-за того, что вода содержит весь кофеин, а не кофейные зерна, содержащие кофеин.
Когда вода нагревается, этилацетат испаряется, унося с собой кофеин.
Этиловый ацетоацетат также содержится в вине.
Этиловый ацетоацетат также является распространенным эфиром в винах, помогая придать вину фруктовый вкус.
Этиловый ацетоацетат используется в качестве искусственного ароматизатора в мороженом и пирожных.
Органическое соединение этилацетоацетат (ЭАА) представляет собой этиловый эфир ацетоуксусной кислоты.
Этилацетоацетат в основном используется в качестве промежуточного химического вещества при производстве широкого спектра соединений, таких как аминокислоты, анальгетики, антибиотики, противомалярийные средства, антипирин и аминопирин, а также витамин B1; а также производство красок, чернил, лаков, духов, пластмасс и пигментов для желтых красок.
Этилацетоацетат используется отдельно в качестве ароматизатора для пищевых продуктов.
Химическая формула: Ch4CO · Ch3 COOC 2H 5.
Бесцветная жидкость с запахом.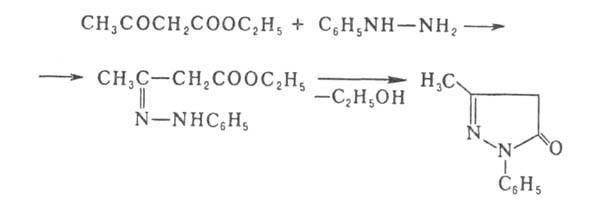
Температура плавления от -43 до -45 °С, температура кипения 181 °С. Растворим в воде, легко растворим в органических растворителях.
Между кетотипом и енолом существует таутомерное равновесие.
Используется для получения различного сырья органического синтеза.
Синтез осуществляют реакцией этилового эфира ацетоацетата с металлическим натрием или т.п.
Этилацетоацетат (EAA) представляет собой бета-кетоновый эфир, содержащий углерод (C), водород (H) и кислород (O) с эмпирической формулой C6h20O3.
Этилацетоацетат можно получить путем конденсации этилового эфира ацетоацетата с ацетатом натрия по Клайзену или с помощью некоторых модификаций этого процесса.
Этилацетоацетат находит множество важных применений как в коммерческих, так и в научных целях. Пищевая промышленность использует его по-разному и в качестве промежуточного продукта в медицине, а также в полиролях, красках и других средствах для подготовки поверхности.
На уровне исследований сложный эфир является важным реагентом в органическом синтезе и химии лигандов.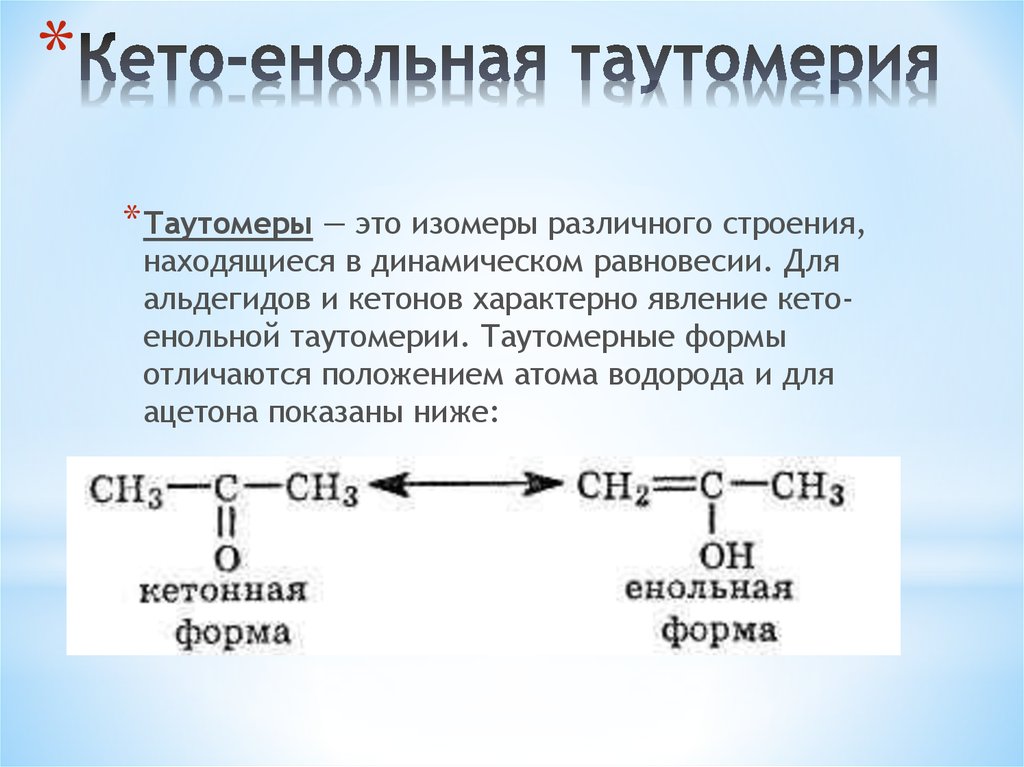
Этилацетоацетат придает приятный фруктовый аромат.
Это делает его популярным синтетическим продуктом для использования в химически модифицированных ароматизаторах и ароматизаторах, как в случае с фруктоном.
Также производители продуктов питания используют вещество в смолистых и полимерных покрытиях.
Такие покрытия можно использовать на контактирующих с пищевыми продуктами поверхностях оборудования или поверхностей или, в ограниченном количестве, на самой пище.
Этилацетоацетат можно использовать в непищевых поверхностных покрытиях или текстиле в качестве ускорителя процесса отверждения.
К ненасыщенной полиэфирной смоле добавляют примерно 1-3 весовых процента ЕАА, называемого промотором или сопромотором.
В другие продукты EAA можно добавлять в качестве растворителя, стабилизатора или катализатора.
Более широко модифицированные производные ацетоуксусной кислоты находят применение в красках, пигментах и агрохимикатах.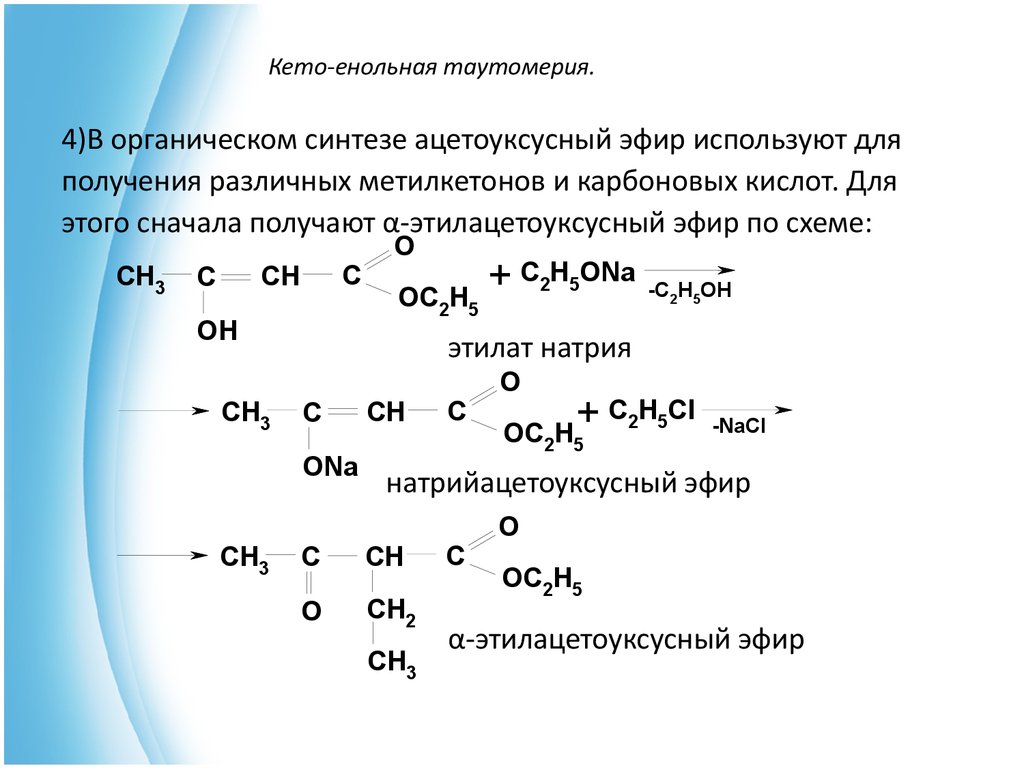
Ацетоацетоксиэтилметакрилат используется при сополимеризации для снижения вязкости клеев.
Этилацетоацетат (CH 3 COCH 2 COOC 2 H 5 ), также называемый ацетоуксусным эфиром, представляет собой сложный эфир, широко используемый в качестве промежуточного соединения в синтезе многих видов соединений органической химии.
Этилацетоацетат используется в промышленности при производстве синтетических лекарств и красителей.
Сложный эфир в основном получают путем самоконденсации этилового эфира ацетоацетата, вызванной металлическим натрием.
Этилацетоацетат уже образует производные натрия, которые можно алкилировать и диалкилировать.
Полученные сложные эфиры можно превратить в кетоны или карбоновые кислоты.
Этилацетоацетат легко вступает в реакции конденсации и используется в синтезе пиридинов, хинолинов, фуранов, пиразолов, пирролов и пуринов.
Органическое соединение этилацетоацетат (ЭАА) представляет собой этиловый эфир ацетоуксусной кислоты.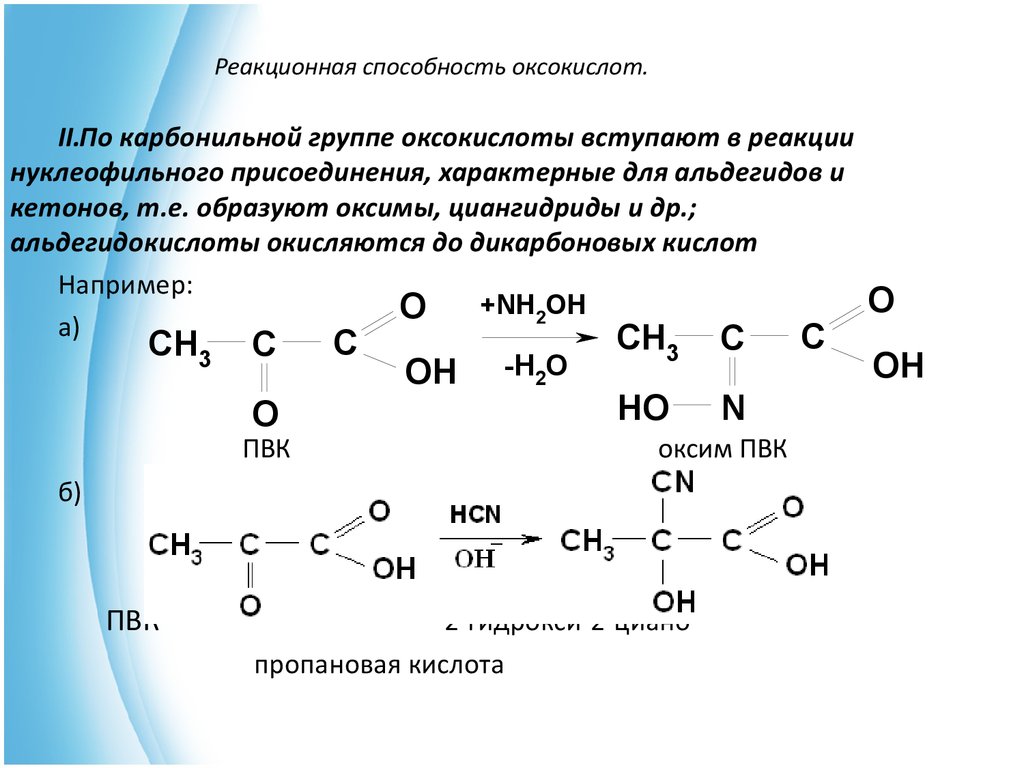
этиловый эфир ацетоацетата в основном используется в качестве промежуточного химического вещества при производстве широкого спектра аминокислот, анальгетиков, антибиотиков, противомалярийных средств, антипирина и аминопирина, а также соединений витамина В1; а также производство красок, чернил, лаков, духов, пластмасс и пигментов для желтых красок.
этиловый эфир ацетоацетата используется как подсластитель для блюд.
Этилацетоацетат имеет характерный эфироподобный, фруктовый, приятный, освежающий запах.
Этил-3-оксобутаноат представляет собой бесцветную жидкость с фруктовым, эфирным, сладким запахом, напоминающим запах зеленых яблок.
этиловый эфир ацетоацетата используется для создания свежих фруктовых верхних нот в женских ароматах.
Этил ацетоацетат содержится в ароматизаторах натуральных материалов, таких как кофе, клубника и желтая маракуйя.
Этилацетоацетат встречается в природе в клубнике, кофе, хересе, соке маракуйи (желтый), плодах бабако (Carica pentagona Heilborn) и хлебе.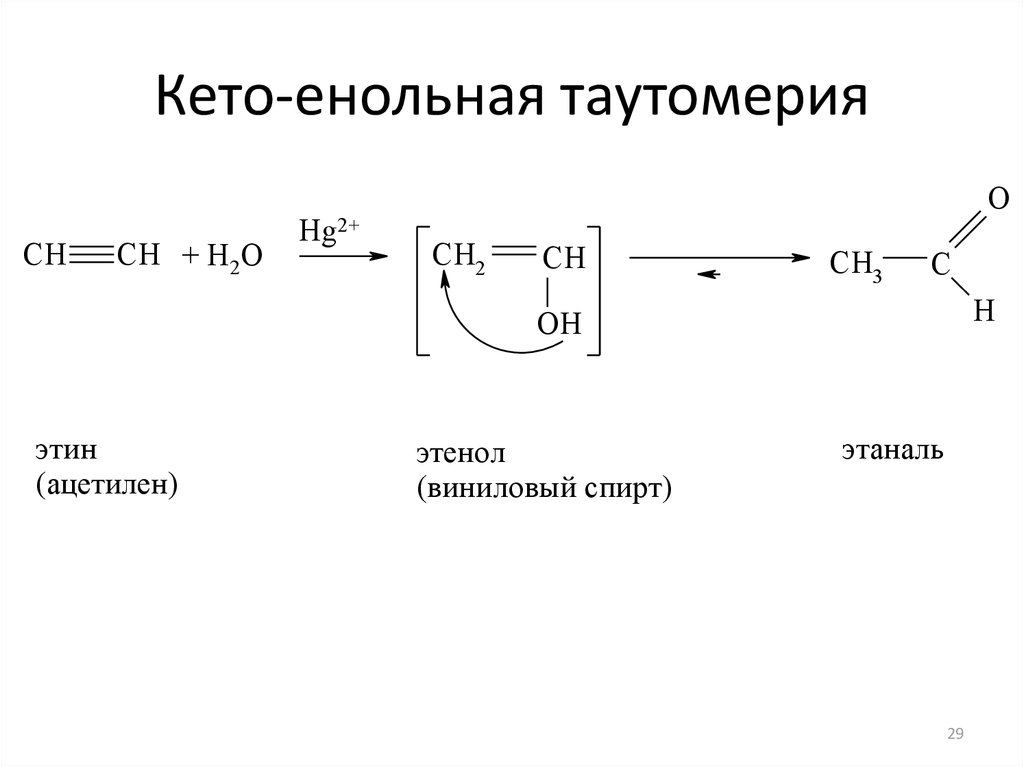

 Аналогичным образом при конденсации эфиров дикарбоновых кислот получаются циклические кетонокислоты, а при конденсации эфиров с энолятами кетонов образуются b-дикетоны.
Аналогичным образом при конденсации эфиров дикарбоновых кислот получаются циклические кетонокислоты, а при конденсации эфиров с энолятами кетонов образуются b-дикетоны.
 рис. 41). Верхний конец холодильника закрывают хлоркальциевой трубкой.
рис. 41). Верхний конец холодильника закрывают хлоркальциевой трубкой.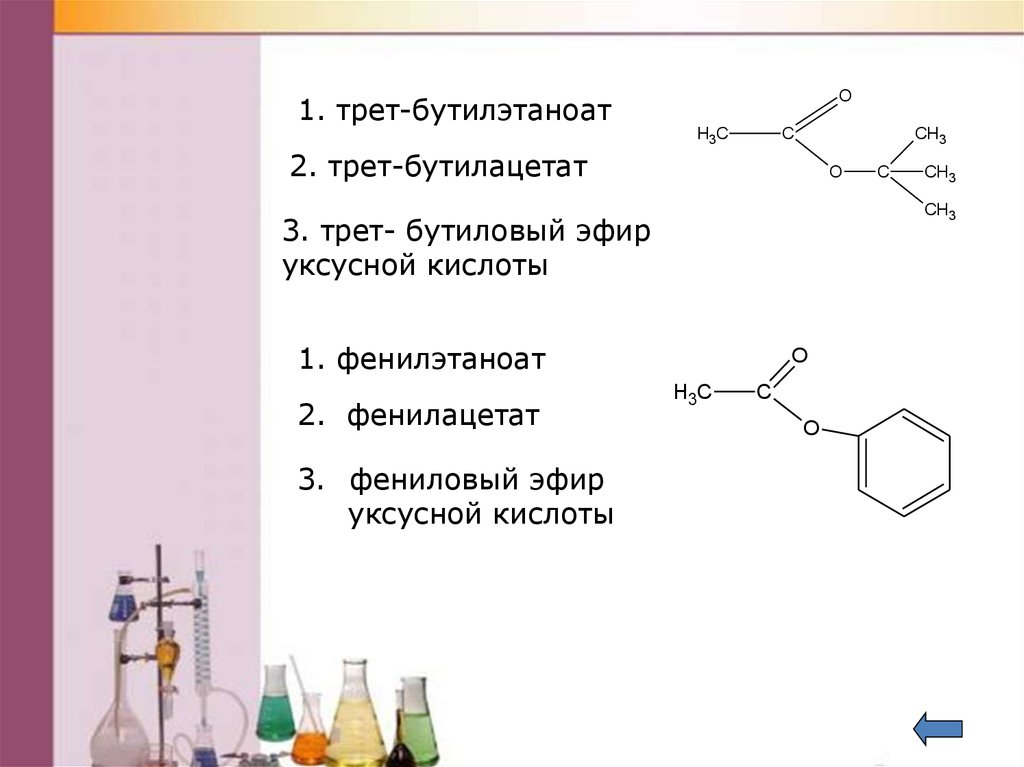
 Щавелевоуксусный эфир
Щавелевоуксусный эфир Прибавляют щавелевоэтиловый эфир и затем через капельную воронку медленно, по каплям, приливают хорошо высушенный уксусноэтиловый эфир; реакция начинается сама собой. После того как весь уксусноэтиловый эфир прибавлен, реакционную смесь нагревают на водяной бане при 30° до тех пор, пока весь натрий не растворится (на что требуется около 1,5 часа), и оставляют стоять в течение ночи.
Прибавляют щавелевоэтиловый эфир и затем через капельную воронку медленно, по каплям, приливают хорошо высушенный уксусноэтиловый эфир; реакция начинается сама собой. После того как весь уксусноэтиловый эфир прибавлен, реакционную смесь нагревают на водяной бане при 30° до тех пор, пока весь натрий не растворится (на что требуется около 1,5 часа), и оставляют стоять в течение ночи. Оставшийся в колбе щавелевоуксусный эфир перегоняют в вакууме.
Оставшийся в колбе щавелевоуксусный эфир перегоняют в вакууме.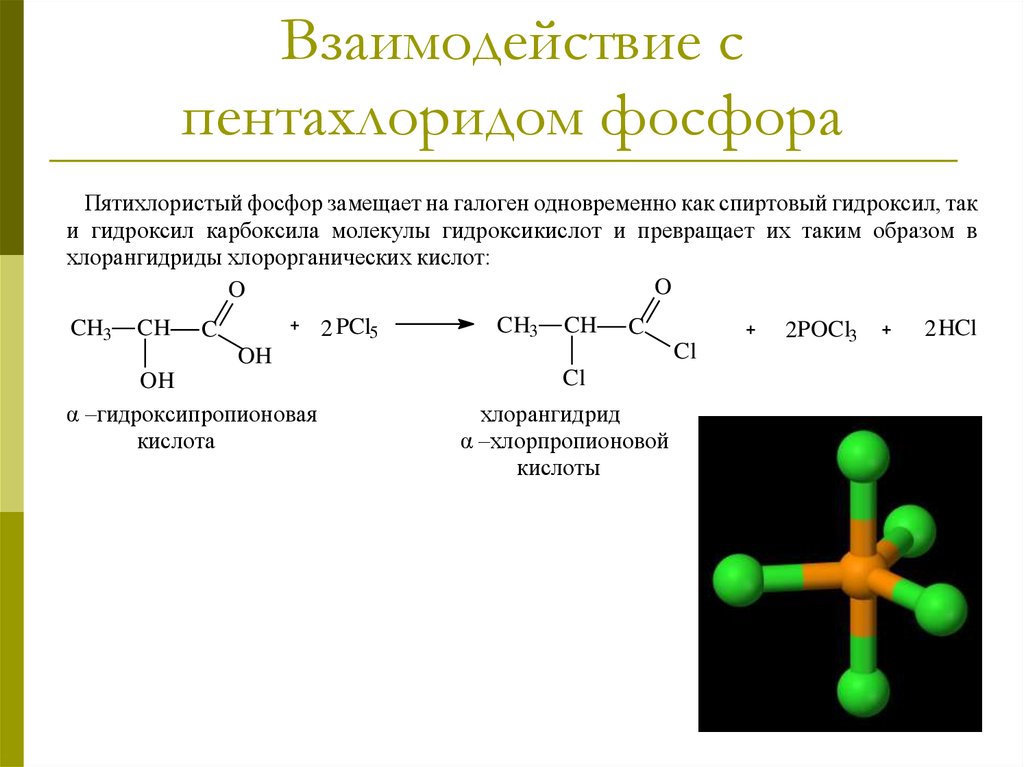 18 г (0,2 моля)
18 г (0,2 моля) Выделившиеся кристаллы отсасывают, промывают водой и высушивают в эксикаторе.
Выделившиеся кристаллы отсасывают, промывают водой и высушивают в эксикаторе.