Содержание
Способ получения моноалкиловых эфиров алкиленгликолей
Изобретение относится к способу получения моноалкиловых эфиров моно- и диэтиленгликолей (этил-, бутил-целлозольвов и карбитолов), а также монометилового эфира пропиленгликоля, которые находят применение в производстве растворителей, пластификаторов, компонентов для низкозамерзающих, антиобледенительных, гидравлических и гидротормозных жидкостей, а также для получения материалов, применяемых в промышленности пластических масс, пестицидов, лаков и красок. Способ получения моноалкиловых эфиров алкиленгликолей путем взаимодействия оксидов этилена и пропилена со спиртами при повышенных температуре и давлении заключается в использовании в качестве катализатора органических соединений металлов пятой и/или шестой группы Периодической системы элементов, предпочтительно органических соединений ванадия, молибдена и вольфрама, а точнее алкиловых эфиров соответствующих неорганических кислот. В результате предложенного способа достигается высокая селективность при использовании меньшего избытка спирта (4-8-кратном) по отношению к оксиду алкилена, получаются концентрированные растворы целевых продуктов (более 20 мас. %) и, как следствие, снижаются энергозатраты на стадии выделения. 2 з.п. ф-лы, 2 табл.
%) и, как следствие, снижаются энергозатраты на стадии выделения. 2 з.п. ф-лы, 2 табл.
Изобретение относится к способу получения моноалкиловых эфиров моно- и диалкиленгликолей, в частности к способу получения метил-, этил-, бутил- целлозольвов и карбитолов, а также моноалкиловых эфиров пропиленгликоля.
Моноалкиловые эфиры алкиленгликолей используются в производстве растворителей, пластификаторов, компонентов для низкозамерзающих, антиобледенительных, гидравлических и гидротормозных жидкостей, а также для получения материалов, применяемых в промышленности пластических масс, пестицидов, лаков и красок.
Известен способ получения моноэтилового эфира этиленгликоля (этилцеллозольва) и моноэтилового эфира диэтиленгликоля (этилкарбитола) взаимодействием этанола и оксида этилена при повышенных температуре и давлении в присутствии катализатора — гидроксида натрия (Дымент О.И. и др. Гликоли и другие производные окисей этилена и пропилена.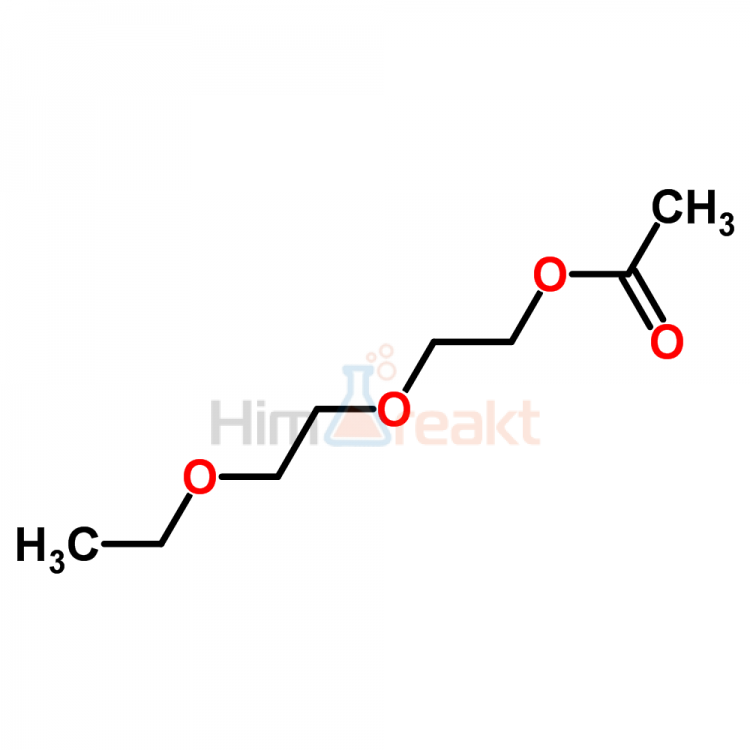 — М.: Химия, 1976; Малиновский М.С. Окиси олефинов и их производные. — М.: Госхимиздат, 1961).
— М.: Химия, 1976; Малиновский М.С. Окиси олефинов и их производные. — М.: Госхимиздат, 1961).
Недостатком данного способа является низкая селективность образования целевых продуктов. При мольном соотношении оксид : спирт = 1 : 5 селективность образования этилцеллозольва не превышает 51,3% мол., этилкарбитола — 13,9% мол.
Наиболее близким аналогом данного способа является способ получения моноалкиловых эфиров алкиленгликолей взаимодействием этанола и оксида этилена и монометилового эфира пропиленгликоля при повышенных температуре и давлении в присутствии металлсодержащего катализатора — молибденсодержащий кубовый остаток после отгонки продуктов эпоксидирования олефинов C3-C5 органической гидроперекисью или водный экстракт указанного кубового остатка (Патент России N 1203846, приоритет 28.10.81).
Недостатком данного способа является то, что высокая селективность (для этилцеллозольва 63,7-83,4% мол. , этилкарбитола 3,24-16,6% мол., монометилового эфира пропиленгликоля 95,1% мол.) достигается путем проведения процесса при большом 8-10-кратном мольном избытке спирта по отношению к оксиду. Это приводит к получению разбавленных растворов целевых продуктов (менее 20% мас.) и в свою очередь требует повышенных энергозатрат при их выделении.
, этилкарбитола 3,24-16,6% мол., монометилового эфира пропиленгликоля 95,1% мол.) достигается путем проведения процесса при большом 8-10-кратном мольном избытке спирта по отношению к оксиду. Это приводит к получению разбавленных растворов целевых продуктов (менее 20% мас.) и в свою очередь требует повышенных энергозатрат при их выделении.
Предлагаемый способ позволяет достигнуть высокой селективности при использовании меньшего избытка спирта (4-8-кратном) по отношению к оксиду алкилена, получать концентрированные растворы целевых продуктов (более 20% мас.) и, как следствие, снизить энергозатраты на стадии выделения.
Указанный результат достигается взаимодействием оксида этилена и пропилена со спиртами при повышенных температуре и давлении и использовании в качестве катализаторов органических соединений металлов пятой и/или шестой группы Периодической системы элементов. Предпочтительно в качестве органических соединений металлов пятой и/или шестой группы Периодической системы элементов используют органические соединения ванадия, молибдена и вольфрама. Предпочтительно в качестве органических соединений ванадия, молибдена и/или вольфрама используют алкиловые эфиры соответствующих неорганических кислот.
Предпочтительно в качестве органических соединений ванадия, молибдена и/или вольфрама используют алкиловые эфиры соответствующих неорганических кислот.
Следующие примеры иллюстрируют способ.
Пример 1 В металлическую ампулу объемом 200 мл, оборудованную рубашкой для обогрева теплоносителем, вентилем для загрузки реагентов и выгрузки продуктов реакции, последовательно загружают 92 г (2 моля) этанола, 22 г (0,5 моля) оксида этилена и в качестве катализатора 0,1 г бис-(этандиол-1,2)-молибдата. Мольное соотношение оксид : спирт = 1 : 4. Содержание молибдена в исходной реакционной смеси составляет — 0,005% мас.
Ампулу помещают на лабораторную качалку и присоединяют к термостату с температурой 120oC, создают давление 20 ати. Через 2 часа конверсия оксида составляет 100%.
Суммарная концентрация целевых продуктов (целлозольва и карбитола) в продуктах реакции (Сцп) составила 36,7% мас. Селективность образования этилцеллозольва (на превращенный оксид) Ф1 составляет 77,0% мол., этилкарбитола Ф2 — 21,4% мол., других гликолей (этиленгликоль, диэтиленгликоль, моноэтиловый эфир триэтиленгликоля) Ф3 — 1,6%.
Селективность образования этилцеллозольва (на превращенный оксид) Ф1 составляет 77,0% мол., этилкарбитола Ф2 — 21,4% мол., других гликолей (этиленгликоль, диэтиленгликоль, моноэтиловый эфир триэтиленгликоля) Ф3 — 1,6%.
Примеры 2-5 Процесс осуществляют аналогично примеру 1 при других мольных отношениях оксид : спирт, при различном содержании молибдена в исходной реакционной смеси, а также при различных условиях проведения процесса оксиэтилирования. Условия проведения процесса и результаты приведены в таблице 1. В таблице 1 также приведены результаты испытания катализаторов при синтезе монобутилового эфира этиленгликоля (бутилцеллозольва) и монобутилового эфира диэтиленгликоля (бутилкарбитола) — примеры 4-5.
Примеры 6-10 Процесс осуществляют аналогично примеру 1 при использовании других катализаторов, температуре 110oC, давлении 20 ати, содержании металлов в исходной реакционной смеси 0,01% мас. и мольном соотношении этанол : оксид этилена = 6 : 1. Процесс осуществляют до полной конверсии оксида в течение 2-3 час. Условия проведения процесса и результаты приведены в таблице 2.
и мольном соотношении этанол : оксид этилена = 6 : 1. Процесс осуществляют до полной конверсии оксида в течение 2-3 час. Условия проведения процесса и результаты приведены в таблице 2.
Пример 11 Процесс осуществляют по методике, описанной в примере 1. В металлическую ампулу последовательно загружают 96 г (3 моля) метанола, 29 г (0,5 моля) оксида пропилена и в качестве катализатора 0,15 г бис-(пропандиол-1,2)-молибдата. Мольное соотношение оксид : спирт = 1 : 6. Содержание молибдена в исходной реакционной смеси составляет — 0,007% мас.
Ампулу помещают на лабораторную качалку и присоединяют к термостату с температурой 95oC, создают давление 15 ати. Через 1 час конверсия оксида составляет 100%.
Концентрация целевого продукта (монометилового эфира пропиленгликоля) в продуктах реакции составила 35,8% мас. Селективность образования целевого продукта (на превращенный оксид) Ф1 составляет 96,9% мол. , монометилового эфира дипропиленгликоля Ф2 — 3,2% мол. Другие гликоли (пропиленгликоль, дипропиленгликоль, моноэтиловый эфир триприпиленгликоля) обнаружены в следовых количествах. Монометиловый эфир пропиленгликоля состоит на 64,5% из соединения с вторичной OH-группой.
, монометилового эфира дипропиленгликоля Ф2 — 3,2% мол. Другие гликоли (пропиленгликоль, дипропиленгликоль, моноэтиловый эфир триприпиленгликоля) обнаружены в следовых количествах. Монометиловый эфир пропиленгликоля состоит на 64,5% из соединения с вторичной OH-группой.
Таким образом, предложенный способ при сохранении высокой селективности позволяет увеличить концентрацию целевых продуктов в реакционной массе с 20% мас. до 21-36,7% мас. и, как следствие, снизить энергетические затраты на стадии выделения.
Формула изобретения
1. Способ получения моноалкиловых эфиров алкиленгликолей взаимодействием оксидов алкилена со спиртами в присутствии металлсодержащих катализаторов при повышенных температуре и давлении, отличающийся тем, что процесс осуществляют в присутствии органических соединений металлов пятой и/или шестой группы Периодической системы элементов.
2. Способ по п.![]() 1, отличающийся тем, что в качестве органических соединений металлов пятой и/или шестой группы Периодической системы элементов используют органические соединения ванадия, молибдена и вольфрама.
1, отличающийся тем, что в качестве органических соединений металлов пятой и/или шестой группы Периодической системы элементов используют органические соединения ванадия, молибдена и вольфрама.
3. Способ по п.2, отличающийся тем, что в качестве органических соединений ванадия, молибдена и/или вольфрама используют алкиловые эфиры соответствующих неорганических кислот.
РИСУНКИ
Рисунок 1
Процессы получения простых эфиров
10
Простые эфиры
являются производными спиртов, диолов,
фенолов и т.п., у которых атом водорода
гидроксильной группы замещен углеводородным
остатком. Рассмотрим способы получения
диалкиловых (симметричных и несимметричных),
циклических, алкилариловых эфиров —
продуктов основного органического
синтеза:
Наиболее
распространенные представители простых
эфироов:
1. Диалкиловые эфиры:
Симметричные
эфиры:
—
диметиловый эфир (метоксиметан) tкип
= -23,7С
—
диэтиловый эфир (серный эфир) tкип
= 34,6С
—
диизопропиловый эфир tкип
= 67,5С
Несимметричные
эфиры:
—
метил-третбутиловый эфир tкип
= 53-56С
азеотроп
с МеОН tкип
= ???С
—
метил-третамиловый эфир tкип
=
ди-, три-, тетра-
и полиэтиленгликоли:
—
диэтиленгликоль tкип
= 245С
—
триэтиленгликоль tкип
= 284С
—
тетраэтиленгликоль tкип
= 313-314С
— полиэтиленгликоль
(ПЭГ-13)
— полиэтиленгликоль
(ПЭГ-35)
— полиэтиленгликоль
(ПЭГ-115)
и их моноалкиловые
эфиры:
моноалкиловые
эфиры этиленгликоля, пропиленгликоля
— целлозольвы:
— монометиловый
эфир этиленгликоля
(метоксиэтанол,
метилцеллозольв) tкип
= 124,3С
— моноэтиловый
эфир этиленгликоля
(этоксиэтанол,
этилцеллозольв) tкип
= 135,1С
— монобутиловый
эфир этиленгликоля
(бутоксиэтанол,
бутилцеллозольв) tкип
= 171С
— монометиловый
эфир пропиленгликоля
моноалкиловые
эфиры диэтиленгликоля- карбитолы:
—
монометиловый эфир диэтиленгликоля
(метилкарбитол) tкип
= 194С
—
моноэтиловый эфир диэтиленгликоля
(этилкарбитол) tкип
= 201-202С
—
монобутиловый эфир диэтиленгликоля
(бутилкарбитол) tкип
=
моноалкиловые
эфиры полиэтиленгликолей, у которых
число
оксиэтильных
звеньев n
= 3-20 и алкильный радикал R
= C10—C20
—
синтанолы (ДС-3, ДС-6, ДС-10, ДС-20 — R
= C10-C18)
—
и диалкиловые
эфиры:
—
диметиловый эфир этиленгликоля
(глим) tкип
= 84,5С
—
диметиловый эфир диэтиленгликоля
(диглим) tкип
= 61-62С
(11 мм рт ст)
2.
 Циклические эфиры:
Циклические эфиры:
эпоксиды:
—
этиленоксид tкип
= 10С
—
пропиленоксид tкип
= 36С
—
глицидол tкип
=56C
(11 мм рт ст)
—
оксид стирола tкип
=
—
оксиды олефинов С10-С16 tкип
=
тетрагидрофуран
(аз. tкип
= 64С,
6% Н2О,
) tкип
= 65,7С
1,3-диоксолан -ОСН2СН2ОСН2 tкип
= 75С
2-метил-1,3-диоксолан -ОСН2СН2ОСН-СН3 tкип
= 82,5С
1,3-диоксан -ОСН2СН2СН2ОСН2
— tкип
= 105С
4,4-диметил-1,3-диоксан
(СН3)2-С-СН2СН2ОСН2О- tкип
=
1,4-диоксан (аз.
tкип
= 87,8, 18,4% Н2О,
) tкип
= 101,3С
3. Алкилариловые эфиры
—
метилфениловый эфир (анизол) (н.р.) tкип
= 155С
азеотроп
с Н2О
tкип
= 95,5С
—
монофениловый эфир этиленгликоля
(феноксиэтанол) tкип
= 236-238С
— моноалкилфениловые
эфиры полиэтиленгликолей
(неонолы
АФ9
3-12)
В
основе промышленных способов получения
простых эфиров лежат следующие химические
превращения:
1. Межмолекулярная и внутримолекулярная дегидратация спиртов и диолов.
Данный
процесс используется главным образом
для получения симметричных диалкиловых
эфиров, циклических эфиров (ТГФ,
1,4-диоксан) и алкилариловых эфиров
(анизол). В некоторых случаях данный
процесс может быть использован для
синтеза несимметричных эфиров:
1 | 2ROH | |
2 | ROH | Слабоэкзотермические |
3 | HOCH2CH2CH2CH2OH | реакции |
4 | HOCH2CH2OCH2CH2OH | -H20 |
5 | СН3ОН |
Все
эти реакции относятся к числу
кислотно-каталитических процессов. В
В
качестве катализаторов используют:
гетерогенные
контакты:
—
AL2O3
—
Н3РО4/на
носителе (AL2O3,
силикагель и др)
— цеолиты
—
фосфаты кальция (CaHPO4)
—
сульфокатиониты:
гомогенные
катализаторы:
-серная кислота.
Основные побочные
реакции:
а). Реакция
внутримолекулярной дегидратации с
образованием олефина с последующей его
кислотной полимеризацией:
CH3CH2CH2CH2OH CH3CH2CH=CH2
+ H2O
(энд)
H
40-48 kДж/моль
n
CH3CH2CH=CH
(CH2CH2CH-CH)n
б). Реакция
дегидрирования спирта с образованием
альдегида или кетона:
CH3CH2CH2CH2OH CH3CH2CH2COH
+ H2
Данная
реакция протекает в присутствии
гетерогенных контактов, содержащих
металлы.
в). Реакция
изомеризации циклических эфиров
CH2CH2
H+
CH2O
CH2OHO
O
| CHCH3
| + CH3COHCH2CH2
CH2O
CH2OH
г).
При получении анизола реакции
межмолекулярной дегидратации метанола
с образованием диметилового эфира,
фенола с образованием дифенилового
эфира, а также продукты реакции
алкилирования фенола и анизола в
ароматическое ядро с образованием
крезолов и т.п.
Все
целевые реакции и основная побочная
являются равновесными (обратимыми) при
этом Кр
целевых реакций с увеличением температуры
падает, а Кр
основной побочной реакции растет. В
В
газовой фазе при 200-400С
основная и побочная конкурируют друг
с другом. В связи с этим для повышения
степени превращения спиртов в целевые
продукты необходимо проводить процесс
при умеренных температурах.
Для
селективного получения циклических
эфиров (тетрагидрофуран, диоксан и др.),
также диалкиловых эфиров (кроме
диметилового и диэтилового) процесс
обычно проводят в жидкой фазе при
температуре 80-200С
при обычном или небольшом давлении.
Учитывая
тот факт, что, как правило, образующиеся
продукты более летучи, чем спирты, для
повышения выхода процесса в жидкой фазе
также используют прием удаления продуктов
из зоны реакции, снижая текущую
концентрация целевого продукта в
реакционной смеси и тем самым снижая
скорость его (целевого эфира) превращения
по реакции изомеризации (в).
В
связи с низкой реакционной способностью
метанола и этанола при получении
диметилового и диэтилового эфиров
процесс следует осуществлять в газовой
фазе при температуре 200-250С
в присутствии гетерогенного катализатора
— фосфорная кислота на носителе (Al2O3).
Аналогично,
для увеличения селективности образования
анизола и исключения образования
продуктов алкилирования в ароматическое
ядро процесс осуществляют в газовой
фазе в присутствии цеолитов при 300-320С
и при соотношении фенол : метанол 1 : 2.
При
проведении процесса в газовой фазе для
повышения селективности образования
целевого эфира используют принцип
Лешателье. Для смещения равновесия
побочной реакции внутримолекулярной
дегидратации влево процесс осуществляют
при повышенном давлении 1-2 МПа. При этом
поскольку тепловой эффект невелик
процесс можно проводить в адиабатических
условиях.
Для
повышения селективности образования
анизола процесс осуществляют в избытке
метанола в присутствии селективных
катализаторов — цеолитов, при этом
образующийся по реакции диметиловый
эфир возвращают в реакцию (циркулируют
на вход реактора).
Аппаратурное
оформление процесса:
1. Агрегатное
состояние реагентов и катализатора-
Ж-Ж-
(Ж)kt-гомогенный
Ж-Ж-
(Т)kt-гетерогенный
Г
— Г — (Т)kt-гетерогенный
2. Непрерывные и
Непрерывные и
периодические реактора
3. Реактора смешения
и вытеснения
4. Движется одна
фаза (жидкость или газ)
5. Адиабатический,
изотермический или политропический
6. Все виды подвода
и отвода тепла реакции
7. Внешнее и
внутреннее
8. Выбор оптимального
зерна гетерогенного катализатора
9. Реакционная
камера, колонны, реже — теплообменник
См.
Рис.I
– IV
Моноэтиловый эфир диэтиленгликоля |
Синоним(ы)
DE Растворитель; 2-
- Обзор
- Документы
- Технические характеристики
- Свойства
- Информация о безопасности
Размер упаковки
Выберите вариант. ..
..
Тип контейнера
Выберите вариант…
Количество
Проверить наличие
Запросить цену
- ≥95% для общелабораторного использования.
пропустить до конца галереи изображений
Skip до начала галереи изображений
| Бренд Honeywell | Код UNSPSC 121 | CAS Numbers (All) 111-90-0 | EC Number 203-919-7 | |
| Linear Formula C 2 H 5 OCH 2 CH 2 OCH 2 CH 2 OH | MDL Number MFCD00002872 | Molar Mass 134. | Номер RTECS KK8750000 | Синонимы DE Растворитель; 2- |
Документы
Лист данных безопасности (SDS)
Спецификации
| СВОБОДА | VALU0153 | 23,5 %, 182 °F |
|---|---|---|
| Идентификация (ИК) | соответствует | |
| Анализ (ГХ) | Мин. 98,7 % | |
| Плотность (D 20/4) | 0,988 — 0,992 | |
| Вода (Карл Фишер) | Макс. 0,10 % | |
| .4 3 COOH) | Макс. 0,01 % | |
| Моноэтиловый эфир этиленгликоля | Макс. 0,1 % | |
| Моноэтиловый эфир триэтиленгликоля | Макс. 0,1 % | |
| APHA | Макс. 10 10 |
Properties
| Property | Value | |
|---|---|---|
| Autoignition Temperature | No data available | |
| Boiling Point/Range | 196 °C (1.013 hPa) | |
| Color | Colorless | |
| Density | 0.99 g/cm3 (20 °C) | |
| Flashpoint | 23.5 %(V) | |
| Форма | Жидкость | |
| Степень | РЕАГЕНТ ДАГЕНТ | |
| Несовместимые материалы | Стротые агенты, сильные кислоты, кислота, кислота, кислота, а нехводы, Anhydrides, Metrides, Metal | .0088 |
| Lower Explosion Limit | 1.2 %(V) | |
| Melting Point/Range | -54 °C | |
| Partition Coefficient | No data available | |
| Purity Percentage | 99 | |
| Детали чистоты | 99% | |
| Растворимость в воде | Полностью смешивается | |
| Верхний предел взрываемости | 23,5 8 0058 Vapor Pressure | 0. 16 hPa (20 °C) 16 hPa (20 °C) |
| Viscosity | No data available | |
| pH-Value | No data available | |
| Product Line | Reagent Grade | |
| Storage Temperature | Окружающая среда |
Информация о безопасности
| Свойство | Значение | N/A |
|---|---|
| Package Group | N/A |
| UN ID | N/A |
Remove Product | Add more compare product |
: Моноэтиловый эфир диэтиленгликоля, этилдигликоль, этилкарбитол, 2(2-этоксиэтокси)этанол ::
:: Моноэтиловый эфир диэтиленгликоля, этилдигликоль, этилкарбитол, 2(2-этоксиэтокси)этанол ::
- Товары
- Моноэтиловый эфир диэтиленгликоля – DGMEE
Моноэтиловый эфир диэтиленгликоля представляет собой продукт окиси этилена и этанола. Моноэтиловый эфир диэтиленгликоля химически известен как этилдигликоль, 2-гидрокси-2-этоксидиэтиловый эфир. Коммерчески он известен как этилкарбитол, который является торговой маркой Union Carbide. Моноэтиловый эфир диэтиленгликоля является отличным растворителем для различных смол, паст и т. д. ADVANCE PETROCHEMICALS LTD. продает этот продукт под торговой маркой APITOL 134.
Моноэтиловый эфир диэтиленгликоля химически известен как этилдигликоль, 2-гидрокси-2-этоксидиэтиловый эфир. Коммерчески он известен как этилкарбитол, который является торговой маркой Union Carbide. Моноэтиловый эфир диэтиленгликоля является отличным растворителем для различных смол, паст и т. д. ADVANCE PETROCHEMICALS LTD. продает этот продукт под торговой маркой APITOL 134.
Области применения
Моноэтиловый эфир диэтиленгликоля имеет низкую температуру застывания и низкую вязкость при низких температурах, поэтому он используется в производстве тормозной жидкости. Этилдигликоль используется в качестве усилителя текучести и блеска в лакокрасочной промышленности. Расширяемость решения также увеличилась. Этилкарбитол используется в производстве печатных красок и как очиститель в офсетной печати.
Моноэтиловый эфир диэтиленгликоля используется в текстильной промышленности в качестве растворителя для красителей при печати и окрашивании волокон и тканей. Этилдигликоль предотвращает образование геля в составе жидких моющих и чистящих средств.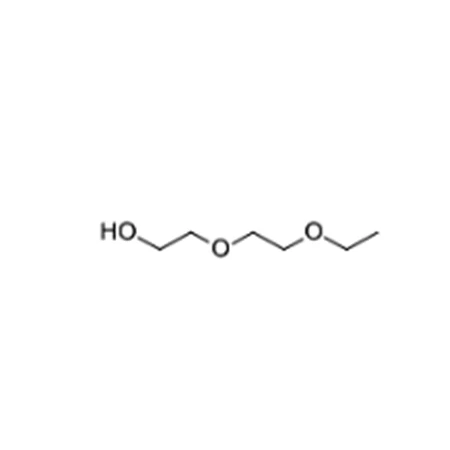 Моноэтиловый эфир диэтиленгликоля также используется в качестве солюбилизатора в охлаждающих жидкостях для сверления и резки. Этилдигликоль используется в производстве и производстве пестицидов и консервантов для древесины. Из-за своей низкой летучести он используется в пастах для шариковых ручек и чернил. Он также используется в косметической и парфюмерной промышленности в качестве растворителя. Этилдигликоль (этилкарбитол) не воздействует на каучук.
Моноэтиловый эфир диэтиленгликоля также используется в качестве солюбилизатора в охлаждающих жидкостях для сверления и резки. Этилдигликоль используется в производстве и производстве пестицидов и консервантов для древесины. Из-за своей низкой летучести он используется в пастах для шариковых ручек и чернил. Он также используется в косметической и парфюмерной промышленности в качестве растворителя. Этилдигликоль (этилкарбитол) не воздействует на каучук.
Спецификация
| Продукт | Апитол 134 |
|---|---|
| Химический состав | Моноэтиловый эфир диэтиленгликоля (DGMEE) |
| Химическое название | Этилкарбитол |
| Химическая формула | С 6 Н 14 О 3 |
| Кас № | 111-90-0 |
| Внешний вид | Прозрачный, яркий и свободный от твердых частиц |
| Цвет платина-кобальт | 10,0 Макс. |
| Удельный вес 20/20 ºC | 0,989 — 0,994 |
| Перегонка Начальная точка кипения Точка сухого остатка | 192,0 ºC Мин. и 202,0 ºC Макс. |
| PH 25% раствора в воде 25 ± 2 ºC | от 6,0 до 7,5 |
| Температура вспышки (ºC) | Мин. 91ºC |
| Содержание воды % | 0,15 Макс. |
| Молекулярный вес | 134,17 |
Кислотность % мас. Begin typing your search term above and press enter to search. Press ESC to cancel. Back To Top
|

 17 g/mol
17 g/mol