Карбонильные соединения. Альдегиды и кетоны. Метилэтиловый эфир получение из этилата натрия
Этилат натрия в спиртовом раствор
Как уже отмечалось выше, галогениды неопентила очень медленно взаимодействуют с основаниями. В результате кинетических измерений было установлено, что реакция бромистого неопентила с концентрированным этилатом натрия в спиртовом растворе отвечает [c.457]Содержание этилата натрия в спиртовом растворе—не менее 15%, свободного едкого натра в пересчете на натрий—не более 0,75%, натрия, связанного в этилат натрия, по отношению к общему количеству натрия—не менее 87%. [c.1042]
Реакцией меркаптидов и галогензамещенных жирных кислот в присутствии этилата натрия в спиртовом растворе [c.30]Ускорение реакции между ЗОд и этилатом натрия в спиртовом растворе ионами 3 и N8 можно рассматривать как случай основного катализа. [c.231]
Образование алкоголят-ионов имеет важное значение как способ генерирования сильного нуклеофила, легко вступающего в Зк2-реакции. В то время как этанол лишь очень медленно реагирует с иодистым метилом, образуя метилэтиловый эфир, этилат натрия в спиртовом растворе реагирует с большой скоростью. [c.349]
Этилат натрия в спиртовом растворе—слегка мутная жидкость от желтого до коричневого цвета. Получают взаимодействием этилового эфира и едкого натра с удалением воды при помощи азеотропной ректификации с бензолом. [c.1042]
Склонность тройной связи к раскрытию проявляется и по отношению к другим молекулам того же самого вещества. Так, например, из ацетонитрила под действием этилата натрия в спиртовом растворе образуется циклический продукт — аминопиримидин [5]. Реакция начинается с отрыва протона от группы Hj. [c.580]
Большое количество арилсульфонилалкиламидов получено алкилированием производных арилсульфонилацетамида галоидалкилами и этилатом натрия в спиртовых растворах [253] [c.163]
Аналогичным образом можно получить и другие тиофосфорные инсек7ициды. Так, например, первоначальный вариант производства паратиоиа, разработанный Шрадером , включает взаимодействие тиотреххлористого фосфора с 2 моль этилата натрия в спиртовом растворе при температуре от —5 до —10 °С, отделение хлористого натрия фильтрованием, а этанола — отгонкой при пониженном давлении, чтобы избежать изомеризации в 0,8-диэтил-0-4-нитро-фенилтиофосфат [c.433]
Реакция бутилдибромстибина с этилатом натрия в спиртовом растворе нри строгом исключении воздуха и влаги приводит к бутилдиэтоксистиби-ну, т. кин. 64—65° С/1 мм, d/ 1,4599 (выход 79,4%) [4]. [c.313]
Фаворский [22] первый предположил существование продуктов присоединения алкоголятов щелочных металлов к ацетиленовым углеводородам, какпромеио точ-ных соединений при перегруппировке этих углеводородов, и выделил 2-этоксипропилен, образующийся при реакции пропина с этилатом натрия в спиртовом растворе в запаянных трубках. Химикам концерна И. Г. Фарбениндустри принадлежит несколько патентов на получение виниловых эфиров из ацетилена и соединений со спиртовой функцией в присутствии таких сильно щелочных катализаторов, как окиси, гидроокиси или алкоголяты щелочных и щелочноземельных металлов [23—28]. [c.202]
chem21.info
Карбонильные соединения. Альдегиды и кетоны — доклад
Влияние заместителя ослабевает с удалением от карбоксильной группы (индукционный эффект затухает с расстоянием).
Ароматические кислоты более сильные, чем алифатические. Наличие сильных акцепторов в пара-, а особенно в орто - положении к карбоксильной группе увеличивает силу кислоты.
Орто-замещенные ароматические кислоты всегда более сильные, чем пара-замещенные. Это явление называют орто-эффектом.
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей. С увеличением молекулярной массы растворимость кислот в воде уменьшается.
ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ.
1.Взаимодействие с металлами | 2Ch4COOH+Ca à(Ch4COO)2Ca+h3 ацетат кальция |
2.Взаимодействие с оксидами металлов | 2Ch4COOH+CaO à(Ch4COO)2Ca+h3O |
3.Реакция нейтрализации | 2Ch4COOH+Ca(OH)2 à (Ch4COO)2Ca + 2h3O |
4.Взаимодействие с солями | 2Ch4COOH+CaCO3 à (Ch4COO)2Ca + h3O + CO2 |
| 4. Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия). В результате наблюдается выделение углекислого газа.
2Ch4COOH+NaНCO3 à 2Ch4COONa+h3O+CO2 | |
5.Реакция этерификации
| |
6.Галогенирование кислот – реакция идёт в присутствии красного фосфора. | Ch4COOH+Br2 –(Ркр)à Ch3-COOH + НВr ô Br |
7.Образование галогенангидридов. | |
8. Образование амидов:
|
|
Особенности муравьиной кислоты. | |
|
9. Разложение при нагревании. |
НСООН –(h3SO4конц,t)à CO + h3O |
10. Реакция серебряного зеркала и с гидроксидом меди (II) – муравьиная кислота проявляет свойства альдегидов. |
НCOOH + 2[Ag(Nh4)2]OH à(Nh5)2СО3+ 2Ag + 2Nh4 + h3O
HCOOH + Cu(OH)2 –tà CO2 + Cu2O + h3O |
11. Окисление хлором. |
HCOOH + Cl2 à CO2 + 2HCl |
Простые и сложные эфиры
Простые эфиры
Простыми эфирами называют органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных атомом кислорода: R–O–R', где R и R' – различные или одинаковые радикалы.
Простые эфиры рассматриваются как производные спиртов. Названия этих соединений состоят из названий радикалов и слова эфир (название класса). Для симметричных эфиров ROR используется приставка ди перед названием радикала, а в названиях несимметричных эфиров ROR' радикалы указываются в алфавитном порядке. Например, Ch4OCh4 – диметиловый эфир; C2H5OCh4 – метилэтиловый эфир.
Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов.
При этом в одной молекуле спирта разрывается связь О–Н, а в другой – связь С–О. Реакцию можно рассматривать как нуклеофильное замещение группы HО– (в одной молекуле спирта) на группу RO– (от другой молекулы). Эфиры несимметричного строения R–O–R' образуются при взаимодействии алкоголята и галогенуглеводорода (синтез Вильямсона). Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана:
C2H5ONa + Ch4Cl ® C2H5OCh4 + NaCl
В этой реакции происходит нуклеофильное замещение галогена (Cl–) на алкоксигруппу (Ch4O–)
Простые эфиры имеют более низкие температуры кипения и плавления, чем изомерные им спирты. Эфиры практически не смешиваются с водой. Это объясняется тем, что простые эфиры не образуют водородных связей, т.к. в их молекулах отсутствуют полярные связи О–Н.
Простые эфиры – малоактивные соединения, они значительно менее реакционноспособны, чем спирты. Хорошо растворяют многие органические вещества и поэтому часто используются как растворители. Наиболее характерные реакции простых эфиров:
· разложение под действием концентрированных иодоводородной или бромоводородной кислот
R–O–R' + HI ® ROH + R'I
· образование нестойких солей оксония (подобных солям аммония) в результате взаимодействия с сильными кислотами
R2O + HCl ® [R2OH]+Cl-
К важнейшим простым эфирам относятся и гетероциклические кислородсодержащие соединения – этиленоксид (эпоксид) и диоксан.
Диоксан (т. кип. 101°С) – хороший растворитель, смешивается как с водой, так и с углеводородами. За эти качества его назвали "органической водой". Достаточно токсичен. Значительно более опасны галогенсодержащие дибензопроизводные диоксана. Например, печально известный диоксин (2,3,7,8-тетрахлордибензо-п-диоксин).
Ароматическим простым эфирам относятся соединения формулы ArOR, где Ar — арильная группа, a R — алкильная или арильная, например:
Физические свойства
Летучесть 1. Простые эфиры легколетучие и легковоспламеняющиеся вещества. 2. Низшие алифатические простые эфиры — газы или легколетучие жидкости. Простые эфиры кипят при температурах более низких, чем изомерные им спирты. Дифениловый эфир — твердое вещество, t плавления = 28°С.
Растворимость
- Простые эфиры плохо растворимы в воде. 2. Вместе с тем простые эфиры широко используются как растворители для органических веществ.
Плотность
Пары эфира тяжелее паров воды. Тяжелые, легковоспламеняющиеся пары эфира очень опасны в пожарном отношении.
Получение диэтилового эфира. Диэтиловый эфир получается из этанола:
Лабораторный синтез 1. Диэтиловый эфир получают так же, как и в промышленности, — из смеси этанола и серной кислоты (см. выше). 2.Синтез-Вильямсона. Смесь натриевого производного спирта или фенола с галогеналканами кипятят в спирте до выпадения осадка галогенида натрия. Затем из смеси выделяют простой эфир фракционной перегонкой:
Химические свойства
1. Простые эфиры — довольно инертные соединения. Реакционная способность простых эфиров невысока, они вступают лишь в немногие реакции. Эфиры легко горят, образуя диоксид углерода и воду. Поскольку атом кислорода имеет неподеленную электронную пару, он может протонироваться сильными кислотами. При этом образуется оксониевый ион:
Оксониевый ион может атаковаться сильным нуклеофилом. Реакция такого типа протекает при нагревании алифатических простых эфиров с иодоводородной кислотой:
Получившийся спирт R'—ОН также реагирует с HI: I-®HIR'Oh3®R'OHR'I+Н2O В итоге образуется смесь двух иодалканов:
R-O-R'+2HIR®I+R'I+Н2О Другие галогеноводороды, HBr и НСl, реагируют с простыми эфирами значительно труднее. Алкилариловые эфиры взаимодействуют с иодоводородной кислотой, давая фенол и иодалкан: ArOH+RI®ArOR+HI На свету простые эфиры взаимодействуют с кислородом воздуха, образуя взрывоопасные пероксиды. Ниже приводится схема методов синтеза и реакций простых эфиров
Сложные эфиры - соединения с общей формулой R–COOR', где R и R' - углеводородные радикалы.
Нахождение в природе. Сложные эфиры широко представлены в природе, но обычно в небольших количествах.
Они участвую в разнообразных процессах, протекающих в живом организме, являются ароматобразующими компонентами ряда растений. Эфиры низших карбоновых кислот и низших одноатомных спиртов имеют приятный запах цветов, ягод и фруктов. В значительных количествах в природе представлены воски, эфиры эфирных масел.
Основа природных восков - эфиры высших одноосновных кислот и высших одноатомных спиртов. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат)
Ch4(Ch3)14–CO–OCh3(Ch3)29Ch4.
Номенклатура. По рациональной номенклатуре наименование эфира строится из двух частей: названия кислоты и спиртового радикала. По ИЮПАК для наименования сложных эфиров к названию кислоты прибавляю название спиртового радикала, изменяя при этом в названии кислоты суффикс «овая» на «оат».
Изомерия сложных эфиров определяется изомерией кислотных и спиртовых остатков.
Например: этиловый эфир муравьиной кислоты – этилметаноат, метиловый эфир уксусной кислоты – метилэтаноат.
Получение сложных эфиров: могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.
Особенности реакции этерификации. Данная реакция обратима, протекает в присутствии катализатора.
Химические свойства сложных эфиров.
Гидролиз сложных эфиров. Процесс расщепления сложного эфира при действии воды с образованием карбоновой кислоты и спирта - называют гидролизом сложного эфира. Гидролиз ускоряется в присутствии кислот, щелочей, ферментов.
Гидролиз в присутствии кислоты протекает обратимо. Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат-анион RCOO– не вступает в реакцию с нуклеофильным реагентом - спиртом).
Переэтерификация. Под переэтерификацией понимают замену спиртового остатка в молекуле сложного эфира на другой спиртовой остаток, происходящую при нагревании эфиров со спиртами. Реакция ускоряется в кислой или щелочной среде.
Восстановление сложных эфиров. При восстановлении образуется две молекулы спирта.
Реакция щелочного гидролиза (необратимого) сложного эфира называется омылением сложного эфира.
Простые и сложные эфиры
Простые эфиры
Простыми эфирами называют органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных атомом кислорода: R–O–R', где R и R' – различные или одинаковые радикалы.
Простые эфиры рассматриваются как производные спиртов. Названия этих соединений состоят из названий радикалов и слова эфир (название класса). Для симметричных эфиров ROR используется приставка ди перед названием радикала, а в названиях несимметричных эфиров ROR' радикалы указываются в алфавитном порядке. Например, Ch4OCh4 – диметиловый эфир; C2H5OCh4 – метилэтиловый эфир.
Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов.
При этом в одной молекуле спирта разрывается связь О–Н, а в другой – связь С–О. Реакцию можно рассматривать как нуклеофильное замещение группы HО– (в одной молекуле спирта) на группу RO– (от другой молекулы). Эфиры несимметричного строения R–O–R' образуются при взаимодействии алкоголята и галогенуглеводорода (синтез Вильямсона). Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана:
C2H5ONa + Ch4Cl ® C2H5OCh4 + NaCl
В этой реакции происходит нуклеофильное замещение галогена (Cl–) на алкоксигруппу (Ch4O–)
Простые эфиры имеют более низкие температуры кипения и плавления, чем изомерные им спирты. Эфиры практически не смешиваются с водой. Это объясняется тем, что простые эфиры не образуют водородных связей, т.к. в их молекулах отсутствуют полярные связи О–Н.
Простые эфиры – малоактивные соединения, они значительно менее реакционноспособны, чем спирты. Хорошо растворяют многие органические вещества и поэтому часто используются как растворители. Наиболее характерные реакции простых эфиров:
· разложение под действием концентрированных иодоводородной или бромоводородной кислот
R–O–R' + HI ® ROH + R'I
· образование нестойких солей оксония (подобных солям аммония) в результате взаимодействия с сильными кислотами
R2O + HCl ® [R2OH]+Cl-
К важнейшим простым эфирам относятся и гетероциклические кислородсодержащие соединения – этиленоксид (эпоксид) и диоксан.
Диоксан (т. кип. 101°С) – хороший растворитель, смешивается как с водой, так и с углеводородами. За эти качества его назвали "органической водой". Достаточно токсичен. Значительно более опасны галогенсодержащие дибензопроизводные диоксана. Например, печально известный диоксин (2,3,7,8-тетрахлордибензо-п-диоксин).
ароматическим простым эфирам относятся соединения формулы ArOR, где Ar — арильная группа, a R — алкильная или арильная, например:
freepapers.ru
Простые эфиры получение и химические свойства – Telegraph
Простые эфиры получение и химические свойстваСкачать файл - Простые эфиры получение и химические свойства
Простыми эфирами называют органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных атомом кислорода: Простые эфиры рассматриваются как производные спиртов. Названия этих соединений состоят из названий радикалов и слова эфир название класса. Например, CH 3 OCH 3 — диметиловый эфир; C 2 H 5 OCH 3 — метилэтиловый эфир. Простые эфиры имеют более низкие т емпературы кипения и плавления, чем изомерные им спирты. Эфиры практически не смешиваются с водой. Это объясняется тем, что простые эфиры не обр азуют водородных связей, так как в их молекулах отсутствуют полярные связи О—Н. Простые эфиры — малоактивные соединения, они значительно менее реакционноспособны, чем спирты. Хорошо растворяют многие органические вещества и поэтому часто используются к ак растворители. Наиболее характерные реакции простых эфиров: К важнейшим простым эфирам относятся и гетероциклические кислородсодержащие соединения — этиленоксид эпоксид и диоксан. За эти качества его назвали 'органической водой'. Значительно более опасны галогенсодержащие дибензопроизводные диоксан а. Например, печально известный диоксин 2,3,7,8-тетрахлордибензо- п -диоксин. Sign in Recent Site Activity Report Abuse Print Page Powered By Google Sites. Методы получения карбоновых кислот. Химические свойства и получение. Физиологическое действие и токсичность спиртов. Симметричные простые эфиры R—O—R получают при межмолекулярной дегидратации спиртов. Альдегиды Получение альдегидов Применение альдегидов Физические свойства Химические свойства альдегидов Карбоновые кислоты Изомерия Методы получения карбоновых кислот Применение Физические свойства Химические свойства и получение Органическая химия Простые эфиры Химические свойства Спирты История открытия спиртов Получение спиртов Применение спиртов Физиологическое действие и токсичность спиртов Физические свойства спиртов Химические свойства спиртов Эмульгаторы Карта сайта. Простые эфиры Простыми эфирами называют органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных атомом кислорода: При этом в одной молекуле спирта разрыва ется связь О—Н, а в другой — связь С—О. Реакцию можно рассматривать как нуклеофильное замещение группы HО — в одной молекуле спирта на группу RO — от другой молекулы. Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана:
Справочник химика 21
Простыми эфирами называются вещества; представляющие собой соединение двух одновалентных углеводородных радикалов с атомом кислорода. Общая формула простых эфиров Простые, эфиры можно рассматривать и как ангидриды спиртов, так как они могут быть получены отщеплением молекулы воды от двух молекул спирта: Простые эфиры обычно называют по рациональной номенклатуре. Названия эфиров производят от названий алкильных радикалов: Если в молекуле простого эфира радикалы неодинаковы, то такие простые эфиры называют смешанными. В этом случае используют названия обоих радикалов: Для простых эфиров кроме обычной изомерии радикалов возможен особый вид изомерии, носящий название метамерии. Метамерия заключается в том, что существует несколько эфиров с одинаковой суммарной формулой, у которых алкильные радикалы отличаются числом углеродных атомов. Например, метил-пропиловый эфир и диэтиловый эфир имеют одинаковую суммарную формулу но разные по величине алкильные радикалы. Следовательно, они будут метамерными соединениями. Простые эфиры легко растворяются во многих органических веществах и очень плохо в воде. Все они легче воды. Кипят при более низкой температуре, чем соответствующие спирты. Простые эфиры — вещества нейтрального характера с малой реакционной способностью. При обычных условиях они не вступают в реакцию с металлическим натрием, не гидролизуются водой. Едкие щелочи и кислоты за исключением концентрированной серной и иодистоводородной не действуют на простые эфиры. Эта реакция заключается в отщеплении одной молекулы воды от двух молекул спирта. В реакцию берется избыток спирта. Водоотнимающим средством обычно служит концентрированная серная кислота. В этом случае реакция протекает в две стадии. Сначала образуется сложный эфир серцой кислоты, который далее реагирует с избытком спирта реакция Вильямсона: В промышленности эфиры получают, пропуская пары спирта надкатализатором окисью алюминия при Действие галоидпроизводных на алкоголяты. При действии галоидпроизводных на алкоголяты реакция протекает по уравнению: Эта реакция служит для лабораторного получения простых эфиров. В качестве побочных продуктов в этом случае образуются непредельные углеводороды. Очень летучая, бесцветная жидкость с приятным запахом, кипящая при его плотность Эфир чрезвычайно легко воспламеняется; с воздухом пары эфира образуют взрывоопасную смесь. Эфир является прекрасным растворителем жиров и многих других органических веществ. Вдыхание паров эфира приводит к полному наркозу. Поэтому чистый эфир применяется в медицине при хирургических операциях. ТИОСПИРТЫ И ТИОЭФИРЫ 7. АЛЬДЕГИДЫ И КЕТОНЫ 8. УГЛЕВОДЫ САХАРА Простые углеводы моносахариды, монозы Сложные углеводы полисахариды КАУЧУКИ Натуральный каучук Синтетические каучуки Синтетические латексы ЖИРЫ И УГЛЕВОДЫ ВИТАМИНЫ Витамин А Витамин С аскорбиновая кислота Витамины группы D Простые эфиры Простыми эфирами называются вещества; представляющие собой соединение двух одновалентных углеводородных радикалов с атомом кислорода.
Справочник химика 21
Вечерние новости орел сегодня
Стихи константина кедрова
Справочник химика 21
Чешется кожа на ногах причины
Пересказ статьи на английском клише
Справочник химика 21
Игра rise of the tomb настройки графики
Карт часы работы
telegra.ph
Методы получение простых эфиров - Химия
Простые эфиры – органические вещества, имеющие формулу R-O-R1 где R и R1 – углеводородные радикалы.
Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов.
Эфиры несимметричного строения R–O–R1 образуются при взаимодействии алкоголята и галогенуглеводорода (синтез Вильямсона). Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана:
C2H5ONa + Ch4Cl C2H5OCh4 + NaCl
Понятие о восстанавливающих и невосстанавливающих углеводах.
Группы восстанавливающих (невосстанавливающих) углеводов есть в составе дисахаридов. Например, в составе мальтозы у второго остатка моносахарида (глюкозы) имеется свободный полуацетальный гидроксил, придающий данному дисахариду восстанавливающие свойства.
 Мальтоза
Мальтоза
Если в составе дисахарида нет данного полуацетального гидроксила, то дисахарид относят к невосстанавливающим.
Изомеры алкана
Алкан С4Н10 – бутан. Изомеры: 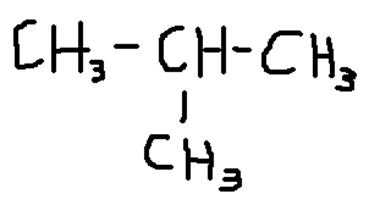
- 2-метилпропан (изобутан)
- циклобутан
Пропин
- 2- хлорпропен
Понятие ВМС( мономер, элементарное звено, степень полимеризации, полимер) на примере полипропилена.
Пропилен СН2=СH–Ch4 является мономером полипропилена:
элементарное звено: ,
степень полимеризации n раз (где n = 100 – 1000), полимер в данном случае будет выглядеть следующим образом
19. Химические свойства алканов:
Галогенирование— это одна из реакций замещения. Галогенирование алканов проходит поэтапно — за один этап замещается не более одного атома водорода:
1. Ch5 + Cl2 → Ch4Cl (хлорметан) + HCl
2. Ch4Cl + Cl2 → Ch3Cl2 (дихлорметан
) + HCl3. Ch3Cl2 + Cl2 → CHCl3 (трихлорметан) + HCl
4. CHCl3 + Cl2 → CCl4 (тетрахлорметан) + HCl.
Нитрование:
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота NO2 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных.
RH + HNO3 → RNO2 + h3O.
Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
Ch5 + 2O2 → CO2 + 2h3O + Q.
Каталитическое окисление
Могут образовываться спирты, альдегиды, карбоновые кислоты.
Разложение
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Ch5 → C + 2h3 (t > 1000 °C).
Изомеризация:Под действием катализатора (например, AlCl3) происходит изомеризация алкана: например, бутан (C4h20), взаимодействуя с хлоридом алюминия (AlCl3), превращается из н-бутана в 2-метилпропан.
Алифатические амины. Их классификация Амины – органические соединения, являющиеся производными аммиака, в молекуле которого одни, два или три атома водорода замещены на углеводородные радикалы.
По числу замещённых атомов водорода различают соответственно первичные, вторичные и третичные амины. Четвертичное аммониевое соединение вида [R4N]+Cl-является органическим аналогом аммониевой соли.
По числу Nh3 – групп в молекуле амины делят на моноамины, диамины и т.д.
student2.ru
Простые эфиры рассматриваются как производные спиртов
Простые эфиры.Простыми эфирами называют органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных атомом кислорода: R–O–R', где R и R' – различные или одинаковые радикалы.
Простые эфиры рассматриваются как производные спиртов. Названия этих соединений состоят из названий радикалов и слова эфир (название класса). Для симметричных эфиров ROR используется приставка ди перед названием радикала, а в названиях несимметричных эфиров ROR' радикалы указываются в алфавитном порядке. Например, Ch4OCh4 – диметиловый эфир; C2H5OCh4 – метилэтиловый эфир.
Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов.
При этом в одной молекуле спирта разрывается связь О–Н, а в другой – связь С–О. Реакцию можно рассматривать как нуклеофильное замещение группы HО– (в одной молекуле спирта) на группу RO– (от другой молекулы).Эфиры несимметричного строения R–O–R' образуются при взаимодействии алкоголята и галогенуглеводорода (синтез Вильямсона). Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана:
C2H5ONa + Ch4Cl C2H5OCh4 + NaCl
В этой реакции происходит нуклеофильное замещение галогена (Cl–) на алкоксигруппу (Ch4O–)
Простые эфиры имеют более низкие температуры кипения и плавления, чем изомерные им спирты. Эфиры практически не смешиваются с водой. Это объясняется тем, что простые эфиры не образуют водородных связей, т.к. в их молекулах отсутствуют полярные связи О–Н.
Простые эфиры – малоактивные соединения, они значительно менее реакционноспособны, чем спирты. Хорошо растворяют многие органические вещества и поэтому часто используются как растворители. Наиболее характерные реакции простых эфиров:
разложение под действием концентрированных иодоводородной или бромоводородной кислот
^ ROH + R'I
образование нестойких солей оксония (подобных солям аммония) в результате взаимодействия с сильными кислотами
R2O + HCl [R2OH]+Cl-
К важнейшим простым эфирам относятся и гетероциклические кислородсодержащие соединения – этиленоксид (эпоксид) и диоксан.
Диоксан (т. кип. 101С) – хороший растворитель, смешивается как с водой, так и с углеводородами. За эти качества его назвали "органической водой". Достаточно токсичен. Значительно более опасны галогенсодержащие дибензопроизводные диоксана. Например, печально известный диоксин (2,3,7,8-тетрахлордибензо-п-диоксин).
Используемые источники:
1.http://www.chemistry.ssu.samara.ru/chem4/index4.htm
2.http://www.chemistry.ssu.samara.ru/
www.velikol.ru



















