Содержание
Как правильно называть сложные эфиры?
Как правильно называть сложные эфиры?
Производные карбоновых или неорганических кислот, в которых атом водорода в гидроксильной группе замещён радикалом, называются сложными эфирами. Обычно общую формулу сложных эфиров обозначают как два углеводородных радикала, присоединённых к карбоксильной группе – C.
Как правильно называть эфиры?
Согласно тривиальной номенклатуре простые эфиры называют по радикалам, связанным с атомом кислорода, добавляя слово «эфир«. По номенклатуре ИЮПАК эфиры рассматривают как алкоксиалканы. Корень слова определяет самая длинная алкильная группа.
Какие виды изомерии характерны для сложных эфиров карбоновых кислот?
Сложные эфиры карбоновых кислот: Изомерия и номенклатура Для сложных эфиров характерны изомерия углеродной цепи, положения сложноэфирной группировки, и межклассовая виды изомерии.
Как получить сложные эфиры?
Важнейшим методом получения сложных эфиров является ацилирование спиртов карбоновыми кислотами или реакция этерификации. Реакция протекает как нуклеофильное замещение в карбоксильной группе. В качестве катализаторов этой реакции используют сильные минеральные кислоты h3SO4, h4PO4, хлороводород и др.
Реакция протекает как нуклеофильное замещение в карбоксильной группе. В качестве катализаторов этой реакции используют сильные минеральные кислоты h3SO4, h4PO4, хлороводород и др.
Какую массу в г этилацетата можно получить из 120 г?
Какую массу (в г) этилацетата можно получить из 120 г уксусной кислоты и 138 г этанола, если выход сложного эфира равен 90%? Ответ: mпракт. (Ch4COOC2H5)=158.
Какую массу этилацетата можно получить в реакции этерификации этанола?
Ответ: 1,98 г.
Какие вещества относятся к сложным эфирам?
Сложными эфирами называют производные карбоновых кислот, в которых атом водорода гидроксильной группы замещен на углеводородный радикал. Сложные эфиры образуются при реакциях карбоновых кислот со спиртами в присутствии катализаторов, например, серной кислоты.
Какие виды изомерии характерны для алканов?
Для алканов характерна структурная изомерия. Структурные изомеры свойственны всем гомологам, начиная с бутана.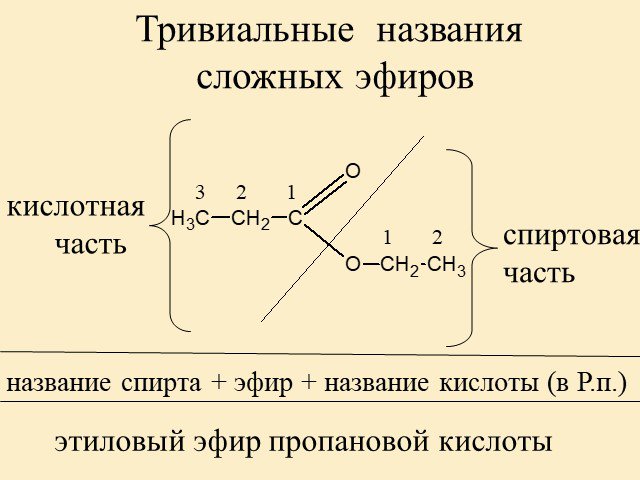 При структурной изомерии заместители присоединяются к атомам углерода в углеродной цепи, образуя сложные разветвлённые цепи.
При структурной изомерии заместители присоединяются к атомам углерода в углеродной цепи, образуя сложные разветвлённые цепи.
Какие виды изомерии характерны для Циклоалканов?
Для циклоалканов характерны следующие виды изомерии:
- Изомерия углеродного скелета;
- Пространственная;
- Межклассовая изомерия с алкенами.
Какие виды изомерии характерны для алкинов?
Для алкинов, так же как и для алкенов, характерна структурная изомерия: изомерия углеродного скелета изомерия положения кратной связи.
Какие виды изомерии характерны для аренов?
Изомерия положения заместителей характерна для аренов, которые содержат два и более заместителей в бензольном кольце.
Какой тип изомерии не характерен для алкинов?
для алкинов не характерна пространственная изомерия.
Какие виды изомерии характерны для углеводородов ряда ацетилена?
Ацетиленовые углеводороды содержат в молекуле одну тройную связь между атомами углерода. Их общая формула СnН2n-2. Для ацетиленовых углеводородов характерна структурная изомерия и изомерия положения тройной связи.
Их общая формула СnН2n-2. Для ацетиленовых углеводородов характерна структурная изомерия и изомерия положения тройной связи.
Какие виды изомерии характерны для альдегидов?
Изомерия альдегидов Для альдегидов характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия. Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т. е.
Какие виды изомерии характерны для углеводородов?
Выделяют два вида изомерии:
- структурная изомерия. Относится к изменению в самом углеводородном скелете, либо в положении функциональных групп относительно углеводородного скелета.
- пространственная изомерия. Касается изменения положения функциональной группы относительно одного атома в цепи.
Какие виды изомерии характерны для карбоновых кислот?
Для предельных карбоновых кислот характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.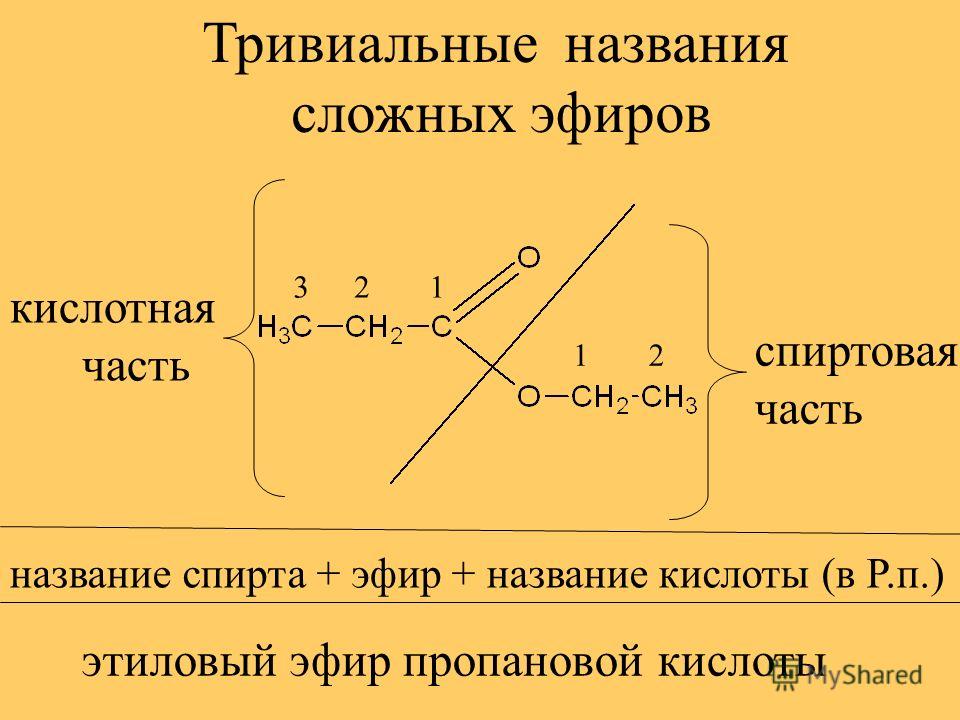
Чему Изомерны карбоновые кислоты?
Изомерия карбоновых кислот — изомерия скелета в углеводородном радикале (начиная с C4). … — Оптическую изомерию проявляют карбоновые кислоты, в молекулах которых присутствует асимметрический атом углерода (sp3-атом, связанный с 4-мя различными заместителями).
Какая простейшая карбоновая кислота имеет изомер?
Одноосновные предельные карбоновые кислоты R—COOH являются изомерами сложных эфиров (сокращенно R’—COOR») с тем же числом атомов углерода. Общая формула и тех, и других Cnh3nO2.
Какие вещества называют предельными основными карбоновыми кислотами?
1 Какие вещества называют предельными одноосновными карбоновыми кислотами? 1. Предельные одноосновные карбоновые кислоты — органические соединения, молекулы которых содержат одну карбоксильную группу — COOH, связанную с предельным насыщенным углеводородным радикалом.
Что будет взаимодействовать с уксусной кислотой?
Химия. Химические свойства уксусной кислоты схожи со свойствами неорганических кислот. Уксусная кислота реагирует с оксидами металлов. При обычных условиях реакция оксида меди двухвалентной и уксусной кислоты идет медленно.
Химические свойства уксусной кислоты схожи со свойствами неорганических кислот. Уксусная кислота реагирует с оксидами металлов. При обычных условиях реакция оксида меди двухвалентной и уксусной кислоты идет медленно.
Какие металлы будут реагировать с уксусной кислотой?
являются слабыми кислотами и очень медленно реагируют с такими металлами как цинк, хром, железо, никель, олово, свинец (хотя с основаниями и оксидами металлов они способны реагировать) .
Чем опасна уксусная кислота?
Если принять несколько глотков уксусной эссенции или кислоты, то на первое место выходят поражения пищевода — его сильный, глубокий, большой площади ожог, человек может погибнуть от болевого шока. Если от болевого шока он оправился, выжил, то неминуемо поражение внутренних органов — крови, печени, почек.
Какие свойства проявляет уксусная кислота?
Физические свойства Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями; в уксусной кислоте хорошо растворимы неорганические соединения и газы, такие как HF, HCl, HBr, HI и другие.
Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями; в уксусной кислоте хорошо растворимы неорганические соединения и газы, такие как HF, HCl, HBr, HI и другие.
Что разъедает уксус?
Врачи предупреждают, что уксус, как любая другая кислота, разъедает кислотно-щелочную среду желудка (если принимать его натощак), тем самым нанося вред слизистой оболочке желудка. Однако и пренебрегать употреблением уксуса не стоит. Особенно полезным считается яблочный уксус.
Где в природе встречается уксусная кислота?
Уксусная кислота широко распространена в природе. Она содержится в выделениях животных (моче, желчи, испражнениях), в растениях (в частности, в зеленых листьях). Эта кислота встречается как в свободном виде, так и в виде солей и эфиров, она присутствует в кислом молоке и сыре.
Сколько граммов уксусной кислоты можно получить из 112?
Ответ: масса уксусной кислоты одинакова 300 г.
«Сложные эфиры»
ч. 1
Тема «Сложные эфиры»
Теория
Сложные эфиры — производные кислот, у которых атом водорода в карбоксильной группе замещен на углеводородный радикал.
Общая формула сложных эфиров карбоновых кислот:
где R и R’ — углеводородные радикалы (в сложных эфиpax муравьиной (метановой) кислоты R — атом водорода).
Номенклатура сложных эфиров
Названия сложных эфиров производят от названия углеводородного радикала и названия кислоты, в котором вместо окончания -овая используют суффикс —ат, например:
Физические свойства и нахождение в природе
Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, нерастворимые в воде жидкости. Многие из них имеют приятный запах. Так, например, бутилбутират имеет запах ананаса, изоамилацетат — груши и т. д.
Сложные эфиры высших жирных кислот и спиртов — воскообразные вещества, не имеют запаха, в воде не растворимы.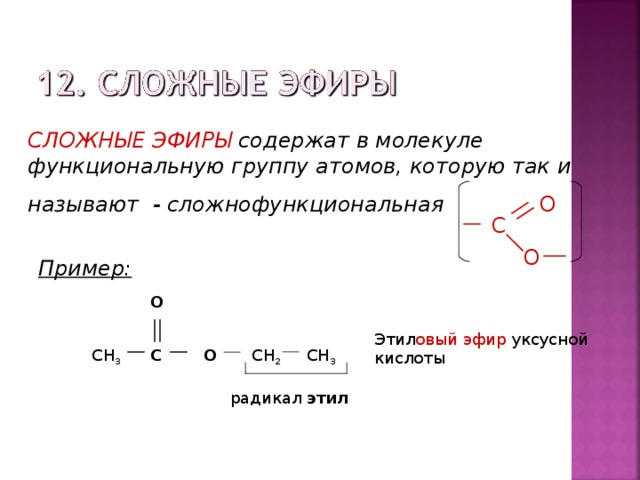
Приятный аромат цветов, плодов, ягод в значительной степени обусловлен присутствием в них тех или иных сложных эфиров.
Сложные эфиры высших карбоновых кислот и высших одноосновных спиртов называют восками. Так, пчелиный воск состоит, главным образом, из эфира пальмитиновой кислоты и мирицилового спирта С15Н31СООС31Н63, кашалотовый воск — спермацет — сложный эфир той же пальмитиновой кислоты и цетилового спирта С15Н31СООС16Н33.
Химические свойства сложных эфиров
1.Реакция гидролиза, или омыления. Так, как реакция этерификации является обратимой, поэтому в присутствии кислот протекает обратная реакция гидролиза:
Реакция гидролиза катализируется и щелочами; в этом случае гидролиз необратим, так как получающаяся кислота со щелочью образует соль:
2. Реакция присоединения. Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения.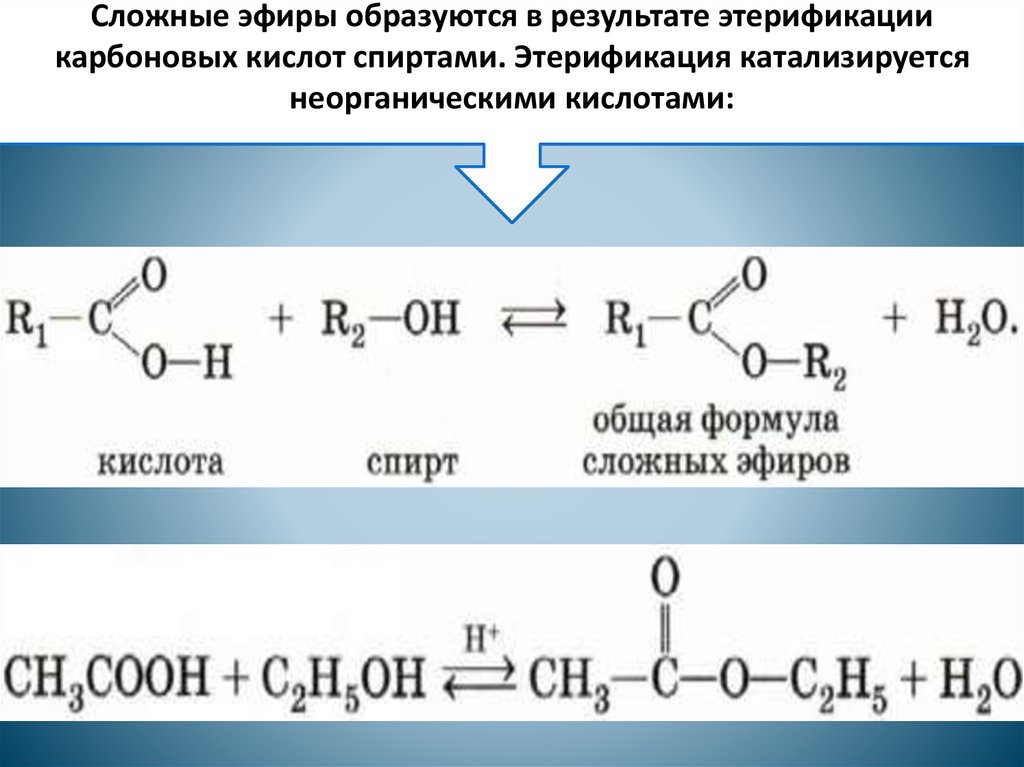
Получение
Реакция этерификации – это реакция, протекающая между карбоновыми кислотами и спиртом, в результате которой получается сложные эфиры.
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
Применение сложных эфиров органических кислот
Наибольшее применение в качестве растворителей получили эфиры уксусной кислоты — ацетаты. Прочие эфиры (кислот молочной — лактаты, масляной — бутираты, муравьиной — формиаты) нашли ограниченное применение. Формиаты из-за сильной омыляемости и высокой токсичности в настоящее время не используются. Определенный интерес представляют растворители на основе изобутилового спирта и синтетических жирных кислот.
Метилацетат СН3СООСН3 отечественной промышленностью выпускается в виде древесно-спиртового растворителя, в котором содержится 50% (масс.) основного продукта. Метилацетат также образуется в виде побочного продукта при производстве поливинилового спирта. По растворяющей способности метилацетат аналогичен ацетону и применяется в ряде случаев как его заменитель. Однако он обладает большей токсичностью, чем ацетон.
Метилацетат также образуется в виде побочного продукта при производстве поливинилового спирта. По растворяющей способности метилацетат аналогичен ацетону и применяется в ряде случаев как его заменитель. Однако он обладает большей токсичностью, чем ацетон.
Этилацетат С2Н5СООСН3 получают методом этерификации на лесохимических предприятиях при переработке синтетической и лесохимической уксусной кислоты, гидролизного и синтетического этилового спирта или конденсацией ацетальдегида. За рубежом разработан процесс получения этилацетата на основе метилового спирта.
Этилацетат подобно ацетону растворяет большинство полимеров. По сравнению с ацетоном его преимущество в более высокой температуре кипения (меньшей летучести). Добавка 15-20 % этилового спирта повышает растворяющую способность этилацетата в отношении эфиров целлюлозы, особенно ацетилцеллюлозы.
Пропилацетат СН3СООСН2СН2СН3. По растворяющей способности подобен этилацетату.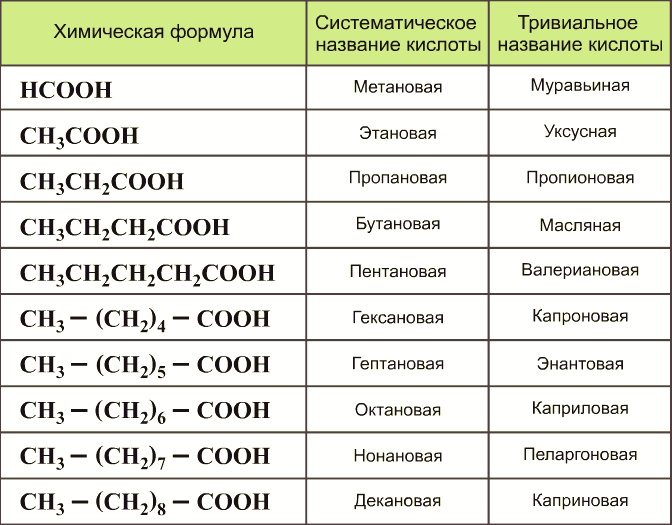
Изопропилацетат СН3СООСН(СН3)2. По свойствам занимает промежуточное положение между этил- и пропилацетатом.
Амилацетат CH3COOCH2CH2CH2CH2CH3, tкип. = 148° С, иногда называют «банановым маслом» (которое он напоминает по запаху). Он образуется в реакции между амиловым спиртом (часто – сивушным маслом) и уксусной кислотой в присутствии катализатора. Амилацетат широко применяется как растворитель для лаков, поскольку он испаряется медленнее, чем этилацетат.
Фруктовые эфиры. Характер многих фруктовых запахов, таких, как запахи малины, вишни, винограда и рома, отчасти обусловлен летучими эфирами, например, этиловым и изоамиловым эфирами муравьиной, уксусной, масляной и валериановой кислот. Имеющиеся в продаже эссенции, имитирующие эти запахи, содержат подобные эфиры.
Исходя из вышесказанного, можно сделать вывод, что сложные эфиры находят широкое применение, как в быту, так и в промышленности. Некоторые из сложных эфиров готовятся искусственно и под названием «фруктовых эссенций» широко применяются в кондитерском деле, в производстве прохладительных напитков, в парфюмерии и во многих других отраслях. Жиры используют для многих технических целей. Однако особенно велико их значение как важнейшей составной части рациона человека и животных, наряду с углеводами и белками. Прекращение использования пищевых жиров в технике и замена их непищевыми материалами – одна из важнейших задач народного хозяйства. Эта задача может быть разрешена только при достаточно основательных знаниях о сложных эфирах и дальнейшем изучении этого класса органических соединений.
Некоторые из сложных эфиров готовятся искусственно и под названием «фруктовых эссенций» широко применяются в кондитерском деле, в производстве прохладительных напитков, в парфюмерии и во многих других отраслях. Жиры используют для многих технических целей. Однако особенно велико их значение как важнейшей составной части рациона человека и животных, наряду с углеводами и белками. Прекращение использования пищевых жиров в технике и замена их непищевыми материалами – одна из важнейших задач народного хозяйства. Эта задача может быть разрешена только при достаточно основательных знаниях о сложных эфирах и дальнейшем изучении этого класса органических соединений.
Сложные эфиры широко распространены в природе, находят применение в технике и различных отраслях промышленности (схема 10). Они являются хорошими растворителями органических веществ, их плотность меньше плотности воды, и они практически не растворяются в ней.
Схема 10. Применение сложных эфиров
Так, сложные эфиры с относительно небольшой молекулярной массой представляют собой легковоспламеняющиеся жидкости с невысокими температурами кипения, имеют запахи различных фруктов.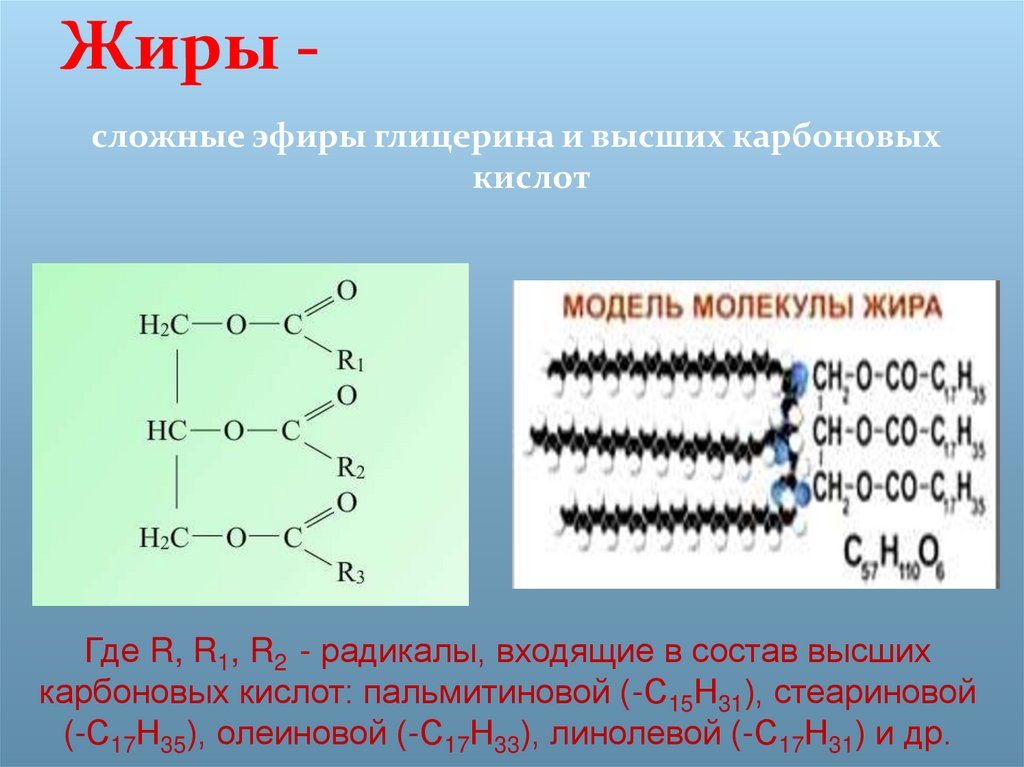 Их применяют как растворители лаков и красок, ароматизаторы изделий пищевой промышленности. Например, метиловый эфир масляной кислоты имеет запах яблок, этиловый эфир этой кислоты — запах ананасов, изобутиловый эфир уксусной кислоты — запах бананов.
Их применяют как растворители лаков и красок, ароматизаторы изделий пищевой промышленности. Например, метиловый эфир масляной кислоты имеет запах яблок, этиловый эфир этой кислоты — запах ананасов, изобутиловый эфир уксусной кислоты — запах бананов.
Ответьте на вопросы
-
Сравните общие формулы простых и сложных эфиров. Что общего в их строении и что отличает их друг от друга? -
Как называется реакция, обратная реакции этерификации? К каким классам веществ относятся реагенты и продукты этой реакции? -
Каково минимальное количество атомов углерода в молекуле сложного эфира? Составьте структурную формулу этого эфира и назовите его. Определите массовые доли химических элементов в нем. При взаимодействии, каких веществ может быть получен этот эфир? Приведите уравнение соответствующей реакции и реакций горения и гидролиза этого эфира. -
Каково строение жиров и сложных эфиров?
5. Сколько изомеров у соединения состава C2H4O2?
Сколько изомеров у соединения состава C2H4O2?
6. Перечислите свойства сложных эфиров.
7. Назовите сложный эфир, образованный уксусной кислотой и этиловым спиртом.
8. Как образуется название сложного эфира на примере метилацетата?
ч. 1
Названия сложных эфиров — видео по органической химии
Гл. 20 — Производные карбоновых кислот: Рабочий лист NAS Посмотреть все главы
| Гл. 1 — Обзор общей химии | 4 часа и 48 минут | 0% выполнено | Рабочий лист Скачать рабочий лист видеоурока Начало | 1 час и 12 минут | 0% завершения | Рабочий лист Скачать рабочий лист видеоурока Старт | |||
| Гл. 3 — Кислоты и щелочи | 2 часа и 45 минут | Выполнено 0% | Рабочий лист Загрузить рабочий лист видеоурока Начало | 9 | 4 часа и 19 минут | 0% завершено | Рабочий лист Скачать рабочий лист видеоурока Старт | ||
Гл. 5 — Хиральность 5 — Хиральность | 3 часа и 33 минуты | 0% завершено | Рабочий лист Загрузить рабочий лист видеоурока Начало | 9 9. 6 — Термодинамика и кинетика | 1 час и 19 минут | Выполнено 0% | Рабочий лист Скачать рабочий лист видеоурока Старт | ||
| Гл. 7 — Реакции замещения | 1 час и 46 минут | 0% завершено | Рабочий лист Загрузить рабочий лист видеоурока Начало 9 | ||||||
| 2 часа и 25 минут | 0% завершено | Рабочий лист Скачать рабочий лист видеоурока Начало | Гл. 9 — Алкены и алкины | 2 часа и 10 минут | Выполнено 0% | Рабочий лист Скачать рабочий лист видеоурока Начало | 3 часа и 32 минуты | Выполнено 0% | Рабочий лист Загрузить рабочий лист видеоурока Начало | 8 | 2 11 — Радикальные реакции | 1 час и 55 минут | Выполнено 0% | Рабочий лист Загрузить рабочий лист видеоурока Начало | 5 Гл.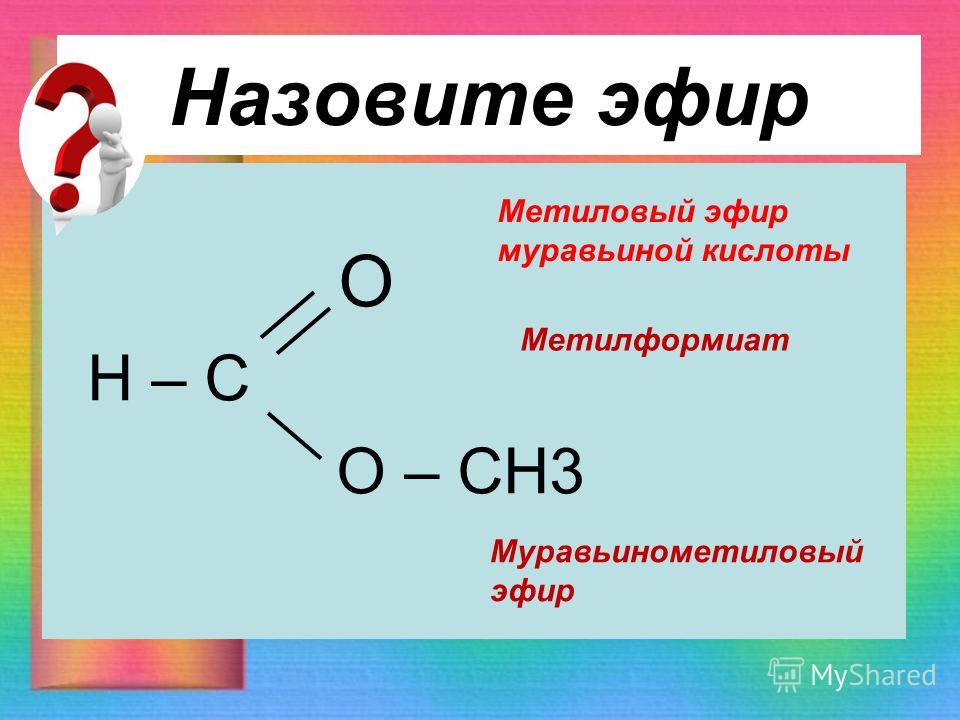 12 — спирты, эфиры, эпоксиды и тиолы 12 — спирты, эфиры, эпоксиды и тиолы | 2 часа и 42 минуты | 0%. Завершите | Рабочий лист Скачать видео -лист урока Start |
| Ch. 13 — Спирты и карбонильные соединения | 2 часа и 14 минут | Выполнено 0% | Рабочий лист Загрузить рабочий лист видеоурока Начало | ||||||
| Гл. 14 — Синтетические методы | 1 час и 28 минут | 0% завершено | Рабочий лист Скачать рабочий лист видеоурока Начало 9 2 15 — Аналитические методы: ИК, ЯМР, масс-спектр | 7 часов и 20 минут | Выполнено 0% | Рабочий лист Скачать рабочий лист видеоурока Начало | |||
Гл. 16 — Сопряженные системы 16 — Сопряженные системы | 5 часов и 49 минут | 0% завершено | Рабочий лист Загрузить рабочий лист видеоурока Начало 92 17 — Ароматичность | 2 часа и 24 минуты | 0% завершения | Рабочий лист Скачать рабочий лист видеоурока Старт | |||
| Гл. 18 — Реакция ароматики: EAS и Beyond | 4HRS & 31MINS | 0%. Завершите | Рабочий лист Скачать видео -лист урока Start | ||||||
| Ch. 19 — Альдегиды и кетоны: нуклеофильная добавка | 4 часа и 54 минуты | 0% завершения | Рабочий лист Скачать рабочий лист видеоурока Старт | ||||||
Гл. 20 — Производные карбоновой кислоты: NAS 20 — Производные карбоновой кислоты: NAS | 2HRS & 3MINS | 0%. Завершите | Рабочий лист Скачать рабочный лист видео урок Start | ||||||
| Ch. 21 — Химия енолята: реакции на альфа-углероде | 1 час и 56 минут | 0% завершения | Рабочий лист Скачать рабочий лист видеоурока Старт | ||||||
| Гл. 22 — Химия конденсации | 2 часа и 13 минут | 0% завершено | Рабочий лист Скачать рабочий лист видеоурока Начало | 1 час и 43 минуты | Выполнено 0% | Рабочий лист Скачать рабочий лист видеоурока Старт | |||
Гл.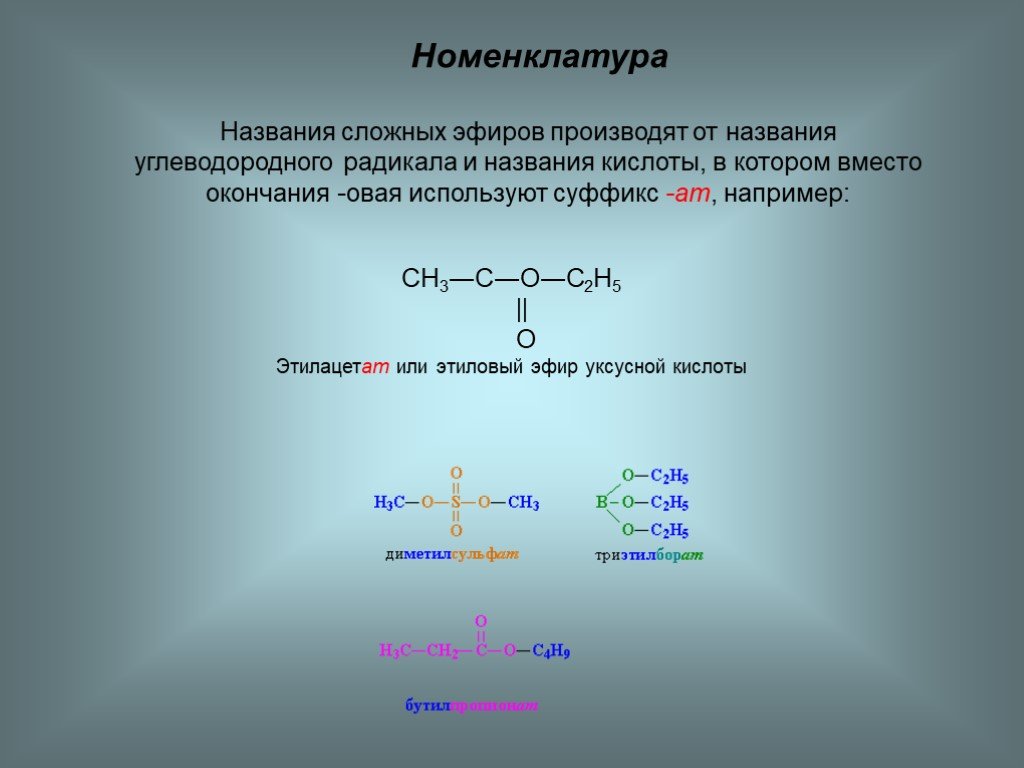 24 — Углеводы 24 — Углеводы | 5 часов и 56 минут | Выполнено 0% | Рабочий лист Загрузить рабочий лист видеоурока Начало | 15 минут | 0% выполнено | Рабочий лист Скачать рабочий лист видеоурока Начало | 2 часа и 54 минуты | 0% завершено | Рабочий лист Загрузить рабочий лист видеоурока Начало | 5 часов и 33 минуты | 0%. Завершите | Рабочий лист Скачать рабочий урок СТАРТ |
SEE
9000
.0502
Learn
Learn
Обучение
УЧЕБНО
Обучение
Learn
 мин
минОбучение
Learn
Summary
Learn
Learn
Резюме
Обучение
Learn
Learn
Обучение
Резюме
| Дополнительные руководства |
|---|
| Карбоновая кислота |
| Сложные эфиры |
Узнать
Следующий разделНазвание нитрилов
3 90 Почему? Потому что мы вообще не увидим слова «e ster» в названии.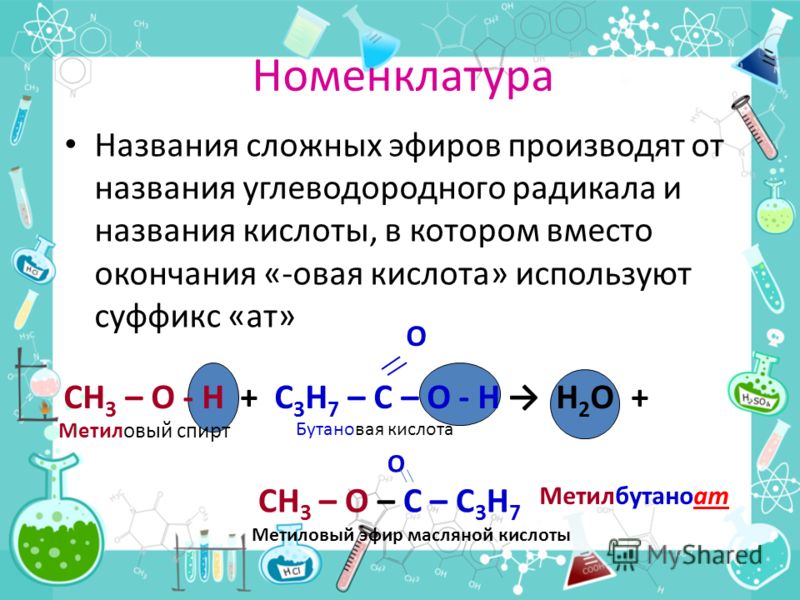 Так как же мы их назовем?
Так как же мы их назовем?
Что ж, мы можем назвать их, используя как Common , так и IUPAC , а также разбив функциональную группу на 2. Давайте посмотрим.
Концепция №1: Номенклатура сложных эфиров
- Название алкил + карбоксилат
Пример №1: Назовите структуру
Пример №2: Нарисуйте молекулу
Предыдущий раздел Номенклатура дикислот
Следующий разделНазвание нитрилов
Вопрос Видео: Название сложного эфира по его конденсированной формуле
Стенограмма видео
Какое название по номенклатуре ИЮПАК имеет сложный эфир Ch4Ch3COOCh3Ch4? (A) пропилэтаноат, (B) этилэтаноат, (C) этоксипропанокси, (D) пропилпропаноат или (E) этилпропаноат.
Номенклатура — это выбор названий для вещей, особенно в науке. Nomen- на латыни означает имя, а -clature происходит от латинского слова, означающего призвание. IUPAC — Международный союз теоретической и прикладной химии.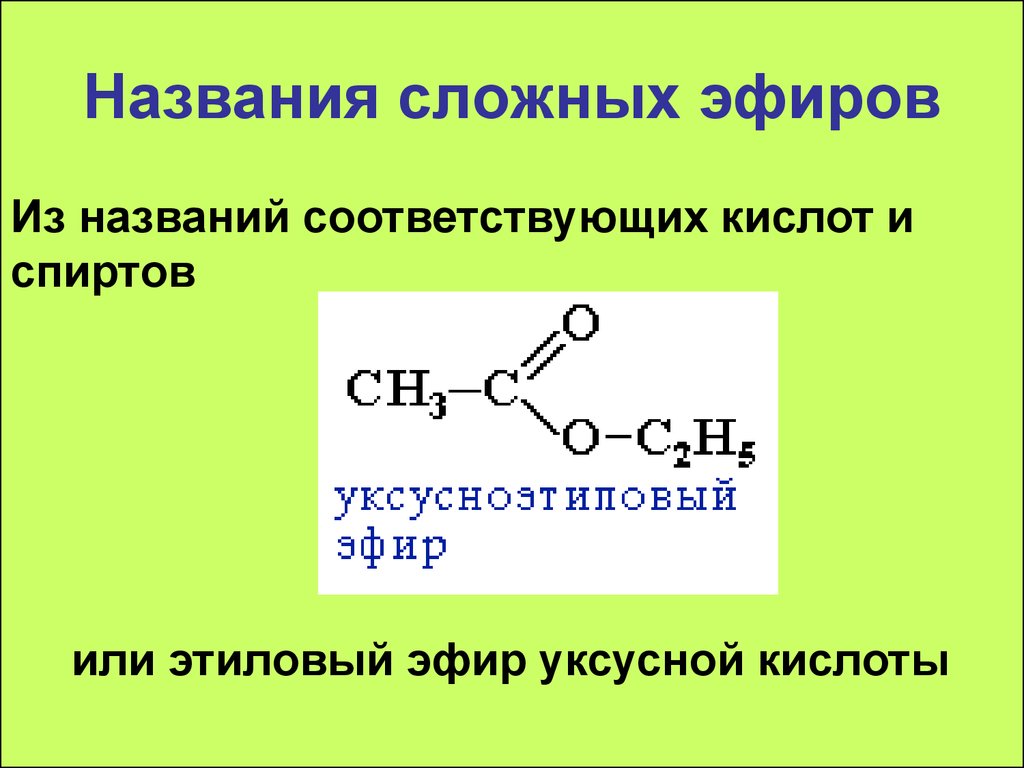 ИЮПАК определил ряд правил именования соединений. Название IUPAC для сложных эфиров состоит из двух частей. Но прежде чем мы назовем сложный эфир, нам нужно знать, как он выглядит. Это отображаемая формула для общего сложного эфира, где эта группа R, представляющая остальную часть молекулы, может быть алкильной группой, арильной группой или атомом водорода. И эта группа R может быть алкильной группой или арильной группой.
ИЮПАК определил ряд правил именования соединений. Название IUPAC для сложных эфиров состоит из двух частей. Но прежде чем мы назовем сложный эфир, нам нужно знать, как он выглядит. Это отображаемая формула для общего сложного эфира, где эта группа R, представляющая остальную часть молекулы, может быть алкильной группой, арильной группой или атомом водорода. И эта группа R может быть алкильной группой или арильной группой.
Это отображаемая формула сложного эфира, но вопрос дает нам сокращенную структурную формулу. Итак, давайте перепишем эту отображаемую формулу в виде сокращенной структурной формулы. Пишем слева направо. Итак, во-первых, у нас есть первая группа R, затем карбонильный углерод, затем атом кислорода в двойной связи CO, затем, наконец, другой атом кислорода и другая группа R.
Теперь, когда мы знаем, как выглядит сложный эфир, давайте посмотрим, как его назвать. Прежде всего, нам нужно расщепить сложный эфир по его одинарной связи CO, а затем найти его исходные молекулы, которыми являются карбоновая кислота и спирт. Это молекулы, которые можно использовать для получения сложного эфира. Чтобы определить, какая карбоновая кислота использовалась для получения сложного эфира, мы добавляем группу ОН или гидроксильную группу к карбонильному углероду. А чтобы узнать, из какого спирта был получен эфир, мы присоединяем атом водорода к атому кислорода в другой части молекулы эфира.
Это молекулы, которые можно использовать для получения сложного эфира. Чтобы определить, какая карбоновая кислота использовалась для получения сложного эфира, мы добавляем группу ОН или гидроксильную группу к карбонильному углероду. А чтобы узнать, из какого спирта был получен эфир, мы присоединяем атом водорода к атому кислорода в другой части молекулы эфира.
Теперь, когда у нас есть две родительские молекулы, нам нужно дать им имена. Поиск названий исходных молекул сложного эфира поможет нам найти название сложного эфира. Чтобы найти первую часть названия сложного эфира, мы берем первую часть названия спирта и добавляем суффикс -ил. Чтобы найти вторую часть названия сложного эфира, мы берем первую часть названия карбоновой кислоты и добавляем суффикс -оат. Теперь, когда мы знаем, как назвать сложный эфир, давайте посмотрим на сложный эфир, указанный в вопросе. Чтобы упростить задачу, сначала нарисуем структурную формулу. Как и прежде, идем слева направо. Мы начинаем с группы Ch4, затем с группы Ch3, затем с карбонильной группы, атома кислорода с простой связью и, наконец, с другой группы Ch3 и Ch4.
Наш первый шаг включает в себя расщепление сложного эфира по одинарной связи CO. Затем нам нужно найти исходные молекулы сложного эфира, которыми являются карбоновая кислота и спирт. Это молекулы, которые можно использовать для получения сложного эфира. Чтобы найти карбоновую кислоту, используемую для получения сложного эфира, мы добавляем группу ОН или гидроксильную группу к карбонильному углероду. А чтобы найти спирт, используемый для получения сложного эфира, мы присоединяем атом водорода к атому кислорода в другой части молекулы сложного эфира. Наш следующий шаг заключается в том, чтобы назвать эту карбоновую кислоту и спирт. Карбоновая кислота содержит три атома углерода, что дает приставку проп-. Они связаны одинарной связью, что дает -an-, и, конечно же, он содержит функциональную группу карбоновой кислоты. Поэтому мы добавляем -овую кислоту в конце названия. Следовательно, наша карбоновая кислота — это пропановая кислота.
Спирт содержит два атома углерода, что дает нам префикс eth-.
