Как получить спирт из природного газа. Как из эфира получить спирт
Получение предельных одноатомных спиртов | Химия онлайн
К наиболее часто используемым химическим способам получения спиртов относятся:
1.Гидратация алкенов (промышленный способ получения этанола для технических целей)
(t, Р, кислая среда (катализатор))
2.Щелочной гидролиз галогеналканов (лабораторный способ получения)
(водный раствор щелочи, t)
3.Восстановление альдегидов и кетонов (лабораторный способ получения)
(t, катализатор –Ni)
Особые способы получения метанола и этанола
1.Получение метанола из синтез-газа (водяной газ, генераторный газ)
(t, Р, оксидные катализаторы)
2.Получение этанола ферментативным брожением глюкозы (получение этилового спирта для пищевых и медицинских целей)
(ферменты — дрожжи)
1. Гидратация алкенов
Гидратация алкенов используется в промышленности для получения спиртов из продуктов нефтепереработки.
Присоединение воды к алкенам происходит в присутствии разбавленной серной или фосфорной кислот. Эта реакция протекает в соответствии с правилом Марковникова, поэтому первичный спирт можно получить только из этилена, а остальные алкены дают вторичные или третичные спирты:
Этот метод в лабораторных условиях нашел ограниченную область применения для получения третичных спиртов.
2. Гидролиз галогеналканов в водном растворе щелочи
В лабораторных условиях спирты получают действием водного раствора щелочи на алкилгалогениды при нагревании, при этом атом галогена в галогеналкане замещается группой –ОН:
С помощью этой реакции можно получать первичные, вторичные и третичные спирты.
При действии спиртового раствора щелочи на галогеналканы происходит отщепление галогеноводорода и образование алкена.
3. Восстановление карбонильных соединений (альдегидов и кетонов)
Дегидрирование спиртов по своей химической сущности является окислением. Обратная реакция – гидрирование альдегидов, кетонов и эфиров карбоновых кислот – является, таким образом, их восстановлением.
При действии водорода в присутствии катализаторов (Ni, Pt, Pd) альдегиды восстанавливаются до первичных спиртов, а кетоны – до вторичных спиртов: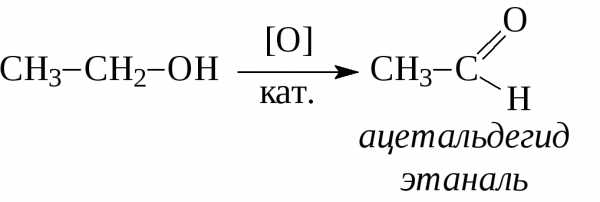
4. Восстановление эфиров карбоновых кислот
Гидрирование сложных эфиров проходит через стадию образования альдегидов:
Этим методом в промышленности из метиловых эфиров высших кислот получают высшие первичные спирты, например:
5. Гидролиз сложных эфиров карбоновых кислот в щелочной среде
Гидролиз сложных эфиров карбоновых кислот протекает как в кислой, так и в щелочной среде (водные или спиртовые растворы NaOH, КОН, а также Ba (OH)2, Ca (OH)2, Ba (OH)2, Ca (OH)2). Однако к образованию спиртов приводит гидролиз, протекающий необратимо в щелочной среде:
6. Синтез спиртов из карбонильных соединений с помощью магнийорганических соединений
Спирты образуются при многочисленных реакциях металлоорганических соединений с различными соединениями, содержащими карбонильную группу >С=О. Этим способом можно получать как первичные спирты, так и вторичные и третичные:
7. Окисление алканов
При мягком окислении метана кислородом воздуха в присутствии различных катализаторов образуются метанол, формальдегид или муравьиная кислота:
Специфические способы получения метанола и этанола
Производство метанола крупнотоннажное, т.к. метиловый спирт является исходным веществом для получения других продуктов органического синтеза.
В промышленности
1. Получение метанола из синтез-газа (водяной газ, генераторный газ)
а) Конверсия природного газа в синтез-газ
Его получают из метана с перегретым водяным паром:
б) Каталитический синтез метанола из оксида углерода (II) и водорода
В качестве катализаторов используют смесь оксидов цинка, меди и хрома, температуру поддерживают в интервале 200-300 оС, а давление – от 40 до 150 атм.
Газ на выходе из реактора содержит 3-5% Ch4OH, затем газ охлаждают и конденсируют полученный метанол, а оставшийся газ смешивают с исходным газом и направляют снова в реактор.
Ранее метанол получали сухой перегонкой древесины без доступа воздуха (отсюда его название «древесный спирт»).
2. Получение этанола спиртовым брожением глюкозы
Ферментативный гидролиз крахмала – наиболее древний синтетический процесс, используемый человеком – до сих пор имеет огромное значение для получения этилового спирта.
Протекает только в присутствии ферментов, которые вырабатывают некоторые микроорганизмы, например, дрожжи:
Глюкоза содержится во фруктовых соках. Глюкозу можно получить гидролизом крахмала (зерно, картофель, целлюлозные опилки):
Предельные одноатомные спирты
himija-online.ru
Получение спиртов, применение, свойства. Способы получения спиртов :: SYL.ru
Спирты распространены в природе. Большинство людей знакомы с этиловым спиртом (этанолом) - активным ингредиентом алкогольных напитков, но он является лишь одним из семейства органических соединений, известных как спирты. Получение их, прежде всего этилового (винного в результате ферментативного брожения виноградного сока стало одним из первых химических техпроцессов, освоенных человечеством.
Номенклатура спиртов
Спирты представляет собой органические соединения гидроксильной (ОН) функциональной группы с алифатическим атомом углерода. Поскольку ОН является принадлежностью молекул всех спиртов, их часто представляют как производными воды с общей формулой ROH, где R обозначает алкильную группу.
Получение спиртов метанола (СН3ОН) и этанола (СН3СН2ОН), являющихся первыми двумя членами их гомологического ряда, является важной задачей химической промышленности многих стран. При содержании от одного до четырех атомов углерода их часто называют общими именами, в которых за названием алкильной группы следует слово спирт: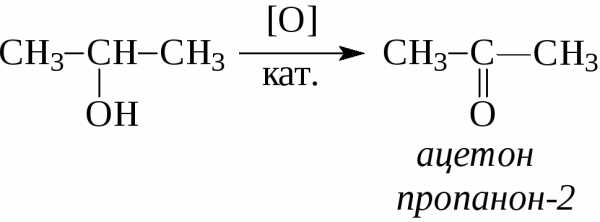
Можно видеть, что все четыре (две последние являются изомерами одного вещества) представленные выше молекулы спиртов содержат одну гидроксильную группу. По этому признаку все они относятся к классу одноатомных спиртов (бывают и двух-, трех, четырех- и многоатомные). Кроме того, все они являются производными предельных углеводородов из ряда алканов: метана, этана, пропана (названия спиртов получают добавлением к названию алкена окончания «-ол»). Поэтому их еще называют предельными одноатомными спиртами.
Одноатомные спирты
Получение, свойства (как физические, так и химические) этих соединений зависят от количества атомов углерода, присоединенных к его же атому, непосредственно связанному с группой ОН. Поэтому одноатомные спирты могут быть сгруппированы в три класса на этой основе.
- Первичные спирты имеют молекулу, в которой один атом углерода, связанный с ОН-группой, присоединен к еще одному атому C. Их общая формула RCh3ОН. Например, этанол – первичный спирт.
- Вторичные спирты имеют в молекуле один атом углерода с ОН-группой, присоединенный к двум другими атомам C. Их общая формула R2СНОН. К ним относятся пропиловый и изопропиловый спирты.
- Третичные спирты содержат в молекуле атом углерода с ОН-группой, присоединенный к трем другими атомам C. Их общая формула R3СОН.
Получение одноатомных спиртов в промышленности возможно целым рядом способов, которые будут рассмотрены ниже.
Метанол как продукт природного газа
Метанол получают смешиванием газа водорода и монооксида углерода при высоких температурах и давлениях (200 ат, 350 °C) в присутствии катализатора, состоящего из оксида цинка (ZnO) и оксида хрома (Cr2 O3) в качестве катализатора: 2h3 + CO → Ch4OH.
При этом сырьем для получения реагентов являются природный газ и водяной пар, смешивая которые, получают синтез – газ, представляющий собой смесь CO и h3.
Метанол является важным растворителем и используется в качестве автомобильного топлива, либо в виде чистой жидкости – в некоторых гоночных автомобилях, либо в качестве высокооктановой добавки в бензин. Получение и применение спиртов в мире, и в частности метанола, измеряется миллионами тонн. По итогам 2013 г. в мире было потреблено 66 млн т метанола, из них 65 % в Азии, 17 % - в Европе и 11 % - в США.
Получение предельных спиртов из алкенов
Многие простые весовые спирты, имеющие промышленное значение, производятся гидратацией (добавлением воды) алкенов (этилена, пропилена, бутена). Этанол, изопропанол, бутанол (вторичный и третичный) получают по этой реакции.
Известны прямой и косвенный способы получения спиртов гидратацией. Прямой позволяет избежать образования стабильных промежуточных продуктов, как правило, с помощью кислых катализаторов.
Катализатором обычно является фосфорная кислота, адсорбированная на пористом носителе, таком как силикагель или кизельгур. Этот катализатор был впервые использован для крупномасштабного производства этанола в США компанией "Шелл" в 1947 году. Реакцию проводят в присутствии пара высокого давления при 300 °C, причем между этиленом и паром поддерживается соотношение 1,0: 0,6.
Аналогичная реакция производства изопропилового спирта с катализаторов в виде серной кислоты выглядит следующим образом
Косвенный способ гидратации этилена
В косвенным способе, на практике впервые примененном в промышленном масштабе в 1930 году, но сегодня считающимся почти полностью устаревшим, реакция получения спиртов заключается в превращении алкена в сульфат эфиры, который затем гидролизуют. Традиционно алкен обрабатывают серной кислотой с получением алкильные сульфатных эфиров. В случае производства этанола, этот шаг может быть записан так: Н2SO4 + С2 Н4 → C2H5 -O-SO3H
Впоследствии этот сульфат эфира гидролизуют до регенерации серной кислоты и освобождения этанола: С2Н5-O-SO3H + h3O → h3SO4 + С2Н5ОН.
Способы получения спиртов чрезвычайно разнообразны, но нижеописанный процесс, пожалуй, известен, хотя бы понаслышке каждому читателю.
Спиртовое брожение
Это биологический процесс, в котором молекулы, такие как глюкоза, фруктоза и сахароза, преобразуются в клеточную энергию с параллельным производством этанола и углекислого газа в качестве продуктов метаболизма. Брожение катализируется ферментами, содержащимися в дрожжах и протекает по сложному многоступенчатому механизму, которое включает в общем случае преобразование (на первом этапе) крахмала, содержащегося в растительных зернах, в глюкозу с последующим получением из нее этанола. Поскольку дрожжи выполняют это преобразование в отсутствие кислорода, спиртовое брожение считается анаэробным процессом.
Реакции получения спиртов брожением можно представить следующим образом:
Способы получения алкогольных напитков
Весь этанол, содержащийся в алкогольных напитках производится посредством ферментации, вызванной дрожжами.
Вино производится путем ферментации из натуральных сахаров, присутствующих в винограде; сидр получают аналогичной ферментацией природного сахара в яблоках и грушах, соответственно; и другие фруктовые вина производятся ферментацией сахаров в любых других видах фруктов. Бренди и коньячные спирты (например, сливовица) производятся при перегонке напитков, получаемых брожением фруктовых сахаров.
Медовые напитки производятся путем ферментации из натуральных сахаров, присутствующих в меде.
Пиво, виски, и водка производятся путем ферментации зерен крахмала, которые преобразуются в сахар под действием фермента амилазы, присутствующей в зерновых ядрах, подвергшихся солодовому проращиванию. Другие источники крахмала (например, картофель и не солодовое зерно) могут быть добавлены к смеси, так как амилаза будет действовать также и на их крахмал.
Рисовые вина (в том числе саке) получают путем брожения зерновых крахмалов, превращаемых в сахар грибками Aspergillus огугае.
Ром и некоторые другие напитки получают ферментацией и дистилляцией сахарного тростника. Ром, как правило, производится из продукта сахарного тростника – патоки.
Во всех случаях брожение должно происходить в сосуде, который позволяет двуокиси углерода выходить, но предотвращает приход наружного воздуха. Это нужно потому, что воздействие кислорода предотвращает образование этанола, а накопление диоксида углерода создает риск разрыва сосуда .
Реакция нуклеофильного замещения
Получение спиртов в лабораториях производится способами, которые используют в качестве исходных продуктов для реакций химические вещества самых разнообразных классов, от углеводородов до карбонильных соединений. Существует несколько способов, которые сводятся к нескольким основным реакциям.
Первичные галогеналканы реагируют с водными растворами щелочей NaOH или КОН, образуя, образуя, главным образом, первичные спирты в реакции нуклеофильного алифатического замещения. Когда, например, метилбромид реагирует с раствором едкого натра, то гидроксильные группы, образующинся при диссоциации щелочи, замещают ионы брома с образованием метанола.
Несколько реакций, позволяющих выполнять получение спиртов в лабораториях, приведены ниже.
Нуклеофильное присоединение.
Реактивы Гриньяра (соединения магния с алкилгалогенидами – иодидами или бромидами), а также металлоорганические соединения меди и лития реагируют с карбонильными группами (C=O) альдегидов с образованием первичных и вторичных спиртов в зависимости от механизма присоединения.Аналогичные реакции с кетонами приводят к третичным спиртам.
Реакция Барбье протекает между галогеналканом и карбонильной группой в качестве электрофильного субстрата в присутствии магния, алюминия, цинка, индия, олова или его солей. Продуктом реакции является первичный, вторичный или третичный спирт. Механизм ее протекания аналогичен реакции Гриньяра с той разницей, что реакция Барбье является синтезом в одном сосуде, тогда как реактив Гриньяра получают отдельно перед добавлением карбонильного соединения. Являясь реакцией нуклеофильного присоединения, она происходит с относительно недорогими и водостойкими металлами или их соединениями в отличие от реагентов Гриньяра или органолитиевых реагентов. По этой причине возможно во многих случаях запускать ее в воде, что делает процесс частью зеленой химии. Реакция Барбье назван в честь Филиппа Барбье – учителя Виктора Гриньяра.
Реакция восстановления
Альдегиды или кетоны восстанавливаются до спиртов с боргидридом натрия (NaBh5) или (после кислотной обработки) с литийалюминий гидридом (LiAlH).
В реакции Меервейна-Пондорфа-Верли (MPV) получение спиртов путем восстановления их из кетонов и альдегидов происходит с использованием алюминиевого алкоксидного катализатора. Достоинства MPV заключаются в ее высокой хемоселективности и использовании дешевого, экологически чистого металлического катализатора. Реакция была обнаружена Меервейном и Шмидтом, и независимо Верли в 1925 г. Они обнаружили, что смесь алюминиевого этоксида и этанола может восстановить альдегиды до их спиртов. Понндорф применил реакцию к кетонам и обновил катализатор до изопропилата алюминия (Al(O-i-Pr)3, где i-Pr означает изопропиловую группу (CH(Ch4)2). в целях получения изопропанола.
Общее уравнение получения спирта путем MPV-восстановления кетонов до спиртов выглядит так:
Это, конечно, не все, что можно сказать относительно спиртов и их свойств, но общее представление о них, надеемся, вам составить удалось.
www.syl.ru
СПИРТЫ

Спирты являются производными углеводородов, в которых один или несколько атомов водорода при sp3-гибридныхатомах углерода замещены на гидроксильную группу. В соответствии с количеством гидроксильных групп спирты бываютодноатомными (общей формулыR-ОН,где R – углеводородный остаток), имногоатомными, например, двухатомными (диолы) или трехатомными (триолы).
В зависимости от того, с каким атомом углерода связана гидроксильная группа, одноатомные спирты подразделяют на первич-
ные, вторичныеи третичные, например:
Ch4CHCh3OH | первичный спирт | ||||||||
|
|
|
|
|
|
|
|
| (2-метил-1-пропанол,или изобутиловыйспирт) |
Ch4 | |||||||||
|
|
|
|
|
|
|
| CHCh4 | вторичный спирт |
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
| |||
|
|
|
|
|
|
| OH | (1-фенилэтанол) | |
|
|
|
|
|
|
| |||
Ch4 |
|
| Ch4 | третичный спирт | |||||
|
|
|
|
|
|
|
| ||
| C |
| OH | ||||||
|
| ||||||||
|
|
|
|
|
|
|
|
| (2-метил-2-пропанол,илит рет -бутиловыйспирт) |
|
|
|
|
|
|
|
|
| |
|
| Ch4 | |||||||
|
|
| |||||||
1. Способы получения
1.1. Гидратация алкенов
Присоединение воды к алкенам с образованием спиртов является реакцией электрофильного присоединения, катализируемой сильной кислотой Бренстеда. Региоселективность реакции, определяемая правилом Марковникова, обусловлена, как и при гидрогалогенировании алкенов, преимущественным протеканием реакции через наиболее устойчивый карбокатион. Так, гидратация 2- метилпропена в присутствии серной кислоты как катализатора приводит к образованию трет-бутиловогоспирта, поскольку из двух образующихся при протонировании этого алкена карбокатионов более устойчивым является третичный(трет-бутилкатион).
|
|
| Ch4 |
| h3O |
|
|
| Ch4 |
| ||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||
CH |
| C |
| CH | CH |
| C |
| CH | |||||||||
|
|
|
|
|
|
|
|
| ||||||||||
|
|
|
|
|
|
|
|
| ||||||||||
|
|
|
|
|
|
| ||||||||||||
3 |
|
|
|
|
| 2 H |
|
|
|
| 3 |
| 24 |
| 3 | |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| OH |
| ||
http://mitht.ru/e-library

Гидратацию алкенов можно осуществить и двухстадийно: присоединением серной кислоты с последующим гидролизом образующегося продукта присоединения – алкилгидросульфата, например:
Ch4 |
| CH=Ch3 | h3SO4 | CH |
| CH |
| CH | h3O |
| CH |
| CH |
| CH | ||||
|
|
| 3 |
|
| 3 | _H SO | 3 |
|
|
|
| 3 | ||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
| O |
| SO3H | 2 | 4 |
|
| OH |
| |||||
|
|
|
|
|
|
|
|
|
|
|
| ||||||||
изопропилгидросульфат
Так как присоединение серной кислоты к алкенам происходит тоже в процессе электрофильной реакции, то общий результат гидратации и в этом случае – гидратация по правилу Марковникова.
1.2. Гидролиз галогенпроизводных
Алкилгалогениды при гидролизе превращаются в соответствующие спирты. Гидролиз представляет собой нуклеофильное замещение и может быть осуществлен как при непосредственном взаимодействии с водой, так и при взаимодействии с водным раствором щелочи (щелочной гидролиз), например:
Ch4 |
|
| Ch4 |
| h3O |
|
|
| Ch4 |
|
| ||||||||
|
|
|
|
|
|
|
| Ch4 |
|
|
|
|
|
|
| ||||
| C |
| Ch3Ch4 | Ch3Ch4 |
|
| |||||||||||||
|
|
|
|
| C |
|
|
| |||||||||||
|
|
| _ |
|
|
|
|
| |||||||||||
|
|
|
|
|
|
|
| HBr |
|
|
|
|
|
|
|
|
|
| |
|
| Br |
|
|
|
| OH |
|
|
| |||||||||
|
|
|
|
|
|
|
|
|
|
| |||||||||
Ch4Ch3Ch3Ch3 |
| Cl | NaOH, h3O | Ch4Ch3Ch3Ch3 |
| OH | |||||||||||||
|
| _NaCl |
| ||||||||||||||||
|
|
| |||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||
В зависимости от строения алкилгалогенида и условий реакции гидролиз может происходить либо по механизму SN1, либо по механизму SN2.
1.3. Восстановление карбонильных соединений
25
http://mitht.ru/e-library
Спирты могут быть получены восстановлением альдегидов и кетонов, причем из альдегидов образуются первичные спирты, а из кетонов – вторичные. Восстановление осуществляют либо водородом на катализаторе, либо комплексными гидридами, такими как алюмогидрид лития (LiAlh5) или боргидрид натрия (NaBh5). Кроме того, алюмогидрид лития может восстановить до первичных спиртов карбоновые кислоты и сложные эфиры. Следующие примеры иллюстрируют восстановление карбонильных соединений до спиртов:
CH=O h3, NiCh3OH
Ch4 |
| CCh4 | NaBh5 |
| CH CHCH |
|
| ||||
|
|
|
|
|
| ||||||
|
|
|
|
|
| 3 |
| 3 |
|
| |
O |
|
|
|
|
| OH |
|
|
| ||
Ch4Ch3Ch3Ch3C | O | LiAlh5 | Ch4Ch3Ch3Ch3Ch3 |
| OH + Ch4OH | ||||||
OCh4 |
|
|
|
| |||||||
|
|
|
| ||||||||
|
|
|
|
|
|
|
|
|
| ||
1.4. Получение спиртов реакцией Гриньяра
Реактивы Гриньяра присоединяются к карбонильным соединениям – альдегидам и кетонам с образованием алкоголятов, которые при гидролизе превращаются в спирты:
R δ+ | + | δ− | δ+ | R | C | O | MgX | h3O | R |
| OH | |
| C Oδ− | R" | MgX |
|
|
| C | |||||
R' |
|
|
|
| R' |
| R" |
| _Mg(OH)X | R' | R" | |
Первичные спирты получают взаимодействием реактива Гриньяра с формальдегидом, например, изобутиловый спирт образуется при реакции формальдегида с изопропилмагнийбромидом и последующем гидролизе в соответствии с уравнением:
Ch3=O + (Ch4)2CHMgBr |
| (Ch4)2CHCh3OMgBr | h3O | (Ch4)2CHCh3 |
| OH |
|
|
| ||||
| 26 |
|
|
|
| |
http://mitht.ru/e-library

Вторичные спирты получают из альдегидов, например:
Для получения третичных спиртов используют взаимодействие кетонов с реактивами Гриньяра. При этом возможно несколько альтернативных схем синтеза одного и того же третичного спирта. Так, например,3-метил-3-гексанолможет быть получен:
• из метилэтилкетона и пропилмагнийбромида
Ch4 |
| CCh3Ch4 | 1. Ch4Ch3Ch3MgBr | CH CH | Ch4 |
|
|
| |
|
|
|
|
| |||||
|
| CCH CH CH | |||||||
|
| ||||||||
|
|
| 2. h3O | 3 | 2 |
| 2 | 2 | 3 |
O |
| OH |
|
|
| ||||
|
|
|
|
| |||||
• из метилпропилкетона и этилмагнийбромида
Ch4CCh3Ch3Ch4 | 1. Ch4Ch3MgBr | CH CH | Ch4 |
|
|
| |||
|
|
|
| ||||||
| CCH CH CH | ||||||||
| |||||||||
|
|
| 2. h3O | 3 | 2 |
| 2 | 2 | 3 |
O |
| OH |
|
|
| ||||
|
|
|
|
| |||||
• из пропилэтилкетона и метилмагнийбромида
Ch4Ch3CCh3Ch3Ch4 | 1.Ch4MgBr | Ch4Ch3 | Ch4 | |||
| ||||||
CCh3Ch3Ch4 | ||||||
|
|
| 2.h3O |
|
| |
O | OH | |||||
| ||||||
Кроме кетонов для синтеза некоторых третичных спиртов с помощью реакции Гриньяра используются также сложные эфиры. Продукт присоединения реактива Гриньяра к карбонильной группе сложного эфира стабилизируется отщеплением алкоксигруппы (в виде алкоксидмагнийгалогенида), и образующийся кетон присоединяет вторую молекулу реактива Гриньяра. Так, при взаимодействии этилбензоата с двумя эквивалентами фенилмагнийбромида и последующем гидролизе может быть получен трифенилкарбинол (трифенилметанол):
O |
| MgBr | C OMgBr |
C | + | 27 | |
OCH CH |
| OCh3Ch4 | |
2 3 |
|
| |
|
| http://mitht.ru/e-library |
|
studfiles.net
Спирты - Получение спиртов
Химия - Спирты - Получение спиртов
28 февраля 2011Оглавление:1. Спирты2. Классификация спиртов3. История открытия спиртов4. Нахождение в природе5. Физиологическая роль спиртов6. Физиологическое действие и токсичность спиртов7. Физические свойства и строение спиртов8. Получение спиртов9. Химические свойства спиртов10. Идентификация спиртов11. Применение спиртов12. Перечень используемых в статье таблиц13. Комментарии
Общие химические методы получения спиртов
Спирты могут быть получены из самых разных классов соединений, таких как углеводороды, алкилгалогениды, амины, карбонильные соединения, эпоксиды. Существует множество методов получения спиртов, среди которых выделим наиболее общие:
- основаны на окислении углеводородов, содержащих кратные или активированные C−H связи;
В качестве окислительных агентов для алканов и циклоалканов используются сильные неорганические окислители: озон, перманганат калия, оксид хрома, хромовая кислота, диоксид селена, а также пероксид водорода и некоторые пероксикислоты. Из-за возможности более глубокого окисления, метод имеет значение, как правило, только для получения третичных спиртов:
Окисление алкенов значительно более распространено в лабораторной практике, особенно когда речь идёт о получении диолов. В зависимости от выбора реагента можно осуществить син-гидроксилирование или анти-гидроксилирование и вольфрама, оксид селена и пр.):
Алкены также могут гидроксилироваться в аллильное положение синглетным кислородом с миграцией двойной связи и образованием гидропероксидов, которые затем восстанавливаются до спиртов:
Важным препаративным методом является окисление галогенпроизводных углеводородов надпероксидом калия.
- реакции восстановления восстановление карбонильных соединений: альдегидов, кетонов, карбоновых кислот и сложных эфиров;
Для восстановления альдегидов или кетонов, обычно, пользуются борогидридом натрия или калия, а также алюмогидридом лития в протонном растворителе:
Восстановление сложных эфиров и карбоновых кислот производится алюмогидридом или борогидридом лития, а также некоторыми другими комплексными гидридами:
- реакции гидратации кислотно-катализируемое присоединение воды к алкенам;
Реакция имеет промышленное значение, однако в лабораторной практике часто замещается реакцией оксимеркурирования-демеркурирования алкенов или гидроборированием алкенов с их последующим окислением:
- реакции присоединения:
- присоединение синтез-газа, формальдегида, оксирана по кратным углеводородным связям;
Простейший пример такой реакции промышленный синтез метанола:
Среди других вариантов использования:
- присоединение нуклеофилов к карбонильным соединениям;
Общая схема реакций подобного типа:
Существует множество реакций присоединения, включая реакции гидратации, этинилирования и прочих, рассмотренных выше. Здесь приведём примеры некоторых важных препаративных методов.
Присоединение аллиборанов с последующим гидролизом:
Реакция Бэйлиса — Хиллмана — Морита:
- реакции замещения реакции нуклеофильного замещения, при которых имеющиеся функциональные группы замещаются на гидроксильную группу;
На практике для реакций замещения, как правило, используются галогенпроизводные:
- синтезы с использованием металлорганических соединений.
Использование металлорганических соединений для синтеза спиртов мощный препаративный метод, позволяющий получить спирты из различных производных.
- синтез через реактивы Гриньяра:
- реакция Циглера:
- синтез с использованием органокупратов:
Получение наиболее важных спиртов в промышленности
Промышленные способы получения спиртов можно разделить на две большие группы:
- химические методы производства;
- биохимические методы производства.
Использование этих методов для производства отдельных спиртов представлено в таблицах 9—11.
Таблица 9. Основные современные процессы, используемые для промышленного получения спиртов.
| 1. | Гидратация алкенов или эпоксидов | Этанол, пропан-2-ол, бутан-2-ол, 2-метилпропан-2-ол, этиленгликоль |
| 2. | Щелочной гидролиз галогенпроизводных | Аллиловый спирт, глицерин, бензиловый спирт |
| 3. | Щелочной гидролиз сложных эфиров | Глицерин, октан-2-ол, высшие жирные спирты |
| 4. | Реакция гидроформилирования | Метанол, пропан-1-ол, бутан-1-ол, пентан-1-ол, гексанол |
| 5. | Окислительные методы | Пропан-1-ол, бутан-1-ол, высшие жирные спирты |
| 6. | Восстановительные методы | Циклогексанол, ксилит, высшие жирные спирты |
| 7. | Реакция конденсации карбонильных соединений | Бутан-1-ол, 2-этилгексанол, пентаэритрит |
| 8. | Биохимические методы | Этанол, бутан-1-ол, глицерин |
Таблица 10. Основные химические промышленные способы получения экономически наиболее важных спиртов.
| МетанолCh4OH | CO + 2h3 → Ch4OH | Каталитический синтез из оксида углерода и водорода | Смешанный медно-цинково-хромовый катализатор, температура 250 °C, давление до 10 МПа | 40,0 млн тонн | |
| ЭтанолC2H5OH | Ch3=Ch3 + h3O → C2H5OH | Сернокислотная или прямая гидратация этилена | Вариант 1: абсорбция этилена концентрированной серной кислотой при температуре 80 °C и давлении 1,5 МПа и последующий гидролиз сульфоэфира. Вариант 2: прямая гидратация при 300 °C и давлении 7 МПа, катализатор: фосфорная кислота, нанесённая на оксид кремния. | 6 млн тонн | |
| Пропанол-1C3H7OH | Ch3=Ch3 + CO + 2h3 → C3H7OH | Гидроформилирование этилена с последующим гидрированием | Первый этап: температура 80—120 °С, давление 2 МПа, катализатор: карбонил родия. Второй этап: медно-хромовые или никель-хромовые катализаторы. | 0,14 млн тонн | |
| Пропанол-2Ch4CHCh4 | Ch4-CH=Ch3 + h3O → Ch4CHCh4 | Сернокислотная или прямая гидратация пропилена | Вариант 1: абсорбция пропилена серной кислотой при комнатной температуре 80 °C и давлении 2—3 МПа и последующий гидролиз сульфоэфира. Вариант 2: прямая гидратация на фосфорнокислом или вольфрамовом катализаторе. | 1,8 млн тонн | |
| Высшие жирные спирты | 1. RCOOCh4 + 2h3 → RCh3OH + Ch4OH 2. RCH=Ch3 + CO + 2h3 → RCh3Ch3Ch3Oh4. Al3 + 3nC2h5 → Al3 + O2 → 3C2H5nOH | 1. Гидрирование метиловых эфиров жирных кислот, получаемых переэтерификацией жиров и масел. 2. Гидроформилирование алкенов.3. Метод Циглера. | 1. Гидрирование при высокой температуре и давление на смешанных меднохромовых или других катализаторах.2. Высокотемпературный газофазный процесс в присутствии модифицированного карбонила кобальта.3. Многостадийный синтез в относительно мягких условиях. | 2,15 млн тонн | . |
| ЭтиленгликольHOCh3Ch3OH | O + h3O → HOCh3Ch3OH | Некаталитическая гидратация окиси этилена | Температура 200 °C и давление 1,5—2 МПа | 18,0 млн тонн | |
| ГлицеринHOCh3CHCh3OH | Ch3CHCh3OCOR + 3NaOH → HOCh3CHCh3OH + 3RCOONa | Щелочной гидролиз растительных жиров и масел | Температура 150—180 °С, давление 1 МПа, катализаторы. | 1,5 млн тонн |
Таблица 11. Получение спиртов биохимическими методами.
| Этанол | целлюлозное сырьё: древесина, солома, багасса, отходы деревообрабатывающего и целлюлозного производства | Кислотный или энзимный гидролиз растительного сырья с последующей анаэробной спиртовой ферментацией образующихся моно- и олигосахаридов дрожжевыми грибами или некоторыми видами бактерий. |
| крахмал- и сахарсодержащее сырьё: сахарная свекла, картофель, маниок, злаковые культуры | ||
| Бутанол | крахмалсодержащее сырьё: сахарная свекла, картофель, маниок, злаковые культуры | Аналогично производству биоэтанола, но с применением бутанольной ферментации бактериями Clostridium. |
| Глицерин | сыворотка, сахарная меласса, пшеничный гидролизат | Ферментация сахаросодержащего сырья дрожжевыми грибами в присутствии сульфита натрия. |
Просмотров: 121826
4108.ru
Получение спиртов: способы и сырье
Спирты применяются в очень многих отраслях промышленности и сферах деятельности. Из них производят различные синтетические полимеры, пластификаторы, каучуки, моющие средства и множество других разновидностей продукции. Получение спиртов осуществляется с помощью биохимических и химических способов. Многие из них являются массовыми продуктами нефтехимического синтеза. Химический синтез из углеводородов является относительно недорогим производственным способом. Также одним из самых важных методов является получение спиртов с помощью гидратации олефинов. Так получают изопропиловый, трет- и втор- бутиловый и этиловый спирты. Получение метилового спирта (метанола) основывается на сухой перегонке древесины.
Основные процессы, с помощью которых получают спирты:
- Щелочной гидролиз производных галогенов: производство глицерина, бензилового спирта и других.
- Гидратация эпоксидов и алкенов: этиленгликоль, этанол и др.
- Гидроформилирование: гексанол, метанол и др.
- Методы окисления: производство высших жирных спиртов.
- Методы восстановления: высшие жирные спирты, ксилит и др.
- Биохимические способы: производство глицерина и этанола.

Одним из наиболее массово производимых продуктов является этиловый спирт (этанол). На его основе был разработан способ изготовления синтетического каучука. Этанол получают из продуктов гидролиза дерева, этилена, сульфитных щелоков и ферментативным методом из пищевого сырья.
Получение спиртов (этанола и метанола) из пищевого сырья и древесины является дорогим и трудоемким процессом. Этиловый спирт гораздо выгоднее и проще производить из недорогого углеводородного сырья, например, с помощью гидратации этилена. Чтобы получить одну тонну этанола ферментативным способом, необходимо переработать четыре тонны зерна или восемь тонн опилок. Для сравнения: одна тонна этанола получается из 2,5 тонн нефтяных дистиллятов или газа этилена. Трудозатраты в человеко-часах при производстве этилового спирта из различного сырья: из зерна – 160, из картофеля - 280, из этилена – 10. Получение спиртов из нефтехимического сырья является менее затратным и трудоемким.

Также очень важным химическим продуктом является метанол. Современное производство метилового спирта осуществляется методом органического синтеза на базе оксида углерода (II) или синтеза-газа в промышленных масштабах. Технологические схемы существуют разные. Условно их можно разделить на следующие три группы.
- Синтез на цинк-хромовых катализаторах при высоком давлении. Данный технологический процесс является устаревшим и заменяется различными способами синтеза при низком давлении.
- Синтез на медь-цинк-алюминиевых катализаторах при низком давлении. Использование методов синтеза при низком давлении позволяет значительно снизить затраты энергии на производство. При данном способе производства требуется высокая степень очистки сырья от примесей, негативно влияющих на катализатор.
- Синтез метанола в трехфазной системе, который проводится в суспензии из инертной жидкости и тонкодисперсного катализатора. Это метод, позволяющий увеличить выход продукта, снизив при этом затраты энергии. Способы получения спиртов совершенствуются. Трехфазная система является прогрессивной технологией производства.
fb.ru
Получение простых эфиров дегидратацией спиртов
Гидроксильные соединения. Изомерия. Номенклатура рациональная, Женевская и Льежская. Получение спиртов из непредельных углеводородов и галоидопроизводных. Замена атома галоида на гидроксил, нуклеофильный характер этой реакции. Свойства спиртов замена гидроксильной группы на галоид, образование простых эфиров, дегидратация спиртов. Сопоставление кислых свойств спиртов и фенолов. Понятие о мезомерном эффекте (эффекте сопряжения). [c.218]
Реакция дегидратации одноатомных спиртов под действием серной кислоты или ее солей является классическим методом получения простых эфиров. В образовании молекулы эфира участвуют две молекулы спирта. Реакция дегидратации гликолей в аналогичных условиях протекает в двух направлениях с образованием линейных полигликолей или с внутримолекулярной циклизацией (если возможно образование ненапряженных пяти- или шестичленных циклов). Этиленгликоль под действием серной кислоты образует полигликоли или шестичленный циклический эфир 1,4-диоксан [c.213]Диэтиловый (этиловый) эфир. Имеет очень большое практическое значение его обычно называют просто эфиром. Получается главным образом дегидратацией этилового спирта при действии концентрированной серной кислоты (стр. 109). Этим методом диэтиловый эфир был получен впервые еще в 1540 г. В. Кордусом долгое время диэтиловый эфир неправильно называли серным эфиром, так как предполагали, что он должен содержать серу. В настоящее время диэтиловый эфир получают так же, пропуская пары этилового спирта над окисью алюминия А120д, нагретой до 240—260 С. [c.129]
Серная кислота применяется в промышленности органического синтеза как катализатор реакций этерификации, полимеризации, конденсации, дегидратации и гидратации. Примерами могут служить синтезы сложных эфиров, получение компонентов высокооктанового топлива, получение простых эфиров, синтез спиртов из олефинов, синтез ДДТ, гидролиз древесины. [c.126]
ПОЛУЧЕНИЕ ПРОСТЫХ ЭФИРОВ ДЕГИДРАТАЦИЕЙ СПИРТОВ [c.336]
Получение простых эфиров дегидратацией спиртов [c.337]
Образование простых эфиров дегидратацией спиртов происходит только в присутствии водородных ионов, которые выполняют роль катализаторов. В зависимости от свойств спирта образую щегося эфира нужно применять тот или иной кислый реагент. Чаще всего для этой цели применяют серную кислоту, но употребляют также хлористый водород, сульфокислоты, фосфорную кислоту и др. При получении простых эфиров таким образом в качестве побочных продуктов образуются олефины, при этом одновременно протекают реакции полимеризации, обугливания и восстановления серной кислоты до ЗОг. [c.143]
Карбонилирование спиртов при катализе комплексами металлов имеет преимущество перед кислотным катализом, поскольку в последнем случае образуется много побочных продуктов дегидратации спирта (олефины, простые эфиры), а также кислот изостроения. В. Реппе впервые осуществил эти реакции при помощи карбонилов никеля и промоторов, которыми служили иод и иодпроизводные. Активны карбонилы кобальта, железа, палладия и особенно родия, но в присутствии тех же промоторов. Впервые процесс был реализован при катализе соединениями кобальта для получения уксусной кислоты из метанола [c.525]
МЕЖМОЛЕКУЛЯРНАЯ ДЕГИДРАТАЦИЯ СПИРТОВ. Третий распространенный способ получения простых эфиров, позволяющий синтезировать только симметричные эфиры, состоит в дегидратации двух молекул спирта в присутствии кислоты [c.442]
Общие способы получения простых эфиров. I. Дегидратация спиртов (отщепление воды) [c.479]
Вещество, предназначенное для перегонки, должно быть гомогенным и не должно расслаиваться в процессе ректификации. При перегонке веществ, ограниченно растворимых в воде, следы влаги необходимо предварительно удалить. Если во время перегонки веществ, не смешивающихся с водой, в холодильнике или в головке колонки появляются капли воды, то следует временно отключить охлаждение холодильника с тем, чтобы вся вода перешла в приемник при необходимости эту операцию повторяют несколько раз. Полученный дистиллат отделяют от воды, сушат и возвращают в колонку. Иногда образование воды в холодильнике вызвано разложением, например дегидратацией третичных спиртов под каталитическим влиянием кислых примесей. При перегонке некоторых веществ (простые эфиры, альдегиды и т. д.) предварительно необходимо удалять перекиси (см. стр. 600). [c.252]
Отнятие воды (дегидратация). Реакции, идущие с отнятием ВОДЫ, могут в конечном результате приводить или к образованию этиленовых углеводородов, или же к получению простых эфиров. В первом случае молекула воды выделяется из одной молекулы спирта (за исключением метилового) [c.200]
Для получения простых эфиров широко пользуются непосредственной дегидратацией паров спирта с помощью катализаторов. Так, пропуская пары этилового спирта через трубку над окисью алюминия при температуре около 250 получают этиловый эфир [c.143]
От правильного выбора ионита зависит возможность многократного использования в периодических и длительного — в непрерывных процессах дегидратации. Например, смола КУ-6 даже в мягких условиях дегидратации грег-бутилового спирта полностью утрачивала активность через 200 ч, тогда как катионит КУ-1 служил 800 ч без существенного изменения его каталитических свойств . В реакции дегидратации диметилфенилкарбинола осуществлявшейся при 96 °С, смола КУ-2 после 6-кратного использования не изменила своей активности, а в гораздо более жестких условиях получения простых эфиров (140°С) после 20-кратного употребления она несколько инактивировалась и . При дегидратации терпингидрата на сульфоугле выход а-терпинеола после 4-кратного [c.122]
Какой побочный процесс протекает при получении простых эфиров кислотной дегидратацией спиртов Объясните, какие из эфиров [c.50]
Дегидратация происходит при обезвоживании спиртов, при приготовлении простых эфиров и в процессе получения олефинов при высоких температурах. Дегидратация уксусной кислоты — один из этапов приготовления ангидрида уксусной кислоты в промышленности. [c.587]
Этот способ, заключающийся в дегидратации спиртов (см. стр. 96), можно использовать для получения различных простых эфиров. [c.111]
Хлористый алюминий может быть использовап как катализатор для получения сложных эфиров из олефинов и кислот и простых эфиров из олефинов и спиртов. Он катализует присоединения окиси олефинов к галоидопроизводным с образованием спиртов. Сообщается о применении хлористого алюминия для дегидратации при получении простых эфиров из спиртов и для гидратации при превращении спиртов в эфиры. Хлористый алюминий вызывает изомеризацию парафинов и циклизацию парафинов и олефинов. Полимеризующее и крекирующее действие хлористого алюминия по отношению к алифатическим и циклоалифатическим углеводородам детально разобрано ниже. Хлористый алюминий является активным катализатором, вызывающим присоединение галоидоводорода и галоидов к олефинам и получение галоидопроизводных из парафинов. Он щироко применяется для получения полихлорпроизводных присоединением парафинов к хлорированным этиленам [c.739]
Существует три обшцх метода получения простых эфиров межмолекулярная дегидратация спиртов, алкокснмеркурироваьше алкенов и реакция А.Вильямсона. [c.916]
Способы получения простых эфиров Межмолекулярная дегидратация спиртов. Реакция Вшъям-сона 51 [c.4]
При газофазной дегидратации спиртов по-прежнему имеется возможность протекания конкурирующей реакции замещения с образованием простых эфиров. Увеличению выхода олефина способствует повышение температуры. Так, при газофазной дегидратации этанола на окиси алюминия при 250° С образуется главным образом эфир, а при 350° С — этилен. Выход простого эфира при каталитической дегидратации спиртов падает с увеличением молекулярного веса спирта. Так, при дегидратации на прокаленных квасцах ряда спиртов в условиях, оптимальных для получения простого эфира, образуется из этанола — 22% олефина, из н. пропанола — 46% олефина, из н. центанола — 76% олефина. При более высокой температуре пропанол и высшие спирты дают соответствующие олефины, практически свободные от примеси простых эфиров. [c.234]
Спирты могут образовывать сложные эфиры и с минеральными кислотами триметилборат В(ОСНз)з, ортоэтилсиликат Si( 2H50)4, применяющиеся- в машиностроении (ортоэтилсиликат применяется для получения точных отливок по восковым выплавляемым моделям). Дегидратация спиртов йли отнятие у нйх молекул воды приводит не только к получению простых эфиров, но. и непредельных углеводородов [c.460]
Пиролиз сложных и простых эфиров арилметилкарбинолов и [ -арилэтиловых спиртов для получения винильных производных ароматических углеводородов менее удобен, чем дегидратация соответствующих спиртов, и поэтому он применяется редко. Этот метод основан на реакции [c.15]
Позднее мы начали исследовапия по систематическому изучению ряда реакций, протекающих в присутствии кислотных катализаторов 1) реакции алкилпровапия фенолов олефинами и спиртами, 2) реакции этерификации (получения сложных и простых эфиров), 3) реакции нереэтерификации (алкоголиза), 4) реакции дегидратации спиртов. [c.70]
Диэтиловый эфир, называемый часто просто эфиром, впервые был получен в 16 веке Валерием Кордусом из этанола и серной кислоты. Этот способ до сих пор используют как в лаборатории, так и в промышленности. Наряду с этим пригодна также каталитическая дегидратация спирта над фосфатом алюминия. Кроме того, эфир является побочным продуктом производства этанола из этилена. [c.337]
На схеме приведены следующие важные синтетические приемы / - алкилирование кетона в присутствии гидрида натрия г - получение диазокетона и перегрупшфовка его по Воль(йг как метод сужения кольца циклоалканона а - ацилирование литийор-ганического соединения и реакция диазопереноса 4 - С-Н-внед-рение родиевого карбеноида в связь С-Н ff - селективное восстановление кетона боргидридом натрия и дегидратация спирта в присутствии дициклогексилкарбодиимида(ДЦК) ff - окисление простого эфира хромовым ангидридом. [c.59]
Сравнение граф А, Д п В показывает, что, как и в синтезе спиртов, добавка к катализаторам 1 % карбоната калия увеличивает выход высших спиртов. Такой же результат был получен прп добавке окиси ципка к окпси тория (графа Ж), хотя окись ципка сама является катализатором сиитеза метанола. В этом опыте содержание метанола фактически оказалось меньшим, чем в опыте А, проведенном на чистой окиси тория. Поведение окиси алюминия не выявило никаких иеожцдаипостей в продукте, полученном в опыте И, содержалось значительно больше метанола, чем в продукте опыта А, большая часть высших спиртов претерпела дегидратацию, и количество воды и простых эфиров соответственпо увеличилось. [c.331]
chem21.info
Как получить спирт из природного газа — Новости науки
С новым катализатором превращение метана, этана и пропана в спирты технологически сильно упростится, а это сделает газ важным источником сырья для промышленного органического синтеза.
Несмотря на нашу исключительную зависимость от природного газа, с технической точки зрения мы используем его исключительно однообразно. То есть попросту сжигаем — для обогрева ли жилья, приготовления пищи или для того, чтобы крутить турбины электрогенераторов. Можно задаться вопросом: неужели за всё это время, что мы активно добываем и используем природный газ, не предпринимались попытки превратить его во что-то иное?
Нет, попытки такие предпринимались, и существуют технологии, позволяющие превратить метан, этан и пропан — обычные компоненты природного газа — в спирт. Спирты можно использовать как сырьё при производстве пластмасс, горючего и пр., и технологии эти были бы весьма многообещающими, не будь столь сложны и дороги (в некоторых случаях процесс требует нагрева до 800 ˚C), а потому в промышленных целях спирты проще получать каким-нибудь менее затейливым и более привычным способом. А вообще, источником сырья для промышленного органического синтеза служит нефть — ещё одно, не побоимся этого слова, сакральное полезное ископаемое.
Атом таллия (в центре) в комплексе с молекулами углеводородов, превращение которых он катализирует(иллюстрация The Scripps Energy and Materials Center).
Однако с технологией, предлагаемой исследователями из Института Скриппса (США), от природного газа, возможно, всё же удастся добиться большего.
Два десятилетия назад Рой Периана (Roy Periana) и его коллеги начали поиск катализаторов, которые позволили бы снизить температуру технологического процесса (те самые 800 ˚C) при получении спирта из газовых углеводородов. По сути, им требовалось такое вещество или соединение, которое облегчало бы разрыв связей между атомом углерода и атомами водорода в молекулах метана, этана и пропана и помогало бы ввести в их молекулы атом кислорода при значительно меньшей температуре. Частыми катализаторами в органическом синтезе служат металлы, которые как раз облегчают разрывы химических связей, но в данном случае в роли более или менее эффективных катализаторов оказывались платина, родий и иридий — весьма дорогие металлы, стоимость которых исключала промышленную рентабельность процесса.
Но неожиданно учёные обнаружили, что катализатором тут может служить более дешёвый металл, причём даже более эффективным. Им оказался таллий, с помощью которого можно было проводить реакцию при 180 ˚C, причём сразу с разными видами газообразных алканов, то есть со смесью метана, этана и пр., не отделяя их друг от друга, как это требуется обычно. В результате получались эфиры спиртов этанола, метанола, изопропанола и другие кислородные модификации алканов.
Химики объясняют это тем, что электронная структура таллия упрощает взаимодействие между ним, молекулой газа и растворителем, в котором происходит реакция, и в результате последняя требует даже меньше энергии, чем, к примеру, при использовании иридия.
Очевидно, использование таллия может сильно упростить технологический процесс превращения углеводородов газа в другие органические соединения, поэтому, возможно, в скором времени газ начнут использовать в промышленном органическом синтезе наряду с традиционной нефтью.
Результаты исследования опубликованы в журнале Science.По материалам Института Скриппса.Источник: compulenta.computerra.ru
sci-dig.ru