Содержание
Простые эфиры: классификация, 📙 номенклатура, изомерия
1. ИЮПАК: общепринятая номенклатура и её правила
2. Полиэфиры
3. Примеры и варианты изомерии
Простые эфиры – интереснейшая группа органических веществ, изучению которой отводится большой промежуток времени. Некоторые примеры с простыми эфирами стали классическими и являются обязательными при изучении химии в ВУЗах.
Надо отметить, что в принципе, работа с реакциями простых эфиров достаточно показательная. А сами вещества широко применяются в промышленности в качестве растворителей.
Простые эфиры принято разделять на соединения рядов:
- алифатического: диметиловый эфир, диэтиловый эфир, диизопропиловый эфир, дибутиловый эфир, диаллиловый эфир, дивиниловый эфир, глим;
- ароматического: дифениловый эфир;
- алкилароматичекеского: анизол, фенетол, вератрол;
- циклического: осиран, оксолан, 1,4-Диоксан.
Простые эфиры алифатического ряда бывают:
- Симметричные – с одинаковыми радикалами;
- Несимметричные – с разными.

Циклические простые эфиры в основе своей классификации имеют количество атомов в цикле. Таким образом, можно выделить оксоланы, диоксоланы, краун-полиэфиры, оксаны, эпоксиды.
Вообще же насыщенные кислородосодержащие гетероциклы имеют названия, связанные с количеством имеющихся членов: оксиран – 3хчленный, оксалан – 5тичленный, оксан и диоксан – 6тичленные с разным количеством атомов кислорода. Оксолан часто называют тетрагидрофураном, как производное ненасыщенного фурана. За оксираном закрепилось название этиленоксид.
Правила формирования названия простых эфиров зависит от названия радикала, с которым связывается атом кислорода, а затем добавляется слово «эфир». Например, диизопропиловый эфир или бутилметиловый эфир.
Номенклатура ИЮПАК – система, которая формирует правила наименования химических соединений. Она поддерживается, развивается и остаётся актуальной благодаря активному влиянию Международного союза теоретической и прикладной химии. Правила номенклатуры актуальны как для органических, так и неорганических соединений и содержатся в официальных изданиях.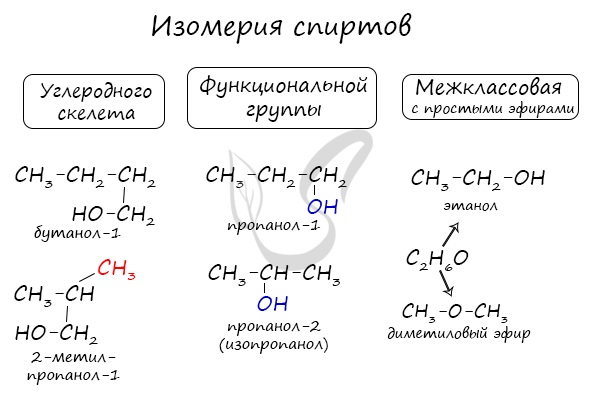 Так же можно встретить обозначение системы в международном формате как IUPAC.
Так же можно встретить обозначение системы в международном формате как IUPAC.
Согласно этой номенклатуре простые эфиры алифатического ряда = алкоксиалканам, а простые эфиры ароматической группы = арилоксиалканам. Так же старший углеводородный радикал самой длинной алкильной группы будет составлять корень в названии эфира. Так, этилпропиловый эфир, согласно IUPAC, будет этоксипропаном; а метилбутиловый эфир – метоксибутаном.
Если один радикал больше другого, куда удобнее использовать префиксные названия, чем употреблять слово «эфир». Например, 2,3,5-триметоксихинолин. А вот для простых соединений это самое слово «эфир» в названии куда удобнее звучит. Например. 1-бутоксибутан сложнее воспринимается, чем дибутиловый эфир. Кроме того, широко используются тривиальные названия некоторых простых эфиров, которые прочно вошли в обиход. Например, диэтиловый эфир называют серным, 1,2-диметоксиэтан – моноглимом, метоксибензол – анизолом.
Линейное строение симметричных полиэфиров влияет на производные их названий. В этом случае важную составляющую названия играет центральная часть молекулы. От производных этой центральной части и получается название. Обращается внимание на число эфирных атомов кислорода. Если молекула с нечётным числом, то центральной частью будет мостик, с чётным – радикал углеводорода.
В этом случае важную составляющую названия играет центральная часть молекулы. От производных этой центральной части и получается название. Обращается внимание на число эфирных атомов кислорода. Если молекула с нечётным числом, то центральной частью будет мостик, с чётным – радикал углеводорода.
Линейные полиэфиры могут образовывать названия на основании заместительной номенклатуры открытых цепей. Так, на название будет влиять то, какие метиленовые группы были замещены атомами кислорода.
В случае неполных эфиров, можно предложить альтернативы названий, используя название радикала R как префикс + название полигидросоединений + учёт положения и умножительными префиксами. Неполные эфиры образуют названия из сочетания этерефицирующих радикалов/радикала и полигидросоединения. С учётом положения или умножающих проефиксов.
Изомерией принято называть такое явление. когда химические элементы-изомеры сходны по атомному составу и массе молекулярной, но отличны по строению и атомному расположению.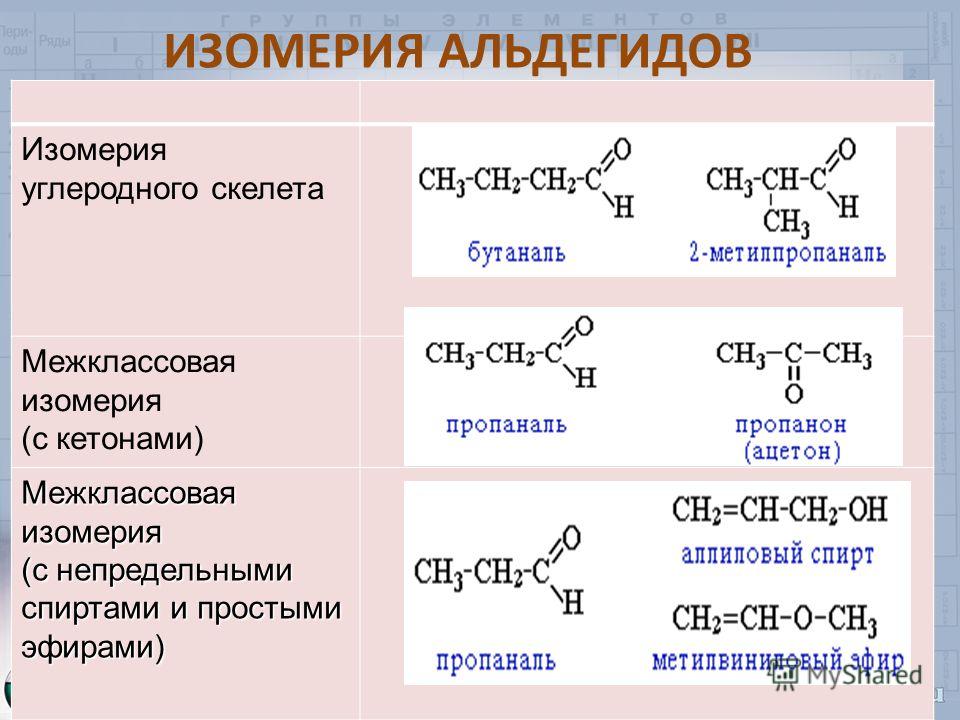 А это приводит к тому, что у них определяются различные свойства. Например, в парах винная и виноградные кислоты, цианокислое и гремучее серебро, вещества имеют одинаковые формулы, но резко отличающие свойства. Знаменитое общение Ю.Либиха и Ф. Вёлера натолкнуло химиков на мысль, что причиной тому могут быть различия «распределения простых атомов в сложном атоме», то есть, в молекуле, как сказали бы сейчас.
А это приводит к тому, что у них определяются различные свойства. Например, в парах винная и виноградные кислоты, цианокислое и гремучее серебро, вещества имеют одинаковые формулы, но резко отличающие свойства. Знаменитое общение Ю.Либиха и Ф. Вёлера натолкнуло химиков на мысль, что причиной тому могут быть различия «распределения простых атомов в сложном атоме», то есть, в молекуле, как сказали бы сейчас.
Интересным примером является межклассовая изомерия. Так, простые эфиры проявляют её в отношении одноатомных спиртов. Классический пример: \(C2P6O\) – это диметиловый эфир и этиловый спирт. Просто один имеет строение \(СН3 – О – СН3\), а второй — \(СН3СН2 – ОН\).
Метамерия проявляется как вид структурной изомерии в виде различного распределения углеродных атомов между несколькими углеводородными радикалами. На данный вид изомерии указывал Бутлеров. Но сейчас термин редко используется. Классическим примером является диэтиловый и метилпропиловый эфиры с формулами \(СН3СН2ОСН2СН3\) и \(СН3ОСН2СН2СН3\). Это изомерия, обусловленная ещё и строением углеводородных радикалов: \(С2Н5 – О – С2Н5\) и \(СН3 – О – С3Н7\). Так же у сохраняется одна бутто-формула.
Это изомерия, обусловленная ещё и строением углеводородных радикалов: \(С2Н5 – О – С2Н5\) и \(СН3 – О – С3Н7\). Так же у сохраняется одна бутто-формула.
Для сложных эфиров характерны три вида изомерии:
1.
Изомерия углеродной
цепи начинается
по кислотному остатку с бутановой
кислоты, по спиртовому остатку — с
пропилового спирта, например, этилбутирату
изомерны этилизобутират, пропилацетат
и изопропилацетат.
2.
Изомерия положения
сложноэфирной группировки —СО—О—.
Этот вид изомерии начинается
со сложных
эфиров, в молекулах которых содержится
не менее 4 атомов углерода, например
этилацетат и метилпропионат.
3.
Межклассовая
изомерия,
например, метилацетату изомерна
пропановая кислота.
Для сложных эфиров,
содержащих непредельную кислоту или
непредельный спирт,
возможны еще два вида изомерии: изомерия
положения кратной связи и цис-,
транс-изомерия.
Простые
эфиры
Простыми
эфирами называются вещества,
которые представляют собой соединение
двух одновалентных углеводородных
радикалов с атомомкислорода.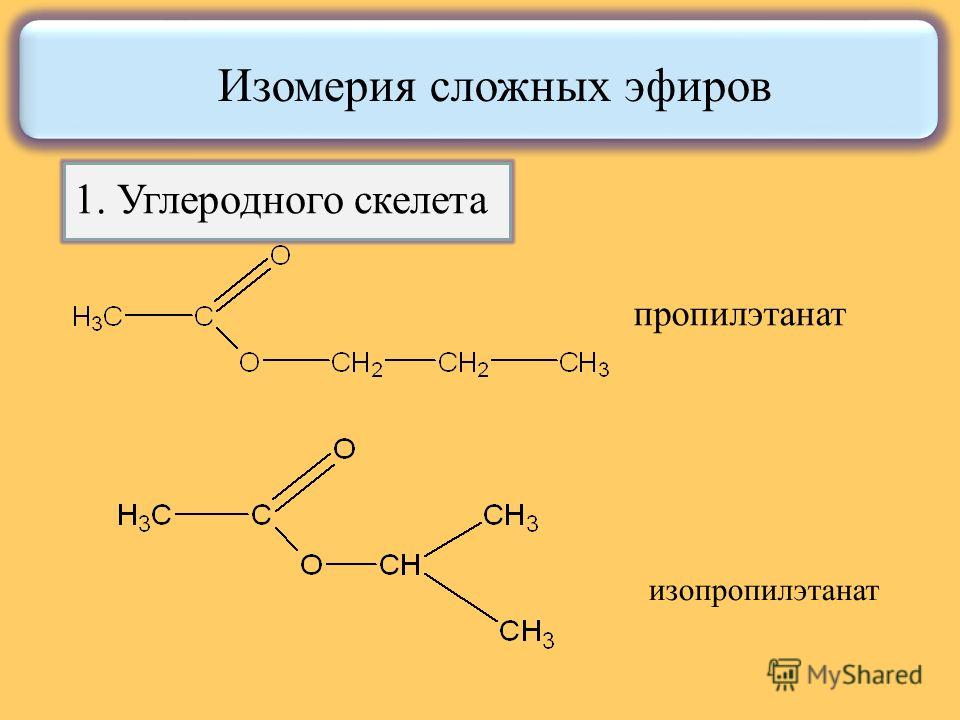
Их можно рассматривать также как продукты
замещения в молекуле воды обоих атомов водорода на
одновалентные углеводородные радикалы.
От
простейшего из эфиров — диметилового
эфира,
или просто метилового
эфира,
СН3—О—СН3 последовательным
замещением атомов водорода в
одной из метальных групп на остаток
метил можно произвести гомологический
ряд:
Для простых
эфиров возможна
такая же изомерия радикалов,
какая существует для спиртов и
вообще для одноатомных производных
парафиновыхуглеводородов.
От каждого из членов этого ряда можно,
кроме того, произвести гомологический
ряд,
заменяя второй метил на высшие радикалы.
Благодаря этому для класса простых
эфиров,
кроме обычной изомерии радикалов,
возможна также особая изомерия,
вызванная тем, что с кислородным атомом могут
быть связаны радикалы различного
состава. Так, эфир С2Н5—О—С2Н5 изомерен
эфиру СН3—О—С3Н7,
поскольку оба эфира имеют эмпирическую
формулу С4Н10О. Изомерия этого
Изомерия этого
рода носит название метамерии.
Простые
эфиры,
содержащие два разных радикала,
называются смешанными
эфирами.
Названия
эфиров производятся от названий
радикалов. Так, мы имеем диметиловый
(метиловый) эфир, метилэтиловый эфир,
диэтиловый (этиловый), метилпропиловый,
метилизопропиловый эфиры и т. д.
Сложные эфиры низших
карбоновых кислот и спиртов представляют
собой летучие, нерастворимые в воде
жидкости. Многие из них имеют приятный
запах. Так, например, бутилбутират имеет
запах ананаса, изоамилацетат — груши
и т. д.
Сложные эфиры
высших жирных кислот и спиртов —
воскообразные вещества, не имеют запаха,
в воде не растворимы.
Приятный аромат
цветов, плодов, ягод в значительной
степени обусловлен присутствием в них
тех или иных сложных эфиров.
Жиры широко
распространены в природе. Наряду с
углеводородами и белками они входят в
состав всех растительных и животных
организмов и составляют одну из основных
частей нашей пищи.
По агрегатному
состоянию при комнатной температуре
жиры делятся на жидкие и твердые. Твердые
жиры, как правило, образованы предельными
кислотами, жидкие жиры (их часто называют
маслами) — непредельными. Жиры растворимы
в органических растворителях и
нерастворимы в воде.
Физические
свойства простых эфиров
Простые
эфиры — подвижные легкокипящие
жидкости, малорастворимые в воде, очень
легковоспламеняющиеся. Проявляют
слабоосновные свойства (присоединяют
протон по атому O).
Эфиры изомерны с:$\left( A \right)$ Альдегидами$\left( B \right)$ Кетонами$\left( C \right)$ И альдегидами и кетонами$\left( D \right)$ Спиртом
Ответить
Проверено
185,7 тыс.+ просмотров
Подсказка: Изомеры — это соединения с одинаковой молекулярной формулой, но разной структурой, называемые изомерами. Это явление известно как изомерия. Изомеры можно разделить на широкие группы, в основном структурные изомеры и стереоизомеры.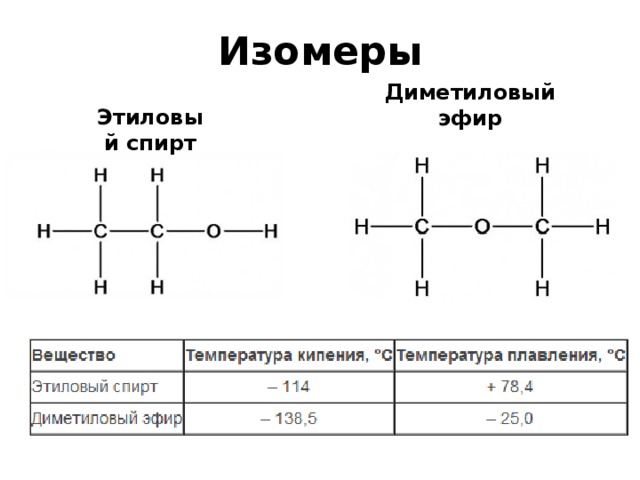
Полный пошаговый ответ: Молекулы с одинаковой молекулярной формулой, но разной молекулярной структурой. Наш вопрос связан с функциональными изомерами (структурные изомеры, которые имеют одинаковую молекулярную формулу, но с атомами, связанными по-разному, и поэтому попадают в разные категории.
Простые эфиры изомерны со спиртами. Давайте рассмотрим пример, чтобы понять, как простые эфиры изомерны. со спиртами. Диметиловый эфир (который является эфиром) является функциональными изомерами этанола (который является спиртом). Они имеют молекулярную формулу $\left( {{C_6}{H_6}O} \right)$, но имеют разные функциональные группы. Альдегиды а кетоны не являются функциональными группами простых эфиров, потому что они имеют другую молекулярную формулу, чем эфир.
Дополнительная информация:
Эфиры: Эфиры представляют собой семейство соединений, которые содержат одну или несколько эфирных групп, атом кислорода, связанный с алкильной или арильной группами. Они имеют общую формулу $\left( {R — O — R’} \right)$ , где $R$ и $R’$ могут быть алкильными или арильными группами, они могут быть одинаковыми или разными. Примерами простых эфиров являются диэтиловый эфир, диэтиловый эфир и т. д.
Они имеют общую формулу $\left( {R — O — R’} \right)$ , где $R$ и $R’$ могут быть алкильными или арильными группами, они могут быть одинаковыми или разными. Примерами простых эфиров являются диэтиловый эфир, диэтиловый эфир и т. д.
Спирты: Спирты представляют собой семейство соединений, которые содержат одну или несколько гидроксильных $\left({ — OH} \right)$ групп, присоединенных к алкану с одинарной связью. Они имеют общую формулу $\left( {{C_n}{H_{2n + 1}}O} \right)$ . Примерами спирта являются метанол, этанол, пропанол и т. д.
Таким образом, правильным вариантом является $D.$
Примечание: Изомеры подразделяются на две категории, такие как структурные изомеры и стереоизомеры. Кроме того, они подразделяются на различные категории.
Структурные изомеры делятся на пять категорий, таких как цепные изомеры, позиционные изомеры, функциональные изомеры, метамеры, таутомерии и кольцевые изомеры.
Стереоизомеры делятся на две категории, такие как геометрические и оптические изомеры.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверки класс 12 химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы класс 12 химии JEE_Main
Что из следующего имеет самый высокий класс электродного потенциала 12 химия JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 химия JEE_Main
Какой элемент обладает наибольшим атомным радиусом A класс 11 химия JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из нижеперечисленного имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды A Химический состав кальция класса 12 JEE_Main
Тенденции сомнений
Конституциональные изомеры — учебник по органической химии
Конституционные изомеры представляют собой молекулы, имеющие одинаковую молекулярную связь атомов в молекулах.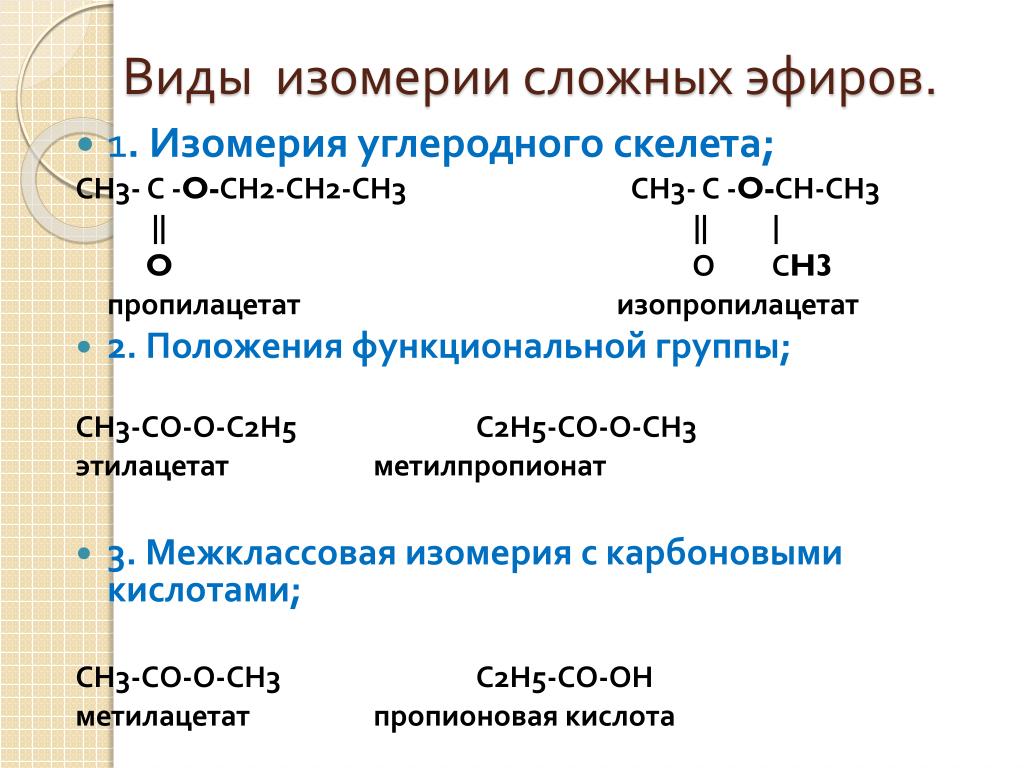 Будет лучше, если я проиллюстрирую идею конституциональных изомеров примером. Предположим, у нас есть молекула с молекулярной формулой C 2 H 6 O. Построение структур Льюиса для этой молекулы показывает два возможных соединения атомов:
Будет лучше, если я проиллюстрирую идею конституциональных изомеров примером. Предположим, у нас есть молекула с молекулярной формулой C 2 H 6 O. Построение структур Льюиса для этой молекулы показывает два возможных соединения атомов:
Две приведенные выше молекулы, этанол (этиловый спирт) и диметиловый эфир, являются примерами структурных изомеров. Они оба имеют точно такие же атомы в одинаковых соотношениях в молекуле. Однако связи между этими атомами или, другими словами, строение молекулы другое. В отношении конституциональных изомеров важно понимать, что это разные молекулы и, следовательно, они обладают разными свойствами. Вы будете встречать примеры конституциональных изомеров много раз в своем курсе, поэтому очень важно уметь их замечать.
Индекс дефицита водорода (HDI)
или
Степень ненасыщенности (DU)
Оба этих термина относятся к одному и тому же. Точный термин, который будет использовать ваш преподаватель, будет зависеть от его личных предпочтений или выбора книги. Хотя HDI обычно не вводят, пока мы не изучим спектроскопию, я считаю, что это очень мощный инструмент, который нужно изучить в начале семестра. И, честно говоря, я немного озадачен, почему здесь этому практически не учат. В любом случае, вернемся к HDI и почему это так круто.
Хотя HDI обычно не вводят, пока мы не изучим спектроскопию, я считаю, что это очень мощный инструмент, который нужно изучить в начале семестра. И, честно говоря, я немного озадачен, почему здесь этому практически не учат. В любом случае, вернемся к HDI и почему это так круто.
ИЧР является полезным инструментом для оценки структурных мотивов в молекуле. По сути, каждая степень ненасыщенности или единица HDI соответствует либо π-связи, либо циклическому мотиву в молекуле. Напомним, что двойные и тройные связи имеют π-связи. Более «правильным» определением HDI является количество эквивалентов H 2 , необходимое для насыщения молекулы, чтобы иметь только структуру одинарных связей с открытой цепью. Что, если вы спросите меня, звучит уродливо, так что я никогда не буду повторять это снова. 🤣
Давайте рассмотрим несколько примеров и посмотрим, как молекулярные особенности соотносятся с единицами HDI:
Сочетание циклов и двойных или тройных связей в вашей молекуле даст вам значение ИЧР.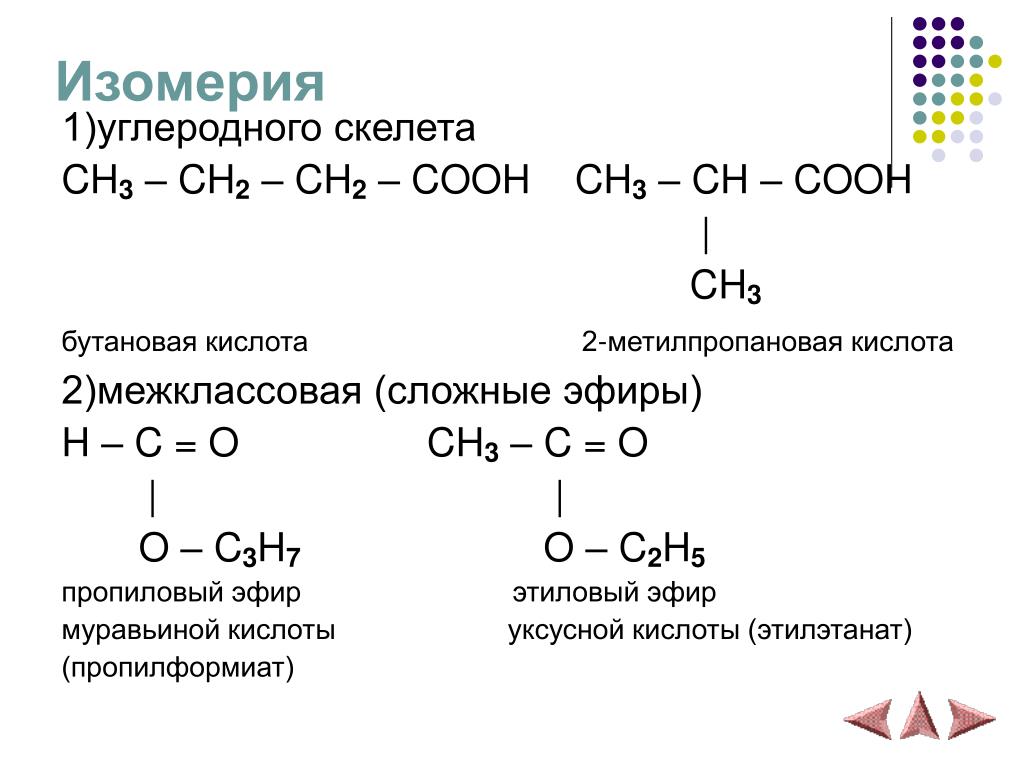 Но как это полезно для конституциональных изомеров? Что ж, поскольку конституциональные изомеры имеют одинаковую молекулярную формулу, они также будут иметь одинаковые индексы HDI! Таким образом, если вы знаете ИРЧП для молекулы, вы можете автоматически нарисовать различные конституциональные изомеры с правильными структурными мотивами. Итак, есть ли способ рассчитать ИРЧП только по молекулярной формуле? Там точно есть!
Но как это полезно для конституциональных изомеров? Что ж, поскольку конституциональные изомеры имеют одинаковую молекулярную формулу, они также будут иметь одинаковые индексы HDI! Таким образом, если вы знаете ИРЧП для молекулы, вы можете автоматически нарисовать различные конституциональные изомеры с правильными структурными мотивами. Итак, есть ли способ рассчитать ИРЧП только по молекулярной формуле? Там точно есть!
Расчет ИЧР по молекулярной формуле
Для расчета ИЧР мы используем очень простую формулу. Возможно, вы захотите запомнить его, так как он очень полезен, особенно если вы пытаетесь нарисовать конституциональные изомеры для множества различных молекул.
Формула, которую я здесь показываю, имеет несколько различных форм. Так что, если ваш инструктор или учебник используют другой, не волнуйтесь, все они дают одинаковый результат. Мне лично нравится этот, так что я буду придерживаться его. Давайте рассмотрим несколько примеров, используя эту формулу:
Как видите, чем выше ИЧР, тем больше возможностей вы можете получить для структурных мотивов в вашей молекуле.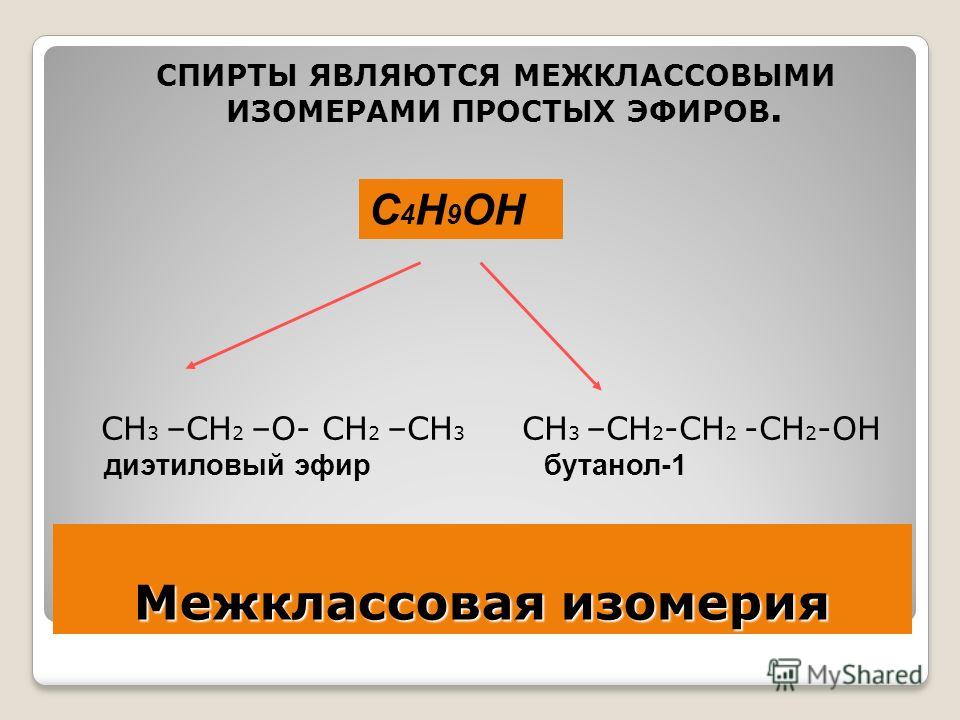 Так что, хотя это мощный инструмент, это не формула «мгновенного ответа», особенно когда речь идет о более сложных молекулах.
Так что, хотя это мощный инструмент, это не формула «мгновенного ответа», особенно когда речь идет о более сложных молекулах.
Как подходить к проблемам, используя формулу HDI
Итак, когда вам нужно придумать возможные конституциональные изомеры для молекулы, первое, на что вы хотите обратить внимание, это молекулярная формула. Оттуда мы получим HDI и получим некоторое представление о том, какие структурные особенности искать в нашей молекуле.
Давайте придумаем все возможные конституциональные изомеры для молекулы с молекулярной формулой C 3 H 6 O.
Шаг 1: Рассчитаем HDI по молекулярной формуле
Основываясь на нашем HDI, мы знаем, что это молекула должна содержать двойную связь или цикл. Но не эти две вместе, поскольку ИЧР = 1.
Шаг 2: Нарисуйте возможные конституциональные изомеры, начиная с линейных (простейших) молекул
Во-первых, я всегда использую возможные линейные структуры для моих конституциональных изомеров.

