Номенклатура и изомерия. Изомеры простых эфиров
Глава 14. Простые эфиры.
Простые эфиры – это органические соединения, в молекулах которых два углеродных радикала связаны атомом кислорода (радикалы могут быть одинаковые и разные).
 Общая формула R – O – R
Общая формула R – O – R
В зависимости от характера радикалов они могут быть: предельные СН3 – СН2 – О – СН3
непредельные СН2 = СН – О – СН2 – СН3
ароматические С6Н5 – О – СН3; С6Н5 – О – С6Н5
 14.1 Номенклатура, изомерия. Название эфиров производится от названия радикалов с прибавлением слова эфир.
14.1 Номенклатура, изомерия. Название эфиров производится от названия радикалов с прибавлением слова эфир.
 Изомерия простых эфиров обусловлена строением радикалов и их составом, например: изомеры состава С4Н10О следующие:
Изомерия простых эфиров обусловлена строением радикалов и их составом, например: изомеры состава С4Н10О следующие:
Простые эфиры изомерны насыщенным одноатомным спиртам. У них общая формула Сnh3n+2O.
14.2 Способы получения. . Дегидратация спиртов:

Взаимодействие алкоголятов с галогенопроизводными:

 Действие спиртов на алкены:
Действие спиртов на алкены:

 Непредельные эфиры получают действием спиртов на алкины:
Непредельные эфиры получают действием спиртов на алкины:
14.3 Физико-химические свойства. Эфиры – хорошие растворители органических веществ, плохо растворимы в воде, плотность меньше единицы, tкип у них ниже, чем у изомерных им спиртов или фенолов, например:
 |  |
Объясняется это тем, что простые эфиры не образуют водородные связи и не ассоциируют, как молекулы спиртов.
Простые эфиры – это инертные вещества. Объясняется это прочностью связей О – С, которая разрывается с трудом. Однако, концентрированные кислоты Н2SО4, НJ разлагают эфиры на холоду:

(Йод связывается с низшим радикалом)
 Металлический натрий расщепляет эфиры при нагревании:
Металлический натрий расщепляет эфиры при нагревании:
 Непредельные простые эфиры (в отличие от предельных) легко гидролизуются в кислой среде:
Непредельные простые эфиры (в отличие от предельных) легко гидролизуются в кислой среде:
Диэтиловый эфир С2Н5 – О – С2Н5 (этиловый эфир, или просто эфир) – бесцветная жидкость с характерным запахом, tкип = 34,50С, ρ = 0,714 г/мл, легкоподвижная и самовоспламеняющаяся. Его пары с воздухом образуют взрывоопасную смесь. Кроме того, окисляясь на свету, образует эфир – гидропероксид.

который также взрывоопасен. Чтобы освободиться от гидропероксида необходимо взболтать эфир с раствором щелочи или железного купороса. Все это требует осторожного обращения и тщательного хранения. Применяется этиловый эфир в качестве растворителя, в производстве бездымного пороха, искусственного шелка, в медицине.
Винилбутиловый эфир. СН2 = СН – О – С4Н9. Жидкость с tкип = 94,10С, плохо растворима в воде, получают в промышленности из ацетилена и бутилового спирта.
|
Применяется для получения полимера – поливинилбутилового спирта (бальзам Шостаковского).

который применяется для лечения ран, язв ит.д.
 14.4 Эпоксидные и пероксидные соединения. Эпоксиды – это циклические простые эфиры, содержащие трехчленный цикл, включающий атом кислорода. Общая формула:
14.4 Эпоксидные и пероксидные соединения. Эпоксиды – это циклические простые эфиры, содержащие трехчленный цикл, включающий атом кислорода. Общая формула:
Простейшим является окись этилена:
 |  |  |
Эпоксиды – химически активные вещества, их цикл легко разрывается (С – О) и происходит присоединение отрицательно заряженных частиц реагента к атому углерода, а положительных – к атому кислорода. Наиболее важный представитель окись этилена (этиленоксид).
Реакции присоединения.
 Присоединение Н2:
Присоединение Н2:
 Гидратация:
Гидратация:
 Действие спиртов:
Действие спиртов:
 Действие галогенводородов:
Действие галогенводородов:
 Действие НСN:
Действие НСN:
Действие магнийорганических соединений:

 Дейстиве аммиака:
Дейстиве аммиака:
 Дейстиве этиленгликоля:
Дейстиве этиленгликоля:
 Изомеризация:
Изомеризация:
Этиленоксид применяется для производства гликолей и их эфиров, этаноламинов, поверхностно-активных веществ (ПАВ), для дезинфекции.
14.5 Вопросы для самоконтроля.
1. Какие соединения называются простыми эфирами? Их общая формула и классификация.
2. Номенклатура и изомерия простых эфиров.
3. Назовите соединения:

4. Способы получения простых эфиров. Приведите три способа получения диэтилового эфира.
5. Физико-химические свойства простых эфиров. Поясните, почему они неактивные вещества.
6. Какой эфир получится при взаимодействии пропилового спирта с хлористым изопропилом?
7. Напишите уравнения реакции взаимодействия изопропилэтилового эфира с НJ.
8. Какие соединения называются эпоксидами. Их общая формула.
9. Этиленоксид, его получение, химические свойства, применение.
10. Напишите уравнения реакций этиленоксида: а) с пропиловым спиртом; б) с NН3; в) с НСN. Назовите полученные соединения.
11. С помощью каких реакций можно отличить диэтиловый эфир от изомерного ему бутилового спирта?
14.6 Обучающее задание №1.
Расшифруйте следующую схему превращений, напишите уравнения реакций:
СН ≡ СН ® СН3 – СНО ® С2Н5ОН ® СН2 = СН – О – С2Н5 ® (С2Н5)2О
 Решение:
Решение:



Обучающее задание №2.
Исходя из метана и неорганических веществ получите фенилэтиловый эфир.

 Решение:
Решение:




Обучающее задание №3.
18,2 мл 95 % этилового спирта (ρ = 0,8 г/мл) подвергли внутримолекулярной и межмолекулярной дегидратации, выделившийся газ пропустили через 320 г 5% раствора бромной воды до полного обесцвечивания. Определите массы продуктов дегидратации.
Решение:

Определяем количество С2Н5ОН по формуле: 



 это значение подставим в уравнение III. Следовательно, n(Br2) = n(C2h5) = =0,1 моль. Перенесем это значение в уравнение I. Следовательно, n(С2Н4) = n(С2Н5ОН) = 0,1 моль, тогда n(С2Н5ОН) в уравнении II будет равно 0,3-0,1=0,2 моль значит n(эф) будет равно 0,2:2 = 0,1 моль. Находим массы продуктов реакции:
это значение подставим в уравнение III. Следовательно, n(Br2) = n(C2h5) = =0,1 моль. Перенесем это значение в уравнение I. Следовательно, n(С2Н4) = n(С2Н5ОН) = 0,1 моль, тогда n(С2Н5ОН) в уравнении II будет равно 0,3-0,1=0,2 моль значит n(эф) будет равно 0,2:2 = 0,1 моль. Находим массы продуктов реакции:
m(С2Н4) = 0,1*28 = 2,8 г. m((С2Н5)2О) = 0,1*74=7,4 г.
Ответ: m(С2Н4) = 2,8г; m(С2Н5)2О = 7,4г.
14.7 Контрольные задания.
1. Напишите уравнения реакций: а) фенолята натрия с пропилхлоридом; б) изопропилэтилового эфира с НJ; в) метилового спирта с бутен-1; г) винилметилового эфира с водой в кислой среде; е) оксида этилена с НСl, NН3, НСN.
2. Напишите формулы всех изомеров состава С5Н12О.
3. В трех склянках находится диэтиловый эфир, этиловый спирт и раствор фенола. С помощью химических реакций определите эти вещества, написав соответствующие уравнения реакций.
 4. Осуществите превращения:
4. Осуществите превращения:

5. Исходя из метана и неорганических реагентов получите диэтиловый эфир.
6. Осуществите превращения, используя неорганические соединения: а) циклогексан ® диизопропиловый эфир;б) циклопропан ® дипропиловый эфир; в) С ® диметиловый эфир.
7. Предельный простой эфир массой 10 г занимает объем 4,87 л (н.у.) установите молекулярную формулу эфира.
8. Какую массу эфира можно получить из 18 г пропилового спирта, если выход продукта реакции составляет 70%.
Ответ: 10,7 г.
9. При межмолекулярной дегидратации предельного одноатомного спирта массой 13,8 г был получен эфир массой 11,1 г. Установите формулу эфира.
10. При нагревании 23 г этилового спирта с концентрированной серной кислотой образовалось несколько соединений, одно из которых полностью реагирует с 40 г 40% раствора брома в четыреххлористом углероде. Определите массы полученных соединений. Спирт в реакцию вступил полностью.
Ответ: 2,8 г С2Н4; 14,8 г С4Н10О; 5,4 г Н2О.
11. При взаимодействии 10,9 г бромистого этила с 10,2 г этилата натрия было получено 6 г эфира. Определите выход продукта реакции.
Ответ: 81%.
Дата добавления: 2017-12-05; просмотров: 110;
znatock.org
Номенклатура и изомерия - Сложные эфиры - Сложная эфиры. Жиры. Моющие средства - Органическая химия
Среди функциональных производных карбоновых кислот особое место занимают сложные эфиры — соединения, представляющие карбоновые кислоты, у которых атом водорода в карбоксильной группе заменен углеводородным радикалом. Общая формула сложных эфиров
| R — C — O — R’ |
| || |
| O |
где R и R‘ — углеводородные радикалы (в сложных эфирах муравьиной кислоты R — атом водорода).
Названия сложных эфиров производят от названия, углеводородного радикала и названия кислоты, в котором вместо окончания "-овая кислота" используют суффикс "ат", например:
|
| |||||||||||||||||||||||||
Часто сложные эфиры называют по тем остаткам кислот и спиртов, из которых они состоят. Так, рассмотренные выше сложные эфиры могут быть названы: этановоэтиловый эфир, кротоновометиловый эфир.
Для сложных эфиров характерны три вида изомерии:
1. Изомерия углеродной цепи, начинается по кислотному/> остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например:
|
| |||||||||||||||||||||||||
|
| |||||||||||||||||||||||||
2. Изомерия положения сложноэфирной группировки />-СО-О-. Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например:/>
| СН3-СО-О-С2Н5 | С2Н5-СО-О-СН3 | |
| этилацетат | метилпропионат |
3. Межклассовая изомерия, например:
| СН3-СО-О-СН3 | С2Н5-СО-ОН | |
| метилацетат | пропионовая кислота |
Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи; цис-транс-изомерия.
Физические свойства сложных эфиров. Сложные эфиры />низших карбоновых кислот и спиртов представляют собой летучие, малорастворимые или практически нерастворимые в воде жидкости. Многие из них имеют приятный запах. Так, например, бутилбутират имеет запах ананаса, изоамилацетат — груши и т.д.
Сложные эфиры имеют, как правило, более низкую температуру кипения, чем соответствующие им кислоты. Например, стеариновая кислота кипит при 232 °С (Р = 15 мм рт. ст.), а метилстеарат— при 215 °С (Р =15 мм рт. ст.). Объясняется это тем, что между молекулами сложных эфиров отсутствуют водородные связи.
Сложные эфиры высших жирных кислот и спиртов — воскообразные вещества, не имеют запаха, в воде не растворимы, хорошо растворимы в органических растворителях. Например, пчелиный воск представляет собой в основном мирицилпальмитат (C15h41COOC31H63).
www.himhelp.ru
Строение органических соединений | Дистанционные уроки
28-Май-2013 | комментария 2 | Лолита Окольнова
Вопрос A13 ЕГЭ по химии —
Теория строения органических соединений: гомология и изомерия. Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.

Темы, которые нужно знать:
Эти вопросы входят в анализ строения каждого класса веществ в органической химии, но в данном вопросе нам нужно свести все эти знания воедино. Давайте рассмотрим каждое определение, каждый пункт этого вопроса, исходя из знаний строения всех органических веществ.
Изомеры и гомологи
Не вдаваясь в сложные формулировки, давайте определим, что такое гомологи и изомеры.
Гомологи — относятся к одному классу веществ (например, алканы). Это значит, что у них:
- Одинаковая общая формула (на примере алканов — (Сnh3n+2) и
- Схожие химические свойства, которые определяются одинаковым строением веществ.
- Гомологи отличаются друг от друга на одну или несколько -Ch3— групп

Обратите внимание, именно н-бутан и н-гексан будут относится к гомологам. Если мы возьмем н-алкан (линейная молекула) и разветвленный алкан, то, хотя у них будет одна и та же общая формула (Сnh3n+2), по химическим свойствам они будут несколько различаться, т.к. разветвленное строение этих органических соединений будет оказывать влияние на направление протекания реакций.
Изомеры —химические соединения, одинаковые по составу и молекулярной массе, но различающиеся по строению и свойствам (химическим и физическим)
Виды изомерии:
- Структурная изомерия — (изомерия углеродного скелета)

- Межклассовая изомерия — характерна для соединений, имеющих одинаковую общую формулу, но принадлежащих к разным классам (и следовательно, иемющим разные химические и физические свойства)

- Изомерия положения кратной связи — вид изомерии, характерный для соединений с количеством атомов углерода больше 3-х и имеющих двойные или тройные связи:

- Изомерия положения функциональной группы -вид изомерии, характерный для кислород- и азотсодержащих органических соединений:

- Пространственная изомерия — в школьном курсе подготовки к ЕГЭ рассматривают пространственную цис-транс-изомерию алкенов. Этот вид изомерии характерен для симметричных относительно двойной связи алкенов:

Виды химической связи в органической химии
Т.к. органическая химия — это химия соединений углерода, то основным видом химической связи является ковалентная химическая связь.
- В углеводородах эта связь — ковалентная малополярная;
- В кислород-, азот- и серасодержащих органических соединениях — ковалентная полярная;
- В случаях алкоголятов или солей органических кислот — ионная (Ch4COONa например).
Как и в неорганических соединениях, в органических вид химической связи определяют исходя из строения вещества.
Когда ковалентная связь -С-С- или -C-H разрывается, образуются частицы — радикалы. Это частицы, имеющие один электрон: (Сh4• — метил ). Называют их соответственно классу соединения с окончанием -ил.
Тип гибридизации атомов в органических соединениях
Как образуется гибридизация атомных орбиталей в молекуле мы подробно рассматривали при изучении каждого класса органических соединений, здесь мы рассмотрим практическое применение этих знаний.
На что нужно обратить внимание:
1) в молекуле, имеющей не только один вид связи, каждый атом имеет свой тип гибридизации:

2) если нужно посчитать суммы s -и π-связей, то нужно учитывать не только связи -С-С-, но и -С-H:

итого: 10 сигма- и 3 π-связей
Давайте систематизируем все эти вопросы по классам углеводородов
| Класс соединения | Общая формула | Тип гибридизации атомов С | Виды изомерии |
| Алканы | Сnh3n+2 | Sp3 | углеродного скелета |
| Алкены | Сnh3n | Sp3 и Sp2 | углеродного скелета положения кратной связи пространственная изомерия межклассовая(алкены изомерны циклоалканам) |
| Алкины | Сnh3n-2 | Sp и Sp3 | углеродного скелета положения кратной связи межклассовая(алкины изомерны алкадиенам) |
| Циклоалканы | Сnh3n | Sp3 | углеродного скелета, межклассовая(циклоалкалканы изомерны алкенам) |
| Алкадиены | Сnh3n-2 | Sp2 и Sp3 | углеродного скелета положения кратной связи межклассовая(алкадиены изомерны алкинам) |
| Бензол и его гомологи | Сnh3n-6 | Sp2 и (Sp3 — в боковой цепи) | углеродного скелета(в боковых цепях) |
| Алифатические спирты | Сnh3n+1OH | Sp3 | углеродного скелетаположения функциональной группымежклассовая —(спирты изомерны простым эфирам) |
| Ароматические спирты | Сnh3n-7OH | Sp2 и (Sp3 — в боковой цепи) | углеродного скелета положения функциональной группы межклассовая(спирты изомерны простым эфирам, толькоодин из радикалов будет ароматический) |
| Простые эфиры | Сnh3n+1O | Sp3 | углеродного скелетамежклассовая(простыеэфиры изомерны спиртам) |
| Альдегиды и кетоны | Сnh3nO | Sp2 (-С=O) и Sp3 | углеродного скелета — альдегиды изомерны кетонам |
| Кислоты | Сnh3n+1COOH | Sp2 (-С=O) и Sp3 | углеродного скелета положения функциональной группы межклассовая(кислоты изомерны сложным эфирам) |
| Сложные эфиры | Сnh3n+1COO | Sp2 (-С=O) и Sp3 | углеродного скелета межклассовая(сложные эфиры изомерны кислотам) |
Какое бы задание вам не попалось, все сводится к определению строения органического соединения, поэтому чтобы не ошибиться, рисуйте структурные формулы данных соединений, а уже из этого вы определите и тип связи, и гибридизацию, и виды изомерии.
Кстати, ответы на наши примеры вопросов: А13 первый вариант: изомером гексена-2 не является гексадиен-1, 3 Ответ: 4) А 13 второй вариант: только Sp2 гибридизация — в молекуле бутадиена Ответ: 4) А 13 третий вариант: гомологами являются: пропан и пентан Ответ: 1)
Еще на эту тему:
Обсуждение: "Строение органических соединений"
(Правила комментирования)distant-lessons.ru
строение, изомерия, свойства и примеры
В зависимости от числа гидроксильных групп спирты делят на одно- (Ch4OH — метанол, 2H5OH — этанол), двух- (Ch3(OH)-Ch3-OH — этиленгликоль) и трехатомные (Ch3(OH)-CH(OH)-Ch3-OH — глицерин). В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают первичные (R-Ch3-OH), вторичные (R2CH-OH) и третичные спирты (R3C-OH). В названии спиртов присутствует суффикс – ол.
Одноатомные спирты
Общая формула гомологического ряда предельных одноатомных спиртов Cnh3n+1OH.
Изомерия
Для предельных одноатомных спиртов характерна изомерия углеродного скелета (начиная с бутанола), а также изомерия положения гидроксильной группы (начиная с пропанола) и межклассовая изомерия с простыми эфирами.
СН3-СН2-СН2-СН2-ОН (бутанол – 1)
СН3-СН(СН3)- СН2-ОН (2-метилпропанол – 1)
СН3-СН(ОН)-СН2-СН3 (бутанол – 2)
СН3-СН2-О-СН2-СН3 (диэтиловый эфир)
Физические свойства
Низшие спирты (до С15) – жидкости, высшие – твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в оде падает. Спирты имеют высокие температуры кипения и плавления за счет образования водородных связей.
Получение спиртов
Получение спиртов возможно с помощью биотехнологического (брожение) способа из древесины или сахара.
К лабораторным способам получения спиртов относятся:
— гидратация алкенов (реакция протекает при нагревании и в присутствии концентрированной серной кислоты)
СН2=СН2 + Н2О → СН3ОН
— гидролиз алкилгалогенидов под действием водных растворов щелочей
СН3Br + NaOH → Ch4OH + NaBr
СН3Br + Н2О → Ch4OH + HBr
— восстановление карбонильных соединений
Ch4-CH-O + 2[H] → Ch4 – Ch3-OH
Химические свойства
1. Реакция, протекающие с разрывом связи О-Н:
— кислотные свойства спиртов выражены очень слабо. Спирты реагируют с щелочными металлами
2C2H5OH + 2K → 2C2H5OK + h3
но не реагируют с щелочами. В присутствии воды алкоголяты полностью гидролизуются:
C2H5OK + Н2О → C2H5OH + KOH
Это означает, что спирты – более слабые кислоты, чем вода
— образование сложных эфиров под действием минеральных и органических кислот:
Ch4-CO-OH + H-OCh4 ↔ Ch4COOCh4 + h3O
— окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты.
R-Ch3-OH + [O] → R-CH=O + [O] → R-COOH
Вторичные спирты окисляются в кетоны:
R-CH(OH)-R’ + [O] → R-C(R’)=O
Третичные спирты более устойчивы к окислению.
2. Реакция с разрывом связи С-О.
— внутримолекулярная дегидратация с образованием алкенов (происходит при сильном нагревании спиртов с водоотнимающими веществами (концентрированная серная кислота)):
Ch4-Ch3-Ch3-OH → Ch4-CH=Ch3 + h3O
— межмолекулярная дегидратация спиртов с образованием простых эфиров (происходит при слабом нагревании спиртов с водоотнимающими веществами (концентрированная серная кислота)):
2C2H5OH → C2H5-O-C2H5 + h3O
— слабые основные свойства спиртов проявляются в обратимых реакциях с галогеноводородами:
C2H5OH + HBr →C2H5Br + h3O
Примеры решения задач
ru.solverbook.com
Изомерия предельных одноатомных спиртов | Химия онлайн
Изомерия алканолов
Первые два члена гомологического ряда – СН3ОН и С2Н5ОН изомеров не имеют. Для остальных алканолов возможны структурная и пространственная изомерия:
Структурная изомерия
1. Изомерия положения функциональной группы –ОН (начиная с С3): 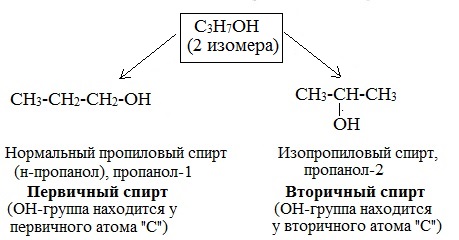
2. Изомерия цепи (углеродного скелета) (начиная с С4)
Например, формуле C4H9OH соответствует 4 структурных изомера: 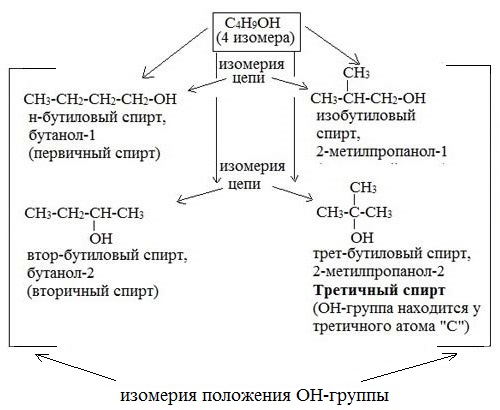
3. Межклассовая изомерия
Спирты изомерны другому классу соединений – простым эфирам (R-O-R'):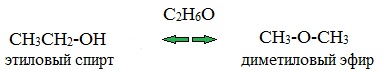
Возможна также пространственная изомерия – оптическая.
Например, бутанол-2 Сh4CH (OH)Сh3Ch4, в молекуле которого второй атом углерода (выделен цветом) связан с четырьмя различными заместителями, существует в форме двух оптических изомеров.
Таким образом, формуле C4H9OH соответствует 5 изомерных спиртов (4 структурных изомера и один из них — бутанол-2 — в виде двух зеркальных изомеров).
Предельные одноатомные спирты
himija-online.ru


















