Содержание
Сложные эфиры: химические свойства и применение
Сложными эфирами принято называть соединения, полученные по реакции этерификации из карбоновых кислот. При этом происходит замещение ОН- из карбоксильной группы на алкоксирадикал. В результате образуются сложные эфиры, формула которых в общем виде записывается как R-СОО-R’.
Строение сложноэфирной группы
Полярность химических связей в молекулах сложных эфиров аналогична полярности связей в карбоновых кислотах. Главным отличием является отсутствие подвижного атома водорода, на месте которого размещается углеводородный остаток. Вместе с тем электрофильный центр располагается на атоме углерода сложноэфирной группы. Но и углеродный атом алкильной группы, соединенный с ней, тоже положительно поляризован.
Электрофильность, а значит, и химические свойства сложных эфиров определяются строением углеводородного остатка, занявшего место атома Н в карбоксильной группе. Если углеводородный радикал образует с атомом кислорода сопряженную систему, то реакционная способность заметно возрастает. Так происходит, например, в акриловых и виниловых эфирах.
Так происходит, например, в акриловых и виниловых эфирах.
Физические свойства
Большинство сложных эфиров представляют собой жидкости или кристаллические вещества с приятным ароматом. Температура их кипения обычно ниже, чем у близких по значениям молекулярных масс карбоновых кислот. Что подтверждает уменьшение межмолекулярных взаимодействий, а это, в свою очередь, объясняется отсутствием водородных связей между соседними молекулами.
Однако так же, как и химические свойства сложных эфиров, физические зависят от особенностей строения молекулы. А точнее, от типа спирта и карбоновой кислоты, из которых он образован. По этому признаку сложные эфиры делят на три основные группы:
- Фруктовые эфиры. Они образованы из низших карбоновых кислот и таких же одноатомных спиртов. Жидкости с характерными приятными цветочно-фруктовыми запахами.
- Воски. Являются производными высших (число атомов углерода от 15 до 30) кислот и спиртов, имеющих по одной функциональной группе.
 Это пластичные вещества, которые легко размягчаются в руках. Основным компонентом пчелиного воска является мирицилпальмитат С15Н31СООС31Н63, а китайский — цериловый эфир церотиновой кислоты С25Н51СООС26Н53. Они не растворяются в воде, но растворимы в хлороформе и бензоле.
Это пластичные вещества, которые легко размягчаются в руках. Основным компонентом пчелиного воска является мирицилпальмитат С15Н31СООС31Н63, а китайский — цериловый эфир церотиновой кислоты С25Н51СООС26Н53. Они не растворяются в воде, но растворимы в хлороформе и бензоле. - Жиры. Образованные из глицерина и средних и высших карбоновых кислот. Животные жиры, как правило, твердые при нормальных условиях, но легко плавятся при повышении температуры (сливочное масло, свиной жир и др.). Для растительных жиров характерно жидкое состояние (льняное, оливковое, соевое масла). Принципиальным отличием в строении этих двух групп, что и сказывается на различиях в физических и химических свойствах сложных эфиров, является наличие или отсутствие кратных связей в кислотном остатке. Животные жиры являются глицеридами непредельных карбоновых кислот, а растительные — предельных кислот.
Химические свойства
Эфиры реагируют с нуклеофилами, что приводит к замещению алкоксигруппы и ацилированию (или алкилированию) нуклеофильного агента.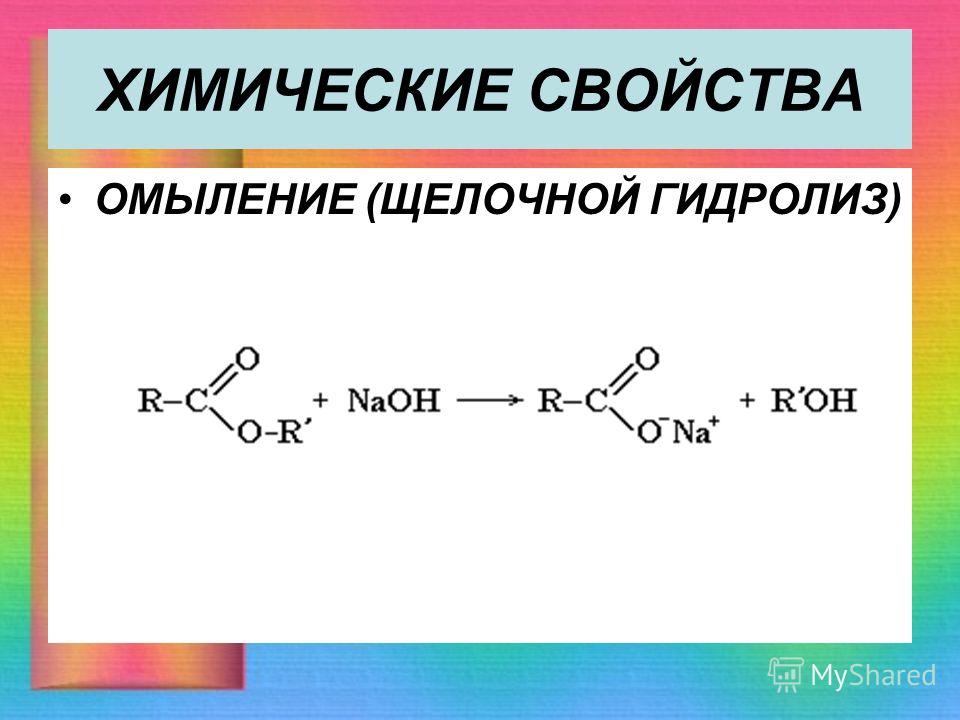 Если в структурной формуле сложного эфира имеется α-водородный атом, то возможна сложноэфирная конденсация.
Если в структурной формуле сложного эфира имеется α-водородный атом, то возможна сложноэфирная конденсация.
1. Гидролиз. Возможен кислотный и щелочной гидролиз, представляющий собой реакцию, обратную этерификации. В первом случае гидролиз обратим, а кислота выступает в роли катализатора:
R-СОО-R’ + Н2О <―> R-СОО-Н + R’-OH
Основной гидролиз необратим и обычно называется омылением, а натриевые и калиевые соли жирных карбоновых кислот — мылами:
R-СОО-R’ + NaOH ―> R-СОО-Na + R’-OΗ
2. Аммонолиз. Нуклеофильным агентом может выступать аммиак:
R-СОО-R’ + NH3 ―> R-СО-NH2 + R’-OH
3. Переэтерификация. Это химическое свойство сложных эфиров можно причислить также к способам их получения. Под действием спиртов в присутствии Н+ или ОН— возможна замена углеводородного радикала, соединенного с кислородом:
R-СОО-R’ + R»-OH ―> R-СОО-R» + R’-OH
4. Восстановление водородом приводит к образованию молекул двух разных спиртов:
R-СО-OR’ + LiAlH4 ―> R-СΗ2-ОΗ + R’OH
5. Горение — еще одна типичная для сложных эфиров реакция:
Горение — еще одна типичная для сложных эфиров реакция:
2CΗ3–COO–CΗ3 + 7O2 = 6CO2 + 6H2O
6. Гидрирование. Если в углеводородной цепи молекулы эфира имеются кратные связи, то по ним возможно присоединение молекул водорода, которое происходит в присутствии платины или других катализаторов. Так, например, из масел возможно получение твердых гидрогенизированных жиров (маргарина).
Применение сложных эфиров
Сложные эфиры и их производные применяются в различных отраслях промышленности. Многие из них хорошо растворяют различные органические соединения, используются в парфюмерии и пищевой промышленности, для получения полимеров и полиэфирных волокон.
Этилацетат. Используется как растворитель для нитроцеллюлозы, ацетилцеллюлозы и других полимеров, для изготовления и растворения лаков. Благодаря приятному аромату применяется в пищевой и парфюмерной промышленностях.
Бутилацетат. Также применяют в качестве растворителя, но уже и полиэфирных смол.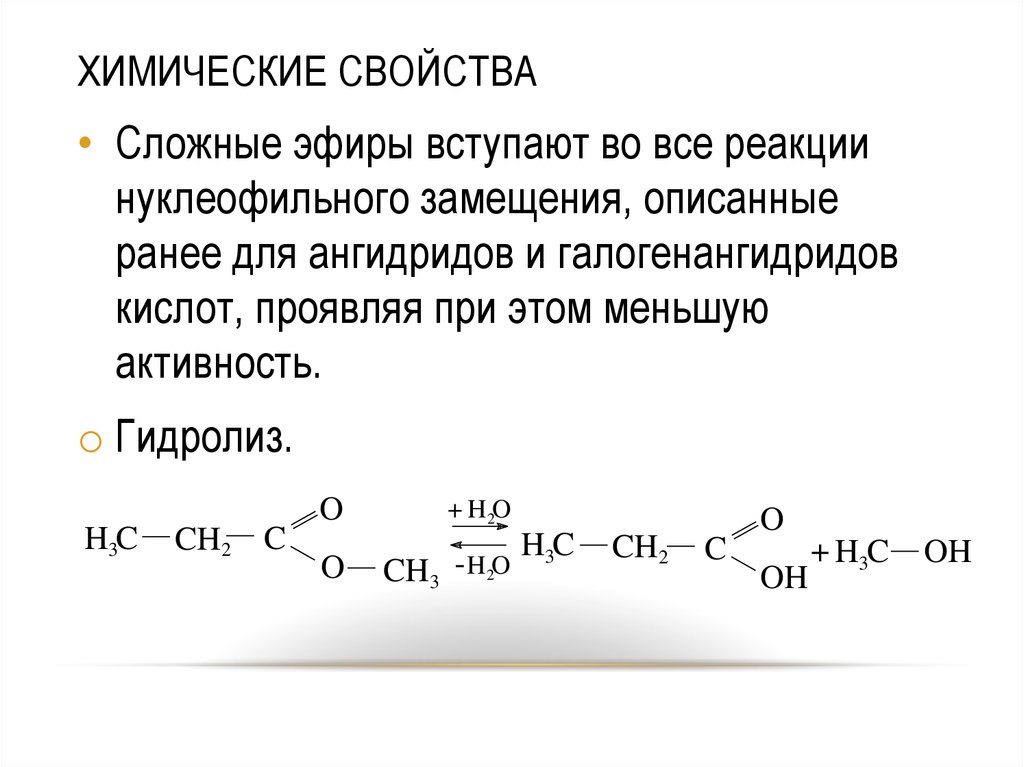
Винилацетат (СН3-СОО-СН=СН2). Используется как основа полимера, необходимого в приготовлении клея, лаков, синтетических волокон и пленок.
Малоновый эфир. Благодаря своим особым химическим свойствам этот сложный эфир широко используется в химическом синтезе для получения карбоновых кислот, гетероциклических соединений, аминокарбоновых кислот.
Фталаты. Эфиры фталевой кислоты используют в качестве пластифицирующих добавок к полимерам и синтетическим каучукам, а диоктилфталат — еще и как репеллент.
Метилакрилат и метилметакрилат. Легко полимеризуются с образованием устойчивого к различным воздействиям листов органического стекла.
Физико-химические свойства сложных эфиров. вопрос 4 параграф 30 химия Рудзитис 10 класс – Рамблер/класс
Физико-химические свойства сложных эфиров. вопрос 4 параграф 30 химия Рудзитис 10 класс – Рамблер/класс
Интересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Доброго дня. Помогите с домашкой) Нужно: Охарактеризуйть физические и химические свойства сложных эфиров. Напишите уравнения соответствующих реакций.
Помогите с домашкой) Нужно: Охарактеризуйть физические и химические свойства сложных эфиров. Напишите уравнения соответствующих реакций.
ответы
Уже помогли! Лови: Физические свойства. Сложные эфиры — бесцветные жидкости, малорастворимые или совсем не растворимые в воде, обладают специфическим запахом (в малых концентрациях — приятным, часто фруктовым или цветочным). Сложные эфиры высших спиртов и высших кислот — твердые вещества.
Химические свойства. Наиболее характерная реакция для сложных эфиров — гидролиз. Гидролиз происходит в присутствии кислот или щелочей. При гидролизе сложного эфира в присутствии кислот образуется карбоновая кислота и спирт:
При гидролизе сложного эфира в присутствии щелочей образуются соль карбоновой кислоты и спирт:
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
9 класс
11 класс
Физика
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
у.) потребуется для сжигания 1 м3 бутана-1?
ГДЗ10 классХимияРудзитис Г.Е.
Почему сейчас школьники такие агрессивные ?
Читали новость про 10 классника который растрелял ? как вы к этому относитесь
Новости10 классБезопасность
Здравствуйте.
(Подробнее…)
Химия
Это правда, что будут сокращать иностранные языки в школах?
Хочется узнать, когда собираются сократить иностранные языки в школе? Какой в итоге оставят? (Подробнее…)
ШколаНовостиИностранные языки
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)…
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Физико-химические свойства сложных эфиров, реакция этерификации и получение этилацетатного эфира
сложные эфиры
сложные эфиры – продукты соединения карбоновых кислот со спиртами, сложные эфиры широко распространены в природе, присутствуют во всех растениях и животных организмов. Большинству эфиров присущ приятный запах, который отвечает за запах и вкус фруктов и цветов.
Большинству эфиров присущ приятный запах, который отвечает за запах и вкус фруктов и цветов.
Многие органические сложные эфиры были приготовлены для коммерческого производства духов и ароматизаторов. Они используются либо отдельно, либо в смеси с натуральными соединениями. Запах эфира уменьшается при увеличении молекулярной массы спирта и кислоты, используемых для их формирование.
Природа сложного эфира изменяется от жидкости с приятным запахом до воскообразного твердого вещества, которое почти не имеет запаха, воски, такие как пчелиный воск, представляют собой сложные эфиры с высокой молекулярной массой, жиры и масла представляют собой сложные эфиры, полученные из глицерина, который представляет собой трехатомный спирт и высшие жирные кислоты.
Название сложного эфира происходит от названия кислотного радикала и названия алкильной группы спирта, например, метилформиат HCOOCH 3 , этилацетат CH 3 COOCH 2 CH 3 и Этилбензоат C 6 H 5 COOC 2 H 5 .
Сложные эфиры
Получение этилацетатного эфира
уксусной кислоты и этилового спирта.
Ч. 3 COOH + C 2 H 5 OH ⇔ CH 3 COOC 2 H 5 + H 2 O 9004
Эта реакция AREVERBILBIBLIBLIBLE, где AREDSIBLE AREVSIBLE, где AREVERBIL AREVSIBLIBLIBLE AREVSIBLE. сложный эфир гидролизуется до кислоты и спирта. Предпочтительно использовать дегидратирующий агент, такой как концентрированная серная кислота или газообразный хлористый водород, чтобы избавиться от образовавшейся воды.
Концентрированная серная кислота используется при приготовлении этилацетатного эфира, чтобы избавиться от воды и убедиться, что реакция смещена в прямом направлении (в направлении образования эфира).
C 6 H 5 COOH + C 2 H 5 OH ⇔ C 6 H 5 COOC 2 H 5 + H 2 O
В прямом методе получения этилбензоатного эфира для обезвоживания используется сухая HCl, неконцентрированная H 2 SO 4 во избежание сульфирования бензойной кислоты.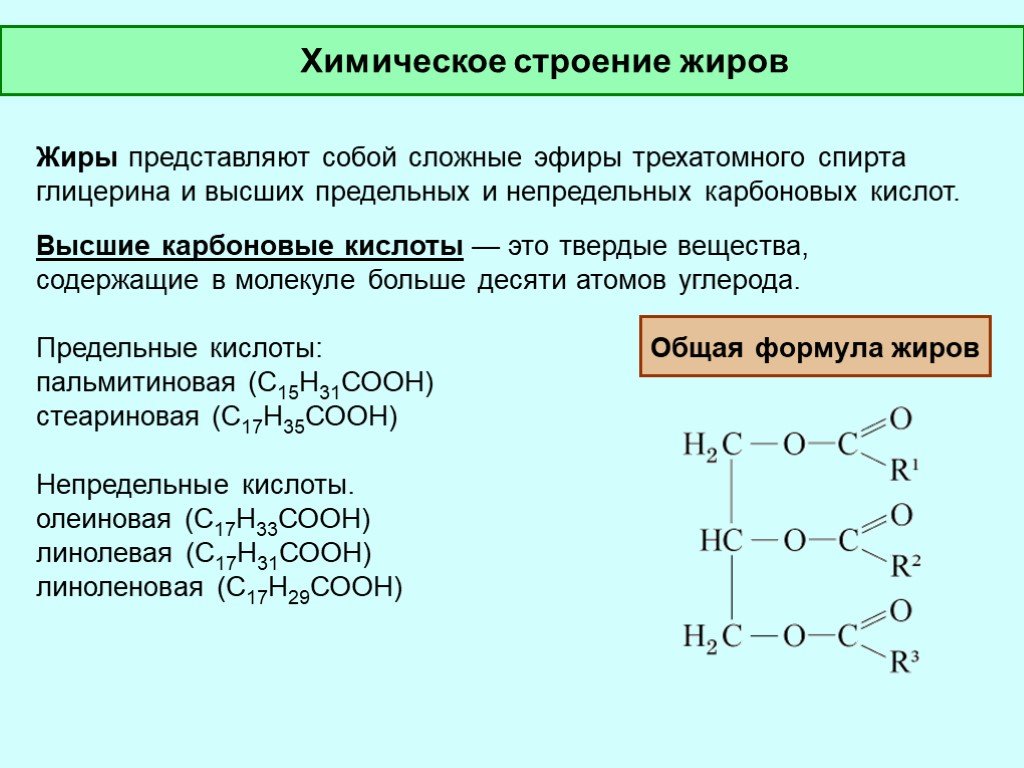
Физические свойства
Большинство сложных эфиров представляют собой жидкости с гораздо более низкой температурой кипения, чем у кислот или спиртов почти одинакового веса, это связано с отсутствием полярной гидроксильной группы, которая встречается в спиртах и кислотах и приводит к ассоциации молекулы спирта и карбоновой кислоты с водородными связями, сложные эфиры оказывают нейтральное действие на лакмус.
Температура кипения сложного эфира ниже температуры кипения образующих его кислоты и спирта из-за отсутствия полярной гидроксильной группы (присутствует в спиртах и кислотах), которая обладает способностью образовывать водородные связи между молекулами и водой .
Степень растворимости сложного эфира в воде меньше, чем у соответствующей кислоты из-за отсутствия полярной гидроксильной группы (присутствует в спиртах и кислотах), которая обладает способностью образовывать водородные связи между молекулами и водой.
Химические свойства
Гидролиз сложных эфиров: Спирт и кислота получают гидролизом сложного эфира, эта реакция обратна образованию сложного эфира, Гидролиз может происходить с использованием разбавленных минеральных кислот в качестве катализатора и называется кислотным гидролизом, Разбавленная минеральная кислота (H + ) используется для предотвращения обратимой реакции.
CH 3 COOC 2 H 5 + H 2 O → CH 3 COOH + C 2 H 5 OH
Hydrolysis of esters may также проводят при нагревании с водными растворами щелочей для получения спирта и соли кислоты, это называется щелочным гидролизом или омылением (поскольку мыло является натриевой солью высших карбоновых кислот), NaOH добавляют для реакции с образуется кислота, превращающая ее в соль и предотвращающая обратимую реакцию.
CH 3 COOC 2 H 5 + NaOH → CH 3 COONa + C 2 H 5 OH
C 6 H 5 COOC 2 H 5 + NAOH → C 6 H 5 COONA + C 2 H 5 OH
Гидроль Estter (в кислой среде) с образованием кислоты и спирта, омыление — нагревание эфира водными щелочами с образованием спирта и соли кислоты, Мыло — натриевая соль высокожирных карбоновых кислот.
Продукт гидролиза эфира зависит от реакционной среды, так как в кислой среде образуются кислота и спирт, а в щелочной среде образуются соли органической кислоты и спирта. производят амид кислоты и спирт.
Ch 3 COOC 2 H 5 + NH 3 → CH 3 CONH 2 + C 2 CONH 2 + C 2 . 0021 H 5 OH
0021 H 5 OH
C 6 H 5 COOC 2 H 5 + NH 3 → C 6 H 5 CONH 2 + C 2 H 5 OH
Реакция этерификации не является реакцией нейтрализации, поскольку она является обратимой реакцией «неполной», Требуется дегидратирующий агент, Это медленная реакция, поскольку она протекает между молекулами, вода образуется за счет соединения молекул Н из спирта и ОН из кислоты.
Кислота + спирт ↔ сложный эфир + H 2 O
сочетание ионов Н + из кислоты и ОН — из щелочи.
Кислота + основание → соль + H 2 O
Органические кислоты в нашей жизни, Ароматические карбоновые кислоты, Получение и свойства бензойной кислоты
Значение и применение сложных эфиров в нашей жизни
Структура, номенклатура и свойства – HSC Chemistry
– Science Ready
Это часть курса HSC Chemistry по теме «Реакции органических кислот и оснований».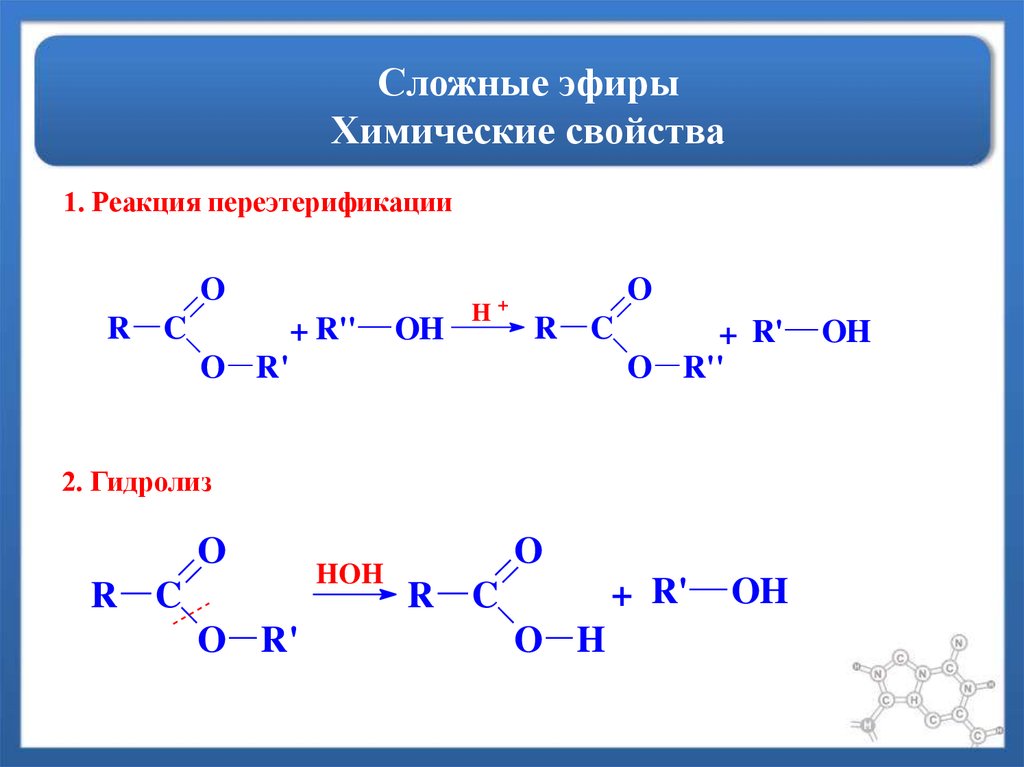
HSC Chemistry Syllabus
Сложные эфиры: структура, номенклатура, температура кипения и растворимость
Сложные эфиры
Строение и номенклатура сложных эфиров
- Сложные эфиры являются производными карбоновых кислот, поскольку они имеют общую карбонильную группу (C=O) и могут быть получены из карбоновых кислот с использованием различных механизмов реакции.
Имя системы | Общая структура | Пример |
-ил-оат |
| метилэтаноат |
- Сложные эфиры образуются в результате реакций конденсации между карбоновой кислотой и спиртом.
 Это называется этерификацией .
Это называется этерификацией .
- Условное обозначение сложных эфиров всегда делится на две части
- Первая часть (-ил) названия указывает на алкильную группу, происходящую от спирта.
- Вторая часть (-оат) названия указывает на производное карбоновой кислоты.
Эфир | Алкоголь | Карбоновая кислота |
Пропилпропаноат | Пропан-1-ол | Пропановая кислота |
Бутилэтанолат | Бутан-1-ол | Этановая кислота |
Свойства эфиров
Точки кипячения и плавления эфиров
- Эфиры не могут образовывать водородные связи внутри себя из -за отсутствия водорода (с подключенными к O, n или F.
 не могут образовывать водородные связи внутри себя из -за отсутствия водорода (подключен к O, n или F). .
не могут образовывать водородные связи внутри себя из -за отсутствия водорода (подключен к O, n или F). . - Сложные эфиры имеют более низкие температуры кипения и плавления, чем спирты и карбоновые кислоты.
Таблица : сравнение температур кипения соединений одинаковой массы в различных функциональных группах.
- Сложные эфиры имеют постоянные диполи из-за присутствия электроотрицательных атомов кислорода. Молекулы сложного эфира также притягиваются дисперсионными силами.
- Сложные эфиры обладают более сильными межмолекулярными силами, более высокими температурами кипения и плавления, чем неполярные углеводороды, т.е. алканы, алкены и алкины.
- У сложных эфиров диполь-дипольные взаимодействия несколько слабее, чем у альдегидов аналогичной молекулярной массы, потому что карбонильная группа всегда расположена на конце углеродной цепи в альдегидах. Однако эта разница невелика, поэтому разница в температуре кипения и плавления между альдегидом и сложным эфиром невелика.

Растворимость сложных эфиров в воде
- Сложные эфиры могут принимать водородные связи от молекул воды.
- Это позволяет им быть растворимыми в воде.
- По мере увеличения молекулярной массы сложных эфиров они становятся более неполярными, а величина их постоянного диполя уменьшается.
- Сложные эфиры становятся менее растворимыми в воде по мере увеличения их размера. Как правило, только небольшие сложные эфиры растворимы в воде при 25ºC.
- Сложные эфиры менее растворимы в воде, чем альдегиды и кетоны аналогичной молекулярной массы. Это связано с тем, что альдегиды и кетоны образуют более сильные диполь-дипольные силы в дополнение к их водородным связям.
- В целом, сложные эфиры менее растворимы, чем спирты и карбоновые кислоты аналогичной молекулярной массы. Это связано с тем, что сложные эфиры могут принимать водородные связи только от воды с использованием неподеленных электронных пар кислорода, тогда как спирты и карбоновые кислоты могут отдавать и принимать водородные связи.


 Это пластичные вещества, которые легко размягчаются в руках. Основным компонентом пчелиного воска является мирицилпальмитат С15Н31СООС31Н63, а китайский — цериловый эфир церотиновой кислоты С25Н51СООС26Н53. Они не растворяются в воде, но растворимы в хлороформе и бензоле.
Это пластичные вещества, которые легко размягчаются в руках. Основным компонентом пчелиного воска является мирицилпальмитат С15Н31СООС31Н63, а китайский — цериловый эфир церотиновой кислоты С25Н51СООС26Н53. Они не растворяются в воде, но растворимы в хлороформе и бензоле. Это называется этерификацией .
Это называется этерификацией .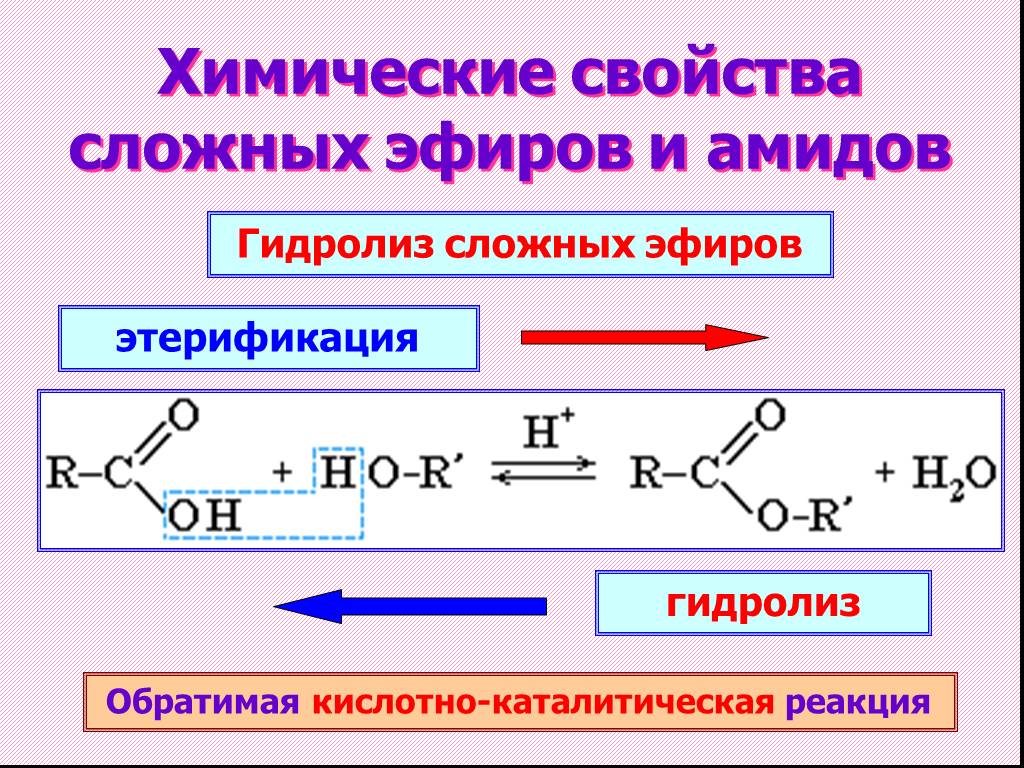 не могут образовывать водородные связи внутри себя из -за отсутствия водорода (подключен к O, n или F). .
не могут образовывать водородные связи внутри себя из -за отсутствия водорода (подключен к O, n или F). .
