СЛОЖНЫЕ ЭФИРЫ. Группа органических соединений представляющих собой эфиры спиртов
Х и м и я
Органическая химия
Спирты.
Спирты – это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами (ОН).
Так метиловый спирт СН3-ОН представляет собой гидроксильное производное метана СН4, этиловый спирт С2Н5-ОН – производное этана.
Название спиртов образуется добавлением окончания «-ол» к названию соответствующего углеводорода (метанол, этанол и т.д)
| Метанол | СН3-ОН | СН4- метан |
| Этанол | С2Н5-ОН | С2Н6 - этан |
| Пропанол | С3Н7-ОН | С3Н8 - пропан |
| Бутанол | С4Н9-ОН | С4Н10 - бутан |
Производные ароматических углеводородов с группой ОН в бензольном ядре называются фенолами.
Свойства спиртов.
Подобно молекулам воды, молекулы низших спиртов связываются между собой водородными связями. По этой причине температура кипения спиртов выше, чем температура кипения соответствующих углеводородов.
Общим свойством спиртов и фенолов является подвижность водорода гидроксильной группы. При действии на спирт щелочного метала этот водород вытесняется металом и получаются твёрдые, растворимые в спирте соединения, называемые алкоголятами.
Спирты взаимодействуют с кислотами, образуя сложные эфиры.
Спирты значительно легче окисляются, чем соответствующие углеводороды. При этом образуются альдегиды и кетоны.
Спирты практически не являются электролитами, т.е. не прводят электрический ток.
Метиловый спирт.
Метиловый спирт (метанол) СН3ОН – бесцветная жидкость. Весьма ядовит: приём небольших его доз вутрь вызывает слепоту, а больших – смерть.
Метиловый спирт получают в больших количествах синтезом из окиси углерода и водорода при высоком давлении (200-300 атм.) и высокой температуре (400 град С) в присутствии катализатора.
Метиловый спирт образуется при сухой перегонке дерева; поэтому его также называют древесным спиртом.
Он применяется как растворитель, а также для получения других органических веществ.
Этиловый спирт.
Этиловый спирт (этанол) С2Н5ОН – одно из важнейших исходных веществ в современной промышленности органического синтеза.
Для получения его издавна пользуются различными сахаристыми веществами, которые путём брожения превращаются в этиловый спирт. Брожение вызывается действием ферментов (энзимов), вырабатываемых дрожжевыми грибками.
В качестве сахаристых веществ используют виноградный сахар или глюкозу :
Глюкоза в свободном виде содержится, например, в виноградном соке, при брожении которого получается виноградное вино с содержанием спирта от 8 до 16%.
Исходным продуктом для получения спирта может служить полисахарид крахмалл, cодержащийся, например в клубнях картофеля, зерна ржи, пшеницы, кукурузы. Для превращения в сахаристые вещества (глюкозу) крахмал предварительно подвергают гидролизу.
В настоящее время осахариванию подвергается также другой полисахарид – целюлозу (клетчатку), образующую главную массу древесины. Целюлозу (например, древесные опилки) также предварительно подвергают гидролизу в присутствии кислот. Полученный таким образом продукт также содержит глюкозу и сбраживается на спирт при помощи дрожжей.
Наконец, этиловый спирт может быть получен синтетическим путём из этилена. Суммарная реакция заключается в присоединении воды к этилену.
Реакция протекает в присутствии катализаторов.
Многоатомные спирты.
До сих пор мы рассматривали спирты с одной гидроксильной группой (ОН). Такие спирты называются алкоголями.
Но также известны спирты, молекулы которых содержат несколько гидроксильных групп. Такие спирты называются многоатомными.
Примерами таких спиртов могут служить двухатомный спирт этиленгликоль и трёхатомный спирт глицерин:
Этиленгликоль и глицерин – жидкости сладковатого вкуса, смешивающиеся с водой в любых соотношениях.
Использование многоатомных спиртов.
Этиленгликоль применяется в качестве составной части, так называемых антифризов, т.е. веществ с низкой температурой замерзания, заменяющих воду в радиаторах автомобильных и авиационных моторов в зимнее время.
Также, этиленгликоль используют в производстве целлофана, полиуретанов и ряда других полимеров, как растворитель красящих веществ, в органическом синтезе.
Область применения глицерина разнообразна: пищевая промышленность, табачное производство, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника.
Глицерин относится к группе стабилизаторов. При этом, он обладает свойствами сохранять и увеличивать степень вязкости различных продуктов, и таким образом менять их консистенцию. Зарегистрирован как пищевая добавка Е422, и используется в качестве эмульгатора, при помощи которого смешиваются различные несмешиваемые смеси.
xn----7sbb4aandjwsmn3a8g6b.xn--p1ai
СПИРТЫ | Энциклопедия Кругосвет
Содержание статьиСПИРТЫ (алкоголи) – класс органических соединений, содержащих одну или несколько группировок С–ОН, при этом гидроксильная группа ОН связана с алифатическим атомом углерода (соединения, у которых атом углерода в группировке С–ОН входит в состав ароматического ядра, называются фенолами)
Классификация спиртов разнообразна и зависит от того, какой признак строения взят за основу.
1. В зависимости от количества гидроксильных групп в молекуле спирты делят на:
а) одноатомные (содержат одну гидроксильную ОН-группу), например, метанол СН3ОН, этанол С2Н5ОН, пропанол С3Н7ОН
б) многоатомные (две и более гидроксильных групп), например, этиленгликоль
HO–Сh3–Ch3–OH, глицерин HO–Сh3–СН(ОН)–Ch3–OH, пентаэритрит С(СН2ОН)4.
Соединения, в которых у одного атома углерода есть две гидроксильных группы, в большинстве случаев нестабильны и легко превращаются в альдегиды, отщепляя при этом воду: RCH(OH)2® RCH=O + h3O
Спирты, содержащие три группы ОН у одного атома углерода , не существуют.
2. По типу атома углерода, с которым связана группа ОН, спирты делят на:
а) первичные, у которых ОН-группа связана с первичным атомом углерода. Первичным называют атом углерода (выделен красным цветом), связанный всего с одним углеродным атомом. Примеры первичных спиртов – этанол Сh4–Ch3–OH, пропанол Сh4–Ch3–Ch3–OH.
б) вторичные, у которых ОН-группа связана с вторичным атомом углерода. Вторичный атом углерода (выделен синим цветом) связан одновременно с двумя атомами углерода, например, вторичный пропанол, вторичный бутанол (рис. 1).
Рис. 1. СТРОЕНИЕ ВТОРИЧНЫХ СПИРТОВ
в) третичные, у которых ОН-группа связана с третичным атомом углерода. Третичный углеродный атом (выделен зеленым цветом) связан одновременно с тремя соседними атомами углерода, например, третичный бутанол и пентанол (рис. 2).
Рис. 2. СТРОЕНИЕ ТРЕТИЧНЫХ СПИРТОВ
В соответствии с типом углеродного атома присоединенную к нему спиртовую группу также называют первичной, вторичной или третичной.
У многоатомных спиртов, содержащих две или более ОН-групп, могут присутствовать одновременно как первичные, так и вторичные НО-группы, например, в глицерине или ксилите (рис. 3).
Рис. 3. СОЧЕТАНИЕ В СТРУКТУРЕ МНОГОАТОМНЫХ СПИРТОВ ПЕРВИЧНЫХ И ВТОРИЧНЫХ ОН-ГРУПП.
3. По строению органических групп, связанных ОН-группой, спирты подразделяют на предельные (метанол, этанол, пропанол), непредельные, например, аллиловый спирт СН2=СН–СН2–ОН, ароматические (например, бензиловый спирт С6Н5СН2ОН), содержащие в составе группы R ароматическую группу.
Непредельные спирты, у которых ОН-группа «примыкает» к двойной связи, т.е. связана с атомом углерода, участвующим одновременно в образовании двойной связи (например, виниловый спирт СН2=СН–ОН), крайне нестабильны и сразу же изомеризуются (см. ИЗОМЕРИЗАЦИЯ) в альдегиды или кетоны:
Ch3=CH–OH ® Ch4–CH=O
Номенклатура спиртов.
Для распространенных спиртов, имеющих простое строение, используют упрощенную номенклатуру: название органической группы преобразуют в прилагательное (с помощью суффикса и окончания «овый») и добавляют слово «спирт»:
| СН3ОН | метиловый спирт |
| С2Н5ОН | этиловый спирт |
| (Н3С)2СНОН | изопропиловый спирт |
| С4Н9ОН | бутиловый спирт |
В том случае, когда строение органической группы более сложное, используют общие для всей органической химии правила. Названия, составленные по таким правилам, называют систематическими. В соответствии с этими правилами, углеводородную цепь нумеруют с того конца, к которому ближе расположена ОН-группа. Далее используют эту нумерацию, чтобы указать положение различных заместителей вдоль основной цепи, в конце названия добавляют суффикс «ол» и цифру, указывающую положение ОН-группы (рис. 4):
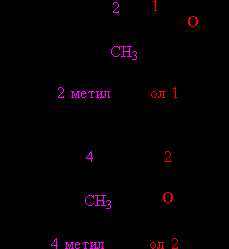
Рис. 4. СИСТЕМАТИЧЕСКИЕ НАЗВАНИЯ СПИРТОВ. Функциональные (ОН) и замещающие (СН3) группы, а также соответствующие им цифровые индексы выделены различающимися цветами.
Систематические названия простейших спиртов составляют по тем же правилам: метанол, этанол, бутанол. Для некоторых спиртов сохранились тривиальные (упрощенные) названия, сложившиеся исторически: пропаргиловый спирт НСєС–СН2–ОН, глицерин HO–Сh3–СН(ОН)–Ch3–OH, пентаэритрит С(СН2ОН)4, фенетиловый спирт С6Н5–Ch3–Ch3–OH.
Физические свойства спиртов.
Спирты растворимы в большинстве органических растворителей, первые три простейших представителя – метанол, этанол и пропанол, а также третичный бутанол (Н3С)3СОН – смешиваются с водой в любых соотношениях. При увеличении количества атомов С в органической группе начинает сказываться гидрофобный (водоотталкивающий) эффект, растворимость в воде становится ограниченной, а при R, содержащем свыше 9 атомов углерода, практически исчезает.
Благодаря наличию ОН-групп между молекулами спиртов возникают водородные связи.
Рис. 5. ВОДОРОДНЫЕ СВЯЗИ В СПИРТАХ (показаны пунктиром)
В результате у всех спиртов более высокая температура кипения, чем у соответствующих углеводородов, например, Т. кип. этанола +78° С, а Т. кип. этана –88,63° С; Т. кип. бутанола и бутана соответственно +117,4° С и –0,5° С.
Химические свойства спиртов.
Спирты отличаются разнообразными превращениями. Реакции спиртов имеют некоторые общие закономерности: реакционная способность первичных одноатомных спиртов выше, чем вторичных, в свою очередь, вторичные спирты химически более активны, чем третичные. Для двухатомных спиртов, в том случае, когда ОН-группы находятся у соседних атомов углерода, наблюдается повышенная (в сравнении с одноатомными спиртами) реакционная способность из-за взаимного влияния этих групп. Для спиртов возможны реакции, проходящие с разрывом как С–О, так и О–Н – связей.
1. Реакции, протекающие по связи О–Н.
При взаимодействии с активными металлами (Na, K, Mg, Al) спирты проявляют свойства слабых кислот и образуют соли, называемые алкоголятами или алкоксидами:
2Ch4OH + 2Na ® 2Ch4OK + h3
Алкоголяты химически не стабильны и при действии воды гидролизуются с образованием спирта и гидроксида металла:
C2H5OК + h3O ® C2H5OH + КOH
Эта реакция показывает, что спирты в сравнении с водой представляют собой более слабые кислоты (сильная кислота вытесняет слабую), кроме того, при взаимодействии с растворами щелочей спирты не образуют алкоголяты. Тем не менее, в многоатомных спиртах (в том случае, когда ОН-группы присоединены к соседним атомам С) кислотность спиртовых групп намного выше, и они могут образовывать алкоголяты не только при взаимодействии с металлами, но и со щелочами:
HO–Ch3–Ch3–OH + 2NaOH ® NaO–Ch3–Ch3–ONa + 2h3O
Когда в многоатомных спиртах НО-группы присоединены к не соседствующим атомам С, свойства спиртов близки к одноатомным, поскольку взаимовлияние НО-групп не проявляется.
При взаимодействии с минеральными или органическими кислотами спирты образуют сложные эфиры – соединения, содержащие фрагмент R–O–A (А – остаток кислоты). Образование сложных эфиров происходит и при взаимодействии спиртов с ангидридами и хлорангидридами карбоновых кислот (рис. 6).
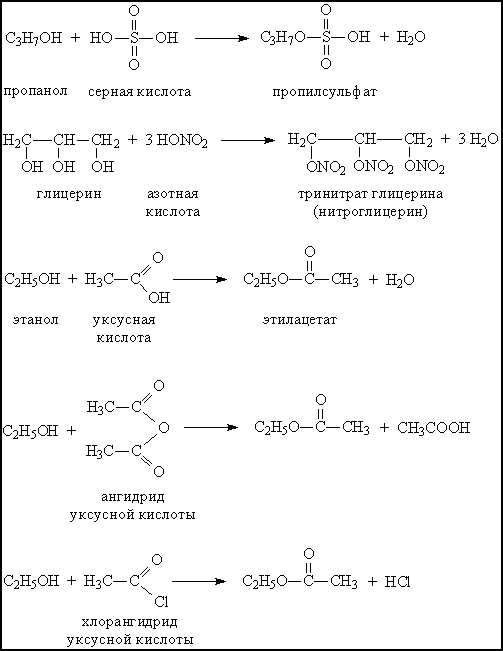
При действии окислителей (К2Cr2O7, KMnO4) первичные спирты образуют альдегиды, а вторичные – кетоны (рис.7)

Рис. 7. ОБРАЗОВАНИЕ АЛЬДЕГИДОВ И КЕТОНОВ ПРИ ОКИСЛЕНИИ СПИРТОВ
Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С, что молекула исходного спирта (рис.8).
Рис. 8. ВОССТАНОВЛЕНИЕ БУТАНОЛА
2. Реакции, протекающие по связи С–О.
В присутствии катализаторов или сильных минеральных кислот происходит дегидратация спиртов (отщепление воды), при этом реакция может идти в двух направлениях:
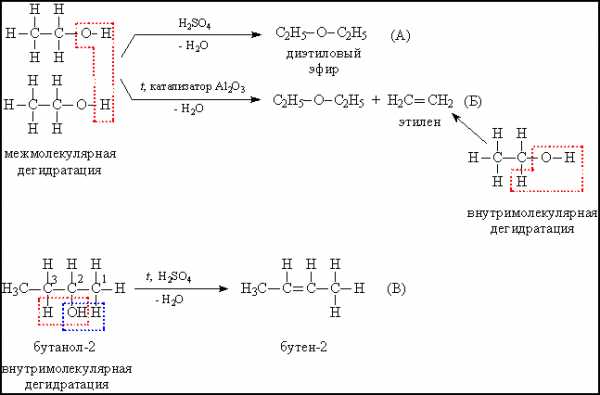
а) межмолекулярная дегидратация с участием двух молекул спирта, при этом связи С–О у одной из молекул разрываются, в результате образуются простые эфиры – соединения, содержащие фрагмент R–О–R (рис. 9А).
б) при внутримолекулярной дегидратации образуются алкены - углеводороды с двойной связью. Часто оба процесса – образование простого эфира и алкена – протекают параллельно (рис. 9Б).
В случае вторичных спиртов при образовании алкена возможны два направления реакции (рис. 9В), преимущественное направление то, при котором в процессе конденсации отщепляется водород от наименее гидрогенизированного атома углерода (отмечен цифрой 3), т.е. окруженного меньшим количеством атомов водорода (в сравнении с атомом 1). Показанные на рис. 10 реакции используют для получения алкенов и простых эфиров.
Разрыв связи С–О в спиртах происходит также при замещении ОН-группы галогеном, или аминогруппой (рис. 10).

Рис. 10. ЗАМЕНА ОН-ГРУППЫ В СПИРТАХ ГАЛОГЕНОМ ИЛИ АМИНОГРУППОЙ
Реакции, показанные на рис. 10, используют для получения галогенуглеводородов и аминов.
Получение спиртов.
Некоторые из показанных выше реакций (рис. 6,9,10) обратимы и при изменении условий могут протекать в противоположном направлении, приводя к получению спиртов, например при гидролизе сложных эфиров и галогенуглеводородов (рис.11А и Б, соответственно), а также гидратацией алкенов – присоединением воды (рис.11В).
Рис. 11. ПОЛУЧЕНИЕ СПИРТОВ ГИДРОЛИЗОМ И ГИДРАТАЦИЕЙ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Реакция гидролиза алкенов (рис. 11, схема В) лежит в основе промышленного производства низших спиртов, содержащих до 4 атомов С.
Этанол образуется и при так называемом спиртовом брожении сахаров, например, глюкозы С6Н12О6. Процесс протекает в присутствии дрожжевых грибков и приводит к образованию этанола и СО2:
С6Н12О6® 2С2Н5ОН + 2СО2
Брожением можно получить не более чем 15%-ный водный раствор спирта, поскольку при более высокой концентрации спирта дрожжевые грибки погибают. Растворы спирта более высокой концентрации получают перегонкой.
Метанол получают в промышленности восстановлением монооксида углерода при 400° С под давлением 20–30 МПа в присутствии катализатора, состоящего из оксидов меди, хрома, и алюминия:
СО + 2 Н2® Н3СОН
Если вместо гидролиза алкенов (рис. 11) проводить окисление, то образуются двухатомные спирты (рис. 12)
Рис. 12. ПОЛУЧЕНИЕ ДВУХАТОМНЫХ СПИРТОВ
Применение спиртов.
Способность спиртов участвовать в разнообразных химических реакциях позволяет их использовать для получения всевозможных органических соединений: альдегидов, кетонов, карбоновых кислот простых и сложных эфиров, применяемых в качестве органических растворителей, при производстве полимеров, красителей и лекарственных препаратов.
Метанол СН3ОН используют как растворитель, а также в производстве формальдегида, применяемого для получения фенолформальдегидных смол, в последнее время метанол рассматривают как перспективное моторное топливо. Большие объемы метанола используют при добыче и транспорте природного газа. Метанол – наиболее токсичное соединение среди всех спиртов, смертельная доза при приеме внутрь – 100 мл.
Этанол С2Н5ОН – исходное соединение для получения ацетальдегида, уксусной кислоты, а также для производства сложных эфиров карбоновых кислот, используемых в качестве растворителей. Кроме того, этанол – основной компонент всех спиртных напитков, его широко применяют и в медицине как дезинфицирующее средство.
Бутанол используют как растворитель жиров и смол, кроме того, он служит сырьем для получения душистых веществ (бутилацетата, бутилсалицилата и др.). В шампунях он используется как компонент, повышающий прозрачность растворов.
Бензиловый спирт С6Н5–Ch3–OH в свободном состоянии (и в виде сложных эфиров) содержится в эфирных маслах жасмина и гиацинта. Он обладает антисептическими (обеззараживающими) свойствами, в косметике он используется как консервант кремов, лосьонов, зубных эликсиров, а в парфюмерии - как душистое вещество.
Фенетиловый спирт С6Н5–Ch3–Ch3–OH обладает запахом розы, содержится в розовом масле, его используют в парфюмерии.
Этиленгликоль HOCh3–Ch3OH используют в производстве пластмасс и как антифриз (добавка, снижающая температуру замерзания водных растворов), кроме того, при изготовлении текстильных и типографских красок.
Диэтиленгликоль HOCh3–Ch3OCh3–Ch3OH используют для заполнения тормозных гидравлических приспособлений, а также в текстильной промышленности при отделке и крашении тканей.
Глицерин HOCh3–CH(OH)–Ch3OH применяют для получения полиэфирных глифталевых смол, кроме того, он является компонентом многих косметических препаратов. Нитроглицерин (рис. 6) – основной компонент динамита, применяемого в горном деле и железнодорожном строительстве в качестве взрывчатого вещества.
Пентаэритрит (HOCh3)4С применяют для получения полиэфиров (пентафталевые смолы), в качестве отвердителя синтетических смол, как пластификатор поливинилхлорида, а также в производстве взрывчатого вещества тетранитропентаэритрита.
Многоатомные спирты ксилит НОСН2–(СНОH)3–CН2ОН и сорбит НОСН2– (СНОН)4–СН2OН имеют сладкий вкус, их используют вместо сахара в производстве кондитерских изделий для больных диабетом и людей страдающих от ожирения. Сорбит содержится в ягодах рябины и вишни.
Михаил Левицкий
www.krugosvet.ru
Тема №21 «Характерные свойства предельных спиртов»
Оглавление
- Электронное строение функциональных групп кислородсодержащих органических веществ (КОВ)
- Предельные одноатомные и многоатомные спирты
- Изомерия и номенклатура спиртов
- Физические свойства спиртов
- Химические свойства спиртов
- Отдельные представители спиртов и их значение
- Шпаргалка
- Задания для самопроверки
Электронное строение функциональных групп кислородсодержащих органических веществ (КОВ)
Прежде чем приступить к изучению спиртов необходимо разобраться с природой -OH группы и ее влияние на соседние атомы.
Функциональными группами называются группы атомов, которые обуславливают характерные химические свойства данного класса веществ.
Строение молекул спиртов R—OH. Атом кислорода, входящий в гидроксильную группу молекул спиртов, резко отличается от атомов водорода и углерода по способности притягивать и удерживать электронные пары. В молекулах спиртов имеются полярные связи C—O и O—H.
Учитывая полярность связи O—H и значительный положительный заряд на атоме водорода, говорят, что водород гидроксильной группы имеет «кислотный» характер. Этим он резко отличается от атомов водорода, входящих в углеводородный радикал. Атом кислорода гидроксильной группы имеет частичный отрицательный заряд и две неподеленные электронные пары, что дает возможность молекулам спирта образовывать водородные связи.
По химическим свойствам фенолы отличаются от спиртов, что вызвано взаимным влиянием в молекуле фенола гидроксильной группы и бензольного ядра (фенил — C6H5). Это влияние сводится к тому, что π-электроны бензольного ядра частично вовлекают в свою сферу неподеленные электронные пары атома кислорода гидроксильной группы, в результате чего уменьшается электронная плотность у атома кислорода. Это снижение компенсируется за счет большей поляризации связи О—Н, что в свою очередь приводит к увеличению положительного заряда на атоме водорода:
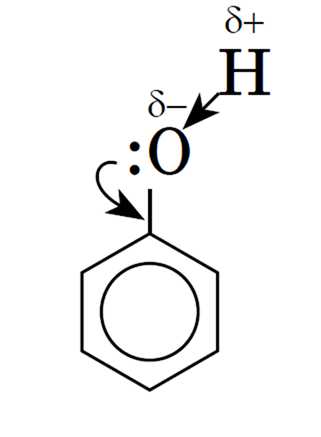
Следовательно, водород гидроксильной группы в молекуле фенола имеет кислотный характер.
Влияние атомов в молекулах фенола и его производных взаимно. Гидроксильная группа оказывает влияние на плотность π-электронного облака в бензольном кольце. Она понижается у атома углерода, связанного с ОН-группой (т. е. у 1-го и 3-го атомов углерода, метаположение) и повышается у соседних атомов углерода — 2, 4, 6-го — орто— и пара-положения.
Водородные атомы бензола в орто- и параположениях становятся более подвижными и легко замещаются на другие атомы и радикалы.
Альдегиды имеют общую формулу 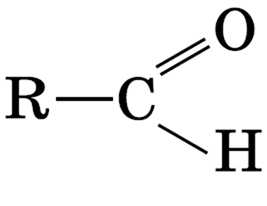 , где карбонильная группа
, где карбонильная группа
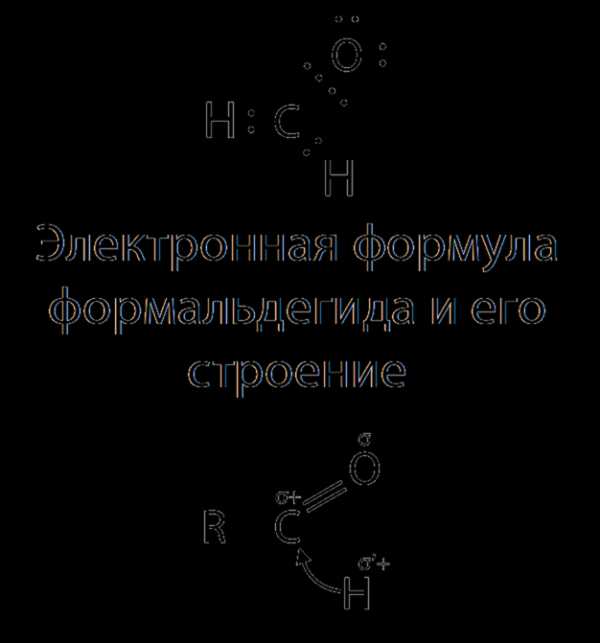
Атом углерода в карбонильной группе sр3-гибридизорован. Атомы, непосредственно с ним связанные, находятся в одной плоскости. Вследствие большой электроотрицательности атома кислорода по сравнению с углеродным атомом связь C=O сильно поляризована за счет смещения электронной плотности π-связи к кислороду:
Под влиянием карбонильного атома углерода в альдегидах увеличивается полярность связи C—H, что повышает реакционноспособность этого атома H.
Карбоновые кислоты содержат функциональноную группу
, называемую карбоксильной группой, или карбоксилом. Так она названа потому, что состоит из карбонильной группы
и гидроксильной —OH.
В карбоновых кислотах гидроксильная группа связана с углеводородным радикалом и карбонильной группой. Ослабление связи между кислородом и водородом в гидроксильной группе объясняется разностью электроотрицательностей атомов углерода, кислорода и водорода. Атом углерода приобретает некоторый положительный заряд. Этот атом углерода притягивает к себе электронное облако от атома кислорода гидроксильной группы. Компенсируя смещенную электронную плотность, атом кислорода гидроксильной группы оттягивает к себе электронное облако соседнего атома водорода. Связь O—H в гидроксильной группе становится более полярной, и атом водорода приобретает большую подвижность.


Предельные одноатомные и многоатомные спирты
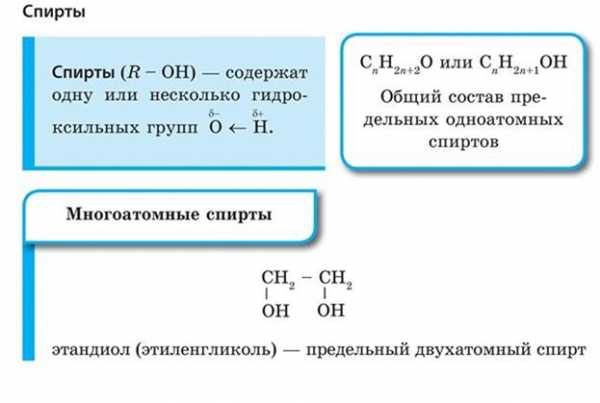
Спиртами (или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп —ОН), соединенных с углеводородным радикалом.
По числу гидроксильных групп (атомности) спирты делятся на:
· Одноатомные, например:
· Двухатомные (гликоли), например:
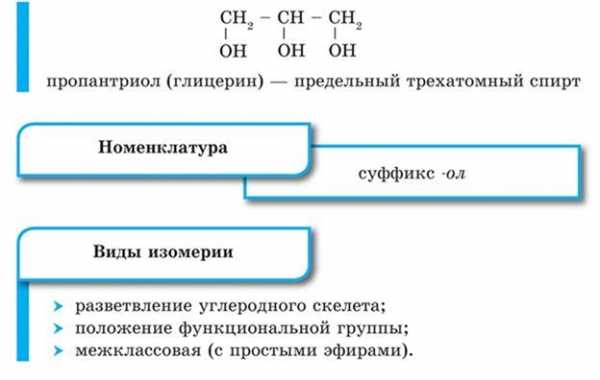
· Трехатомные, например:
По характеру углеводородного радикала выделяют следующие спирты:
· Предельные, содержащие в молекуле лишь предельные углеводородные радикалы, например:
· Непредельные, содержащие в молекуле кратные (двойные и тройные) связи между атомами углерода, например:
· Ароматические, т. е. спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, связанные друг с другом не непосредственно, а через атомы углерода, например:
Органические вещества, содержащие в молекуле гидроксильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений — фенолы. Например:
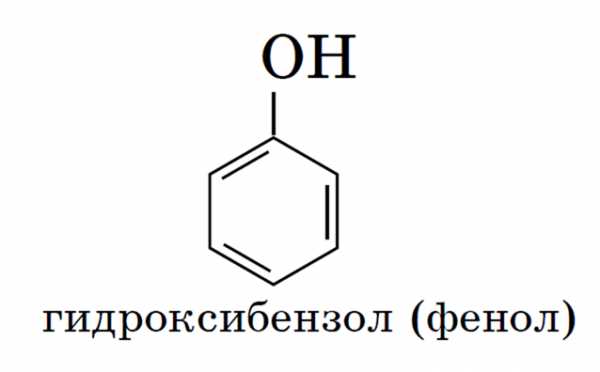
Существуют и полиатомные (многоатомные) спирты, содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексанол (сорбит):
Изомерия и номенклатура спиртов
При образовании названий спиртов к названию углеводорода, соответствующего спирту, добавляют (родовой) суффикс -ол. Цифрами после суффикса указывают положение гидроксильной группы в главной цепи, а префиксами ди-, три-, тетра- и т. д. — их число:
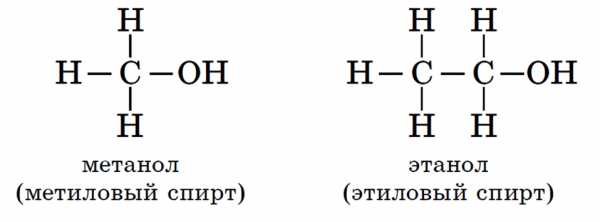
В нумерации атомов углерода в главной цепи положение гидроксильной группы приоритетно перед положением кратных связей:
Начиная с третьего члена гомологического ряда, у спиртов появляется изомерия положения функциональной группы (пропанол-1 и пропанол-2), а с четвертого — изомерия углеродного скелета (бутанол-1, 2-метилпропанол-1). Для них характерна и межклассовая изомерия — спирты изомерны простым эфирам:
Физические свойства спиртов
Спирты могут образовывать водородные связи как между молекулами спирта, так и между молекулами спирта и воды.

Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы. Именно благодаря водородным связям между молекулами спирты имеют аномально высокие для своей молекулярной массы температуры кипения. Так, пропан с относительной молекулярной массой 44 при обычных условиях является газом, а простейший из спиртов — метанол, имея относительную молекулярную массу 32, в обычных условиях — жидкость.

Химические свойства спиртов
Свойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в себя углеводородные и гидроксильные радикалы, поэтому химические свойства спиртов определяются взаимодействием и влиянием друг на друга этих групп.
Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы.
1. Взаимодействие спиртов со щелочными и щелочноземельными металлами. Для выявления влияния углеводородного радикала на гидроксильную группу необходимо сравнить свойства вещества, содержащего гидроксильную группу и углеводородный радикал, с одной стороны, и вещества, содержащего гидроксильную группу и не содержащего углеводородный радикал, — с другой. Такими веществами могут быть, например, этанол (или другой спирт) и вода. Водород гидроксильной группы молекул спиртов и молекул воды способен восстанавливаться щелочными и щелочноземельными металлами (замещаться на них):
2. Взаимодействие спиртов с галогеноводородами. Замещение гидроксильной группы на галоген приводит к образованию галогеналканов. Например:
Данная реакция обратима.
3. Межмолекулярная дегидратация спиртов — отщепление молекулы воды от двух молекул спирта при нагревании в присутствии водоотнимающих средств:
В результате межмолекулярной дегидратации спиртов образуются простые эфиры. Так, при нагревании этилового спирта с серной кислотой до температуры от 100 до 140 °С образуется диэтиловый (серный) эфир.
4. Взаимодействие спиртов с органическими и неорганическими кислотами с образованием сложных эфиров (реакция этерификации):
Реакция этерификации катализируется сильными неорганическими кислотами.
Например, при взаимодействии этилового спирта и уксусной кислоты образуется уксусноэтиловый эфир — этилацетат:
5. Внутримолекулярная дегидратация спиртов происходит при нагревании спиртов в присутствии водоотнимающих средств до более высокой температуры, чем температура межмолекулярной дегидратации. В результате образуются алкены. Эта реакция обусловлена наличием атома водорода и гидроксильной группы при соседних атомах углерода. В качестве примера можно привести реакцию получения этена (этилена) при нагревании этанола выше 140 °С в присутствии концентрированной серной кислоты:
6. Окисление спиртов обычно проводят сильными окислителями, например, дихроматом калия или перманганатом калия в кислой среде. При этом действие окислителя направляется на тот атом углерода, который уже связан с гидроксильной группой. В зависимости от природы спирта и условий проведения реакции могут образовываться различные продукты. Так, первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты:
При окислении вторичных спиртов образуются кетоны:
Третичные спирты достаточно устойчивы к окислению. Однако в жестких условиях (сильный окислитель, высокая температура) во
www.chem-mind.com
Спирты Википедия
Модель молекулы простейшего спирта — метанолаСпирты́ (от лат. spiritus — дух; устар. алкого́ли, от араб. الكحول аль-кухуль — порошок[1]) — органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным (находящимся в состоянии sp³-гибридизации) атомом углерода[2]. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−O−H.
В номенклатуре ИЮПАК для соединений, в которых гидроксильная группа связана с ненасыщенным (sp²-гибридным) атомом углерода, рекомендуются названия «енолы» (гидроксил связан с винильной C=C-связью)[3] и «фенолы» (гидроксил связан с бензольным или другим ароматическим циклом)[4].
Спирты представляют собой обширный и разнообразный класс соединений: они весьма распространены в природе и часто выполняют важные функции в живых организмах. Спирты являются важными соединениями с точки зрения органического синтеза, не только представляя интерес как целевые продукты, но и как промежуточные вещества, имеющие ряд уникальных химических свойств. Кроме того, спирты являются промышленно важными продуктами и находят широчайшее применение как в промышленности, так и в повседневных приложениях.
ru-wiki.ru
Ответы@Mail.Ru: Химические свойства спиртов. Пожалуйста!!!
Спирты отличаются разнообразными превращениями. Реакции спиртов имеют некоторые общие закономерности: реакционная способность первичных одноатомных спиртов выше, чем вторичных, в свою очередь, вторичные спирты химически более активны, чем третичные. Для двухатомных спиртов, в том случае, когда ОН-группы находятся у соседних атомов углерода, наблюдается повышенная (в сравнении с одноатомными спиртами) реакционная способность из-за взаимного влияния этих групп. Для спиртов возможны реакции, проходящие с разрывом как С–О, так и О–Н – связей. 1. Реакции, протекающие по связи О–Н. При взаимодействии с активными металлами (Na, K, Mg, Al) спирты проявляют свойства слабых кислот и образуют соли, называемые алкоголятами или алкоксидами: 2Ch4OH + 2Na → 2Ch4OK + h3 Алкоголяты химически не стабильны и при действии воды гидролизуются с образованием спирта и гидроксида металла: C2H5OК + h3O → C2H5OH + КOH Эта реакция показывает, что спирты в сравнении с водой представляют собой более слабые кислоты (сильная кислота вытесняет слабую) , кроме того, при взаимодействии с растворами щелочей спирты не образуют алкоголяты. Тем не менее, в многоатомных спиртах (в том случае, когда ОН-группы присоединены к соседним атомам С) кислотность спиртовых групп намного выше, и они могут образовывать алкоголяты не только при взаимодействии с металлами, но и со щелочами: HO–Ch3–Ch3–OH + 2NaOH ® NaO–Ch3–Ch3–ONa + 2h3O Когда в многоатомных спиртах НО-группы присоединены к не соседствующим атомам С, свойства спиртов близки к одноатомным, поскольку взаимовлияние НО-групп не проявляется. При взаимодействии с минеральными или органическими кислотами спирты образуют сложные эфиры – соединения, содержащие фрагмент R–O–A (А – остаток кислоты) . Образование сложных эфиров происходит и при взаимодействии спиртов с ангидридами и хлорангидридами карбоновых кислот <img src="//otvet.imgsmail.ru/download/471702be21faad01ad0f3622d1c892e5_i-1021.gif" > При действии окислителей (К2Cr2O7, KMnO4) первичные спирты образуют альдегиды, а вторичные – кетоны <img src="//otvet.imgsmail.ru/download/471702be21faad01ad0f3622d1c892e5_i-1024.gif" > 2. Реакции, протекающие по связи С–О. В присутствии катализаторов или сильных минеральных кислот происходит дегидратация спиртов (отщепление воды) , при этом реакция может идти в двух направлениях: а) межмолекулярная дегидратация с участием двух молекул спирта, при этом связи С–О у одной из молекул разраваются, в результате образуются простые эфиры – соединения, содержащие фрагмент R–О–R (рис. 9А) . б) при внутримолекулярной дегидратации образуются алкены - углеводороды с двойной связью. Часто оба процесса – образование простого эфира и алкена – протекают параллельно. В случае вторичных спиртов при образовании алкена возможны два направления реакции, преимущественное направление то, при котором в процессе конденсации отщепляется водород от наименее гидрогенизированного атома углерода (отмечен цифрой 3), т. е. окруженного меньшим количеством атомов водорода (в сравнении с атомом 1). Показанные на рис. реакции используют для получения алкенов и простых эфиров. <img src="//otvet.imgsmail.ru/download/471702be21faad01ad0f3622d1c892e5_i-1023.gif" > Разрыв связи С–О в спиртах происходит также при замещении ОН-группы галогеном, или аминогруппой (нуклеофильное замещение) . <img src="//otvet.imgsmail.ru/download/471702be21faad01ad0f3622d1c892e5_i-1025.gif" >
реагируют с щелочными и щелочноземельными металлами, с кислотами (с органическими образуют сложные эфиры) , с галогенпроизводными (алифатического и ароматического ряда образуют эфиры) Пример СН3ОН - метанол 2СН3ОН + 2К=2СН3ОК+Н2 СН3ОН+НСООН=СН3ООСН СН3ОН+ВгСН3=СН3ОСН3+НВг
touch.otvet.mail.ru
СЛОЖНЫЕ ЭФИРЫ | Энциклопедия Кругосвет
Содержание статьиСЛОЖНЫЕ ЭФИРЫ – класс соединений на основе минеральных (неорганических) или органических карбоновых кислот, у которых атом водорода в НО-группе замещен органической группой R. Прилагательное «сложные» в названии эфиров помогает отличить их от соединений, именуемых простыми эфирами.
Если исходная кислота многоосновная, то возможно образование либо полных эфиров – замещены все НО-группы, либо кислых эфиров – частичное замещение. Для одноосновных кислот возможны только полные эфиры (рис.1).

Рис. 1. ПРИМЕРЫ СЛОЖНЫХ ЭФИРОВ на основе неорганической и карбоновой кислоты
Номенклатура сложных эфиров.
Название создается следующим образом: вначале указывается группа R, присоединенная к кислоте, затем – название кислоты с суффиксом «ат» (как и в названиях неорганических солей: карбонат натрия, нитрат хрома). Примеры на рис. 2
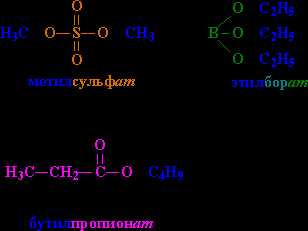
Рис. 2. НАЗВАНИЯ СЛОЖНЫХ ЭФИРОВ. Фрагменты молекул и соответствующие им фрагменты названий выделены одинаковым цветом. Сложные эфиры обычно рассматривают как продукты реакции между кислотой и спиртом, например, бутилпропионат можно воспринимать как результат взаимодействия пропионовой кислоты и бутанола.
Если используют тривиальное (см. ТРИВИАЛЬНЫЕ НАЗВАНИЯ ВЕЩЕСТВ) название исходной кислоты, то в название соединения включают слово «эфир», например, С3Н7СООС5Н11 – амиловый эфир масляной кислоты.
Классификация и состав сложных эфиров.
Среди изученных и широко применяемых сложных эфиров большинство представляют соединения, полученные на основе карбоновых кислот. Сложные эфиры на основе минеральных (неорганических) кислот не столь разнообразны, т.к. класс минеральных кислот менее многочисленен, чем карбоновых (многообразие соединений – один из отличительных признаков органической химии).
Когда число атомов С в исходных карбоновой кислоте и спирте не превышает 6–8, соответствующие сложные эфиры представляют собой бесцветные маслянистые жидкости, чаще всего с фруктовым запахом. Они составляют группу фруктовых эфиров. Если в образовании сложного эфира участвует ароматический спирт (содержащий ароматическое ядро), то такие соединения обладают, как правило, не фруктовым, а цветочным запахом. Все соединения этой группы практически нерастворимы в воде, но легко растворимы в большинстве органических растворителей. Интересны эти соединения широким спектром приятных ароматов (табл. 1), некоторые из них вначале были выделены из растений, а позже синтезированы искусственно.
| Табл. 1. НЕКОТОРЫЕ СЛОЖНЫЕ ЭФИРЫ, обладающие фруктовым или цветочным ароматом (фрагменты исходных спиртов в формуле соединения и в названии выделены жирным шрифтом) | ||
| Формула сложного эфира | Название | Аромат |
| СН3СООС4Н9 | Бутилацетат | грушевый |
| С3Н7СООСН3 | Метиловый эфир масляной кислоты | яблочный |
| С3Н7СООС2Н5 | Этиловый эфир масляной кислоты | ананасовый |
| С4Н9СООС2Н5 | Этиловый эфир изовалериановой кислоты | малиновый |
| С4Н9СООС5Н11 | Изоамиловый эфир изовалериановой кислоты | банановый |
| СН3СООСН2С6Н5 | Бензилацетат | жасминовый |
| С6Н5СООСН2С6Н5 | Бензилбензоат | цветочный |
При увеличении размеров органических групп, входящих в состав сложных эфиров, до С15–30 соединения приобретают консистенцию пластичных, легко размягчающихся веществ. Эту группу называют восками, они, как правило, не обладают запахом. Пчелиный воск содержит смесь различных сложных эфиров, один из компонентов воска, который удалось выделить и определить его состав, представляет собой мирициловый эфир пальмитиновой кислоты С15Н31СООС31Н63. Китайский воск (продукт выделения кошенили – насекомых Восточной Азии) содержит цериловый эфир церотиновой кислоты С25Н51СООС26Н53. Кроме того, воски содержат и свободные карбоновые кислоты и спирты, включающие большие органические группы. Воски не смачиваются водой, растворимы в бензине, хлороформе, бензоле.
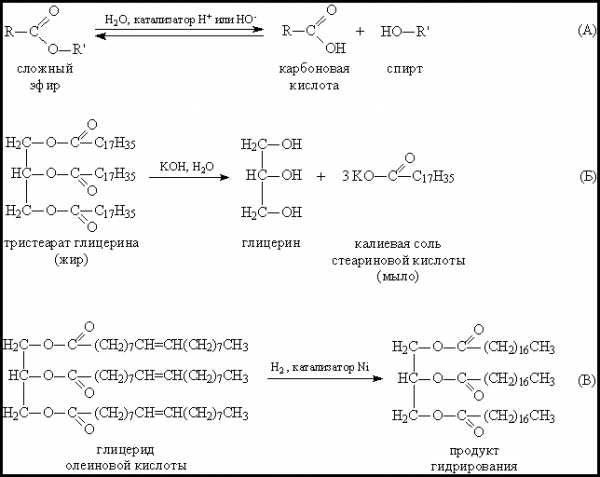
Третья группа – жиры. В отличие от предыдущих двух групп на основе одноатомных спиртов ROH, все жиры представляют собой сложные эфиры, образованные из трехатомного спирта глицерина НОСН2–СН(ОН)–СН2ОН. Карбоновые кислоты, входящие в состав жиров, как правило, имеют углеводородную цепь с 9–19 атомами углерода. Животные жиры (коровье масло, баранье, свиное сало) – пластичные легкоплавкие вещества. Растительные жиры (оливковое, хлопковое, подсолнечное масло) – вязкие жидкости. Животные жиры, в основном, состоят из смеси глицеридов стеариновой и пальмитиновой кислоты (рис. 3А,Б). Растительные масла содержат глицериды кислот с несколько меньшей длиной углеродной цепи: лауриновой С11Н23СООН и миристиновой С13Н27СООН. (как и стеариновая и пальмитиновая – это насыщенные кислоты). Такие масла могут долго храниться на воздухе, не меняя своей консистенции, и потому называются невысыхающими. В отличие от них, льняное масло содержит глицерид ненасыщенной линолевой кислоты (рис. 3В). При нанесении тонким слоем на поверхность такое масло под действием кислорода воздуха высыхает в ходе полимеризации по двойным связям, при этом образуется эластичная пленка, не растворимая в воде и органических растворителях. На основе льняного масла изготавливают натуральную олифу.

Рис. 3. ГЛИЦЕРИДЫ СТЕАРИНОВОЙ И ПАЛЬМИТИНОВОЙ КИСЛОТЫ (А И Б) – компоненты животного жира. Глицерид линолевой кислоты (В) – компонент льняного масла.
Сложные эфиры минеральных кислот (алкилсульфаты, алкилбораты, содержащие фрагменты низших спиртов С1–8) – маслянистые жидкости, эфиры высших спиртов (начиная с С9) – твердые соединения.
Химические свойства сложных эфиров.
Наиболее характерно для эфиров карбоновых кислот гидролитическое (под действием воды) расщепление сложноэфирной связи, в нейтральной среде оно протекает медленно и заметно ускоряется в присутствии кислот или оснований, т.к. ионы Н+ и НО– катализируют этот процесс (рис. 4А), причем гидроксильные ионы действуют более эффективно. Гидролиз в присутствии щелочей называют омылением. Если взять количество щелочи, достаточное для нейтрализации всей образующейся кислоты, то происходит полное омыление сложного эфира. Такой процесс проводят в промышленном масштабе, при этом получают глицерин и высшие карбоновые кислоты (С15–19) в виде солей щелочных металлов, представляющих собой мыло (рис. 4Б). Содержащиеся в растительных маслах фрагменты ненасыщенных кислот, как и любые ненасыщенные соединения, могут быть прогидрированы, водород присоединяется к двойным связям и образуются соединения, близкие к животным жирам (рис. 4В). Этим способом в промышленности получают твердые жиры на основе подсолнечного, соевого или кукурузного масла. Из продуктов гидрирования растительных масел, смешанных с природными животными жирами и различными пищевыми добавками, изготавливают маргарин.
Основной способ синтеза – взаимодействие карбоновой кислоты и спирта, катализируемое кислотой и сопровождаемое выделением воды. Эта реакция обратна показанной на рис. 3А. Чтобы процесс шел в нужном направлении (синтез сложного эфира), из реакционной смеси дистиллируют (отгоняют) воду. Специальными исследованиями с применением меченых атомов удалось установить, что в процессе синтеза атом О, входящий в состав образующейся воды, отрывается от кислоты (отмечено красной пунктирной рамкой), а не от спирта (нереализующийся вариант выделен синей пунктирной рамкой).
По такой же схеме получают сложные эфиры неорганических кислот, например, нитроглицерин (рис. 5Б). Вместо кислот можно использовать хлорангидриды кислот, метод применим как для карбоновых (рис. 5В), так и для неорганических кислот (рис. 5Г).
Взаимодействие солей карбоновых кислот с галоидалкилами RCl также приводит к сложным эфирам (рис. 5Г), реакция удобна тем, что она необратима – выделяющаяся неорганическая соль сразу удаляется из органической реакционной среды в виде осадка.
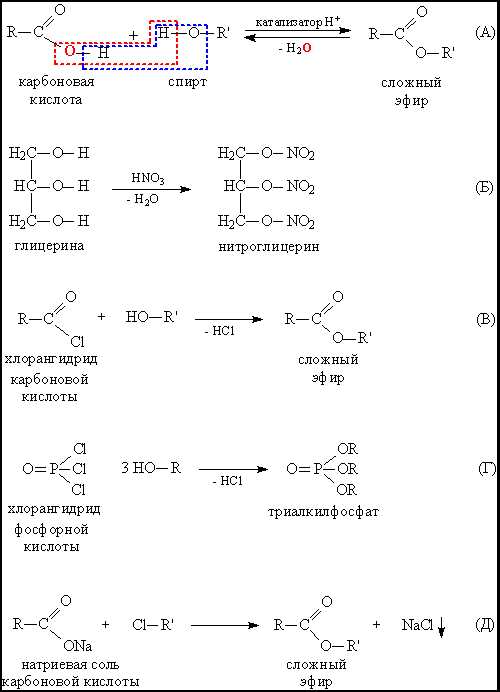
Применение сложных эфиров.
Этилформиат НСООС2Н5 и этилацетат Н3СООС2Н5 используются как растворители целлюлозных лаков (на основе нитроцеллюлозы и ацетилцеллюлозы).
Сложные эфиры на основе низших спиртов и кислот (табл. 1) используют в пищевой промышленности при создании фруктовых эссенций, а сложные эфиры на основе ароматических спиртов – в парфюмерной промышленности.
Из восков изготавливают политуры, смазки, пропиточные составы для бумаги (вощеная бумага) и кожи, они входят и в состав косметических кремов и лекарственных мазей.
Жиры вместе с углеводами и белками составляют набор необходимых для питания пищевых продуктов, они входят в состав всех растительных и животных клеток, кроме того, накапливаясь в организме, играют роль энергетического запаса. Из-за низкой теплопроводности жировой слой хорошо предохраняет животных (в особенности, морских – китов или моржей) от переохлаждения.
Животные и растительные жиры представляют собой сырье для получения высших карбоновых кислот, моющих средств и глицерина (рис. 4), используемого в косметической промышленности и как компонент различных смазок.
Нитроглицерин (рис. 4) – известный лекарственный препарат и взрывчатое вещество, основа динамита.
На основе растительных масел изготавливают олифы (рис. 3), составляющие основу масляных красок.
Эфиры серной кислоты (рис. 2) используют в органическом синтезе как алкилирующие (вводящие в соединение алкильную группу) реагенты, а эфиры фосфорной кислоты (рис. 5) – как инсектициды, а также добавки к смазочным маслам.
Михаил Левицкий
www.krugosvet.ru





















