Содержание
«Какие качественные реакции позволяют обнаружить борную кислоту в растворе? » — Яндекс Кью
Популярное
Биология
Сообщества
ХимияХимическая реакцияБорная кислота
Анонимный вопрос
Биология
·
15,7 K
На Кью задали 1 похожий вопросОтветитьУточнить
Александр Мальцев
6
Кандидат химических наук. Занимаюсь химическими источниками тока и материалами с… · 13 окт 2021
Борная кислота и ее соли в растворе вызывают гелеобразование при добавлении в раствор поливинилового спирта. Но метод работает только для больших концентраций борной кислоты, от 0.5% и выше. Например, добавить к исследуемому раствору раствор 5% поливинилового спирта. Если в растворе есть борная кислота, то или сразу, или при выпаривании в растворе образуется белый или прозрачный нерастворимый в воде гель.
А. Валерий
16 декабря 2021
Вообще-то, вероятно более наглядным способом опреления содержания бора в растворе, является реакция горение борноэт… Читать дальше
Комментировать ответ…Комментировать…
Елисей Синицын
Студент биотехнолог · 27 сент 2021
Борная кислота при взаимодействии со спиртами образует летучие борноэтиловые эфиры, которые горят зелёным пламенем. Борноэтиловый эфир образуется при смешении борной кислоты или солей этой кислоты с концентрированной серной кислотой и этиловым спиртом.
1 эксперт согласен
Комментировать ответ…Комментировать…
Tanya
8
Я работаю научным работником.
Люблю читать, писать, вышивать · 27 сент 2021
Поскольку борная кислота это довольно слабая кислота, то обнаружить ее можно путем реакции с шелочью. Например, добавив раствор гидроокиси натрия или калия.
2 эксперта не согласны
Philipp Popov
возражает
6 октября 2021
Реакция слабой кислоты со щёлочью не даёт никаких видимых эффектов и качественной быть не может. Кроме того, эта… Читать дальше
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
Ответы на похожие вопросы
Какие качественные реакции позволяют обнаружить борную кислоту в растворе? — 1 ответ, задан
Никита Шевченко
Биология
838
Биолог-генетик и ведущий подкаста «Британские учёные выяснили» и автор проекта OneScience · 18 янв ·
onesience
Можно описать несколько характерных реакций:
- Реакция борной кислоты с бензоином отлична от большинства реакций на борную кислоту, так как она протекает только в слабощелочном спиртовом растворе.
 Реакция очень чувствительна и позволяет открывать следы борной кислоты в присутствии большого числа ионов. Бензоин с бором реагирует в отношении 1 к 1
Реакция очень чувствительна и позволяет открывать следы борной кислоты в присутствии большого числа ионов. Бензоин с бором реагирует в отношении 1 к 1 - Качественной реакцией на борную кислоту и ее соли служит реакция горения борноэтилового эфира с характерной зеленой окраской пламени. Борноэтиловый эфир образуется при смешении борной кислоты или боратов с концентрированной серной кислотой и этиловым спиртом
Больше полезного в моём интересном Telegram-канале с кучей информации🦠
Перейти на t.me/onesience
Комментировать ответ…Комментировать…
О сообществе
Биология
Сообщество Кью для биологов: зоологов, ботаников, генетиков и всех, кто обладает профессиональными и экспертными знаниями и опытом в этой области. Здесь можно и нужно задавать научные и бытовые вопросы по этим темам. Не медицина!
Видеоопыты по органической химии | CHEMEGE.RU
Ниже приведены ссылки на видеоопыты по органической химии, выложенные в Единой коллекции цифровых образовательных ресурсов. Видеоопыты по основным темам органической химии позволяют лучше понять химию, лучше запомнить изучаемый материал.
Видеоопыты по основным темам органической химии позволяют лучше понять химию, лучше запомнить изучаемый материал.
1. Предельные углеводороды
— Получение метана
— Горение метана и изучение его физических свойств
— Горение жидких углеводородов
— Горение твердых углеводородов (на примере парафина)
— Установление качественного состава предельных углеводородов
— Определение содержания хлора в органических соединениях
— Отношение метана к раствору перманганата калия и бромной воде
— Взрыв метана с кислородом
2. Непредельные углеводороды
— Горение этилена
— Взаимодействие этилена с бромной водой
— Взаимодействие этилена с раствором перманганата калия
— Получение ацетилена и его горение
— Взаимодействие ацетилена с бромной водой
— Взаимодействие ацетилена с раствором перманганата калия
— Получение ацетиленида серебра
— Получение ацетиленида меди
— Горение ацетилена
— Взрыв смеси ацетилена с кислородом
— Взаимодействие ацетилена с хлором
— Непрочность ацетиленидов металлов
3. Ароматические углеводороды
Ароматические углеводороды
— Изучение физических свойств бензола
— Горение бензола
— Изучение отношения бензола к бромной воде и раствору перманганата калия
— Бромирование бензола
— Нитрование бензола
— Хлорирование бензола (получение гексахлорана)
4. Спирты. Фенолы
— Физические свойства спиртов
— Горение спиртов
— Взаимодействие этилового спирта с металлическим натрием
— Взаимодействие этилового спирта с бромоводородом
— Изучение физических свойств глицерина
— Взаимодействие глицерина с металлическим натрием
— Взаимодействие многоатомных спиртов с гидроксидом меди (II)
— Взаимодействие глицерина с перманганатом калия
— Изучение физических свойств фенола
— Взаимодействие фенола с металлическим натрием
— Взаимодействие фенола с раствором щелочи
— Взаимодействие фенола с бромной водой
— Качественная реакция на этанол
— Качественная реакция на фенол
— Окисление этилового спирта оксидом меди (II)
— Окисление этилового спирта раствором перманганата калия
— Окисление этилового спирта кристаллическим перманганатом калия
— Каталитическое окисление этанола
— Окисление этанола (тест на алкоголь)
5. Альдегиды
Альдегиды
— Качественная реакция на альдегиды с фуксинсернистой кислотой
— Качественная реакция на альдегиды с гидроксидом меди (II)
6. Карбоновые кислоты. Эфиры. Жиры
— Растворимость в воде различных карбоновых кислот
— Карбоновые кислоты — слабые электролиты
— Взаимодействие уксусной кислоты с раствором щелочи
— Взаимодействие уксусной кислоты с оксидом меди (II)
— Взаимодействие уксусной кислоты с металлами
— Взаимодействие уксусной кислоты с карбонатом натрия
— Горение уксусной кислоты на воздухе
— Замораживание уксусной кислоты (демонстрация ледяной уксусной кислоты)
— Возгонка бензойной кислоты
— Разложение муравьиной кислоты
— Взаимодействие бромной воды с олеиновой кислотой
— Получение уксусноэтилового эфира
— Получение борноэтилового эфира
— Определение непредельности жиров
— Выделение свободных жирных кислот из мыла
— Образование нерастворимых кальциевых солей жирных кислот
— Окисление муравьиной кислоты раствором перманганата калия
— Гидролиз ацетата натрия
7. Углеводы
Углеводы
— Качественная реакция глюкозы с гидроксидом меди (II)
— Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)
— Окисление глюкозы кислородом воздуха в присутствии метиленового голубого
— Определение глюкозы в виноградном соке
— Доказательство наличия гидроксильных групп в сахарозе
— Отсутствие восстанавливающей способности сахарозы
— Кислотный гидролиз сахарозы
— Реакция крахмала с йодом
— Кислотный гидролиз крахмала
— Кислотный гидролиз целлюлозы
— Получение и свойства нитроцеллюлозы
— Растворение целлюлозы в аммиачном растворе гидроксида меди (II)
8. Азотсодержащие соединения
Азотсодержащие соединения
— Изучение физических свойств анилина
— Получение диметиламина и его горение
— Получение гидроксида диметиламмония и изучение его свойств
— Взаимодействие анилина с соляной кислотой
— Окисление анилина раствором хлорной извести
— Окисление анилина раствором дихромата калия
— Бромирование анилина
— Изучение среды раствора анилина
— Образование медной соли аминоуксусной кислоты
— Свойства аминоуксусной кислоты
— Свертывание белков при нагревании
— Осаждение белков солями тяжелых металлов
— Осаждение белков спиртом
— Биуретовая реакция белков
— Ксантопротеиновая реакция на белки
— Качественное определение азота в органических соединениях
9. Высокомолекулярные соединения
Высокомолекулярные соединения
— Получение пенопласта
— Получение пластмасс на примере резорцинформальдегидной смолы
Дорогие друзья! Эту коллекцию я пополняю и буду пополнять. Присылайте ссылки на качественные видеоопыты по школьному курсу в комментариях или на почту [email protected].
Понравилось это:
Нравится Загрузка…
Диметиловый эфир | Сжигание
- Дом
- Механизмы
- Диметиловый эфир
Подробный химический кинетический механизм был разработан и проверен путем сравнения с экспериментальными результатами для стабилизированного пламени горелки, проточных реакторов, реакторов с мешалкой и ударных труб. Механизм был проверен в широком диапазоне температур, давлений и отношений эквивалентности. При сравнении предварительно смешанных ламинарных пламен численные результаты сравнивались с измеренными профилями концентрации частиц в атмосферном пламени ДМЭ-воздух при коэффициентах эквивалентности 0,67 и 1,49.. При сравнении проточных реакторов механизм был подтвержден в условиях пиролиза при температуре 1060 К, давлении 2,5 атм и коэффициенте эквивалентности, равном единице. В условиях, близких к пиролизу в проточном реакторе, механизм был проверен при температуре 1118 К и давлении 1 атм. В условиях окисления в проточном реакторе и при более низких температурах механизм был подтвержден в диапазоне температур от 580 до 852 К, диапазоне давлений от 12 до 18 атм и коэффициенте эквивалентности от 0,81 до 2,48. В условиях окисления в проточном реакторе и при более высоких температурах механизм был подтвержден в диапазоне температур 9от 44 до 1086 К, давление 1 атм и диапазон коэффициента эквивалентности от 0,3 до 3,4. В условиях реактора с мешалкой при низких температурах механизм был подтвержден в диапазоне температур от 550 до 800 К, давлении 10 атм и коэффициентах эквивалентности 0,2 и 1,0.
При сравнении предварительно смешанных ламинарных пламен численные результаты сравнивались с измеренными профилями концентрации частиц в атмосферном пламени ДМЭ-воздух при коэффициентах эквивалентности 0,67 и 1,49.. При сравнении проточных реакторов механизм был подтвержден в условиях пиролиза при температуре 1060 К, давлении 2,5 атм и коэффициенте эквивалентности, равном единице. В условиях, близких к пиролизу в проточном реакторе, механизм был проверен при температуре 1118 К и давлении 1 атм. В условиях окисления в проточном реакторе и при более низких температурах механизм был подтвержден в диапазоне температур от 580 до 852 К, диапазоне давлений от 12 до 18 атм и коэффициенте эквивалентности от 0,81 до 2,48. В условиях окисления в проточном реакторе и при более высоких температурах механизм был подтвержден в диапазоне температур 9от 44 до 1086 К, давление 1 атм и диапазон коэффициента эквивалентности от 0,3 до 3,4. В условиях реактора с мешалкой при низких температурах механизм был подтвержден в диапазоне температур от 550 до 800 К, давлении 10 атм и коэффициентах эквивалентности 0,2 и 1,0. В условиях реактора с мешалкой при высоких температурах механизм был подтвержден в диапазоне температур от 825 до 1200 К, давления 1 и 10 атм и коэффициента эквивалентности 1,0. В условиях ударной трубы при низких температурах и высоких давлениях механизм был подтвержден в диапазоне температур от 650 до 1300 К, давлений 13 и 40 атм и коэффициентов эквивалентности 1,0. В условиях ударной трубы при высоких температурах механизм был проверен в диапазоне температур от 1220 до 1600 К, давлении 3,5 бар и коэффициентах эквивалентности 0,5, 1,0 и 2,0. Согласие расчетов с экспериментом в целом хорошее. Количественные сравнения можно увидеть в ссылках ниже.
В условиях реактора с мешалкой при высоких температурах механизм был подтвержден в диапазоне температур от 825 до 1200 К, давления 1 и 10 атм и коэффициента эквивалентности 1,0. В условиях ударной трубы при низких температурах и высоких давлениях механизм был подтвержден в диапазоне температур от 650 до 1300 К, давлений 13 и 40 атм и коэффициентов эквивалентности 1,0. В условиях ударной трубы при высоких температурах механизм был проверен в диапазоне температур от 1220 до 1600 К, давлении 3,5 бар и коэффициентах эквивалентности 0,5, 1,0 и 2,0. Согласие расчетов с экспериментом в целом хорошее. Количественные сравнения можно увидеть в ссылках ниже.
Скачать файлы (формат CHEMKIN):
- Термодинамический параметр
- Химический кинетический механизм
- Параметры транспорта
Ссылки
Fischer, S.L., F.L. Dryer, and H.J. Curran, «Кинетика реакции диметилового эфира. I: Высокотемпературный пиролиз и окисление в проточных реакторах», Int. Дж. Хим. Кинет. 32 : 713–740, 2000. Ливерморская национальная лаборатория Лоуренса, Ливермор, Калифорния, UCRL-JC-239461 . (Здесь приведены ссылки на скорость реакции).
Дж. Хим. Кинет. 32 : 713–740, 2000. Ливерморская национальная лаборатория Лоуренса, Ливермор, Калифорния, UCRL-JC-239461 . (Здесь приведены ссылки на скорость реакции).
Карран, Х. Дж., Фишер С. Л. и Драйер Ф. Л., «Кинетика реакции диметилового эфира. II: низкотемпературный пиролиз и окисление в проточных реакторах», Int. Дж. Хим. Кинет. 32 : 741–759, 2000. Ливерморская национальная лаборатория Лоуренса, Ливермор, Калифорния, UCRL-JC-239496 .
Кайзер, Э. У., Т. Дж. Уоллингтон, М. Д. Херли, Дж. Платц, Х. Дж. Карран, У. Дж. Питц и С. К. Вестбрук, «Экспериментальное и модельное исследование предварительно смешанного пламени диметилового эфира атмосферного давления и воздуха», Journal of Physical Chemistry A 104 , № 35, 8194-8206 (2000), Ливерморская национальная лаборатория Лоуренса, Ливермор, Калифорния, UCRL-JC-136123 .
Образование диэтилового эфира при взаимодействии йодэтана с атомарным кислородом на поверхности Ag(110)
Образование диэтилового эфира при взаимодействии иодэтана с атомарным кислородом на поверхности Ag(110)
- Джонс, Г. Скотт
- Барто, Марк А.
- Вос, Джон М.
;
;
Аннотация
Реакции йодэтана (ICH 2 CH 3 ) на чистых и покрытых кислородом поверхностях Ag(110) исследовали с помощью температурно-программируемой десорбции (TPD) и спектроскопии потерь энергии электронов высокого разрешения (HREELS). Йодоэтан диссоциативно адсорбируется при 150 К с образованием поверхностных этильных групп как на чистых, так и на покрытых кислородом поверхностях Ag(110). Этильные частицы соединяются с образованием бутана на обеих поверхностях, при этом максимум пика десорбции находится между 218 и 238 К, в зависимости от покрытия этилом. Помимо бутана, на поверхности Ag(110) с дозированным кислородом образовался ряд продуктов окисления, включая диэтиловый эфир, этанол, ацетальдегид, поверхностный ацетат, этилен, диоксид углерода и воду. Диэтиловый эфир был основным оксигенатом, образующимся при всех соотношениях этил:кислород, а пиковая температура выделения эфира варьировалась от 220 до 266 К в зависимости от относительных покрытий этих реагентов. Сумма продуктов сгорания, СО 2 и H 2 O, в основном образуются при низких этильных покрытиях в присутствии избытка кислорода. Образование этилена при температуре около 240 К, вероятно, происходит по пути дегидрирования с участием кислорода, поскольку этилен не образуется из этильных групп на чистой поверхности. Ацетальдегид и этанол выделяются одновременно с пиком с центром при 270-280 К и приписываются реакциям поверхностных этоксидных частиц.
Этильные частицы соединяются с образованием бутана на обеих поверхностях, при этом максимум пика десорбции находится между 218 и 238 К, в зависимости от покрытия этилом. Помимо бутана, на поверхности Ag(110) с дозированным кислородом образовался ряд продуктов окисления, включая диэтиловый эфир, этанол, ацетальдегид, поверхностный ацетат, этилен, диоксид углерода и воду. Диэтиловый эфир был основным оксигенатом, образующимся при всех соотношениях этил:кислород, а пиковая температура выделения эфира варьировалась от 220 до 266 К в зависимости от относительных покрытий этих реагентов. Сумма продуктов сгорания, СО 2 и H 2 O, в основном образуются при низких этильных покрытиях в присутствии избытка кислорода. Образование этилена при температуре около 240 К, вероятно, происходит по пути дегидрирования с участием кислорода, поскольку этилен не образуется из этильных групп на чистой поверхности. Ацетальдегид и этанол выделяются одновременно с пиком с центром при 270-280 К и приписываются реакциям поверхностных этоксидных частиц.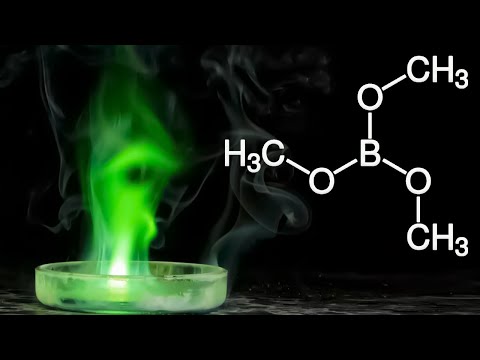

 Реакция очень чувствительна и позволяет открывать следы борной кислоты в присутствии большого числа ионов. Бензоин с бором реагирует в отношении 1 к 1
Реакция очень чувствительна и позволяет открывать следы борной кислоты в присутствии большого числа ионов. Бензоин с бором реагирует в отношении 1 к 1