Содержание
строение, таутомерия; синтез карбоновых кислот и кетонов.
Алкилирование
эфиров β-оксокарбоновых кислот.
Как
уже упоминалось, эфиры β-оксокарбоновых
кислот обладают довольно сильными
кислотными свойствами,
например, рКа
ацетоуксусного эфира составляет 10,65.
Анионы солей ацетоуксусного и других
эфиров β-оксокислот стабилизированы
за счет сопряжения, отрицательный заряд
делокализуется в них при участии атомов
кислорода двух карбонильных групп:
Ацетоуксусный
эфир имеет 2 СН-кислотных центра => в
молекулу могут быть введены 2 алкильных
радикала.
Анионы
солей ацетоуксусного и других эфиров
β-оксокислот
вследствие делокализации отрицательного
заряда в сопряженной системе представляют
собой амбидентные
нуклеофилы
(два нуклеофильных центра: α-атом
углерода и атом кислорода кетонной
группы).
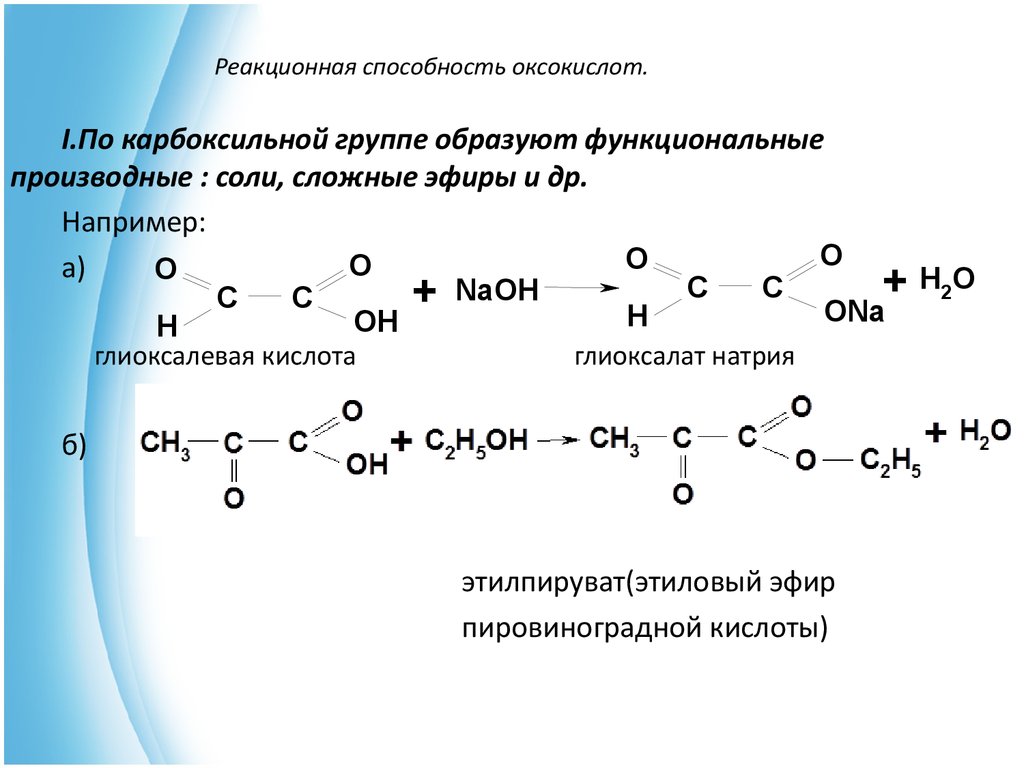
Кислотное
расщепление. Ацетоуксусный
Ацетоуксусный
эфир и его алкильные производные при
действии концентрированных спиртовых
растворов щелочи подвергаются так
называемому кислотному расщеплению,
приводящему к образованию сложных
эфиров замещенных уксусных кислот.
Гидролиз сложного эфира обычно
осуществляют в кислой среде:
Декарбоксилирование.
Декарбоксилирование
является этапом так называемого
кетонного
расщепления
замещенных ацетоуксусных эфиров с
целью получения метилкетонов. Процедура
включает в себя щелочной гидролиз
сложного эфира β-оксокислоты и
декарбоксилирование образовавшейся
оксокислоты после подкисления реакционной
смеси:
Из
приведенных примеров видно, что
ацетоуксусный эфир является удобным
синтетическим предшественником
алифатических карбоновых кислот и
метилкетонов. При планировании синтеза
какой-либо карбоновой кислоты или
метилкетона исходят из того, что от
молекулы ацетоуксусного эфира в
результате кетонного расщепления
в структуре соответствующего кетона
останется фрагмент ацетона, а в
результате кислотного расщепления в
молекуле образовавшейся карбоновой
кислоты — остаток уксусной кислоты.
Функциональные
производные угольной кислоты: фосген,
эфиры карбаминовой кислоты; карбамид
(мочевина) – гидролиз, взаимодействие
с азотистой кислотой и гипобромитами,
образование биурета, биуретовая
реакция; основные свойства гуанидина.
Угольная
кислота традиционно не относится к
органическим соединениям, но она
сама и ее функциональные производные
имеют определенное сходство с карбоновыми
кислотами и их производными, поэтому
и рассматриваются в настоящей главе.
Двухосновная угольная кислота —
неустойчивое соединение, легко
распадается на диоксид углерода и воду.
В водном растворе углекислого газа
лишь 0,1% его существует в виде угольной
кислоты. Угольная кислота образует
два ряда функциональных производных
— полные
(средние) и неполные (кислые).
Кислые эфиры, амиды и другие производные
нестабильны и разлагаются с выделением
диоксида углерода:
Хлорангидриды.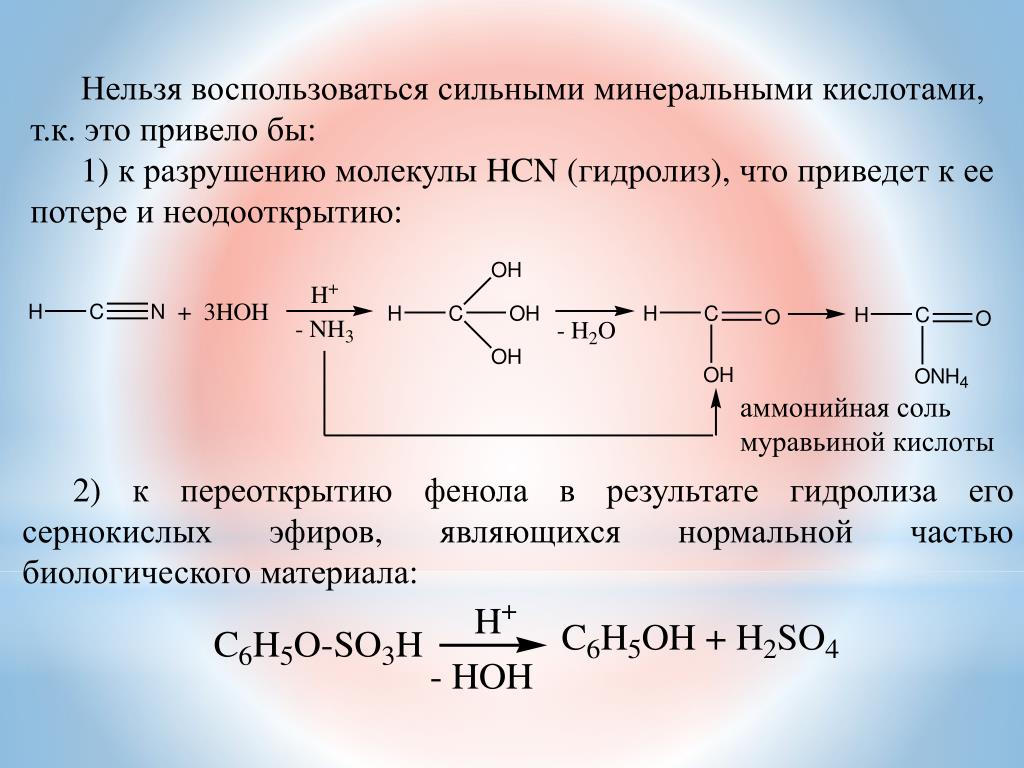
Полный
хлорангидрид угольной кислоты — фосген
СОС12
— низкокипящая жидкость с запахом
прелого сена, очень ядовит, вызывает
отек легких, образуется в качестве
вредной примеси при фотохимическом
окислении хлороформа в результате
неправильного хранения последнего.
В
промышленности фосген получают
радикальным хлорированием оксида
углерода(Н) в реакторе, заполненном
активированным углем:
Фосген,
подобно хлорангидридам карбоновых
кислот, обладает высокой
ацилирующей способностью,
из него получают многие другие
функциональные производные угольной
кислоты.
При
взаимодействии фосгена со спиртами
образуются сложные эфиры двух типов —
полные (карбонаты)
и неполные (хлороугольные
эфиры,
или хлороформиаты), последние одновременно
являются и сложными эфирами, и
хлорангидридами.
С
гликолями и пирокатехином фосген
образует циклические
эфиры,
используемые в качестве защитных
групп. Для ацилирования фенолов часто
Для ацилирования фенолов часто
применяют метод Шоттена—Баумана,
например:
Карбоновые
кислоты под действием фосгена превращаются
в соответствующие хлорангидриды:
Амиды.
Угольная
кислота образует два ряда амидов —
кислые (карбаминовая
кислота
и ее производные) и средние (мочевина
и ее производные).
Карбаминовая
кислота
— неполный амид угольной кислоты —
неустойчивое соединение, распадается
с образованием аммиака и диоксида
углерода:
Эфиры
карбаминовой кислоты — карбаматы,
или уретаны,
— устойчивые соединения, получаемые
в результате присоединения спиртов к
изоцианатам или ацилированием аммиака
и аминов соответствующим хлороформиатом:
N-Замещенные
карбаматы широко используются в качестве
пестицидов. Некоторые карбаматы нашли
применение в медицине как лекарственные
средства.
Широкое
практическое применение имеют полиуретаны
— высокомолекулярные соединения,
образующиеся при взаимодействии
полифункциональных изоцианатов с
многоатомными спиртами. Получаемый
при этом сшитый полимер применяют в
основном в виде разнообразных пенопластов.
Мочевина
(карбамид)
— полный амид угольной кислоты —
важнейший конечный продукт белкового
обмена у млекопитающих; взрослый человек
выделяет в сутки 25—30 г мочевины.
Мочевина
— крупнотоннажный продукт (мировое
производство более 100 млн т/год),
используется в основном как азотное
удобрение, значительныеьколичества
мочевины идут на получение
мочевиноформальдегидных смол. В
фармацевтической промышленности
мочевину используют для получения
барбитуратов.
Мочевина
обладает слабыми
основными свойствами,
образует соли с сильными кислотами.
Соли азотной и щавелевой кислот
нерастворимы в воде.
Мочевина
протонируется
по атому кислорода,
а не азота. Это, вероятно, связано с
Это, вероятно, связано с
делокализацией неподеленных пар
электронов атомов азота за счет
р,π-сопряжения.
В
кипящей воде мочевина гидролизуется
с образованием аммиака и диоксида
углерода; кислоты и основания катализируют
эту реакцию:
Первичными
продуктами, образующимися при нагревании
мочевины, являются аммиак и изоциановая
кислота. Изоциановая кислота может
тримеризоваться в циануровую кислоту
или конденсироваться со второй молекулой
мочевины с образованием биурета.
В зависимости от скорости нагрева
доминирует тот или иной путь разложения
мочевины:
С
гидроксидом меди(II) в щелочной среде
биурет образует хелатный комплекс
красно-фиолетового цвета (моделирует
качественная
реакция на
белки).
При
взаимодействии мочевины с
азотистой кислотой
образуются диоксид углерода, азот и
вода. Реакция применяется для удаления
избытка азотистой кислоты при проведении
реакций диазотирования и нитрозирования:
Действие
гипогалогенитов также приводит к
разложению мочевины. В зависимости
В зависимости
от условий могут образовываться азот
или гидразин; последний именно так
получают в промышленности:
Гуанидин.
Гуанидин,
или иминомочевину (H2N)2C=NH,
в промышленности получают сплавлением
мочевины с нитратом аммония или при
нагревании эфиров ортоугольной кислоты
с аммиаком. Гуанидин — бесцветное
кристаллическое вещество (т. пл. 50 °С),
обладает сильными
основными свойствами.
Высокая основность на уровне гидроксидов
щелочных металлов обусловлена полной
делокализацией положительного
заряда в симметричном катионе гуанидиния:
Остатки
гуанидина и бигуанидина содержатся в
некоторых природных соединениях и
лекарственных веществах.
Сульфокислоты:
номенклатура; кислотные свойства,
образование солей; функциональные
производные: эфиры, амиды, хлорангидриды.
Реакции десульфирования и замещения
сульфогруппы в ароматических
сульфокислотах.
Сульфоновыми
кислотами
называются сероорганичсские соединении
общей формулы RSО3Н.
Сульфоновые
кислоты (сульфокислоты) имеют сходство
с карбоновыми кислотами, обладают
кислотными свойствами, образуют
производные тех же типов, что и карбоновые
кислоты.
Сульфоновые
кислоты представляют собой кристаллические
вещества, часто гигроскопические,
хорошо растворимые в воде. В органическом
синтезе, например при получении
красителей, введение сульфогруппы в
структуру соединений используется для
повышения их растворимости в воде.
Химические
свойства.
Сульфоновые
кислоты обладают высокой
кислотностью,
они сравнимы с серной кислотой и даже
превосходят ее (например,
трифторометансульфоновая кислота
CF3SО3H).
Атом
серы в сульфокислотах и их производных
имеет тетраэдрическую конфигурацию.
В анионах сульфоновых кислот заряд
делокализован при участии трех
атомов кислорода, т. е. более полно, чем
е. более полно, чем
в анионах карбоновых кислот. Ниже
приведены геометрические параметры
бензолсульфонат-иона и резонансные
структуры, демонстрирующие делокализацию
заряда:
Как
слабые, так и сильные основания образуют
с сульфокислотами соли, называемые
сульфонатами:
Сульфонаты
бария и свинца в отличие от сульфатов
хорошо растворимы в воде, это их свойство
используется при очистке полученных
в результате сульфирования ароматических
сульфоновых кислот.
Под
действием перегретого водяного пара
сульфоновые кислоты подвергаются
десульфированию:
Возможность
удаления сульфогруппы используется в
препаративной органической химии для
защиты определенных положений бензольного
кольца, что можно проиллюстрировать
на примере синтеза 2,6-динитроанилина:
Сульфогруппа
из ароматического кольца может быть
удалена также при действии нуклеофилов,
при этом степень окисления серы
понижается.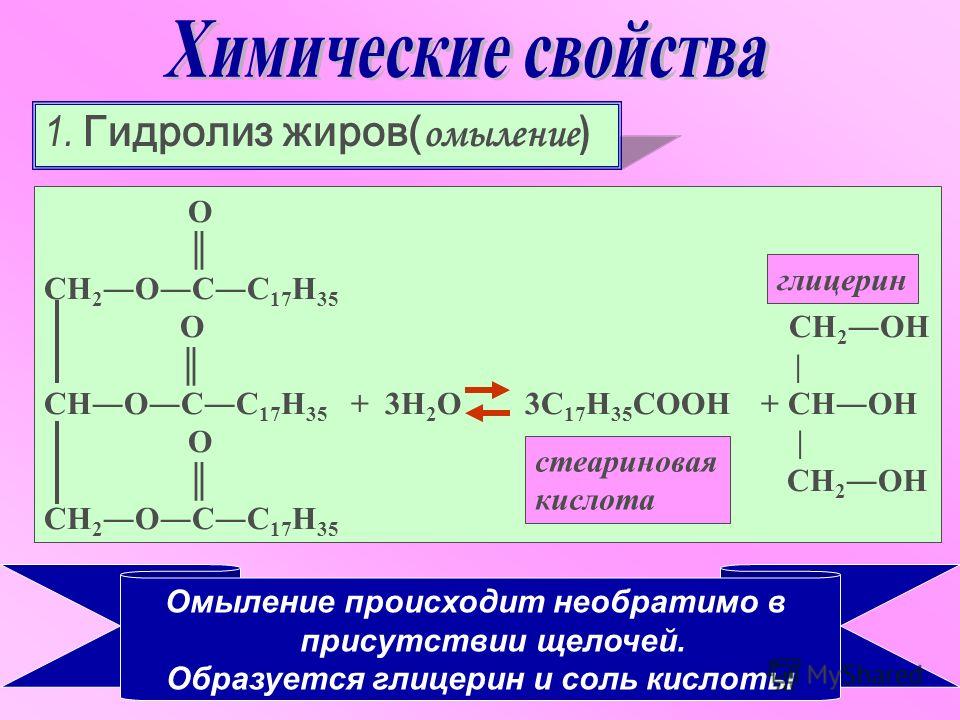 Кроме упоминавшегося ранее
Кроме упоминавшегося ранее
способа получения фенолов, с помощью
реакций этого типа получают тиофенолы,
амины и др.:
Сульфонилхлориды.
Сульфонилхлориды
синтезируют из сульфоновых кислот или
их солей теми же методами, что и
хлорангидриды карбоновых кислот:
Кроме
того, арилсульфонилхлориды могут быть
получены прямым сульфированием
ароматического кольца хлорсульфоновой
кислотой. В качестве побочных продуктов
в этой реакции образуются диарилсульфоны:
Химические
свойства.
Из сульфонилхлоридов в результате
нуклеофильного замещения у атома
серы получают различные функциональные
производные сульфоновых кислот,
наиболее значимы из которых сульфонаты
(сложные эфиры) и сулъфонамиды
(амиды).
Сульфонаты
образуются в реакциях сульфонилхлоридов
со спиртами. При получении сульфонатов
в качестве акцептора хлороводорода и
нуклеофильного катализатора
используют пиридин:
Сульфонамиды
образуются при взаимодействии
сульфонилхлоридов с аммиаком или
аминами:
При
восстановлении сульфонилхлоридов
образуются тиолы или тиофенолы, например:
Эфиры
сульфоновых кислот.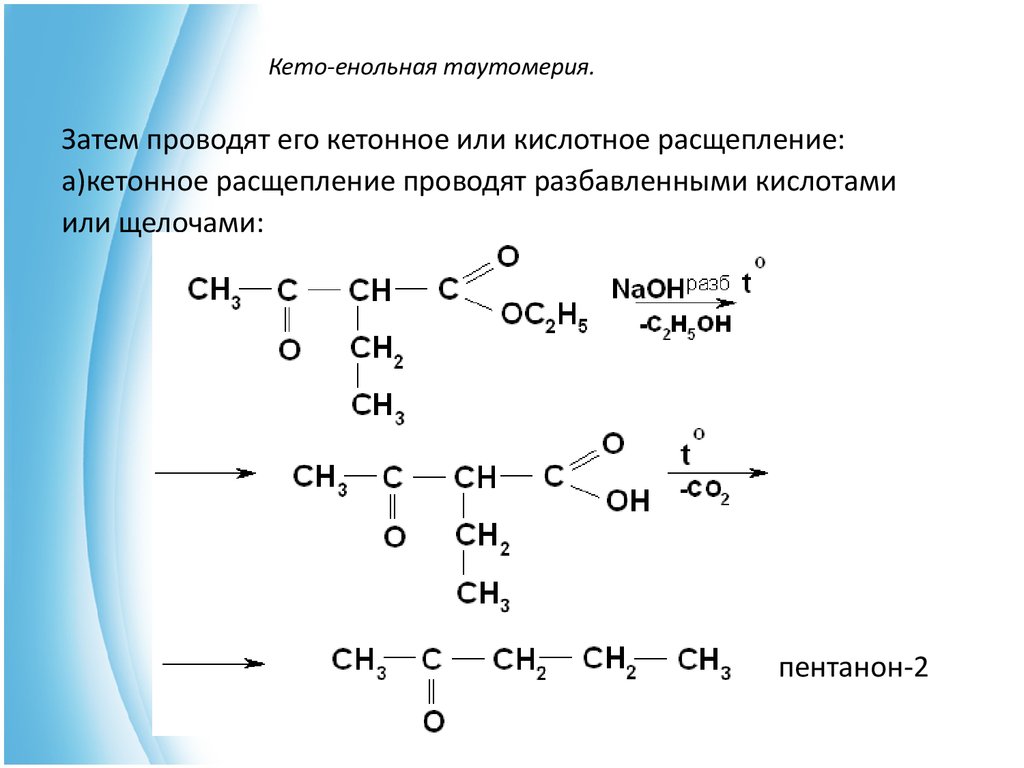
Эфиры
сульфоновых кислот используют в
органическом синтезе в качестве
субстратов в реакциях нуклеофильного
замещения. Как уже упоминалось,
сульфоновые кислоты обладают
высокой кислотностью,
поэтому их анионы, будучи стабильными,
являются хорошими уходящими группами
в реакциях нуклеофильного замещения.
Алкильный
радикал эфира должен быть первичным
или вторичным, поскольку сульфонаты
третичных спиртов труднодоступны и
малоустойчивы (подвергаются
элиминированию). Приведенный ниже
пример показывает, что из алкилсульфонатов
можно получать соединения практически
тех же классов, что и из алкилгалогенидов.
Например, при взаимодействии
этил-п-толуолсульфоната с феноксидом
натрия образуется простой эфир
фенола:
Сульфонамиды.
Существуют
сульфонамиды трех типов: незамещенные,
монозамещенные и дизамещенные,
которые следует рассматривать как
сульфонильные производные
соответственно аммиака, первичных и
вторичных аминов:
Атом
серы в молекулах сульфонамидов, как и
в сульфоновых кислотах и их солях, имеет
тетраэдрическую конфигурацию. Ниже
Ниже
приведены геометрические параметры
метансульфонамида:
Сульфонамиды
представляют собой кристаллические
вещества с довольно высокими и четкими
температурами плавления, поэтому их
получают в аналитических целях для
идентификации соответствующих
сульфоновых кислот.
Сульфонамиды
гидролизуются
в жестких условиях
в кислой или щелочной среде с
образованием аммиака или аминов и
сульфоновой кислоты. В отличие от
сульфонатов, в которых при действии
нуклеофилов расщепляется связь С—О,
в сульфонамидах расщепляется
связь S—N:
Незамещенные
и монозамещенные сульфонамиды обладают
NH-кислотными
свойствами
и образуют соли со щелочами:
На
этой реакции основана проба
Хинсберга,
позволяющая различать первичные,
вторичные и третичные амины, а также
разделять их смеси (качественная
реакция).
С этой целью смесь аминов обрабатывают
тозилхлоридом в присутствии щелочи,
при этом первичные и вторичные амины
образуют соответственно моно- и
дизамещенные сульфонамиды, третичные
амины в эту реакцию не вступают.
Сульфонамид,
образовавшийся из вторичного амина,
нерастворим в щелочах и выпадает в
осадок. Сульфонамид, полученный из
первичного амина, остается в щелочном
растворе в виде соли и выпадает в осадок
после подкисления раствора.
Еще
одним практически значимым производным
сульфоновых кислот является сахарин,
который представляет собой имид
о-сульфобензойной кислоты. Сахарин
в виде натриевой соли применяется в
качестве подсластителя диетических
пищевых продуктов; он в 500—600 раз слаще
сахара и в неизмененном виде выводится
с мочой из организма.
ФГБОУ ВО ПГФА Минздрава России
Пермская государственная
фармацевтическая академия
Для слабовидящих
youtube.com/embed/GzJP-Y_6rBo»>
Осторожно: грипп!!!
…
Грипп — симптомы и профилактика
…
еще …
Наши новости
Пять вузов Пермского края вошли в рейтинг лучших в стране
15 октября 2022
Электронные образовательные ресурсы ПГФА
11 октября 2022
еще …
Наши события
Выступление иностранных студентов ПГФА на выставке «Карьера и образование»
31 октября 2022
Визит генерального консула Республики Узбекистан
14 октября 2022
еще . ..
..
Конференции, олимпиады, форумы…
О краевом молодёжном конкурсе социальной антикоррупционной рекламы
08 ноября 2022
О социальной программе «Неограниченные возможности»
02 ноября 2022
Федеральный проект «Платформа университетского технологического предпринимательства»
20 октября 2022
еще …
Новости спорта
Стартовал Чемпионат Пермского края по мини-футболу
07 ноября 2022
Фестиваль чемпионов ВФСК ГТО «ИГРЫ ГТО» в СК им. В.П. Сухарева
05 ноября 2022
Матч с командой Пермского университета ФСИН в рамках «Открытого чемпионата по мини-футболу среди женских команд ВУЗов Пермского Края»
31 октября 2022
еще …
Button
Ученый совет
Научный полк
Обращение советов ректоров вызов Пермского края
Мисс Фармация-2019
Галерея новостей
День открытых дверей
Информация об аккредитации специалистов
Видеообзор — введение в профессию
Ректор ПГФА Алексей Юрьевич Турышев рассказывает о перспективах специальности и приёме в 2019 году
В ПГФА имеется 200 бюджетных мест для абитуриентов. Трудоустройство выпускников ПГФА почти 100 %. ПГФА обеспечивает половину кадровой потребности отрасли. Провизоры — аналитики, технологи, организаторы. Обеспечивается полный цикл обучения от создания молекулы до разработки лекарственной формы. Эфир 26 февраля 2019 года
Трудоустройство выпускников ПГФА почти 100 %. ПГФА обеспечивает половину кадровой потребности отрасли. Провизоры — аналитики, технологи, организаторы. Обеспечивается полный цикл обучения от создания молекулы до разработки лекарственной формы. Эфир 26 февраля 2019 года
Смотреть все видеообзоры о професии
Условия проживания студентов в общежитии № 2 (более новое первое общежитие не показано). Съёмка 2016 года.
Имеющиеся у ПГФА два общежития неизменно входят в десятку лучших общежитий образовательных учреждений города Перми. В общежитиях имеются столовая, кухни на каждом этаже, библиотека, спортзал, бытовая, душевая и постирочная комнаты (общежитие № 1 новее).
Первокурсники на лабораторных занятиях по физике в ПГФА. Съёмка 25 февраля 2019 года
На первом курсе студенты изучают биологию, физиологию, математику, физику, неорганическую химию, физическую химию, латинский язык, информатику, экономическую теорию, историю. Основной предмет — химия. За годы учёбы её будет 9 видов.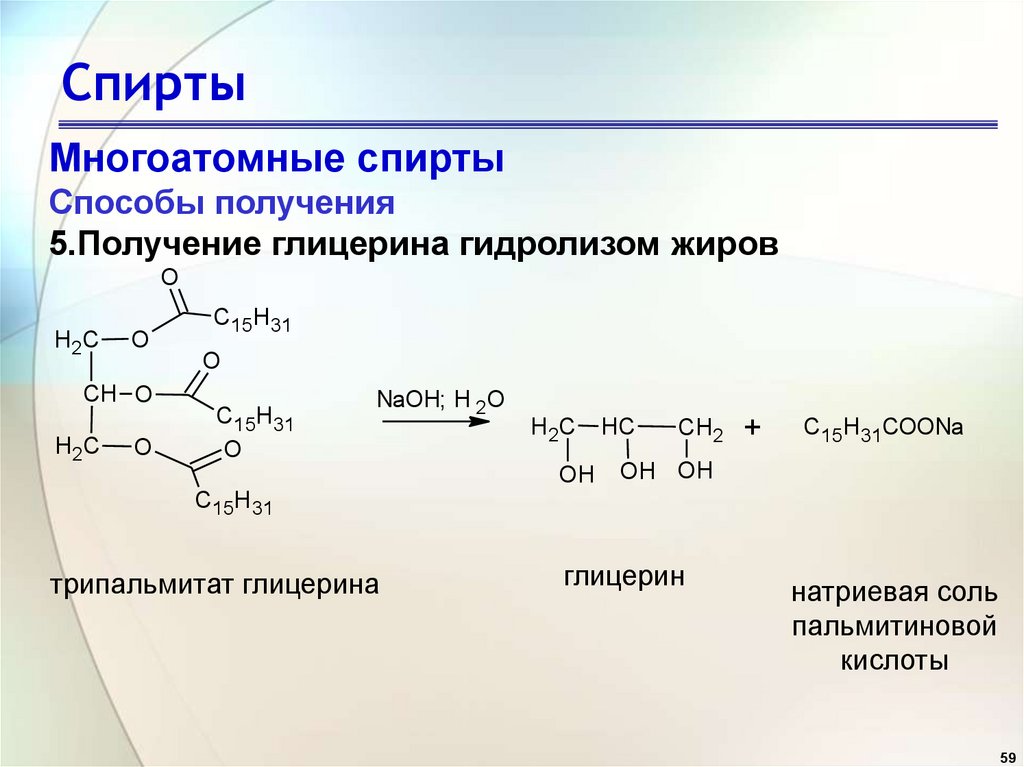
Впечатления первокурсника
после двух месяцев учёбы в 2018 году.
Ректор
Проректоры
Помощник ректора по воспитательной работе
Ученый совет
Административно — управленческие подразделения
Ведущий юрисконсульт
Учебные подразделения
Кафедры
Научные подразделения
Корпуса и общежития
Отдел качества
Региональный испытательный центр «Фарматест»
Полиграфический отдел
Стоматологическая клиника
Столовая
Здравпункт
Музей
Профком сотрудников
Профком студентов
Социально-психологическая служба
Синтез малонового эфира и ацетоуксусного эфира – Master Organic Chemistry
Синтез малонового эфира и его аналог, синтез ацетоуксусного эфира со слабым основанием, а затем образует связь С–С в альфа-положении с алкилгалогенидом (алкилирование енолята) Содержание Прежде чем углубляться в механизм, посмотрите, сможете ли вы определить общую схему синтеза для каждого из этих синтезов эфира малоновой кислоты. Следите за различными цветами атомов. Откуда каждый? Куда идет каждый из них?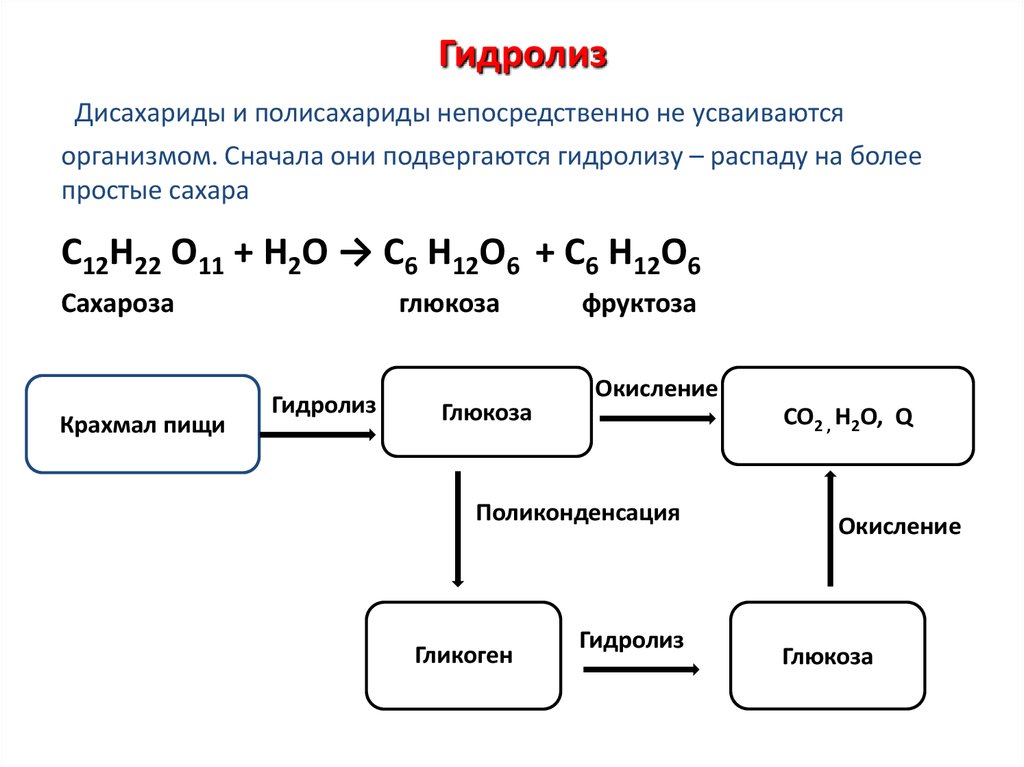
1.
 Общая схема синтеза эфира малоновой кислоты
Общая схема синтеза эфира малоновой кислоты
Самое интересное в этом процессе состоит в том, что он построен из серии простых реакций. Опять же, механизмы в органической химии очень похожи на музыку – из небольшого количества частей мы можем построить что-то сложное.
Давайте рассмотрим механизм (для краткости сосредоточимся на синтезе малонового эфира — механизм синтеза ацетоуксусного эфира идентичен, за исключением того, что мы начинаем с другого соединения).
Синтез малонового эфира состоит из пяти отдельных реакций
Эти процессы состоят всего из пяти реакций:
- депротонирование сложного эфира с образованием енолята
- S 9007 энолата на алкилгалогенид, образуя новую связь C-C
- acidic hydrolysis of the ester to give a carboxylic acid
- decarboxylation of the carboxylic acid to give an enol
- tautomerization of the resulting enol to a carboxylic acid
Step 1: Deprotonation To Give An Енолят
На первом этапе основание (в данном случае CH 3 O – ) удаляет наиболее кислый протон из сложного эфира (здесь на C 2 , с pK a около 13) до дать енолят .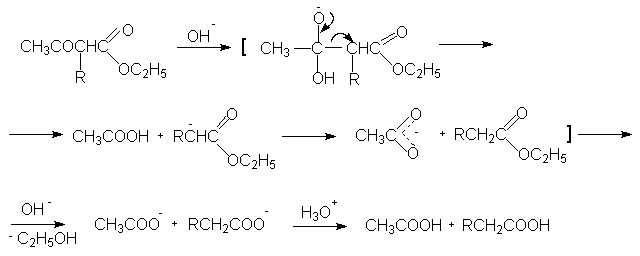 Полученный енолят можно представить как одну из двух резонансных форм.
Полученный енолят можно представить как одну из двух резонансных форм.
Стадия 2: S
N 2 Реакция енолятного нуклеофила с алкилгалогенидным электрофилом
Еноляты являются отличными нуклеофилами. На втором этапе енолят действует как нуклеофил в реакции S N 2 с образованием новой связи C-C:
проводят водный гидролиз сложного эфира до карбоновой кислоты.
Этап 4: Декарбоксилирование для получения энола
Теперь наступает часть, которая часто доставляет студентам проблемы. Когда карбоновые кислоты имеют карбонильную группу (C=O) через две связи, они могут легко терять углекислый газ. Почему? Потому что карбонил может действовать как «поглотитель» электронов для пары электронов, поступающих от разрыва связи С-С, образуя енол . Это называется «декарбоксилирование». Обратите внимание, что это также относится к карбоновым кислотам с кетоном, отстоящим на две связи, так называемым «β-кетокислотам».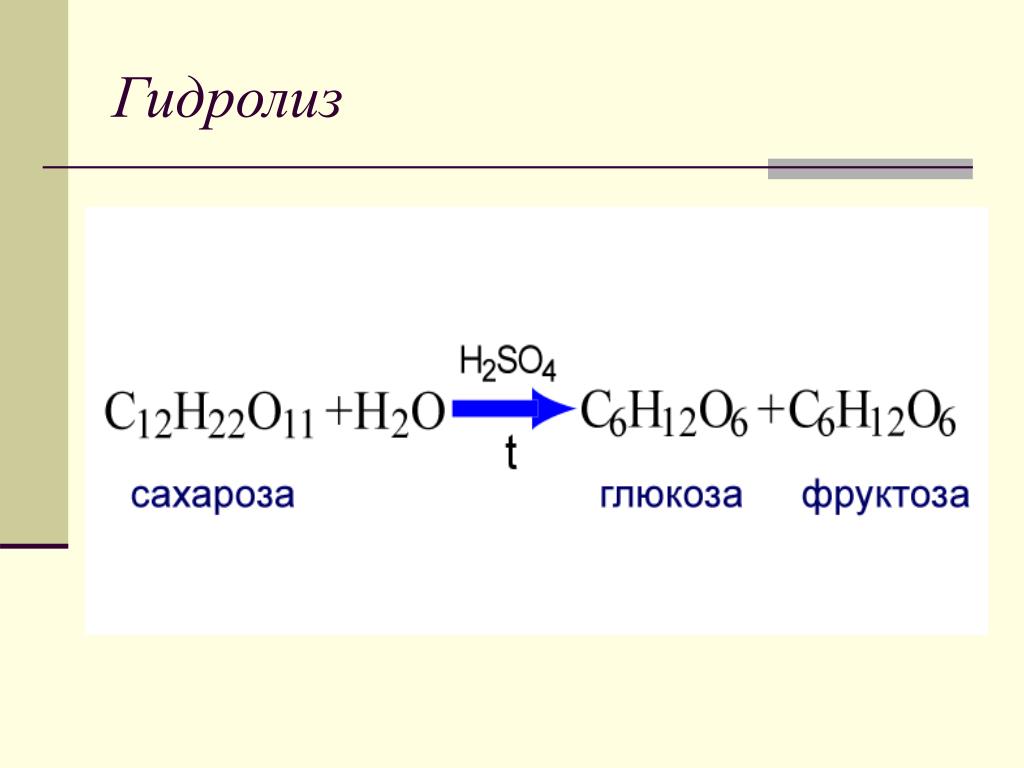 [См. статью – Декарбоксилирование]
[См. статью – Декарбоксилирование]
Стадия 5: Таутомеризация енола обратно в карбоновую кислоту
Наконец, образующийся енол не является стабильным соединением . Он может трансформироваться в свой конституциональный изомер: в данном случае в карбоновую кислоту. Эти два структурных изомера находятся в равновесии друг с другом, хотя «кето» форма (с карбонильной группой) предпочтительнее. Этот процесс называется «таутомерия ». [См. статью: Кето-енольная таутомерия]
Опять же, ключевым моментом, который следует отметить в отношении синтеза малонового эфира, является наблюдение за характером образования и разрыва связей. Как и в случае с любой другой реакцией в органической химии, если вы видите закономерность в движении вперед, вы сможете применить ее и в отношении назад. Посмотрите, сможете ли вы понять, как получить соединение A из синтеза эфира малоновой кислоты.
Во вторых тоже можно сделать два алкилирования перед стадией водного гидролиза. Можете ли вы понять, как получить B из синтеза эфира малоновой кислоты?
[Если вы дочитали до этого места, работали над этими проблемами и хотели бы получить ответ, оставьте комментарий!]
Примечания
(Дополнительно) Ссылки и дополнительная литература
- ДОПОЛНЕНИЕ МАЛОНОВЫЕ ЭФИРЫ В БЕНЗОИЛ-ФЕНИЛ-АЦЕТИЛЕН.
Элмер П. Колер
Журнал Американского химического общества 1922, 44 (2), 379-385
DOI: 10.1021/ja01423a019
Один из первых в литературе примеров использования малоновых эфиров в органическом синтезе. - Расщепление неэффективных малонических эфиров с помощью такисида натрия
Артур С. Коуп и С. М. МакЭлвейн
Журнал Американского химического общества 1932, 54 (11), 43193 1932, 54 (11), 43193932, 54 (11), 43193932, 54 (11), 43193 1932, 54 (11). 1021/ja01350a026
1021/ja01350a026
В этой статье профессора А. К. Коупа (перегруппировка Копа) показано, что сложные эфиры малоновой кислоты могут быть синтезированы из енолятов алифатических кислот с диэтилкарбонатом. - Алкилирование Malonic Ester
Ralph G. Pearson
Журнал Американского химического общества 1949, 71 (6), 2212-2214
DOI: 11/JA01744.0140101010101010101010101010101010101010184.101842010184201842018420184201842018420101842010184420101844.9.01144420101842. очень тщательное физико-органическое исследование синтеза малонового эфира и показывает, что скорость алкилирования связана с кислотностью а-протона в малоновом эфире. - Синтез эфира малоновой кислоты в студенческой лаборатории
Bernard E. Hoogenboom, Phillip J. Ihrig, Arne N. Langsjoen, Carol J. Linn и Stephen D. Mulder
Journal of Chemical Education 1991, 68 (8), 689
DOI: 1021/ed068p689
В этой публикации описывается прототипный, но все еще упрощенный метод проведения синтеза эфира малоновой кислоты, что делает его подходящим для студентов лабораторных курсов органической химии.
- ДИЭТИЛ 1,1-ЦИКЛОБУТАНДИКАРБОКСИЛАТ
Raymond P. Mariella and Richard Raube
Org Synth. 1953 , 33 , 23
DOI: 10.15227/orgsyn.033.0023
В этой процедуре используется дигалогенид для осуществления внутримолекулярной циклизации, которая также известна как алициклический синтез Перкина. Organic Syntheses , который публикуется подразделением органической химии ACS, является авторитетным источником надежных и независимо протестированных синтетических органических лабораторных процедур.
Синтез эфира ацетоуксусной кислоты — химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 112618
- Джонни Бетанкур
- ClutchPrep
Ацетоуксусный эфир (этилацетоацетат) — чрезвычайно полезная молекула, которую можно использовать для получения кетонов и других молекул. Вы даже будете использовать это позже в синтезе аминокислот, поэтому давайте разберем, как это реагирует.
Вы даже будете использовать это позже в синтезе аминокислот, поэтому давайте разберем, как это реагирует.
Из бета-кетоэфира в кетон:
Как нам осуществить эту трансформацию
Енолятная формация
Меченые альфа-углероды
Видите эти два карбонила? У каждого карбонила есть нечто, называемое альфа-углеродом, и у каждого альфа-углерода есть атомы водорода, которые легко отделить. РКа зеленого альфа-водорода составляет около 20, а рКа синего альфа-водорода на самом деле около 10. Почему? Из-за резонансных структур могут образовываться анионы!
Резонансные структуры енолята зеленого цвета
Резонансные структуры енолята синего цвета
Всякий раз, когда у вас есть бета-дикарбонил, подобный этому, енолят предпочтительно будет образовываться на общем альфа-углероде.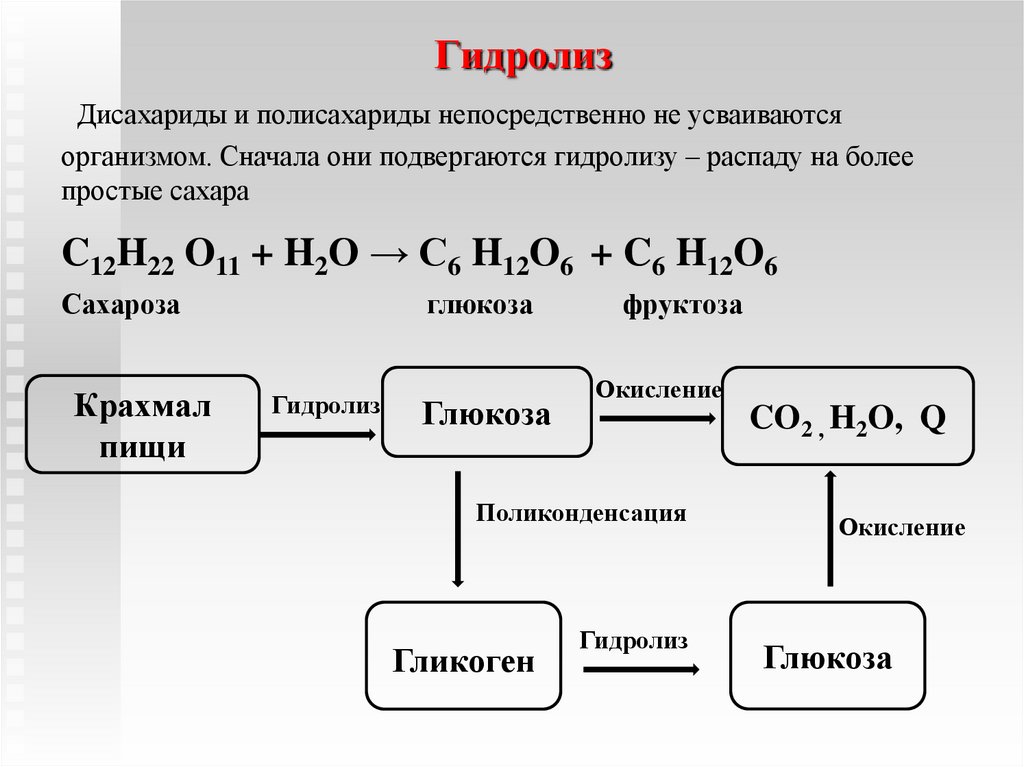 Анион на синем альфа-углероде выше может образовывать больше резонансных структур, чем анион на зеленом альфа-углероде, поэтому pKa синего водорода будет ниже (более кислая).
Анион на синем альфа-углероде выше может образовывать больше резонансных структур, чем анион на зеленом альфа-углероде, поэтому pKa синего водорода будет ниже (более кислая).
Звучит круто, но можем ли мы просто использовать любое старое основание для получения нашего енолята? Точно нет! Допустим, мы должны были попробовать использовать NaOH. Вместо образования енолята мы фактически получили бы конкурирующую реакцию: омыление, тип нуклеофильного замещения ацила. Обратите внимание, что гидроксид заменяет этоксигруппу.
сокращенный механизм омыления
Итак, как мы можем конкретно избежать такого типа ацильной замены? Мы можем использовать объемную основу, такую как LDA, или анионную версию нашей алкоксигруппы! Видите, как мы получили этоксигруппу (-OEt) в нашем исходном материале? Чтобы предотвратить любые замены этой группы, мы можем использовать NaOEt. Эти этоксигруппы полностью заменяются, но образуется одна и та же молекула.
Этерификация по Фишеру с этоксидом натрия
Образование метилененолята
Алкилирование енолята
Ладно, круто! Эти еноляты довольно хороши в реакциях SN2. Они могут действовать как нуклеофилы на алкилгалогениды, ацилхлориды (кислоты) и многое другое! Попробуем добавить пропильную группу.
Они могут действовать как нуклеофилы на алкилгалогениды, ацилхлориды (кислоты) и многое другое! Попробуем добавить пропильную группу.
Алкилирование енолята
Декарбоксилирование
Как только мы получим нашу алкильную группу, мы сможем полностью избавиться от сложного эфира с помощью механизма, называемого декарбоксилированием, если захотим. Все, что нужно, это немного тепла и немного водной кислоты. Это можно было написать кучей разных способов — H 2 SO 4 (водн.), HCl (водн.) или даже в общем виде H 3 O + .
Кислотно-катализируемый гидролиз эфира
Сначала мы гидролизуем эфир, чтобы получить бета-кетокислоту, а затем нагреваем, чтобы избавиться от CO 2 . После кислотного гидролиза образующийся енол (виниловый спирт) таутомеризуется обратно в замещенный кетон.
Таутомеризация и декарбоксилирование
Бум! Вот наш продукт, замещенный кетон, в зеленой коробке! Не так уж и плохо, правда? Конечно, существует множество различных способов использования этой молекулы.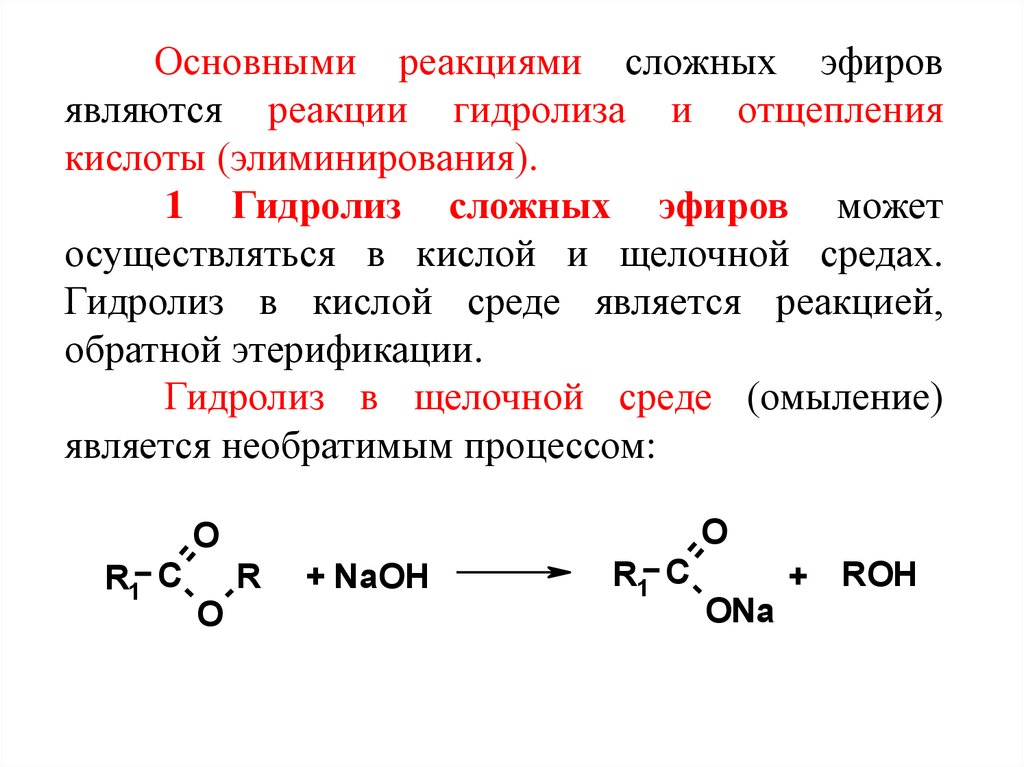 Мы только что прошли этапы для одного алкилирования, но ничто не мешает нам добавлять разные группы.
Мы только что прошли этапы для одного алкилирования, но ничто не мешает нам добавлять разные группы.
Добавление двух алкильных групп
Мы добавили одну алкильную группу, но что, если мы хотим добавить еще одну? Что ж, нам просто нужно следовать тем же шагам! Итак, начнем с самого начала. Давайте сначала добавим пропильную группу, а затем этильную группу. Как только мы добавили пропильную группу, все, что нам нужно сделать, это добавить еще один эквивалент основания, а затем этильную группу. Вот как выглядит порядок реагентов:
Реагенты двойного алкилирования
А вот как будет выглядеть механизм:
Механизм двойного алкилирования
Добавление циклических алкильных групп
Хорошо, но что, если мы хотим добавить циклическую группу к нашей молекуле? Что ж, к счастью, это тоже не так уж и плохо. Нам просто нужна молекула, которая имеет две уходящие группы в концевых положениях. По сути, это будет очень похоже на двойное алкилирование, но с добавлением только одного эквивалента нашей алкильной молекулы. Вот как выглядят реагенты: Реагенты циклического алкилирования
Вот как выглядят реагенты: Реагенты циклического алкилирования
А вот как выглядит механизм:
Механизм циклического алкилирования
Добавление ацильных групп
Давайте сделаем шаг назад и используем тот же енолят, который мы использовали при алкилировании, но давайте использовать ацилхлорид вместо алкилгалогенида в это время. Это в основном следует той же схеме, что и алкилирование, но я собираюсь немного повернуть ацетоуксусный эфир и выделить хлорангидрид, чтобы его было легче следовать.
Механизм ацилирования енолята
Видите, как мы только что следовали той же схеме? Сформируйте енолят, дайте электрофил и отщепьте сложный эфир, добавив кислоту и нагрев его!
Авторы
- Джонни Бетанкур, Clutchprep. Исходная страница доступна здесь.
Эта страница под названием Синтез ацетоуксусного эфира распространяется по лицензии CC BY-NC-SA, автором, ремиксом и/или куратором этой страницы является Джонни Бетанкур.


 1021/ja01350a026
1021/ja01350a026 