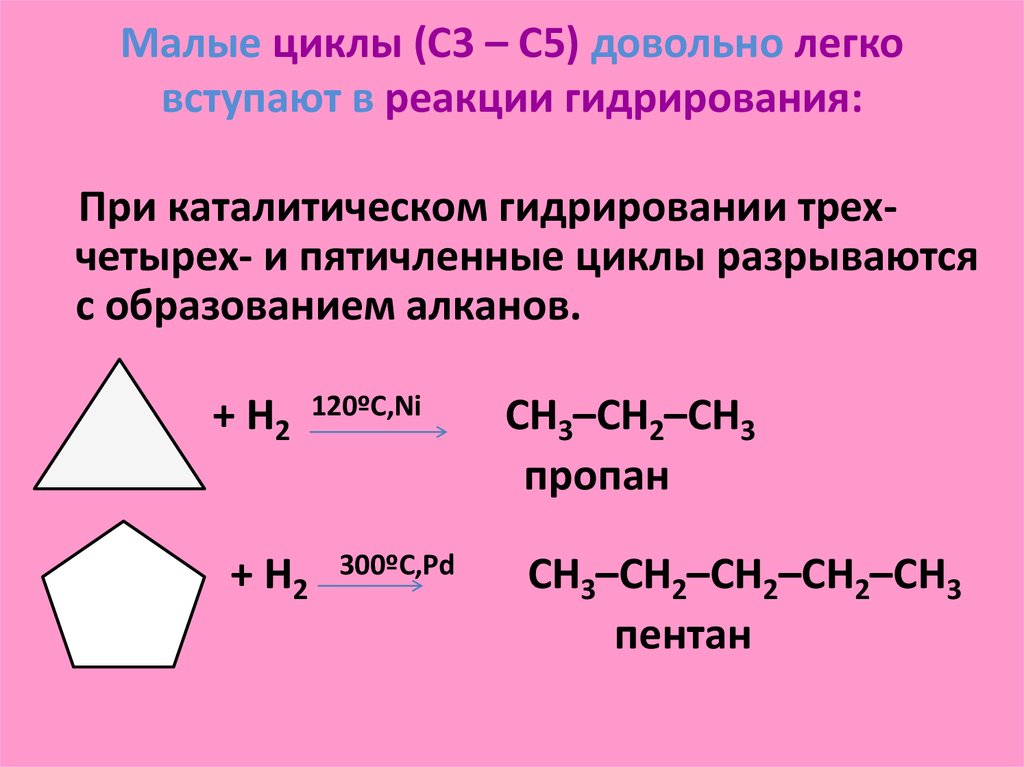
Содержание
Гидрирование — сложный эфир — Большая Энциклопедия Нефти и Газа, статья, страница 1
Cтраница 1
Гидрирование сложных эфиров включает промежуточную реакцию отщепления, которой подвергаются первые образующиеся продукты — гемиацетали.
[1]
Гидрирование сложных эфиров или кислот ( в более жестких условиях) также приводит к образованию спиртов; эта реакция применяется в промышленности в основном при производстве высших спиртов из жирных кислот или их сложных эфиров.
[2]
Гидрирование сложных эфиров можно проводить литийалюминий-гидридом в эфирном растворе, металлическим натрием в спирте ( метод Буво — Блана) или в условиях гетерогенного катализа над меднохромовым катализатором. Во всех этих реакциях продуктом реакции является первичный спирт.
[3]
Гидрирование сложных эфиров может сопровождаться гидро-генолизом, а эфиров ароматических кислот, кроме того, восстановлением ароматического ядра. Побочные реакции, которые характерны и для других высокотемпературных процессов, существенно интенсифицируются с повышением температуры.
Побочные реакции, которые характерны и для других высокотемпературных процессов, существенно интенсифицируются с повышением температуры.
[4]
Гидрирование сложных эфиров включает промежуточную реакцию отщепления, которой подвергаются первые образующиеся продукты — гемиацетали.
[5]
Гидрирование сложных эфиров можно проводить литийалюминий-гидридом в эфирном растворе, металлическим натрием в спирте ( метод Буво — Блана) или в условиях гетерогенного катализа над меднохромовым катализатором. Во всех этих реакциях продуктом реакции является первичный спирт.
[6]
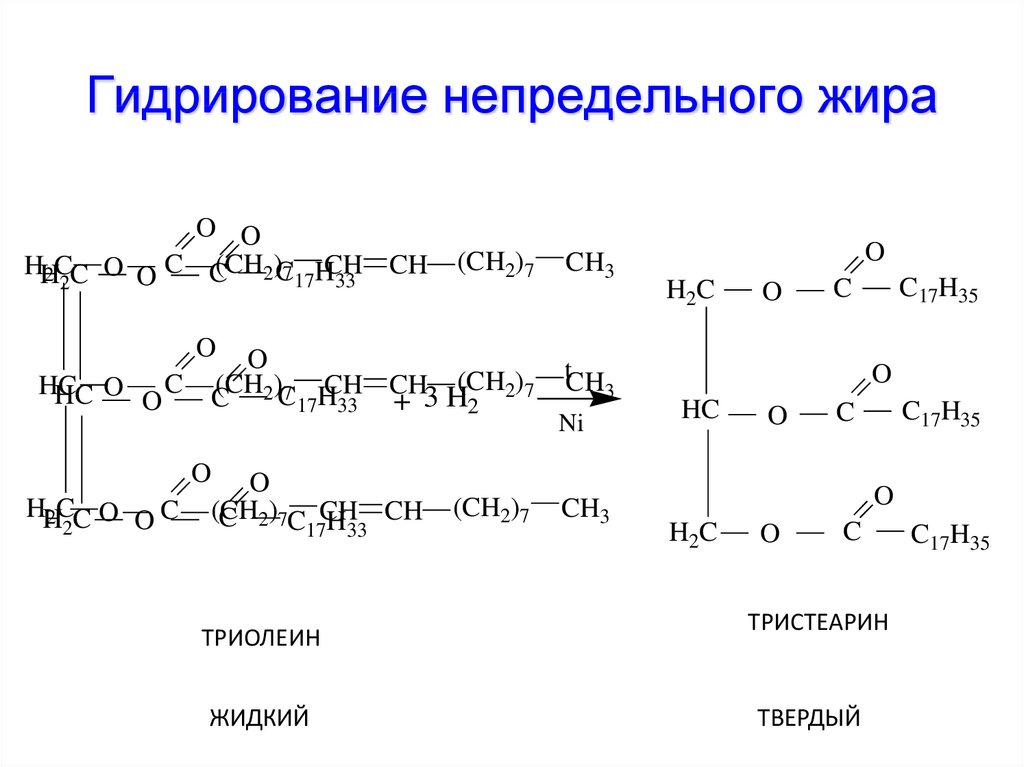
| Технологическая схема получения высших спиртов гидрированием1 метиловых эфиров СЖК.
[7] |
Технология гидрирования сложных эфиров осложняется стадиями этерификации карбоновых кислот и регенерации спирта, поэтому все большее практическое значение приобретают процессы прямого гидрирования жирных кислот до спиртов.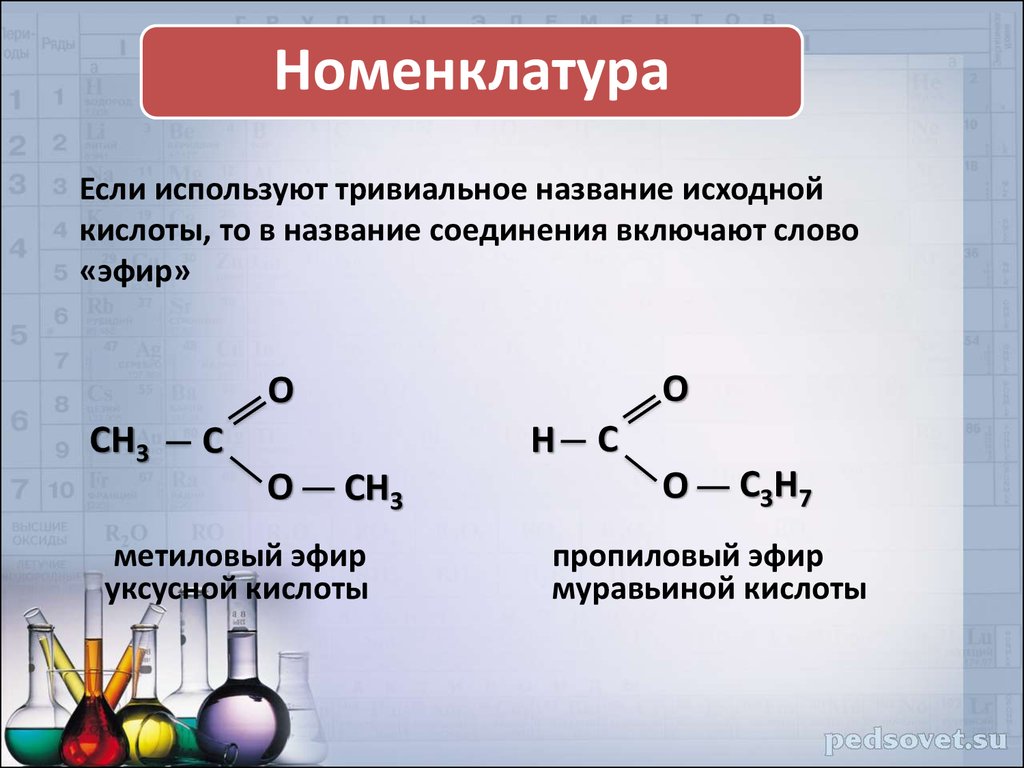
[8]
При гидрировании сложного эфира при 250 обычно нет необходимости применять растворитель, так как исходный сложный эфир и получаемые спирт или гликоль служат подходящей средой для реакции. Однако иногда целесообразно использовать растворитель при гидрогенизации небольших количеств сложного эфира, для того чтобы свести к минимуму механические потери или предотвратить затвердевание получаемого препарата в автоклаве. В качестве растворителя можно применять диоксан или спирт с двумя или более атомами углерода в молекуле. Поскольку критические температуры метилового и этилового спиртов близки к 240, наблюдаемое давление при применении в качестве растворителя этилового спирта при 250 оказывается примерно в два раза большим, чем соответствующее давление яри 25, тогда как при использовании диоксана или другого растворителя, для которых температура 250 не лежит столь близко к критической, давление при 250 будет больше давления при 25 только в 1 8 раза, В случае применения в качестве рас творителн этилового спирта получаются, првидимому, лучшш выходы у чем при применении метилового спирта при темпер ату pax, превышающих 200, в то время как при температурах ниж 200 метиловый спирт следует предпочесть этиловому, Есд. Основные или кислые примеси в pea ционной среде могут дезактивировать катализатор. В качеств растворителей при работе с медно-хромовым катализаторе межно применять также предельные углеводороды, однако и i пользование их редко дает какие-либо — преимущества. Во многих случаях выходы, указанные в табл. I-VIII, моп быть, несомненно, улучшены при подборе условий, отвечающ. В конечном итоге наибои бла гоприятными условиями являются следующие. Давлен ] должно быть настолько высоким, насколько это достижш в данных условиях и допустимо при работе в стандартной апп ратуре. Это приводит к максимальной скорости реакции к максимальной степени гидрогенизаций. Исходное давлен должно быть достаточно высоким, для того чтобы, когда бу д достигнута температура реакции, максимальное давление было ( порядка 420 атм. Если проводить работу при температуре 25 то исходное давление должно быть около 245 атм.
Основные или кислые примеси в pea ционной среде могут дезактивировать катализатор. В качеств растворителей при работе с медно-хромовым катализаторе межно применять также предельные углеводороды, однако и i пользование их редко дает какие-либо — преимущества. Во многих случаях выходы, указанные в табл. I-VIII, моп быть, несомненно, улучшены при подборе условий, отвечающ. В конечном итоге наибои бла гоприятными условиями являются следующие. Давлен ] должно быть настолько высоким, насколько это достижш в данных условиях и допустимо при работе в стандартной апп ратуре. Это приводит к максимальной скорости реакции к максимальной степени гидрогенизаций. Исходное давлен должно быть достаточно высоким, для того чтобы, когда бу д достигнута температура реакции, максимальное давление было ( порядка 420 атм. Если проводить работу при температуре 25 то исходное давление должно быть около 245 атм.
[9]
При гидрировании сложных эфиров ненасыщенных кислот связь СС не затрагивается [82], что отличает действие цинк-хромовых катализаторов от медно-хромовых. Взаимодействие СО и водорода на непромотированных цинк-хромовых катализаторах приводит к образованию метанола, а на контактах, промотированных щелочными добавками, происходит также конденсация и образуются, помимо метанола, изобутанол и другие высшие спирты. Удельная производительность ZnO в реакции синтеза метанола существенно выше, чем СгаОз, и примерно равна удельной производительности промышленных цинк-хромовых катализаторов. Важно отметить, что для предшествующих цинку металлов VIII группы ( Fe, Co, Ni) более характерно образование из СО и На углеводородов.
Взаимодействие СО и водорода на непромотированных цинк-хромовых катализаторах приводит к образованию метанола, а на контактах, промотированных щелочными добавками, происходит также конденсация и образуются, помимо метанола, изобутанол и другие высшие спирты. Удельная производительность ZnO в реакции синтеза метанола существенно выше, чем СгаОз, и примерно равна удельной производительности промышленных цинк-хромовых катализаторов. Важно отметить, что для предшествующих цинку металлов VIII группы ( Fe, Co, Ni) более характерно образование из СО и На углеводородов.
[10]
При гидрировании сложных эфиров карбоновых кислот получаются первичные спирты.
[11]
В связи с некоторыми задачами, возникшими перед нашей промышленностью, появилась необходимость подобрать катализатор гидрирования сложных эфиров, нечувствительный к примеси хлорорганических соединений.
[12]
Скорость коррозии металлов и сплавов в технически чистых спиртах.
[13] |
В процессе пуска и освоения цеха производства ВЖС фракций С7 — Со на Салаватском нефтехимкомбинате выявилась низкая коррозионная стойкость технического алюминия А5 ( ГОСТ 1069 — 64), использованного в качестве прокладок в колоннах гидрирования сложных эфиров кислот С7 — Сд и принадлежащих им теплообменников. В колоннах происходит гидрирование эфиров при 240 — 250 С и давлении 300 ат.
[14]
Наиболее важное значение в промышленности имеют процессы гидрирования бензола до циклогексана; альдегидов, алифатических монокарбоновых кислот или их сложных эфиров до соответствующих первичных алифатических спиртов. Гидрирование сложных эфиров дикарбоновых алифатических кислот дает возможность получать гликоли.
[15]
Страницы:
1
2
3. Сложные эфиры. Реакции этерификации и гидролиза сложных эфиров, их механизм. Жиры, их состав. Гидрирование и гидролиз жиров.
Сложные
эфиры — производные кислот, у которых
кислотный водород заменён на алкильные
(или вообще углеводородные) радикалы.
Сложные
эфиры делятся в зависимости от того,
производной какой кислоты они являются
(неорганической или карбоновой).
Среди
сложных эфиров особое место занимают
природные эфиры — жиры и масла, которые
образованы трехатомным спиртом глицерином
и высшими жирными кислотами, содержащими
четное число углеродных атомов. Жиры
входят в состав растительных и животных
организмов и служат одним из источников
энергии живых организмов, которая
выделяется при окислении жиров.
Общая формула
сложных эфиров карбоновых кислот:
где
R и R’ — углеводородные радикалы (в сложных
эфиpax муравьиной кислоты R — атом
водорода).
Общая
формула жиров:
где
R’, R», R»‘
— углеродные радикалы.
Жиры бывают
“простыми” и “смешанными”. В состав
простых жиров входят остатки одинаковых
кислот (т. е. R’ = R» = R'»), в состав
смешанных — различных.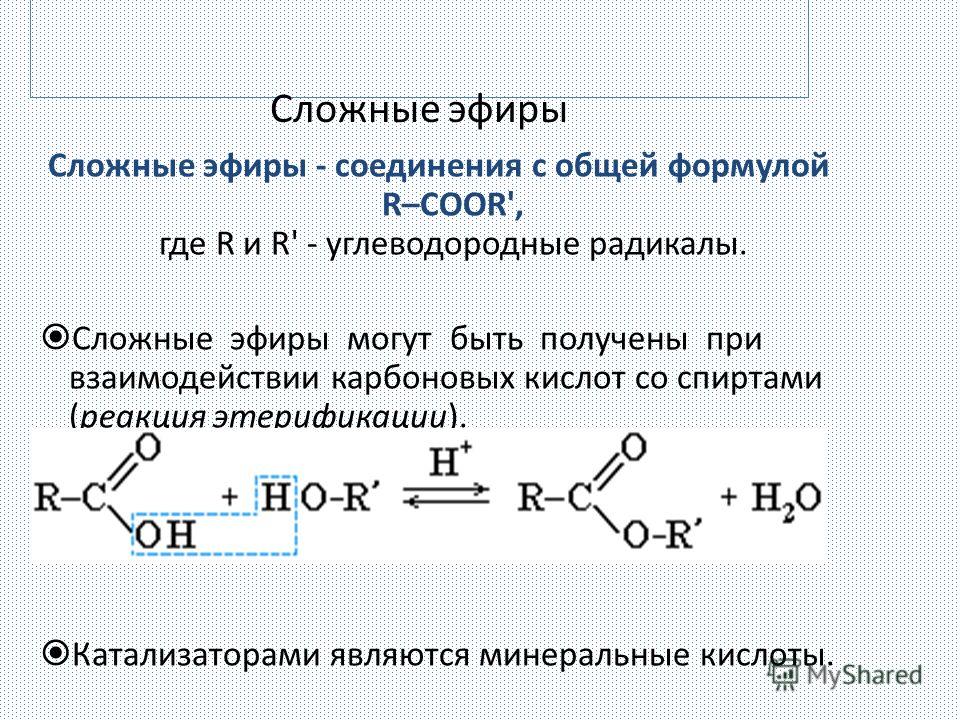
В жирах наиболее
часто встречаются следующие жирные
кислоты:
1.
Масляная кислота СН3
— (CH2)2
— СООН
2.
Капроновая кислота СН3
— (CH2)4
— СООН
3.
Пальмитиновая кислота СН3
— (CH2)14
— СООН
4.
Стеариновая кислота СН3
— (CH2)16
— СООН
5.
Олеиновая кислота С17Н33СООН
СН3—(СН2)7—СН
=== СН—(СН2)7—СООН
6.
Линолевая кислота С17Н31СООН
СН3—(СН2)4—СН
= СН—СН2—СН
= СН—СООН
7.
Линоленовая кислота С17Н29СООН
СН3СН2СН
= CHCH2CH
== CHCH2CH
= СН(СН2)4СООН
Для сложных эфиров
характерны следующие виды изомерии:
1.
Изомерия углеродной цепи начинается
по кислотному остатку с бутановой
кислоты, по спиртовому остатку — с
пропилового спирта, например, этилбутирату
изомерны этилизобутират, пропилацетат
и изопропилацетат.
2.
Изомерия положения сложноэфирной
группировки —СО—О—. Этот вид изомерии
начинается со
сложных эфиров, в молекулах которых
содержится не менее 4 атомов углерода,
например этилацетат и метилпропионат.
3.
Межклассовая изомерия, например,
метилацетату изомерна пропановая
кислота.
Для
сложных эфиров, содержащих непредельную
кислоту или непредельный спирт, возможны
еще два вида изомерии: изомерия положения
кратной связи и цис-, транс-изомерия.
Сложные
эфиры низших карбоновых кислот и спиртов
представляют собой летучие, нерастворимые
в воде жидкости. Многие из них имеют
приятный запах. Так, например, бутилбутират
имеет запах ананаса, изоамилацетат —
груши и т. д.
Сложные эфиры
высших жирных кислот и спиртов —
воскообразные вещества, не имеют запаха,
в воде не растворимы.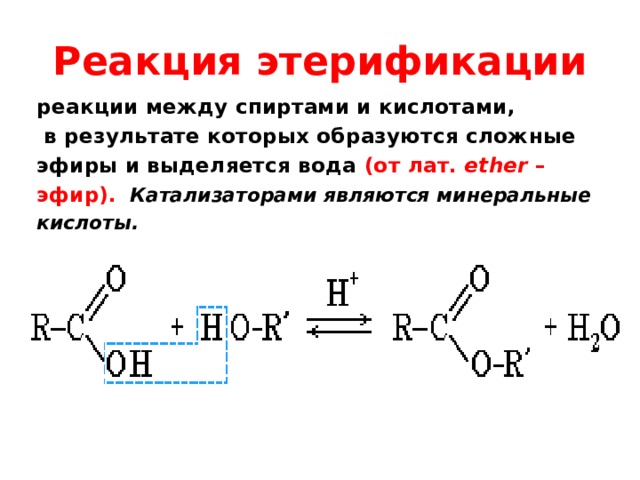
Приятный
аромат цветов, плодов, ягод в значительной
степени обусловлен присутствием в них
тех или иных сложных эфиров.
Жиры
широко распространены в природе. Наряду
с углеводородами и белками они входят
в состав всех растительных и животных
организмов и составляют одну из основных
частей нашей пищи.
По
агрегатному состоянию при комнатной
температуре жиры делятся на жидкие и
твердые. Твердые жиры, как правило,
образованы предельными кислотами,
жидкие жиры (их часто называют маслами)
— непредельными. Жиры растворимы в
органических растворителях и нерастворимы
в воде.
1.
Реакция гидролиза, или омыления. Так,
как реакция этерификации является
обратимой, поэтому в присутствии кислот
протекает обратная реакция гидролиза:
Реакция
гидролиза катализируется и щелочами;
в этом случае гидролиз необратим, так
как получающаяся кислота со щелочью
образует соль:
2. Реакция
Реакция
присоединения. Сложные эфиры, имеющие
в своем составе непредельную кислоту
или спирт, способны к реакциям
присоединения.
3.
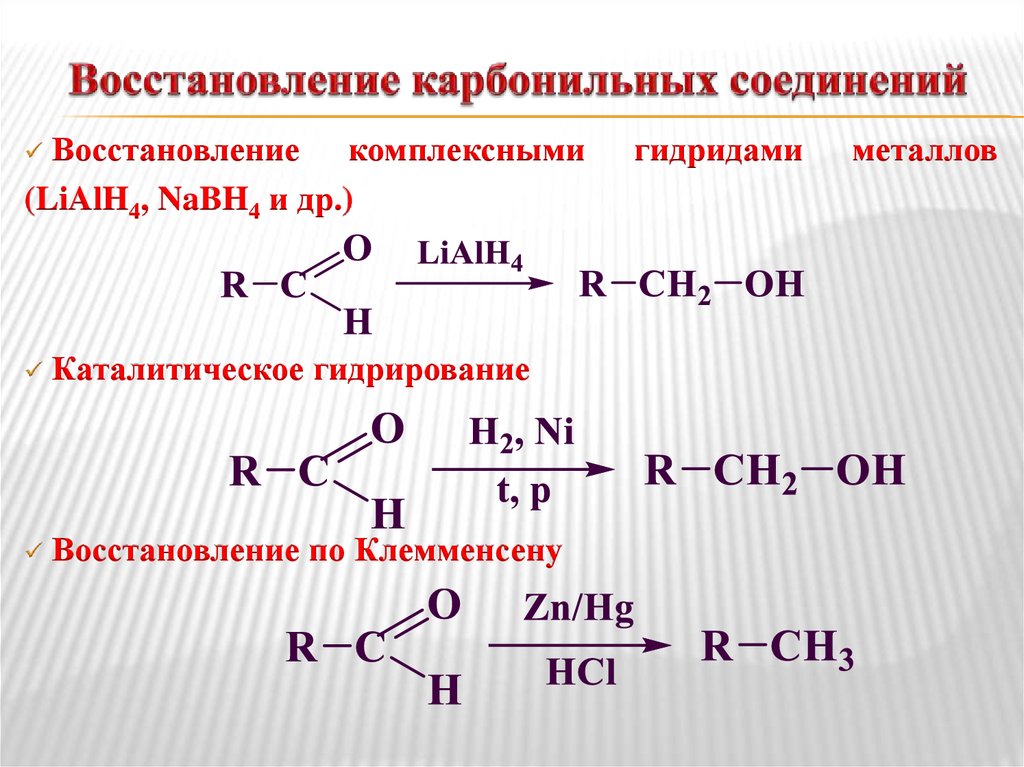
Реакция восстановления. Восстановление
сложных эфиров водородом приводит к
образованию двух спиртов:
4.
Реакция образования амидов. Под действием
аммиака сложные эфиры превращаются в
амиды кислот и спирты:
Получение.
1. Реакция
этерификации:
Спирты вступают
в реакции с минеральными и органическими
кислотами, образуя сложные эфиры. Реакция
обратима (обратный процесс – гидролиз
сложных эфиров).
Реакционная
способность одноатомных спиртов в этих
реакциях убывает от первичных к третичным.
2. Взаимодействием
ангидридов кислот со спиртами:
3. Взаимодействием
галоидангидридов кислот со спиртами:
Механизм гидролиза:
Жидкие
жиры превращаются в твердые путем
реакции гидрогенизации.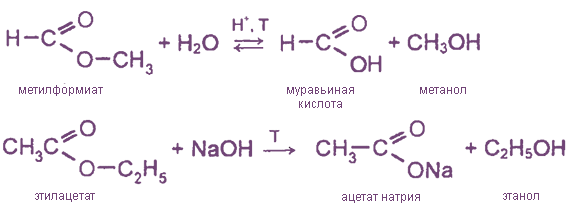 Водород
Водород
присоединяется по месту разрыва двойной
связи в углеводородных радикалах молекул
жиров:
Реакция
протекает при нагревании под давлением
и в присутствии катализатора — мелко
раздробленного никеля. Продукт
гидрогенизации — твердый жир (искусственное
сало), называется саломасом идет на
производство мыла, стеарина и глицерина.
Маргарин — пищевой жир, состоит из смеси
гидрогенизованных масел (подсолнечного,
хлопкового и др.), животных жиров, молока
и некоторых других веществ (соли, сахара,
витаминов и др.).
Важное
химическое свойство жиров, как и всех
сложных эфиров, — способность подвергаться
гидролизу (омылению). Гидролиз легко
протекает при нагревании в присутствии
катализаторов — кислот, щелочей, оксидов
магния, кальция, цинка:
Реакция
гидролиза жиров обратима. Однако при
участии щелочей она доходит практически
до конца — щелочи превращают образующиеся
кислоты в соли и тем самым устраняют
возможность взаимодействия кислот с
глицерином (обратную реакцию).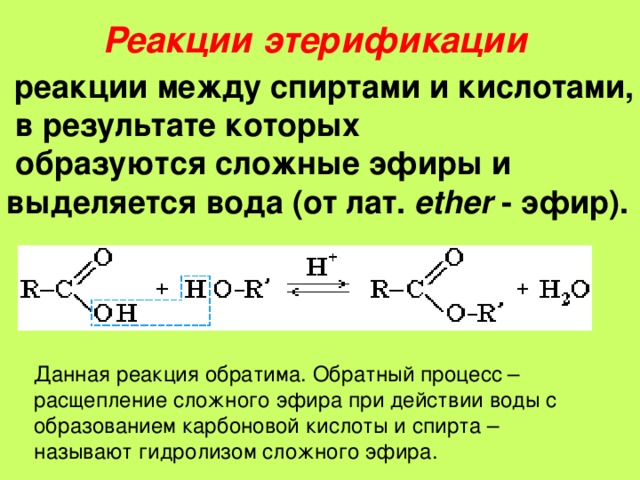
Последние достижения в области гидрирования сложных эфиров на гетерогенных биметаллических катализаторах
Анна А.
Стрекалова, аб
Анастасия А.
Шестеркина
* аб
а также
Леонид М.
Кустов абв
Принадлежности автора
*
Соответствующие авторы
и
Национальный исследовательский технологический университет МИСиС, Ленинский проспект, 4, Москва, Россия
Электронная почта:
anastasiia. [email protected]
[email protected]
б
Зелинский Институт органической химии РАН, Ленинский проспект, 47, Москва, 119991, Россия
с
Химический факультет Московского государственного университета им. М.В. Ломоносова, Ленинские горы, 1/3, Москва 119991, Россия
Аннотация
Монометаллические катализаторы на основе филлосиликатов меди активно изучались в 2000-х годах в качестве альтернативы медно-хромовому катализатору Адкинса в связи с их нетоксичностью и высокой активностью в гидрировании сложных эфиров в мягких условиях реакции.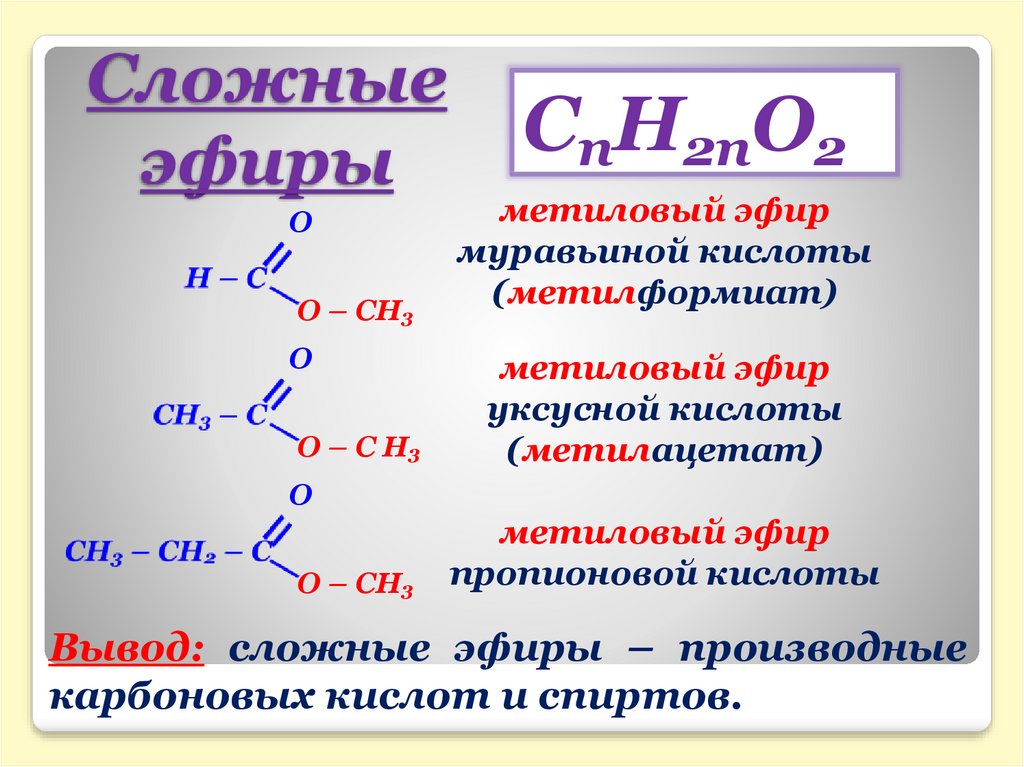 Однако исследования последнего десятилетия показывают, что биметаллические катализаторы на основе медьсодержащих наночастиц являются наиболее перспективными каталитическими системами для гидрирования диэфиров и короткоцепочечных эфиров. Настоящий обзор посвящен изучению взаимодействия второго металла с медьсодержащими наночастицами и влиянию на каталитические характеристики. Сильное взаимодействие второго металла (Ce, Fe, Zn, Pt, Pd, Ag, Au) с наночастицами меди приводит к увеличению TOF, высокой селективности по требуемому спирту и повышению стабильности каталитической системы. Синергетическое взаимодействие второго металла (Ce, Fe, Zn, Pt, Pd, Ag, Au) и наночастиц меди приводит к увеличению TOF, высокой селективности по требуемому спирту и повышенной стабильности каталитической системы. Биметаллические системы на основе благородных металлов являются перспективными катализаторами селективного гидрирования длинноцепочечных эфиров жирных кислот благодаря их повышенной устойчивости к спеканию и высокой эффективности в мягких условиях реакции.
Однако исследования последнего десятилетия показывают, что биметаллические катализаторы на основе медьсодержащих наночастиц являются наиболее перспективными каталитическими системами для гидрирования диэфиров и короткоцепочечных эфиров. Настоящий обзор посвящен изучению взаимодействия второго металла с медьсодержащими наночастицами и влиянию на каталитические характеристики. Сильное взаимодействие второго металла (Ce, Fe, Zn, Pt, Pd, Ag, Au) с наночастицами меди приводит к увеличению TOF, высокой селективности по требуемому спирту и повышению стабильности каталитической системы. Синергетическое взаимодействие второго металла (Ce, Fe, Zn, Pt, Pd, Ag, Au) и наночастиц меди приводит к увеличению TOF, высокой селективности по требуемому спирту и повышенной стабильности каталитической системы. Биметаллические системы на основе благородных металлов являются перспективными катализаторами селективного гидрирования длинноцепочечных эфиров жирных кислот благодаря их повышенной устойчивости к спеканию и высокой эффективности в мягких условиях реакции. Таким образом, разработка и исследование высокоэффективных катализаторов гидрирования сложных эфиров, обеспечивающих высокую активность и селективность образования соответствующих спиртов, является актуальной задачей современного гетерогенного катализа.
Таким образом, разработка и исследование высокоэффективных катализаторов гидрирования сложных эфиров, обеспечивающих высокую активность и селективность образования соответствующих спиртов, является актуальной задачей современного гетерогенного катализа.
Исследования в OIST — Метатезис сложных эфиров и переносное гидрирование сложных эфиров
Метатезис сложных эфиров
Пока я разрабатывал химию сочетания спиртов Виттига, что-то, что было предложено Дэвидом (Мильштейном, постдокторским боссом https://www.weizmann .ac.il/Organic_Chemistry/milstein/) должен был попробовать реакцию илида вместе со сложным эфиром в присутствии катализатора дегидрирования. Была мысль достать какой-нибудь каталитический реагент Теббе, но это было маловероятно и нереально. Результат, который я увидел, был неожиданным, а также не очень интересным с точки зрения химии реактивов Виттига и Теббе. Большая часть олефинового продукта образуется с алкоксильной частью сложного эфира, а также немного с ацильной частью сложного эфира. Реакция была не такой селективной при использовании несимметричных сложных эфиров, и даже при использовании симметричного сложного эфира, такого как этилацетат, выход был ниже, чем при использовании только чистого этанола. Интересно, что при использовании несимметричного эфира, такого как этилгексаноат, я обнаружил немного гексилацетата и гексилгексаноата в кривых ГХ.
Реакция была не такой селективной при использовании несимметричных сложных эфиров, и даже при использовании симметричного сложного эфира, такого как этилацетат, выход был ниже, чем при использовании только чистого этанола. Интересно, что при использовании несимметричного эфира, такого как этилгексаноат, я обнаружил немного гексилацетата и гексилгексаноата в кривых ГХ.
Изображение реагента Теббе взято из Википедии
Реальная полезность реактива Теббе, вероятно, связана с селективным алкилированием ацильной части сложного эфира и образованием виниловых эфиров таким образом
Некоторые неожиданные продукты, наблюдаемые в ГХ при взаимодействии илида и эфира в присутствии катализатора дегидрирования Ru
Приступая к работе в лаборатории OIST, я решил пересмотреть этот интересный результат и реакцию сложного эфира в отсутствие илида, чтобы увидеть, смогу ли я получить аналогичный тип скремблирования сложного эфира. В то время я предположил, что сложный эфир образовался в результате некоторого разложения, которое позволило образовать комплекс дигидрида Ru, который является промежуточным продуктом, часто обнаруживаемым ЯМР в реакционных смесях, и считается состоянием покоя катализатора. Как только это было сформировано и резервуара, обеспечивающего водород, было достаточно, спирты могли быть получены из сложного эфира с помощью катализатора и немедленно дегидрированы обратно в сложный эфир, перемешивая его по пути. Все предыдущие отчеты о гидрировании сложных эфиров требовали давления водорода не менее 5 атмосфер для образования связанных спиртов, поэтому казалось маловероятным, что я увижу здесь такой процесс метатезиса, но небольшие пики, которые я видел на кривых ГХ/МС во время Проект Виттига вселял некоторую надежду.
В то время я предположил, что сложный эфир образовался в результате некоторого разложения, которое позволило образовать комплекс дигидрида Ru, который является промежуточным продуктом, часто обнаруживаемым ЯМР в реакционных смесях, и считается состоянием покоя катализатора. Как только это было сформировано и резервуара, обеспечивающего водород, было достаточно, спирты могли быть получены из сложного эфира с помощью катализатора и немедленно дегидрированы обратно в сложный эфир, перемешивая его по пути. Все предыдущие отчеты о гидрировании сложных эфиров требовали давления водорода не менее 5 атмосфер для образования связанных спиртов, поэтому казалось маловероятным, что я увижу здесь такой процесс метатезиса, но небольшие пики, которые я видел на кривых ГХ/МС во время Проект Виттига вселял некоторую надежду.
В литературе упоминаются различные катализаторы, обладающие хорошей активностью в гидрировании сложных эфиров, но требующие давления водорода. В данной работе использовались Kuriyama 2012 (PNP), Gusev 2012 (PNN) и Gusev 2013 (SNS), причем последний оказался наиболее активным, и только первый и третий были активны в чистой химии метатезиса
Сначала чтобы иметь достаточно водородного резервуара и не разлагать эфир (в то время я думал, что, возможно, катализатор просто образует олефин путем дегидрирования рядом с ацильным фрагментом), я добавил к этилгексаноату около 100% этанола и бросил в 1 моль % катализатора и 2-3 моль % KOtBu в дейтерированном бензоле.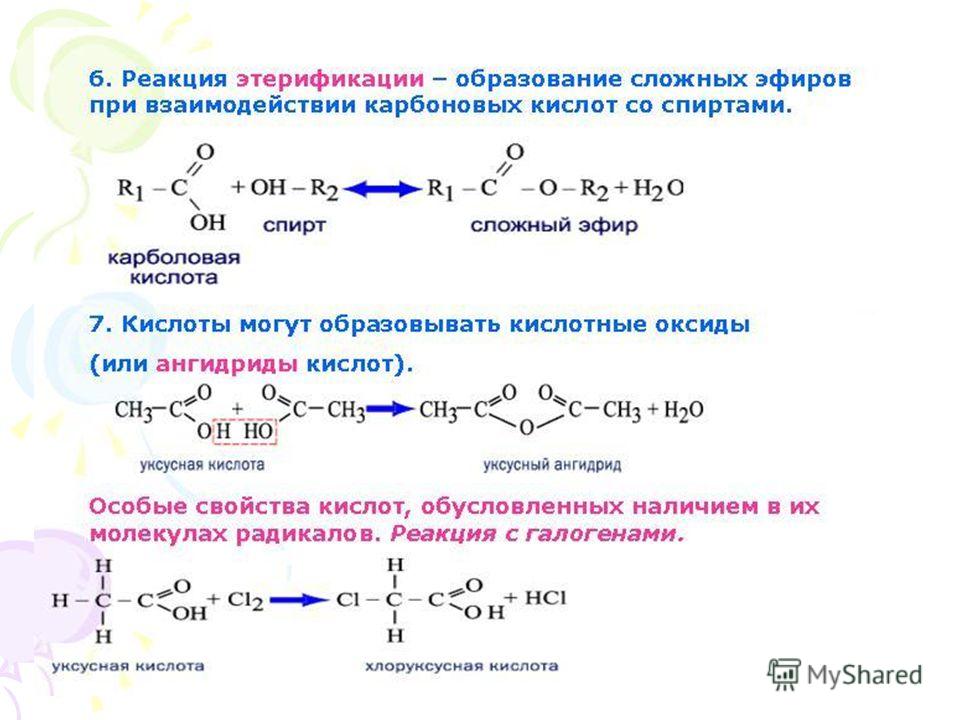 Таким образом, можно было нагреть реакцию и проследить ее с помощью ЯМР. Катализатор представлял собой коммерчески доступный катализатор Takasago MACHO. Теперь, когда я действительно не был в группе Мильштейна, мне не хотелось использовать катализатор Мильштейна, так как его (бипиридильный) труднее изготовить. И MACHO, вы просто делаете заказ онлайн, в то время как бипиридил Мильштейна, используемый для сочетания Виттига, не был коммерчески доступен (я недавно сделал много лиганда, так что это не сложно, но это просто занятая работа).
Таким образом, можно было нагреть реакцию и проследить ее с помощью ЯМР. Катализатор представлял собой коммерчески доступный катализатор Takasago MACHO. Теперь, когда я действительно не был в группе Мильштейна, мне не хотелось использовать катализатор Мильштейна, так как его (бипиридильный) труднее изготовить. И MACHO, вы просто делаете заказ онлайн, в то время как бипиридил Мильштейна, используемый для сочетания Виттига, не был коммерчески доступен (я недавно сделал много лиганда, так что это не сложно, но это просто занятая работа).
Метатезис этилгексаноата с этанолом в качестве суррогатного источника водорода
Логика сработала, и я действительно увидел некоторое количество гексилацетата, гексилгексаноата и этилацетата вместе с исходным материалом. В то же время я также видел довольно много гексанола. В этом не было ничего удивительного, так как лишний этанол, который я влил в начале, участвовал в реакции, и если он образовывал ацильную часть какого-то эфира, часть эфира, который был там изначально, должна была превратиться в спирт. Тем не менее, эти результаты были обнадеживающими, потому что они тут же показали, что для гидрирования сложного эфира не обязательно иметь большое давление водорода (может быть, меньше 1 атм). Следующее, что нужно было сделать, это уменьшить объем резервуара водорода (этанола), чтобы избежать образования гексанола, и вместо этого иметь как можно больше чистых сложных эфиров. Реакцию оказалось возможным провести даже при 50% этаноле в эфире. Затем оказалось возможным использовать 10% этанола в эфире, при этом образуется очень мало побочного продукта гексанола и вместо этого образуется много сложного эфира. Затем я провел контрольный эксперимент, абсолютно не добавляя этанол, и реакция все еще работала. Это было удивительно. Почему это могло бы работать в отсутствие какого-либо источника водорода вообще?
Тем не менее, эти результаты были обнадеживающими, потому что они тут же показали, что для гидрирования сложного эфира не обязательно иметь большое давление водорода (может быть, меньше 1 атм). Следующее, что нужно было сделать, это уменьшить объем резервуара водорода (этанола), чтобы избежать образования гексанола, и вместо этого иметь как можно больше чистых сложных эфиров. Реакцию оказалось возможным провести даже при 50% этаноле в эфире. Затем оказалось возможным использовать 10% этанола в эфире, при этом образуется очень мало побочного продукта гексанола и вместо этого образуется много сложного эфира. Затем я провел контрольный эксперимент, абсолютно не добавляя этанол, и реакция все еще работала. Это было удивительно. Почему это могло бы работать в отсутствие какого-либо источника водорода вообще?
Метатезис вообще без источника водорода. Соотношения в конце были очень близки к 25,0 %. Что было более важным, так это то, что субстраты, которые не могли образовывать олефины, также были реакционноспособными в реакции скремблирования.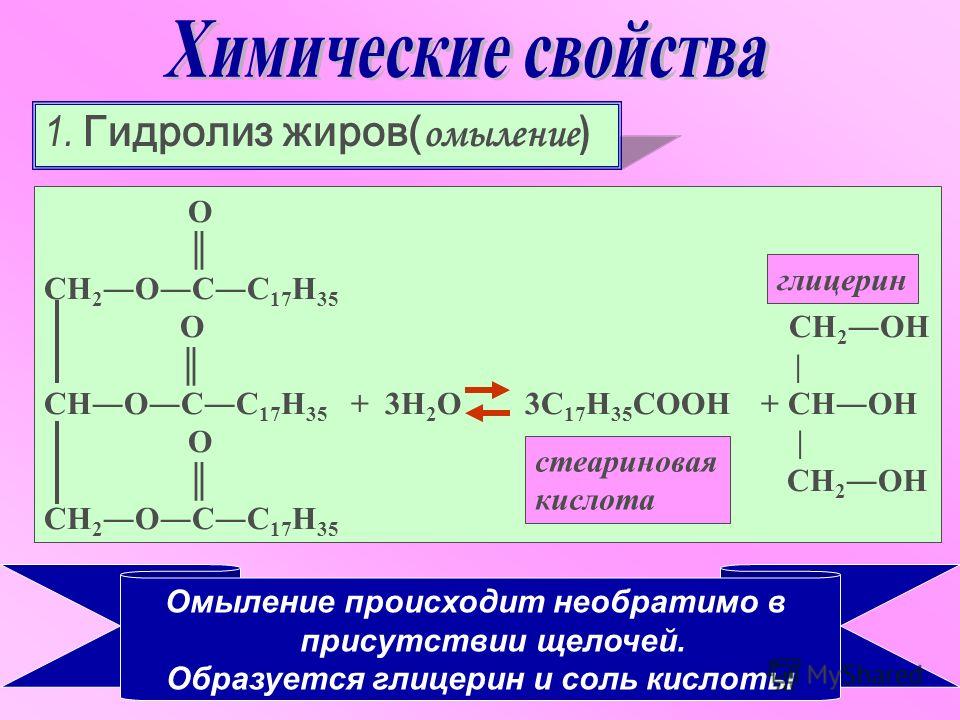 Субстрат, такой как, например, толилбензоат. Это означало, что катализатор смешивал сложный эфир сам по себе, без необходимости в дополнительном водороде. К этому времени в лаборатории стали доступны некоторые другие катализаторы по мере поступления поставок и установки перчаточного ящика, поэтому я протестировал еще несколько имеющихся в продаже катализаторов. С MACHO потребовалось очень много времени, чтобы отреагировать, и я начал использовать 5 моль%, чтобы получить быстрый метатезис эфира (статистическое распределение всех четырех возможных эфиров) через один день. Катализатор Мильштейна, который имеется в продаже, немного отличается от того, который я использовал в химии сочетания Виттига, но он тоже разочаровал. Два катализатора Гусева были коммерчески доступны от Aldrich. Одна клещевая PNN и одна SNS, которые оказались очень необычными, поскольку не имели донора фосфина, а также сообщалось, что они намного более активны, чем MACHO, в гидрировании сложных эфиров. Первый на основе PNN был полностью неактивен в скремблировании/метатезе этилгексаноата, но на самом деле на основе SNS оказался более активным, чем MACHO в метатезе.
Субстрат, такой как, например, толилбензоат. Это означало, что катализатор смешивал сложный эфир сам по себе, без необходимости в дополнительном водороде. К этому времени в лаборатории стали доступны некоторые другие катализаторы по мере поступления поставок и установки перчаточного ящика, поэтому я протестировал еще несколько имеющихся в продаже катализаторов. С MACHO потребовалось очень много времени, чтобы отреагировать, и я начал использовать 5 моль%, чтобы получить быстрый метатезис эфира (статистическое распределение всех четырех возможных эфиров) через один день. Катализатор Мильштейна, который имеется в продаже, немного отличается от того, который я использовал в химии сочетания Виттига, но он тоже разочаровал. Два катализатора Гусева были коммерчески доступны от Aldrich. Одна клещевая PNN и одна SNS, которые оказались очень необычными, поскольку не имели донора фосфина, а также сообщалось, что они намного более активны, чем MACHO, в гидрировании сложных эфиров. Первый на основе PNN был полностью неактивен в скремблировании/метатезе этилгексаноата, но на самом деле на основе SNS оказался более активным, чем MACHO в метатезе.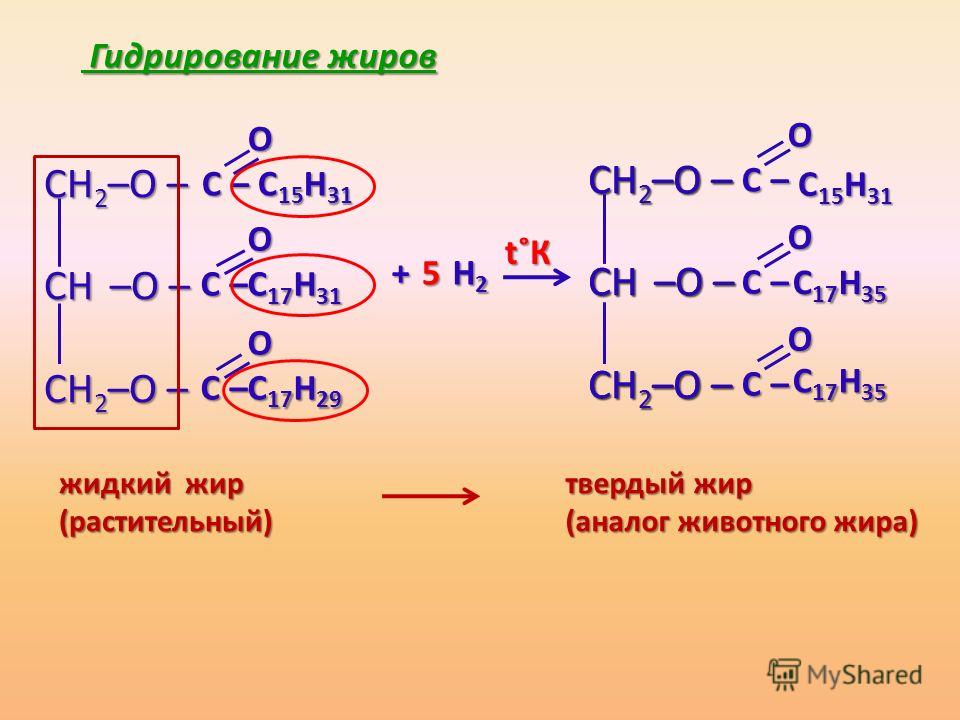 Теперь я мог уйти с 1 моль% и получить статистическое скремблирование через 1 день при 80 o C.
Теперь я мог уйти с 1 моль% и получить статистическое скремблирование через 1 день при 80 o C.
Метатезис толилбензоата, который не может быть дегидрирован с образованием олефина
Катализаторы, до некоторой степени активные в реакции метатезиса сложных эфиров, имели, однако, одну общую черту. Они были чрезвычайно чувствительны к типу субстрата. Реагировать могли только сложные эфиры углеводородов. Если бы был гетероатом, такой как галогенид, реакция не происходила бы. Кроме того, реакция не происходила, если субстратом был метиловый эфир, такой как метилгексаноат или метилбензоат (или формиат). Он просто установился в трубке ЯМР, даже если загрузка катализатора составляла 5 мол.%.
К сожалению, ограниченный объем чистой реакции метатезиса
Конечно, сложные эфиры — это не то же самое, что олефины (из более известного метатезиса олефинов). Одно из наиболее очевидных отличий заключается в том, что несимметричные олефины, которые могут образоваться, например, в результате скремблирования 2-октена, оба будут 2-октеном, одной и той же молекулой (есть некоторые более тонкие детали, такие как E/Z-изомерия, но большинство катализаторов будут селективны в отношении олефинов Е), причем различаются только симметричные продукты, такие как 2-бутен и 6-додецен. Однако для сложного эфира несимметричные продукты скремблирования этилгексаноата будут другими, в отличие от случая с олефином. У нас должно получиться равное соотношение этилгексаноата и гексилацетата, которые имеют разные физические свойства. Это означает, что энергии двух продуктов немного отличаются, и мы должны ожидать небольшой разницы в их соотношении. Теперь, для простого эфира с углеродной цепью различия между двумя возможными положениями ацильной группы не будут такими значительными, но для сложного эфира, такого как, например, этилбензоат, имеющего ацильную группу, сопряженную с ароматическим кольцом, будет внести существенную разницу. Я сделал быстрый расчет DFT и, конечно же, этилбензоат имеет свободную энергию Гиббса, которая примерно на ~ 2 ккал / моль меньше, чем у бензилацетата. Взяв симметричные сложные эфиры этилацетата и гексилгексаноата, сложив их энергии и разделив на два, чтобы сравнить их напрямую, мы также получим значение на ~ 1 ккал / моль меньше, чем у бензилацетата.
Однако для сложного эфира несимметричные продукты скремблирования этилгексаноата будут другими, в отличие от случая с олефином. У нас должно получиться равное соотношение этилгексаноата и гексилацетата, которые имеют разные физические свойства. Это означает, что энергии двух продуктов немного отличаются, и мы должны ожидать небольшой разницы в их соотношении. Теперь, для простого эфира с углеродной цепью различия между двумя возможными положениями ацильной группы не будут такими значительными, но для сложного эфира, такого как, например, этилбензоат, имеющего ацильную группу, сопряженную с ароматическим кольцом, будет внести существенную разницу. Я сделал быстрый расчет DFT и, конечно же, этилбензоат имеет свободную энергию Гиббса, которая примерно на ~ 2 ккал / моль меньше, чем у бензилацетата. Взяв симметричные сложные эфиры этилацетата и гексилгексаноата, сложив их энергии и разделив на два, чтобы сравнить их напрямую, мы также получим значение на ~ 1 ккал / моль меньше, чем у бензилацетата.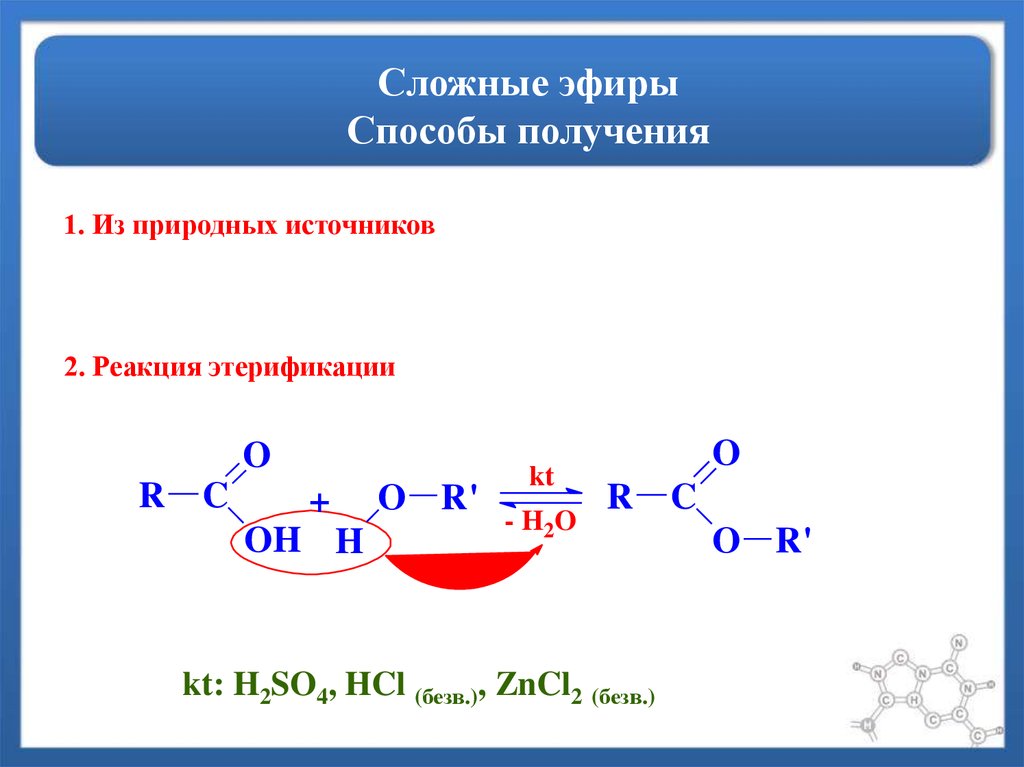
Сравнение сложных эфиров и олефинов. Первый и третий олефины представляют собой одно и то же соединение, но первый и третий эфир будут разными.
Это означает, что если мы возьмем бензилацетат и добавим наш катализатор Гусева SNS, который я теперь стал называть «катализатором метатезиса», то мы должны получить больше других продуктов, в зависимости от времени, которое мы оставь их карабкаться. Количество TON, необходимое для достижения статистического равновесия, становится все больше и больше по мере приближения к этой точке равновесия, и это усугубляется низкой разницей энергий между исходным материалом и реагентами, но, тем не менее, через некоторое время мы должны увидеть этот эффект. Действительно, через 1 день я действительно увидел значительно больше этилбензоата, чем исходный материал (около 7:3), я думаю, но я решил прекратить это прямо сейчас, так как ждал около недели, чтобы получить 9Соотношение :1 не было действительно необходимо для моих целей. Еще одна вещь, на которую мы могли обратить внимание в этой реакции, — это скорость появления продуктов. Интересно, что вначале появились только симметричные эфиры этилацетат и бензилбензоат, хотя они на ~1 ккал/моль выше по энергии, чем этилбензоат. Потребовалось очень много времени, чтобы действительно самый стабильный продукт начал появляться. Через день это был основной компонент, но это никак не отражалось на начальном значении. Упрощенный механизм, который мы придумали, чтобы объяснить это, заключался в том, что катализатор участвовал в прямом переворачивании ацильной и алкоксигрупп эфира на первой стадии, а высвобождение этоксигруппы приводило к образованию симметричного эфира путем взаимодействие с пулом бензилацетата, имеющимся в реакционной колбе. Другой партнер, или бензокси, заберет бензоат обратно от катализатора, чтобы сформировать другого симметричного партнера. Это означает, что скорость появления симметричных сложных эфиров будет одинаковой и через некоторое время быстро замедлится, так как в конце концов, когда образуется достаточно большой их пул, этокси может реагировать со свободным бензилбензоатом с образованием наиболее стабильный продукт, который, как мы действительно видим, медленно появляется после достаточно длительного времени реакции.
Еще одна вещь, на которую мы могли обратить внимание в этой реакции, — это скорость появления продуктов. Интересно, что вначале появились только симметричные эфиры этилацетат и бензилбензоат, хотя они на ~1 ккал/моль выше по энергии, чем этилбензоат. Потребовалось очень много времени, чтобы действительно самый стабильный продукт начал появляться. Через день это был основной компонент, но это никак не отражалось на начальном значении. Упрощенный механизм, который мы придумали, чтобы объяснить это, заключался в том, что катализатор участвовал в прямом переворачивании ацильной и алкоксигрупп эфира на первой стадии, а высвобождение этоксигруппы приводило к образованию симметричного эфира путем взаимодействие с пулом бензилацетата, имеющимся в реакционной колбе. Другой партнер, или бензокси, заберет бензоат обратно от катализатора, чтобы сформировать другого симметричного партнера. Это означает, что скорость появления симметричных сложных эфиров будет одинаковой и через некоторое время быстро замедлится, так как в конце концов, когда образуется достаточно большой их пул, этокси может реагировать со свободным бензилбензоатом с образованием наиболее стабильный продукт, который, как мы действительно видим, медленно появляется после достаточно длительного времени реакции. Количественное измерение немного усложняется тем, что при 60 o C этилацетат имеет тенденцию накапливаться на верхних стенках ЯМР-трубки в небольшой степени, но это нормально для достаточно точного приближения. По крайней мере, этот возможный механизм (см. схему ниже) довольно хорошо объясняет кинетику.
Количественное измерение немного усложняется тем, что при 60 o C этилацетат имеет тенденцию накапливаться на верхних стенках ЯМР-трубки в небольшой степени, но это нормально для достаточно точного приближения. По крайней мере, этот возможный механизм (см. схему ниже) довольно хорошо объясняет кинетику.
Как эксперимент по кинетике ЯМР выглядит в реальной жизни (преобразование Фурье во временной области)
Данные для пиков, построенные для сравнения данных о концентрации продуктов
Возможные механизмы. Верхний путь активен в отсутствие какого-либо источника водорода, а второй путь становится активным, когда присутствует источник водорода, что объясняет нашу переносную гидрогенизирующую активность, описанную ниже
. Это также объясняет, почему катализатор действительно чувствителен к функциональным группам. . У нас есть центр Ru, каким-то образом удерживающий ацил, и это может быть очень реактивный вид. И никакого источника водорода вокруг. Таким образом, в основном будут работать только углеводороды, которые не могут генерировать метанол (и, следовательно, CO, отравляющий катализатор). В то время мне было все равно, потому что я думал, что это отличный результат. Это была настоящая метатезис. Разве это не отличный результат, который был так же хорош, как и метатезис олефинов, но здесь мы сталкиваемся с совершенно новой функциональной группой? Я говорил об этом всем, и хотя это попало бы в хороший журнал. Должен признаться, что в то время я лелеял иллюзию даже опубликовать ее в журнале Science. Я старался держать их в секрете, насколько это было возможно, потому что в глубине души у вас всегда есть мысль, что вы действительно опозоритесь, если скажете это вслух (умное мышление в ретроспективе), но я мог бы рассказать нескольким людям…
И никакого источника водорода вокруг. Таким образом, в основном будут работать только углеводороды, которые не могут генерировать метанол (и, следовательно, CO, отравляющий катализатор). В то время мне было все равно, потому что я думал, что это отличный результат. Это была настоящая метатезис. Разве это не отличный результат, который был так же хорош, как и метатезис олефинов, но здесь мы сталкиваемся с совершенно новой функциональной группой? Я говорил об этом всем, и хотя это попало бы в хороший журнал. Должен признаться, что в то время я лелеял иллюзию даже опубликовать ее в журнале Science. Я старался держать их в секрете, насколько это было возможно, потому что в глубине души у вас всегда есть мысль, что вы действительно опозоритесь, если скажете это вслух (умное мышление в ретроспективе), но я мог бы рассказать нескольким людям…
В конце концов, я поговорил с несколькими профессорами, которые сказали мне, что нет, то, что у меня есть, не так уж интересно, если не считать небольшого любопытства.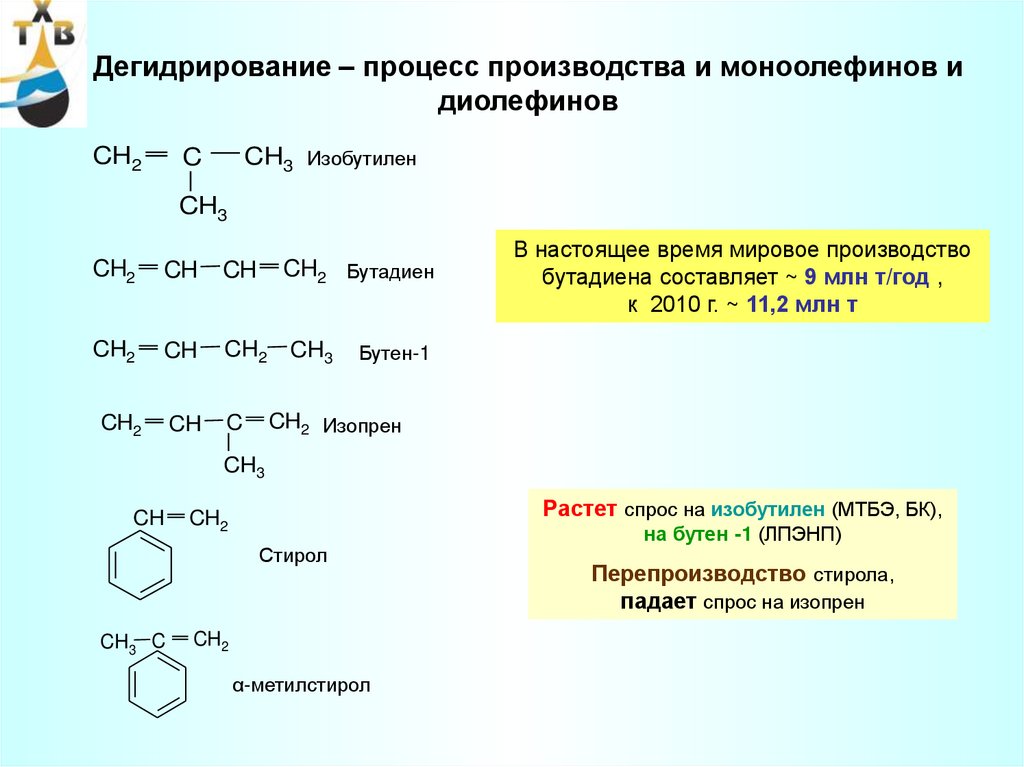
«Это совершенно новая реакция! Вы просто берете несимметричный сложный эфир, и катализатор превращает ацильную группу в спирт, а спирт в ацил. Вы получаете четыре продукта в статистическом отношении точно так же, как при метатезисе олефинов!»
«Да, но метатезис олефинов на самом деле полезен, потому что вы получаете один продукт. Вы можете сделать это выборочно».
«Нет, не избирательно! В этом весь смысл. Это статистическая помойка. Но она избирательна в том смысле, что если они возьмут 1-октен, то в конечном итоге получат этилен и тетрадекан. А этилен — это газ, поэтому он просто улетает, и у вас остается только тетрадецен».
«Как видите, он селективен в отношении тетрадецена».
«Но сама реакция не избирательна! Он управляется равновесием, когда вы удаляете один из продуктов! Когда впервые было сообщено о метатезе олефинов, они не сообщали о какой-либо селективности, это была просто интересная реакция, в результате которой олефины перемешивались».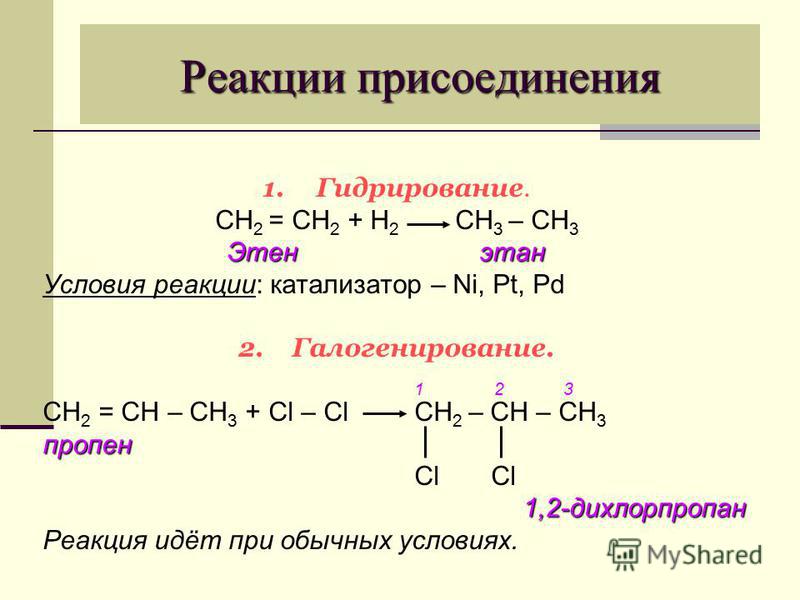
«Во-первых, я не уверен, что это правда, но можете ли вы проявить избирательность по отношению к одному из ваших эфиров?»
«Ну, если я использую бензилацетат, я получаю немного больше этилбензоата, потому что он более стабилен, но он никогда не достигнет 100% этого продукта. В лучшем случае может быть около 50% после очень долгого времени реакции, поскольку этилацетат и бензилбензоат близки по энергии…»
«Послушай, это просто непрактично. С помощью метатезиса олефинов вы можете создавать полимеры, и он устойчив к функциональным группам. Он используется в фармацевтической промышленности при синтезе некоторых лекарств».
«Вы знаете, есть полиэфиры. Причина, по которой они могут делать полимеры из чего-то вроде циклооктена, заключается в том, что вы образуете этилен, и он улетает, поэтому они просто форсируют равновесие. По своей сути это не избирательная реакция. Они используют этот трюк Ле Шателье. Если бы у меня было что-то подобное, я мог бы получить и селективность, но для меня метокси просто не работает с этими катализаторами, а с этокси я получаю этилацетат, который имеет высокую температуру кипения. Если я начну кипячение с обратным холодильником только для того, чтобы избавиться от этилацетата, будет беспорядок, поскольку он снова конденсируется, а катализатор очень чувствителен, поэтому открытая система орошения вредна для него, так как что-то может попасть внутрь и убить его. И знаете что, держу пари, что первый зарегистрированный метатезис олефинов также не был толерантным к функциональным группам».
Если я начну кипячение с обратным холодильником только для того, чтобы избавиться от этилацетата, будет беспорядок, поскольку он снова конденсируется, а катализатор очень чувствителен, поэтому открытая система орошения вредна для него, так как что-то может попасть внутрь и убить его. И знаете что, держу пари, что первый зарегистрированный метатезис олефинов также не был толерантным к функциональным группам».
«Это правда из первых отчетов? Я не уверен, что вы проверяли. Может ли ваш катализатор сделать полиэфир?
«Ну, полиэстер сделан из лактона, но он просто полимеризуется сам по себе с какой-то основой. Есть сообщения о совершенно новом, необычном комплексе или необычной трансформации, превращающей его в JACS. Когда я был аспирантом, кто-то сообщил о первом в истории трансферном гидрировании алканов с Pt-катализатором. У них было всего 1,3 оборота, и было немного сомнительно, может быть, это был не какой-то артефакт, а поскольку это была первая реакция, она попала в JACS».
«Я думаю, что ваша реакция интересна, но в эти дни вы должны показать какую-то пользу. Это может попасть в небольшой журнал само по себе.
Конечно, после получения таких негативных новостей о реакции, которая вас очень волнует, возникает тенденция защищаться. Но я очень хорошо усвоил во время своего постдока, что вы можете застрять, думая, что ваша химия действительно хороша, и обнаружить, что внешнему миру это не кажется таким. Это верно не только в случае, когда вы разрабатываете новый смартфон, создающий 3D-голограммы, которые, как выясняется, никто не хочет покупать, потому что вы не занимаетесь исследованием рынка, а пользователи больше заботятся о времени автономной работы. пытается опубликовать в JACS или Angewandte. Здесь немного по-другому, так как все-таки это химия и объективно вы можете быть правы. Конечно, вы также можете ошибаться, и это гораздо более вероятно, если вы всего лишь один человек, не согласный с множеством других химиков. В конечном счете, если вы идете против общего мнения о том, какой тип химии интересен и ценен для других химиков, вы не будете публиковаться в этих журналах. Вы должны провести исследование рынка, и вы не можете злиться на клиента, если он скажет вам что-то, чего вы не хотели слышать (жаловаться на клиента в баре в пятницу вечером — это, конечно, совсем другое дело). ).
Вы должны провести исследование рынка, и вы не можете злиться на клиента, если он скажет вам что-то, чего вы не хотели слышать (жаловаться на клиента в баре в пятницу вечером — это, конечно, совсем другое дело). ).
Перенос гидрирования сложных эфиров
Итак, вернемся к чертежной доске, к моей ныне бесполезной и столь презираемой реакции метатезиса сложных эфиров. Чертежная доска была в основном в моей голове, и она говорила: «Разве у вас не было такого набора реакций, когда вы пытались оптимизировать это раньше, до того, как вы сделали контрольную реакцию? Что-то вроде: «Итак, следующее, что нужно сделать, это уменьшить объем резервуара водорода (этанола), чтобы избежать производства гексанола и вместо этого получить как можно больше чистого эфира». Верно. Я получал побочный продукт гексанол, если был источник водорода, такой как этанол, который брал в себя ацильную группу и образовывал этилацетат. Что, если бы у меня было много этанола? Смогу ли я просто образовать гексанол в каком-то переносном гидрировании сложных эфиров по новому механизму?
Реакция, которая натолкнула меня на мысль о возможности переносного гидрирования сложных эфиров
На самом деле оказалось, что переносное гидрирование сложных эфиров не происходит легко ни по какому механизму. Был только что вышедший обзор по трансферному гидрированию под названием «Золотой век трансферного гидрирования», но сложные эфиры там не упоминались. Незадолго до этого вышла статья, в которой утверждалось первое сообщение о трансферном гидрировании. Но в лучшем случае они могли получить 9TON с активированным вторичным алкокси и действительно высокой загрузкой катализатора. В качестве источника водорода они использовали изопропанол. Это означает, что ацетон образуется по мере поглощения ацильной группы для получения спирта из сложного эфира. Немного подумав об этом, я предположил, что энергия получения кетона из сложного эфира и образования первичного спирта из вторичного должна быть выше. Если я использую этанол и получаю этилацетат, я меняю один тип эфира на другой. Я буду энергетически нейтральным или, в худшем случае, на пару килокалорий. Я должен быть в состоянии подавить эту разницу в энергии с достаточным количеством этанола. Я попробовал это с 10 эквивалентами этанола в этилгексаноат, и это сработало.
Был только что вышедший обзор по трансферному гидрированию под названием «Золотой век трансферного гидрирования», но сложные эфиры там не упоминались. Незадолго до этого вышла статья, в которой утверждалось первое сообщение о трансферном гидрировании. Но в лучшем случае они могли получить 9TON с активированным вторичным алкокси и действительно высокой загрузкой катализатора. В качестве источника водорода они использовали изопропанол. Это означает, что ацетон образуется по мере поглощения ацильной группы для получения спирта из сложного эфира. Немного подумав об этом, я предположил, что энергия получения кетона из сложного эфира и образования первичного спирта из вторичного должна быть выше. Если я использую этанол и получаю этилацетат, я меняю один тип эфира на другой. Я буду энергетически нейтральным или, в худшем случае, на пару килокалорий. Я должен быть в состоянии подавить эту разницу в энергии с достаточным количеством этанола. Я попробовал это с 10 эквивалентами этанола в этилгексаноат, и это сработало.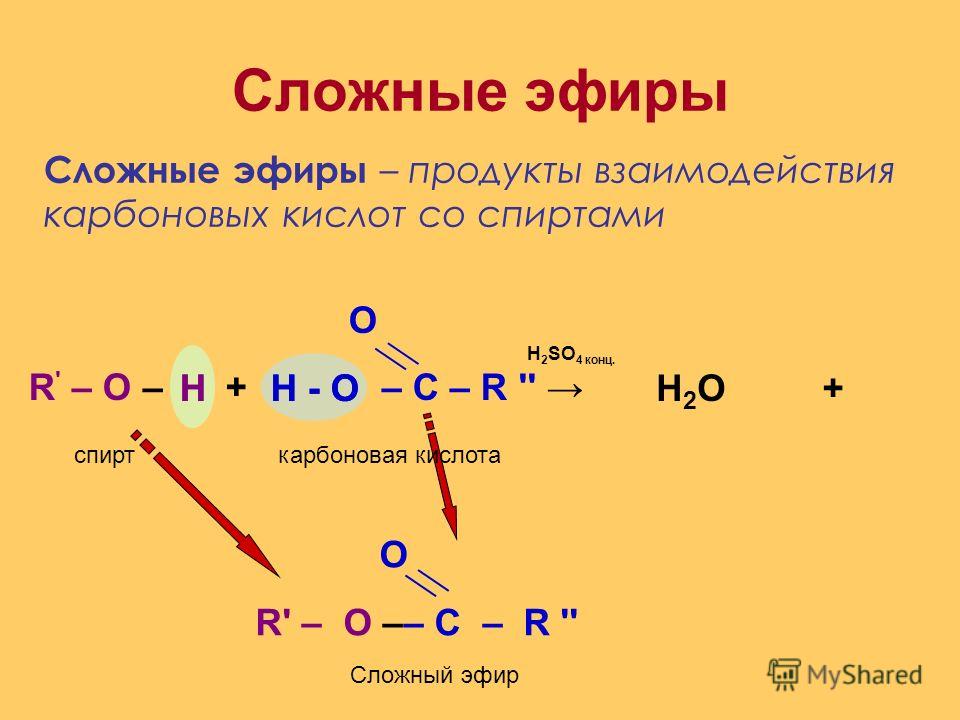 С помощью ЯМР и ГХ я увидел целую кучу свободного гексанола. Часть его была связана с гексилацетатом или гексилгексаноатом, но большая часть определенно была гексанолом.
С помощью ЯМР и ГХ я увидел целую кучу свободного гексанола. Часть его была связана с гексилацетатом или гексилгексаноатом, но большая часть определенно была гексанолом.
Единственный предыдущий отчет о трансферном гидрировании сложных эфиров вышел в прошлом году. Результат далек от практического, но он показывает, что это может быть возможно
В это время я убедил одного из постдоков Джулии, Абхишека Дубея, помочь мне в свободное время, сказав, что проект займет всего чуть-чуть (наш обычный трюк в торговле) и он может быстро сделать это на стороне, не влияя на его работу в группе Хуснутдиновой, если она не против. Это привело бы к очень хорошей публикации о первом в истории «(практическом) трансферном гидрировании сложных эфиров», которая была бы опубликована в каком-нибудь крупном журнале и была бы полезна для его карьеры и т. д.…
Abhi оптимизировал реакцию и построил несколько калибровочных кривых для ГХ/ПИД. Мы выяснили, что лучше всего проводить реакцию в толуоле, но использовать 20 эквивалентов этанола. Еще чуть-чуть и катализатора стало слишком много, и он начал сильно тормозить. 10 эквивалентов означали, что теоретический выход гексанола был ограничен ~90%, а практически мы могли ожидать ~80%. После успеха с этилгексаноатом мы предварительно опробовали его с другими субстратами, которые не прошли метатезис сложных эфиров. И такие вещи, как метилгексаноат и даже сложные эфиры с функциональными группами, только начали работать. Я предположил, что это потому, что в присутствии источника водорода механизм был другим, и мы можем получить этот транс-дигидридный комплекс. Предполагаемый механизм — это то, что я предполагал с самого начала, когда у нас есть транс-дигидрид, образованный из этанола, и он гидрирует целевой эфир.
Еще чуть-чуть и катализатора стало слишком много, и он начал сильно тормозить. 10 эквивалентов означали, что теоретический выход гексанола был ограничен ~90%, а практически мы могли ожидать ~80%. После успеха с этилгексаноатом мы предварительно опробовали его с другими субстратами, которые не прошли метатезис сложных эфиров. И такие вещи, как метилгексаноат и даже сложные эфиры с функциональными группами, только начали работать. Я предположил, что это потому, что в присутствии источника водорода механизм был другим, и мы можем получить этот транс-дигидридный комплекс. Предполагаемый механизм — это то, что я предполагал с самого начала, когда у нас есть транс-дигидрид, образованный из этанола, и он гидрирует целевой эфир.
Допуск по функциональным группам включает все, что не участвует в традиционной химии сочетания амина и спирта. Таким образом, первичные и вторичные амины исключены, но третичные амины переносятся хорошо. Пиридиновые кольца тоже подходят, так как они не так сильно связываются с рутением. Мы также попытались гидрогенизировать некоторые сложные эфиры жирных кислот, и хотя были некоторые признаки того, что это сработало, выходы длинноцепочечных спиртов были не такими высокими. Я полагаю, что на самом деле это было в основном вызвано растворимостью, поскольку мы могли видеть белые шарики этого сложного эфира жирной кислоты, подпрыгивающие внутри горячей реакционной колбы толуол / этанол. Есть что улучшить в будущем.
Мы также попытались гидрогенизировать некоторые сложные эфиры жирных кислот, и хотя были некоторые признаки того, что это сработало, выходы длинноцепочечных спиртов были не такими высокими. Я полагаю, что на самом деле это было в основном вызвано растворимостью, поскольку мы могли видеть белые шарики этого сложного эфира жирной кислоты, подпрыгивающие внутри горячей реакционной колбы толуол / этанол. Есть что улучшить в будущем.
Таблица субстратов, активных в переносном гидрировании (определенно не исчерпывающий список). Трилинолеат разочаровал, но, вероятно, это связано с проблемами растворимости
В любом случае, теперь у меня наконец-то появилось что-то практичное, и завод обратной связи сообщил мне, что у меня есть шанс с JACS, пока я могу понять механизм. На данный момент я просто сказал, что хватит, так как многие люди публикуют с предварительным механизмом, когда реакция достаточно велика, и здесь у нас есть две совершенно новые реакции, одна из которых является своего рода практической.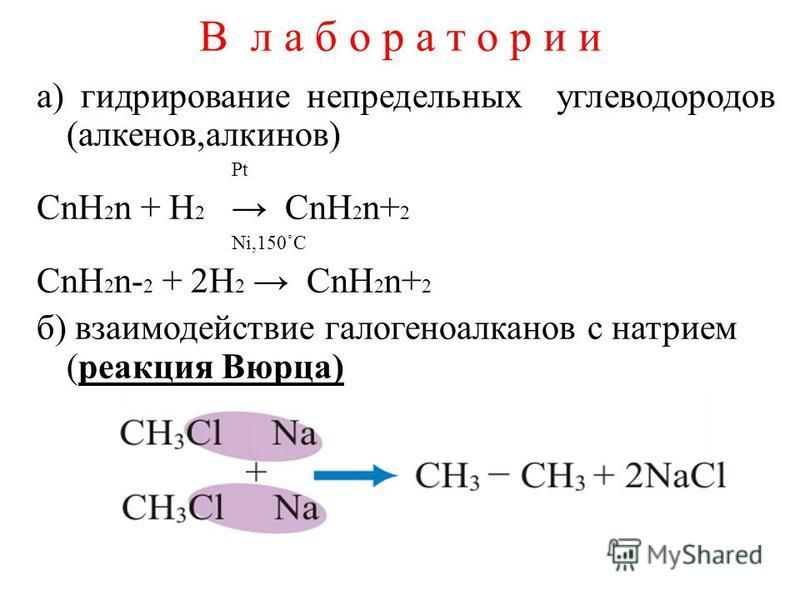 Конечно, мы проигнорируем тот факт, что даже 9Выход 0% означает, что вместо этого вам может быть лучше работать с газообразным водородом под давлением, важна концепция первого в истории гидрирования сложных эфиров с переносом.
Конечно, мы проигнорируем тот факт, что даже 9Выход 0% означает, что вместо этого вам может быть лучше работать с газообразным водородом под давлением, важна концепция первого в истории гидрирования сложных эфиров с переносом.
Итак, я отправил документ, но он был отклонен после проверки из-за сумасшедшего и не очень правдоподобного механизма. Теперь, чтобы быть справедливым, первый механизм, который я нарисовал, действительно имел вид формиата Ru (который действительно существует в литературе в кристаллизованной форме, но только в одной статье), и рецензент заявил, что это маловероятно. Мы изменили некоторые из самых сумасшедших частей для нашего перехода на ACS Catalysis, и после следующего раунда проверки они были приняты там.
Дубей, А. Хаскин, Э. 2016, ACS Catalysis, 3998-4002.
Хотя я получил несколько положительных отзывов о статье и несколько восторженных отзывов (думаю, она достигла среднего уровня ACS Catalysis), она не оказала того огромного влияния, на которое я рассчитывал.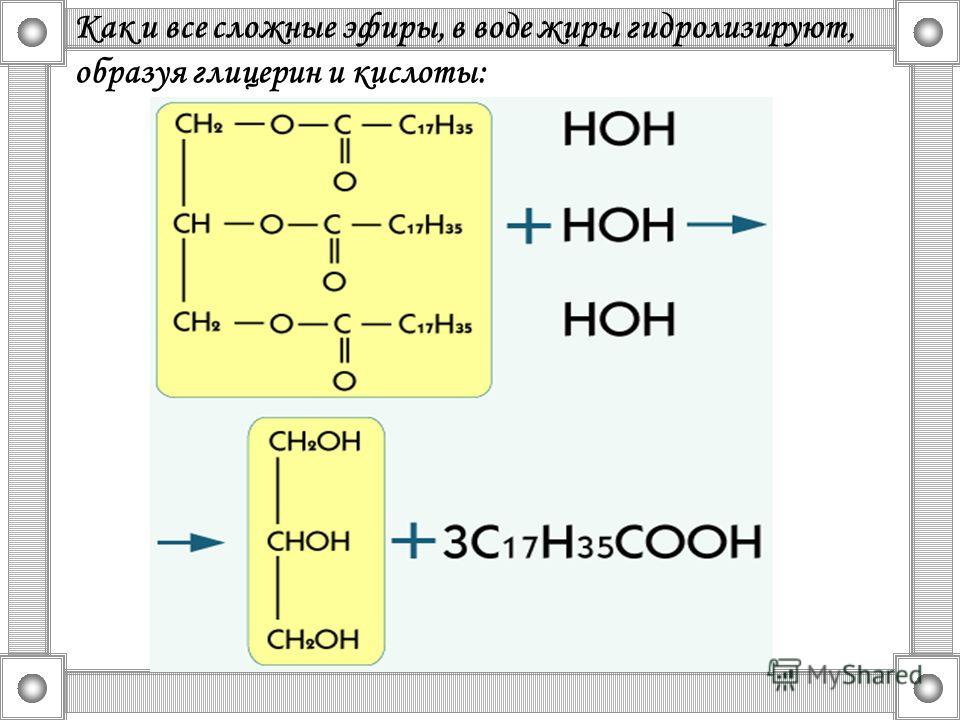 Я думаю, это правда, что даже если это новая реакция, если она никому не нужна, никто не будет ее цитировать. Тем не менее, когда я впервые рисую кому-то реакцию метатезиса эфира на бумаге, они смотрят и говорят, что это невозможно, а потом говорят, что это действительно необычно. Так что от этого можно получить некоторое удовлетворение.
Я думаю, это правда, что даже если это новая реакция, если она никому не нужна, никто не будет ее цитировать. Тем не менее, когда я впервые рисую кому-то реакцию метатезиса эфира на бумаге, они смотрят и говорят, что это невозможно, а потом говорят, что это действительно необычно. Так что от этого можно получить некоторое удовлетворение.
Я надеялся улучшить процесс метатезиса за счет более селективного действия спирта в качестве акцептора ацильной группы, но не было альтернативы, которая была бы достаточно дешевой и могла бы привести реакцию к очень высоким выходам. Вам лучше использовать этанол, и если единственный способ получить селективное образование 99% спирта из вашего сложного эфира — это несколько эквивалентов очень дорогого акцептора спирта, то вам, вероятно, лучше подойдет газообразный водород. Что может помочь, так это катализатор, который работает даже быстрее, чем катализатор Гусева SNS. Тогда мы могли бы избежать загрузки большего количества этанола в систему и по-прежнему получать высокие выходы спирта через 1 день.