Содержание
Урок по теме «Сложные эфиры.Жиры.»
УРОК ХИМИИ В 10 КЛАССЕ
по теме: «Сложные эфиры. Жиры»
,
учитель химии ГОУ Луганской Народной Республики
«Краснолучская школа№4» Поляница Надежда Павловна
Цель: формирование представлений о сложных эфирах и наиболее важных представителей этого класса – жирах.
Задачи:
— обучающие:
знать о строении и свойствах сложных эфиров и жиров;
уметь осуществлять и составлять уравнение реакции этерификации;
иметь представление об областях применения жира и мыла;
— развивающие:
развивать коммуникативные действия и приёмы диалогической речи; умение анализировать, сравнивать, делать выводы и умозаключения;
развивать познавательный интерес, творческие способности, уверенность в своих силах, настойчивость.
владеть способами взаимоконтроля и самоконтроля при выполнении заданий;
— воспитательные:
создать условия для развития самостоятельности, реализации творческой активности, умения самостоятельно находить решение поставленной проблемы
Планируемые результаты:
Знать:
химические понятия: функциональная группа
важнейшие вещества и материалы: пальмитиновая, стеариновые кислоты, сложные эфиры, жиры, мыла.
Уметь:
называть кислородсодержащие орг. вещества по международной номенклатуре;
определять принадлежность органических веществ к определенному классу;
характеризовать общие химические свойства кислородсодержащих орг. веществ,
объяснять зависимость физических и химических свойств веществ от их строения
выполнять химический эксперимент по распознаванию веществ ;
проводить самостоятельный поиск химической информации с использованием различных источников, использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах
Оборудование и реактивы.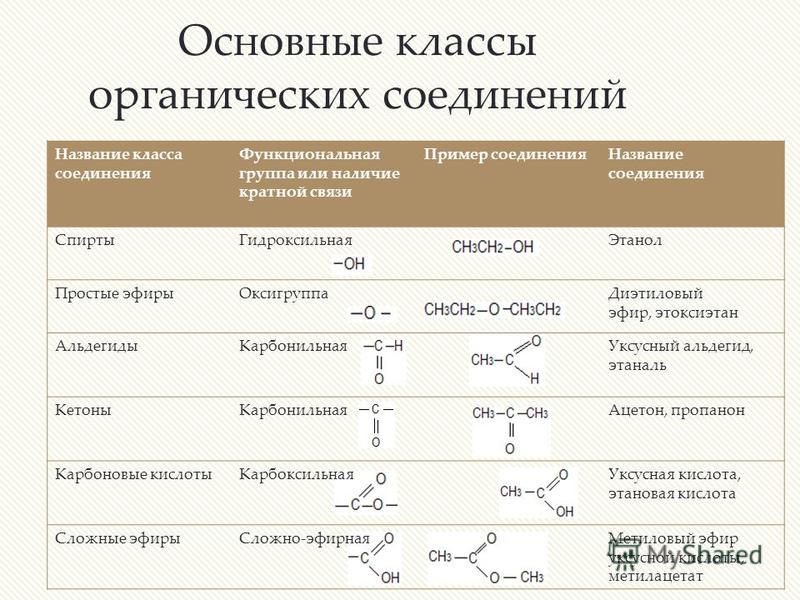
На демонстрационном столе: бутылка подсолнечного масла, пачка маргарина, свеча, мыло, пачка сливочного масла, бутылка олифы.
На столах учащихся: пробирки, вода, бензин, раствор КMnO4, подсолнечное масло.
Форма организации работы – групповая
Тип урока: формирование новых знаний.
Структура и ход урока:
№ | Этап урока | Содержание | Деятельность учителя | Деятельность ученика | Время, мин. |
1 | Организационный момент | . | Приветствует учащихся | Приветствуют учителя | 1 |
2 | Ориентировочно-мотиваци-онный | 1 Рассказываю притчу: Гуляя в тенистой роще, греческий мудрец беседовал со своим учеником. Сегодня наш урок мы начнем такими словами (на доске): «Химия везде, химия во всем: Все вещества, которые у меня на демонстрационном столе, – подсолнечное масло, маргарин, свеча, мыло, сливочное масло, олифа – мы используем в своей повседневной жизни. 2. Наш сегодняшний урок по теме: «Сложные эфиры. Жиры» постараемся рассмотреть с позиций собственного «Я». Мы сегодня будем искать интересующие нас знания по теме урока . Запишите тему урока. 3. Как вы думаете, что мы будем делать с вами в течение урока, чтобы изучить данную тему? По какому плану пойдёт изучение темы? | Эмоционально мобилизует на активную работу Формулирует тему урока. Направляет на формулировку цели урока. | Настраиваются на работу Предлагают варианты ответов Записывают тему Формулируют цель урока. | 10 |
3 | Информационно-поисковый | 1. Задание: соотнесите общие формулы веществ и названия классов (спирт, простой эфир, карбоновая кислота, сложный эфир). 2. Предположите реакцию получения сложного эфира из спирта и карбоновой кислоты. Она называется — этерификация. Как вы думаете, сложные эфиры могут реагировать с водой? 3. Свойства сложных эфиров: жидкость с запахом, горючи. Распространение в природе. Проделайте опыт. 4. Почему жиры изучают вместе со сложными эфирами? Жиры – сложные эфиры глицерина (многоатомного спирта) и высших карбоновых кислот (более 10 атомов углерода в молекуле). Какие ассоциации у вас вызывает слово жир? 5. Какие вы знаете жиры в природе? Приведите примеры. Какое происхождение имеет маргарин? 6. Изучение жира проводил в первой половине XIX в. французский химик Мишель Эжен Шеврель, когда изучал состав мыла. Мыло – соль жирных кислот, которую получают щелочным гидролизом жира. | Выводит учащихся на вывод о строении формулы сложного эфира. Направляет учащихся на выводы. Демонстрирует опыты Предлагает проблемный вопрос. Даёт определение. Схема «Животные и растительные жиры». Предлагает найти области применения жира и мыла. | Сравнивают формулы, находят сходство и отличие. Дают определение сложного эфира. Делают вывод об обратимости реакции этерификации. Делают вывод о свойствах. Предполагают сходство в строении. Проводят аналогии между жиром и сложными эфирами Вывод о предельном и непредельном строении. Записывают в тетрадь области применения веществ. | 20 |
4 | Обобщение и систематизация | Вам предлагаются тестовые вопросы по материалу урока. | Объясняет задание, наблюдает. | Отвечают на вопросы, производят самооценку. | 7 |
5 | Рефлексия | сегодня я узнал… я попробую… урок дал мне для жизни… «БУКЕТ НАСТРОЕНИЯ» Предложить учащимся расставить цветы в вазу красный – есть проблема, нужна помощь; желтый – не все понятно; зеленый – все хорошо. | Формулирует вопросы, помогает с ответами. | Отвечают на вопросы. | 4 |
6 | Домашнее задание | Сделайте анализ усвоения пройденной темы. | Предлагает выбрать задание. | Выбирают вариант задания исходя из личных предпочтений. | 2 |
7 | Итог урока | Организованно заканчивает урок, благодарит учащихся за активную работу. | Выходят из класса. | 1 |
Приложение(объяснение учителя)
Жиры – это сложные эфиры глицерина и высших карбоновых кислот (стеариновой, пальмитиновой, линоленовой, олеиновой и др.). Синтез одного из жиров (тристеарина) можно представить схемой:
По происхождению жиры подразделяют на животные и растительные.
К животным жирам относят свиной и говяжий жиры, барсучье сало, жиры млекопитающих, рыбий жир.
Растительные жиры называют маслами. Известны соевое, подсолнечное, оливковое, облепиховое, кокосовое и другие масла.
В составе животных жиров преобладают остатки предельных кислот, а в составе растительных – остатки непредельных кислот.
Остатки карбоновых кислот могут быть одинаковыми (простые жиры) или различными (смешанные жиры).
По физическим свойствам жиры – легкоплавкие, твердые или жидкие вещества. Жиры нерастворимы в воде, зато хорошо растворяются в органических растворителях (ацетон, керосин, бензин).
Проведите лабораторный опыт и посмотрите, происходит ли растворение жира (подсолнечного масла) в холодной воде, бензине и ацетоне.
Жиры не имеют точки плавления и плавятся в широком интервале температур. При высоких температурах жиры разлагаются. Плотность жиров меньше 1 г/мл, они бывают различными по окраске, впитывают запахи других веществ.
Химические свойства жиров определяются их принадлежностью к классу сложных эфиров.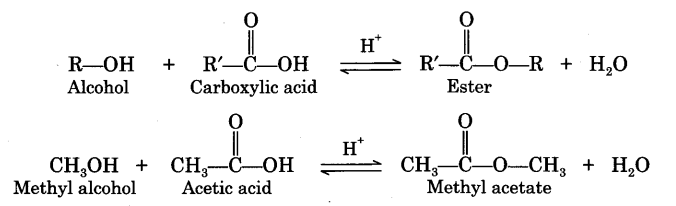 Поэтому наиболее характерная реакция жиров – гидролиз. Непредельные жиры могут вступать в реакцию окисления, например окисляются кислородом воздуха.
Поэтому наиболее характерная реакция жиров – гидролиз. Непредельные жиры могут вступать в реакцию окисления, например окисляются кислородом воздуха.
Реакция гидролиза жиров:
Уравнение реакции гидрирования жиров:
Тест
Презентация «История открытия жиров»
Лекция 9. Карбоновые кислоты. Сложные эфиры — Студопедия
Поделись
Органическая химия.
Тема: ««Кислородсодержащие органические соединения»
Лекция 9. Карбоновые кислоты. Сложные эфиры.
План.
1.Карбоксильная группа. Классификация карбоновых кислот. Гомологический ряд предельных одноосновных кислот: номенклатура, изомерия.
2. Строение карбоксильной группы
3. Физические и химические свойства уксусной кислоты.
4. Получение, применение уксусной кислоты.
5. Строение и номенклатура сложных эфиров.
6. Свойства сложных эфиров, применение.
7. Получение, нахождение в природе, применение.
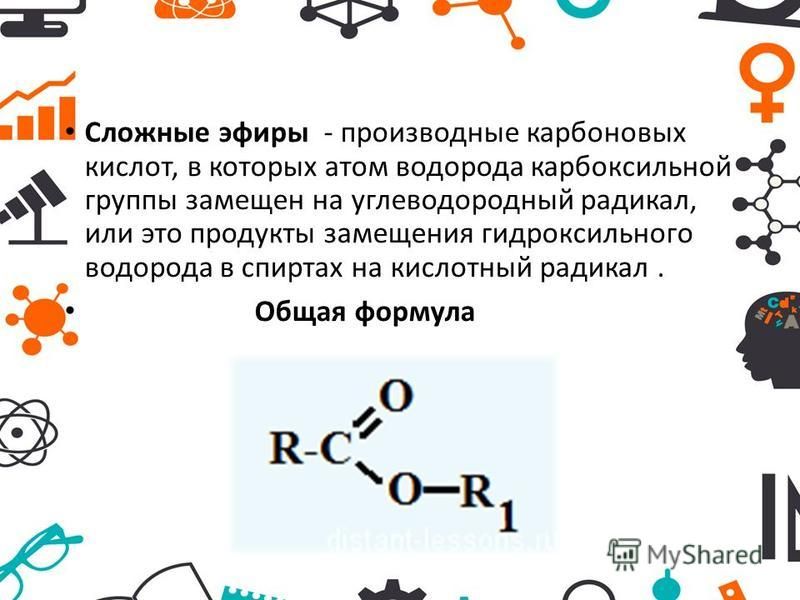
1. Карбоновые кислоты – это карбонильные соединения, в которых карбонил (группа =С=О) и гидроксогруппа (группа –ОН) находятся у одного атома углерода.
-СООН
Такую функциональную группу, характерную для карбоновых кислот называют карбоксильной. В зависимости от числа карбоксильных групп различают одноосновные и многоосновные кислоты. По характеру радикала кислоты делят на предельные, непредельные и ароматические кислоты. В природе кислоты могут встречаться в свободном состоянии, но чаще встречаются в виде сложных эфиров и других производных.
Гомологический ряд предельных одноосновных кислот.Атом углерода, который входит в карбоксильную группу является первичным, т.е. эта функциональная группа может находиться только на конце углеродной цепи. Точнее в начале, потому что эта функциональная группа является самой главной, она всегда обозначается в названии суффиксом «-овая кислота».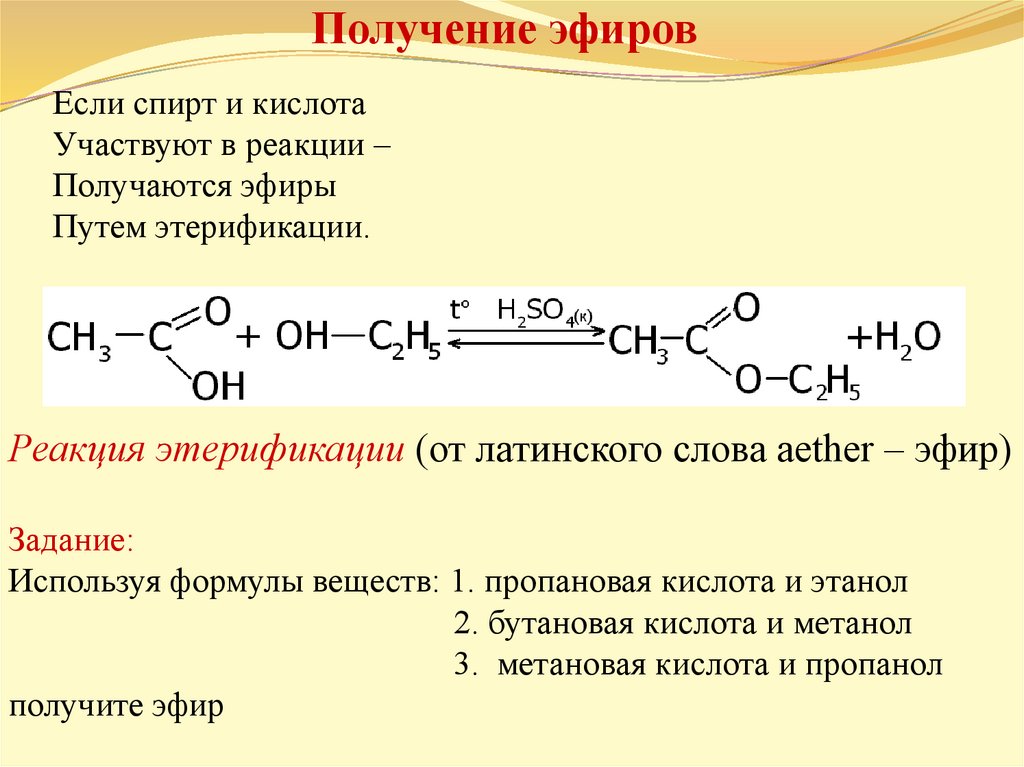 Кроме систематических названий для первых представителей ряда широко используют тривиальные названия. Для предельных одноосновныхкислот нет изомерии положения функциональной группы, есть только изомерия углеродного скелета и межклассовая изомерия со сложными эфирами.
Кроме систематических названий для первых представителей ряда широко используют тривиальные названия. Для предельных одноосновныхкислот нет изомерии положения функциональной группы, есть только изомерия углеродного скелета и межклассовая изомерия со сложными эфирами.
Например:
Метановая (муравьиная) кислота; Этановая (уксусная кислота; Пропановая (пропионовая) кислота;
Бутановая (масляная) кислота …
2.
Особенности строения карбоксильной группы. Взаимное влияние карбонильной и гидроксогруппы приводит к изменению их свойств. Влияние гидроксогруппы на карбонильную группу проявляется в том, что в результате смещения избытка электронной плотности кислорода к карбонильному атому углерода уменьшается положительный заряд на нем. Значит, реакции присоединения по двойной связи, которые характерны для карбонильных соединений, для карбоновых кислот становятся нехарактерны. Влияние карбонильной группы на гидроксогруппу проявляется в том, что благодаря положительному заряду карбонильного атома углерода происходит смещение электронной плотности от группы ОН.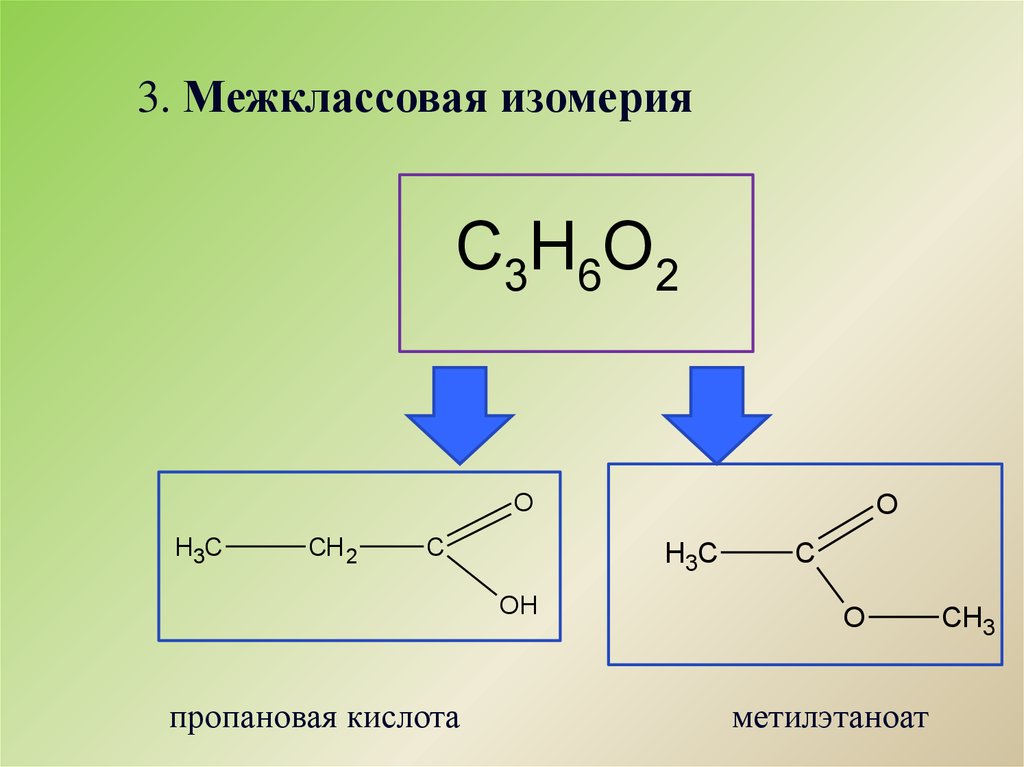 Это способствует увеличению полярности связи между водородом и кислородом и уменьшает полярность связи углерода с кислородом. Т.е. облегчается разрыв связи О-Н карбоксильной группы. А значит появляются кислотные свойства, которые связаны с возможностью отщепления протона. Остается возможен и разрыв связи между углеродом и гидроксогруппой. Но эта реакция проходит хуже, чем у спиртов.
Это способствует увеличению полярности связи между водородом и кислородом и уменьшает полярность связи углерода с кислородом. Т.е. облегчается разрыв связи О-Н карбоксильной группы. А значит появляются кислотные свойства, которые связаны с возможностью отщепления протона. Остается возможен и разрыв связи между углеродом и гидроксогруппой. Но эта реакция проходит хуже, чем у спиртов.
3. Физический свойства предельных одноосновных кислот. Между молекулами кислоты, благодаря группам ОН, образуются многочисленные водородные связи. Поэтому газов среди кислот нет, у них аномально высокие температуры кипения. У муравьиной кислоты около 100 , а для уксусной – 118 Температура кристаллизации уксусной кислоты 16,6 , поэтому абсолютную уксусную кислоту называют ледяной. Низшие представители предельных одноосновных кислот являются подвижными жидкостями, неограниченно растворимы в воде, имеют характерный запах. Начиная с валериановой (пентановой) кислоты, это маслянистые жидкости, ограничено растворимые, имеют характерный запах.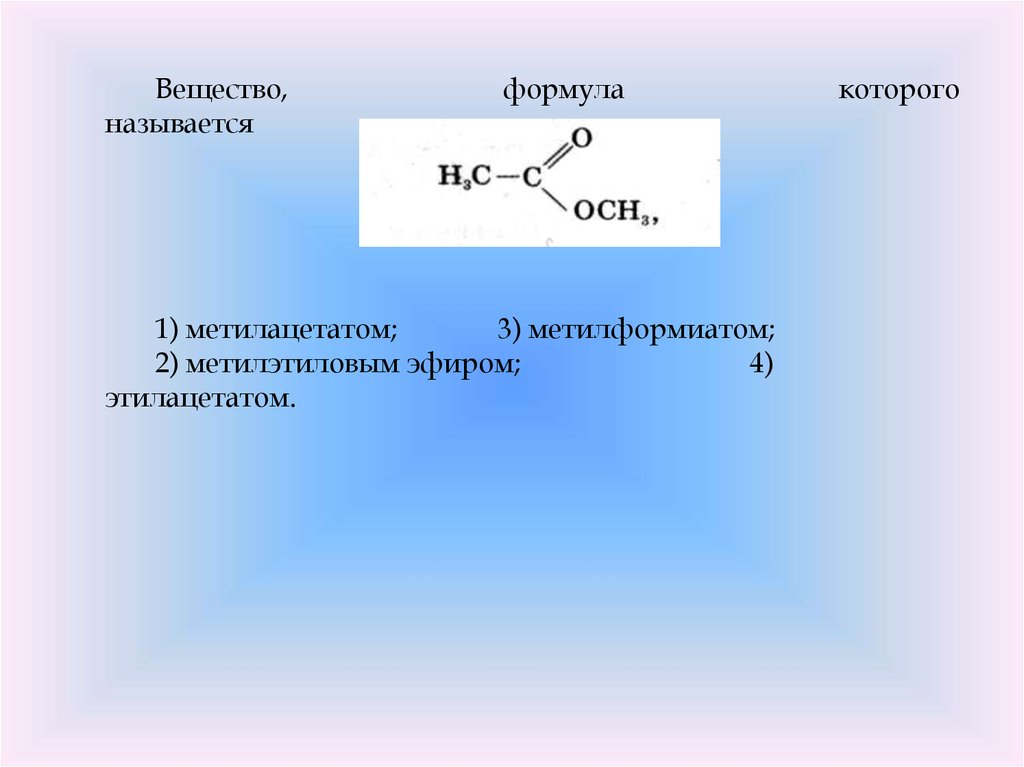 Высшие кислоты (больше 6 углеродов в цепи) – твердые вещества, практически нерастворимые, запаха не имеют.
Высшие кислоты (больше 6 углеродов в цепи) – твердые вещества, практически нерастворимые, запаха не имеют.
Химические свойства.
1). Диссоциация кислот. Мы рассмотрели с вами строение карбоксильной группы и видели, что карбоновые кислоты могут отщеплять протон. Величина кислотности карбоновых кислот зависит от природы радикала. Обычный алифатический радикал является донором электронной плотности и уменьшает заряд на карбонильном углероде. Поэтому алифатические карбоновые кислоты – слабые, наиболее сильная из них – муравьиная ( как фосфорная). Чем больше углеродный радикал, тем слабее кислота. Если в радикале появляются электроотрицательные заместители (например, хлор) или бензольное кольцо, то степень диссоциации кислоты увеличивается.
2). Для растворов карбоновых кислот будут возможны все реакции, общие для кислот. Они изменяют окраску индикаторов, потому что в растворах карбоновых кислот кислая среда.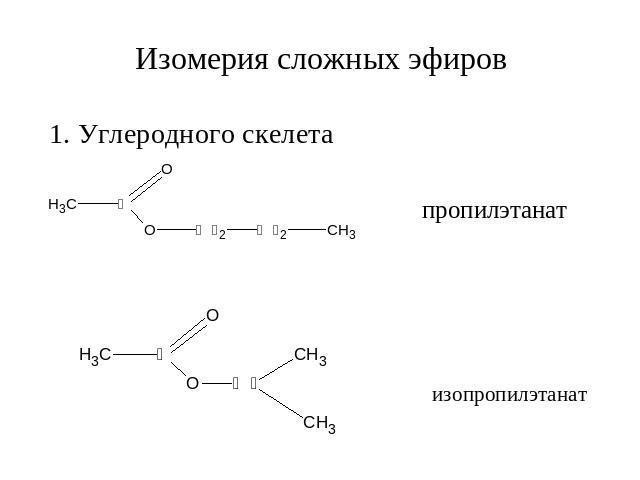 Проходят реакции замещения водорода на металл при взаимодействии кислот с некоторыми металлами (до Н), оксидами металлов, щелочами и солями более слабых кислот. Эти реакции можно назвать реакциями электрофильного замещения водорода.
Проходят реакции замещения водорода на металл при взаимодействии кислот с некоторыми металлами (до Н), оксидами металлов, щелочами и солями более слабых кислот. Эти реакции можно назвать реакциями электрофильного замещения водорода.
CH3COOH+ NaOH CH3COONa + H2O
CH3COOH + Mg (CH3COO)2Mg + H2
CH3COOH + NaНСO3 CH3COONa + СО2 + H2O
CH3COOH + Fe3O3 → (CH3COO)3Fe + H2O
При этом образуются соли карбоновых кислот. Остатки кислот в этом случае называются ацилаты(например: ацетат-соль уксусной кислоты, формиат-соль муравьиной кислоты и т.д.).
3). Для карбоновых кислот (и их производных) характерны так же реакции нуклеофильного замещения.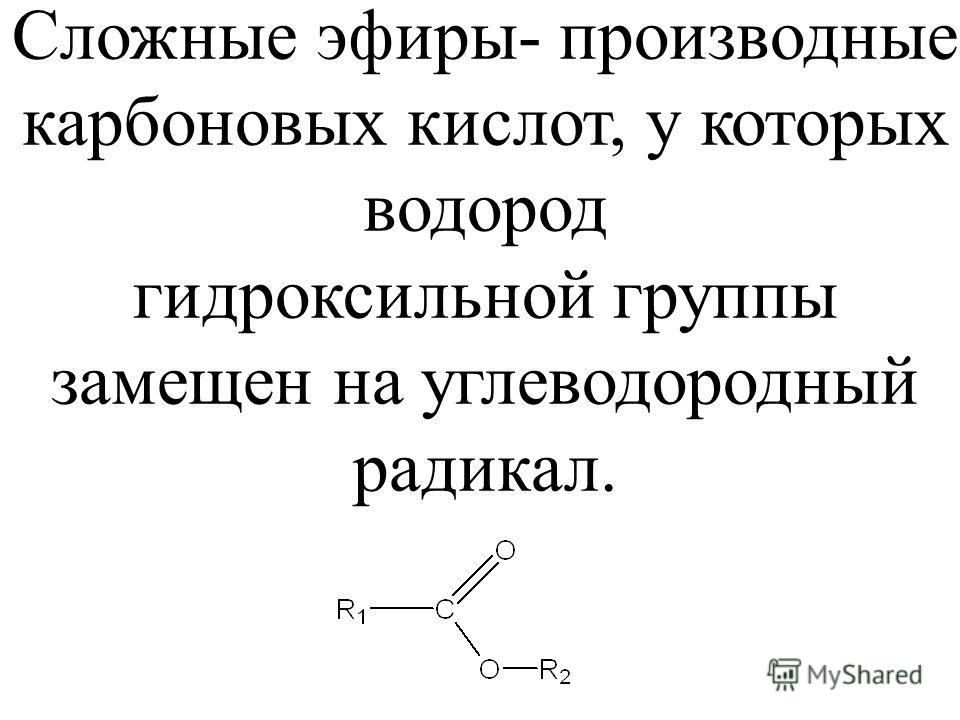 Связанный с атомом углерода карбонильной группы заместитель (у кислот это группа ОН) способен замещаться на нуклеофил. Способность подвергаться атаке нуклеофила возрастают в ряду с увеличением заряда на карбонильном атоме углерода. По сравнению с альдегидами кислоты труднее подвергаются нуклеофильной атаке и нуждаются в катализаторах- кислотах.
Связанный с атомом углерода карбонильной группы заместитель (у кислот это группа ОН) способен замещаться на нуклеофил. Способность подвергаться атаке нуклеофила возрастают в ряду с увеличением заряда на карбонильном атоме углерода. По сравнению с альдегидами кислоты труднее подвергаются нуклеофильной атаке и нуждаются в катализаторах- кислотах.
Наиболее важные из реакций нуклеофильного замещения – реакции этерификации. Так называют реакции образования сложных эфиров из кислот и спиртов. В отсутствии катализатора реакция протекает очень медленно. В присутствии серной или соляной кислоты реакция заметно ускоряется. Эта реакция обратимая. Обратная реакция относится к реакциям гидролиза. Для увеличения практического выхода и сдвига равновесия в нужную сторону из реакционной смеси надо удалять один из продуктов реакции, например, связывать воду концентрированной серной кислотой.
CH3— CO-OH + C2H5O-H CH3-CO-OC2H5 + H2O
4). Ряд свойств карбоновых кислот обусловлен наличием и характером углеродного радикала. Например, предельные карбоновые кислоты могут вступать в реакцию свободно-радикального замещения, образуя галогензамещенные кислоты.
Ряд свойств карбоновых кислот обусловлен наличием и характером углеродного радикала. Например, предельные карбоновые кислоты могут вступать в реакцию свободно-радикального замещения, образуя галогензамещенные кислоты.
CH3COOH + Cl2 → CCl3COOH + HCl
Если радикал непредельный, то для него возможны реакции присоединения по двойной связи. Например, реакция гидрирования.
СН2=СН-СООН + Н2 → СН3— СН2 -СООН
Непредельные кислоты способны и к реакциям полимеризации (олифа).
5). Реакции ОВР. Карбоновые кислоты под действием восстановителей ([H] условно) в присутствии катализаторов способны превращаться в альдегиды, спирты и даже углеводороды.
CH3COOH + Н2 → CH3CH=O + Н2O
В атмосфере кислорода, или под действием другого окислителя, карбоновые кислоты окисляются до углекислого газа и воды. Легче всего окисляется муравьиная кислота. (Почему?)
Легче всего окисляется муравьиная кислота. (Почему?)
CH3COOH + О2 → СО2+ H2O
6) Обратите внимание! Реакции присоединения по двойной связи, которые характерны для карбонильной группы, для кислот не характерны.Здесь проявляется влияние гидроксогруппы на величину положительного заряда карбонильного атома углерода. Неподеленные электронные пары кислорода из гидроксогруппы смещаются к карбонильному углероду и уменьшают заряд на нем. Поэтому атака нуклеофил на карбонильный углерод становится проблематичной.
Эфир и правило трех
, опубликованных по адресу:
Брайан С. Смит
Спектроскопия
Спектроскопия , Spectroscopy-07-01-2018, том 33, выпуск 7
Page: Page: 07-01-2018, том 33, выпуск 7
Page: 07-01-2018. 20–23
Столбцы | Колонка: Семинар по интерпретации ИК-спектров
Сложные эфиры представляют собой распространенную и экономически важную функциональную группу, полученную путем реакции спирта и карбоновой кислоты.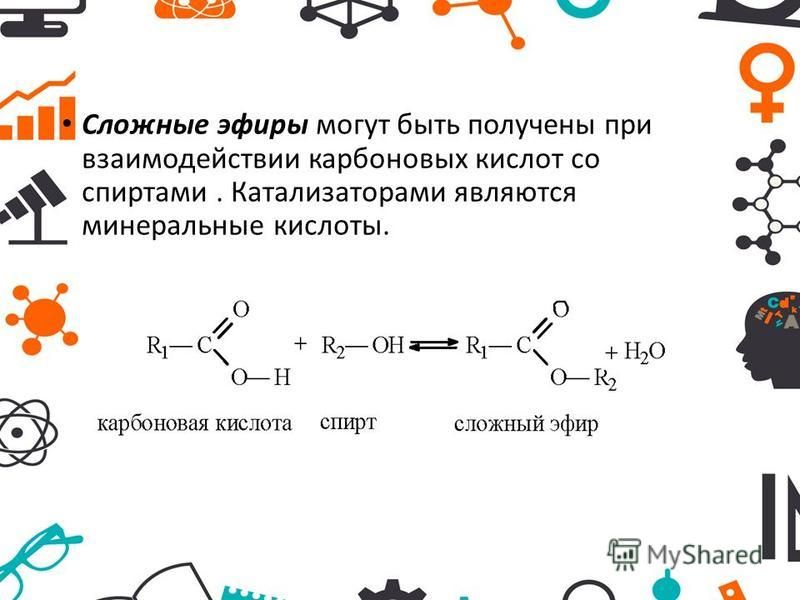
Шестая часть нашего исследования инфракрасной спектроскопии карбонильной группы посвящена сложным эфирам. Подобно ангидридам и карбоксилатам кислот, сложные эфиры образуются в результате реакции с участием карбоновых кислот. Сложные эфиры очень распространены и важны с экономической и биологической точек зрения. Все сложные эфиры демонстрируют три интенсивных пика и, следовательно, следуют тому, что я называю правилом трех. Спектры насыщенных и ароматических эфиров будут рассмотрены в следующих двух колонках.
До сих пор в нашем исследовании инфракрасной (ИК) спектроскопии карбонильной функциональной группы мы рассматривали кетоны, альдегиды, карбоновые кислоты, ангидриды кислот и карбоксилаты (1–5). Кислотные ангидриды и карбоксилаты оба сделаны из карбоновых кислот. Если спирт и карбоновая кислота взаимодействуют, синтезируется функциональная группа, называемая сложным эфиром . Реакция называется этерификацией . Мой учитель химии в старшей школе (который в значительной степени отвечал за выбор моей профессии) помог нам запомнить название этой реакции, произнеся его «эфирные каникулы» и сказав, что это было свободное время, которое мы получили в школе перед Пасхой.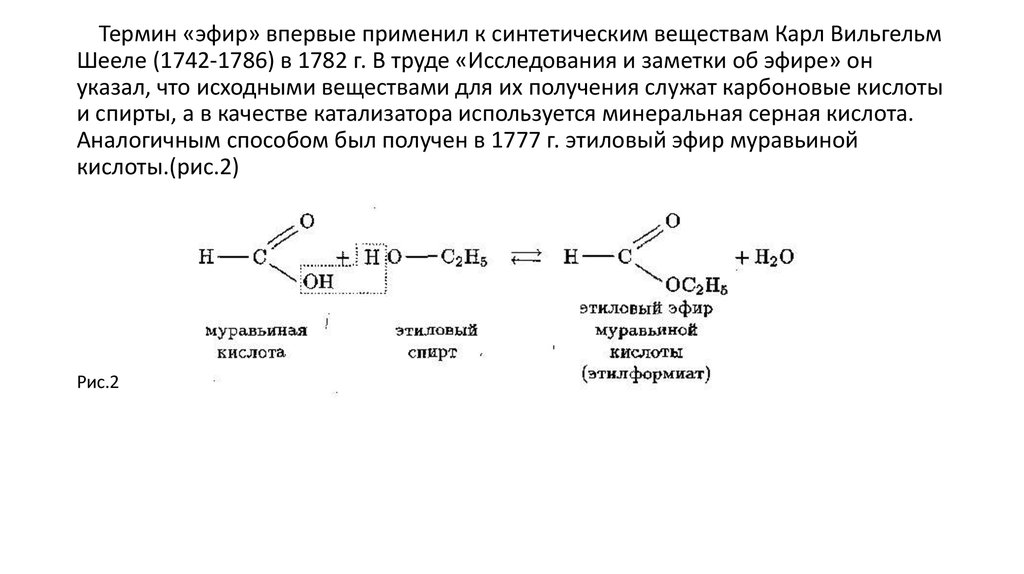 Молекулярная структура сложноэфирной функциональной группы показана на рис. 1.
Молекулярная структура сложноэфирной функциональной группы показана на рис. 1.
Рисунок 1: Молекулярный каркас функциональной группы сложного эфира.
Углерод в группе C=O в сложных эфирах называется карбонильным углеродом , как и во всех других изученных нами карбонилсодержащих функциональных группах (1–5). Углерод слева от карбонильного углерода на рисунке 1 называется альфа-углеродом, а кислород справа называется эфирным кислородом. Если альфа-углерод насыщен, он дает насыщенный эфир, тогда как если альфа-углерод ароматический, мы получаем ароматический эфир. Как мы увидим в следующих двух колонках, с помощью ИК-спектроскопии можно легко отличить насыщенные эфиры от ароматических.
Слово о произношении этой функциональной группы в порядке. Я не родом из Новой Англии, но жил там несколько лет. Я заметил, что туземцы любили опускать букву «р» в конце слов, как это видно из избитой фразы «Пахк ках в Хавахд Яхд». Неудивительно, что коренные жители Новой Англии постоянно называют эту функциональную группу «эста».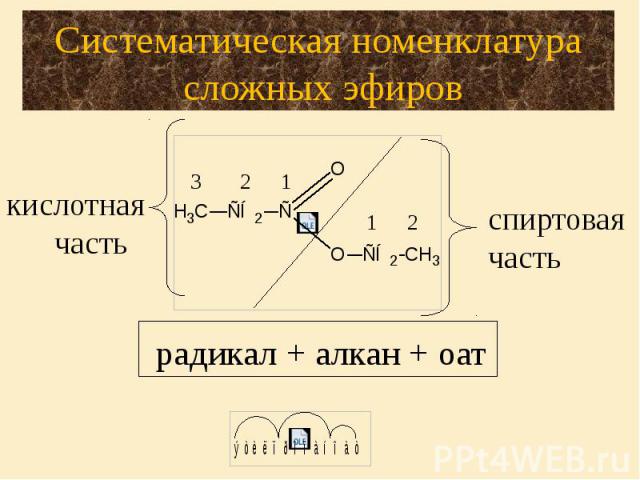
Сложные эфиры имеют промышленное и биохимическое значение. Полиэфиры являются важными материалами, из которых изготавливают бутылки для напитков, ткани и одежду. Молекулы жира содержат много сложноэфирных связей. Наконец, сложные эфиры входят в число ароматизаторов пищевых продуктов и используются в качестве растворителей.
ИК-спектроскопия сложных эфиров
Обратите внимание, что сложноэфирные группы содержат одну связь C=O и две связи C-O. Мы уже изучили ИК-спектроскопию обеих этих функциональных групп, поэтому можем попробовать предсказать, как могут выглядеть их спектры. Напомним (1–5), что пики карбонильных валентных колебаний являются сильными и обычно возникают между 1800 и 1600 см -1 (предположим, что все положения пиков, отмеченные в этой статье, будут в см -1 единиц, даже если это не указано явно). Мы также знаем (6), что удлинения СО представляют собой интенсивные пики, обычно наблюдаемые между 1300 и 1000.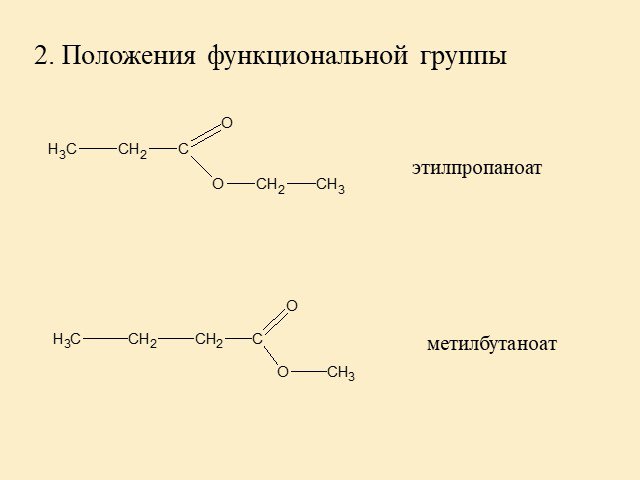 Поскольку одна из связей СО в сложноэфирной группе присоединена к карбонильному углероду, а другая нет, можно ожидать, что эти две связи будут химически различны. , имеют разные силовые постоянные и, следовательно, дают два отдельных пика между 1300 и 1000 годами.0005
Поскольку одна из связей СО в сложноэфирной группе присоединена к карбонильному углероду, а другая нет, можно ожидать, что эти две связи будут химически различны. , имеют разные силовые постоянные и, следовательно, дают два отдельных пика между 1300 и 1000 годами.0005
Как оказалось, наши предсказания верны. Сложные эфиры имеют запоминающийся образец из трех интенсивных пиков на ~1700, ~1200 и ~1100 от C=O и двух растяжек C-O, и, следовательно, следуют тому, что я называю правилом трех (7). Пример спектра насыщенного эфира этилацетата показан на рисунке 2.
Рисунок 2: ИК-спектр насыщенного эфира этилацетата. Обратите внимание на правило трех пиков, обозначенных буквами A, B и C.
Этилацетат получают из уксусной кислоты и этилового спирта. Теоретически его можно получить путем взаимодействия уксуса с водкой. Этилацетат обычно содержится в пищевых продуктах и имеет фруктовый вкус. Это насыщенный сложный эфир, потому что альфа-углерод представляет собой метильную группу.
Правило трех пиков на рис. 2 обозначены A, B и C, и их легко заметить, они торчат вниз, как три длинных пальца в середине спектра. Пик при 1742, конечно, представляет собой карбонильное удлинение, и для насыщенных сложных эфиров в целом этот пик падает с 1755 до 1735. Второй пик, помеченный буквой B на 1241, связан с растяжением связи С-О слева от кислорода сложного эфира, т.е. присоединен к карбонильному углероду, а также включает растяжение связи альфа-углерод-карбонил-углерод С-С. Я называю это асимметричным растяжением C-C-O, и эта вибрация показана на рис. 3.
Рисунок 3: Участок С-С-О сложноэфирной функциональной группы. Эта вибрация отвечает за второй из пиков Правила Трех.
Обычно для насыщенных сложных эфиров этот пик падает с 1210 до 1160.
Третий пик на рис. 2, обозначенный цифрой С под номером 1047, соответствует растяжению второй связи С-О в сложном эфире, расположенном справа. эфирного кислорода. В эту вибрацию также будет вовлечен любой углерод, присоединенный справа от этой связи, образуя группу O-C-C. Я называю эту вибрацию асимметричным растяжением О-С-С, и оно показано на рис. 4.9.0005
Я называю эту вибрацию асимметричным растяжением О-С-С, и оно показано на рис. 4.9.0005
Рисунок 4: Растяжение O-C-C функциональной группы сложного эфира. Эта вибрация отвечает за третий из пиков Правила Трех.
Для насыщенных сложных эфиров в целом растяжение O-C-C появляется в диапазоне 1100–1030. Чтобы было ясно, такая связь, как C=O(O-CH 3 ), которая имеет связь O-C, а не фрагмент O-C-C, по-прежнему будет демонстрировать этот пик.
Если вы внимательно перечитаете этот раздел, то заметите, что я солгал вам. Выше я указывал, что для насыщенных сложных эфиров диапазон С-С-О находится в диапазоне 1210–1160, но ясно, что диапазон С-С-О этилацетата приходится на 1241. Что здесь происходит? Этот пик определенно является исключением из правил, но на этот раз мы можем его понять и использовать. Сложные эфиры ацетата уникальны тем, что альфа-углерод представляет собой просто метильную группу, к которой больше ничего не присоединено. Напомним из первой части этой серии (8), что одним из факторов, определяющих положения пиков в ИК-спектроскопии, является уменьшение массы, и что по мере того, как приведенная масса функциональной группы уменьшается, ее положения ИК-пиков, измеренные в волновых числах, увеличиваются. Метильная группа — это самый легкий альфа-углерод, который может быть в сложном эфире, и, скорее всего, поэтому ацетатные эфиры имеют уникальное удлинение C-C-O с высоким волновым числом, которое обычно составляет около 1240. Ацетатные эфиры распространены из-за повсеместного распространения уксусной кислоты. Тот факт, что они имеют уникальный асимметричный пик растяжения C-C-O, помогает отличить их от многих других типов насыщенных сложных эфиров.
Метильная группа — это самый легкий альфа-углерод, который может быть в сложном эфире, и, скорее всего, поэтому ацетатные эфиры имеют уникальное удлинение C-C-O с высоким волновым числом, которое обычно составляет около 1240. Ацетатные эфиры распространены из-за повсеместного распространения уксусной кислоты. Тот факт, что они имеют уникальный асимметричный пик растяжения C-C-O, помогает отличить их от многих других типов насыщенных сложных эфиров.
Обратите внимание на рис. 2, что по мере продвижения слева направо к пикам A, B и C третий пик немного менее интенсивен, чем два других. Эта картина интенсивности типична для сложных эфиров и может быть полезна при их идентификации. Сводка групповых волновых чисел для насыщенных сложных эфиров приведена в Таблице I.
Выводы
Сложные эфиры представляют собой распространенную и экономически важную функциональную группу, полученную реакцией спирта и карбоновой кислоты. Их структурный каркас состоит из группы C=O и двух связей C-O.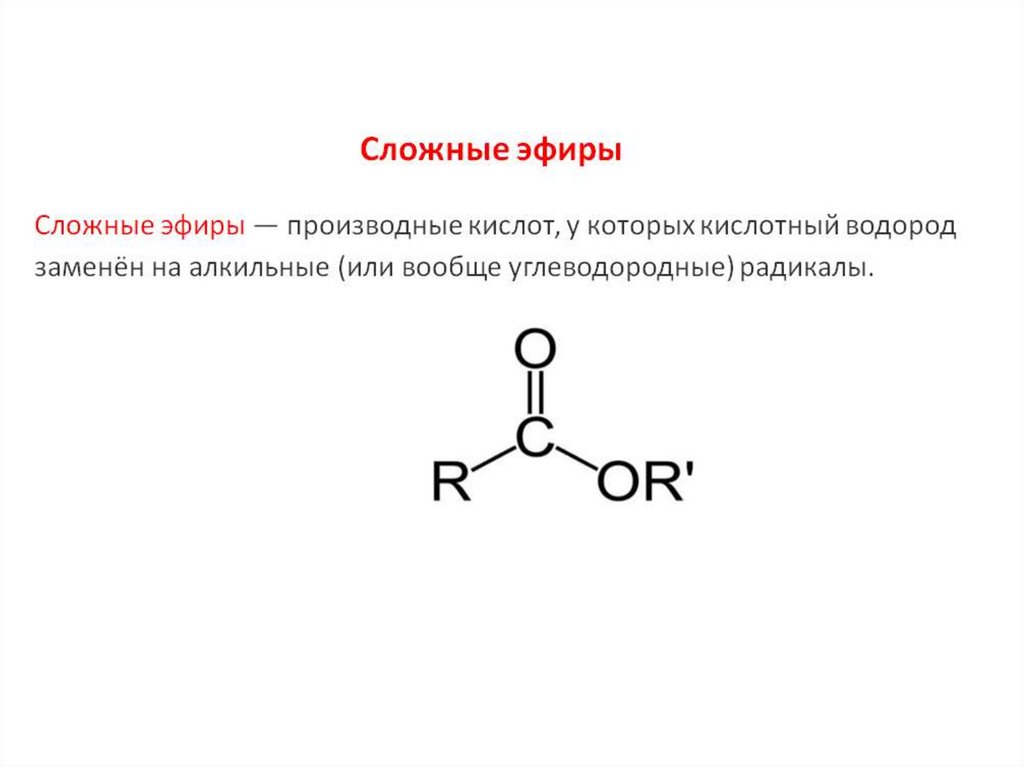 Это приводит к трем интенсивным пикам, называемым правилом трех, с положениями пиков примерно при волновых числах 1700, 1200 и 1100. Три задействованные вибрации — это растяжка C=O, растяжка C-C-O и растяжка O-C-C. Насыщенные эфиры изучались здесь, ароматические эфиры будут рассмотрены в следующем выпуске.
Это приводит к трем интенсивным пикам, называемым правилом трех, с положениями пиков примерно при волновых числах 1700, 1200 и 1100. Три задействованные вибрации — это растяжка C=O, растяжка C-C-O и растяжка O-C-C. Насыщенные эфиры изучались здесь, ароматические эфиры будут рассмотрены в следующем выпуске.
Ссылки
(1) до н.э. Smith, Spectroscopy 32 (9), 31–36 (2017).
(2) до н.э. Smith, Spectroscopy 32 (10), 28–34 (2017).
(3) до н.э. Smith, Spectroscopy 33 (1), 14–20 (2018).
(4) до н.э. Smith, Spectroscopy 33 (3), 16–20 (2018).
(5) до н.э. Smith, Spectroscopy 33 (5), 20–23 (2018).
(6) до н.э. Smith, Spectroscopy 32 (1), 14–21 (2017).
(7) до н.э. Смит, Инфракрасная спектральная интерпретация: систематический подход (CRC Press, Бока-Ратон, Флорида, 1999).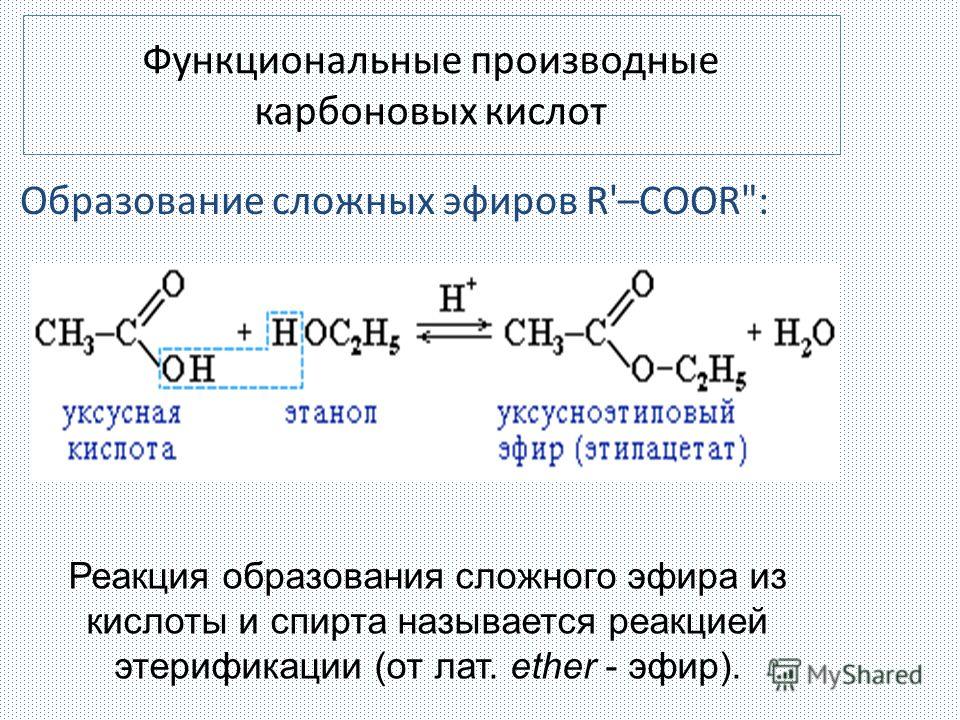
(8) до н.э. Smith, Spectroscopy 30 (1), 16–23 (2015).
(9) до н.э. Smith, Spectroscopy 31 (3), 34–37 (2016).
(10) до н.э. Smith, Spectroscopy 31 (5), 36–39 (2016).
(11) до н.э. Smith, Spectroscopy 33 (5), 20–23 (2018).
Брайан С. Смит, доктор философии, имеет более чем тридцатилетний опыт работы инфракрасным спектроскопистом. Он опубликовал множество рецензируемых статей и написал три книги на эту тему: Fundamentals of FTIR и Infrared Spectral Interpretation , обе опубликованы CRC Press, и Quantitative Spectroscopy: Theory and Practice e, опубликованные Elsevier. В качестве тренера по спектроскопии он помог тысячам людей во всем мире улучшить свои инфракрасные анализы. Он получил докторскую степень по физической химии в Дартмутском колледже. С ним можно связаться по адресу: SpectroscopyEdit@UBM. com
com
Связанный контент:
Столбец: ИК-спектральная интерпретация семинарсфраус (IR) Spectroscopyspectroscopy-07-01-2018
Связанная статья >>>
Реклама
Реклама 9000
. группы — VCE Химия
Химия ВКЭ
Функциональные группы 1. Галогеналканы (-X, где X представляет собой галоген ). | Изображения предоставлены wikimedia commons Этанол Этановая кислота (уксусная кислота) Метиламин Метилэтаноат Таблица эфиров и их запахов- https://jameskennedymonash. Begin typing your search term above and press enter to search. Press ESC to cancel. Back To Top
|

 «Скажи мне, — спросил юноша, — почему тебя часто одолевают сомнения? Ты прожил долгую жизнь, умудрен опытом и учился у великих эллинов. Как же так, что и для тебя осталось столь много неясных вопросов?»
«Скажи мне, — спросил юноша, — почему тебя часто одолевают сомнения? Ты прожил долгую жизнь, умудрен опытом и учился у великих эллинов. Как же так, что и для тебя осталось столь много неясных вопросов?» Как вы назовете их одним словом?
Как вы назовете их одним словом?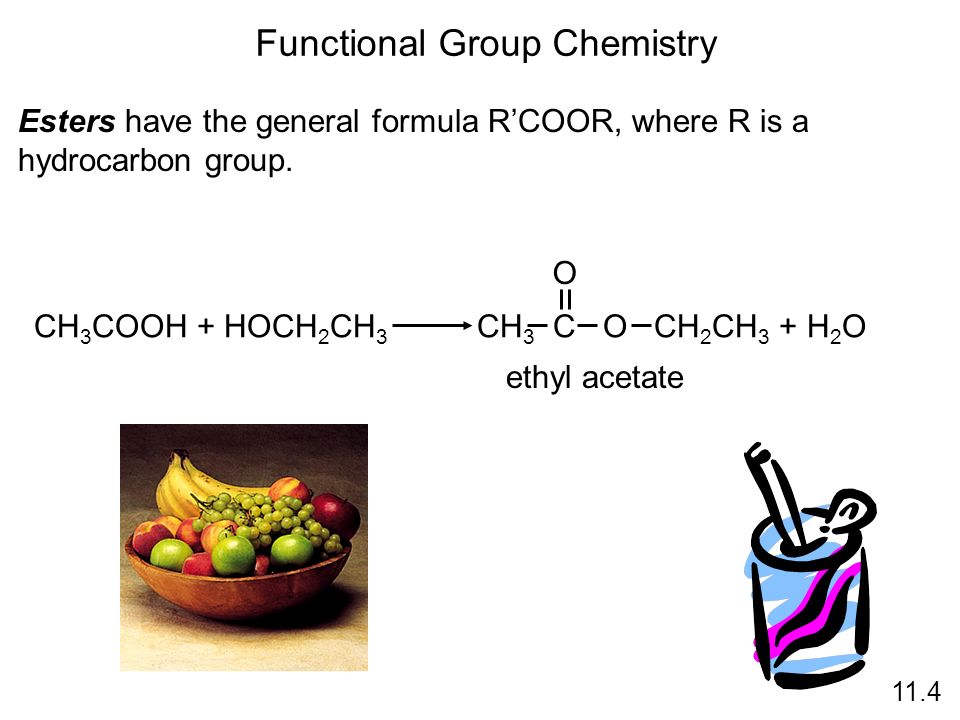 Что вызывает затруднение? Что общего между сложным и простым эфиром; спиртом, карбоновой кислотой и сложным эфиром? Дайте определение.
Что вызывает затруднение? Что общего между сложным и простым эфиром; спиртом, карбоновой кислотой и сложным эфиром? Дайте определение. Твёрдое (натриевые соли) и жидкое мыло (калиевые соли). Применение жира и мыла.
Твёрдое (натриевые соли) и жидкое мыло (калиевые соли). Применение жира и мыла. На слайде критерии оценивания. Выполните задания. Запишите пример своего вопроса по теме урока.
На слайде критерии оценивания. Выполните задания. Запишите пример своего вопроса по теме урока.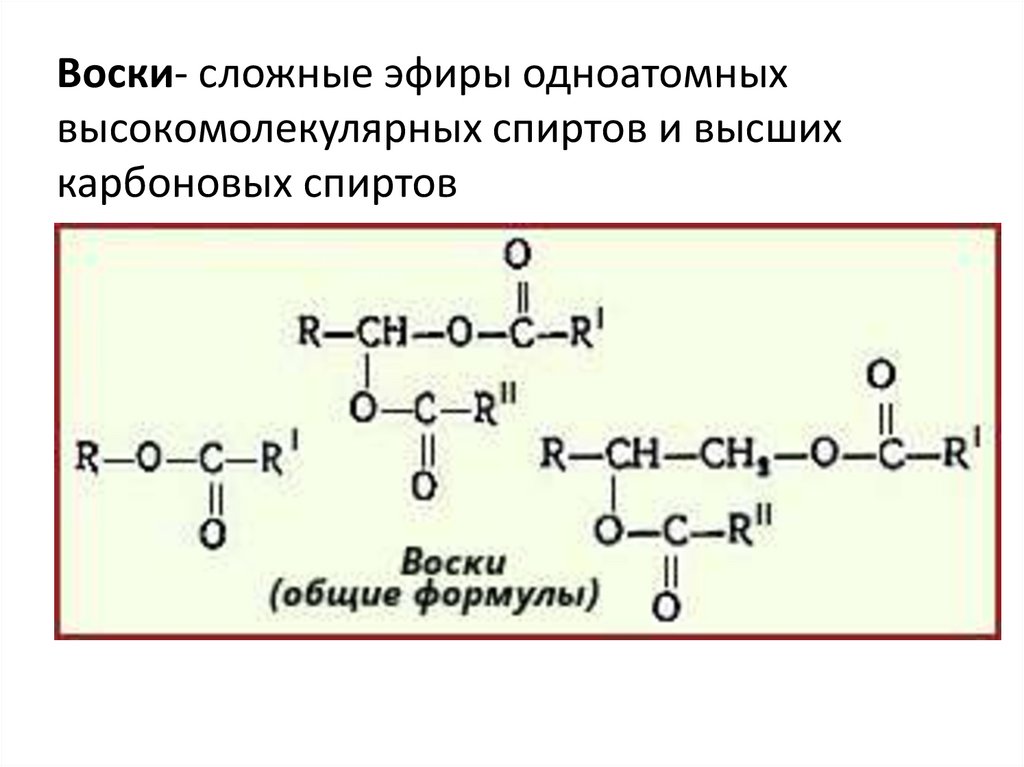 Подготовьте сообщения по темам «Способы удаления жировых пятен», «Ожирение и его последствия», «Интересные факты о жирах»
Подготовьте сообщения по темам «Способы удаления жировых пятен», «Ожирение и его последствия», «Интересные факты о жирах»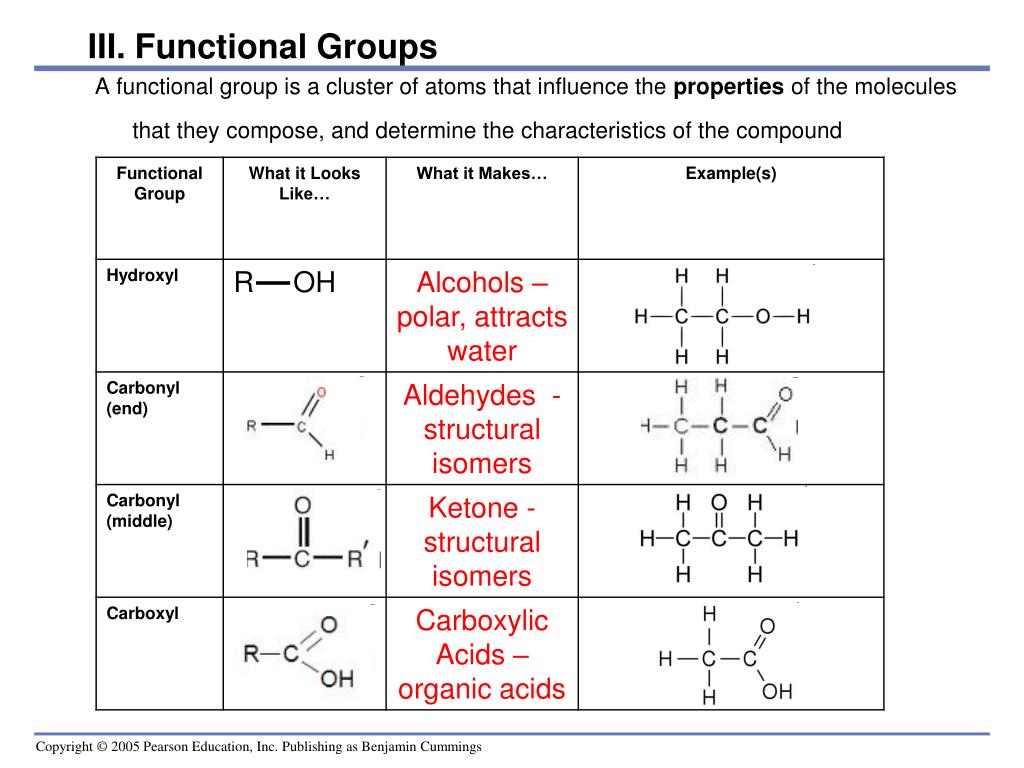 Спирты (-ОН).
Спирты (-ОН). 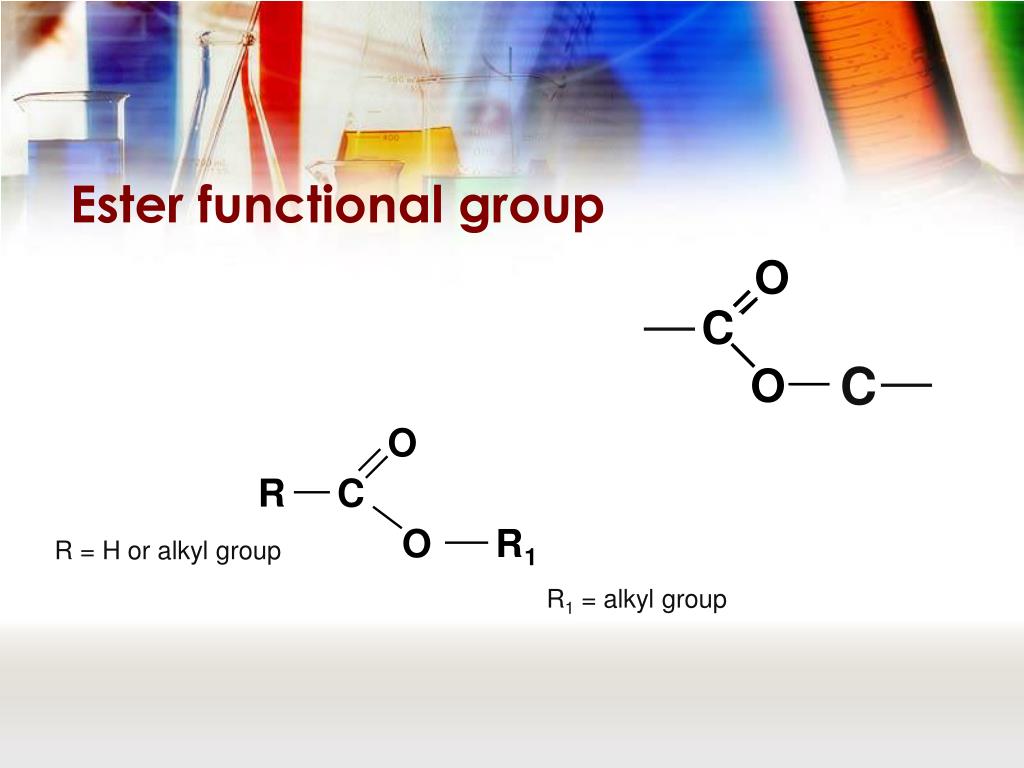 Сложные эфиры (-COO-).
Сложные эфиры (-COO-). 