1.Классификация органических соединений. Важнейшие функциональные группы. Примеры. Функциональная группа эфиров
Эфирная функциональная группа - Большая Энциклопедия Нефти и Газа, статья, страница 1
Эфирная функциональная группа
Cтраница 1
Эфирная функциональная группа не дает характеристических полос поглощения в видимой и ультрафиолетовой частях спектра, однако обычно наблюдается сильное поглощение в инфракрасной области между 1250 - 1060 см -, обусловленное асимметрическими колебаниями. Эта ИК-полоса может маскироваться поглощением вследствие колебаний С-С. В связи с этим для кислородсодержащих соединений вывод о наличии простой эфирной группы из электромагнитного спектра может быть сделан только непрямым путем при условии отсутствия полос поглощения, характеристических для других кислородных функциональных групп, таких как ОН и С О например. [1]
Эфирная функциональная группа может влиять на поведение молекулы в реакции, поскольку эта группа в силу ее электронных характеристик изменяет стабильность исходного, переходного или конечного состояния реакции и тем самым оказывает влияние на скорость или равновесие данной реакции. Влияние эфирной группы на реакционную способность более подробно рассмотрено в разд. В связи с этим реакции, включающие образование таких переходных состояний в а-положении к эфирной группе, протекают с большей легкостью. Некоторые фотохимические реакции, реакции а-гало-генэфиров и ненасыщенных эфиров, ведущие к образованию других эфиров, в этом разделе не обсуждаются, а рассмотрены отдельно соответственно в разд. [2]
Эфирная функциональная группа не дает характеристических полос поглощения в видимой и ультрафиолетовой частях спектра, однако обычно наблюдается сильное поглощение в инфракрасной области между 1250 - 1060 см 1, обусловленное асимметрическими колебаниями. Эта ИК-полоса может маскироваться поглощением вследствие колебаний С-С. В связи с этим для кислородсодержащих соединений вывод о наличии простой эфирной группы из электромагнитного спектра может быть сделан только непрямым путем при условии отсутствия полос поглощения, характеристических для других кислородных функциональных групп, таких как ОН и С О например. [3]
Эфирная функциональная группа может влиять на поведение молекулы в реакции, поскольку эта группа в силу ее электронных характеристик изменяет стабильность исходного, переходного или конечного состояния реакции и тем самым оказывает влияние на скорость или равновесие данной реакции. Влияние эфирной группы на реакционную способность более подробно рассмотрено в разд. В связи с этим реакции, включающие образование таких переходных состояний в а-положении к эфирной группе, протекают с большей легкостью. Некоторые фотохимические реакции, реакции а-гало-генэфиров и ненасыщенных эфиров, ведущие к образованию других эфиров, в этом разделе не обсуждаются, а рассмотрены отдельно соответственно в разд. [4]
При хроматографическом разделении на полимерных сорбентах, содержащих эфирные функциональные группы, наблюдаются следующие особенности удерживания компонентов. [5]
Проведено сопоставление удерживания соединений различных классов на сорбентах с эфирными функциональными группами и на полярных жидких фазах - дибутил-фталате и полиэтиленгликоле 1000 ( ПЭГ-1000), нанесенных на фторопластовый носитель полихром-1. Можно видеть ( см. табл. 8 - 13), что наблюдается качественная аналогия в удерживании молекул различной электронной и геометрической структуры на полисорбате-2 и на указанных фазах. Это говорит о том, что полисорбат-2 - полимерный сорбент на основе метилакрилата и л-дивинилбензола по разделительным свойствам соответствует полярным жидким фазам. [6]
Этот карбанион возникает в результате отщепления протона в а-положении от эфирной функциональной группы под действием основания. [7]
Представленные в работе [44] данные свидетельствуют о специфическом взаимодействии молекул спиртов с эфирными функциональными группами полисорбата-2 и о возрастании роли водородной связи между сорбатом и поли-сорбатом-2 с уменьшением разветвленное углеродной цепочки в молекулах спиртов с одним и тем же числом атомов углерода. [8]
Диизопропилфторфосфат сранительно стабклыюе, хорошо хранящееся соединение, химические свойства которого определяются наличием фторангндриднон н эфирных функциональных групп. Поведение его в химических реакциях аналогично GB, различие состоит только а скоростях превращений. [9]
Диизопропилфторфосфат - сранительно стабильное, хорошо хранящееся соединение, химические свойства которого определяются наличием фторангидридной и эфирных функциональных групп. Поведение его в химических реакциях аналогично GB, различие состоит только в скоростях превращений. [10]
Жирные кислоты Q - С4, способные образовывать более прочные водородные связи, на сорбентах с эфирными функциональными группами удерживаются сильнее спиртов с равным числом атомов углерода в молекуле. Отношения удерживаемых объемов нормальных кислот и нормальных спиртов с равным числом атомов углерода в молекуле, приведенные в табл. 11, показывают, что сорбенты с эфирными функциональными группами обладают специфичностью молекулярного взаимодействия. При этом по мере увеличения длины углеродной цепочки в разделяемых молекулах спирта и кислоты уменьшается вклад специфического взаимодействия в общую энергию межмолекулярного взаимодействия: молекула группы D-полярный полимерный сорбент. [12]
При разделении на полярных сорбентах: порапаках R, N, S, Т, хромосорбах 103 - 104, полисорбатах, - сорбентах с эфирными функциональными группами наблюдается зависимость удерживания и от величины дипольного момента соединений и от способности их к образованию водородных связей с активными центрами поверхности сорбента. [13]
Были исследованы также спектры аэросила со сложными радикалами, содержащими один или два атома хлора, а также аллиль-ную группу. Термически наиболее устойчивы радикалы с эфирной функциональной группой и радикалы, содержащие атомы хлора. Аллильная группа термически менее устойчива. [14]
Полимеры, полученные из эпоксидов, гликолей и подобных материалов, характеризуемые наличием простой эфирной связи в полимерной цепи. Их не следует смешивать с поливиниловыми эфирами товарной позиции 3905, в которых эфирные функциональные группы являются заменителями в полимерной цепи. Эти продукты имеют широкое применение, РРО используется как и полиацетали в качестве технических пластмасс, полипропиленоксид - в качестве полупродукта для пенополиуретана. [15]
Страницы: 1 2
www.ngpedia.ru
Спирты, фенолы, простые эфиры. Номенклатура, изомерия одноатомных спиртов. Строение функциональной группы. Физические свойства спиртов, роль водородной связи.
Спиты: одноатомные, двух- трехатомные..
Первичные, вторичные, третичные.
Гидроксильные группы находятся у одного и того же атома углерода, тоесть занимают геминальное положение (гем-диолы).
Гидроксильные группы расположенные у соседних атомов углерода, находятся в винциальном положении (виц-диолы).
ФИЗИЧЕСКИЕ Спирты, содержащие не более 11 атомов С, жидкости. Более 11 атомов С – тв. вещества. Низшие спирты имею характерный алкогольный запах и жгучий вкус, обладают сильным физиологическим дейтвием. Низшие спирты смешиваются с водой во вех соотношениях.
Метанол, древесный спирт – сильный яд.
Этанол, винный спирт.
Этиленгликоль – вязкая жидкость сладковатого вкуса. Яд. В виде 50-% р-ра применяется как антифриз.
Глицерин
Фенолы
Производные аренов, в которых один или несколько атомов водорода ароматич. кольца замещены на гидроксильные группы.
Фенол- одноатомный
Пирокатехин, резорцин – многоатомные.
Физические
Фенол и его низшие гомологи представляют собой бесцветные низкоплавкие кристаллич. в-ва или жидкости довольно сильным характерным запахом. Двух и трехатомные фенолы – тв. в-ва с более высокими темп. плавления, без запаха.
Фенол умеренно растворим в воде.
Фенолы и особенно нафтолы относятся к выокотоксичным веществам.
Бензолдиол, безолтриол.
ХИМИЕСКИЕ
Галогенирование 2,4,6, нитрирование, восстановление, с акт. Металлами, щелочами и др.
Биологическое значение фенола обычно рассматривается в рамках его воздействия на окружающую среду. Фенол — один из промышленных загрязнителей. Фенол довольно токсичен для животных и человека. Фенол губителен для многих микроорганизмов, поэтому промышленные сточные воды с высоким содержанием фенола плохо поддаются биологической очистке.
Фенол обладает антисептическими свойствами, поэтому карболка (5%), которая является разбавленным водным раствором фенола, используется для дезинфекции белья и помещений, красители, капрон и др.
Простые эфиры представляют собой соединения, в которых два углеводородных радикала связаны атомом кислорода. Систематическая номенклатура рассматривает простые эфиры как производные алканов, например диэтиловый эфир следует называть этоксиэтаном, анизол метоксибензолом. По рациональной номенклатуре названия простых эфиров составляют по именам с добавлением слова «эфир»: диэтиловый эфир, метилэтиловый эфир, дифениловый эфир. Применяется "оксидная" номенклатура: дифенилоксид = дифениловый эфир, иногда используются тривиальные названия: диэтиловый эфир = серный эфир (по способу получения) или просто эфир, анизол (метилфениловый эфир), фенетол (этилфениловый эфир)
Свойства простых эфиров
Химические свойства простых эфиров обусловлены присутствием атома кислорода, связанного с двумя С-атомами. Две несвязывающих пары электронов кислорода обусловливают основность (по Льюису) простых эфиров. Низшие представители сравнительно неплохо растворимы в воде (водородные связи), с сильными кислотами они образуют гидроксониевые соли. Поэтому диэтиловый эфир растворим в концентрированной соляной кислоте и выделяется при разбавлении раствора водой.

Кислоты Льюиса с простыми эфирами дают солеобразные оксониевые соединения, которые называют эфиратами. Кислота и основание связаны донорно-акцепторной связью.

Комплексы эфиров с трифторидом бора весьма стабильны и в синтетических целях, к примеру, удобным реагентом является эфират трифторида бора: сам BF3 при комнатной температуре представляет собой газообразное вещество, диэтиловый эфир кипит при 34.5 °С, тогда как их комплекс перегоняется без разложения при 129 °С.
Несмотря на полярность связи С-О в молекулах простых эфиров (m=1,6D), они не реагируют с нуклеофилами. Вероятно, это обусловлено тем, что в ходе расщепления должно было бы произойти вытеснение нуклеофилом более сильного основания – алкоголят-иона (плохая уходящая группа). Напротив, в сильнокислой среде, где плохая уходящая группа алкоксид-ион превращается в хорошую уходящую группу (молекулу спирта), простые эфиры расщепляются действием сильных нуклеофилов. Так, эфиры расщепляются до соответствующего спирта и алкилгалогенида под действием HBr или HI (но не HCl):
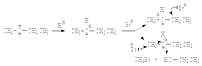


Простые эфиры легко вступают реакции свободно-радикального замещения по α-углеродному атому. Так, получение хлордиэтилового эфира ведут действием хлора на эфир при -20 °С.

Столь легкое замещение при α-С-атоме объясняют тем, что в результате отрыва атома водорода возникает радикальная частица, стабилизированная за счет нахождения неспаренного электрона в поле атома кислорода ("три электрона в поле двух атомов").
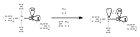
Это же обстоятельство является причиной легкости окисления простых эфиров кислородом воздуха по свободно-радикальному механизму. Вследствие этого пары эфиров образуют с воздухом взрывчатую смесь, а во время хранения эфира в нем накапливаются гидропероксиды, которые, благодаря более высокой температуре кипения, остаются в перегонной колбе и в конце перегонки могут взрываться. Поэтому эфиры перед перегонкой обрабатывают раствором солей двухвалентного железа либо твердой щелочью.
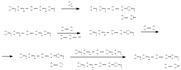
В то же время простые эфиры очень устойчивы к действию других окислителей, сильных кислот (кроме HBr и HI) и оснований, в т.ч. металлоорганических соединений, и поэтому широко используются в лабораторной практике в качестве растворителей, особенно это касается диэтилового эфира, ТГФ, диоксана и глимов.
α-Хлорзамещенные эфиры вступают как очень активные электрофилы в реакции нуклеофильного замещения хлора по мономолекулярному механизму с различными реагентами цианид-, иодид-, ацетат-ионом. Этилхлорметиловый эфир гидролизуется в 1·109 раз быстрее трет-бутилхлорида по механизму SN1, а метилхлорметиловый эфир лишь в 400 раз быстрее, чем хлорэтан, по SN2-механизму. Предпочтительность SN1-механизма легко объясняется резонансной стабилизацией карбокатиона.

Кислотно-основные свойства спиртов. Алкоголяты металлов, их основные и нуклеофильные свойства. Реакции нуклеофильного замещения с участием спиртов. Примеры биологически важных реакций нуклеофильного замещения с участием эфиров фосфорных кислот.
спирты являются слабыми ОН-кислотами Бренстеда и жесткими кислотами по Пирсону. По кислотности спирты близки к воде. Кислотные свойства спиртов определяются способностью к протонизации атома водорода гидроксильной группы. Последняя обусловливается не только разницей в электроотрицательностях между атомами кислорода (3,5) и водорода (2,1), но и природой радикала. Метанол (pKa = 15,5), несколько более сильная кислота, чем вода (pKa = 15,7), но большинство спиртов являются более слабыми кислотами, чем вода. Причиной этого являются стерические препятствия, мешающие в разветвленных спиртах сольватации образующегося алкоксид-аниона. Сольватация стабилизирует алкоксид-анион и следовательно усиливает кислотные свойства.Реакции с участием нуклеофильного центра.Высокая электроотрицательность атома кислорода (3,5 по шкале Полинга), являющегося основным центром, позволяет рассматривать спирты как слабые n-основания Бренстеда и жесткие основания по Пирсону.спирты способны образовывать соли оксония только с сильными протонными кислотами и жесткими кислотами по Пирсону (фторид бора, хлорид цинка и др.Таким образом, спирты обладают слабыми кислотными и слабыми основными свойствами, т.е. являются амфипротонными соединениями.При достаточно высокой температуре и в отсутствие хорошего нуклеофила протонированные спирты способны к реакции, т.е. к реакции дегидратации.Будучи жесткими основаниями, вследствие низкой поляризуемости и высокой электроотрицательности, атома кислорода спирты являются слабыми нуклеофилами. Кислоты Бренстеда протонируют атом кислорода гидроксигруппы.
42. Внутри- и межмолекулярная дегидратация спиртов.:Дегидратация спиртов может осуществляется в двух направлениях: внутримолекулярно и межмолекулярно. Направление дегидратации зависит от природы спирта и условий проведения реакции.При внутримолекулярной дегидратации спирта образуется ненасыщенный этиленовый углеводород, в результате межмолекулярной дегидратации – простой эфир. Так, при нагревании спиртов с такими водоотнимающими веществами, как концентрированная h3SO4, h4PO4, безводная щавелевая кислота, оксид алюминия и т.д., образуются ненасыщенные соединения этиленового ряда.Реакционная способность спиртов к дегидратации, то есть к образованию из них этиленовых соединений, изменяется в таком порядке:третичные спирты > вторичные спирты >первичные спирты.Некоторые третичные спирты дегидратируются настолько легко, что их можно перегнать только в случае, если предотвратить попадание в них даже лабораторного воздуха, который содержит в незначительных количествах пары кислот.Дегидратация спиртов в присутствии концентрированной h3SO4 в зависимости от температуры, соотношения объемов спирта и кислоты может осуществляться с образованием разных продуктов. Например, этиловый спирт при 105оС образует с серной кислотой кислый сложный эфир – этилсерную кислоту (реакция 1). При избытке спирта и более высокой температуре (130 –140оС) осуществляется межмолекулярная дегидратация, главным продуктом которой является диэтиловый эфир (простой эфир; реакция 2). При температуре выше 160оС этилсерная кислота разлагается с образованием этилена (реакция 3):
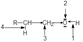
43. Окисление первичных и вторичных спиртов. Спирты при 300-400оС и в присутствии медных и других катализаторов окисляются кислородом воздуха. Такие окислители, как KMnO4, хромовая смесь, окисляют спирты уже при комнатной температуре. В зависимости от того, какой это спирт – первичный, вторичный или третичный – при окислении образуются разные продукты.
Первичные спирты при окислении дают альдегиды с таким же количеством углеродных атомов, как и в молекуле исходного спирта. Альдегиды в этих условиях могут окисляться в карбоновые кислоты. Чтобы избежать дальнейшего окисления, альдегиды необходимо быстро выводить из реакционной смеси
Первичные спирты можно также окислить в альдегиды мелко раздробленной медью. Нагретой до 280-300оС. В этих условиях от молекулы спирта отщепляются два атома водорода и в молекуле органического вещества, которая при этом образуется, появляется двойная связь углерод – кислород (>C=O). Такое превращение спиртов называется дегидрированием:
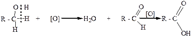
Вторичные спирты при окислении, а также при дегидрировании, превращаются в кетоны:
Третичные спирты окисляются достаточно трудно с одновременным разрывом углеродной цепи их молекул и образования смеси карбоновых кислот и кетонов. Такое окисление этих спиртов связано с тем, что в условиях реакции окисления они дегидратируются и превращаются в этиленовые углеводороды, которые в присутствии сильного окислителя окисляются с разрывом молекулы по месту двойной С=C – связи
cyberpedia.su
1.Классификация органических соединений. Важнейшие функциональные группы. Примеры.
ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ.
По строению углеродного скелета органические соединения делятся на: а) ациклические (алифатические), в которых цепь атомов углерода может быть неразветвленной и разветвленной: СН3 – СН2 – СН2 – СН3 СН3 – СН – СН2 – СН3
СН3
б) карбоциклические соединения, в составе циклов которых только атомы углерода
В) гетероциклические соединения, которые кроме атомов углерода в циклическом скелете содержат один или несколько гетероатомов (лат. гетерос – иной, другой): азот, кислород, серу
важнейшие функциональные группы:
| Функциональная группа | Название класса | Общая формула класса | ||||
| формула | название | |||||
| – | – | Углеводороды | R–H | |||
| –F, –Cl, –Br, –I (–Hal) | галогены | Галогено-производные | R–Hal | |||
| –ОН | гидроксильная | Спирты Фенолы | R–OH Ar–OH | |||
| –О– | окси | Простые эфиры | R–O–R' | |||
| –SH | меркапто | Тиолы | R–SH | |||
| –Nh3 | амино | Амины (первичные) | R–Nh3 | |||
| – NO2 | нитро | Нитросоединения | R–NO2 | |||
| >C=O | карбонильная | Альгедиды Кетоны | R–CH=O R–CO–R' | |||
| –COOH | карбоксильная | Карбоновые кислоты | R–COOH | |||
| –SO3H | сульфо | Сульфокислоты | R–SO3H | |||
2. Понятие о взаимном влиянии атомов в молекуле, электронные эффекты (положительные и отрицательные индуктивный и мезомерный эффекты).
Согласно теории А.М. Бутлерова, свойства и реакционная способность молекулы во многом зависят от взаимного влияния атомов или групп атомов друг на друга. Результатом взаимного влияния атомов в молекулах является перераспределение электронной плотности, что вызывает изменение реакционной способности отдельных связей и молекулы в целом. Взаимное влияние передается с помощью электронных эффектов. Различают электроноакцепторные (оттягивающие электроны – эффект « – ») и электронодонорные (посылающие электроны – эффект « + ») заместители.
Индуктивный эффект (I-эффект) – передача электронного влияния заместителей по цепи σ-связей.
Заместитель, вызвавший появление в молекуле полярной связи, способствует поляризации ближайших двух-трех σ-связей и приводит к возникновению частичных зарядов (δ) на соседних атомах. Электроноакцепторные заместители (Х), уменьшающие электронную плотность соседних σ-связей, проявляют отрицательный индуктивный эффект (– I-эффект). Электронодонорные заместители (Y), повышающие электронную плотность соседних σ-связей, проявляют положительный индуктивный эффект (+I-эффект). Графически индуктивный эффект обозначают стрелкой на конце валентной черты с острием, направленным в сторону более электроотрицательного атома. Как правило, через три-четыре связи он уже не проявляется.
Мезомерный эффект (М-эффект) – передача электронного влияния заместителей по сопряженной системе. В отличие от индуктивного, мезомерный эффект не затухает, а передается по всей сопряженной системе, т.к. р- и π-электроны более подвижны, чем σ-электроны.
Заместители, отдающие пару электронов в сопряженную систему (электронодоноры), проявляют положительный (+М-эффект) мезомерный эффект. Этот эффект характерен для заместителей, содержащих гетероатомы с неподеленной электронной парой или целым отрицательным зарядом. Заместители, являющиеся участниками сопряженной системы и содержащие кратную связь с электроотрицательным атомом, оттягивающим на себя делокализованную электронную плотность системы, проявляют отрицательный мезомерный эффект (–М-эффект). Графически М-эффект обозначают изогнутыми стрелками, начало которых показывает, какие π- или р-электроны смещаются, а их конец указывает связь или атом, к которым они смещаются:
при оценке влияния заместителей на распределение электронной плотности в молекуле необходимо учитывать результирующее действие обоих эффектов. Например, в анилине отрицательный I-эффект перекрывается более сильным +М-эффектом. За редким исключением (атомы галогенов) мезомерный эффект превалирует над индуктивным.
studfiles.net
1.Классификация органических соединений. Важнейшие функциональные группы. Примеры.
ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ.
По строению углеродного скелета органические соединения делятся на: а) ациклические (алифатические), в которых цепь атомов углерода может быть неразветвленной и разветвленной: СН3 – СН2 – СН2 – СН3 СН3 – СН – СН2 – СН3
СН3
б) карбоциклические соединения, в составе циклов которых только атомы углерода
В) гетероциклические соединения, которые кроме атомов углерода в циклическом скелете содержат один или несколько гетероатомов (лат. гетерос – иной, другой): азот, кислород, серу
важнейшие функциональные группы:
| Функциональная группа | Название класса | Общая формула класса | ||||
| формула | название | |||||
| – | – | Углеводороды | R–H | |||
| –F, –Cl, –Br, –I (–Hal) | галогены | Галогено-производные | R–Hal | |||
| –ОН | гидроксильная | Спирты Фенолы | R–OH Ar–OH | |||
| –О– | окси | Простые эфиры | R–O–R' | |||
| –SH | меркапто | Тиолы | R–SH | |||
| –Nh3 | амино | Амины (первичные) | R–Nh3 | |||
| – NO2 | нитро | Нитросоединения | R–NO2 | |||
| >C=O | карбонильная | Альгедиды Кетоны | R–CH=O R–CO–R' | |||
| –COOH | карбоксильная | Карбоновые кислоты | R–COOH | |||
| –SO3H | сульфо | Сульфокислоты | R–SO3H | |||
2. Понятие о взаимном влиянии атомов в молекуле, электронные эффекты (положительные и отрицательные индуктивный и мезомерный эффекты).
Согласно теории А.М. Бутлерова, свойства и реакционная способность молекулы во многом зависят от взаимного влияния атомов или групп атомов друг на друга. Результатом взаимного влияния атомов в молекулах является перераспределение электронной плотности, что вызывает изменение реакционной способности отдельных связей и молекулы в целом. Взаимное влияние передается с помощью электронных эффектов. Различают электроноакцепторные (оттягивающие электроны – эффект « – ») и электронодонорные (посылающие электроны – эффект « + ») заместители.
Индуктивный эффект (I-эффект) – передача электронного влияния заместителей по цепи σ-связей.
Заместитель, вызвавший появление в молекуле полярной связи, способствует поляризации ближайших двух-трех σ-связей и приводит к возникновению частичных зарядов (δ) на соседних атомах. Электроноакцепторные заместители (Х), уменьшающие электронную плотность соседних σ-связей, проявляют отрицательный индуктивный эффект (– I-эффект). Электронодонорные заместители (Y), повышающие электронную плотность соседних σ-связей, проявляют положительный индуктивный эффект (+I-эффект). Графически индуктивный эффект обозначают стрелкой на конце валентной черты с острием, направленным в сторону более электроотрицательного атома. Как правило, через три-четыре связи он уже не проявляется.
Мезомерный эффект (М-эффект) – передача электронного влияния заместителей по сопряженной системе. В отличие от индуктивного, мезомерный эффект не затухает, а передается по всей сопряженной системе, т.к. р- и π-электроны более подвижны, чем σ-электроны.
Заместители, отдающие пару электронов в сопряженную систему (электронодоноры), проявляют положительный (+М-эффект) мезомерный эффект. Этот эффект характерен для заместителей, содержащих гетероатомы с неподеленной электронной парой или целым отрицательным зарядом. Заместители, являющиеся участниками сопряженной системы и содержащие кратную связь с электроотрицательным атомом, оттягивающим на себя делокализованную электронную плотность системы, проявляют отрицательный мезомерный эффект (–М-эффект). Графически М-эффект обозначают изогнутыми стрелками, начало которых показывает, какие π- или р-электроны смещаются, а их конец указывает связь или атом, к которым они смещаются:
при оценке влияния заместителей на распределение электронной плотности в молекуле необходимо учитывать результирующее действие обоих эффектов. Например, в анилине отрицательный I-эффект перекрывается более сильным +М-эффектом. За редким исключением (атомы галогенов) мезомерный эффект превалирует над индуктивным.
studfiles.net
Кислородная функциональная группа - Большая Энциклопедия Нефти и Газа, статья, страница 3
Кислородная функциональная группа
Cтраница 3
О групповом составе кислородных соединений в смеси обычно судят по функциональным группам. Определение кислородных функциональных групп в нефтях, нефтяных остатках, смолах и ас-фальтенах является одним из перспективных методов изучения высокомолекулярных компонентов нефти. В частности, оно могло бы, вероятно, пролить свет на характер окислительных реакций, происходящих в природных условиях, и механизм асфальтообразова-ния, помочь решению вопроса о диагностике первичных смол. [31]
О групповом составе кислородсодержащих соединений в смеси обычно судят по функциональным группам. Определение кислородных функциональных групп непосредственно в нефтях, остатках, смолах, асфальтенах является одним из перспективных методов изучения компонентов нефти, ее генезиса, миграции, аккумуляции, а также ее высокомолекулярной части, так как при этом не требуется выделение, разделение и очистка от примесей анализируемых соединений. Эти методы необходимы также для оперативного контроля состава изучаемых нефтей и нефтепродуктов. [32]
Эти соединения содержат как кислородные функциональные группы только спиртов, их простых или сложных эфиров, так и сочетания этих функциональных групп. Любая кислородная функция, находящаяся в не основном сегменте, присоединенном к исходному амино-спирту, при классификации не принимается во внимание. [33]
Изучение инфракрасных спектров поглощения сернистых концентратов в области 2 - 15 мк при помощи однолучевого регистрирующего спектрофо-томера ИКС-11 ( призмы NaCl) не дало аналитически ценных результатов. Это объясняется тем, что ароматические структуры и кислородные функциональные группы, имеющиеся в соединениях сернистых концентратов, создают сложный фон поглощения, перекрывающий характеристические полосы поглощения связей серы. Кроме того, совместное присутствие сераорганических соединений разного строения значительно усложняет решение аналитических задач. [34]
Для классификации в данных субпозициях эфирные или сложноэфирные функциональные группы органической или неорганической кислоты рассматриваются либо как спиртовые, феноль-ные или кислотные функциональные группы в зависимости от положения кислородной функциональной группы по отношению к аминной группе. В этих случаях должны приниматься во внимание только те кислородные функциональные группы, которые представлены в той части молекулы, которая расположена между аминной функциональной группой и атомом кислорода любой рассматриваемой функциональной группы простого или сложного эфира. Если соединение содержит две или более функциональные группы простого или сложного эфира, то для целей классификации молекула разделяется на сегменты по атому кислорода каждой функциональной группы простого или сложного эфира, и учитываются только те кислородные функциональные группы, которые находятся в том же сегменте, что и аминная функциональная группа; сегмент, содержащий аминную функцию рассматривается как исходный ( parent) сегмент. [35]
В начале занятия уточняется классификация изученных органических соединений. Преподаватель предлагает учащимся ответить на вопрос: сколько классов органических соединений, содержащих кислородные функциональные группы, им известно. Изучено девять таких классов: спирты, фенолы, альдегиды, кетоны, органические кислоты, простые эфиры, сложные эфиры, ангидриды, хлоран-гидриды кислот. Необходимо предупредить распространенную ошибку, допускаемую учащимися, относящими фенол к ароматическим спиртам. Нужно пояснить, что фенол - это особый тип гидроксильных соединений, проявляющий слабокислые свойства. [36]
Известно, что с повышением температуры окисления со 150 до 350 содержание воды в отходящем газе увеличивается. Это количество воды легко может быть разделено на две части, обусловленные: а) образованием кислородных функциональных групп и б) другими реакциями дегидрирования. Таким путем были получены данные, приведенные на фиг. Они показывают, что повышение температуры окисления сопровождается заметным усилением реакций дегидрирования. [37]
Окисление соединения двухвалентной серы протекает сложно. По углеродным атомам молекулы оно идет по механизму радикально-цепной вырожденной реакции с образованием типичных для такого процесса кислородных функциональных групп. Атом же серы окисляется по ионному механизму, свободные валентные связи серы последовательно заполняются кислородом с образованием еульфоксидов, сульфонов, сульфоновых кислот и, наконец, сульфатов. Образуются и продукты взаимодействия соединений этой сложной системы. К наиболее глубокоокисленным сернистым соединениям в жидкой фазе следует отнести структуры, у которых свободная валентность атома серы полностью или почти полностью занята кислородом, например, сульфоновые кислоты, сульфонаты, сульфаты. По мере увеличения содержания кислорода в молекулах таких соединений их растворимость в углеводородной среде топлива падает. Наиболее глубоко окисленные структуры становятся растворимыми в воде и спирте. Однако в продуктах жидкофазного окисления соединений двухвалентной серы в моторном топливе образуются в основном соединения, хорошо растворимые в топливе. [38]
В составе нефтяных смол содержатся асфальтены, характеризующиеся конденсированными ароматическими кольцами и, следовательно, большим молекулярным весом, чем жидкая фаза, в растворе которой они находятся. Согласно данным, полученным Сергиенко [23], в средней молекуле нефтяных смол ( молекулярный вес 500 - 1200) кислорода содержится 0 8 - 3 2 атома, что дает основание предположить наличие нескольких кислородных функциональных групп. В этих же смолах обнаружено серы от 0 1 до 1 1 атома и азота-от 0 до 0 7 атома на среднюю молекулу. Отношение углерода к водороду указывает на циклические конденсированные структуры. [39]
Битум, полученный при низкотемпературном режиме продувки, содержит больше кислорода, чем исходная смола. При этом в ходе продувки содержание гидроксильных групп понижается, содержание карбонильных групп возрастает немного, а содержание неизвестного кислорода повышается значительно. Если продувка проводится при температуре выше 170 - 180 С, то содержание кислорода в битуме падает, а вместе с тем уменьшается и содержание кислородных функциональных групп. При 200 С начинает улетучиваться легкое масло, а с повышением температуры продувки до 250 С в составе летучих продуктов появляется водород. [40]
Эфирная функциональная группа не дает характеристических полос поглощения в видимой и ультрафиолетовой частях спектра, однако обычно наблюдается сильное поглощение в инфракрасной области между 1250 - 1060 см 1, обусловленное асимметрическими колебаниями. Эта ИК-полоса может маскироваться поглощением вследствие колебаний С-С. В связи с этим для кислородсодержащих соединений вывод о наличии простой эфирной группы из электромагнитного спектра может быть сделан только непрямым путем при условии отсутствия полос поглощения, характеристических для других кислородных функциональных групп, таких как ОН и С О например. [41]
Эфирная функциональная группа не дает характеристических полос поглощения в видимой и ультрафиолетовой частях спектра, однако обычно наблюдается сильное поглощение в инфракрасной области между 1250 - 1060 см -, обусловленное асимметрическими колебаниями. Эта ИК-полоса может маскироваться поглощением вследствие колебаний С-С. В связи с этим для кислородсодержащих соединений вывод о наличии простой эфирной группы из электромагнитного спектра может быть сделан только непрямым путем при условии отсутствия полос поглощения, характеристических для других кислородных функциональных групп, таких как ОН и С О например. [42]
Для классификации в данных субпозициях эфирные или сложноэфирные функциональные группы органической или неорганической кислоты рассматриваются либо как спиртовые, феноль-ные или кислотные функциональные группы в зависимости от положения кислородной функциональной группы по отношению к аминной группе. В этих случаях должны приниматься во внимание только те кислородные функциональные группы, которые представлены в той части молекулы, которая расположена между аминной функциональной группой и атомом кислорода любой рассматриваемой функциональной группы простого или сложного эфира. Если соединение содержит две или более функциональные группы простого или сложного эфира, то для целей классификации молекула разделяется на сегменты по атому кислорода каждой функциональной группы простого или сложного эфира, и учитываются только те кислородные функциональные группы, которые находятся в том же сегменте, что и аминная функциональная группа; сегмент, содержащий аминную функцию рассматривается как исходный ( parent) сегмент. [43]
Это содержание довольно существенно в углях начальной стадии метаморфизма: в бурых углях до 15 % кислорода входит в состав хиноидных групп и до 2 % - в состав альдегидных и кетонных групп. Последние быстро исчезают, их уже нет в жирных углях, тогда как хиноидные группировки не найдены только в антрацитах. Характерно, что доля хиноидного кислорода во всем кислороде угля сначала быстро уменьшается, если ее рассматривать как функцию выхода летучих веществ, принимая последний за критерий степени метаморфизма, с 15 - 16 % до 3 - 4 % ( при выходе летучих около 30 %), а затем вновь возрастает примерно до 8 %, Это показывает, что какое-то незначительное число хиноидных групп довольно стабильно и превосходит по своей стабильности другие кислородные функциональные группы. [44]
Однако удаление атома водорода из фенольной гидроксиль-ной группы фенилпропанового структурного звена не влияет на процесс окисления пропановой боковой цепи. В лигнине эта цепь обладает более высокой степенью окисления, чем кониферило-вый спирт, что указывает на дополнительное энзиматическое окисление, происходящее во время образования лигнина. Например, боковая цепь гваяцилацетона имеет стадию окисления пропил-гликоля, а а-этоксипропиогваякон - глицерина, тогда как вани-лоилацетил имеет пропильную боковую цепь с четырьмя кислородными функциональными группами. [45]
Страницы: 1 2 3 4
www.ngpedia.ru
Функциональные группы органических соединений » HimEge.ru
Функциональными группами называются группы атомов, которые обуславливают характерные химические свойства данного класса веществ.

Спирты
 Строение молекул спиртов R-OH. Атом кислорода, входящий в гидроксильную группу молекул спиртов, резко отличается от атомов водорода и углерода по способности притягивать и удерживать электронные пары. В молекулах спиртов имеются полярные связи С-О и О-Н.Учитывая полярность связи О-Н и значительный положительный заряд на атоме водорода, говорят, что водород гидроксильной группы имеет «кислотный» характер. Этим он резко отличается от атомов водорода, входящих в углеводородный радикал. Атом кислорода гидроксильной группы имеет частичный отрицательный заряд и две неподеленные электронные пары, что дает возможность молекулам спирта образовывать водородные связи.
Строение молекул спиртов R-OH. Атом кислорода, входящий в гидроксильную группу молекул спиртов, резко отличается от атомов водорода и углерода по способности притягивать и удерживать электронные пары. В молекулах спиртов имеются полярные связи С-О и О-Н.Учитывая полярность связи О-Н и значительный положительный заряд на атоме водорода, говорят, что водород гидроксильной группы имеет «кислотный» характер. Этим он резко отличается от атомов водорода, входящих в углеводородный радикал. Атом кислорода гидроксильной группы имеет частичный отрицательный заряд и две неподеленные электронные пары, что дает возможность молекулам спирта образовывать водородные связи.

Фенолы
По химическим свойствам фенолы отличаются от спиртов, что вызвано взаимным влиянием в молекуле фенола гидроксильной группы и бензольного ядра (фенил — С6Н5). Это влияние сводится к тому, что π-электроны бензольного ядра частично вовлекают в свою сферу неподеленные электронные пары атома кислорода гидроксильной группы, в результате чего уменьшается электронная плотность у атома кислорода. Это снижение компенсируется за счет большой поляризации связи О-Н, что в свою очередь приводит к увеличению положительного заряда на атоме водорода:

Следовательно, водород гидроксильной группы в молекуле фенола имеет кислотный характер.Влияние атомов в молекулах фенола и его производных взаимно. Гидроксильная группа оказывает влияние на плотность π-электронного облака в бензольном кольце. Она понижается у атома углерода, связанного с ОН-группой (т. е у 1-го и 3-го атомов углерода, метаположение) и повышается у соседних атомов углерода – 2, 4, 6-го – орто— и параположения.Водородные атомы бензола и орто— и параположения становятся более подвижными и легко замещаются на другие атомы и радикалы.
Альдегиды
Альдегиды имеют общую формулу  , где — С=О — карбонильная группа. Атом углерода в карбонильной группе sp2 – гибридизирован. Атомы, непосредственно с ним связанные, находятся в одной плоскости. Вследствие большой электороотрицательности атома кислорода по сравнению с углеродным связь С=О сильно поляризована за счет смещения электронной плотности π-связи к кислороду:
, где — С=О — карбонильная группа. Атом углерода в карбонильной группе sp2 – гибридизирован. Атомы, непосредственно с ним связанные, находятся в одной плоскости. Вследствие большой электороотрицательности атома кислорода по сравнению с углеродным связь С=О сильно поляризована за счет смещения электронной плотности π-связи к кислороду:

Под влиянием карбонильного атома углерода в альдегидах увеличивается полярность связи С–Н, что повышает реакционноспособность этого атома Н.
Карбоновые кислоты
 Карбоновые кислоты содержат функциональную группу
Карбоновые кислоты содержат функциональную группу  , называемую карбоксильной группой, или карбоксилом. Так она названа потому, что состоит из карбонильной группы -С=О и гидроксильной –ОН.В карбоновых кислотах гидроксильная группа связана с углеводородным радикалом и карбоксильной группой. Ослабление связи между кислородом и водородом в гидроксильной группе объясняется разностью электроотрицательностей атомов углерода, кислорода и водорода. Атом углерода приобретает некоторый положительный заряд. Этот атом углерода притягивает к себе электронное облако от атома кислорода гидроксильной группы. Компенсируя смещенную электронную плотность, атом кислорода гидроксильной группы оттягивает к себе электронное облако соседнего атома водорода. Связь О–Н в гидроксильной группе становится более полярной, и атом водорода приобретает большую подвижность.
, называемую карбоксильной группой, или карбоксилом. Так она названа потому, что состоит из карбонильной группы -С=О и гидроксильной –ОН.В карбоновых кислотах гидроксильная группа связана с углеводородным радикалом и карбоксильной группой. Ослабление связи между кислородом и водородом в гидроксильной группе объясняется разностью электроотрицательностей атомов углерода, кислорода и водорода. Атом углерода приобретает некоторый положительный заряд. Этот атом углерода притягивает к себе электронное облако от атома кислорода гидроксильной группы. Компенсируя смещенную электронную плотность, атом кислорода гидроксильной группы оттягивает к себе электронное облако соседнего атома водорода. Связь О–Н в гидроксильной группе становится более полярной, и атом водорода приобретает большую подвижность.
Образование водородных связей меду молекулами карбоновых кислот:

himege.ru
Функциональная группа Википедия
Бензил ацетат имеет эфирную функциональную группу (показано красным), ацетильную группу (зелёная) и бензильную группу (оранжевая).Функциональная группа — структурный фрагмент органической молекулы (некоторая группа атомов), определяющий её химические свойства. Старшая функциональная группа соединения является критерием его отнесения к тому или иному классу органических соединений[1].
Функциональные группы, входящие в состав различных молекул, обычно ведут себя одинаково в одной и той же химической реакции, хотя их химическая активность может быть различной.
Неоднозначность определения
Некоторые авторы не относят к функциональным группам такие структурные единицы как ароматические системы, сопряжённые связи и прочее. Однако согласно определению, приведенному выше, которое используется большинством авторов химической литературы, такие группы также можно причислять к функциональным группам, так как они в большой мере определяют химические свойства веществ.
В литературе можно встретить похожее понятие радикал или углеводородный радикал (не путать с понятием свободный радикал), чаще всего используемый для обозначения углеводородных заместителей в органической молекуле. Однако многие ученые не акцентируют внимание на различиях понятий углеводородный радикал и функциональная группа и используют оба понятия параллельно. Хотя это и достаточно близкие понятия, путать их не следует.
Особое внимание надо обратить на использование этих терминов в контексте ароматических фрагментов молекул. В таких случаях, если речь идёт о химической реакции с учётом ароматического фрагмента, то его следует называть функциональной группой, а если о фрагменте молекулы, который проявляет некий мезомерный или индуктивный эффект в молекуле, то его следует называть углеводородным радикалом.
Примеры функциональных групп
Известно более 100 функциональных групп.
- Функциональные группы, содержащие атом кислорода:
- Функциональные группы, содержащие атом азота:
- Функциональные группы, содержащие атом серы:
- тиольная (сульфгидрильная, меркапто-) –SH
- сульфидная >S
- дисульфидная –S–S–
- сульфоксидная >S=O,
- сульфонная >SO2 и др.
- Функциональные группы, содержащие ненасыщенные углерод-углеродные связи:
- Функциональные группы, содержащие прочие атомы:
Молекулы, в состав которых входит больше чем одна функциональныая группа называются полифункциональными.
При построении названия органического соединения, согласно номенклатуре ИЮПАК, отталкиваются от наличия в данном соединении функциональных групп.
Таблица функциональных групп
Углеводородные группы
Известно множество других функциональных групп из этой категории, носящих специфические названия, например: изопропил, трет-бутил и т.д.
Галогеновые группы
Функциональные группы, содержащие кислород
Этерная группа (R1-O-R2)
Карбонильная группа (R1-C(O)-R2)
Альдегидная группа (H-C(O)-R1)
Карбоксильная группа (R1-С(O)-OH)
Эстерная группа (R1-C(O)-O-R2)
Функциональные группы, содержащие азот
Аминогруппа (Nh3-R1)
Нитрогруппа (R1-NO2)
Нитрозогруппа (R1-N(O))
Функциональные группы, содержащие серу
Сульфогруппа (R1-SO3H)
Сульфиногруппа (R1-SO2H)
Гидроксисульфанил (R1-SOH)
Функциональные группы, содержащие фосфор
Примечания
- ↑ Химическая энциклопедия
wikiredia.ru




















