Уксусноэтиловый эфир. Формула уксусноэтиловый эфир
Уксусноэтиловый эфир Вики
| Этилацетат | |
 | |
 | |
| C4H8O2 | |
| 88,11 г/моль | |
| 0,902 г/см³ | |
| 25,13±0,01 мН/м[1], 23,39±0,01 мН/м[1], 20,49±0,01 мН/м[1], 17,58±0,01 мН/м[1] и 14,68±0,01 мН/м[1] | |
| 0,578±0,001 мПа·с[2], 0,423±0,001 мПа·с[2], 0,325±0,001 мПа·с[2] и 0,259±0,001 мПа·с[2] | |
| 10,01±0,01 эВ[3] | |
| −84 °C | |
| 77 °C | |
| 24±1 °F[3] и −4±1 °C[4] | |
| 2±1 об.%[3] и 2±0,1 об.%[4] | |
| 73±1 мм.рт.ст.[3], 10±1 кПа[5], 12,6±0,1 кПа[6] и 100±1 кПа[5] | |
| 1,3720 | |
| 1,78±0,09 Д[7] | |
| 141-78-6 | |
| 8857 | |
| 205-500-4 | |
| E1504 | |
| AH5425000 | |
| 27750 | |
| 8525 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
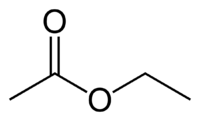
Этилацетат (этиловый эфир уксусной кислоты) СН3−СОО−Ch3−Ch4 — бесцветная летучая жидкость с резким запахом.
Получение[ | код]
Этилацетат образуется при прямом взаимодействии этанола с уксусной кислотой (реакция этерификации):
Ch4COOH+C2H5OH→Ch4COOC2H5+h3O{\displaystyle {\mathsf {CH_{3}COOH+C_{2}H_{5}OH\rightarrow CH_{3}COOC_{2}H_{5}+H_{2}O}}}Лабораторный метод получения этилацетата заключается в ацетилировании этилового спирта хлористым ацетилом или уксусным ангидридом:
Ch4COCl+C2H5OH→Ch4COOC2H5+HCl{\displaystyle {\mathsf {CH_{3}COCl+C_{2}H_{5}OH\rightarrow CH_{3}COOC_{2}H_{5}+HCl}}}К промышленным способам синтеза этилацетата относятся:
- Перегонка смеси этилового спирта, уксусной и серной кислот.
- Обработке этилового спирта кетеном.
- По реакции Тищенко из ацетальдегида при 0-5 °C в присутствии каталитических количеств алкоголята алюминия:
Физические свойства[ | код]
Бесцветная подвижная жидкость с резким запахом эфира. Молярная масса 88,11 г/моль, температура плавления −83,6 °C, температура кипения 77,1 °C, плотность 0,9001 г/см³, n204 1,3724. Растворяется в воде 12 % (по массе), в этаноле, диэтиловым эфире, бензоле, хлороформе; образует двойные азеотропные смеси с водой (т. кип. 70,4 °C, содержание воды 8,2 % по массе), этанолом (71,8; 30,8), метанолом (62,25; 44,0), изопропанолом (75,3; 21,0), CCl4 (74,7; 57), циклогексаном (72,8; 54,0) и тройную азеотропную смесь Э.: вода: этанол (т. кип. 70,3 °C, содержание соотв. 83,2, 7,8 и 9 % по массе).[8]
Применение[ | код]
Этилацетат широко используется как растворитель, из-за низкой стоимости и малой токсичности, а также приемлемого запаха. В частности, как растворитель нитратов целлюлозы, ацетилцеллюлозы, жиров, восков, для чистки печатных плат, в смеси со спиртом — растворитель в производстве искусственной кожи. Годовое мировое производство в 1986 году составляло 450—500 тысяч тонн. Мировое производство этилацетата на 2014 год составляет около 3,5 млн тонн в год.
Один из самых популярных ядов, применяемых в энтомологических морилках для умерщвления насекомых[источник не указан 178 дней]. Насекомые после умерщвления в его парах гораздо мягче и податливее в препарировании, чем после умерщвления в парах хлороформа.
Обладая фруктовым запахом применяется как компонент фруктовых эссенций. Зарегистрирован в качестве пищевой добавки E1504 (ароматизатор). Добавляется в состав водок (либо образуется при реакции содержащегося в них этилового спирта с добавляемыми уксусной кислотой или уксуснокислыми солями) для смягчения запаха и вкуса спирта[9].
Лабораторное применение[ | код]
Этилацетат часто используется для экстракции, а также для колоночной и тонкослойной хроматографии. Редко в качестве растворителя для проведения реакций из-за склонности к гидролизу и переэтерефикации.
Используется для получения ацетоуксусного эфира:[10]:
2Ch4COOC2H5→Ch4COCh3COOC2H5{\displaystyle {\mathsf {2CH_{3}COOC_{2}H_{5}\rightarrow CH_{3}COCH_{2}COOC_{2}H_{5}}}}Очистка и сушка[ | код]
Продажный этилацетат обычно содержит воду, спирт и уксусную кислоту. Для удаления этих примесей его промывают равным объёмом 5 % карбоната натрия, сушат хлоридом кальция и перегоняют. При более высоких требованиях к содержанию воды несколько раз (порциями) добавляют фосфорный ангидрид, фильтруют и перегоняют, защищая от влаги. С помощью молекулярного сита 4А содержание воды в этилацетате можно снизить до 0,003 %.
Безопасность[ | код]
ЛД50 для крыс составляет 11,6 г/кг, показывая низкую токсичность. Пары этилацетата раздражают слизистые оболочки глаз и дыхательных путей, при действии на кожу вызывают дерматиты и экземы. ПДК в воздухе рабочей зоны 200 мг/м³. ПДК в атмосферном воздухе населенных мест 0,1 мг/м³[11].
Температура вспышки — 2 °C, температура самовоспламенения — 400 °C, концентрационные пределы взрыва паров в воздухе 2,1—16,8 % (по объёму).
Безопасность при транспортировке. В соответствии с ДОПОГ (ADR) класс опасности 3, код по реестру ООН 1173.
Примечания[ | код]
- ↑ 1 2 3 4 5 CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6–183. — ISBN 978-1-4822-0868-9
- ↑ 1 2 3 4 CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6–232. — ISBN 978-1-4822-0868-9
- ↑ 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0260.html
- ↑ 1 2 CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 16–22. — ISBN 978-1-4822-0868-9
- ↑ 1 2 CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6–99. — ISBN 978-1-4822-0868-9
- ↑ CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 15–17. — ISBN 978-1-4822-0868-9
- ↑ CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 9–56. — ISBN 978-1-4822-0868-9
- ↑ Химическая энциклопедия, Москва 1998, с. 494.
- ↑ Ильина Е. В., Макаров С. Ю., Славская И. Л. Технология и оборудование для производства водок и ликёроводочных изделий // Учебное пособие — М.: ДеЛи плюс, 2013. — 492 с. ISBN 978-5-905170-40-9 С. 24, 27, 92, 102-104, 118.
- ↑ Органикум. Том 2. Москва, Мир, 1992, с. 180.
- ↑ Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест
Литература[ | код]
- ГОСТ 8981-78 «Эфиры этиловый и нормальный бутиловый уксусной кислоты технические. Технические условия». (С изменениями № 1, 2, 3, 4).
ru.wikibedia.ru
Уксусноэтиловый эфир Википедия
| Этилацетат | |
 | |
 | |
| C4H8O2 | |
| 88,11 г/моль | |
| 0,902 г/см³ | |
| 25,13±0,01 мН/м[1], 23,39±0,01 мН/м[1], 20,49±0,01 мН/м[1], 17,58±0,01 мН/м[1] и 14,68±0,01 мН/м[1] | |
| 0,578±0,001 мПа·с[2], 0,423±0,001 мПа·с[2], 0,325±0,001 мПа·с[2] и 0,259±0,001 мПа·с[2] | |
| 10,01±0,01 эВ[3] | |
| −84 °C | |
| 77 °C | |
| 24±1 °F[3] и −4±1 °C[4] | |
| 2±1 об.%[3] и 2±0,1 об.%[4] | |
| 73±1 мм.рт.ст.[3], 10±1 кПа[5], 12,6±0,1 кПа[6] и 100±1 кПа[5] | |
| 1,3720 | |
| 1,78±0,09 Д[7] | |
| 141-78-6 | |
| 8857 | |
| 205-500-4 | |
| E1504 | |
| AH5425000 | |
| 27750 | |
| 8525 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Этилацетат (этиловый эфир уксусной кислоты) СН3−СОО−Ch3−Ch4 — бесцветная летучая жидкость с резким запахом.
Получение
Этилацетат образуется при прямом взаимодействии этанола с уксусной кислотой (реакция этерификации):
Ch4COOH+C2H5OH→Ch4COOC2H5+h3O{\displaystyle {\mathsf {CH_{3}COOH+C_{2}H_{5}OH\rightarrow CH_{3}COOC_{2}H_{5}+H_{2}O}}}Лабораторный метод получения этилацетата заключается в ацетилировании этилового спирта хлористым ацетилом или уксусным ангидридом:
Ch4COCl+C2H5OH→Ch4COOC2H5+HCl{\displaystyle {\mathsf {CH_{3}COCl+C_{2}H_{5}OH\rightarrow CH_{3}COOC_{2}H_{5}+HCl}}}К промышленным способам синтеза этилацетата относятся:
- Перегонка смеси этилового спирта, уксусной и серной кислот.
- Обработке этилового спирта кетеном.
- По реакции Тищенко из ацетальдегида при 0-5 °C в присутствии каталитических количеств алкоголята алюминия:
Физические свойства
Бесцветная подвижная жидкость с резким запахом эфира. Молярная масса 88,11 г/моль, температура плавления −83,6 °C, температура кипения 77,1 °C, плотность 0,9001 г/см³, n204 1,3724. Растворяется в воде 12 % (по массе), в этаноле, диэтиловым эфире, бензоле, хлороформе; образует двойные азеотропные смеси с водой (т. кип. 70,4 °C, содержание воды 8,2 % по массе), этанолом (71,8; 30,8), метанолом (62,25; 44,0), изопропанолом (75,3; 21,0), CCl4 (74,7; 57), циклогексаном (72,8; 54,0) и тройную азеотропную смесь Э.: вода: этанол (т. кип. 70,3 °C, содержание соотв. 83,2, 7,8 и 9 % по массе).[8]
Применение
Этилацетат широко используется как растворитель, из-за низкой стоимости и малой токсичности, а также приемлемого запаха. В частности, как растворитель нитратов целлюлозы, ацетилцеллюлозы, жиров, восков, для чистки печатных плат, в смеси со спиртом — растворитель в производстве искусственной кожи. Годовое мировое производство в 1986 году составляло 450—500 тысяч тонн. Мировое производство этилацетата на 2014 год составляет около 3,5 млн тонн в год.
Один из самых популярных ядов, применяемых в энтомологических морилках для умерщвления насекомых[источник не указан 178 дней]. Насекомые после умерщвления в его парах гораздо мягче и податливее в препарировании, чем после умерщвления в парах хлороформа.
Обладая фруктовым запахом применяется как компонент фруктовых эссенций. Зарегистрирован в качестве пищевой добавки E1504 (ароматизатор). Добавляется в состав водок (либо образуется при реакции содержащегося в них этилового спирта с добавляемыми уксусной кислотой или уксуснокислыми солями) для смягчения запаха и вкуса спирта[9].
Лабораторное применение
Этилацетат часто используется для экстракции, а также для колоночной и тонкослойной хроматографии. Редко в качестве растворителя для проведения реакций из-за склонности к гидролизу и переэтерефикации.
Используется для получения ацетоуксусного эфира:[10]:
2Ch4COOC2H5→Ch4COCh3COOC2H5{\displaystyle {\mathsf {2CH_{3}COOC_{2}H_{5}\rightarrow CH_{3}COCH_{2}COOC_{2}H_{5}}}}Очистка и сушка
Продажный этилацетат обычно содержит воду, спирт и уксусную кислоту. Для удаления этих примесей его промывают равным объёмом 5 % карбоната натрия, сушат хлоридом кальция и перегоняют. При более высоких требованиях к содержанию воды несколько раз (порциями) добавляют фосфорный ангидрид, фильтруют и перегоняют, защищая от влаги. С помощью молекулярного сита 4А содержание воды в этилацетате можно снизить до 0,003 %.
Безопасность
ЛД50 для крыс составляет 11,6 г/кг, показывая низкую токсичность. Пары этилацетата раздражают слизистые оболочки глаз и дыхательных путей, при действии на кожу вызывают дерматиты и экземы. ПДК в воздухе рабочей зоны 200 мг/м³. ПДК в атмосферном воздухе населенных мест 0,1 мг/м³[11].
Температура вспышки — 2 °C, температура самовоспламенения — 400 °C, концентрационные пределы взрыва паров в воздухе 2,1—16,8 % (по объёму).
Безопасность при транспортировке. В соответствии с ДОПОГ (ADR) класс опасности 3, код по реестру ООН 1173.
Примечания
- ↑ 1 2 3 4 5 CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6–183. — ISBN 978-1-4822-0868-9
- ↑ 1 2 3 4 CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6–232. — ISBN 978-1-4822-0868-9
- ↑ 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0260.html
- ↑ 1 2 CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 16–22. — ISBN 978-1-4822-0868-9
- ↑ 1 2 CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6–99. — ISBN 978-1-4822-0868-9
- ↑ CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 15–17. — ISBN 978-1-4822-0868-9
- ↑ CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 9–56. — ISBN 978-1-4822-0868-9
- ↑ Химическая энциклопедия, Москва 1998, с. 494.
- ↑ Ильина Е. В., Макаров С. Ю., Славская И. Л. Технология и оборудование для производства водок и ликёроводочных изделий // Учебное пособие — М.: ДеЛи плюс, 2013. — 492 с. ISBN 978-5-905170-40-9 С. 24, 27, 92, 102-104, 118.
- ↑ Органикум. Том 2. Москва, Мир, 1992, с. 180.
- ↑ Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест
Литература
- ГОСТ 8981-78 «Эфиры этиловый и нормальный бутиловый уксусной кислоты технические. Технические условия». (С изменениями № 1, 2, 3, 4).
wikiredia.ru
Этилацетат | Info-Farm.RU
Этилацетат — органическое соединение ряда эфиров. Имеет химический состав CH 3 COOC 2 H 5 и условно рассматривается как продукт взаимодействия этанола и уксусной кислоты. При обычных условиях представляет собой бесцветную жидкость с приятным, фруктовым запахом. Хорошо растворяется в воде, неограниченно смешивается с этанолом.
Широко применяется как растворитель в производств покрытий, адгезивов, лекарственных средств, а также как экстрагент в пищевой промышленности.
Физические свойства
Этилацетат собой бесцветную жидкость с фруктовым запахом. Он образует азеотропную смесь с водой, кипит при 70,38 ° C и содержит 8,47% воды и 91,53% эфира. Выделение этилацетата с водно-этанольного раствора происходит в виде азеотропной смеси эфир-спирт-вода, кипит при 70,2 ° C и содержит 9,0% воды, 8,4% этанола и 82,6% эфира.
| 0,9245 | 0,9126 | 0,9006 | 0,8884 | 0,8759 | 0,8632 | 0,8503 | 0,8370 | 0,8234 | 0,8095 | 0,7952 |
| 0,578 | 0,423 | 0,325 | 0,259 |
Получение
Основным применяемым методом для синтеза этилацетата является взаимодействие уксусной кислоты и этанола (этерификация):
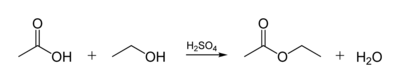
Выделение эфира из реакционной смеси происходит в виде азеотропной смеси эфир-спирт-вода. После декантации и очистки конечный выход продукта составляет 95%.
Уксусная кислота является сравнительно слабым ацилюючим агентом, поэтому для увеличения эффективности синтеза применяют хлороангидрид кислоты:
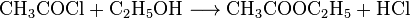
Дня связывания образованного хлороводорода в реакционную смесь добавляют третичный амин (например, пиридин).
Другим способом является реакция Тищенко с участием этаналя:
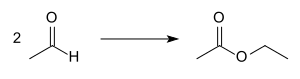
Взаимодействие проходит в неводной среде при низкой температуре (0-5 ° C) и в присутствии катализатора, например, алкоксиды алюминия Al (OR) 3 или титана Ti (OR) 4 (R — алкильный заместитель).
Химические свойства
Этилацетат подвергается гидролизу, образуя уксусную кислоту и этанол. Распад эфира ускоряется в присутствии кислот или оснований:
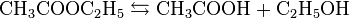
Как типичный эфир, этилацетат может реагировать с реактивами Гриньяра с образованием третичных спиртов:
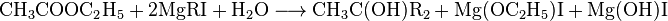
Под действием сильных восстановителей, таких как борогидрид или алюмогидрида щелочных металлов, эфир восстанавливается до первоначального спирта:
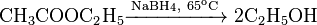
Применение
Этилацетат является распространенным растворителем в изготовлении покрытий, адгезивных материалов, чернил, косметики, фармацевтических препаратов. При производстве кофе без кофеина его применяют как экстрагент.
Видео по теме
Изображения по теме
info-farm.ru
Уксусноэтиловый эфир свойства - Справочник химика 21
Физические свойства. Сложные эфиры могут быть как жидкими, так и твердыми веществами в зависимости от молекулярной массы образующих их кислоты и спирта. Сложные эфиры низших и средних гомологов — летучие жидкости с характерным, часто приятным запахом. Многие из них являются носителями запаха различных плодов, овощей и фруктов. Сложные эфиры труднее растворимы в воде, чем образующие их спирты и кислоты. Так, этиловый спирт и уксусная кислота смешиваются с водой во всех отношениях, тогда как уксусноэтиловый эфир трудно растворим в воде. В органических растворителях сложные эфиры растворяются хорошо. [c.180] Диэтиловый эфир в небольших количествах усиливает запах спирта, муравьиноэтиловый и уксусноэтиловый эфиры смягчают вкус спирта. Тем же свойством обладает аммиак. Эфиры с большим числом атомов углерода сообщают спирту несвойственный ему фруктовый или цветочный запах. Метил- и этиламины, меркаптаны, диоксид серы, сернистый водород вызывают неприятные вкус и запах, например триметиламин обладает отвратительным запахом ворвани и рыбьего жира. [c.304]Ионообменный катализ — одна из важнейших и весьма быстро развивающихся областей применения ионитовых смол [1—3]. Однако наряду с несомненными и большими достоинствами синтетических ионитов как катализаторов процессов кислотно-основного типа в растворах (легкость отделения их от реакционной массы, простота регенерации, высокая избирательность, хороший выход, чистота получаемых продуктов и т. д.) они обладают и рядом существенных недостатков, прежде всего явно неудовлетворительной для многих целей химической и термической устойчивостью [4]. Это предопределяет необходимость поисков ионообменных катализаторов, свободных от указанных недостатков. Большого внимания заслуживают в этом отношении активированные угли, которые в зависимости от химической природы их поверхности, иначе говоря, от условий взаимодействия угля с кислородом, могут проявлять как анионообменные так и катионообменны е свойства [5—7]. Имелись, в частности, веские основания предполагать [8], что так называемый окисленный уголь Дубинина — Кройта, являющийся полифункциональным катионитом [9] , будет служить эффективным катализатором химических процессов, ускоряемых в растворах водородными ионами. Исходя из этого, в настоящей работе каталитическое действие активных углей исследовалось преимущественно на примерах протолитических реакций кислотного типа. Наиболее детально были изучены реакции инверсии сахарозы, гидролиза уксусноэтилового эфира и пинаколиновой перегруппировки, из которых первая и третья ускоряются только ионами водорода [10, 11], а вторая — как водородными, так и, особенно сильно, гидроксильными ионами [10]. [c.32]
Химические свойства. Сложные эфиры — нейтральные вещества. Им свойственно омыление, которое в живой природе происходит под действием ферментов (энзимов). В лаборатории оно достигается действием кислот и щелочей. Например, при нагревании с водой в присутствии кислоты (или щелочи) уксусноэтиловый эфир разлагается на уксусную кислоту и этиловый спирт [c.341]
Опишите физические свойства уксусноэтилового эфира, которые вам удалось наблюдать в этой работе. [c.113]
Свойства. Желто-зеленый порошок, in л >800 С сублимируется при температуре красного каления d 3,63. Почти не растворяется в воде, спирте, ацетоне, уксусноэтиловом эфире, уксусном ангидриде, ледяной уксусной кислоте, толуоле, I4, хлороформе и S2. При действии гидроксида натрия VF3 чернеет. [c.287]Триметил- и триэтиламины можно обнаружить наряду с моно- и диалкильными соединениями при помощи калийиодистой ртути (реактива Несслера), воспользовавшись их свойством при большом разбавлении выделять соединение RsNHJ HgJs, которое можно извлечь из смеси прибавлением равных количеств хлороформа и уксусноэтилового эфира [c.708]
Одно из характерных химических свойств сложных эфиров — способность разлагаться водою (гидролизоваться) с образованием кислоты и спирта. Например, уксусноэтиловый эфир СН3СООС2Н5 дает при гидролизе уксусную кислоту и этиловый спирт [c.240]
Уже в 1881 г. Меншуткин, сопоставив скорости этерификации спиртов различного строения, заметил ...углеводородные остатки понижают способность спиртов образовывать эфиры вводя в эти остатки галогены, удаляя эти остатки по характеру еще более от водорода, должно этим еще более понизить эту способность [154, стр. 302]. Однако уже в выводах рассматриваемой статьи Меншуткин выразил свои взгляды более определенно. По его мнению, с введением в цепь электроотрицательных элементов, подобных хлору, или групп, подобных ОН (подчеркнуто мной.— в. К.), этерификационная способность падает [154, стр. 315]. В следующем году Меншуткин обнаружил, что в противоположность влиянию водорода на скорость этерификации спиртов в кислотах металлический (электроположительный.— В. К.) характер водорода содействует уменьшению кислотных свойств [155, стр. 118]. Одновременно с Меншуткиным Вардер, изучая скорости омыления уксусноэтилового эфира гидратом окиси натрия в интервале температур от 3,6 до 37,7° С, показал, что электрическая проводимость реакционной смеси увеличивается при росте температуры медленнее, чем скорость этерификации [156, стр. 349]. Каяндер считал, что зависимость между электропроводностью какого-либо раствора кислоты и скоростьк совершающейся в нем реакции растворения (металла.— В. К.).. совершенно ясна [157, стр. 475]. [c.38]
Несмотря на это, Каррара искал объяснение действию инертных растворителей на скорости реакций в химических свойствах их молекул. К аналогичному выводу пришел также Гемптин, изучив влияние природы растворителей на скорости образования бромистого тетраэтил аммония [205] и рассмотрев скорости омыления уксусноэтилового эфира [206] в различных растворителях. [c.53]
Получить кислоту в более чистом состоянии не удалось за неимением материала. Вся совокупность ее свойств, отношение к различным растворителям, в особенности к уксусноэтиловому эфиру, позволяют с уверенностью признать ее за 3-карбоксиадипи-новую кислоту [c.66]
Свойства. Антраниловая кислота — белый или слегка кремовый кристаллический порошок, сладкого вкуса, способный возгоняться т. п. 144—145°. Растворимость в воде 3,5 при 13,8" и очень хорошая при 100 в ЭО /о-ном спирте 1,07 при 9,6° в эфире 1,605 при 6,8° в сероуглероде 0,02 при 10,9° в уксусноэтиловом эфире 1,169 при 10°. Щелочные соли антраниловой кислоты хорошо растворимы в воде в концентрированных растворах они окрашены в желтоватый цвет, а в разбавленных растворах дают бело-голубую флюоресценцию. [c.17]
В отличие от своих предшественников Ловиц экспериментально установил оптимальные температурные границы при вымораживании уксуса. Оказалось, что лучше всего вымораживание вести при температуре 195—200° Делиля , т. е. около —30° Цельсия. Комбинированным путем вымораживания, перегонки, обработки углем и уксусноэтиловым эфиром — Ловиц и получил впервые свой ледяной уксус (A etum gla iale), свойства которого его чрезвычайно удивили. Вначале Ловиц несомненно сомневался в том, представляет ли собою полученный им продукт уксусную кислоту или же является каким-то другим соединением. Только после ряда испытаний, он, наконец, пришел к выводу, что ледяной уксус есть не что иное, как наиболее чистая, максимально концентрированная уксусная кислота. [c.493]
Предварительно учащиеся знакомятся с некоторыми свойствами органического стекла эластичностью, прочностью и т. п. Убеждаются, что горит оно лишь при постоянном нагревании. С помощью ацетона или уксусноэтилового эфира склеивают 2 пластинки плексигласса. [c.209]
Аналогия в свойствах уксуснокислого свинца и уксусного ангидрида, а также уксусноэтилового эфира, тоже легко конденсирующегося с альдегидами, не ограничивается высокой подвижностью их атомов водорода в метильной группе. Известно, что ангидриды и эфиры кислот грри многих реакциях служат эпилирующими агентами и вообще склонны к расщеплению связей по схеме [c.584]
Из диффузора или из центрофуги пироксилин, напитанный спиртом, поступает в мешатель, где при добавлении эфира желатинируется. Сначала для этой цели применяли уксусноэтиловый эфир, затем ацетон, в настоящее время применяют обычно смесь эфира и спирта. Основное требование, предъявляемое к летучему растворителю, заключается в том, чтобы он полностью мог быть удален из пороха или остающееся в порохе количество его было настолько мало, чтобы это совершенно не влияло на балистические свойства пороха, и второе, чтобы растворитель не оказывал а массу никакого химического воздействия. По этой причине применявшийся ранее во Франции труднолетучий амиловый спирт в настоящее время вышел из употребления. [c.277]Проведенные исследования обнаружили совершенно отчетливую связь между каталитическим действием активных углей и химической природой их поверхности (ионообменными свойствами) в то время как обычный, неокисленный уголь, электрохимический анионообменник [5, 6], не проявлял практически никакой каталитической активности (см., например, табл. 1), окисленный уголь Дубинина — Кройта, являюш ийся, как уже отмечалось, полифункциональным катионообменником [9], весьма эффективно ускорял все изученные процессы кислотного типа (помимо названных выше трех основных реакций, в этом плане были исследованы также реакции образования уксусноэтилового, олеиновобутилового эфиров, диметилового эфира адипиновой кислоты и получения 1,4-диоксана из этиленгликоля). Было установлено также, что, подобрав со-ответствуюш,им образом условия низкотемпературной обработки угля БАУ азотной кислотой, нетрудно получить катализатор, равноценный или даже превосходяш ий по активности образец ОУ, окисленный в токе воздуха при 450° С. Как видно из табл. 2, эффективность угля ОУ по Гам-метту [15] намного превосходит таковую не только карбоксильной смолы КБ-4П-2, но и сильнокислотного сульфокатионита КУ-2. [c.33]
chem21.info
Этилацетат
Новосибирск: +7(383) 3-34-34-34,8 (800) 200-11-66,Иркутск: +7 (3952) 475732
 Описание:
Описание:
Этилацетат (этиловый эфир уксусной кислоты) – бесцветная летучая жидкость с приятным фруктовым запахом. Получают этилацетат этерификацией уксусной кислоты этиловым спиртом-сырцом. Этилацетат хорошо растворяет смолы, жиры, масла, а также сложные эфиры целлюлозы.
Применение:
Этилацетат используют в производстве растворителей для пигментов, смол, красок, коллоксилинов, мастик, полиэфирных, нитроглифталевых, поливинилацетатных лаков, нитро- и этилцеллюлозы, различных масел, жиров, восков, в производстве люминофорных ламп, фотопленки, целлофана, клеев, резинотехнических изделий, пластмасс, винилискожи, клеенки, дерматина, бумвинила, линолеума, в полиграфической и кожевенно-обувной промышленности.
Технические характеристики:
Этилацетат марки А высший сорт |
|
| Внешний вид | бесцветная, прозрачная жидкость, не содержащая механических примесей |
| Цветность по Pt/Co шкале, не более | 5 |
| Плотность при 20 °С г/куб.см | 0.898-0.900 |
| Массовая доля основного вещества, % не менее | 99.6 |
| Массовая доля кислот в пересчете на уксусную кислоту, % не более | 0.004 |
| Массовая доля нелетучего остатка, % не более | 0.001 |
| Температурные пределы перегонки при давлении 760 мм рт. ст, t °С | 75-78 |
| Массовая доля воды, % не более | 0.13 |
| Относительная летучесть (по этиловому эфиру) | 2-3 |
Упаковка:
Отгрузка этилацетата производится наливом в ж/д цистерны, бензовозами, наливом в стальные 200 л бочки.
Хранение:
Этилацетат хранят в герметично закрытой таре вдали от нагревательных приборов, в сухом, хорошо проветриваемом помещении, предохраняя от прямых солнечных лучей, влаги. Беречь от огня! Гарантийный срок хранения 6 месяцев.
Транспортировка:
Этилацетат перевозят железнодорожным или автомобильным транспортом, в крытых транспортных средствах, железнодорожных цистернах, автоцистернах с соблюдением правил перевозок опасных грузов, действующих на транспорте данного вида.
Техника безопасности:
Этилацетат ГОСТ 8981-78 марки А первый сорт применяют в качестве растворителя в различных отраслях промышленности. При работе с этилацетатом должны применятся герметичные аппараты и оборудование. Помещения, в которых проводятся работы с этилацетатом, должны быть оборудованы приточно-вытяжной вентиляцией. При работе с этилацетатом необходимо пользоваться индивидуальными защитными средствами (перчатки, очки, фильтрующий промышленный противогаз марки А).
Этилацетат реализует компания "Логосиб".
Цены:
Несмотря на изначально низкие цены, мы делаем скидки в зависимости от объема закупаемого товара.
Качество:
Мы работаем непосредственно с производителями, поэтому обеспечиваем наших клиентов товарами высокого качества.
Оформление и отгрузка:
Благодаря отлаженной работе офиса и складов, мы предоставляем быстрое оформление и отгрузку товаров.
Доставка:
Мы предлагаем доставку товаров по России: •автотранспортом; •железнодорожными контейнерами, вагонами; •через транспортные компании.
Для получения подробной информации о ценах на этилацетат и условиях поставки звоните нашим специалистам по телефонам: +7 (383) 3-34-34-34 и 8-800-200-11-66 (бесплатный звонок по России).
www.logosib.ru
Уксусноэтиловый эфир, образование - Справочник химика 21
Классическим и простейшим примером сложноэфирной конденсации является образование ацетоуксусного эфира взаимодействием двух молекул уксусноэтилового эфира в присутствии этилата натрия [c.183]Из полученного уравнения следует, что в состоянии равновесия отношение произведений концентраций реагирующих веществ обратно отношению констант скоростей реакций. В случае реакции образования уксусноэтилового эфира в состоянии равновесия, как упомянуто выше, в реакционной смеси содержится по 1/3 моля кислоты и спирта и по 2/3 моля эфира и воды. Поэтому [c.205]
Открытие ацетат-иона. Ацетат-ион СН3СОО открывают в отдельной пробе раствора реакцией образования уксусноэтилового эфира, обладаюшего характерным приятным запахом (см. выше Аналитические реакции ацетат-иона СНзСОО" ). [c.496]Для реакции образования уксусноэтилового эфира [c.189]
Примером обратимой реакции является образование уксусноэтилового эфира из этилового спирта и уксусной кислоты [c.188]
Во МНОГИХ случаях удается эфиры кислот превращать в амидь. кислот, т. е. остаток оксалкила замещать остатком аммиака. Гофман 381 исследовал условия течения. этой реакции и определил границы её применения. Сводным аммиаком сравнительно гладко амиды образуют только эфиры, достаточно растворимые в воде. Так, из уксусноэтилового эфира получается ацетамид с выходом до 70% 382, так же получаются формамид и оксамид звз. Эфиры масляной и валериановой кислот.реагируют незначительно даже при месячном стоянии не ускоряет образование амида н спиртовый аммиак. В более короткое время, но при одновременном образовании аммониевой соли в качестве побочного продукта, идет реакция при нагревании эфиров кислот с водным аммиаком в запаянной трубке при 100° или, лучше, при 150°. [c.500]
Чтобы сместить равновесие в сторону образования продукта, т. е. повысить выход эфира, следует брать для реакции избыток кислоты или спирта, или удалять из сферы реакции образующийся эфир или воду. При получении низкокипящих сложных эфиров отгоняют из реакционной колбы эфир, а при получении высококипящих сложных эфиров — воду. Например, при получении уксусноэтилового эфира (т. кип. 77° С) отгоняют сам эфир, а при получении уксусноизоамилового эфира (т. кип. 142° С) — воду. [c.156]
Уксусноэтиловый эфир, не содержащий вовсе этилового спирта, не взаимодействует с натрием. Следовательно, конденсирующим средством является не металлический натрий, а алкоголят натрия, образующийся при воздействии натрия на спирт, обычно имеющийся в эфире в качестве примеси. Наиболее правильно образование натрийацетоуксусного зфира изображается следующим уравнением [c.340]
В каждый данный момент большое число молекул уксусной кислоты и этилового спирта взаимодействуют между собой и одновременно с этим также большое число молекул уксусноэтилового эфира разлагаются водой. Скорости этих процессов вначале различны, но потом наступает момент, когда становится равной ьч и система приходит в состояние равновесия, хотя и в этот момент продолжают идти реакции как образования сложного эфира, так и его омыления. [c.95]
Реакция образования уксусно тилового эфира (фармакопейная). Ацетат-ион в сернокислой среде (концентрированна h3SO4) реагирует со спиртами с образованием сложных эфиров уксусной кислоты. Так, при взаимодействии с этанолом образуется уксусноэтиловый эфир (этилаце-тат) СН3СООС2Н5 [c.472]
Уксусноэтиловый эфир при взаимодействии с концентрированным водным раствором аммиака подвергается расщеплению (аммонолизу) с образованием ацетамида и этилового спирта [c.154]
Механизм реакции образования ацетоуксусного эфира был разобран выше. При проведении синтеза необходимо обратить внимание на тш,ательное высушивание как уксусноэтилового эфира, так и прибора, в котором проводится реакция. [c.179]
Ацетат калня белый кристаллический гигроскопический порошок без запаха или со слабым запахом уксусной кислоты солоноватого вкуса, т. пл. 292°, легко растворим в воде и в спирте. Водные растворы нейтральной или слабощелочной реакции. Ацетат-ион устанавливают по образованию уксусноэтилового эфира, определяемого по запаху при нагревании соли со спиртом и серной кислотой [c.154]
Хотя уксусноэтиловый эфир в присутствии натрия легко конденсируется с образованием ацетоуксусного эфира, реакция эта [c.316]
Азлактон можно перекристаллизовывать из спирта, из четыреххлористого углерода или из уксусноэтилового эфира с добавкой петролейного эфира. Водных растворителей следует избегать, так как вода легко расщепляет кольцо азлактона. Если применять для перекристаллизации спирт, то можно опасаться, что кольцо азлактона расщепится с образованием сложного эфира, особенно при продолжительном нагревании раствора. [c.73]
Названия сложных эфиров по МН производят аналогично названиям солей, указывая на кислоту и спирт, из которых был образован данный эфир, например уксусноэтиловый эфир, или этиловый эфир уксусной кислоты. Подобно солям, сложные эфиры называют также сокращенно, исходя из латинских названий соответствующих кислот. [c.76]
При синтезе ацетоуксусного эфира избыток уксусноэтилового эфира не только служит растворителем, но и препятствует образованию побочных продуктов сс-дикетона и ацилоина, которые могут получаться в присутствии больших количеств натрия. [c.277]
Образование уксусноэтилового эфира [c.61]
Эфиры кислот малого молекулярного веса легко вступают во взаимодействие с гидразином, но с возрастанием молекулярного веса требуются более жесткие условия. Эфиры ароматических кислот менее реакционноспособны, чем эфиры алифатических кислот для проведения реакции с ними и с наиболее инертными эфирами алифатических кислот иногда требуется продолжительное нагревание с гидразином при высокой температуре в запаянных трубках. Разветвление углеродной цепи в а-положении к карбоксильной группе замедляет образование гидразидов. Так, например, уксусноэтиловый эфир реагирует с гидразином самопроизвольно при комнатной температуре, этиловый эфнр триметилуксусной кислоты вступает в реакцию только при нагревании до НО , а из диэтилового эфира адамантан-1,3-дикарбоновой кислоты (1) не удалось получить гидразид, хотя были испытаны различные условия [17]. [c.324]
Реакция уксусноэтилового эфира СНзСООСгНз с водой протекает с образованием уксусной кислоты и этилового спирта СН,С00С2Н,+НаО СН,СООН+СаН,ОН [c.35]
Реакция уксусноэтилового эфира СН3СООС2Н5 с водой протекает с образованием уксусной кислоты и этилового спирта [c.57]
Открытие ионов СН3СОО . К 3—5 каплям испытуемого раствора прибавьте столько же этилового спирта и столько же концентрированной HjSO . Характерный запах уксусноэтилового эфира указывает на присутствие ионов СН3СОО . Составьте уравнение реакции образования эфира. Объясните роль серной кислоты. [c.291]
Реакция образования уксусноэтилового эфира. Поме стите в пробирку 0,5 мм раствора ацетата натрия, 1 мл этилового спирта и 0,5 мл концентрированной Н2504. При нагревании смеси наблюдается образование уксусноэтилового эфира. [c.383]
Реакция этерификации обратима поэтому при проведении ее обычно приходится принимать меры к тому, чтобы сместить равновесие в нужном направлении. В данном случае, так как уксусноэтиловый эфир легколетуч, то отгонка его из реакционной смеси по мере его образования обусловливает смещение равновесия рассматриваемой реакции вправо и практически полное его протекание. [c.82]
А. В. Карташев исследовал также процесс нитрования фенола в растворе уксусноэтилового эфира. Произведенные им наблюдения показали, что в ходе процесса можно выделить Два периода начальный период, проходящий без изменения температуры реагирующей смеси, и второй период экзотермической реакции, причем подъем температуры происходит вначале медленно, а эатем более быстро. Такое течение реакции указывает, что при взаимодействия между фенолом и азотной кислотой имеет место автокаталитический процесс, развитие и протекание которого происходят за счет некоторой промежуточной реакции, являющейся источником образования катализатора. [c.95]
С другой стороны, нет никакой необходимости писать развернутую формулу, например, этилового спирта при рассмотрении реакции образования хлористого этила, этилового эфира, уксусноэтилового эфира и вообще во всех тех случаях, когда радикал этил не претерпевает никаких изменений в процессе реакции. Из тех же соображений совершенно излишне давать развернутую формулу строения серной кислоты при изучении реакции образования этилена или хлористого этила. В таких случаях вполне можно ограничиться рациональными формулами Н—504Н или НО—80зН, которые достаточно хорошо позволяют объяснить ход реакции тогда, когда радикал серной кислоты остается без изменения. Умение пользоваться формулами строения для объяснения механизма реакций помогает обобщать материал занятий. [c.13]
Из раствора, содержащего аммиак, N11 01 и сегнетовую соль при pH 9, висмут осаждается количественно с образованием интенсивножелтого осадка, растворимого в уксусноэтиловом эфире. [c.155]
Можно понижать щелочность реакционной массы даже при применении сернистого натрия, вводя в реакционную смесь вещества, могущие нейтрализовать свободную образующуюся щелочь. Бранд применял в своих лабораторных опытах уксусноэтиловый эфир, омыляющийся от действия свободной щелочи, причем уксусная кислота образовывала соль с едким натром, и получал хороший выход л-нитранилина из динитробензола. А. А. Разумееа с успехом испытывал применение бикарбоната натрия, связывающего едкий натр с образованием соды Можно также прибавлять к раствору сернистой шелочи растворимую аммиачную соль, например сульфат, и проводить реакцию практически посредством сернистого аммония. [c.148]
Чрезвычайно важно отношение озонидов к воде, так как при действии последней озониды более или менее легко расщепляются с образованием альдегидов, кетонов и их перекисей и кислот, в зависимости от условий и строения. Расщепление всегда происходит между углеродными атомами, которые в исходном веществе были соединены двойной связью. На этой реакции основан важный способ определения положения двойной связи в соединении, выгодно отличающейся от ненадежных способов с применением щелочных или кислых реактивов. Общий метод озгонирования заключается в пропускании сухого озонированного воздуха или кислорода (1—15% озона) через раствор ненасыщенного соединения в подходящем растворителе. Для этой цели в качестве растворителей обычно применяют хлороформ, четыреххдористый углерод, гексан, уксусноэтиловый эфир для работы при низкой температуре или с нестойкими озонидами весьма рекомендуется пользоваться в качестве растворителя хлористым этилом. Пропускание озонированного воз-,духа продолжают до тех пор, пока раствор еще содержит неизмененное ненасыщенное соединение. По окончании реакции растворитель удаляют в вакууме, причем озонид остается обычно в виде вязкого масла с неприятным запахом. Лишь некоторые озониды были получены в кристаллическом состоянии. [c.32]
Конденсация с образованием эфира [5-кетонокислоты при действии натрия или алкоголята натрия может протекать между двумя различными эфирами. При этом необходи/мо, чтобы один из компонентов реагировал достаточно быстро, а возможность внутренней конденсации была бы исключена. Например, для этой цели можно пользоваться эфирами муравьиной и щавелевой кислот и с меньшим успехом эфирами бензойной кислоты. При конденсации щавелевоэтилового эфира с уксусноэтиловым эфиром в присутствии натрия образуется щавелевоуксусный эфир-(XXI) 9 с эфиром пропионовой кислоты получается а-метил-щавелевоуксусный эфир (XXII) 9 , а с эфиром фенилуксусной кТн-слоты а-фенилщавелевоуксусный эфир (XXIII) в [c.312]
Третичные амины, благодаря своему строению, не способны к образованию амидов при взаимодействии с хлорангидридами или ангидридами кислот. Однако они могут давать с хлорангидридами продукты присоединения, которые обычно разлагаются при действии воды с образованием исходного амина. Например, продукт присоединения 1 моля пиридина к 1 молю хлористого ацетила при действии спирта превращается в солянокислый пиридин и уксусноэтиловый эфир 21. Хлористый юксалил также образует продукт присоединения к лиридину Кроме того, описаны соединения, образующиеся при взаимодействии хлористого бензоила и хлористого ацетила с триэтиламином, пиридином, диметиланилином и некоторыми другими третичными аминами Продукты присоединения триметиламина к арилсульфохлоридам сравнительно стойки к действию воды и дают хлороплатииаты и хлораураты [c.347]
По нашим данным, па промышленном алюмосиликате уже при 200° реакция этерификации уксусной кислоты этиловым спиртом проходит почти нацело с образованием уксусноэтилового эфира и воды. Менее селективно и с меньшим выходом (20,7%) эта реакция протекает на Ti02 при 350°. Наряду с образованием эфира и воды, получались газы, годержавшие СО2, СО, непредельные и предельные соединения это [c.299]
chem21.info
Опыт 40. Получение уксусноэтилового эфира
из "Качественные микрохимические реакции по органической химии Издание 2"
Напишите уравнение реакции образования амилацетата по аналогии с образованием этилацетата (опыт 40). [c.90] При недостатке уксусной кислоты и относительном избытке серной кислоты может образоваться непредельный углеводород амилен, неприятно пахнущий. [c.90] Попробуйте написать схему его образования, руководствуясь схемой, приведенной в опыте 38. [c.90] Уксусноизоамиловый эфир входит в состав грушевой эссенции. Используется также для склеивания кинопленки, которую он легко растворяет. Он широко применяется при изготовлении нитролаков, в том числе широко известного лака для окраски ногтей. [c.91] Пары амилацетата вредны и вызывают раздражение дыхательных путей. При неаккуратной работе находящиеся в лаборатории начинают кашлять. [c.91] При нагревании реакция идет в обратном направлении — полимер деполимеризуется. [c.91] Небольшой кусочек плeк иглa a положите в среднюю часть горизонтально расположенной пробирки. Осторожно нагревайте его над пламенем микрогорелки. Обратите внимание на то, как стеклообразный полимер постепенно начинает плавиться, а затем в пробирке появляются его пары. Слегка наклоните пробирку, чтобы образовавшийся жидкий мономер стекал в нижнюю, ненагретую часть пробирки. Метилмета-крилат распознают по характерному запаху. [c.91] По окончании деполимеризации, когда пробирка остынет, добавьте постепенно, при встряхивании, несколько капель бромной воды (9). Убедитесь в том, что при встряхивании пробирки бромная вода обесцвечивается, а запах продукта изменяется. [c.91] На что это указывает Назовите продукты, получающиеся в результате бронирования мономера. [c.91] Для эфиров характерно наличие кислородного мостика — О — между двумя углеродными атомами радикалов. В приводимых примерах как простых, так и сложных эфиров кислородный мостик отмечен пунктирной рамкой. [c.92] Жиры можно рассматривать как сложные эфиры глицерина и различных высших жирных кислот. Соли высших жирных кислот называют мылами. [c.95] В пробирку а поместите из бюретки 1 каплю подсолнечного масла (Oleum Helianthi). Старайтесь капать точно на дно, а не на стенки пробирки. Добавьте 5 капель этилового спирта (21). Встряхните пробирку получается мутная жидкость — эмульсия масла в спирте. Добавьте еще 5 капель этилового спирта и вновь энергично встряхните. Жидкость не просветляется, что указывает на плохую растворимость подсолнечного масла в спирте. [c.95] Нагрейте смесь до кипения. При встряхивании жидкость по-прежнему остается мутной от наличия множества мелких капелек масла, которые при стоянии постепенно оседают на дно и образуют одну большую каплю масла. Слейте мутную жидкость, содержащую спиртовой раствор масла, в пробирку б, стараясь, чтобы большая капля осталась в пробирке а. Нагрейте мутную жидкость в пробирке б — она станет прозрачной, однако при охлаждении вновь помутнеет. Мы видим, что при повышении температуры растворимость подсолнечного масла в спирте несколько увеличивается. При охлаждении раствора растворимость вновь понижается и масло вновь выделяется в виде мельчайших капелек, образукзщих муть. [c.95] Прибавьте в пробирку б 1 каплю воды (1) — жидкость помутнеет еще сильнее и при нагревании уже не просветляется. Это указывает на то, что при понижении крепости спирта его способность растворять подсолнечное масло резко падает. Подумайте, чем объяснить помутнение спирта-сырца или одеколона при разведении их водой. [c.95] В пробирку налейте из бюретки 1 каплю касторового масла (Oleum Ri ini) и добавьте 3—4 капли этилового спирта (21). Обратите внимание на то, что в противоположность подсолнечному касторовое масло хорошо растворяется в этиловом спирте и дает вполне прозрачный раствор. От прибавления 1 капли воды (1) прозрачный раствор мутнеет. Объясните, почему происходит помутнение раствора. [c.96] Аналогичные результаты получатся на бумажке б после экстракции масла бензолом. Убедитесь в том, что бензол также хорошо растворяет подсолнечное масло. [c.97] На бумажке в проделайте тот же опыт экстракции масла этиловым спиртом (21). По испарении спирта центральное масляное пятно останется почти без изменения. Опыт подтверждает наши предыдущие наблюдения (опыт 43), что этиловый спирт плохо растворяет подсолнечное масло. [c.97] В небольшую фарфоровую чашечку диаметром 5—6 см. поместите из бюретки (рис. 28) точно 1 мл касторового масла и 0,2 мл (4 капли) 35%-ного раствора едкого натра из соседней бюретки. Так как касторовое масло имеет большую вязкость, то кончик бюретки не должен быть очень узким, чтобы не задерживать работы. [c.97]Вернуться к основной статье
chem21.info
























