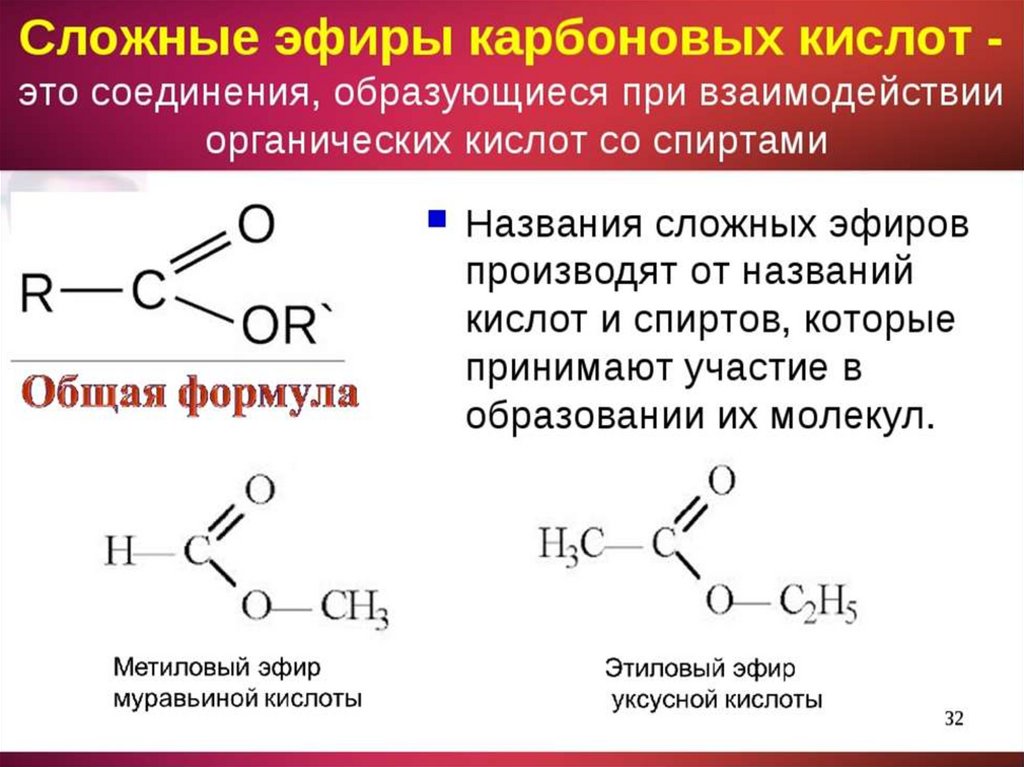
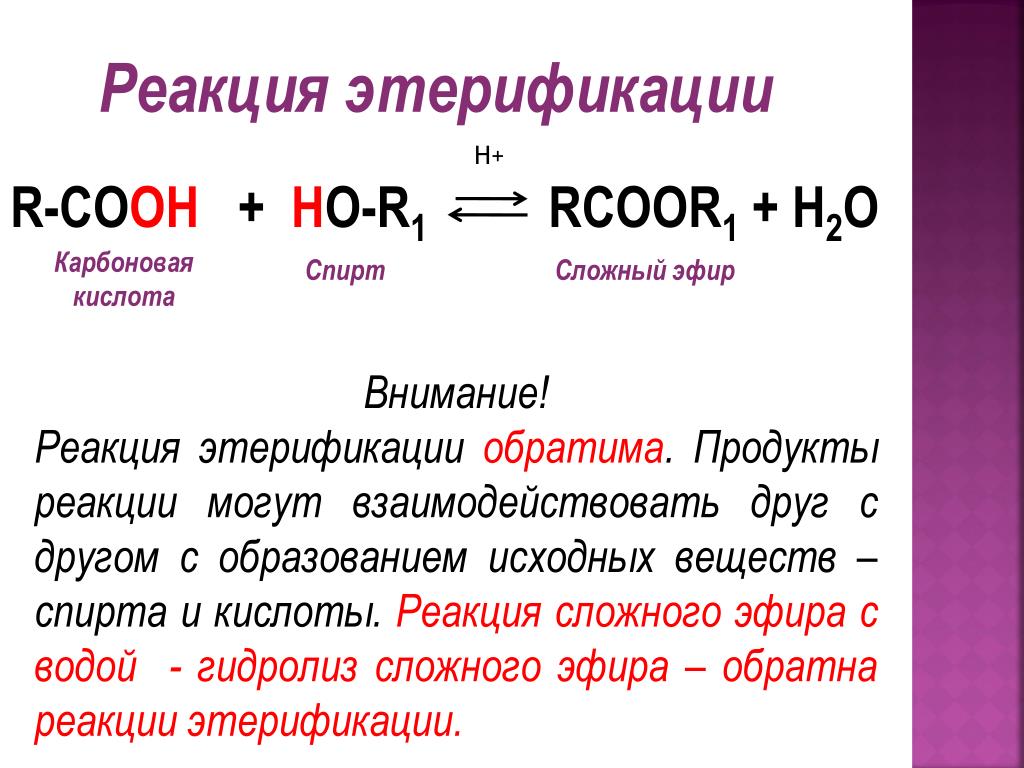
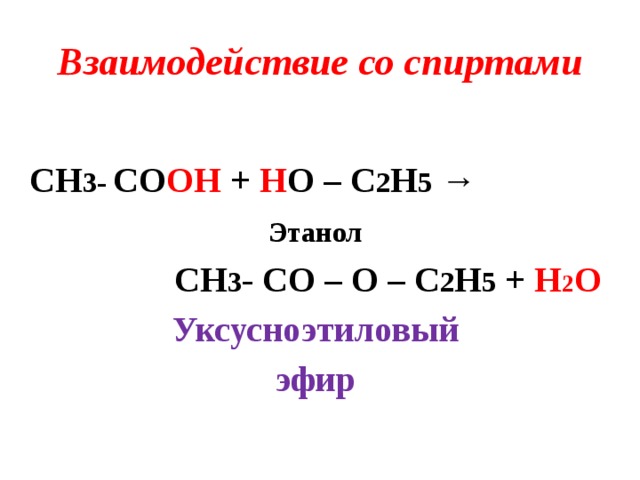
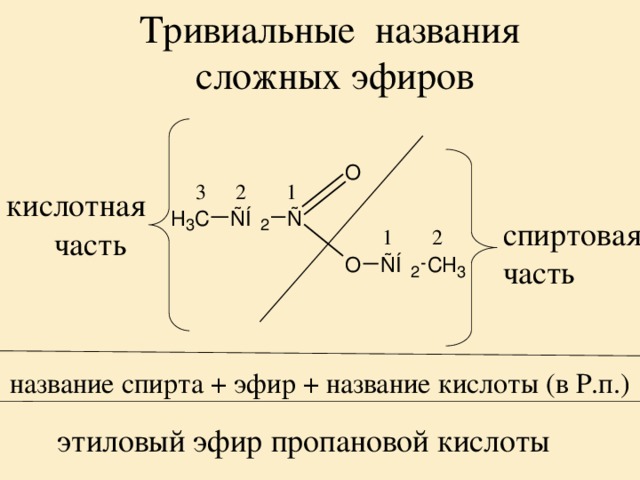
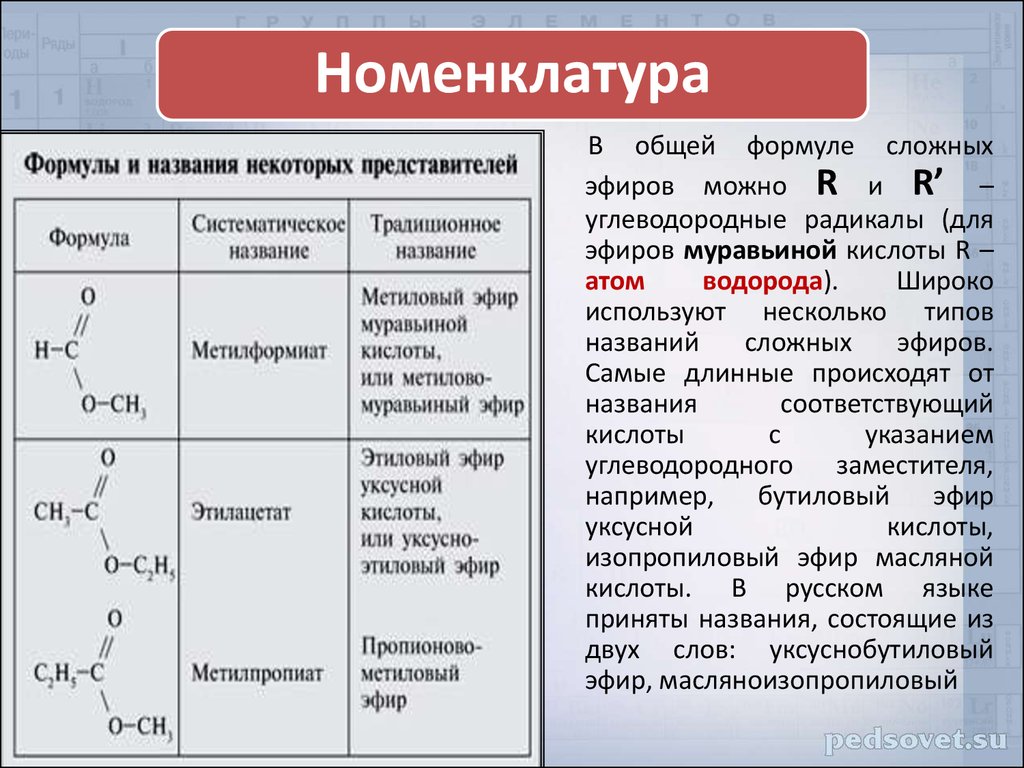
| Алгоэвристическая программа «Сложные эфиры» Управляют целым миром. Вы уже не раз убеждались в том, что химия не абстрактная дисциплина, а вполне жизненная наука. Химия вокруг нас, химия в нас и где бы мы ни были, она всегда с нами, поэтому так важно её изучать. Чтобы сделать этот процесс не только полезным, но и увлекательным, сегодня вам представляется возможность самостоятельно исследовать еще не известный вам класс органических соединений – сложные эфиры. Вообразив себя молодыми учеными, вы будете решать теоретические задачи, выводить свои гипотезы, сделаете массу неожиданных для себя открытий. Напоследок вам будет предложено несколько заданий, с помощью которых вы в игровой форме сможете закрепить новый материал. Внимательно читайте задания и инструкции. Удачи вам, юные исследователи! Общая формула сложных эфиров, где R и R1 – радикалы углеводородов, одинаковые или разные. 2. Названия сложных эфиров по тривиальной номенклатуре образуется из названия соответствующих спиртов и кислот. Запомните, что на первом месте в названии стоит кислота, на втором – спирт! Пример: Названия сложных эфиров по научной номенклатуре можно образовать по следующему принципу: к названию радикала, взятого от спирта, прибавить название углеводорода, лежащего в основе кислоты с добавлением суффикса –ат. Пример: уксусноэтиловый эфир = этил + ацет + ат (этилацетат) Для каждого соединения выберите верное название: Напишите формулы следующих эфиров: а) пентилбутанат; б) этилпропанат; в)изобутилметанат. 3. Ранее вы встречались с изомерией между спиртами и простыми эфирами. Подобно этому существует изомерия между одноосновными карбоновыми кислотами и сложными эфирами (при одинаковом числе атомов углерода в молекуле) Даны формулы следующих веществ СН3ОН и С5Н11ОН. Выпиши отдельно формулы изомеров и гомологов и поставь под ними названия соответствующих веществ. Гомологи Изомеры Сложные эфиры карбоновых кислот – это обычно летучие жидкости с приятным фруктовым запахом. Уксусноизоамиловый эфир имеет запах груши, масляноэтиловый эфир пахнет абрикосами, запах маслянобутилового эфира напоминает ананасы. Наш организм не безразличен к запахам. Если воздух загрязнен дымом, плохо пахнет, мозг подает сигнал тревоги, носовая щель сужается, и в легкие поступает меньше воздуха. Аромат цветов, леса, моря вдыхать приятно, мы чувствуем, как легко дышится, когда воздух приятно пахнет. У курящих острота обоняния ниже, чем у некурящих. Огорчение и волнение притупляет обоняние. Во влажном воздухе запах ощущается сильнее. Химическое соединение, запах которого человек может обнаружить, при наименьшей концентрации вещества в воздухе — ванилин. Достаточно 2.10-11 г ванилина на 1 л воздуха, чтобы мы почувствовали его присутствие. Люди способны выделять не только притягивающие ароматические вещества (антрактанты), но и отталкивающие (репелленты). Антрактанты чаще выделяются тогда, когда человек находится в хорошем состоянии, репелленты – во время депрессии, стрессов, ссор, когда человек ощущает страх и дискомфорт. По-видимому, существует запах страха. Науку о лечении запахами называют ароматерапией. Замечено, что запахи мирта, лимона, мяты оказывают тонизирующее действие на нервную систему, ароматы розы, жасмина, лаванды – успокаивающее. Запахи пиридина и толуола повышают остроту ночного зрения, а запахи бензола и гераниола – остроту слуха. Животные используют обоняние для поисков пищи, запах для них – средство коммуникации, взаимодействия полов. Согласны ли вы, что запахи имеют очень большое значение в нашей жизни?! 4. Получают сложные эфиры в лаборатории главным образом при взаимодействии карбоновых кислот со спиртами в присутствии концентрированной серной кислоты. В общем виде получение сложных эфиров может быть выражено таким уравнением: Реакции образования сложных эфиров называются реакциями этерификации (acther — эфир). Если спирт и кислота а) пропионовой кислоты с бутиловым спиртом; б) масляной кислоты с метиловым спиртом; а) муравьинометилового эфира, исходя из метана; б) уксусноэтилового эфира, исходя из этилена. Получение уксусноэтилового эфира (мысленный эксперимент) Прибор для получения эфиров состоит из реакционной колбы, водяного холодильника и приемника. (Укажи на рисунке) Какие вещества вы будете использовать для получения уксусноэтилового эфира? В каком количестве? Куда помещаются реагенты? К колбе присоединяется водяной или воздушный холодильник (для чего необходим холодильник?), нижний конец которого опускается в приемник, помещенный в слив воды со льдом (почему используется именно ледяная вода?). Нагревать смесь в колбе нужно осторожно (что нужно использовать для осторожного нагревания колбы?). Эфир собирается тяжелыми маслянистыми каплями на дне приемника. Когда соберется достаточное количество эфира и перегонка замедлится, опыт прекращают. Чтобы освободить эфир от примесей спирта и кислоты, добавляют к полученному продукту воды и смесь взбалтывают. 6. Сложный эфир метилметакрилат широко используется в производстве пластмасс. Напиши уравнения реакции получения этого эфира. (В качестве подсказки тебе дана структурная формула метакриловой кислоты) Напишите реакции гидролиза: а) муравьиноэтилового эфира; б) бутилэтаната; в) уксусноамилового эфира; Какими способами можно сдвинуть равновесие этой реакции в каждую из сторон? При каких условиях удобно применять тот или иной способ? 10. Для борьбы с сорняками в посевах зерновых культур применяется бутиловый эфир 2,4-дихлорфеноксиуксусной кислоты. Составьте структурную формулу этого гербицида. 11. Какую формулу имеет запах? уксусноизоамиловый эфир изоамилбутират маслянобутиловый масляноэтиловый эфир эфир | |||
| Урок химии по теме «Сложные эфиры» Мыслящий ум не чувствует себе счастливым, пока ему не удастся связать воедино разрозненные факты, им наблюдаемые” | Инструкции к опытам по теме «Сложные эфиры. Жиры. Моющие средства» Опыт Гидролиз жира Жиры. Моющие средства» Опыт Гидролиз жираВ чашку поместить 10 г маргарина и 24 мл 20%-го раствора NaOH, прилить 7 мл этанола и кипятить 20 мин | ||
| Эфирные масла это ароматические (летучие) компоненты состава растений…. … | Рабочая программа для общеобразовательных организаций, реализующих… В программу можно включать характеристику обучающегося, его навыки и умения по предмету, уточнять значимые и сложные темы | ||
| Должностная инструкция бетонщика 5-го разряда подразделения «Сложные технологии» Общие положения Настоящая должностная инструкция определяет функциональные, должностные обязанности, права и ответственность бетонщика 5-го разряда… | Дипломная работа о редакционной специфике транснациональных новостных медиа Европы в новых медиа на русском и английском языках. Руководила запуском интернет-видеотрансляций матчей, интернет-канала, вела полуторачасовые. 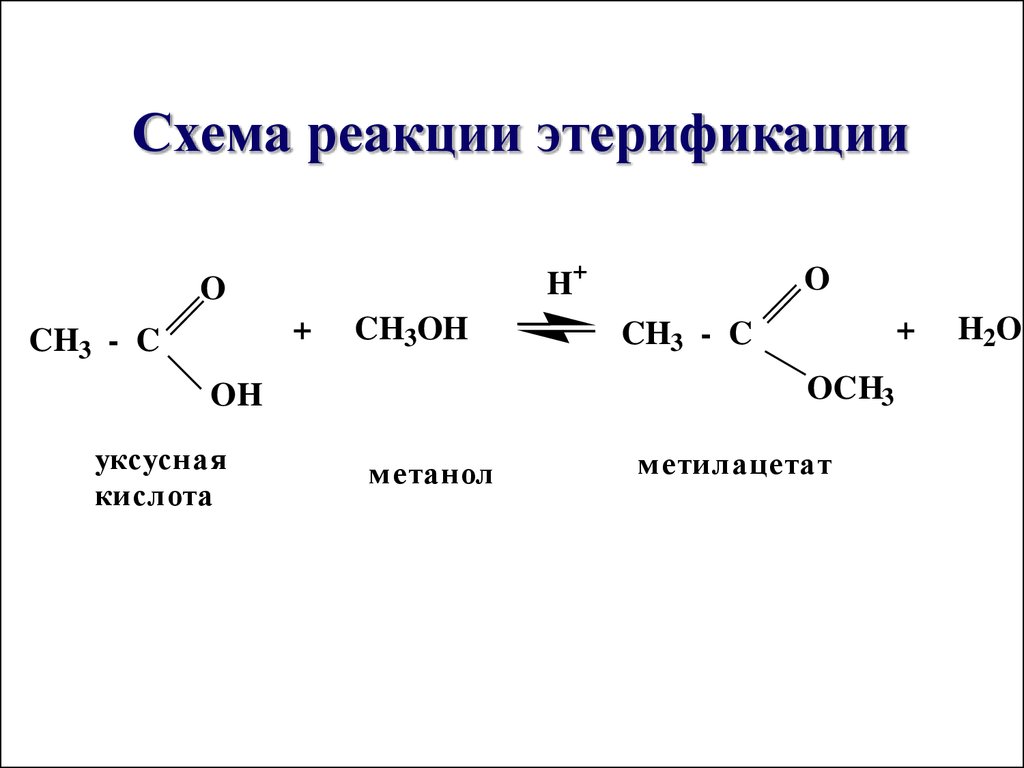 .. .. | ||
| Сложные бизнес-процессы Стоимость использования Windows Azure для конечных пользователей | Некоммерческое Партнерство «Строители Поволжья» Настоящий стандарт не распространяется на особо опасные, технически сложные и уникальные объекты ( статья 48, Градостроительный кодекс… | ||
| Техническое задание «закупка реактивов для бактериологической лаборатории… Препараты (реагенты) сложные диагностические, не включенные в другие группировки, прочие | Должностная инструкция ремонтника искусственных сооружений 6-го и… «Центр организации труда и проектирования экономических нормативов филиал ОАО «ржд»» | ||
| Учебник для юридических вузов … | Техническое задание. Код по (окдп) 2429420: Среды и реагенты сложные диагностические … | ||
| Экология и защита биосферы Одним словом, экология – это наука, изучающая все сложные взаимосвязи и взаимоотношения в природе, рассматриваемые Дарвином как условия. 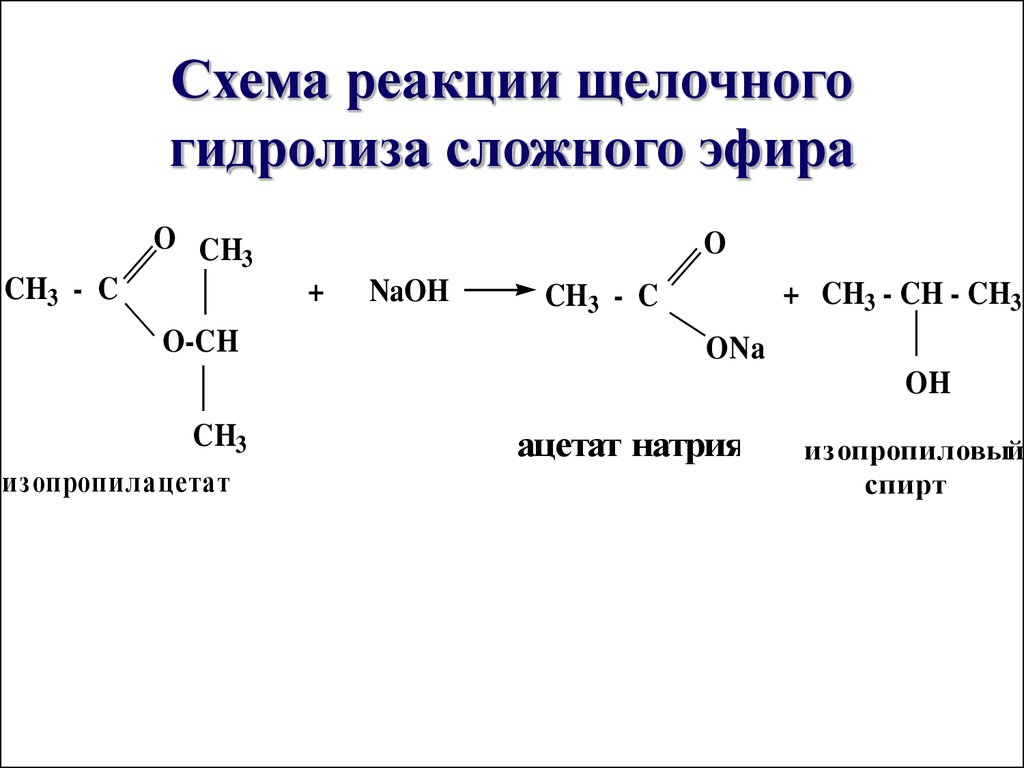 .. .. | Армирование стен и перекрытий Только в исключительных случаях сложные конструкции армируют непосредственно в проектном положении из отдельных стержней (штучная… | ||
| Реферат Тема: Схема различных комбинаций ингаляционных и внутривенных анестетиков Чем более сложна и многообразна комбинация препаратов, тем более сложные отношения возникают в организме при ее использовании | Инструкция «Об организации отделов записей браков и рождений» Сложившаяся к настоящему моменту правовая база, регулирующая порядок регистрации актов гражданского состояния, развивалась вместе… |
Уксусной кислоты амид. Мини-справочник по химическим веществам (3340 веществ)
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
Синонимы:
ацетамид
Формула в виде текста: Ch4CONh3
Метод получения 1.
(лабораторный синтез)
Источник информации: «Синтезы органических препаратов» сб.1 М.1949 стр. 63-64
В 5-литровую колбу наливают 3 кг (2860 мл; 50,0 мол.) ледяной уксусной кислоты и прибавляют столько углекислого аммония, чтобы содержание аммиака равнялось 400 г (23,5 мол.; примечание 1). Колбу закрывают пробкой с одним отверстием, в которое вставлена фракционная колонка длиною в 90 см, соединенная с холодильником и приемником. Холодильником служит стеклянная трубка длиною в 150—200 см. Смесь нагревают до слабого кипения, дальнейший нагрев регулируют с расчетом получения около 180 мл погона в 1 час. Такая перегонка продолжается в течение 8—10 часов (пока температура в верхней части колонки не достигнет 110°). Объем дестиллата, состоящего из водной уксусной кислоты, достигает 1400—1500 мл. Затем меняют приемник, постепенно усиливают нагревание и продолжают перегонку до тех пор, пока температура в колонке не поднимется до 140°. Объем дестиллата, представляющего собой почти чистую уксусную кислоту, которую можно применить при повторении синтеза, составляет 500— 700 мл.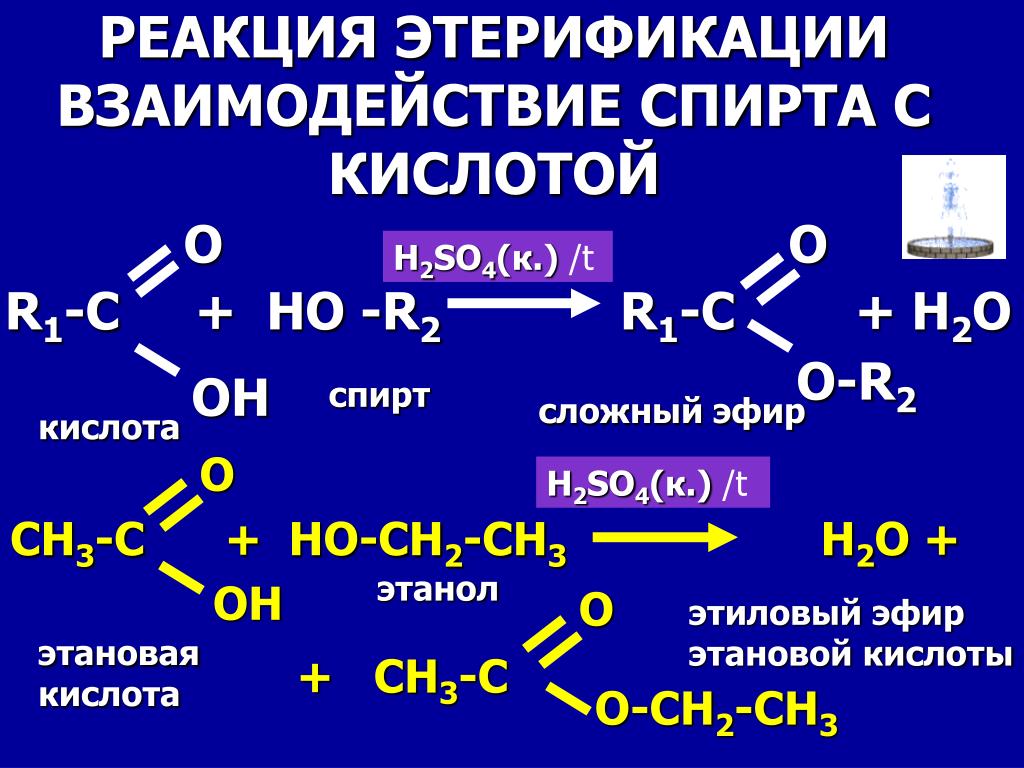
Содержимое 5-литровой колбы переливают в 2-литровую для фракционной разгонки, снабженную дефлегматором длиной в 40—50 см, и подвергают перегонке при атмосферном давлении. Холодильником служит стеклянная трубка. Фракция, кипящая до 210°, собирается отдельно; объем ее — до 250—300 мл. В колбе остается почти чистый ацетамид, который перегоняется при 210—216°; вес перегнанного продукта: 1150—1200 г. Перегонкой фракции, кипящей до 210°, выход может быть увеличен до 1200—1250 г (87—90% теоретич.). Ацетамид, полученный таким путем, достаточно чист для большинства работ. Для получения совершенно чистого продукта достаточно подвергнуть перегнанный ацетамид кристаллизации из смеси бензола с уксусноэтиловым эфиром; 1 кг ацетамида кристаллизуют из смеси 1 л бензола с 300 мл уксусноэтилового эфира (примечание 2). Получают бесцветные гиглы с т. пл. 81° (примечание 3). Растворитель можно регенерировать и содержащийся в растворе ацетамид выделить, если маточник подвергнуть перегонке.
Примечания
1. Продажный углекислый аммоний часто содержит значительное количество примесей; поэтому необходимо предварительным титрованием кислотой определить в нем содержание аммиака. Углекислый аммоний, употребленный в вышеописанной операции, содержал 27,2% аммиака; для реакции было взято 1470 г.
Продажный углекислый аммоний часто содержит значительное количество примесей; поэтому необходимо предварительным титрованием кислотой определить в нем содержание аммиака. Углекислый аммоний, употребленный в вышеописанной операции, содержал 27,2% аммиака; для реакции было взято 1470 г.
2. В качестве одного из лучших методов очистки была предложена кристаллизация ацетамида растворением его в горячем метиловом спирте (0,8 мл на 1 г) с последующим разбавлением раствора эфиром (8—10 мл на 1 г).
3. Ацетамид гигроскопичен; поэтому его нельзя оставлять открытым на воздухе.
Показатель диссоциации:
pKa (1) = 15,1 (20 C, вода)
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
Еще по теме:
- амид уксусной кислоты — химическая энциклопедия
Этилацетат — Американское химическое общество
Я — ароматный растворитель.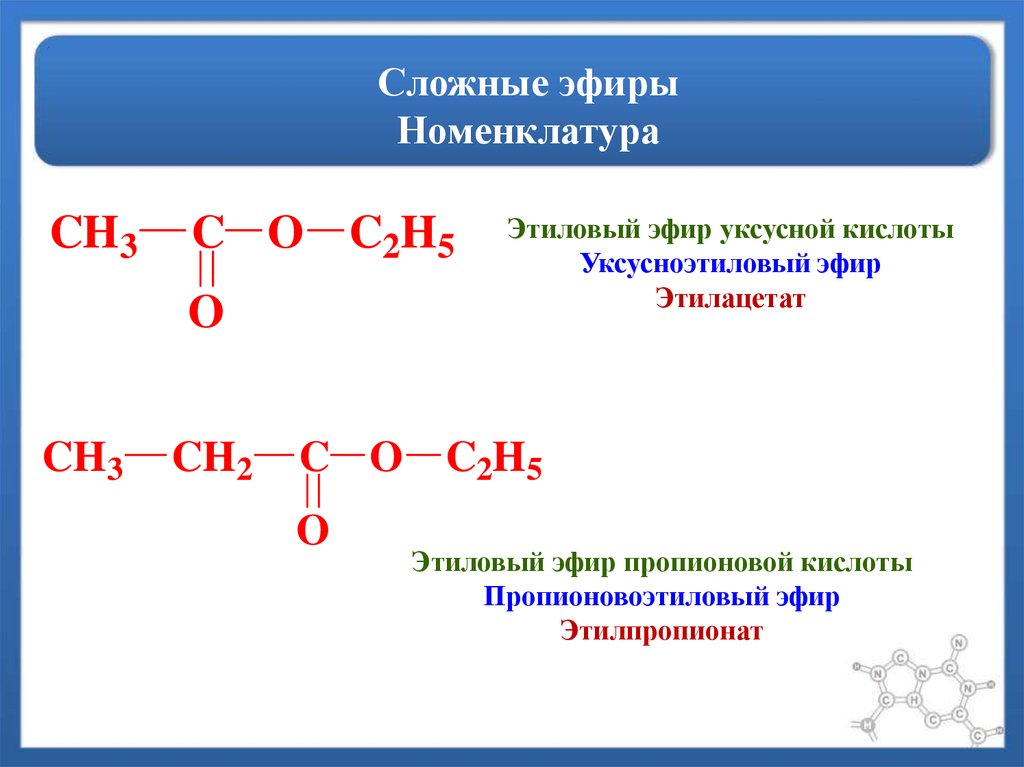
Какая я молекула?
Март — месяц растворителей MOTW! Это вторая из четырех статей о ключевых растворителях — ред.
Этилацетат – один из простейших эфиров карбоновой кислоты. (Самый простой – метилформиат, бывшая молекула недели.) Бесцветная жидкость имеет сладкий фруктовый запах, который большинству людей кажется приятным.
Как и следовало ожидать, этилацетат впервые был синтезирован из этанола и уксусной кислоты. Реакция представляла собой классическую катализируемую кислотой этерификацию Фишера, которая восходит к 189 г.5. Это по-прежнему наиболее широко используемый коммерческий синтез. Альтернативным методом является реакция Тищенко, в которой ацетальдегид диспропорционирует в присутствии основания до спирта и кислоты, которые затем этерифицируются in situ.
Этилацетат является широко используемым растворителем, особенно для красок, лаков, чистящих смесей и парфюмерии. Как и MOTW прошлой недели, дихлорметан, он используется в качестве растворителя для удаления кофеина из кофейных зерен. В лаборатории этилацетат является обычным растворителем для колоночной и тонкослойной хроматографии.
В лаборатории этилацетат является обычным растворителем для колоночной и тонкослойной хроматографии.
| Классификация СГС*: Воспламеняющиеся жидкости, категория 2 | |
| h325 — Легковоспламеняющиеся жидкости и пары | |
| Классификация СГС: серьезное раздражение глаз, категория 2A | |
| h419 — вызывает серьезное раздражение глаз | |
| Классификация СГС: специфическая токсичность для органа-мишени, однократное воздействие, центральная нервная система, категория 3 | |
| h436 — Может вызывать сонливость или головокружение | |
*Глобально согласованная система классификации и маркировки химических веществ. Пояснения к пиктограммам.
Этилацетат быстрые факты
CAS Reg. № № | 141-78-6 |
| Эмпирическая формула | С 4 Н 8 О 2 |
| Молярная масса | 88,11 г/моль |
| Внешний вид | Бесцветная жидкость |
| Температура кипения | 77 °С |
| Растворимость в воде | 83 г/л |
Обновление MOTW
N , N -Диметилтриптамин (ДМТ) был Молекулой недели на 17 сентября 2018 года. ДМТ является растительным галлюциногеном, который запрещен законом в большинстве стран; но исследователи изучают его возможное использование в качестве лекарства от депрессии. Теперь Дэвид Э. Олсон из Калифорнийского университета в Дэвисе и его коллеги из нескольких учреждений сообщают, что «постоянное, прерывистое, низкие дозы ДМТ вызывали фенотип, подобный антидепрессанту, и усиливали обучение подавлению страха, не влияя на рабочую память или социальное взаимодействие».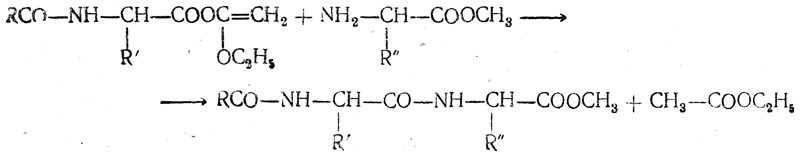 лабораторные крысы. К сожалению, крысы также значительно прибавили в весе. Их исследования продолжаются.
лабораторные крысы. К сожалению, крысы также значительно прибавили в весе. Их исследования продолжаются.
Узнайте больше об этой молекуле из CAS, самого авторитетного и всеобъемлющего источника химической информации.
Этилацетат – структура, формула, свойства, производство и применение
Этилацетат представляет собой органическое соединение, представляющее собой сложный эфир этанола и уксусной кислоты. Он широко используется в качестве растворителя в химических реакциях или препаратах. Именно по этой причине он производится в больших масштабах.
Молекулярная формула этилацетата C 4 Н 8 О 2 . Его можно записать как CH 3 -COO-CH 2 -CH 3 .
Структура этилацетата —
(изображение будет загружено в ближайшее время)
Молекулярная формула этилацетата можно легко запомнить, потому что как имя предполагает, что он содержит этил -группу (CH 2 -CH 3 или C 2 H 5 ) и ацетатной группы (CH 3 СОО).
Свойства этилацетата
Физические свойства этилацетата. Обладает следующими физическими свойствами.
Бесцветная жидкость.
Имеет эфироподобный фруктовый запах.
Температура плавления -83,6℃.
Температура кипения 77,1 ℃.
Растворим в воде, этаноле, ацетоне и т.д.
Химические свойства этилацетата
Ниже перечислены некоторые химические свойства этилацетата –
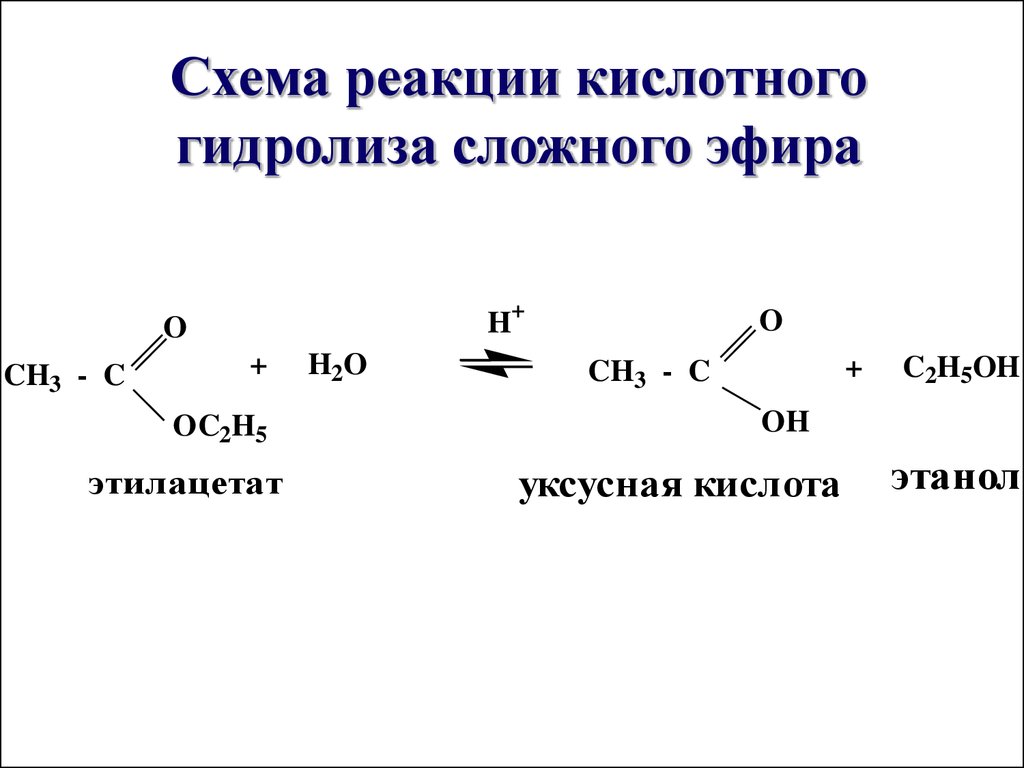
Гидролиз – при реакции с водой этилацетат дает этанол и уксусную кислоту. Реакция приведена ниже –
Реакция с гидроксидом натрия – когда этилацетат реагирует с гидроксидом натрия, он дает ацетат натрия и этанол.
 Реакция приведена ниже –
Реакция приведена ниже –
CH 3 CO 2 C 2 H 5 + NaOH 🡪 C 2 H 5 OH + CH 3 CO 2 NA
Производство этилацетата
Ethyl Acetate — это базовый Organic Comploy с Organic Comploy с базовым компанией. 3 -COO-CH 2 -CH 3 , упрощено до C 4 H 8 O 2 . Эта бесцветная жидкость имеет общий характерный сладковатый запах и используется в производстве клеев, средств для снятия лака с ногтей, а также участвует в процессе декофеинизации чая и кофе.
Этилацетат, как правило, получают синтетическим путем и несет в себе определенный риск при высоких дозах. И все же растворители, которые используются в процессе декофеинизации, намного безопаснее, чем кажутся, и обычно их можно найти в бобах лишь в небольшом количестве. Этилацетат также очень хорошо используется для разбавления и растворения других твердых веществ, включая нитроцеллюлозу, которая является основным материалом, присутствующим в лаке для ногтей.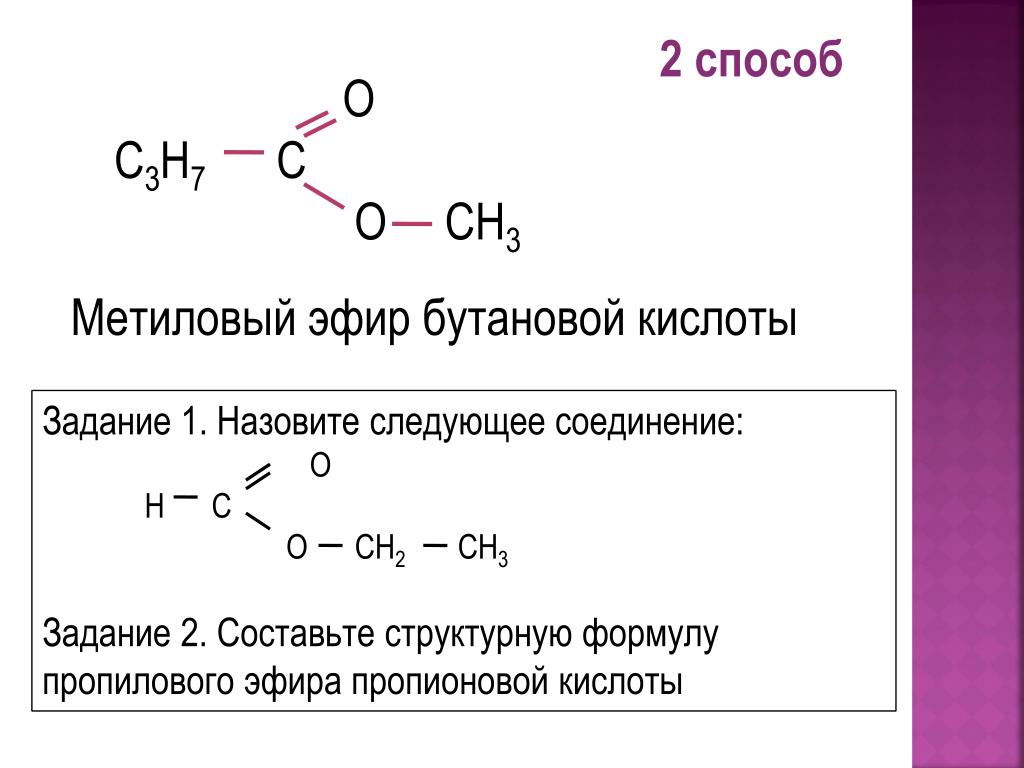 Поэтому он считается важным и эффективным ингредиентом, присутствующим в индустрии ухода за ногтями.
Поэтому он считается важным и эффективным ингредиентом, присутствующим в индустрии ухода за ногтями.
Этилацетат синтезируется в больших масштабах, поскольку он широко используется в качестве растворителя для многих соединений. В промышленности его синтезируют по реакции этерификации Фишера. В этой реакции в качестве реагентов используются этанол и уксусная кислота. Реакция протекает при комнатной температуре, что дает выход 65%. Реакция представлена ниже –
CH 3 COOH + CH 3 CH 2 OH 🡪 CH 3 COOCH 2 CH 3 909720073 + H 2 O
В промышленных масштабах также получают по реакции Тищенко. В этой реакции два эквивалента ацетальдегида реагируют в присутствии алкоксидного катализатора. Ниже приведена реакция:
Использование этилацетата
Этилацетат является очень полезным органическим соединением.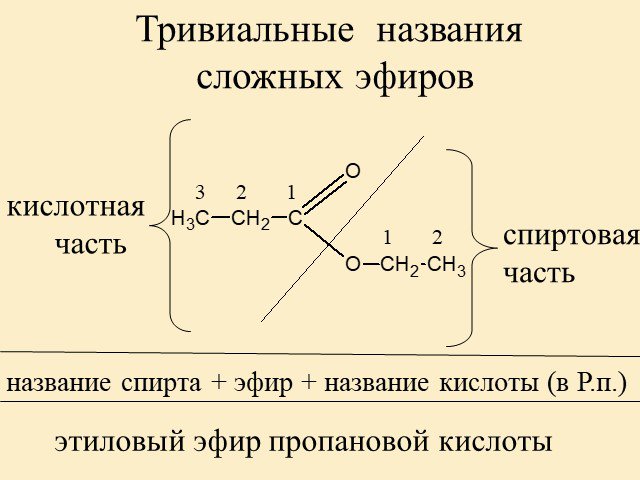 Крупнотоннажное производство этилацетата само по себе показывает его важность в отрасли. Некоторые из его применений перечислены ниже —
Крупнотоннажное производство этилацетата само по себе показывает его важность в отрасли. Некоторые из его применений перечислены ниже —
В основном используется в качестве растворителя и разбавителя.
Используется для декофеинизации кофейных зерен и чайных листьев.
Используется в красках как активатор и отвердитель.
Из-за своего фруктового запаха он используется в парфюмерии, желе и т. д.
Это важный лабораторный реактив.
Используется в колоночной хроматографии и экстракции в качестве растворителя.
Используется в винах.

Где мы можем найти этилацетат вокруг нас?
Чистящие химикаты, используемые в домах и других местах, содержат некоторый процент химикатов. Наши эмоции также связаны с химией, окситоцин, вырабатываемый, когда мы с нашими близкими, является формой химической реакции и буквально каждым объектом, который мы можем увидеть или потрогать. Некоторые общие химические концепции могут быть очевидны для большинства из нас, но другие могут удивить нас во многих неожиданных формах. Наше тело также состоит из множества уникальных химических соединений, представляющих собой комбинации различных элементов.
Опасность для здоровья, связанная с этилацетатом реакция, и использование таких реакций для образования новых веществ.
Этилацетат является очень полезным соединением, но имеет небольшой риск токсичности. Его опасные эффекты перечислены ниже –
Чрезмерное употребление этилацетата вызывает раздражение глаз, носа и горла.

Также может вызвать слабость, сонливость и потерю сознания.
Регулярное употребление этилацетата оказывает вредное воздействие на дыхательные пути.
В очень высоких концентрациях может вызвать угнетение центральной нервной системы и смерть.
Может также вызывать поражение печени, кожные высыпания и повреждение роговицы.
Этилацетат также может сильно раздражать кожу, глаза, нос и горло. Воздействие высоких концентраций этого растворителя может вызвать у вас сильное головокружение и даже привести к смерти. Повторяющийся контакт может вызвать высыхание и растрескивание внешнего слоя кожи, а длительное воздействие может сильно повлиять на печень и почки.




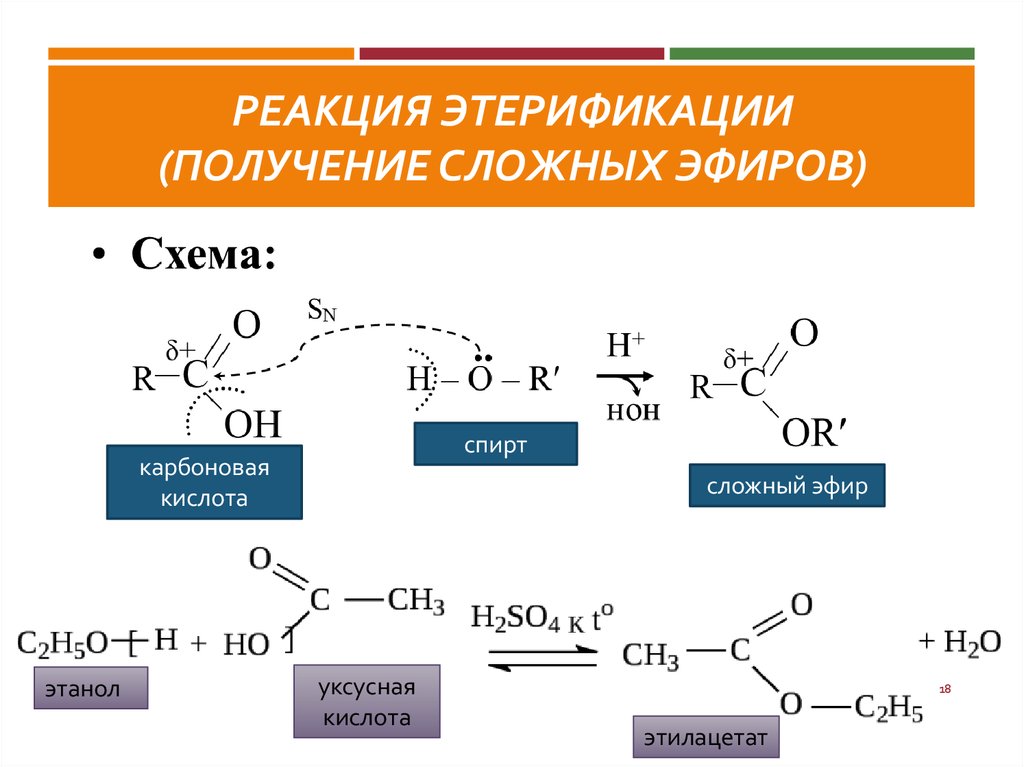
 Проведем эксперимент – получение эфира, пусть мысленный, ведь мысль материальна. Не правда ли?
Проведем эксперимент – получение эфира, пусть мысленный, ведь мысль материальна. Не правда ли? Затем разделяют ее при помощи делительной воронки. Обратите внимание, что слой синтезированного вещества образуется поверх воды.
Затем разделяют ее при помощи делительной воронки. Обратите внимание, что слой синтезированного вещества образуется поверх воды.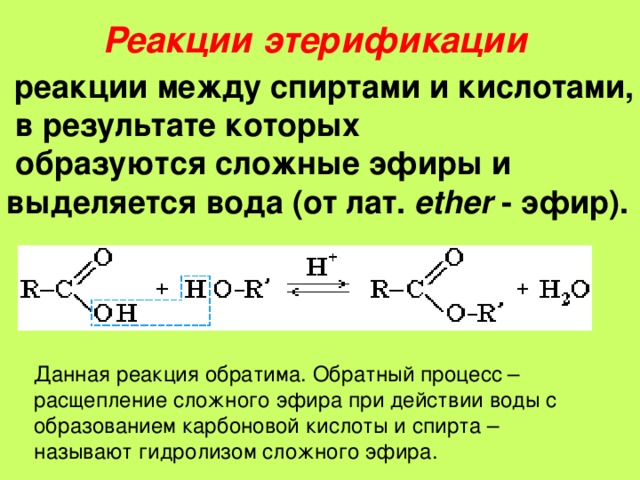 Наконец, наступает такой момент, когда скорости реакций этерификации и гидролиза становятся равными. Наступает химическое равновесие и количество эфира в смеси практически более не увеличивается.
Наконец, наступает такой момент, когда скорости реакций этерификации и гидролиза становятся равными. Наступает химическое равновесие и количество эфира в смеси практически более не увеличивается. Реакция приведена ниже –
Реакция приведена ниже –