Содержание
Эстеры (сложные эфиры). Жиры. | Тест з хімії – «На Урок»
Запитання 1
Эстеры (сложные эфиры) — это производные
варіанти відповідей
спиртов
карбоновых кислот
альдегидов
углеводородов
Запитання 2
Общая формула эстеров (сложных эфиров)
варіанти відповідей
R-COOH
R-O-R’
R-COOR’
Запитання 3
Межклассовые изомеры эстеров (сложных эфиров) — это
варіанти відповідей
этеры (простые эфиры)
спирты
карбоновые кислоты
альдегиды
Запитання 4
Эстер имеет запах ананаса. Его формула — С3Н7СООС2Н5. Укажите название этого эстера
варіанти відповідей
этилбутаноат
этилпропаноат
бутилэтаноат
пропилэтаноат
Запитання 5
Укажите формулы изомеров (две) для предложенного эстера: С2Н5СООСН3
варіанти відповідей
СН3СН2СН2СООН
СН3СООСН2СН3
СН3СН2СООН
СН3СООСН2СН2СН3
Запитання 6
Установите, какие суждения о физических свойствах эстеров (сложных эфиров) являются верными:
А. Эстеры (эложные эфиры) простейших одноосновных карбоновых кислот и спиртов – летучие жидкости и легче воды.
Эстеры (эложные эфиры) простейших одноосновных карбоновых кислот и спиртов – летучие жидкости и легче воды.
Б. Большинство эстеров (сложных эфиров) не имеют запаха.
варіанти відповідей
Верно только А
Верно только Б
Верны оба суждения
Верных суждений нет
Запитання 7
В основе получения эстеров (сложных эфиров) лежит реакция
варіанти відповідей
полимеризации
эстерификации
гидратации
поликонденсации
Запитання 8
Эстеры — горючие вещества. Продуктами реакции горения эстеров являются
варіанти відповідей
углерод и вода
углекислый газ и водород
углекислый газ, азот и вода
углекислый газ и вода
Запитання 9
Жиры — это эстеры, которые образованы
варіанти відповідей
низшими карбоновыми кислотами и низшими спиртами
высшими карбоновыми кислотами и высшими спиртами
низшими карбоновыми кислотами и глицеролом (глицерином)
высшими карбоновыми кислотами и глицеролом (глицерином)
Запитання 10
Для превращения жидкого жира в твердый проводят реакцию
варіанти відповідей
гидрирования (гидрогенизации)
гидратации
гидролиза
полимеризации
Запитання 11
Установите, какие суждения о физических свойствах жиров являются верными:
А.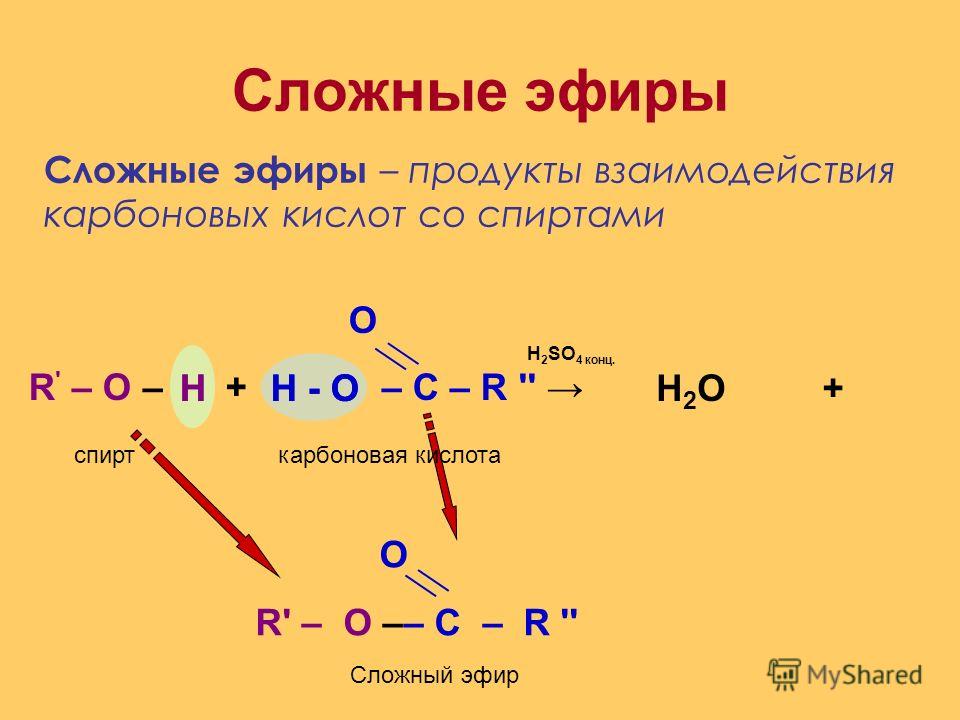 Жиры имеют постоянную температуру плавления
Жиры имеют постоянную температуру плавления
Б. Жиры легче воды, нерастворимы в ней, но хорошо растворяются в органических растворителях.
варіанти відповідей
Верно только А
Верно только Б
Верными являются оба суджения
Верных суждений нет
Запитання 12
Укажите ВКК, которые входят в состав растительных жиров (масел). Верных — четыре варианта.
варіанти відповідей
олеиновая (С17Н33СООН)
стеариновая (С17Н35СООН)
линолевая (С17Н31СООН)
линоленовая (С17Н29СООН)
пальмитиновая (С15Н31СООН)
арахидоновая (С19Н31СООН)
Запитання 13
Установите, какие суждения о химических свойствах жиров являются верными:
А. Жирам. как эстерам (сложным эфирам), свойственна обратимая реакция гидролиза, катализируемая минеральными кислотами
Б. При участии щелочей гидролиз жиров происходит необратимо.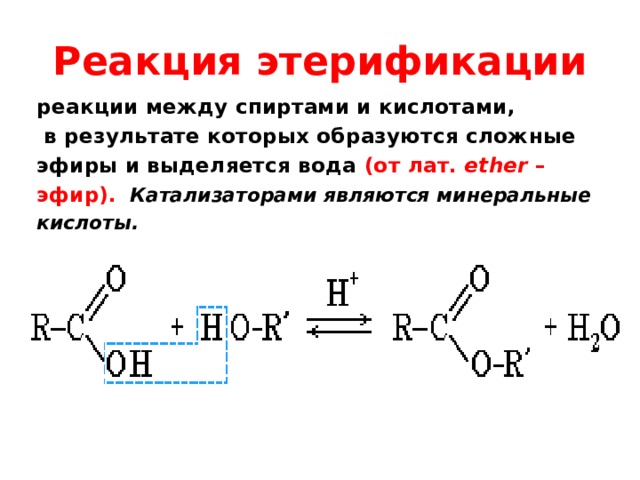
варіанти відповідей
Верно только А
Верно только Б
Верными являются оба суждения
Верных суждений нет
Запитання 14
Омылением иначе называют реакцию
варіанти відповідей
гидрирования жиров
кислотного гидролиза жиров
щелочного гидролиза жиров
ферментативного гидролиза жиров
Запитання 15
Укажите верные суждения относительно состава и агрегатного состояния жиров:
А. В состав триглицеридов масел входят остатки ненасыщенных (непредельных) ВКК
Б. Животные жиры состоят главным образом из триглицеридов насыщенных
(предельных) ВКК.
В. Большинство животных жиров — твердые вещества, а растительных — жидкости
Г. Агрегатное состояние жиров не зависит от того, остатки каких ВКК присутствуют в их составе
варіанти відповідей
Верными суждениями являются А, Б, В
Верными суждениями являются Б, В, Г
Верными суждениями являются В, Г, А
Верными являются все суждения
Запитання 16
Какое из веществ может быть составляющей жидкого мыла
варіанти відповідей
C17H35COONa
C15H31COOK
C15H31COOLi
(C15H31COO)2Ca
Створюйте онлайн-тести
для контролю знань і залучення учнів
до активної роботи у класі та вдома
Створити тест
Натисніть «Подобається», щоб слідкувати за оновленнями на Facebook
Простые и сложные эфиры — презентация онлайн
Похожие презентации:
Сложные эфиры.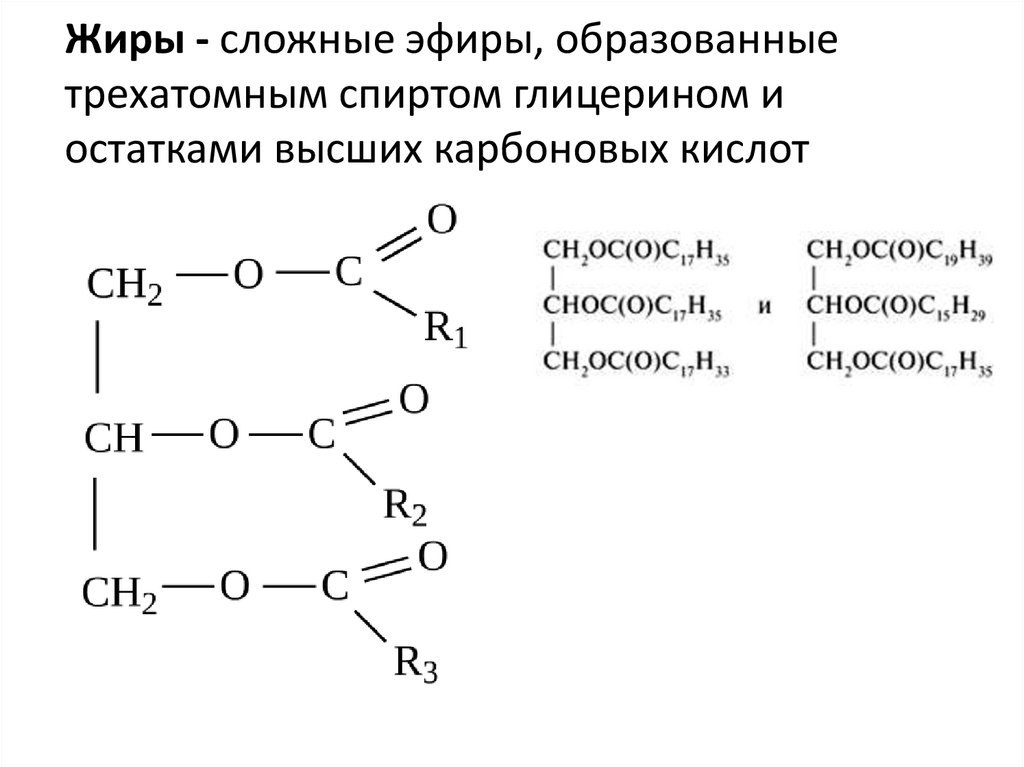 Жиры
Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Эфиры
Выполнил:
Ученик 10 класса
ГБОУ КОСШ №20
Емельченко Ярослав
2. Эфиры
Эфиры — совокупное название нескольких классов
химических соединений.
Данная многозначность сложилась в процессе
развития химической номенклатуры
(изначально существовал один общий класс
веществ).
3. Простые эфиры
Органические вещества
Имеют формулу R-O-R1,
где R и R1 — углеводородные радикалы.
подвижные легкокипящие жидкости, малорастворимые в воде,
очень легко воспламеняющиеся.
Проявляют слабоосновные свойства.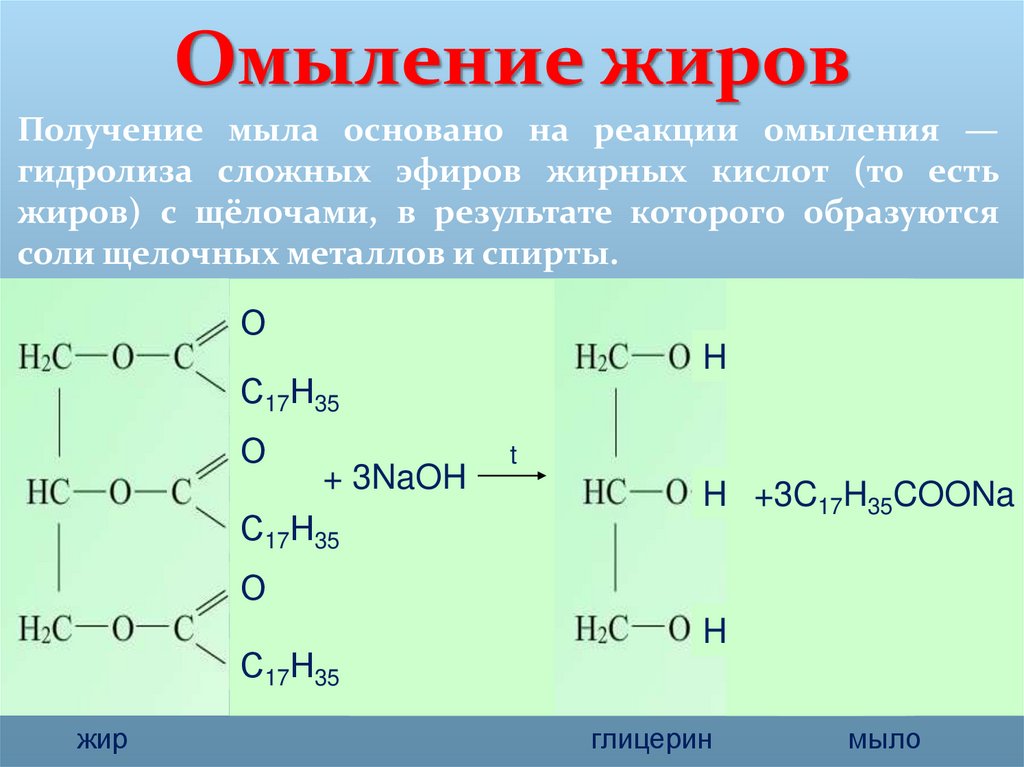
Акриловые эфиры — консерванты, антиоксиданты,
применяются в парфюмерной промышленности. Некоторые
простые эфиры обладают инсектицидным действием.
Оксиран
Анизол
Диоксан
4. Сложные эфиры Эстеры
производные карбоновых или минеральных кислот, в которых
гидроксильная группа -OH кислотной функции заменена на
спиртовой остаток.
Имеют формулу RkE(=O)l(OH)m,
где l ≠ 0,
рассматриваются также как ацилпроизводные спиртов
Множество сложных эфиров было синтезировано и испытано
фармакологами. Они стали основой таких лекарственных
средств, как салол, валидол и др.
5. Полиэфиры
Высокомолекулярные соединения, получаемые
поликонденсацией многоосновных кислот или их альдегидов с
многоатомными спиртами.
Известны природные: янтарь, древесная смола, шеллак и др.
Практическое применение получили глифталевые смолы,
полиэтилентерефталат, полиэфирмалеинаты и
полиэфиракрилаты.
Формула полиэтилентерефталата
6.
 Эфирные масла
Эфирные масла
Смесь жидких пахучих летучих веществ, выделенных из
растительных материалов (дистилляцией, экстракцией,
прессованием).
Нерастворимые в воде
В отличие от настоящих жиров они не оставляют жировых пятен
на бумаге, потому что испаряются при комнатной температуре.
Образуются только в растениях, но имеют чрезвычайно сильные
физиологические и фармакологические свойства
Структура изопрена
(шаростержневая модель)
7. Диэтиловый эфир
Бесцветная, прозрачная, очень подвижная, летучая жидкость со
своеобразным запахом и жгучим вкусом.
В медицине используется в качестве лекарственного средства
общеанестезирующего действия
Применяется как растворитель нитратов целлюлозы в
производстве бездымного пороха, природных и синтетических
смол, алкалоидов.
English
Русский
Правила
Что такое сложные эфиры? | Химические дистрибьюторы
Сложные эфиры представляют собой органические соединения, полученные из карбоновых кислот. Карбоксильная группа –COOH содержится в карбоновой кислоте. Водород в этой группе заменяется углеводородной группой в сложных эфирах. Эти углеводородные группы могут быть метильной, этильной или фенильной группой. Сложные эфиры имеют характерный приятный фруктовый запах и часто встречаются в органических и биологических материалах. Они используются в основном в производстве ароматизаторов и ароматизаторов.
Карбоксильная группа –COOH содержится в карбоновой кислоте. Водород в этой группе заменяется углеводородной группой в сложных эфирах. Эти углеводородные группы могут быть метильной, этильной или фенильной группой. Сложные эфиры имеют характерный приятный фруктовый запах и часто встречаются в органических и биологических материалах. Они используются в основном в производстве ароматизаторов и ароматизаторов.
Solventis является поставщиком и дистрибьютором полного ассортимента сложных эфиров, включая ацетат бутилдигликоля, ацетат бутилгликоля, этилацетат, изобутилацетат, изопропилацетат, метилацетат, бутилацетат и пропилацетат.
Как они производятся?
Сложные эфиры образуются в результате реакции двух реагентов, которыми являются спирты и кислоты, в реакции этерификации. Этерификация по Фишеру — классический способ получения сложных эфиров. Это включает обработку карбоновой кислоты спиртом и дегидратирующим агентом. Серная кислота служит катализатором для ускорения процесса этерификации.
Ацилхлориды и ангидриды кислот Алкоголиз – еще один способ получения сложных эфиров. Ацилхлориды и ангидриды кислот реагируют со спиртами с образованием сложных эфиров. Рекомендуются безводные условия, поскольку и ацилхлориды, и ангидриды кислот реагируют с водой.
Как они хранятся?
Резервуары из углерода, алюминия и нержавеющей стали подходят для хранения сложных эфиров. Резервуар для хранения, облицованный обожженной фенольной смолой, следует использовать, если существует критическое качество продукта и если его конечное использование вредно для производства со следами железа. Эфиры характеризуются высокой летучестью и высокой воспламеняемостью. Как низкокипящие, так и высококипящие сложные эфиры следует хранить в атмосфере сухого азота, чтобы исключить попадание воздуха и влаги в резервуар для хранения.
Достаточно иметь трубопроводы из углеродистой стали. Для сложных эфиров рекомендуется использовать взрывозащищенный центробежный насос с приводом от двигателя.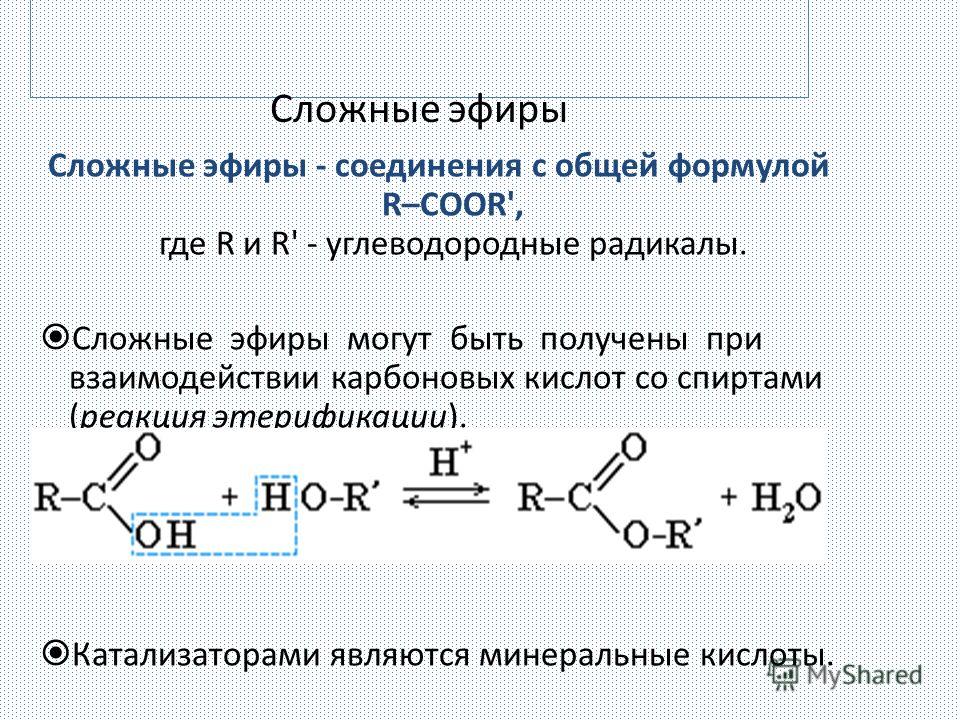 Нагрев внешних резервуаров и трубопроводов не требуется, поскольку сложные эфиры имеют низкую температуру замерзания и низкую вязкость.
Нагрев внешних резервуаров и трубопроводов не требуется, поскольку сложные эфиры имеют низкую температуру замерзания и низкую вязкость.
Однако наиболее распространенные эластомеры несовместимы со сложными эфирами.
Для чего используются сложные эфиры?
При производстве духов, эфирных масел и феромонов используется широкий спектр сложных эфиров. Несколько сложных эфиров оказались полезными в тяжелых условиях окружающей среды, когда речь идет о синтетической смазке.
Низкотемпературная текучесть сложных эфиров и чистая работа при высоких температурах позволили использовать их исключительно в смазочных материалах для реактивных двигателей. Сложные эфиры также играют роль синтетических холодильных смазок в хладагентах, заменяющих CFC. Характеристики при низких и высоких температурах улучшаются за счет смешиваемости сложных эфиров с HFC из-за их характерного разветвления и полярности.
Сложные эфиры широко используются в автомобильной промышленности. Из-за более высоких смазывающих свойств сложные эфиры обычно комбинируют с полиальфаолефинами (ПАО) в полностью синтетических моторных маслах для растворения присадок, балансировки воздействия на уплотнения, снижения летучести и повышения эффективности использования энергии.
Из-за более высоких смазывающих свойств сложные эфиры обычно комбинируют с полиальфаолефинами (ПАО) в полностью синтетических моторных маслах для растворения присадок, балансировки воздействия на уплотнения, снижения летучести и повышения эффективности использования энергии.
Глава 4 — Карбоновые кислоты, сложные эфиры — CHE 120 — Введение в органическую химию — Учебник
Цели обучения
- Назовите карбоновые кислоты общепринятыми названиями.
- Назовите карбоновые кислоты по номенклатуре IUPAC.
Карбоновые кислоты широко распространены в природе, часто в сочетании со спиртами или другими функциональными группами, такими как жиры, масла и воски. Они входят в состав многих продуктов питания, лекарств и предметов домашнего обихода. Неудивительно, что многие из них наиболее известны под общими именами, основанными на латинских и греческих словах, описывающих их источник. То, что вы узнаете из этой главы о химии карбоновых кислот, поможет вам понять биохимию (глава 6 «Углеводы» — глава 11 «Метаболические пути и производство энергии»).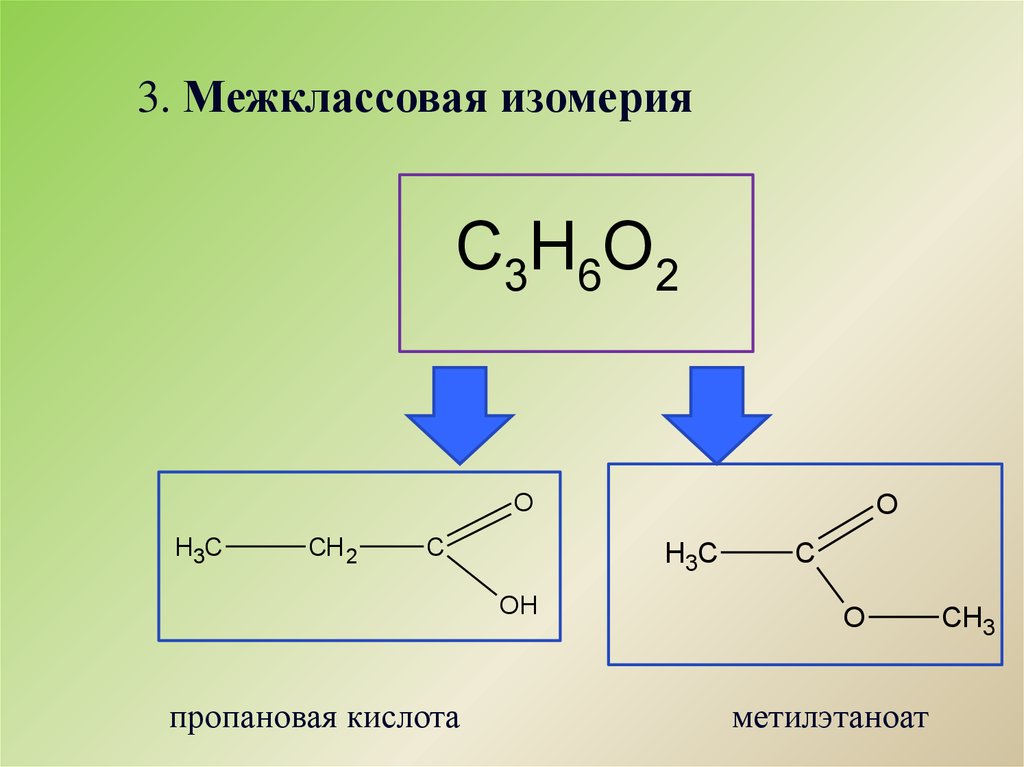
Простейшая карбоновая кислота, муравьиная кислота (HCOOH), была впервые получена перегонкой муравьев (лат. formica , что означает «муравей»). Укусы некоторых муравьев выделяют муравьиную кислоту, а укусы ос и пчел содержат муравьиную кислоту (а также другие ядовитые материалы).
Следующим более высоким гомологом является уксусная кислота, которая производится путем ферментации сидра и меда в присутствии кислорода. В результате ферментации получается уксус, раствор, содержащий 4–10% уксусной кислоты, а также ряд других соединений, которые придают ему вкус. Уксусная кислота, вероятно, является наиболее известной слабой кислотой, используемой в учебных и промышленных химических лабораториях.
Примечание
Чистая уксусная кислота затвердевает при 16,6°C, что лишь немного ниже нормальной комнатной температуры. В плохо отапливаемых лабораториях конца 19 — начала 20 веков на севере Северной Америки и Европы уксусная кислота часто «замерзала» на полке хранения. По этой причине чистая уксусная кислота (иногда называемая концентрированной уксусной кислотой) стала известна как ледяная уксусная кислота , и это название сохранилось до наших дней.
По этой причине чистая уксусная кислота (иногда называемая концентрированной уксусной кислотой) стала известна как ледяная уксусная кислота , и это название сохранилось до наших дней.
Третий гомолог, пропионовая кислота (CH 3 CH 2 COOH), редко встречается в быту. Четвертый гомолог, масляная кислота (СН 3 СН 2 СН 2 СООН), является одним из самых дурно пахнущих веществ, которые только можно себе представить. Он содержится в прогорклом масле и является одним из компонентов неприятного запаха тела. Распознавая очень небольшие количества этого и других химических веществ, ищейки могут выслеживать беглецов. Модели первых четырех карбоновых кислот показаны на рис. 4.1 «Шарикостержневые модели карбоновых кислот».
Рис. 4.1 Шарико-стержневые модели карбоновых кислот
Карбоновые кислоты имеют атом углерода, дважды связанный с атомом кислорода, а также присоединенный к группе ОН. Здесь показаны четыре кислоты: муравьиная кислота (а), уксусная кислота (б), пропионовая кислота (в) и масляная кислота (г).
Кислота с карбоксильной группой, присоединенной непосредственно к бензольному кольцу, называется бензойной кислотой (C 6 H 5 COOH).
В общих названиях карбоновых кислот используются греческие буквы (α, β, γ, δ и т. д.), а не цифры для обозначения положения замещающих групп в кислотах. Эти буквы относятся к положению атома углерода по отношению к атому углерода карбоксильной группы.
В номенклатурной системе Международного союза теоретической и прикладной химии (IUPAC) исходным углеводородом является тот, который соответствует самой длинной непрерывной цепи (LCC), содержащей карбоксильную группу. Окончание — e исходного алкана заменено суффиксом — oic и словом кислота . Например, карбоновая кислота, полученная из пентана, представляет собой пентановую кислоту (СН 3 СН 2 СН 2 СН 2 СООН). Как и в случае с альдегидами, сначала считается карбоксильный атом углерода; цифры используются для обозначения любых замещенных атомов углерода в исходной цепи.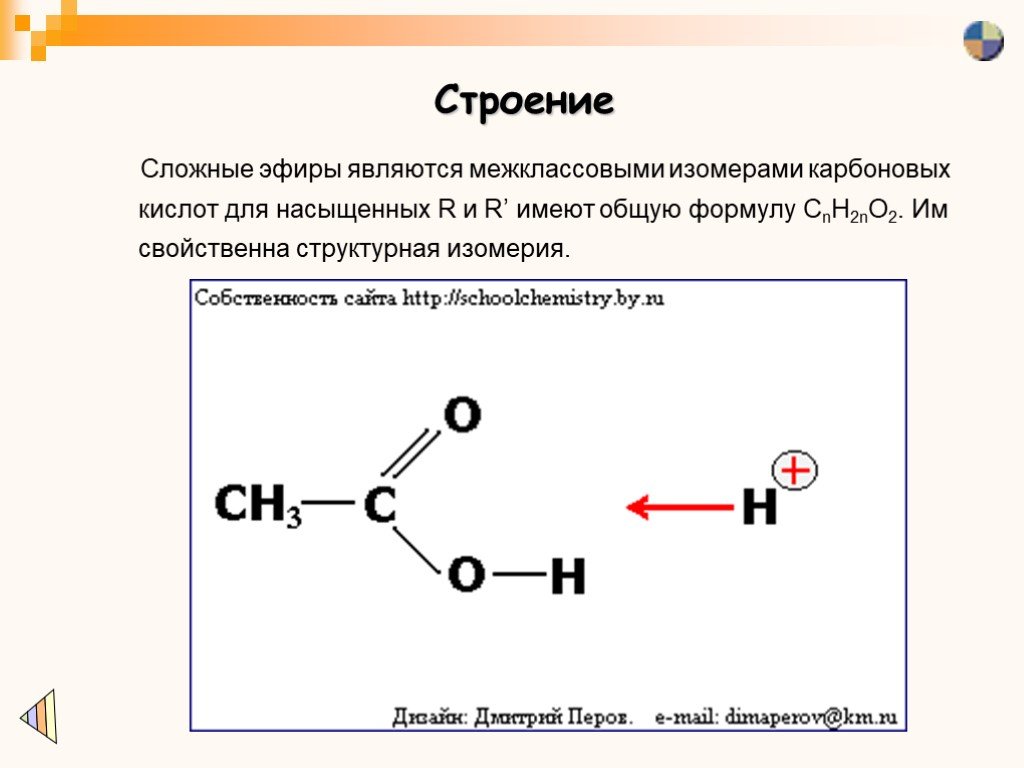
Примечание
Греческие буквы используются с общими именами; номера используются с именами IUPAC.
Пример 1
Дайте общее название и название IUPAC для каждого соединения.
- ClCH 2 CH 2 CH 2 COOH
Раствор
LCC содержит четыре атома углерода; поэтому соединение называют замещенной масляной (или бутановой) кислотой.
Атом хлора присоединен к γ-углероду в общей системе или C4 в системе IUPAC. Соединение представляет собой γ-хлормасляную кислоту или 2-бромбутановую кислоту.
- LCC содержит четыре атома углерода; поэтому соединение называют замещенной масляной (или бутановой) кислотой.
Атом брома (Br) находится при α-углероде в обычной системе или C2 в системе IUPAC. Соединение представляет собой α-броммасляную кислоту или 4-хлорбутановую кислоту.
Упражнение для развития навыков
Дайте название IUPAC для каждого соединения.
ClCH 2 CH 2 CH 2 CH 2 COOH
(CH 3 ) 2 CHCH 2 CHBrCOOH
Пример 2
Напишите сокращенную структурную формулу β-хлорпропионовой кислоты.
Раствор
Пропионовая кислота имеет три атома углерода: C–C–COOH. Присоединить атом хлора (Cl) к материнской цепи по бета-атому углерода, второй от карбоксильной группы: Cl–C–C–COOH. Затем добавьте столько атомов водорода, чтобы дать каждому атому углерода четыре связи: ClCH 2 СН 2 СООН.
Упражнение по развитию навыков
Напишите сокращенную структурную формулу 4-бром-5-метилгексановой кислоты.
Упражнения по обзору концепции
Как называется IUPAC карбоновой кислоты с прямой цепью с шестью атомами углерода?
Альдегид с прямой цепью с пятью атомами углерода имеет общее название валеральдегид.
 Каково общее название соответствующей карбоновой кислоты с прямой цепью?
Каково общее название соответствующей карбоновой кислоты с прямой цепью?
Ответы
гексановая кислота
валериановая кислота
Ключевые выводы
- Простые карбоновые кислоты наиболее известны под общими названиями, основанными на латинских и греческих словах, описывающих их источник (например, муравьиная кислота, латинское formica , что означает «муравей»).
- Греческие буквы, а не цифры, обозначают положение замещенных кислот в общепринятом соглашении об именах.
- Названия IUPAC получены из LCC исходного углеводорода с — е окончание исходного алкана заменено суффиксом — ойк и словом кислота .
Упражнения
1. Нарисуйте структуру каждого соединения.
а. гептановая кислота
b. 3-метилбутановая кислота
c. 2,3-дибромбензойная кислота
d. β-гидроксимасляная кислота
2. Изобразите структуру каждого соединения.
а. o -кислота нитробензойная
b. p -хлорбензойная кислота
в. 3-хлорпентановая кислота
d. α-хлорпропионовая кислота
3. Назовите каждое соединение либо по ИЮПАК, либо по общепринятому названию, либо по тому и другому.
а. (СН 3 ) 2 СНСН 2 СООН
б. (CH 3 ) 3 CCH(CH 3 )CH 2 COOH
c. CH 2 OHCH 2 CH 2 COOH
4. Назовите каждое соединение его названием IUPAC.
а. СН 3 (СН 2 ) 8 СООН
б. (CH 3 ) 2 CHCCl 2 CH 2 CH 2 COOH
c. CH 3 CHOHCH(CH 2 CH 3 )CHICOOH
Ответы
1.
a. СН 3 СН 2 СН 2 СН 2 СН 2 СН 2 СООН
b.

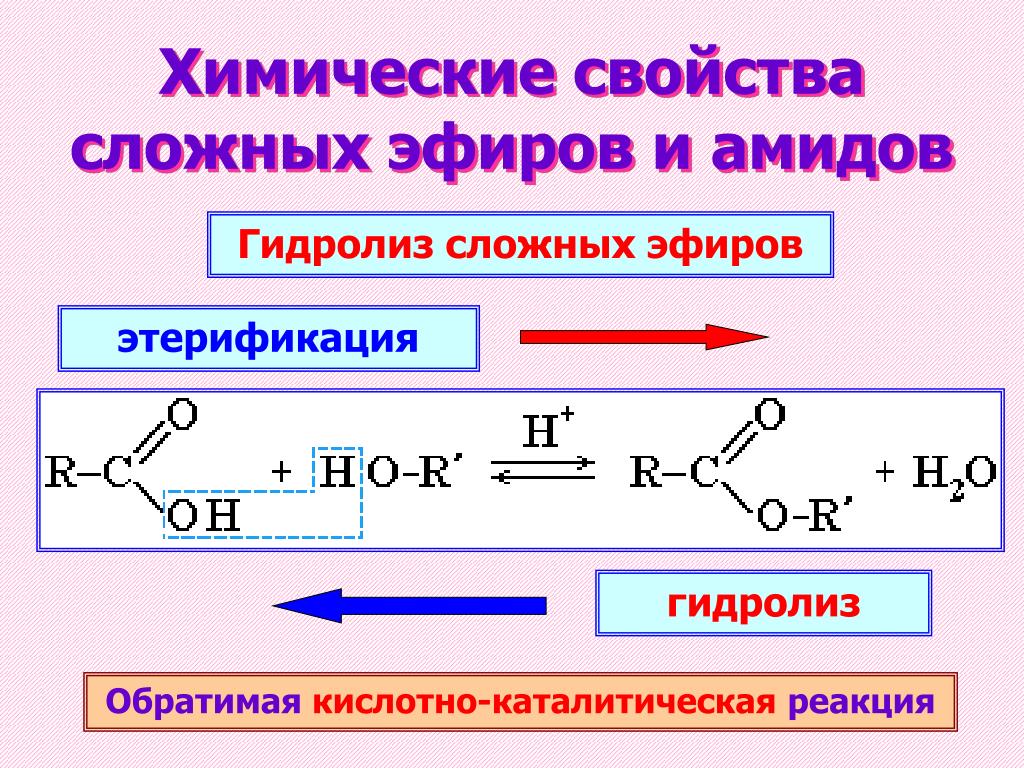 Каково общее название соответствующей карбоновой кислоты с прямой цепью?
Каково общее название соответствующей карбоновой кислоты с прямой цепью?