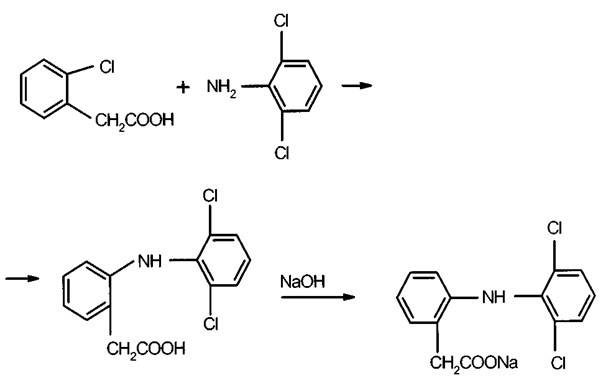
Производные фенолокислот. Эфиры салициловой кислоты
литература для фармацевтов : Лекция 19. Ароматические кислоты и их производные
Ароматические кислоты и их производные.
Ароматические кислоты – производные ароматических углеводородов, у которых в бензольном ядре один или несколько атомов водорода замещены карбоксильными группами. В качестве лекарственных веществ и исходных продуктов их синтеза наибольшее значение имеют бензойная кислота и кислота салициловая (фенолокислота):

Наличие ароматического ядра в молекуле усиливает кислые свойства вещества. Константа диссоциации у бензойной кислоты имеет несколько меньшее значение ( К=6,3·10-5), чем у уксусной (К=1,8·10-5). Аналогичными химическими свойствами обладает и салициловая кислота, однако присутствие фенольного гидроксила в ее молекуле повышает константу диссоциации до 1,06·10-3 и расширяет число аналитических реакций, которые могут быть использованы для качественного о количественного анализа. Бензойная и салициловая кислоты при взаимодействии со щелочами образуют соли.
Ароматические кислоты так же, как и неорганические или алифатические, проявляют антисептическое действие. Они могут оказывать на ткани также раздражающее и прижигающее действие, связанное с образованием альбуминатов. Фармакологический эффект зависит от степени диссоциации кислоты.
Натриевые соли бензойной и салициловой кислот в отличие от самих кислот легко растворимы в воде. В водных растворах они ведут себя как соли сильных оснований и слабых кислот. Фармакологическое действие солей и самих кислот одинаково, однако из-за большей растворимости раздражающее действие их ниже.
Бензойная кислота-Acidum benzoicum
Натрия бензоат-Natrii benzoicum

Свойства. Бензойная кислота – бесцветные игольчатые кристаллы или белый мелкокристаллический порошок с т.пл. 122-124,5°C. Бензоат натрия – белый мелкокристаллический порошок без запаха или с очень слабым запахом, сладко-соленого вкуса. Температура плавления не определяется.
Получение.
1. Окисление толуола перманганатом калия, двуокисью марганца, бихроматом калия.

2. Парофазный каталитический процесс окисления кислородом воздуха толуола до бензойной кислоты.
3. Декарбоксилирование фталевой кислоты до бензойной.
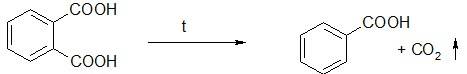
Подлинность. Из реакций подлинности специфичной для бензойной кислоты и ее солей является реакция образования комплексной соли телесного цвета при взаимодействии ее с раствором FeCl3. Для этого бензойную кислоту нейтрализуют щелочью по индикатору и затем добавляют несколько капель раствора Fe Cl3:
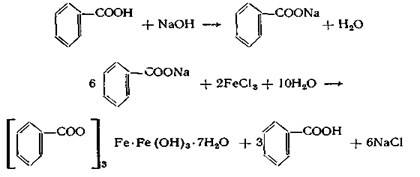
Необходимым условием проведения этой реакции является получение нейтральной натриевой соли бензойной кислоты, так как в кислой среде осадок комплексной соли будет растворяться, при избытке щелочи будет выпадать бурый осадок гидроокиси железа (III).
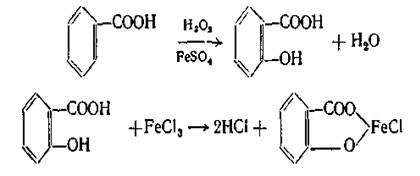
При действии на бензойную кислоту перекиси водорода в присутствии катализатора сульфата железа (II) она превращается в салициловую кислоту, которая может быть обнаружена по фиолетовому окрашиванию с раствором FeCl3:
В качестве одной из примесей в препарате может быть продукт неполного хлорирования исходного вещества синтеза (толуола), который обнаруживается по зеленому цвету пламени после внесения крупинки препарата на медной проволоке в бесцветное пламя горелки — реакция Белыитейна.
Количественное содержание препарата определяется методом нейтрализации в спиртовой среде по индикатору фенолфталеину:

Бензойная кислота применяется как слабый антисептик в мазевых основах, она действует и как отхаркивающее средство. Чаще бензойная кислота применяется в виде своей натриевой соли C6H5COONa. Введение катиона натрия уменьшает раздражающее действие бензойной кислоты и в то же время несколько уменьшает антисептическую активность препарата. Соли бензойной кислоты действуют как слабые диуретики и, подобно самой бензойной кислоте, применяются для консервации пищевых продуктов.
Бензойная кислота летуча, поэтому хранить ее следует в хорошо закупоренных склянках.
Бензоат натрия.
Получение. Получают по реакции нейтрализации бензойной кислоты содой или щелочью:
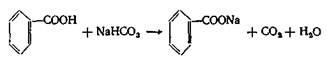
Подлинность препарата подтверждается образованием осадка телесного цвета при действии раствора FеСl3 .
Сухой остаток после прокаливания бензоата натрия окрашивает пламя горелки в желтый цвет (реакция на Na+). Если этот остаток растворить в воде, реакция среды оказывается щелочной на лакмус (реакция на Na+).
Характерной (но не официнальной) реакцией на бензоат натрия является реакция с 5% раствором сульфата меди — выпадает осадок бирюзового цвета. Этой реакцией удобно пользоваться во внутриаптечном контроле как быстро выполнимой и специфичной для данного препарата.
При действии на бензоат натрия минеральной кислоты выпадает осадок бензойной кислоты, который отфильтровывается, высушивается и подтверждается определением температуры плавления (122—124,5°). Эта реакция положена в основу количественного определения препарата: бензоат натрия растворяют в воде и в присутствии эфира, извлекающего бензойную кислоту, титруют кислотой при индикаторе метиловом оранжевом.
Применяется внутрь как отхаркивающее и слабо дезинфицирующее средство. Кроме того, применяется для исследования антитоксической функции печени. Находящаяся в печени аминоуксусная кислота глицин-1 вступает в реакцию с бензойной кислотой с образованием гиппуровой кислоты, которая выделяется с мочой. По количеству выделенной гиппуровой кислоты судят о состоянии печени.
Из эфиров бензойной кислоты в медицинской практике находит применение в настоящее время бензилбензоат.
Бензилбензоат медицинский –Benzylii benzoas medicinalis.
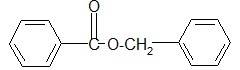
Свойства. Бесцветная маслянистая жидкость со слегка ароматическим запахом. Острого и жгучего вкуса. Практически не растворим в воде. Смешивается в любых соотношениях со спиртом, эфиром и хлороформом. Температура кипения 316-317°C, Т.пл. 18,5-21°C. Нормативный документ ФС 42-1944-89.
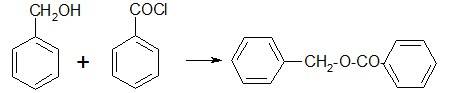
Получение. Взаимодействием хлористого бензоила и бензилового спирта в присутствии оснований.
Подлинность.1. ИК спектр.2. УФ-Спектр.
Количественное определение.
- Спектрофотометрия.
- Газожидкостная хроматография.
Применение. В качестве противочесоточного средства, против вшей. Применяется в ряде косметических средств.
Форма выпуска: гель 20%, крем 25%, мазь 10%, эмульсия.
ФЕНОЛОКИСЛОТЫ. Кислота салициловая. Acidum salicylicum.
Из трех возможных изомеров фенолокислот только салициловая или о-оксибензойная кислота проявляет наибольшую физиологическую активность.

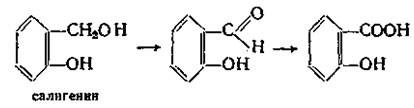
Сама салициловая кислота в настоящее время малоприменима, однако ее производные являются одними из самых многотоннажных лекарственных средств. Сама салициловая кислота –игольчатые кристаллы или мелкокристаллический порошок. При нагревании способна возгоняться – этот факт используется для очистки салициловой кислоты при производстве ацетилсали-циловой кислоты. При нагревании свыше 160°C дексарбоксилируется с образованием фенола.
Впервые салициловая кислота была получена окислением феноло-спирта салигенина, который был получен при гидролизе гликозида салицина, содержащегося в коре ивы. От латинского названия ивы — Salix — и произошло название «салициловая кислота»:
В эфирном масле растения Gaulteria procumbens находится метиловый эфир салициловой кислоты, омылением которого может быть также получена салициловая кислота.
Однако природные источники салициловой кислоты не могут удовлетворить потребности в ее препаратах и поэтому кислоту и ее производные получают исключительно синтетическим путем.
Наибольший интерес и промышленное значение имеет метод получения салициловой кислоты из фенолята натрия. Этот метод впервые применил Кольбе и усовершенствовал Р. Шмидт. Сухой фенолят натрия подвергают действию двуокиси углерода под давлением 4,5—5 атм. при температуре 120—135°. В этих условиях СО2 внедряется в молекулу фенолята в о-положение по отношению к фенольному гидроксилу:
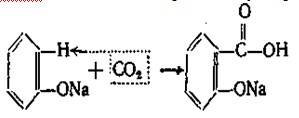
Полученный фенолят салициловой кислоты тотчас же претерпевает внутримолекулярную перегруппировку, в результате получается натриевая соль салициловой кислоты, которая при подкислении выделяет салициловую кислоту:

Салициловая кислота проявляет одновременно свойства фенола и кислоты. Как фенол она дает типичную для фенола реакцию с раствором хлорного железа. Салициловая кислота в отличие от фенолов может растворяться не только в щелочах, но и в растворах карбонатов. При растворении в карбонатах она дает среднюю соль – салицилат натрия – применяемую в медицине:
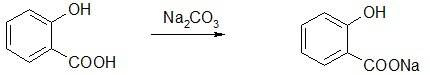
В щелочах образуется динатриевая соль.

3.Температура плавления 158-161°C.
При наличии избытка брома происходит декарбоксилирование и образование трибромфенола. Этот метод используется также для количественного определения.
Количественное определение.
1. Методом нейтрализации в спиртовом растворе при индикаторе фенолфталеине ( фармакопейный метод).

2. Броматометрический метод.

Избыток брома определяется йодометрически.
Применение. Наружно как антисептическое и раздражающее средство.
Формы выпуска. Мази 4%, салициловой кислоты, бензойной кислоты и вазелина паста, салицилово-цинковая паста, спиртовые растворы 2%.
Хранение. В плотно закрытых склянках в защищенном от света месте.
Натрия салицилатNatrii salicylas
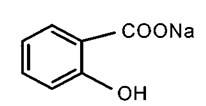
Получение препарата.

Подлинность препарата.1. По реакции с хлорным железом.2. С реактивом Марки ( смесь серной кислоты с формалином) дает красное окрашивание.3. Реакция окрашивания пламени на катион натрия.4. Отстаток от сжигания дает щелочную реакцию на лакмус.5. Образование интенсивного зеленого окрашивания с раствором медного купороса. Если к водному раствору салицилата натрия добавлять по каплям 5% раствор CuSO4, появляется интенсивное зеленое окрашивание.
Количественное определение.
1. Ацидиметрический метод прямого титрования. В качестве индикаторов используется смесь метилового оранжевого и метиленового синего.

2. Броматометрический метод.
Применение. Внутрь в порошках и таблетках в качестве болеутоляющего и противовоспалительного средства при ревматизме.Таблетки 0,25 и 0,5 г, Таблетки натрия салицилата 0,3 и кофеина 0.05 г..
Эфиры салициловой кислоты.
МЕТИЛСАЛИЦИЛАТ – Methylii salicilas
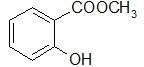
В природе встречается в эфирном масле растения Gaulteria procumbens, но в промышленности его получают синтетическим путем при нагревании салициловой кислоты с метиловым спиртом в присутствии серной кислоты. Метилсалицилат – бесцветная жидсть с ароматным запахом. Дает характерную реакцию с хлорным железом на фенолы. Для препарата определяется в качестве характеристического показателя – показатель преломления 1,535-1,538. Недопустимые примеси влага и кислота, так в этих условиях происходит гидролиз препарата.
Количественное определение. Проводят по количеству щелочи, затраченной на омыление эфира. К навеске препарата добавляют избыток титрованного раствора щелочи и нагревают, оставшуюся после омыления щелочь оттитровывают кислотой.
Применяется наружно как обезболивающее и противовоспалительное средство чаще всего в виде линиментов с хлороформом и жирными маслами.
Фенилсалицилат –Phenylii salicylas
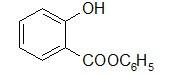
Фенилсалицилат (салол) является эфиром салициловой кислоты и фенола. Впервые он был получен М. В. Ненцким в 1886 г. Учитывая раздражающее действие салициловой кислоты, он стремился найти такой препарат, который бы, сохраняя антисептические свойства фенола, не обладал ядовитым свойством фенола и раздражающим действием кислоты. С этой целью он заблокировал карбоксильную группу в салициловой кислоте и получил эфир ее с фенолом. Исследования показали, что салол, проходя через желудок, не изменяется, а в щелочной среде кишечника омыляется с образованием натриевых солей салициловой кислоты и фенола, которые и оказывают лечебное действие. Так как омыление происходит медленно, продукты омыления салола поступают в организм постепенно и не накапливаются в больших количествах, что обеспечивает более длительное действие препарата. Этот принцип введения в организм сильнодействующих веществ в виде их сложных эфиров вошел в литературу как «принцип салола» М. В. Ненцкого и использовался в дальнейшем для синтеза многих лекарственных препаратов.
Свойства. Мелкие бесцветные кристаллы со слабым запахом. Температура плавления 42-43°C.
Получение. Фенилсалицилат получают синтетически. Наиболее распространенным и общепринятым методом является следующий:
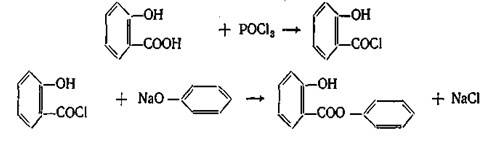
Качественные реакции. В молекуле салола сохранилась свободная фенольная группа, поэтому реакция с раствором FeCl3 дает фиолетовое окрашивание. С реактивом Марки, подобно другим фенолам, препарат дает красноватое окрашивание.
Количественное определение.
1. Омылением с последующим титрованием избытка щелочи кислотой (фармакопейный метод).2. Броматометрический метод.3. Ацидиметрический по салицилату натрия. Для этого используется смесь индикаторов. Сначала до розового цвета с метиловым красным нейтрализуют избыток щелочи и фенолят и затем с метиловым оранжевым в присутствии эфира.
Форма выпуска. Таблетки 0,25 и 0,5 г., таблетки с экстрактом красавки и висмутом нитрата основным.
Применение. Антисептическое действие для лечения заболеваний кишечника.
Эфиры салициловой кислоты по ОН-группе. Кислота ацетилсалициловая –Acidum acetylsalicylicum.
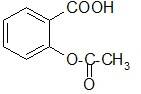
о-Ацетилсалициловая кислота является природным продуктом и содержится в цветах растений вида спиреи (spiraea ulmaria). Этот эфир был введен в медицинскую практику лечения острого суставного ревматизма еще в 1874 г., а как синтетическое лекарственное вещество стал выпускаться в промышленных масштабах в конце прошлого века под названием аспирин (приставка “а” означала, что данное лекарственное вещество не добывается из спиреи, а делается химическим путем). Аспирин называют лекарством 20-го столетия. В настоящее время его производят в мире более 100 тысяч тонн в год.
Известны его противовоспалительные, жаропонижающие и болеутоляющие свойства. Обнаружено также, что он препятствует образованию тромбов, оказывает сосудорасширяющее действие и начинает применяться даже для профилактики и лечения инфарктов и инсультов. Считают, что весь потенциал лечебных свойств этого вещества еще не исчерпан. В то же время аспирин раздражает слизистую оболочку желудочно-кишечного тракта, что может вызывать кровотечения. Возможны также аллергические реакции. Аспирин в организме влияет на синтез простагландинов (контролирующих, в частности, образование тромбов) и гормона гистамина (расширяющего сосуды и вызывающего приток иммунных клеток к месту воспаления; кроме того, он может препятствовать при воспалительных процессах биосинтезу болевых веществ).

Свойства. Бесцветные кристаллы или белый порошок слабокислого вкуса. Мало растворим в воде(1:500), легко растворим в спирте.
Подлинность.
1. Омыление едким натром приводит к образованию салицилата натрия, который при обработке кислотой дает осадок салициловой кислоты.


2. По фиолетовому окрашиванию с хлорным железом после гидролиза и отщепления ацетильного фрагмента.
3. Салициловая кислота дает характерную реакцию образования ауринового красителя с реактивом Марки: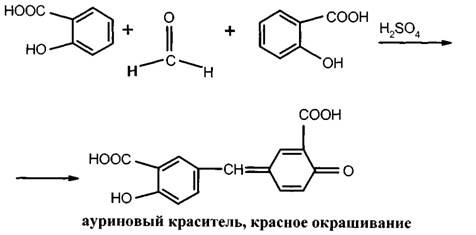
4.Температура плавления 133-136°C.
Специфической примесью, контролируемой согласно требований Фармакопейной статьи является салициловая кислота. Содержание салициловой кислоты должно быть не более 0,05%. Метод анализа спектрофотометричексий комплекса, образующегося при взаимодействии железоаммонийных квасцов с салициловой кислотой, окрашенного в синий цвет.
Количественное определение.
1. Метод нейтрализации по свободной карбоксильной группе (фармакопейный метод). Титрование проводят в спиртовой среде (во избежание гидролиза ацетильной группы), индикатор фенолфталеин.

2. Омылением с последующим титрованием избытка щелочи кислотой по метиловому оранжевому. Фактор эквивалентности равен ½.
3. Броматометрический метод.
4. ВЭЖХ в буферной среде.
Форма выпуска. Таблетки от 0,1 до 0,5 г. Известны таблетки с кишечнорастворимым покрытием, шипучие таблетки. Используется в композиционных лекарственных средствах в комбинации с кофеином, кодеином и другими веществами.
Применение – противовоспалительное, жаропонижающее, дезагрегант.
Хранение в укупоренных банках.
Ведутся работы по синтезу других производных с фрагментом салицилата. Так, получен препарат флюфенизал (11), который в четыре раза более активен, чем аспирин, по противовоспалительному действию (в ревматоидном артрите) и мягче в отношении слизистой оболочки желудка. Его получают фторсульфонированием производного дифенила (7) до соединения (8), в котором затем элиминируют SО2 в присутствии трифенилфосфинродийфторида. Образовавшийся фторид (9) гидрируют для снятия бензильной защиты, затем получают фенолят, который карбоксилируют по методу Кольбе до арилсалицилата (10). После ацилирования соединения (10) получают флюфенизал (11):

АМИДЫ САЛИЦИЛОВОЙ КИСЛОТЫ
САЛИЦИЛАМИД –Salicylamidum
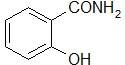
Свойства. Белый кристаллический порошок с т.пл. 140-142°C.
Качественные реакции.1.При щелочном гидролизе образуется салицилат натрия и выделяется аммиак.2.С бромом дает дибромпроизводное.
Количественное определение проводят по выделившемуся аммиаку.
Форма выпуска. Таблетки 0,25 и 0,5 г. Жаропонижающее средство.
ОКСАФЕНАМИД Oxaphenamidum.

Свойства. Белый или белый с лиловато-серым оттенком порошок без запаха с т.пл. 175-178°C.
Получение. Сплавлением фенилсалицилата с п-аминофенолом.
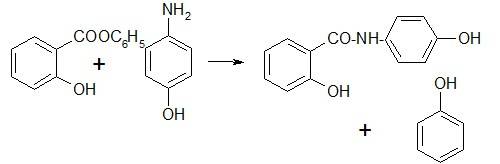
Фенолы отгоняют. Оставшуюся смесь обрабатывают изопропанолом с соляной кислотой. Кристаллы отфильтровывают и перекристаллизовывают из амилового спирта.
Подлинность.
1. Спиртовый раствор дает с хлорным железом красно-фиолетовое окрашивание.
2. С соляной кислотой в присутствии резорцина образуется индофенол, дающий с едким натром красно-фиолетовое окрашивание:

1.Метод Кьельдаля2.ВЭЖХ.
Форма выпуска. Таблетки 0,25 и 0,5 г.
Желчегонное средство (холециститы, желчекаменная болезнь).
ПРОИЗВОДНЫЕ ФЕНИЛПРОПИОНОВОЙ КИСЛОТЫ
ИБУПРОФЕН – Ibuprofenum
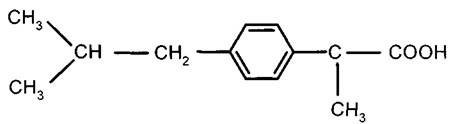
Бесцветные кристаллы, белый порошок, температура плавления 75-77°C, нерастворим в воде, растворим в спирте.
Нестероидное противовоспалительное средство. Препарат относительно малотоксичен, обладает выраженной противовоспалител-ной и болеутоляющей активностью, жаропонижающим действием, стимулирует образование эндогенного интерферона. Применяют для лечения ревматоидного артрита, других заболеваний суставов, для снижения температуры у больных.
Ниже приведен синтез, заключающийся в ацетилировании изобутилбензола по Фриделю-Крафтсу, получении циангидрина реакцией с цианистым натрием и восстановлении этого циангидрина под действием иодистоводородной кислоты и фосфора в п-изобутил-α-метилфенилуксусную кислоту — ибупрофен.
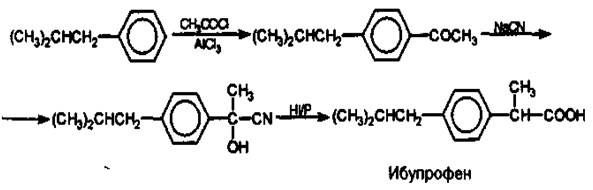
Подлинность.1.УФ спектр.2.ИК спектр3.Осадок с хлорным железом.4.Температура плавления субстанции 75-77°C.
Количественное определение нейтрализация спиртовым раствором едкого натра с фенолфталеином в спиртовом растворе.
Форма выпуска. Таблетки 0,2 г. покрытые оболочкой. Композиционные лекарственные формы с кодеином (нурофен) и др.
Примененние. Нестероидное противовоспалительное средство. Обладающее обезболивающим эффектом.
Среди других нестероидных противовоспалительных препаратов следует отметить следующие:
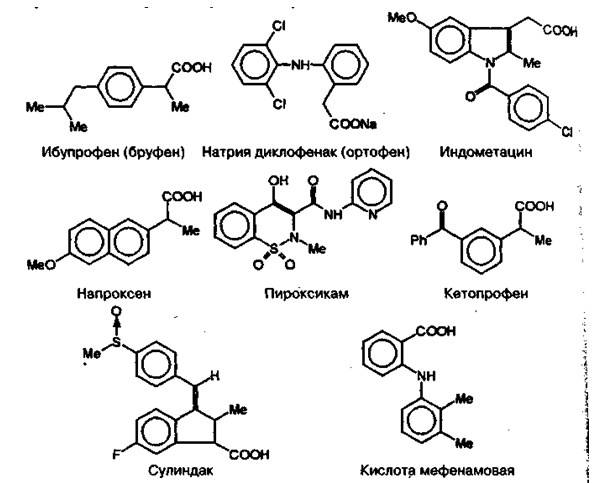
ДИКЛОФЕНАК НАТРИЯ, Ортофен, Вольтарен
Diclofenac sodium

Свойства. Белый или сероватый порошок, растворим в воде.
Препараты натрия диклофенак, мефенаминовая кислота и индометацин близки по противовоспалительному и болеутоляющему действию, последний обладает несколько более значительными эффектами в этом отношении, но первый менее токсичен и обладает лучшей переносимостью. Натрия диклофенак и мефенаминовая кислота хорошо проникает в полости суставов при ревматоидном артрите, его применяют при остром ревматизме, артрозах. Используется для купирования болей и при заболеваниях слизистой оболочки полости рта и пародонтите.
Получение.
Белый или сероватый порошок, растворим в воде. ПОДЛИННОСТЬ:
- осадок с FeCl3 – бурого цвета
- УФ спектр
- ИК спектр
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ: Нейтрализация НСl. ПРИМЕНЕНИЕ:
Противовоспалительное, жаропонижающее, при ревматоидных артритах, 0,025, амп. 2,5% р-р, вольтарен-ретард 0,1.
КИСЛОТА МЕФЕНАМИНОВАЯ Acidum mephenaminicum
Кристаллический порошок серовато-белого цвета, без запаха, горького вкуса. Практически нерастворим в воде, плохо растворим в спирте.
Получение. Препарат получают конденсацией о-хлорбензойной кислоты с ксилидином в присутствии в качестве катализатора порошка меди.

Подлинность.1.Температура плавления2.УФ спектр3.ИК спектр
Количественное определение.Перевод в растворимую натриевую соль и титрование избытка едкого натра.
Форма выпуска. Таблетки 0,5 г, суспензия. Применение. Противовоспалительное, обезболивающее средство.
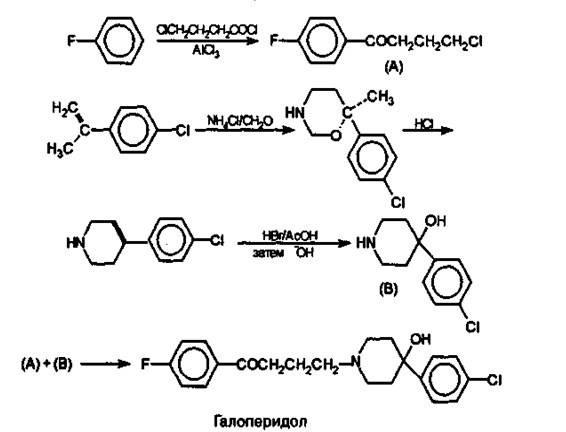
ГАЛОПЕРИДОЛ Haloperidolum

Галоперидол является производным 4-фторбутирофенона. Это одна из новейших групп нейролептиков с очень сильным действием
Получение. Синтез осуществляют по двум ниткам. Сначала по Фриделю-Крафтсу ацилируют фторбензол хлорангидридом γ-хлор-масляной кислоты с образованием 4-фтор- γ-хлорбутирофенона (А). Затем по схеме (В) из 4-хлорпропен-2-илбензола получают произ-водное 1,3-оксазина, которое далее в кислой среде трансформируют в 4-п-хлорфенил-1,2,5,6-тетрагидропиридин. Последний при обра-ботке бромистым водородом в уксусной кислоте превращается в 4-гидрокси-4-п-хлорфенилпиперидин (В). И, наконец, при взаимодей-ствии полупродуктов (А) и (В), получают галоперидол.
Белый или желтоватый порошок, мало растворим в воде, растворим в спирте.
ПОДЛИННОСТЬ:1. ИК спектр2. УФ спектр3. Кипятят со щелочью и проводят реакцию на хлорид-ион.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ: ВЭЖХ
ПРИМЕНЕНИЕ: 0,0015 и 0,005 табл., 0,2% капли, 0,5% инъекционный р-р для купирования приступов шизофренических психозов, при белой горячке.
farmf.ru
Салициловая кислота эфиры - Справочник химика 21
Аспирин — сложный эфир, образованный уксусной и салициловой кислотами. Как следует из проведенного опыта, эфирная связь осуществляется в нем за счет фенольной группы. Карбоксильная группа остается свободной, сообщая аспирину кислые свойства. Отсюда и рациональное название аспирина — ацетилсалициловая кислота. Как сложный эфир ацетилсалициловая кислота очень легко подвергается [c.138]Полученное соединение известно в медицине под названием аспирин (в последнее время стали употреблять химическое название — ацетилсалициловая кислота). Оно является жаропонижающим и болеутоляющим средством. При действии на салициловую кислоту фенола и хлорокиси фосфора образуется сложный эфир за счет карбоксильной группы и гидроксила фенола [c.210]
Этиловый эфир салициловой кислоты (этилсалицилат). ..... [c.651]
Метиловый эфир салициловой кислоты (метилсалицилат). . . [c.645]
В состав еще более известного эфира входит салициловая кислота. Ее молекула представляет собой бензольное кольцо, к соседним углеродным атомам которого присоединены карбоксильная и гидроксильная группы. Из-за этого салициловая кислота обладает двойственными свойствами. С одной стороны, ее карбоксильная группа может конденсироваться со спиртом, например с метиловым, в результате получается метиловый эфир салициловой кислоты, или метилсалицилат, обладающий сильным и приятным хвойным запахом. А с другой стороны, гидр- [c.186]
Аспирин (ацетилсалициловая кислота уксуснокислый эфир салициловой кислоты), Ацетальдегид (этаналь) [c.63]
Салициловая кислота обладает антисептическими свойствами и поэтому широко применяется для консервирования фруктов, пищевых продуктов, белков, вина и т. д. В медицине она применяется наружно как антисептическое и дезинфицирующее средство, а при приеме внутрь является специфическим средством против суставного ревматизма, Ее ацетильное производное, аспирин СбН4(ОСОСНз)СООН (т. пл. 135°), оказывает жаропонижающее, антиневралгическое, а также болеутоляющее действие и имеет широкое применение. Известное антисептическое средство салол является фениловым эфиром салициловой кислоты (т. пл. 42—43 ) и получается в результате сплавления салициловой кислоты с фенолом и хлорокисью фосфора. [c.660]
При реакции с уксусной кислотой салициловая кислота проявляет себя как фенол и за счет гидроксила в ядре вбразует уксусносалициловый эфир, который называют также ацетилсалициловой кислотой, или аспирином. В реакции же с фенолом салициловая кислота ведет себя как кислота и образует сложный эфир за счет карбоксильной группы он называется фениловым эфиром салици- [c.383]
Метиловый эфир салициловой кислоты [c.713]
Нагревайте осторожно над пламенем горелки, все время встряхивая пробирку, чтобы жидкость не выбросило. Эфир образуется не сразу, а постепенно. Через 2—3 мин появляется плавающая сверху бурая капля жидкости с характерным запахом этилового эфира салициловой кислоты. Чтобы лучше различить запах, по остывании пробирки вылейте содержимое в фарфоровую чашку или стакан с водой. [c.138]
Из фенола получают пикриновую кислоту. Кроме того, фенол играет значительную роль в качестве дезинфицирующего средства (карболовая кислота). Наконец, его применяют как исходный материал при синтезе некоторых лекарственных веществ, в частности салициловой кислоты (стр. 659), ее эфиров (например, салола, стр. 660) и т. п. [c.542]
Бензойная кислота легко этерифицируется путем растворения ее в 10%-ном растворе углекислого натрия и кипячения полученного раствора с метиловым или этиловым эфиром п-толуолсульфокислоты [215а]. Любопытно, что подобным же образом можно получить эфир из салициловой кислоты, не затрагивая фенольной группы, тогда как аминобепзойные кислоты алкилируются у атома азота. При растворении оксибензойной кислоты в двух эквивалентах щелочи фенольная группа алкилировалась бы, по всей вероятности, в большей степени, чем карбоксильная. [c.367]
Вы проведете конденсацию салициловой кислоты с метанолом и получите сложный эфир, называемый метилсалицилатом. [c.222]
Оба нафтола, особенно р-соединение, как таковые и в форме их сульфокислот, нитро- и аминопроизводных имеют исключительно большое значение для синтеза всевозможных красителей. Поэтому мы еще не раз встретимся с ними на протяжении этой книги. Некоторые ацильные производные нафтолов, например а- и (З-нафтиловые эфиры салициловой кислоты, находят ограниченное применение в медицине (в качестве антисептиков). Более значительное применение имеют метиловый и этиловый эфиры р-нафтола, которые используются в парфюмерной промышленности. [c.556]
Из салициловой кислоты получите ацетилсалициловую кислоту и фениловый эфир салициловой кислоты. [c.69]
Моющими присадками, действующими одновременно как противокоррозионные, являются кальциевые соли октилового эфира салициловой кислоты [c.85]
Салициловая кислота 119, 345, 467, 542, 600, 611, 659 аллиловый эфир 107 ацетильное производное (аспирин) 660 [c.1197]
Вследствие быстрого сульфирования в реакционной смеси к концу реакции присутствуют лишь следы метилового эфира салициловой кислоты. [c.68]
Образуется диметиловый эфир салициловой кислоты — он одновременно и простой, и сложный. Гидролизуется только сложноэфирная группа. Конечный продукт — простой метиловый эфир салициловой кислоты. [c.200]
Целью настоящего исследования является разработка нового технологически более приемлемого способа получения метилового эфира 2-бензимидазолилкарбаминовой кислоты (карбендазима, известного фунгицида), 2-ацетиламинобензимидазола, а также синтез впервые производных 2-аминобензимидазола и галоидзамещенных (бром- и хлор-) салициловых кислот по 1 - или 2- положению бензимида-зольного цикла и исследование их фунгицидной активности. [c.80]
Когда материал непрозрачен (например, защитная оболочка кабеля), хорошими стабилизаторами бывают сажа, различные пигменты и наполнители. Прозрачные материалы стабилизируют различными эфирами салициловой кислоты (например, п-трет-бутилсалицилатом). Чтобы фильтрация ультрафиолетовых лучей была надежной, стабилизаторы тщательно смешивают с полимером. Эффект защиты усиливается, если вместе со стабилизаторами— поглотителями ультрафиолетовых лучей ввести антиоксиданты, предотвращающие возможный процесс окисления. Сажа выполняет обе функции — защиту полимера от проникновения света и от окисления. [c.91]
САЛОЛ (мусол, фениловый эфир салициловой кислоты) С13Н10О3 — белый кристаллический порошок, т. пл. 42° С, почти нерастворим в воде. С. дезинфицирует мочевые пути, применяют при заболеваниях желудка, кишок, циститах. [c.218]
О-Ацетил-3,5-либромсалицило-вой кислоты хлорангидрид Салициловой кислоты эфир [c.398]
В ледяной уксусной кислоте, содержащей небольшие количества уксусного ангидрида и хлорной кислоты, нри низких температурах бутадиен дает два изомерных ацетата непредельных димеров, причем ацетат 2,6-октадиен-1-ола преобладает [17]. Очень хорошие выходы ]13онропила-цетата были получены из пропилена и уксусной кислоты (80%) при 100-110° со смесью трехфтористого бора и фтористого водорода в качестве катализатора. Другие олефины давали более низкие выходы [5, 29]. Октен-1 с салициловой кислотой и трехфтористым бором при 100° давал более высокие выходы слон ного эфира, чем его изомеры с разветвленной цепью [28]. [c.385]
Детергентными свойствами обладают основные серусодержащие алкилсалицилаты щелочноземельных металлов, получаемые реакцией алкил- или алкенилзамещенной салициловой кислоты или ее соли с серой в присутствии метилового эфира диэтиленгликоля в качестве растворителя [пат. США 3595791]. [c.86]
Эфиры салициловой кислоты ведут себя необычно в них гидрируется бензоязное кольцо. Например, метиловый эфир салициловой кислоты гидрируется до 2-метилциклогексанола. Вероятно, салицилаты реагируют в кетоформе /1/. [c.233]
Метиловый эфир салициловой кислоты, основная составная часть гаультерневого масла, встречается в виде гликозида в различных растениях (ср, стр. 659) он имеет большое значение в качестве душистого вещества т. кип. 222°. [c.660]
Напишите урзЕнсния реакций получения а ) метилового эфира салициловой кислоты б ) ацетилсалициловой кислоты в) полного уксуснокислого эфира галловой кислоты. [c.102]
Для повышения устойчивости полимеров к фотохимической деструкции используют такие органические соединения, которые способны преобразовывать (трансформировать) поглощаемую ими световую энергию. При этом излучаемая такими соединениями световая энергия должна быть намного меньше, чем при поглощении, т. е. уже безопасной для полимера. Такими фотостабилизаторами, заранее вводимыми в полимер, могут быть производные оксибензо-фенона [например, 2-окси-4-октилокси-(или метокси) бензофенон], эфиры салициловой кислоты (применяемые для светостабилизации полнолефинов и поливинилхлорида), пиперидина (2,2,6,6-тетраме-тил-4-оксипиперидин) и др. [c.412]
Кинетику гидролиза циклического эфира 2-(2-карбоксифе-нил) -1,3,2-диоксафосфоринан-2-оксида регистрировали спектрофотометрически по образованию салициловой кислоты при длине волны 298,5 нм (изобестическая точка для кислоты и ее аниона) О О О О [c.42]
Избирательное травление и растворение минералов. Путем обработки поверхности шлифа (или скола) растворами определенных солей удается селективно растворить кристаллы одного минерала, не затрагивая кристаллов других минералов. Так, при обработке поверхности скола клинкера метиловым эфиром салициловой кислоты растворяются кристаллы СзЗ и СгЗ и сохраняют первоначальную форму кристаллы алюминатов и алюмоферритов кальция. При частичном растворении кристаллов алнта и белита удается вскрыть их тонкую внутреннюю структуру — двойниковую текстуру, сростки и др. [c.143]
При нагревании основных 1едных солей ароматических кислот происходит гидроксилирование по орго-положению [176]. Результаты улучшаются, если подвергать нагреванию карбоксилаты меди (II) в протонных растворителях [177]. Вследствие побочного процесса декарбоксилирования салициловых кислот или их сложных эфиров образуются фенолы [178]. Аналогичным образом при нагревании медных солей ароматических кислот с аммиаком при 220° С и при повыщенном давлении образуются ароматические амины [179]. См. также реакции 11-31 (т. 2), 14-5 и 14-10. [c.35]
Салициловая кислота — сильный антисептик. Применяется для консервирования пищевых продуктов (варенья, икры и др.). Ее эфиры (аспирин, салол и некоторые другие) представляют собой лекарственные вещества. Значительное количество ее используют в синтезе ааокрасителей (в качестве азосоставляющей стр. 398). [c.384]
chem21.info
Хранение
В хорошо укупоренной таре, в защищенном от света месте.
Примененне
Осалмид - желчегонное средство.
Сложные эфиры салициловой кислоты
| Структура. Химическое название | Строение и Названия ФГ | МНН, латинское название. Формы выпуска. Фармакологическое действие |
|
Кислота ацетилсалициловая Аспирин 2-ацетоксибензойная кислота | Карбоксильная группа -СООН Сложно-эфирная группа - О – С - ║ О | Acethylsalicylic acid Acidum acethylsalicylicum Aspirjnum Субстанция, таблетки 0,1; 0,25; 0,5 Противовоспалительное, противоревматическое, болеутоляющее, жаропонижающее средство |
Получение
Реакцией этерификации салициловой кислоты с уксусным ангидридом или уксусной кислотой в присутствии Н2SО4(к).
O
h4C – C
O
h4C – C
O
+ Ch4COOH
+
Описание
Бесцветные кристаллы или белый кристаллический порошок, без запаха или со слабым запахом, слабокислого вкуса. Препарат устойчив в сухом воздухе, во влажном постепенно гидролизуется с образованием салициловой и уксусной кислот.
Растворимость
Кислота ацетилсалициловая мало растворима в воде. Легко растворима в этаноле, растворах гидроксидов, карбонатах и гидрокарбонатах щелочных металлов.
Подлинность
1) ИК-спектр поглощения в области 4000-400 см- (в диске с КВr) должен полностью совпадать с прилагаемым к ФС рисунком спектра.
2) УФ-спектр 0,007%-ного раствора кислоты ацетилсалициловой в хлороформе имеет максимум поглощения при 278±2 нм, а УФ-спектр в растворе серной кислоты два максимума при 228±2 и 276±2 нм и один минимум поглощения при 257±2 нм.
3) Температура плавления препарата.
Реакции подлинности основаны на способности сложных эфиров к кислотному и щелочному гидролизу.
4) реакции гидролиза (по сложноэфирной группе)
а) Щелочной гидролиз проводят при кипячении с раствором гидроксида натрия. Прозрачный раствор после кипячения подкисляют Н2SО4 разв. При подкислении разведенной серной кислотой образуется белый кристаллический 1. осадок салициловой кислоты, который отфильтровывают и идентифицируют с помощью хлорида железа (III) по образованию фиолетового окрашивания. 2. К фильтрату (раствору над осадком), содержащему кислоту уксусную, добавляют этанол, концентрированную кислоту серную и при нагревании образуется уксусно-этиловый эфир, имеющий характерный запах.
+ Na2SO4
+ h3SO4 2
2
2СН3СООNа + h3SО4 2СН3СООН + Na2SО4
б) Реакция гидролиза в кислой среде. При обработке препарата в фарфоровой чашке концентрированной серной кислотой ощущается запах уксусной кислоты.
h3SO4, > t° HOH
HOH
+ Ch4COOH
Кислота
уксусная (запах)
Если затем добавить реактив Марки (раствор формальдегида в концентрированной h3S04), то при нагревании появляется розовое окрашивание. Цветная реакция на салициловую кислоту (фенольный гидроксил).
studfiles.net
Сложный эфир - салициловая кислота
Сложный эфир - салициловая кислота
Cтраница 1
Сложный эфир салициловой кислоты ( по фенольной группе) с уксусной кислотой известен под названием аспирина. [1]
Сложные эфиры салициловой кислоты имеют свободную фе-нольную группу НОСбН4СООН и дают растворимые в воде салицилаты щелочных металлов. Натриевое производное мегилсалицилата выпадает в виде осадка. [2]
Сложный эфир салициловой кислоты ( по фенольной группе) с уксусной кислотой известен под названием аспирина. [3]
Все сложные эфиры салициловой кислоты со спиртами и фенолами обладают приятным запахом; это доказывает, что давление их паров достаточно велико даже при комнатной температуре. Их омыление может быть осуществлено в паровой фазе едкой щелочью или окисью магния; получающийся салицилат обнаруживают по флуоресценции. [4]
Если несколько миллиграммов какого-либо сложного эфира салициловой кислоты внести в микротигель, накрыть его кружком фильтровальной бумаги, смоченной едкой щелочью, и прижать сверху часовым стеклом, то в течение 10 - 15 мин. [5]
Значительно более чувствителен метод обнаружения сложных эфиров салициловой кислоты, при котором каплю эфирного раствора вносят в описанный выше прибор и затем испаряют эфир кратковременным погружением пробирки в кипящую воду. Затем пробирку закрывают пробкой со стеклянным шариком, на который нанесена капля едкой щелочи или суспензия окиси магния, и оставшийся сложный эфир выдерживают примерно в течение 10 мин. Выделяющиеся при этом пары омыляются в подвешенной капле, образуя флуоресцирующий салицилат. [6]
Например, пропилен конденсируется с салициловой кислотой с образованием пзопропилсалицилита и алкилированных в ядре сложных эфиров салициловой кислоты. Процесс протекает таким образом, что пропилен вначале конденсируется с салициловой кислотой с образованием изопропилсалицилата, который затем подвергается изомеризации, причем изопропиль-ная группа вступает в бензольное ядро. Механизм действия фтористого бора в данном случае, вероятно, состоит в том, что фтористый бор образует комплекс с салициловой кислотой, присоединяясь к кислороду гидроксила группы GOOH; водород карбоксильной группы делается при этом более подвижным, чем и обусловливается возможность конденсации кислоты с олефином. Это ослабляет связь между кислородом и углеводородным радикалом, что облегчает изомеризацию. [7]
Среди многих органических соединений, предлагаемых в последнее время для фотостабилизации полимеров, находят применение производные бензофенона, сложные эфиры салициловой кислоты, производные бензотриазола, различные органические соединения олова, тиазолидоны и др. В настоящей главе последние два класса соединений не рассматриваются, так как методы синтеза, свойства и применение оловоорганических соединений [1, 2] и тиазолидонов [3, 4] довольно полно освещены в литературе. [8]
Для определения эфиров салициловой кислоты: амил -, метил -, фенил - и этилсалицилатов [138] смешивают 5 мл раствора в этиловом спирте, содержащего 0 5 - 5 мг сложного эфира салициловой кислоты, с 1 мл 10 % - ного раствора Nh3OH - HC1 в 80 % - ном этиловом спирте, добавляют 2 мл 10 % - ного раствора NaOH в 90 % этиловом спирте и 5 мл диэтилового эфира. Полученный раствор фильтруют, первые порции фильтрата отбрасывают, а оптическую плотность следующих порций измеряют при 520 нм. [9]
Обычные антиоксиданты также мало эффективны, поскольку в данном случае необходимо устранить вредное действие ультрафиолетовых лучей ( см. гл. Для этой цели применяются сложные эфиры салициловой кислоты ( например, салол) и производные 2-оксибензофенона. При введении 0 17 % этого светостабилизатора в пленку полиэтилена толщиной 1 мм в течение 45 дней выпотевает всего лишь 3 % добавки; препарат хорошо совмещается с полиэтиленом. В табл. 19 приведены результаты стабилизации полиэтилена различными количествами указанного препарата. [10]
Уравнение (10.9) описывает обычный гидролиз сложного эфира, а уравнение (10.10) - катализируемый гидролиз, который зависит от наличия салициловой кислоты, причем катализатор полностью регенерируется после завершения каталитического акта. Принципиально важным является здесь то, что промежуточный сложный эфир салициловой кислоты гидролизуется очень быстро, превращаясь в кислоту. Причина такого быстрого гидролиза, конечно же, связана с внутримолекулярным характером реакции. [11]
Эти стабилизаторы предохраняют полимеры от действия ультрафиолетовых лучей. В качестве фотостабилизаторов наибольшее значение имеют производные бензофенона и бензотриазола. В США IB промышленном масштабе производится фенилсалицилат, ре-зорцинолдибензоат, й-окси - метаксибеизофеион, 2 2 -диокси - 4-мето кси-бензофенон, 2-окси - 4-н-октоксибензофенон, 2 2 -диокси - 4-н-октоксибензо - фенон, бензотриазол и др. Применяются также сложные эфиры салициловой кислоты, различные органические соединения олова. Стабилизаторы на основе бензофенона содержат не менее одной оксигруппы в ор-то-положен ии по отношению к карбонильной группе. Этот тип фотостабилизаторов применяется в основном для стабилизации винилгалоид-ных полимеров, а некоторые из них-для стабилизации полиэтилена. Эфиры салициловой кислоты и фенолов используют - в случае полиолефинов и галоидсодержащих полимеров. Они применяются для стабилизации поливинилхлорида и полиэтилена. [12]
Страницы: 1
www.ngpedia.ru
Салициловая кислота и ее сложные эфиры
Впервые фенилсалицилат был получен М. В. Ненцким (1886). Он стремился найти такой препарат, который бы, сохраняя антисептические свойства фенола, не обладал бы раздражающим действием кислоты салициловой. Для этого он заблокировал карбоксильную группу в салициловой кислоте и получил ее эфир с фенолом. Фенилсалицилат, проходя через желудок, не изменяется, а в щелочной среде кишечника гидролизуется с образованием натриевых солей кислоты салициловой и фенола, которые и оказывают лечебное действие. Так как гидролиз проходит медленно, продукты гидролиза фенилсалицилата поступают в организм постепенно и не накапливаются в больших количествах, что обеспечивает более длительное действие препарата. Этот принцип введения в организм веществ с раздражающими свойствами в виде их сложных эфиров вошел в литературу как принцип салола> М. В. Ненцкого и использовался в дальнейшем для синтеза многих лекарственных препаратов. [c.234]Аспирин — сложный эфир, образованный уксусной и салициловой кислотами. Как следует из проведенного опыта, эфирная связь осуществляется в нем за счет фенольной группы. Карбоксильная группа остается свободной, сообщая аспирину кислые свойства. Отсюда и рациональное название аспирина — ацетилсалициловая кислота. Как сложный эфир ацетилсалициловая кислота очень легко подвергается [c.138]
Полученное соединение известно в медицине под названием аспирин (в последнее время стали употреблять химическое название — ацетилсалициловая кислота). Оно является жаропонижающим и болеутоляющим средством. При действии на салициловую кислоту фенола и хлорокиси фосфора образуется сложный эфир за счет карбоксильной группы и гидроксила фенола [c.210]
Сложный эфир салициловой кислоты (по карбоксильной группе) и фенола называется салолом [c.480]
При реакции с уксусной кислотой салициловая кислота проявляет себя как фенол и за счет гидроксила в ядре вбразует уксусносалициловый эфир, который называют также ацетилсалициловой кислотой, или аспирином. В реакции же с фенолом салициловая кислота ведет себя как кислота и образует сложный эфир за счет карбоксильной группы он называется фениловым эфиром салици- [c.383]
Реакция. Бромирование Р-дикарбонильной системы с последующим элиминированием НВг и образование.м ароматического соединения. Одновременно происходят расщепление сложного эфира и декарбоксилирование образовавшейся карбоновой кислоты (ср. декарбоксилирование салициловой кислоты). [c.325]
Салициловая кислота образует сложные эфиры как со спиртами и фенолами, так и с кислотами. [c.480]
Вы проведете конденсацию салициловой кислоты с метанолом и получите сложный эфир, называемый метилсалицилатом. [c.222]
Водорастворимые органические кислоты (муравьиная, уксусная, салициловая, янтарная и др.) и вещества, из которых при определенных условиях могут получиться кислоты (сложные эфиры, альдегиды, хлористый метил, растворенные в воде или спирте), опасны для магния (табл. 10.10). [c.549]
Салициловой кислоты сложные эфиры [c.335]
Образуется диметиловый эфир салициловой кислоты — он одновременно и простой, и сложный. Гидролизуется только сложноэфирная группа. Конечный продукт — простой метиловый эфир салициловой кислоты. [c.200]
Салол, см. Салициловой кислоты сложные эфиры. [c.336]
ЭФИР МЕТИЛОВЫЙ САЛИЦИЛОВОЙ КИСЛОТЫ, сложный [c.136]
Сложный эфир салициловой кислоты (по фенольной группе) с уксусной кислотой известен под названием аспирина. Он может быть получен действием хлористого ацетила или уксусного ангидрида на салициловую кислоту [c.480]
Применяемые для этой реакции катализаторы, в основном галогениды металлов, весьма разнообразны. Наиболее часто используются, по-видимому, хлориды алюминия, олова(1У), титана(1У) и цинка. Находят применение также катализаторы других типов п-толуолсульфокислота, фтористый водород, трехфтористый бор и в особенности полифосфорная кислота в некоторых случаях реакцию проводят в отсутствие катализатора. В этих случаях применяют облучение в полярных растворителях, например в метиловом спирте такая реакция называется фотореакцией Фриса. Так, при облучении фенилового эфира салициловой кислоты получают 28% 2,2 - и 32% 2,4 -диоксибензофенона [27]. Термическую реакцию обычно проводят, нагревая смесь сложного эфира и катализатора до 80—180 °С или (используя какой-нибудь растворитель) при более низкой температуре. В качестве растворителей применяют нитробензол, тетра- хлорэтан, сероуглерод или хлорбензол. [c.127]
В 2-литровую круглодонную колбу, снабженную термометром, доходящим до дна колбы, и обратным холодильником, защищенным хлоркальциевой трубкой (примечание 1), помещают 138,1 г (1 моль) салициловой кислоты и 128, 6 г (1 моль) л-хлорфенола и к содержимому колбы прибавляют 58,3 г (0,38 моля) хлорокиси фосфора. Смесь нагревают и время от времени перемешивают ее вращательным движением температуру поддерживают при 75—80°. Через 4 часа реагенты переходят в расплавленное состояние реакционную массу при энергичном перемешивании медленно приливают к раствору 120 г соды в 800 мл воды. Выпавший в осадок сложный эфир отфильтровывают, промывают четырьмя порциями воды по 200 мл и сушат на воздухе. Выход неочищенного л-хлорфенилового эфира салициловой кислоты составляет 174—189 г (70—76% теоретич.) т. пл. 65—66° После перекристаллизации из абсолютного этилового спирта получают 136—154 г чистого препарата (55—62%) т. пл. 69,5—70,5°. Вторую порцию вещества можно получить, если [c.545]
Кальциевые соли алкилированных сложных эфиров салициловой кислоты. ........ [c.324]
Сложные эфиры салициловой кислоты. . . 2245639 13.06.1946 [c.339]
Упомянутый ранее главный компонент жаропонижающих таблеток и выпускаемых в ГДР таблеток от зубной боли — ацетилсалициловая кислота — тоже относится к классу сложных эфиров. Однако в данном случае салициловая кислота образует эфир за счет другой своей группы — гидроксила ОН, который эте-рифицируется уксусной кислотой . Поскольку получить это вещество в наших условиях трудно, проведем с ним лишь некоторые простые реакции. Таблетку ацетилсалициловой кислоты растворим при слабом нагревании и перемешивании в 200 мл воды. Проверим реакцию раствора с помощью индикаторной бумаги. Поскольку в веществе содержится незатронутая карбоксильная группа салициловой кислоты СООН, среда оказывается кислой. [c.265]
ВОЙ кислоты ЭФИР Метиловый САЛИЦИЛОВОЙ кислоты, простой ЭФИР МЕ1 ИЛОВЫЙ САЛИЦИЛОВОЙ КИс-МОТЫ, сложный ЭФИР МЕТИЛОВЫЙ СЕРНОЙ КИСЛО I, Ы ЭФИР МЕТИЛОВЫЙ УКСУСНОЙ КИСЛОТЫ ЭФИР МЕТИЛОВЫИ ХЛОРМУРАВЬИНОЙ КИСЛОТЫ ЭФИР МЕТИЛОВЫЙ ХЛОРУГОЛЬНОЙ КИСЛОТЫ [c.193]
Функции фотостабилизаторов выполняют известные соединения на основе производных салициловой кислоты, бензофенонов и бензотриазолов. В качестве стабилизаторов-антирадов можно применять ароматические соединения с конденсированными кольцами, некоторые типы стабильных радикалов и пр. Что касается механо- и биохимических стабилизаторов, то до сих пор их вообще не рассматривают как стабилизаторы ПВХ. Лубриканты, например, относят к специальным добавкам . Между тем они являются обязательной составной частью практически всех композиций, способствуя сохра- нению комплекса эксплуатационных свойств ПВХ. Механические воздействия, например при переработке, приводяа к ускоренному распаду ПВХ is-is Лубриканты снижают внутреннее трение, тем самым уменьшая опасность перегрева ПВХ во время пребывания в перерабатывающих машинах, обеспечивают равномерное распределение тепла в зоне пластикации полимера и, как следствие, способствуют повышению стабильности ПВХ Лубриканты внутреннего действия понижают вязкость композиции, способствуя ее переработке при более низких температурах. Именно по этой причине химические соединения, относящиеся к классу высокомолекулярных жирных кислот, сложных эфиров, длинноцепных спиртов и т. д., характеризующиеся свойствами лубрикантов следует причислять к механохимическим стабилизаторам ПВХ. [c.179]
При нагревании основных 1едных солей ароматических кислот происходит гидроксилирование по орго-положению [176]. Результаты улучшаются, если подвергать нагреванию карбоксилаты меди (II) в протонных растворителях [177]. Вследствие побочного процесса декарбоксилирования салициловых кислот или их сложных эфиров образуются фенолы [178]. Аналогичным образом при нагревании медных солей ароматических кислот с аммиаком при 220° С и при повыщенном давлении образуются ароматические амины [179]. См. также реакции 11-31 (т. 2), 14-5 и 14-10. [c.35]
Аспирин является сложным эфиром, образованным уксусной и салициловой кислотами. Как следует из проведенного опыта, эфирная связь осуществляется в нем за счет фенольной группы, на что указывает отсутствие фиолетовой окраски с Fe lg. Карбоксильная группа остается свободной, сообщая аспирину кислые свойства. Отсюда и рациональное название аспирина — ацетилсалициловая кислота. Как сложный эфир аспирин очень легко подвергается гидролизу при кипячении с водой. При этом, как видно из уравнения реакции, образуются уксусная кислота и салициловая кислота, содержащая свободную фенольную группу. [c.161]
Гидроксильная группа в орто-положении играет важную роль в гидролизе сложных эфиров и амидов салициловой кислоты. Довольно сложный график рН-зависимости константы скорости гидролиза п-нитрофенил-5-нитросалицилата (рис. [c.257]
Многие сложные эфиры обладают очень приятным запахом, а некоторые из них имеют знакомый вкус. Например, винтергреновое (гаульте-риевое) масло представляет собой сложный эфир салициловой кислоты и метилового спирта [c.461]
Иногда образованием сложного эфира добиваются получения препарата направленного действия. Например, феняловый эфир салициловой кислоты (феиилсалицияат) как сложный эфир распадается в кишечнике под влиянием щелочной среды [c.193]
Пропиленгликоль служит одним из исходных веществ для получения лекарственных препаратов. Так, эфир пропиленгликоля и сульфаметилфенилкарбаминовой кислоты обладает бактерицидной активностью [75]. Сложные эфиры пропиленгликоля и салициловой кислоты или ее производных обладают противолихорадочным, противовоспалительным и анальгетическим действием [76]. [c.206]
Салициловая (2-оксибензойная) кислота в виде сложных эфиров является составной частью некоторых эфирных масел. Ее получают из фенолята натрия и диоксида углерода под давлением 5—6 кгс/см 10 — 6-10 Па) и температуре 120—140°С по реакции Кольбе — Шмитта (1885 г.) [c.446]
К 23 весовым частям натрия, распыленным в 400 весовых частях сухого толуола, прибавляют 152 весовые части метилового эфира салициловой кислоты, и самостоятельно начавшуюся реакцию легким нагреванием доводят до конца. К полученной мелкораздробленной натриевой соли эфира прибапляют при охлаждении и взбалтывании раствор 48 весовых частей магния и 218 весовых частей бромистого этила Б эфире. По мере протекания реакции натриевая соль исчезает. По окончании реакции подкисляют разбавленной уксусной кислотой и толуольно-эфирный раствор экстрагируют 5%-ным раствором едкого кали. Для разложения образовавшегося сложного эфира щелочный раствор некоторое время нагревают на водяной бане. По охлаждении раствора э-гмилофенол осаждают углекислотой. Выделившееся масло застывает в виде кристаллов, которые перекристаллизовывают из лигроииа. Температура плавления 55,5 — 56 температура кшшиия 151 — 152°. [c.105]
Kai.iy, оказывает значительное сопротивление алкилированию. Так. салициловая кислота в тех условиях, в которых т- и р-оксибензойныс кислоты дают эфирокислоты, образует только сложный эфир [c.178]
Салициловая кислота растворима в воде, дает интенсивное шивание с хлоридом железа(III) (качественное обнаруже-фенольной гидроксильной группы). Она оказывает антипатическое, жаропонижающее и антигрибковое действие, но сильная кислота (рКа 2,98) вызывает раздражение пище-Ительного тракта и поэтому применяется только наружно, трь применяют ее производные — соли или эфиры. Салициловая кислота способна образовывать производные по [дой функциональной группе. Практическое значение имеют ицилат натрия, сложные эфиры по СООН-группе гтилсалицилат, фенилсалицилат) и ОН-груп- [c.273]
Некоторые сложные эфиры этилен- п пропиленгликолей, образованные салициловой, бензойной и ацетилбензойной кислотами, обладают терапевтическими свойствами [22, с. 328]. Метоксиэтия-никотин снижает содержание холестерина в крови. Полигликоли и их эфиры используются в медицине для приготовления легкопроникающих в кожу мазевых основ, в которые добавляются лекар- [c.326]
Хорошие результаты дает следующий простой способ ацети-лирования фенолов Фенол прибавляют к небольшому избытку водного раствора едкого натра или едкого кали, туда же добавляют измельченный лед, а затем уксусный ангидрид в небольшом избытке. Смесь взбалтывают в течение нескольких секунд, причем ацетильное производное выделяется в практически чистом состоянии. По этому способу можно получить фенилаце тате 98%-ным выходом. Точно также ацетилируются ди- и три-оксифенолы, нитро- и галоидозамещенные фенолы, а также сложные эфиры ароматических оксикислот. Салициловая кислота не вступает в эту реакцию, но / -оксибензойная и галловая кислоты превращаются таким путем в соответственные ацетильные произйодные с хорошим выходом. В этом случае, по окончании реакции раствор подкисляют для выделения ацети-лированной оксикислоты. [c.114]
Термическое разложение полученной соли с переходо Си —уСп и с образованием сложного эфира салициловой их замещенной салициловой кислоты [c.155]
Реакция. Бромированне р-дикарбонильной системы с последующим минированием НВг и образованием ароматического соединеиия. Одновременно происходят расщепление сложного эфира и декарбокси- Ирование образовавшейся карбоновой кислоты (ср. декарбоксилирова-салициловой кислоты). [c.325]
chem21.info
Салициловая кислота
Содержание.
Общие сведения 3
Получение 4
Качественный анализ 5
Аналитические реакции салицилат-иона 5
Количественный анализ 6
Кислотно-основное титрование в водных растворах 6
Инструментальный анализ 7
5.1. Фотоколориметрия 7
Применение 9
Список использованной литературы 10
Салициловая кислота (2-гидроксибензойная кислота), С6Н4(ОН)СООН; бесцветные кристаллы, хорошо растворима в этаноле, диэтиловом эфире и других полярных органических растворителях, плохо растворима в воде (1.8 г/л при 20 °C).
Выделена из ивовой коры итальянским химиком Рафаэлем Пириа и затем синтезирована им же.
В природе встречается в растениях в виде производных — главным образом в виде гликозида метилового эфира (в частности, салициловая кислота была впервые выделена из коры ивы Salix L., откуда и происходит название), свободная салициловая кислота наряду с салициловым альдегидом в небольших количествах содержится в эфирном масле, выделяемых из цветов некоторых видов спиреи (Spiraea ulmaria, Spiraea Digitata).
3Получение.
Синтез бензойной и салициловой кислот осуществляют, используя общие методы синтеза ароматических кислот. В промышленности бензойную кислоту получают жидкофазным окислением толуола воздухом при 130 — 160 °С и давлении 308 — 790 кПа (катализаторы — бензоаты кобальта и марганца, промотированные соединениями брома). Бензойную кислоту получают окислением толуола кислородом воздуха в присутствии катализатора (соединений Со, Mn, V)
В химической промышленности салициловую кислоту получают карбокси-лированием твердого фенолята натрия (реакция Кольбе —Шмитта):
Получение ацетилсалициловой кислоты проводят ацилированием гидроксильной группы салициловой кислоты уксусным ангидридом:
Рассмотрим основные этапы контроля качества ароматических кислот и их производных (определение подлинности, испытания на чистоту, количественное определение) в соответствии с их общими химическими свойствами, которые обусловлены присутствием фенольного гидроксида (в молекуле салициловой кислоты), карбоксильной группы (в молекулах бензойной, салициловой, ацетилсалициловой кислот), сложноэфирной группы (в молекулах фенилсалици-лата, ацетилсалициловой кислоты), амидной группы (в молекулах салицила-мида, оксафенамида).
4
Качественный анализ.
Аналитические реакции на салицилат-ион.
С хлоридом железа (III), с образованием окрашенного комплексного соединения:
С Сульфатом меди (II) с образованием растворимой в воде медной соли зелёного цвета:
5
Количественный анализ.
Кислотно-основное титрование в водных растворах.
Определение массовой доли салициловой кислоты в образце алкалиметрическим методом (вариант прямого титрования).
C6h5(OH)COOH + NaOH = C6h5(OH)COONa + h3O
М (C6h5(OH)COOH) = 138,12 г/моль
Методика: Точную навеску салициловой кислоты помещают в колбу для титрования, растворяют в 5 см3 нейтрализованного по фенолфталеину спирта, прибавляют 1-2 капли раствора фенолфталеина и титруют 0,1 М раствором гидроксида натрия до слабо-розовой окраски раствора.
Инструментальный анализ.
Фотоколориметрия.
Применение.
Салициловая кислота - активный компонент ивовой коры. Ещё в XIX в. её использовали для лечения ревматизма и мочекислого диатеза, а сегодня это вещество синтезируют в больших количествах, так как оно служит основой для производства многих лекарств.
Салициловая кислота обладает слабыми антисептическими, раздражающими и кератолитическими (в больших концентрациях) свойствами и применяется в медицине наружно в мазях, пастах, присыпках и растворах при лечении кожных заболеваний; входит в состав пасты Лассара, присыпки «гальманин», препаратов «мозольная жидкость» и «мозольный пластырь».
Производные салициловой кислоты также применяются в медицине (салицилат натрия), её амид (салициламид) и ацетилсалициловую кислоту (аспирин) используют как жаропонижающие, противоревматические, противовоспалительные и болеутоляющие средства; фенилсалицилат — как антисептик, пара-аминосалициловую кислоту (структурно близкую к пара-аминобензойной кислотой, необходимой туберкулезным микобактериям и поэтому метаболически конкурирующую с ней) — как специфическое противотуберкулёзное средство.
Благодаря антисептическому действию салициловую кислоту употребляют при консервировании пищевых продуктов; её используют также в производстве азокрасителей, душистых веществ (сложных эфиров салициловой кислоты), для колориметрических определения Fe и Cu, для отделения тория от других элементов.
9
Список литературы.
Гузей Л.С., Кузнецов В.Н. «Новый справочник по химии». М. 1998 г. С-261;
Методическое пособие по аналитической химии. «Инструментальные методы анализа», Пермь, 2004;
Методическое пособие по аналитической химии. «Качественный химический анализ», Пермь, 2003;
Методическое пособие по аналитической химии. «Количественный химический анализ», Пермь, 2004;
Оганесян Э.Т. «Руководство по химии поступающим в вузы». Москва. 1992 г. С-447;
Тюкавкина Н.А., Бауков Ю.И. «Биоорганическая химия». Москва. 1985 г. С-258;
Степаненко Б.Н. «Органическая химия». Москва. 1980г. С-253.
10
studfiles.net
Производные фенолокислот
Препараты сложных эфиров салициловой кислоты
Лекарственные вещества
1. Кислота ацетилсалициловая.
Acidum acetylsalicylicum – салициловый эфир уксусной кислоты.
Бесцветные кристаллы или белый кристаллический порошок без запаха или со слабым запахом. Т. пл. = 133-138 о С. Слабокислый вкус. Мало растворим в воде, легко растворим в спирте, растворим в эфире, хлороформе. Растворим в растворе NaOH и соды (NaHCO3, NaCO3).
Получение
Слово «аспирин» произошло от слов ацетил + спираевая кислота, старое название салициловой кислоты.
Чистота.
Отсутствие салициловой кислоты, влаги, уксусной кислоты.
2. Метилсалицилат, Methylii salicylas.
Метиловый эфир салициловой кислоты
ρ = 1,176 - 1,184 г/см3, η20Д = 1,535 – 1,538, Тпл = 8°С, Ткип = 223°С
Встречается во многих растениях, впервые обнаружен как душистое начало гаултериевого масла. Бесцветная или желтоватая жидкость с характерным сильным ароматическим запахом.
Получение.
Получают нагреванием смеси салициловой кислоты с избытком метанола в присутствии концентрированной серной кислоты.
Чистота.
Определяют отсутствие влаги и кислотность.
3. Фенилсалицилат.
Phenylii salycilas, фениловый эфир салициловой кислоты, Салол, Salolum.
Белый кристаллический порошок или мелкие бесцветные кристаллы со слабым запахом. Тпл = 42 - 43°С
Дает эвтектические смеси с камфорой, тимолом, ментолом.
Практически не растворим в воде, растворим в этаноле и других растворителях, в растворе NaOH, не растворим в NaHCO3.
Получение.
Впервые получен в 1886 году Н.В. Ненцким.
Реакция конденсации салицилата и фенолята натрия в присутствии трихлороксида фосфора.
фенилсалицилат
Связь строения с физиологическим действием.
Происходит блокирование фенольного гидроксила фенола и карбоксильной группы салициловой кислоты в сложную эфирную группу. Это «принцип салола» широко используется при синтезе лекарственных препаратов (принцип введения сильнодействующих веществ в виде их сложных эфиров).
Применение этих трех соединений в медицине основано на том, что целебным действием обладает сама салициловая кислота. Абсорбируясь стенками кишечника, но, будучи довольно сильной кислотой, она вызывает неприятное раздражение при приеме через рот. Раздражающее действие устраняют этерификацией карбоксильной группы метиловым спиртом или фенолом, а также ацетилированием, ацетильное производное обладает менее кислым характером. Все три эфира – метилсалицилат, аспирин и салол не гидролизуются в заметной степени при соприкосновении со слабокислым желудочным соком и проходят через желудок, не оказывая вредного действия на чувствительные ткани, но, спускаясь в кишечный тракт, эфиры гидролизуются под влиянием щелочи с выделением свободной салициловой кислоты.
Ацелизин. Acelysinum
Представляет собой смесь Д,L-лизина ацетилсалицилата и глицина в соотношении 9:1
глицин
в цвиттер ионной форме
Д,L – лизина ацетилсалицилат
Белый кристаллический порошок
Действие аналогично ацетилсалициловой кислоте. Он оказывает противовоспалительное, жаропонижающее, антитромбическое действие.
Назначают внутримышечно или внутривенно при тромбозах, в том числе коронарных и мозговых сосудах, гипертермии, некоторых болевых синдромах.
Форма выпуска – флаконы по 1 г (содержат 0,5 г аспирина). Перед введением растворяют в 5 мл воды для инъекций. Как обезболивающее средство вводят по 5-10 мл 1-3 раза в сутки в течение 3-10 дней.
Хранение: +4-10 оС в защищенном от света месте, раствор можно хранить не более 30 минут.
Все препараты хранят в сухом месте, в хорошо закупоренных банках.
Ацетилсалициловая кислота с некоторыми веществами основного характера (NaCO3, уротропин) дает легко отсыревающие смеси, что необходимо учитывать при выписывании рецептов.
| Препарат, физические свойства | Гидролиз. Общая реакция | |
| реакция | Идентификация продуктов Гидролиза {Р-я с хлоридом железа (III)} | |
| Аспирин Ацетилсалициловая кислота Т.пл.= 133-138°С УФ–спектр в 0,1 М NaOH, спирте. λmax=290 нм. (после NaOH + h3O2) | 1) Ch4COOHпо реакции этерификации. С этанолом появляется запах яблок у эфира 2) салициловую к-ту - по реакции с FeCI3 образуется фиолетовое окрашивание; - с формальдегидом (реактив Марки) образуется розовое окрашивание. {нет} | |
| Метилсалицилат n20 =1,535 –1,538 | осадок салициловой кислоты отфильтровывают, промывают, сушат и устанавливают Т.пл. 156-161°С { Фиолет. ок-раска после добавления к водному или спирт. р-ру капли FeCI3} | |
| Фенилсалицилат Салол Т.пл.=42 -43°С | 1) запах фенола 2) салициловую к-ту с Ch3Oвh3SO4 – розовое окрашивание {Фиолетовое окрашивание} | |
| Ацелизин УФ |
| 1) салициловую кислоту по реакциям с FeCI3,реактивом Марки, лизин и глицин по специфическим реакциям на аминокислоты. 2) УФ {нет} |
Реакции подлинности эфиров салициловой кислоты
Количественное определение
Для количественного определения всех препаратов могут быть использованы реакции щелочного гидролиза. Для этого берут избыток 0,5 М раствора гидроксида натрия и гидролизуют препараты на кипящей водяной бане с обратным холодильником.
Избыток титрованного раствора щелочи оттитровывают 0,5 М раствором соляной кислоты.
ГФ Х – для метилсалицилата и фенилсалицилата применяют алкалиметрический метод гидролиза.
а)
избыток щелочи и феноляты титруют с бромкрезоловым пурпуровым:
б)
Индикатор – фенолфталеин
fэкв = 1
ГФ Х - для ацетилсалициловой кислоты используют метод алкалиметрии без предварительного гидролиза – вариант нейтрализации по свободной OH- группе
Препарат растворяют в нейтрализованном и охлажденном до 8-10°С этаноле и титруют 0,1 М раствором NaOH (индикатор – фенолфталеин).
Броматометрический метод используется для эфиров салициловой кислоты (после гидролиза с NaOH)
-3HBr
fэкв. =1/6
СФМ по сравнению со стандартным раствором
УФ – спектроскопия для аспирина после щелочного гидролиза с перекисью водорода. λ max=290 нм
В ацелизине глицин определяют ацидиметрическим методом неводного титрования хлорной кислотой.
Хранение. В хорошо укупоренной таре, предохраняющей от действия света.
Применение:
Аспирин применяют внутрь в качестве противоревматического, противовоспалительного, болеутоляющего и жаропонижающего средства по 0,25 - 0,5 г, 3 - 4 раза в день.
Фенилсалицилат применяют внутрь в качестве антисептического средства при заболеваниях кишечника и мочевых путей по 0,3-0,5 г. «Бесалол», «Уробесал».
Метилсалицилат назначают в качестве противоревматического, противовоспалительного и болеутоляющего средства для наружного применения в виде втираний (иногда в смеси с хлороформом и жирными маслами).
Исследования последних лет показали, что аспирин в малых дозах оказывает антитромбическое действие, т.к. угнетает агрегацию тромбоцитов. Была показана возможность применения её в сочетании с некоторыми аминокислотами для парентерального введения.
studfiles.net

















