Содержание
Сложный эфир — азотная кислота
Cтраница 2
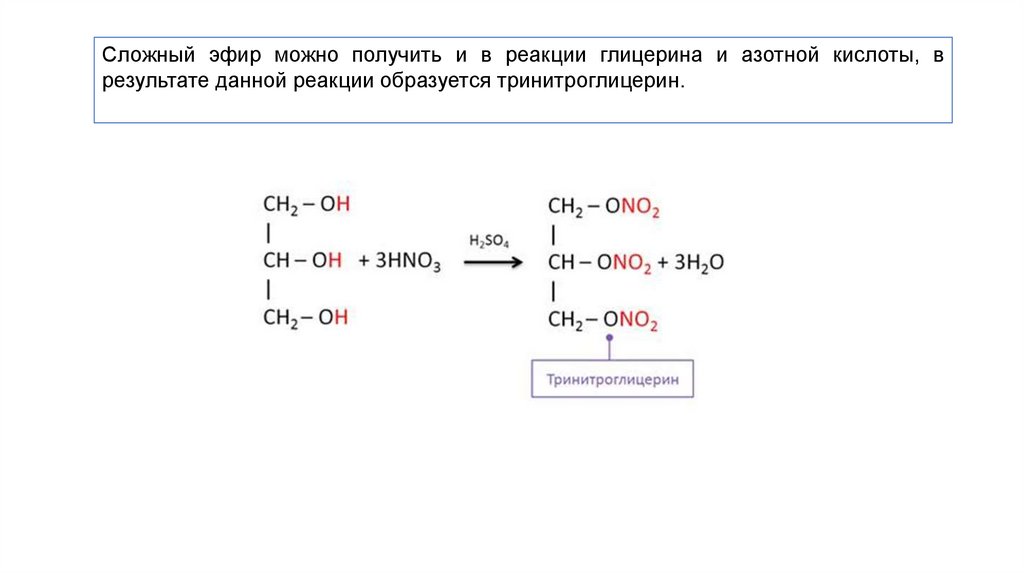
Следует иметь в виду, что нитроглицерин и нитроцеллюлоза являются сложными эфирами азотной кислоты, а не истинными органическими нитросоединениями.
[16]
Пентаэритрит широко используется при изготовлении покрытий, а также для производства сложного эфира азотной кислоты — пентаэритриттетранитрата ( ПЭТН) C ( Ch3ONO2) 4, представляющего собой взрывчатое вещество.
[17]
Пентаэритрит широко используется при изготовлении покрытий, а также для производства сложного эфира азотной кислоты — пентаэритритилтетранитрата ( ПЭТН) C ( Ch3ON02) 4, представляющего собой взрывчатое вещество.
[18]
Подобно глицерину, целлюлоза ( хлопчатобумажная и бумажная материя) может образовывать сложный эфир азотной кислоты. Наиболее нитрированный продукт есть тринитро-целлюлоза, хлопчатобумажный порох, с содержанием до 14 % азота; она растворяется в ацетоне.
[19]
Из числа эфиров целлюлозы, используемых для лакокрасочных материалов, наибольшее распространение имеют сложные эфиры азотной кислоты — нитраты целлюлозы с содержанием 11 — 12 % азота, называемые коллоксилинами.
[20]
Нитросоединения содержат связь C-N и поэтому являются азотсодержащими производными углеводородов, тогда как сложные эфиры азотной кислоты имеют связь С-О и являются азотсодержащими производными спиртов. Важнейшими нитросоединениями являются нитробензол, тринитротолуол, нитрометан.
[21]
Зато разложение азотной кислоты, органических соединений, содержащих нитро — и нитрозогруппы, сложных эфиров азотной кислоты, нитритов и нитратов ( за исключением нитрата и нитрита аммония) сопровождается образованием оксидов азота.
[22]
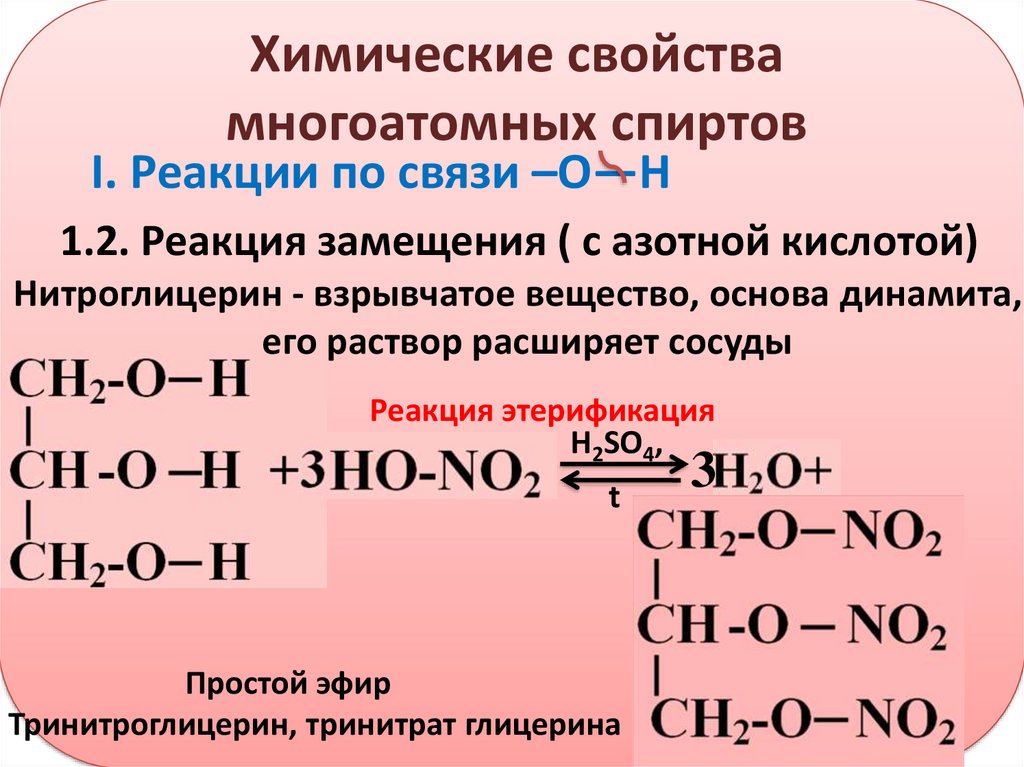
Группа — О-NCb встречается в псион огенной форме в алкилнитратах R-О — Т02, представляющих собой сложные эфиры азотной кислоты. Низшие эфиры с малым числом атомов углерода являются подвижными жидкостями с сладковатым запахом; при нагревании они сильно взрывают. Нитроэфиры многоатомных спиртов ( нитроглицерин, нитроцеллюлоза и др.) представляют собой твердые вещества, если исходные спирты являются также твердыми веществами.
Нитроэфиры многоатомных спиртов ( нитроглицерин, нитроцеллюлоза и др.) представляют собой твердые вещества, если исходные спирты являются также твердыми веществами.
[23]
Тривиальное название вводит в заблуждение: нитроглицерин является не нитросоединением ( см. раздел 2.2.13), а сложным эфиром азотной кислоты, правильнее называть его глицериннитратом. Он представляет собой бесцветную или желтоватую маслянистую жидкость. Обращение с этим соединением требует крайней осторожности, поскольку при нагревании или ударе оно взрывает с большой силой.
[24]
Во время второй мировой войны в Германии для производства пороха, обладающего якобы наименьшей зависимостью скорости горения от температуры, применялся триэтиленгликольдинитрат — сложный эфир азотной кислоты и триэтиленгликоля.
[25]
Это соединение отличается весьма положительными свойствами, так как оно не только способствует желатинированию, но действует также и в качестве стабилизатора нейтрализуя продукты разложения сложных эфиров азотной кислоты и удлиняя, таким образом, срок полезной службы ВВ.
[26]
Нитроглицерин и нитрогликоль очень плохо растворимы в воде, но хорошо в жире и при попадании на кожу или при вдыхании могут вызвать явления отравления. Сложные эфиры азотной кислоты при нейтрализации кислых промывных вод щелочами или известью расщепляются с образованием нитратов и при этом частично окисляются.
[27]
В 1875 г. Нобель сделал дальнейшее открытие, что нитрат целлюлозы может набухать в нитроглицерине, образуя достаточно устойчивую желатинообразную массу, обладающую мощными взрывчатыми свойствами. Это сложный эфир азотной кислоты, который по своему строению подобен нитроглицерину С3Н5 ( ОМО2) з, и это сходство может быть является причиной растворимости твердого высокомолекулярного нитрата целлюлозы в жидком сложном эфире-нитроглицерине. Впервые приготовленное взрывчатое вещество этого типа, названное Нобелем гремучий желатин, содержало 92 % нитроглицерина и 8 % нитрата целлюлозы. Это одно из наиболее мощных бризантных веществ из известных взрывчатых веществ; применяется для взрывания скал. При более низком соотношении нитроглицерина и нитрата целлюлозы получаются медленно сгорающие смеси, пригодные для заполнения снарядов. Для оружия с нарезными стволами необходимо очень медленное горение пороха. Первоначальный толчок снаряду не должен сопровождаться возникновением чрезмерного давления в почти герметически замкнутом пространстве, где заключена свинцовая пуля или снаряд, плотно пригнанные в винтообразном канале ствола оружия.
При более низком соотношении нитроглицерина и нитрата целлюлозы получаются медленно сгорающие смеси, пригодные для заполнения снарядов. Для оружия с нарезными стволами необходимо очень медленное горение пороха. Первоначальный толчок снаряду не должен сопровождаться возникновением чрезмерного давления в почти герметически замкнутом пространстве, где заключена свинцовая пуля или снаряд, плотно пригнанные в винтообразном канале ствола оружия.
[28]
Исходные материалы для этих процессов имеются в любом количестве. Преимущества сложных эфиров азотной кислоты нитробутил-глицерина по сравнению с нитроглицерином состоят в полном кислородном балансе ( C4H6OiiN4 4СО2 ЗН2О 2N2), в меньшей чувствительности их к ударам и в повышенной приблизительно на 70 % взрывной силе.
[29]
Существуют два важнейших класса твердых топлив. Основой первого являются сложные эфиры азотной кислоты, такие как нитроглицерин и нитроцеллюлоза. Такое топливо принято называть двухосновным или баллиститным. Основой второго топлива являются неорганический окислитель, например селитры или перхлораты, и органическое горючее, смолы, каучук или полимеры. В ряде случаев к ним добавляются различные присадки для повышения качества топлива.
Основой второго топлива являются неорганический окислитель, например селитры или перхлораты, и органическое горючее, смолы, каучук или полимеры. В ряде случаев к ним добавляются различные присадки для повышения качества топлива.
[30]
Страницы:
1
2
3
Соли И Эфиры Азотной Кислоты 7 Букв
Решение этого кроссворда состоит из 7 букв длиной и начинается с буквы Н
Ниже вы найдете правильный ответ на Соли и эфиры азотной кислоты 7 букв, если вам нужна дополнительная помощь в завершении кроссворда, продолжайте навигацию и воспользуйтесь нашей функцией поиска.
ответ на кроссворд и сканворд
Суббота, 27 Апреля 2019 Г.
НИТРАТЫ
предыдущий
следующий
ты знаешь ответ ?
ответ:
похожие кроссворды
- Соли или эфиры лимонной кислоты
- Соли и эфиры щавелевой кислоты
- Группа органических соединений, соли и эфиры масляной кислоты
- Соли и эфиры фосфорных кислот, основное применение
- Органич.
 соед-я, соли и эфиры уксусной кислоты
соед-я, соли и эфиры уксусной кислоты - Сложные эфиры уксусной кислоты или ее соли 7 букв
- Соли или эфиры фосфорных кислот 7 букв
- Соли и эфиры фосфорных кислот, основное применение 7 букв
- Соли и эфиры уксусной кислоты 6 букв
- Соли и эфиры фосфорных кислот, основное применение букв
- Эфиры и соли уксусной кислоты
- Минерал, содержащий соли азотной кислоты
- Соли и эфиры угольной кислоты
- Без соли или с недостаточным количеством соли (а также кислоты, остроты) 7 букв
- Сложные эфиры амиловых спиртов и азотистой кислоты
- Сложные эфиры амиловых спиртов и азотистой кислоты hno2
Переливаемый из расплава нитратный эфир с большой энергией взрыва
Нитратный эфир с высокой плотностью энергии (1) с уникальными свойствами был синтезирован с хорошим выходом в трехстадийном процессе. Исследования разрушающих воздействий и расчеты характеристик взрывчатых веществ показывают, что (1) имеет характеристики, аналогичные характеристикам хорошо изученных взрывчатых веществ. Кредит: (C) Wiley-VCH 2008
Исследования разрушающих воздействий и расчеты характеристик взрывчатых веществ показывают, что (1) имеет характеристики, аналогичные характеристикам хорошо изученных взрывчатых веществ. Кредит: (C) Wiley-VCH 2008
С момента открытия нитроглицерина в 1846 году группа сложных эфиров нитратов была известна своими взрывоопасными свойствами. Целый ряд других нитратных эфиров впоследствии был использован в качестве взрывчатых веществ и топлива. Исследовательская группа под руководством Дэвида Э. Чавеса из Лос-Аламосской национальной лаборатории (США) разработала новый тетранитратный эфир. Как сообщается в журнале Angewandte Chemie , соединение имеет особенно интересные характеристики: оно твердое при комнатной температуре, является очень мощным взрывчатым веществом и может быть отлито из расплава в желаемую форму.
Нитратные эфиры представляют собой органические соединения азотной кислоты, которые могут обладать огромной взрывной силой. Однако их жидкое физическое состояние делает обращение с ними очень трудным.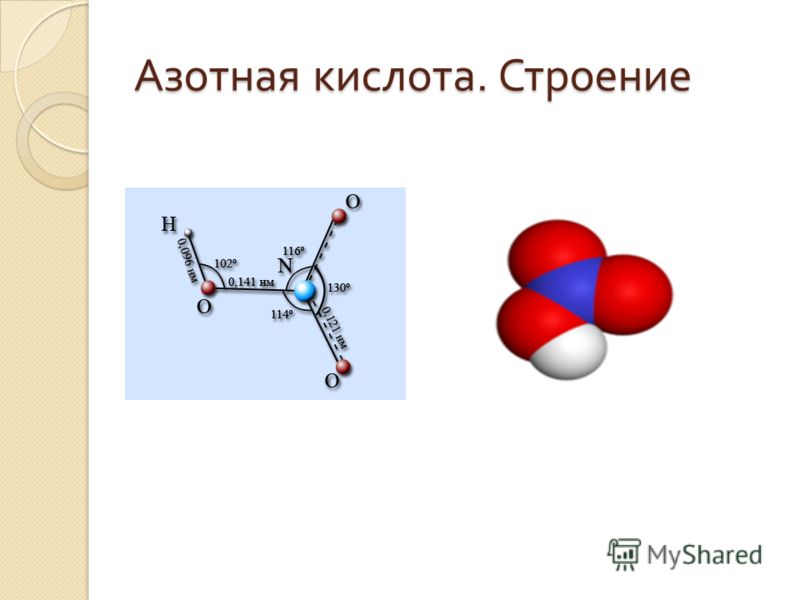 Смешивая различные другие компоненты, Альфред Нобель разработал динамит, значительно более безопасное и легкое в обращении взрывчатое вещество на основе нитроглицерина. Единственным твердым нитратным эфиром, использовавшимся ранее в качестве взрывчатого вещества, является нитропента. Из-за высокой температуры плавления (около 140 °C) нитропента должна быть спрессована в желаемую форму.
Смешивая различные другие компоненты, Альфред Нобель разработал динамит, значительно более безопасное и легкое в обращении взрывчатое вещество на основе нитроглицерина. Единственным твердым нитратным эфиром, использовавшимся ранее в качестве взрывчатого вещества, является нитропента. Из-за высокой температуры плавления (около 140 °C) нитропента должна быть спрессована в желаемую форму.
Чавес и его коллеги создали еще один нитратный эфир, чтобы составить конкуренцию нитропенте. Благодаря низкой температуре плавления, составляющей всего около 85 °C, что значительно ниже точки разложения (141 °C), его можно плавить и заливать в формы, что намного упрощает процесс производства компонентов взрывчатых веществ.
Новое соединение содержит четыре группы нитратного эфира (–ONO2) и две нитратные группы (–NO2), связанные в общей сложности с шестью атомами углерода. Его кристаллы демонстрируют самую высокую плотность нитратного эфира. Компьютерные расчеты предсказывают, что новый тетранитратный эфир должен иметь такую же взрывную силу, как октоген (октоген) — в настоящее время одно из самых мощных взрывчатых веществ. Чувствительность нового соединения к ударам, трению и искрам эквивалентна чувствительности нитропента.
Чувствительность нового соединения к ударам, трению и искрам эквивалентна чувствительности нитропента.
«Благодаря своим удивительным свойствам новый нитратный эфир открывает уникальную возможность для производства литейных взрывчатых компонентов», — говорит Чавес. «Кроме того, его также можно использовать в качестве высокоэнергетического пластификатора для других взрывчатых веществ и в качестве компонента-окислителя».
Исследователи также планируют использовать свой новый синтетический метод для разработки других взрывчатых материалов.
Образец цитирования: Дэвид Э. Чавес, Синтез энергичного нитратного эфира, Международное издание Angewandte Chemie, 2008 г., 47, № 43, 8306–8308, doi: 10.1002/anie.200803648
Источник: Wiley
Цитата :
Новое взрывчатое вещество: расплавляемый нитратный эфир с большой энергией взрыва (2008 г., 10 октября)
получено 11 ноября 2022 г.
с https://phys.org/news/2008-10-explosive-melt-castable-nitrate-ester-high. html
html
Этот документ защищен авторским правом. Помимо любой добросовестной сделки с целью частного изучения или исследования, никакие
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в ознакомительных целях.
Реакция органических нитратных эфиров и S-нитрозотиолов с восстановленными флавинами: возможный механизм биоактивации
Сохранить цитату в файл
Формат:
Резюме (текст)PubMedPMIDAbstract (текст)CSV
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Невозможно загрузить вашу коллекцию из-за ошибки
Повторите попытку
Добавить в мою библиографию
- Моя библиография
Не удалось загрузить делегатов из-за ошибки
Повторите попытку
Ваш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Эл. адрес:
адрес:
(изменить)
Который день?
Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый рабочий день
Который день?
ВоскресеньеПонедельникВторникСредаЧетвергПятницаСуббота
Формат отчета:
SummarySummary (text)AbstractAbstract (text)PubMed
Отправить максимум:
1 шт. 5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
Полнотекстовые ссылки
HighWire
Полнотекстовые ссылки
. 1999 апр; 27 (4): 502-9.
1999 апр; 27 (4): 502-9.
П. С. Вонг
1
, Дж. М. Фукуто
принадлежность
- 1 Факультет фармакологии, Медицинский факультет Калифорнийского университета в Лос-Анджелесе, Центр медицинских наук, Лос-Анджелес, Калифорния
-1735, США.
PMID:
10232931
PS Вонг и др.
Препарат Метаб Распоряжение.
1999 апрель
. 1999 апр; 27 (4): 502-9.
Авторы
П. С. Вонг
1
, Дж. М. Фукуто
принадлежность
- 1 Факультет фармакологии, Медицинский факультет Калифорнийского университета в Лос-Анджелесе, Центр медицинских наук, Лос-Анджелес, Калифорния
-1735, США.

PMID:
10232931
Абстрактный
Органические нитратные эфиры, такие как тринитрат глицерина и динитрат изосорбида, представляют собой класс соединений, используемых для лечения различных сосудистых заболеваний. Их эффективность зависит от их способности биоактивироваться до оксида азота (NO), который, в свою очередь, расслабляет гладкие мышцы сосудов. Хотя было проведено много биологических исследований, которые показывают, что NO может образовываться из органических эфиров нитратов в биологической среде, химический механизм, с помощью которого это происходит, еще предстоит установить. Предыдущие исследования выявили участие как флавинов, так и тиолов в биоактивации органических нитратных эфиров. Таким образом, мы исследовали химическое взаимодействие флавинов и тиолов с органическими нитратными эфирами как средство определения роли, которую эти соединения могут играть в продукции NO. На основании этих исследований мы пришли к выводу, что разумный химический механизм биоактивации органического нитратного эфира включает восстановление до органического нитритного эфира с последующим превращением в нитрозотиол. Высвобождение NO из нитрозотиолов может происходить посредством различных процессов, включая реакцию с дигидрофлавинами и НАДН.
На основании этих исследований мы пришли к выводу, что разумный химический механизм биоактивации органического нитратного эфира включает восстановление до органического нитритного эфира с последующим превращением в нитрозотиол. Высвобождение NO из нитрозотиолов может происходить посредством различных процессов, включая реакцию с дигидрофлавинами и НАДН.
Похожие статьи
Влияние ингибитора флавопротеина, сульфата дифениленйодония, на толерантность к органическим нитратам ex vivo у крыс.
Ратц Д.Д., Макгуайр Д.Дж., Андерсон Д.Дж., Беннетт Б.М.
Ratz JD и соавт.
J Pharmacol Exp Ther. 2000 г., май; 293(2):569-77.
J Pharmacol Exp Ther. 2000.PMID: 10773030
Нитраты и выделение NO: современные аспекты биологической и медицинской химии.

Тэтчер Г.Р., Николеску А.С., Беннет Б.М., Тоадер В.
Тэтчер Г.Р. и др.
Свободный Радик Биол Мед. 2004 г., 15 октября; 37(8):1122-43. doi: 10.1016/j.freeradbiomed.2004.06.013.
Свободный Радик Биол Мед. 2004.PMID: 15451053
Обзор.
Реакция между S-нитрозотиолами и тиолами: образование нитроксила (HNO) и последующая химия.
Вонг П.С., Хён Дж., Фукуто Дж.М., Широта Ф.Н., ДеМастер Э.Г., Шуман Д.В., Нагасава Х.Т.
Вонг П.С. и др.
Биохимия. 1998 21 апреля; 37 (16): 5362-71. дои: 10.1021/bi973153g.
Биохимия. 1998.PMID: 9548918
Ксантиноксидаза катализирует анаэробное превращение органических нитратов в оксид азота и нитрозотиолы: характеристика этого механизма и связь между органическими нитратами и активацией гуанилилциклазы.

Ли Х, Цуй Х, Лю Х, Цвайер Дж.Л.
Ли Х и др.
Дж. Биол. Хим. 2005 г., 29 апреля; 280(17):16594-600. doi: 10.1074/jbc.M411905200. Epub 2005, 28 января.
Дж. Биол. Хим. 2005.PMID: 15695823
Взаимодействие органических нитратов с тиоловыми группами.
Абрамс Дж.
Абрамс Дж.
Am J Med. 1991 г., 30 сентября; 91 (3C): 106S-112S. doi: 10.1016/0002-9343(91)90292-6.
Am J Med. 1991.PMID: 1928200
Обзор.
Посмотреть все похожие статьи
Цитируется
Количественная оценка внутриклеточной доставки HNO с электрофорезом капиллярной зоны.
Amarakoon TN, Ke N, Aspinwall CA, Miranda KM.
Амаракун Т.Н. и соавт.
Оксид азота. 2022 1 января; 118: 49-58. doi: 10.1016/j.niox.2021.10.005. Epub 2021 27 октября.
doi: 10.1016/j.niox.2021.10.005. Epub 2021 27 октября.
Оксид азота. 2022.PMID: 34715361
Пролекарства нестероидных противовоспалительных препаратов (НПВП) больше, чем кажется на первый взгляд: критический обзор.
Кандиль АМ.
Кандиль АМ.
Int J Mol Sci. 2012 17 декабря; 13 (12): 17244-74. дои: 10.3390/ijms131217244.
Int J Mol Sci. 2012.PMID: 23247285
Бесплатная статья ЧВК.Обзор.
Митохондриальный транспорт глутатиона: физиологические, патологические и токсикологические последствия.
Ресница левая.
Ресница ЛХ.
Химическое биологическое взаимодействие. 2006 27 октября; 163 (1-2): 54-67. doi: 10.1016/j.cbi.2006.03.001. Epub 2006 4 апр.
Химическое биологическое взаимодействие. 2006.PMID: 16600197
Бесплатная статья ЧВК.

 соед-я, соли и эфиры уксусной кислоты
соед-я, соли и эфиры уксусной кислоты

 doi: 10.1016/j.niox.2021.10.005. Epub 2021 27 октября.
doi: 10.1016/j.niox.2021.10.005. Epub 2021 27 октября.