Содержание
Виниловый эфир, структурная формула, химические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Раздвинувший границы химии | Политехнический музей
Жан-Мари Лен
Родился 30 сентября 1939 года, Росайм, департамент Нижний Рейн, Франция
Нобелевская премия по химии 1987 года (1/3 премии, совместно с Чарльзом Педерсеном и Дональдом Крамом).
Формулировка нобелевского комитета: «за создание и использование молекул со структурно-специфическими взаимодействиями высокой селективности».
Герой нашей статьи почти так же близок автору, как и «евангелист органической химии» Вудворд. Но если Вудворд определил, какой именно химией я хотел заниматься, Жан-Мари Лен предопределил область внутри (а точнее, вовне) органики, которой я занимался, пока был внутри науки.
Наш нынешний лауреат родился во французском Эльзасе через 30 дней после начала Второй мировой войны, в пока еще свободной Франции. Отец его был булочником и городским органистом (бывает так). Судя по всему, семья Лена сравнительно спокойно пережила немецкую оккупацию и в 1950 году юный Жан-Мари пошел в среднюю школу. У нас с вами был шанс сейчас слушать концерты выдающегося музыканта Лена или читать книги музыковеда Лена – главной страстью его была музыка. И гимназию ему подобрали классическую – языки (английский, немецкий, греческий, латынь), литература, философия. Но естественным наукам повезло – Лен познакомился с химией, и увлекся ею больше музыки. Впрочем, бакалавром философии он стал в свои 18. Но через несколько месяцев получил бакалаврскую степень и по химии и поступил в Страсбургский университет. Юноша так увлекся органикой, что начал ставить эксперименты дома (не пытайтесь это повторить, домашняя неорганика — еще куда ни шло!). На третьем году обучения Лен начинает работу над диссертацией, изучая тритерпены (терпены — вещества природного происхождения, в основе которых лежит молекула метилбутадиена; к ним относится, например, камфора, а также ароматические вещества многих эфирных масел).
Судя по всему, семья Лена сравнительно спокойно пережила немецкую оккупацию и в 1950 году юный Жан-Мари пошел в среднюю школу. У нас с вами был шанс сейчас слушать концерты выдающегося музыканта Лена или читать книги музыковеда Лена – главной страстью его была музыка. И гимназию ему подобрали классическую – языки (английский, немецкий, греческий, латынь), литература, философия. Но естественным наукам повезло – Лен познакомился с химией, и увлекся ею больше музыки. Впрочем, бакалавром философии он стал в свои 18. Но через несколько месяцев получил бакалаврскую степень и по химии и поступил в Страсбургский университет. Юноша так увлекся органикой, что начал ставить эксперименты дома (не пытайтесь это повторить, домашняя неорганика — еще куда ни шло!). На третьем году обучения Лен начинает работу над диссертацией, изучая тритерпены (терпены — вещества природного происхождения, в основе которых лежит молекула метилбутадиена; к ним относится, например, камфора, а также ароматические вещества многих эфирных масел).
Получив степень PhD в 1963 году, Лен на год отправляется работать к герою одной из наших предыдущих публикаций, Роберту Бернсу Вудворду и участвует в одном из величайших органических синтезов за всю историю человечества – синтезе витамина B12. Как мы помним, в структуре витамина есть комплекс корринового ядра и катиона кобальта типа «гость-хозяин». Возможно, это тоже определило дальнейшую научную карьеру Лена. Он заинтересовался процессом ионного транспорта через клеточную мембрану и задумался о том, как синтезировать искусственные «контейнеры» для переноса ионов.
Кстати, рассказывая о своей области, Лен очень часто упоминает одного из первопроходцев, советского химика Михаила Шемякина, имя которого теперь носит Институт Биоорганической химии РАН (наряду с именем академика Овчинникова). Именно исследования структуры антибиотика валиномицина, проведенные Шемякиным в 1960-х годах, показали, как он связывается с ионом калия, образуя природный комплекс типа «гость-хозяин».
Еще одно открытие, которое было сделано в тех же 60-х годах, это случайный, но ключевой синтез краун-эфиров Чарльзом Педерсеном (за это Педерсен вместе с Леном был удостоен нобелевской премии). Что такое краун-эфир? Сrown – это корона. Краун-эфиры представляют собой большие циклы (самые распространенные крауны – 18-членные, с шестью атомами кислорода, соединенными этиленовыми мостиками). Ввиду того, что такие циклы имеют уже не плоскую структуру, они напоминают собой корону, которая как бы надевается на ион калия или натрия. При этом полость цикла «подходит» иону по размеру, а связь осуществляется за счет перетягивающих на себя избыточную электронную плотность атомов кислорода. В итоге получается атом калия или натрия, «упакованный» в органическую оболочку, что заметно повышает растворимость этих ионов в органических растворителях. К примеру, очень мощный окислитель – перманганат калия KMnO4 почти нерастворим в органике, что делает сложным его использование в органических реакциях. А в присутствии краун-эфиров он прекрасно растворяется в бензоле, и «пурпурный бензол» стал почти стандартным реагентом.
Что такое краун-эфир? Сrown – это корона. Краун-эфиры представляют собой большие циклы (самые распространенные крауны – 18-членные, с шестью атомами кислорода, соединенными этиленовыми мостиками). Ввиду того, что такие циклы имеют уже не плоскую структуру, они напоминают собой корону, которая как бы надевается на ион калия или натрия. При этом полость цикла «подходит» иону по размеру, а связь осуществляется за счет перетягивающих на себя избыточную электронную плотность атомов кислорода. В итоге получается атом калия или натрия, «упакованный» в органическую оболочку, что заметно повышает растворимость этих ионов в органических растворителях. К примеру, очень мощный окислитель – перманганат калия KMnO4 почти нерастворим в органике, что делает сложным его использование в органических реакциях. А в присутствии краун-эфиров он прекрасно растворяется в бензоле, и «пурпурный бензол» стал почти стандартным реагентом.
Что же сумел сделать наш герой? Заслуга Жан-Мари Лена в том, что он во-первых, заметно расширил ассортимент краун-эфиров (это же сделал и третий нобелиат, Дональд Крам), во-вторых, создал новый класс соединений – криптанды (это уже сложные органические молекулы с полостью, образованной двумя циклами – вместо короны мы теперь имеем «чашу», в которую можно «прятать» другие ионы или даже молекулы, Дональд Крам создал еще более жесткий вариант — карцеранды, которые представляют собой «одиночную камеру» на одну молекулу), а в-третьих, фактически создал новую науку – супрамолекулярную химию.
Именно Лен стал автором термина «супрамолекулярная химия», введенного им еще до получения Нобелевской премии. В 1978 году он писал: «супрамолекулярная химия – это химия за пределами молекулы, описывающая сложные образования, которые являются результатом ассоциации двух (или более) химических частиц, связанных вместе межмолекулярными силами». Впрочем, сам он в своей монографии [1] называет супрамолекулярную химию «социологией в химии».
Вот как пишет сам Лен о своей науке [2].
«Вначале был Большой взрыв и воцарилась физика. Затем, вместе с более умеренными температурами, на смену ей пришла химия; из элементарных частиц образовались атомы; атомы соединялись во все более сложные молекулы, которые, в свою очередь образовали еще более сложные ассоциаты и мембраны, определившие примитивные клетки, из которых возникла жизнь.
[…]
Молекулярная химия утвердилась в своей власти над ковалентной связью. Настало время овладеть в равной мере нековалентными межмолекулярными силами. За пределами молекулярной химии, основанной на манипулировании молекулярными связями, простирается область супрамолекулярной химии, которая призвана подчинить себе межмолекулярные связи».
За пределами молекулярной химии, основанной на манипулировании молекулярными связями, простирается область супрамолекулярной химии, которая призвана подчинить себе межмолекулярные связи».
Интересующиеся могут послушать рассказ о супрамолекулярной химии самого Лена.
Результатом стала поделенная «на троих» Нобелевская премия 1987 года – через много лет после пионерских работ Лена, Крама и Педерсена. На нобелевском банкете выступать с благодарственным словом от имени всех троих лауреатов премии по химии было доверено именно Лену, который не преминул съязвить: «несмотря на то, что эта приятная задача была поручена самому молодому из лауреатов, я бы не забывал, что в моем возрасте Моцарт уже 13 лет как умер (Педерсену на тот момент было 83 года, Краму – 68, Лену – 48)» [3].
Отметим в скобках, что с нашей страной Лена связывают достаточно тесные связи – не только память о трудах Шемякина. Я сам лично видел его дважды – в 2007 году на Менделеевском конгрессе (которые, к сожалению, после не продолжились) и в 2013 году на конгрессе FEBS в Санкт-Петербурге. Он стал первым лауреатом Нобелевской премии, которого я фотографировал. А сейчас Жан-Мари входит в число членов Консультативного научного совета фонда Сколково, одним из трех лауреатов Нобелевской премии в нем (два других – это Жорес Алферов и Роджер Корнберг).
Он стал первым лауреатом Нобелевской премии, которого я фотографировал. А сейчас Жан-Мари входит в число членов Консультативного научного совета фонда Сколково, одним из трех лауреатов Нобелевской премии в нем (два других – это Жорес Алферов и Роджер Корнберг).
В своем интервью Нобелевскому комитету [4] на вопрос, как премия изменила его жизнь, Лен дал очень интересный ответ. По его словам, премия дала больше возможностей (и обязала!) говорить о науке и о химии в частности – ведь слово нобелиата слышно громче. И Лен активно пользуется этим правом – говорить о науке. «Мне важно сказать, что наука – это тоже важная часть человеческой культуры, подобно искусству» — говорит Лен. Мне кажется, в этом (и не только в этом) создатель супрамолекулярной химии оказался достойным продолжателем дела своего учителя Роберта Вудворда, более всего ценившего в химии красоту.
Наград у Лена не счесть – Нобелевская премия, австрийский почетный знак «За науку и искусство», командорство Ордена почетного легиона, медаль Дэви Королевского общества… Но интересно, что Лен по-прежнему активно работает в науке и является очень плодовитым автором – суммарно его группа опубликовала более 900 (!) статей в реферируемых научных журналах. Как говорил сам Лен в том же интервью Нобелевскому комитету, часто премия – это повод сменить область научной деятельности. От себя добавим, что иногда премия – это повод уйти на покой, как это было, скажем, с Хиггсом. Но, судя по всему, оба повода – это не про человека, которого зовут Жан-Мари Лен.
Как говорил сам Лен в том же интервью Нобелевскому комитету, часто премия – это повод сменить область научной деятельности. От себя добавим, что иногда премия – это повод уйти на покой, как это было, скажем, с Хиггсом. Но, судя по всему, оба повода – это не про человека, которого зовут Жан-Мари Лен.
1. Лен Ж.-М., Супрамолекулярная химия. Концепции и перспективы. Новосибирск, «Наука», 1998
2. Там же.
3. http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1987/lehn-speech.html
4. http://www.nobelprize.org/mediaplayer/index.php?id=410
DGR Industrial Products, Inc. :: Generic Chemicals :: Эфир, 500 мл
Подробное описание продукта:
Это специальный эфир высокой чистоты (диэтиловый эфир), не содержащий
обычных ингибиторов и стабилизаторов ( например, этанол или BHT).
Диэтиловый эфир, также известный как эфир и этоксиэтан, представляет собой прозрачную бесцветную
легковоспламеняющуюся жидкость с низкой температурой кипения и характерным
запахом.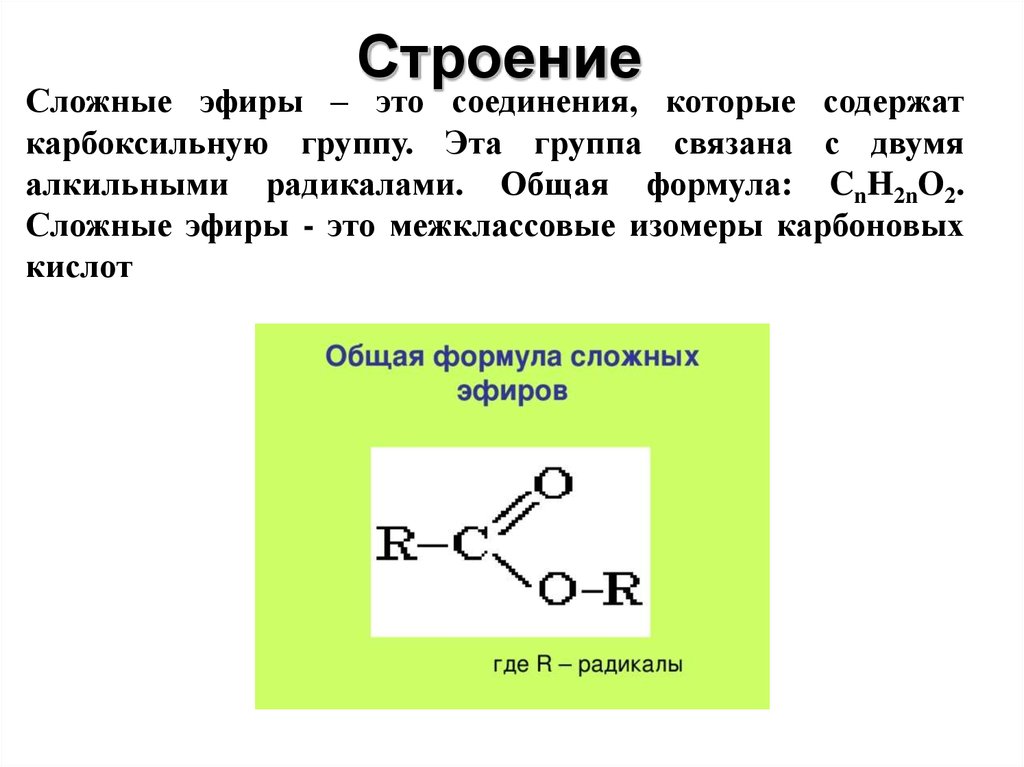 Это наиболее распространенный представитель класса химических соединений 9.0005
Это наиболее распространенный представитель класса химических соединений 9.0005
, обычно известные как эфиры. Это изомер бутанола. Он используется в качестве общего растворителя
и используется в качестве общего анестетика. Эфир
мало растворим в воде (6,9 г/100 мл).
Класс/чистота:
Это реактивный материал, безводный, не содержащий ингибиторов,
минимальная чистота 99,9%.
Области применения:
Обычно используется в качестве растворителя алкалоидов, жиров, восков и нитроцеллюлозы.
Диэтиловый эфир является обычным растворителем для реакции Гриньяра и для многих
других реакций с участием металлоорганических реагентов. Особенно важен
в качестве растворителя при производстве целлюлозных пластиков, таких как ацетат целлюлозы.
Диэтиловый эфир имеет высокое цетановое число от 85 до 96 и часто используется
в качестве пусковой жидкости для дизельных и бензиновых двигателей из-за его высокой летучести
и низкой температуры самовоспламенения.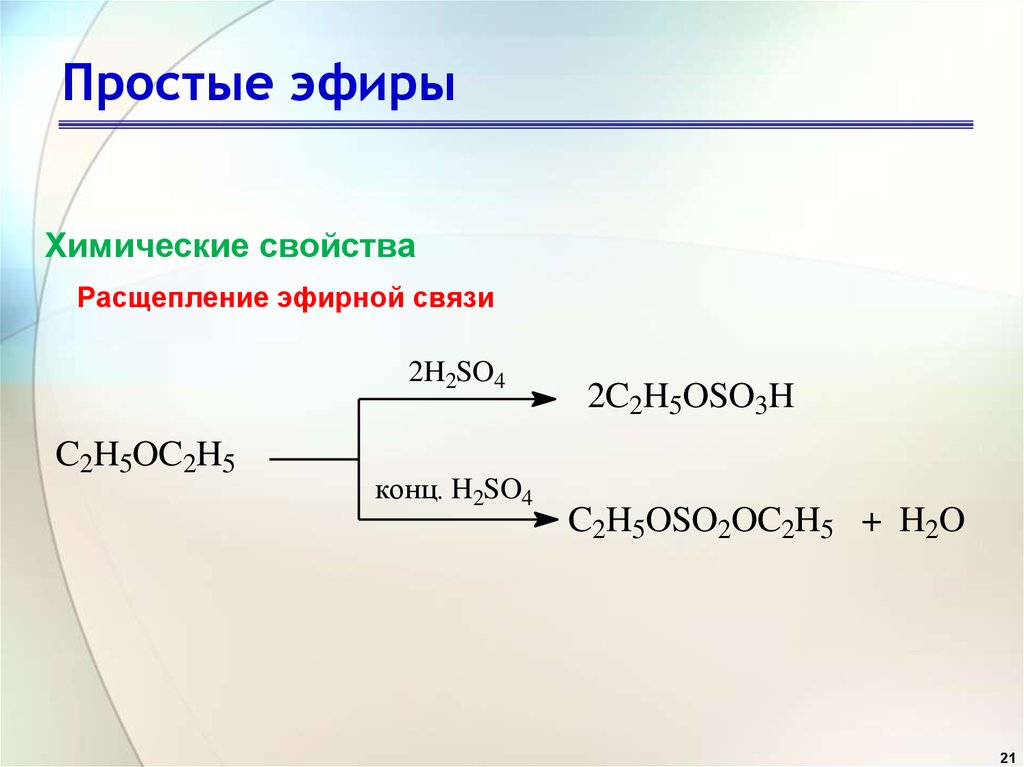 По той же причине он также используется как
По той же причине он также используется как
Компонент топливной смеси для карбюраторных двигателей с воспламенением от сжатия.
Справочная информация:
Эфир представляет собой класс органических соединений, которые содержат эфирную группу
атом кислорода, связанный с двумя (замещенными) алкильными или арильными группами. Типичным примером
является растворитель и анестетик диэтиловый эфир, обычно называемый
просто «эфир» (этоксиэтан).
Молекулы эфира не могут образовывать водородные связи между собой, что приводит к
относительно низкая температура кипения по сравнению с аналогичными спиртами. Однако
различия в температурах кипения простых эфиров и их изометрических спиртов
становятся меньше по мере того, как углеродные цепи становятся длиннее, поскольку гидрофобная природа
углеродной цепи становится более преобладающей над наличием водородной связи.
Простые эфиры слабополярны, более полярны, чем алкены, но не так полярны, как спирты, сложные эфиры
или амиды аналогичной структуры.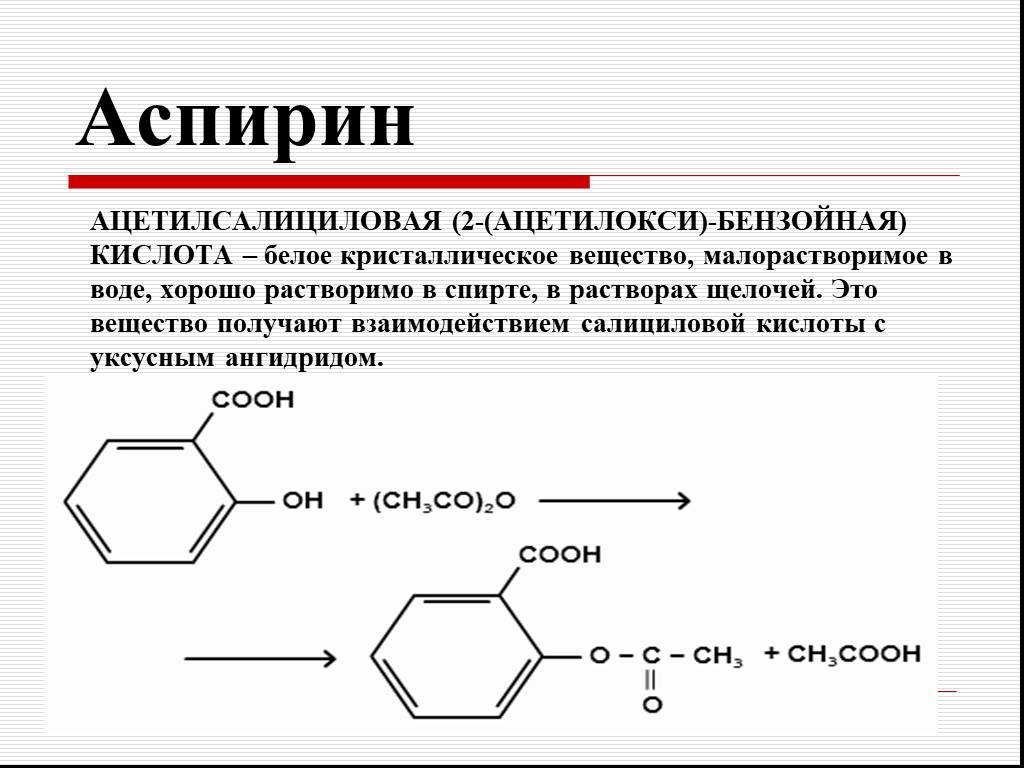 Однако наличие двух неподеленных пар
Однако наличие двух неподеленных пар
электронов на атомах кислорода делает возможной водородную связь с молекулами воды
, в результате чего растворимость спиртов (например, бутанол-1) и простых эфиров
(этоксиэтан) оказывается совершенно разной.
Циклические эфиры, такие как тетрагидрофуран и 1,4-диоксан, полностью смешиваются с водой.
Эфиры могут действовать как основания Льюиса. Например, диэтиловый эфир образует комплекс с бором
соединения, такие как диэтилэфират трифторида бора. Эфиры также координируются с
магния в реактивах Гриньяра.
В номенклатурной системе ИЮПАК простые эфиры обозначаются по общей формуле
«алкоксиалкан», например Ch4-Ch3-O-Ch4 — метоксиэтан. Если эфир
является частью более сложной молекулы, он описывается как алкоксизаместитель, поэтому -OCh4
будет считаться «метокси-» группой. Более простой алкильный радикал написан впереди,
, поэтому Ch4-O-Ch3Ch4 будет дан как метокси(Ch4O)этан(Ch3Ch4).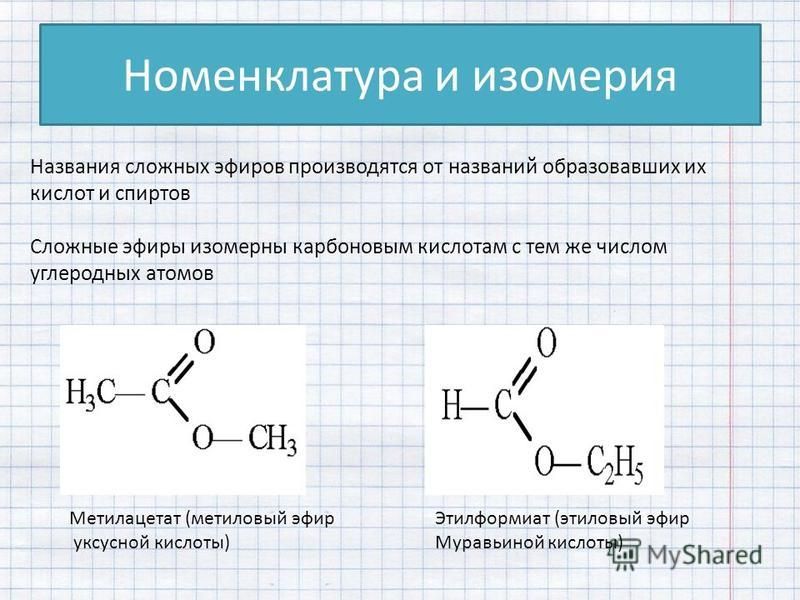
Исторически эфир называли также сладким купоросным маслом.
Меры предосторожности:
Легко воспламеняющаяся жидкость и пары. Депрессант центральной нервной системы.
Эфиры в целом имеют очень низкую химическую активность, но в правильных условиях
склонны к образованию нестабильных перекисей.
Диэтиловый эфир склонен к образованию пероксидов и может образовывать взрывоопасный диэтил
пероксид эфира. Пероксиды эфира имеют более высокую температуру кипения и в сухом виде являются контактными взрывчатыми веществами
.
Диэтиловый эфир обычно поставляется со следовыми количествами антиоксиданта BHT
(2,6-ди-трет-бутил-4-метилфенол), который уменьшает образование пероксидов.
Хранение над NaOH приводит к осаждению промежуточных эфирных гидропероксидов. Вода
и пероксиды могут быть удалены либо перегонкой из натрия и бензофенона,
, либо пропусканием через колонку с активированным оксидом алюминия.
Эфир — легковоспламеняющийся материал. При использовании эфира следует избегать открытого огня и даже устройств с электрическим нагревом
, поскольку он легко воспламеняется от пламени или искры
. Температура самовоспламенения эфира составляет всего 170°С (338°F), поэтому он может воспламениться от горячей поверхности без пламени или искры. Общепринятой практикой в химических лабораториях
является использование пара (таким образом ограничивая температуру до 100°C (212F), когда эфир необходимо нагревать или перегонять.
Щелкните здесь, чтобы загрузить паспорт безопасности материала (MSDS)
Упаковка:
Поставляется в бутылке из темного стекла объемом 500 мл. Также доступен в объеме 250 мл.
Эфир (химия) — Citizendium
| Основной артикул | Обсуждение | Статьи по теме [?] | Библиография [?] | Внешние ссылки [?] | Версия для цитирования [?] |
| |||||||||||||
Эта редактируемая основная статья находится в разработке и подлежит отказу от ответственности . [изменить введение] | |||||||||||||||||||
Два простых алкиловых эфира.
Тетрагидрофуран, циклический эфир.
Эфир представляет собой химическое соединение, в котором два углеводорода соединены вместе промежуточным атомом кислорода. Эфиры, особенно диэтиловый эфир, часто называемый просто эфиром, и тетрагидрофуран (ТГФ) являются обычными растворителями для реакций органической химии. Диэтиловый эфир был одним из первых анестетиков. Многие эфиры чрезвычайно легко воспламеняются, и поэтому использование диэтилового эфира в операционной в присутствии высокого уровня кислорода больше не используется.
Синтез простых эфиров
Синтез простых эфиров по Вильямсону использует нуклеофильную природу алкоксид-ионов для взаимодействия с первичными алкилгалогенидами по механизму реакции S N 2 . Таким образом, реакция изопропоксида натрия реагирует с н-бутилиодидом с образованием асимметрического эфира н-бутилизопропилового эфира. Первичные алкилгалогениды используются для минимизации механизма реакции E 2 . В методе, аналогичном гидратации алкенов, простые эфиры могут быть образованы реакцией алкенов со спиртом и кислотным катализатором или со спиртом и ацетатом ртути. Синтез Вильямсона, но не методы на основе алкенов, также можно использовать для получения циклических простых эфиров, таких как тетрагидрофуран. Для получения циклических эфиров используется первичный алкан, который содержит атом галогенида на одном конце и спирт на другом, чтобы вступить во внутримолекулярную реакцию. Добавление сильного основания гидроксида натрия (NaOH) создает ион алкоксида из спирта. Алкоксидный конец реагирует с галогенированным углеродом в S N 2 механизм циклизации соединения с удалением атома галогена. Так, 4-хлор-1-бутанол в присутствии гидроксида натрия дает тетрагидрофуран. Оксираны, также называемые эпоксидами, представляют собой класс циклических простых эфиров, содержащих только два атома углерода и один атом кислорода в кольцевой структуре.
Первичные алкилгалогениды используются для минимизации механизма реакции E 2 . В методе, аналогичном гидратации алкенов, простые эфиры могут быть образованы реакцией алкенов со спиртом и кислотным катализатором или со спиртом и ацетатом ртути. Синтез Вильямсона, но не методы на основе алкенов, также можно использовать для получения циклических простых эфиров, таких как тетрагидрофуран. Для получения циклических эфиров используется первичный алкан, который содержит атом галогенида на одном конце и спирт на другом, чтобы вступить во внутримолекулярную реакцию. Добавление сильного основания гидроксида натрия (NaOH) создает ион алкоксида из спирта. Алкоксидный конец реагирует с галогенированным углеродом в S N 2 механизм циклизации соединения с удалением атома галогена. Так, 4-хлор-1-бутанол в присутствии гидроксида натрия дает тетрагидрофуран. Оксираны, также называемые эпоксидами, представляют собой класс циклических простых эфиров, содержащих только два атома углерода и один атом кислорода в кольцевой структуре. В дополнение к синтезу эфира Вильямсона (в этом случае исходный материал, который имеет соседние гидроксильные и галогенидные группы, называется галогенгидрином), оксираны могут быть образованы реакцией алкена с пероксикислотой, карбоновая кислота с заменой группы ОН на OOH-группа. Наиболее распространенной из них является метахлорпербензойная кислота (мХПБК).
В дополнение к синтезу эфира Вильямсона (в этом случае исходный материал, который имеет соседние гидроксильные и галогенидные группы, называется галогенгидрином), оксираны могут быть образованы реакцией алкена с пероксикислотой, карбоновая кислота с заменой группы ОН на OOH-группа. Наиболее распространенной из них является метахлорпербензойная кислота (мХПБК).
реакции расщепления простых эфиров
Один энантиомер транс -2,3-диметилоксиран.
Эфиры легко расщепляются при добавлении тепла и сильной кислоты, такой как йодистый водород (HI). HI часто используется, потому что он достаточно кислый, чтобы протонировать атом кислорода эфира, а йодид-ион достаточно нуклеофилен, чтобы атаковать алкильную группу протонированного эфира. Таким образом, анизол (метилфениловый эфир) можно расщепить с образованием фенола и метилиодида в присутствии HI и тепла. Поскольку оксираны менее стабильны, чем другие циклические эфиры, из-за деформации кольца, бромистый водород (HBr) можно использовать без дополнительного нагрева для расщепления оксиранов, таких как транс-2,3-диметилоксиран.