Содержание
Насыщенный и ненасыщенный пар — определение, свойства, формулы
Фазовые переходы: изменение агрегатных состояний вещества
Прежде чем говорить о насыщенном паре, нужно освежить знания об агрегатных состояниях и фазовых переходах между ними. Если вы забыли, какие бывают агрегатные состояния, то можете сбегать в нашу статью про них.
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Вот какие бывают фазовые переходы:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.

На схеме — названия всех фазовых переходов:
Фазовые переходы — важная штука. Все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы в металлургии и микроэлектронике.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Парообразование
Итак, парообразование — это переход из жидкого состояния в газообразное.
При парообразовании всегда происходит поглощение энергии: к веществу необходимо подводить теплоту, чтобы оно испарялось. Из-за этого внутренняя энергия вещества увеличивается.
У процесса парообразования есть две разновидности: испарение и кипение.
Испарение — это превращение или переход жидкости в газ (пар) со свободной поверхности жидкости.
 Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.
Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.Кипение — процесс интенсивного парообразования, который происходит в жидкости при определенной температуре.
Например, мы заварили себе горячий чай. Над чашкой мы увидим пар, так как вода только что поучаствовала в процессе кипения.
Подождите-ка, мы ведь только что сказали, что кипение и испарение — разные вещи. 🤔 Это действительно так, но при этом оба процесса могут происходить параллельно.
Испарение может происходить и без кипения, просто тогда оно не будет для нас заметно. Например, вода в озере испаряется, хотя мы этого и не замечаем. Кипение по сути своей — это интенсивное испарение, которое вызвали внешними условиями — доведя вещество до температуры кипения.
Физика объясняет испарение тем, что жидкость обычно несколько холоднее окружающего воздуха, и из-за разницы температур происходит испарение.
Если нет каких-то внешних воздействий, испарение жидкостей происходит крайне медленно. Молекулы покидают жидкость из-за явления диффузии.
Направление тепловых потоков при испарении может идти в разной последовательности и комбинациях:
|
Подытожим, чтобы не запутаться, в чем главная разница между испарением и кипением:
Испарение | Кипение |
|---|---|
Температура кипения
При температуре кипения давление насыщенного пара становится равным внешнему давлению на жидкость — чаще всего это атмосферное давление. Значит, чем больше внешнее давление, тем при более высокой температуре начнется кипение.
Значит, чем больше внешнее давление, тем при более высокой температуре начнется кипение.
При нормальном атмосферном давлении, которое приблизительно равно 100 кПа, температура кипения воды равна 100°C. Поэтому можно сразу сказать, что давление насыщенного водяного пара при температуре 100 градусов по Цельсию равно 100 кПа. Это значение пригодится при решении задач.
Чем выше мы поднимаемся, тем меньше становится атмосферное давление, потому что масса атмосферы над нами уменьшается. Так, например, на вершине Эльбруса атмосферное давление составляет 5 × 104 Па — в два раза меньше, чем нормальное атмосферное давление. Поэтому и температура кипения на вершине Эльбруса будет ниже, чем на уровне моря. Вода там закипит при температуре 82°C.
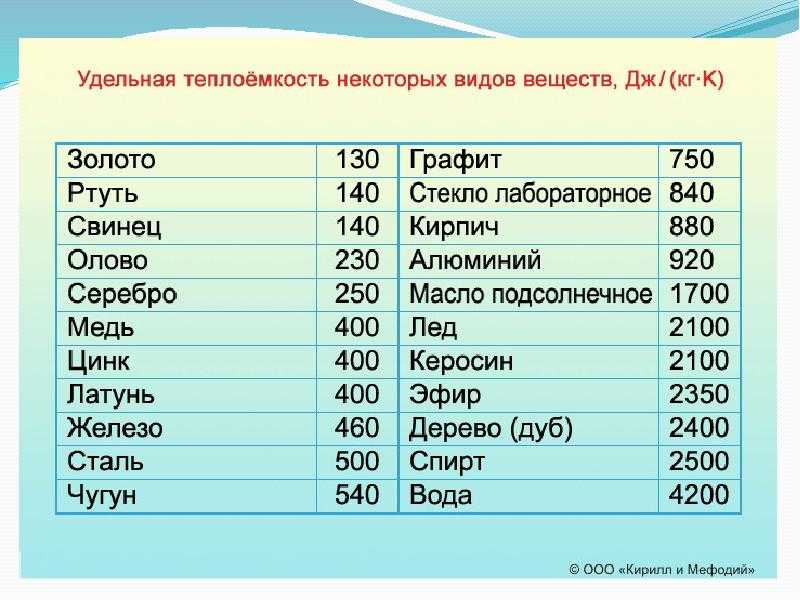
Температура кипения при нормальном атмосферном давлении — это строго определенная величина для каждой жидкости.
t, °C | Вещество |
|---|---|
-253 -183 35 78 100 357 3050 4200 5657 | водород кислород эфир спирт вода ртуть железо графит вольфрам |
Испарение и конденсация
Молекулы в жидкости непрерывно и хаотично движутся. Это значит, что направление движения отдельно взятых молекул — это случайные направления. При этом жидкость сохраняет свой объем. Также молекулы силами притяжения притягиваются друг к другу, из-за чего не могут покинуть Омск жидкость.
Это значит, что направление движения отдельно взятых молекул — это случайные направления. При этом жидкость сохраняет свой объем. Также молекулы силами притяжения притягиваются друг к другу, из-за чего не могут покинуть Омск жидкость.
Значения скоростей молекул случайны. Из-за этого среди всех молекул обязательно есть те, что движутся очень быстро. Если такая молекула окажется вблизи поверхности раздела жидкости и окружающей среды, то ее кинетическая энергия может достигнуть большого значения, и молекула покинет жидкость.
Собственно, именно так происходит процесс испарения (мы говорили о нем выше, когда речь шла о фазовых переходах). Когда испарившихся молекул становится много, образуется пар.
Обратный процесс тоже возможен: вырвавшиеся за пределы жидкости молекулы вернутся в жидкость. Это конденсация, о ней мы тоже говорили.
Если открыть сосуд с жидкостью, то испарившиеся молекулы будут покидать пространство над жидкостью и не возвращаться обратно. Количество жидкости таким образом будет уменьшаться. То есть жидкость испаряется, а пар обратно не конденсируется (потому что молекулы этого пара удаляются от жидкости) — так происходит высыхание.
Количество жидкости таким образом будет уменьшаться. То есть жидкость испаряется, а пар обратно не конденсируется (потому что молекулы этого пара удаляются от жидкости) — так происходит высыхание.
Испарение может происходить с разной скоростью. Чем больше силы притяжения молекул друг к другу, тем меньшее число молекул в единицу времени окажется в состоянии преодолеть эти силы притяжения и вылететь наружу, и тем меньше скорость испарения.
Быстро испаряются такие жидкости, как эфир, ацетон, спирт. Из-за этого свойства их иногда называют летучими жидкостями. Медленнее — вода. Намного медленнее воды испаряются масло и ртуть.
Курсы подготовки к ОГЭ по физике помогут снять стресс перед экзаменом и получить высокий балл.
Определение насыщенного пара
Оставим стакан воды на столе и будем замерять уровень воды в нем каждый день. Если записать эти измерения и сравнить их, станет очевидно: уровень воды стал меньше, то есть вода испарилась.
Теперь давайте накроем стакан сверху. Молекулы пара уже не смогут покидать пространство над жидкостью, по мере испарения их количество начнет расти, а значит, будет расти и количество молекул, которые конденсируются в единицу времени.
Сначала количество конденсирующихся молекул за единицу времени будет меньше количества испаряющихся молекул. Но по мере роста концентрации пара (то есть увеличении количества молекул в единице объема пара) поток конденсирующихся молекул вырастет. Это приведет к состоянию, которое называется динамическим равновесием.
Пар, находящейся в динамическом равновесии, называют насыщенным.
Представьте себе огромный бизнес-центр с не менее огромными дверями. У сотрудников бизнес-центра разный график работы, поэтому люди одновременно заходят в здание и выходят из него в произвольном количестве. Допустим, в 6 часов вечера 100 человек заходят в здание, чтобы попасть на деловую встречу, а другие 100 человек уже закончили работать и идут домой. Количество заходящих в бизнес-центр и выходящих из него будет одинаковым — это и есть состояние насыщения.
Количество заходящих в бизнес-центр и выходящих из него будет одинаковым — это и есть состояние насыщения.
Значение давления насыщенного пара и его плотности являются максимальными при заданном значении температуры. Если это не так, то пар ненасыщенный. |
Свойства насыщенного пара
При постоянной температуре плотность насыщенного пара не зависит от его объема.
Представьте, что объем сосуда с насыщенным паром уменьшили, не изменив температуры.
Количество молекул, переходящих от пара к жидкости, превысит количество испаряющихся молекул, но при этом часть пара сконденсируется, а оставшийся пар снова придет в динамическое равновесие. В итоге плотность этого пара будет равна начальной плотности.
Давление насыщенного пара не зависит от его объема.

Это связано с тем, что давление и плотность связаны через уравнение Менделеева-Клапейрона, и следует из первого свойства насыщенного пара.
Кстати, уравнение Менделеева-Клапейрона справедливо для насыщенного пара. При этом нужно быть внимательным с частными случаями. Так, например, закон Бойля-Мариотта для насыщенного пара не выполняется.
Уравнение Менделеева-Клапейрона
pV = νRT
p — давление газа [Па]
V — объем [м3]
ν — количество вещества [моль]
T — температура [К]
R — универсальная газовая постоянная
R = 8,31 м2 × кг × с-2 × К-1 × моль-1
При неизменном объеме плотность насыщенного пара растет с повышением температуры и уменьшается с понижением температуры.

В начальный момент испарения динамическое равновесие будет нарушено (некоторая часть жидкости испарится дополнительно). Плотность пара будет расти, пока динамическое равновесие не восстановится.
Давление и температура насыщенного пара растут быстрее, чем по линейному закону, который справедлив для идеального газа.
В случае идеального газа рост давления обусловлен только ростом температуры, а в случае с насыщенном паром имеют значение два фактора: температура и масса пара.
В случае нагревания насыщенного пара молекулы начинают ударяться чаще, так как их в целом стало больше, потому что пара стало больше.
Главное отличие насыщенного пара от идеального газа: пар сам по себе не является замкнутой системой, а находится в постоянном контакте с жидкостью.
Решение задач по теме «Насыщенный пар»
Применим свойства насыщенного пара при решении задач.
Задачка раз
В цилиндрическом сосуде под поршнем длительное время находятся вода и ее пар. Поршень начинают вдвигать в сосуд. При этом температура воды и пара остается неизменной. Как будет меняться при этом масса жидкости в сосуде? Ответ поясните.
Решение
Так как пар и вода находятся в контакте длительное время, пар является насыщенным. При уменьшении объема сосуда давление насыщенного пара не меняется. Из уравнения Менделеева-Клапейрона следует, что для того, чтобы давление пара не менялось, его количество вещества (а значит и масса) должно уменьшаться.
pV = νRT
В этом процессе происходит конденсация, часть молекул пара переходят в жидкость, поэтому масса жидкости увеличивается.
Ответ
Масса жидкости увеличивается.

Задачка два
Какова плотность насыщенного пара при температуре 100°С?
Решение
При нормальном давлении (p = 105 Па) 100°С — это температура кипения воды. Значит, давление насыщенного пара при этой температуре равно атмосферному давлению.
Найдем связь между давлением и плотностью через уравнение Менделеева-Клапейрона.
Подставим значение давления в уравнение состояния идеального газа, предварительно переведя температуру в Кельвины:
T = 100 + 273 = 373 K
Таблица плотности веществ
К содержанию
Плотность — физическая величина, которая равна отношению массы тела к его объему:
(при норм. атм. давл., t = 20ºC)
| Твердое тело | ρ, кг / м 3 | ρ, г / cм 3 | Твердое тело | ρ, кг / м 3 | ρ, г / cм 3 |
|---|---|---|---|---|---|
| Осмий | 22 600 | 22,6 | Мрамор | 2700 | 2,7 |
| Иридий | 22 400 | 22,4 | Стекло оконное | 2 500 | 2,5 |
| Платина | 21 500 | 21,5 | Фарфор | 2 300 | 2,3 |
| Золото | 19 300 | 19,3 | Бетон | 2 300 | 2,3 |
| Свинец | 11 300 | 11,3 | Кирпич | 1 800 | 1,8 |
| Серебро | 10 500 | 10,5 | Сахар-рафинад | 1 600 | 1,6 |
| Медь | 8 900 | 8,9 | Оргстекло | 1 200 | 1,2 |
| Латунь | 8 500 | 8,5 | Капрон | 1 100 | 1,1 |
| Сталь, железо | 7 800 | 7,8 | Полиэтилен | 920 | 0,92 |
| Олово | 7 300 | 7,3 | Парафин | 900 | 0,90 |
| Цинк | 7 100 | 7,1 | Лёд | 900 | 0,90 |
| Чугун | 7 000 | 7,0 | Дуб (сухой) | 700 | 0,70 |
| Корунд | 4 000 | 4,0 | Сосна (сухая) | 400 | 0,40 |
| Алюминий | 2 700 | 2,7 | Пробка | 240 | 0,24 |
(при норм.
 атм. давл., t = 20ºC)
атм. давл., t = 20ºC)| Жидкость | ρ, кг / м 3 | ρ, г / cм 3 | Жидкость | ρ, кг / м 3 | ρ, г / cм 3 |
|---|---|---|---|---|---|
| Ртуть | 13 600 | 13,60 | Керосин | 800 | 0,80 |
| Серная кислота | 1 800 | 1,80 | Спирт | 800 | 0,80 |
| Мёд | 1 350 | 1,35 | Нефть | 800 | 0,80 |
| Вода морская | 1 030 | 1,03 | Ацетон | 790 | 0,79 |
| Молоко цельное | 1 030 | 1,03 | Эфир | 710 | 0,71 |
| Вода чистая | 1000 | 1,00 | Бензин | 710 | 0,71 |
| Масло подсолнечное | 930 | 0,93 | Жидкое олово(при t = 400ºC) | 6 800 | 6,80 |
| Масло машинное | 900 | 0,90 | Жидкий воздух(при t = -194ºC) | 860 | 0,86 |
(при норм.
 атм. давл., t = 20ºC)
атм. давл., t = 20ºC)| Газ | ρ, кг / м 3 | ρ, г / cм 3 | Газ | ρ, кг / м 3 | ρ, г / cм 3 |
|---|---|---|---|---|---|
| Хлор | 3,210 | 0,00321 | Оксид углерода (II)(угарный газ) | 1,250 | 0,00125 |
| Оксид углерода (IV)(углекислый газ) | 1,980 | 0,00198 | Природный газ | 0,800 | 0,0008 |
| Кислород | 1,430 | 0,00143 | Водяной пар (приt = 100ºC) | 0,590 | 0,00059 |
| Воздух (при 0ºC) | 1,290 | 0,00129 | Гелий | 0,180 | 0,00018 |
| Азот | 1,250 | 0,00125 | Водород | 0,090 | 0,00009 |
Другие заметки по химии
Полезная информация?
Диметиловый эфир | Газовая энциклопедия Air Liquide
- Молекула
- Характеристики
- Приложения
- Безопасность и совместимость
- Учить больше
Нажмите и перетащите, чтобы переместить трехмерную молекулу
Объемы жидкости/газа
Расчет объема или массы количества газа или жидкости
Жидкая фаза
При температуре кипения при 1,013 бар
м³ (Объем)
кг (масса)
Газовая фаза
В стандартных условиях (1,013 бар, 15°C)
м³ (Объем)
кг (масса)
Физические свойства
Загрузить набор данных (XLS — 77,98 КБ)
- Общие свойства
- Твердая фаза
- Жидкая фаза
- Газовая фаза
Давление (бар)
| Скрытая теплота плавления (при температуре плавления) | 107,168 кДж/кг |
| Температура плавления | — 141,49 °С |
| Температура кипения | — 24,81 °С |
| Скрытая теплота парообразования (при температуре кипения) | 461,55 кДж/кг |
| Плотность жидкости (при температуре кипения) | 735,2 кг/м 3 |
| Коэффициент сжимаемости Z | 9. 7179E-1 7179E-1 |
| Отношение Cp/Cv γ | 1.1746 |
| Плотность газа (при температуре кипения) | 2,362 кг/м 3 |
| Плотность газа | 2,1145 кг/м 3 |
| Эквивалент газ/(жидкость при температуре кипения) | 345,58 об/об |
| Теплоемкость Cp | 1,4431 кДж/(кг.К) |
| Теплоемкость Cv | 1,2285 кДж/(кг.К) |
| Удельный объем | 4.729E-1 м 3 /кг |
| Теплопроводность | 15,616 мВт/(м.К) |
| Давление пара | 2,673 бар |
| Вязкость | 8.2865E-5 По |
| Коэффициент сжимаемости Z | 9.7735E-1 |
| Отношение Cp/Cv γ | 1,164 |
| Плотность газа | 1,993 кг/м 3 |
| Эквивалент газ/(жидкость при температуре кипения) | 366,65 об/об |
| Теплоемкость Cp | 1,4615 кДж/(кг. К) К) |
| Теплоемкость Cv | 1,2556 кДж/(кг.К) |
| Удельный объем | 5.018E-1 м 3 /кг |
| Теплопроводность | 16,999 мВт/(м.К) |
| Давление пара | 4,392 бар |
| Вязкость | 8.7748E-5 По |
| Коэффициент сжимаемости Z | 9.8021E-1 |
| Отношение Cp/Cv γ | 1,158 |
| Плотность газа | 1,9205 кг/м 3 |
| Эквивалент газ/(жидкость при температуре кипения) | 380,49том / том |
| Теплоемкость Cp | 1,4787 кДж/(кг.К) |
| Теплоемкость Cv | 1,2769 кДж/(кг.К) |
| Удельный объем | 5.207E-1 м 3 /кг |
| Теплопроводность | 17,958 мВт/(м.К) |
| Давление пара | 5,928 бар |
| Вязкость | 9. 0995E-5 По 0995E-5 По |
Применение
Примеры использования этой молекулы в промышленности и здравоохранении
Химические вещества
Диметиловый эфир используется в качестве растворителя в химической и нефтехимической промышленности.
Безопасность и совместимость
- Основные опасности
- Совместимость материалов
GHS02
Легковоспламеняющиеся
GHS04
Газ под давлением
Температура самовоспламенения, пределы воспламеняемости и температура вспышки
Европа (в соответствии с EN1839 для предельных значений и EN 14522 для температуры самовоспламенения)
| Температура самовоспламенения (Chemsafe) | 240 °С |
| Нижний предел воспламеняемости (IEC 80079-20-1) | 2,8 об. % % |
| Верхний предел воспламеняемости (IEC 80079-20-1) | 24,4 об.% |
США (согласно ASTM E681 для пределов и ASTM E659для температуры самовоспламенения)
| Температура самовоспламенения (NFPA 325) | 350 °С |
| Нижний предел воспламеняемости (NFPA 325) | 3,4 об.% |
| Верхний предел воспламеняемости (NFPA 325) | 27 об.% |
Порог токсичности
| РКН-8ч ЕС (на Патме и 293,15 К) | 1920 или |
Запах
Слегка эфирный
Металлы
| Алюминий | Удовлетворительно |
| Латунь | Удовлетворительно |
| Монель | Нет данных |
| Медь | Нет данных |
| Ферритная сталь | Удовлетворительно |
| Нержавеющая сталь | Удовлетворительно |
| Цинк | Нет данных |
| Титан | Нет данных |
Пластик
| Политетрафторэтилен | Удовлетворительно |
| Полихлортрифторэтилен | Удовлетворительно |
| Поливинилиденфторид | Удовлетворительно |
| Поливинилхлорид | Не рекомендуется |
| Этилентетрафторэтилен | Нет данных |
| Поликарбонат | Нет данных |
| Полиамид | Не рекомендуется |
| Полипропилен | Не рекомендуется |
Эластомеры
| Бутилкаучук (изобутен-изопрен) | Не рекомендуется |
| Нитриловый каучук | Не рекомендуется |
| Хлоропрен | Не рекомендуется |
| Хлорфторуглероды | Нет данных |
| Силикон | Удовлетворительно |
| Перфторэластомеры | Не рекомендуется |
| Фторэластомеры | Не рекомендуется |
| Неопрен | Нет данных |
| Полиуретан | Не рекомендуется |
| Этилен-пропилен | Не рекомендуется |
Смазочные материалы
| Смазка на углеводородной основе | Не рекомендуется |
| Смазка на основе фторуглерода | Не рекомендуется |
Совместимость материалов
Рекомендации: Компания Air Liquide собрала данные о совместимости газов с материалами, чтобы помочь вам определить, какие материалы использовать для газовой системы. Хотя информация была собрана из источников, которые Air Liquide считает надежными (Международные стандарты: Совместимость материалов баллонов и клапанов с содержанием газа; Часть 1 — Металлические материалы: ISO11114-1 (март 2012 г.), Часть 2 — Неметаллические материалы: ISO11114-2 (апрель 2013 г.), ее следует использовать с особой осторожностью и инженерной оценкой. Такие необработанные данные не могут охватывать все условия концентрации, температуры, влажности, примесей и аэрации. Поэтому рекомендуется использовать эту таблицу только для определения возможных материалов для применения при высоком давлении и температуре окружающей среды.Для подтверждения выбора материала для данного применения необходимо провести обширные исследования и испытания в конкретных условиях использования.Обратитесь в региональную группу Air Liquide для получения экспертных услуг.
Хотя информация была собрана из источников, которые Air Liquide считает надежными (Международные стандарты: Совместимость материалов баллонов и клапанов с содержанием газа; Часть 1 — Металлические материалы: ISO11114-1 (март 2012 г.), Часть 2 — Неметаллические материалы: ISO11114-2 (апрель 2013 г.), ее следует использовать с особой осторожностью и инженерной оценкой. Такие необработанные данные не могут охватывать все условия концентрации, температуры, влажности, примесей и аэрации. Поэтому рекомендуется использовать эту таблицу только для определения возможных материалов для применения при высоком давлении и температуре окружающей среды.Для подтверждения выбора материала для данного применения необходимо провести обширные исследования и испытания в конкретных условиях использования.Обратитесь в региональную группу Air Liquide для получения экспертных услуг.
Подробнее
Подробнее
Диметиловый эфир (ДМЭ), также известный как метоксиметан, представляет собой органическое соединение с формулой Ch4OCh4, упрощенно до C2H6O. Простейший эфир, это бесцветный газ, который является полезным предшественником других органических соединений и аэрозольным пропеллентом и изучается как вариант получения энергии в будущем. Это изомер этанола. В отличие от других алкиловых эфиров, диметиловый эфир устойчив к самоокислению. Диметиловый эфир также относительно нетоксичен, хотя легко воспламеняется.
Простейший эфир, это бесцветный газ, который является полезным предшественником других органических соединений и аэрозольным пропеллентом и изучается как вариант получения энергии в будущем. Это изомер этанола. В отличие от других алкиловых эфиров, диметиловый эфир устойчив к самоокислению. Диметиловый эфир также относительно нетоксичен, хотя легко воспламеняется.
Диметиловый эфир Информационный бюллетень по ДМЭ
Введение и основные данные по ДМЭ
Процесс производства ДМЭ
Современные технологии производства ДМЭ
Применение ДМЭ
Проекты по ДМЭ, финансируемые ЕС
EU
Введение
Диметиловый эфир (обычно сокращенно ДМЭ), также известный как метоксиметан, древесный эфир, диметилоксид или метиловый эфир, является простейшим эфиром. Это бесцветный, слегка наркотический, нетоксичный, легко воспламеняющийся газ в условиях окружающей среды, но с ним можно обращаться как с жидкостью при небольшом давлении. Свойства ДМЭ аналогичны свойствам сжиженного нефтяного газа (СНГ). ДМЭ разлагается в атмосфере и не является парниковым газом.
ДМЭ разлагается в атмосфере и не является парниковым газом.
Молекулярная формула
Сравнение свойств топлива
Источник: *FNR 2012. Средние значения используются для упрощения. Пожалуйста, обратитесь к стандартам для диапазонов. **Директива 2009/28/EC, всего по выращиванию, переработке, транспортировке и распространению .
Утилизация
Заменитель дизельного топлива; транспортное топливо; топливо для производства электроэнергии; бытовой газ
Соответствующие правила топлива
EN590 (diesel fuel)
Main feedstocks
Forest products, agricultural by-products, organic waste, energy crops, black liquor
Scale of Production
Demonstration scale
Production process
ДМЭ в основном производится путем преобразования природного газа, органических отходов или биомассы в синтез-газ (синтез-газ). Затем синтетический газ преобразуется в ДМЭ посредством двухстадийного синтеза: сначала в метанол в присутствии катализатора (обычно на основе меди), а затем путем последующей дегидратации метанола в присутствии другого катализатора (например, алюмосиликата). в ДМЭ.
Затем синтетический газ преобразуется в ДМЭ посредством двухстадийного синтеза: сначала в метанол в присутствии катализатора (обычно на основе меди), а затем путем последующей дегидратации метанола в присутствии другого катализатора (например, алюмосиликата). в ДМЭ.
The following reactions occur:
2H 2 + CO CH 3 OH
2CH 3 OH CH 3 OCH 3 + H 2 O
CO+H 2 O CO 2 +H 2
В качестве альтернативы, ДМЭ может быть получен путем прямого синтеза с использованием системы с двумя катализаторами, которая позволяет как синтез метанола, так и дегидратацию в одной и той же технологической установке без промежуточного отделения метанола. отказ от промежуточной стадии синтеза метанола, как утверждают лицензиары, обещает преимущества в эффективности и рентабельности.
Как одноэтапный, так и двухэтапный процессы имеются в продаже.
ДМЭ также может быть преобразован в олефины и синтетические углеводороды.
Современное состояние
Демонстрационная установка DME в Питео, Швеция, введенная в эксплуатацию в 2010 году, является единственной в мире установкой газификации, производящей высококачественный синтез-газ на основе 100% возобновляемого сырья. В качестве сырья используется черный щелок, высокоэнергетический остаточный продукт химического производства бумаги и целлюлозы, который обычно сжигают для извлечения отработанной серы.
Области применения
Благодаря хорошему воспламенению и высокому цетановому числу ДМЭ может использоваться в дизельных двигателях вместо обычного дизельного топлива. Однако по сравнению с дизельным топливом ДМЭ имеет меньшую вязкость (недостаточную) и плохую смазывающую способность. Как и СУГ для бензиновых двигателей, ДМЭ хранится в жидком состоянии при относительно низком давлении 0,5 МПа. Это помогает ограничить количество модификаций, необходимых для двигателя. Тем не менее, необходимы некоторые небольшие модификации двигателя, в первую очередь касающиеся топливного насоса высокого давления и установки нагнетательного бака, аналогичного тому, что используется для сжиженного нефтяного газа.


 Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.
Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.