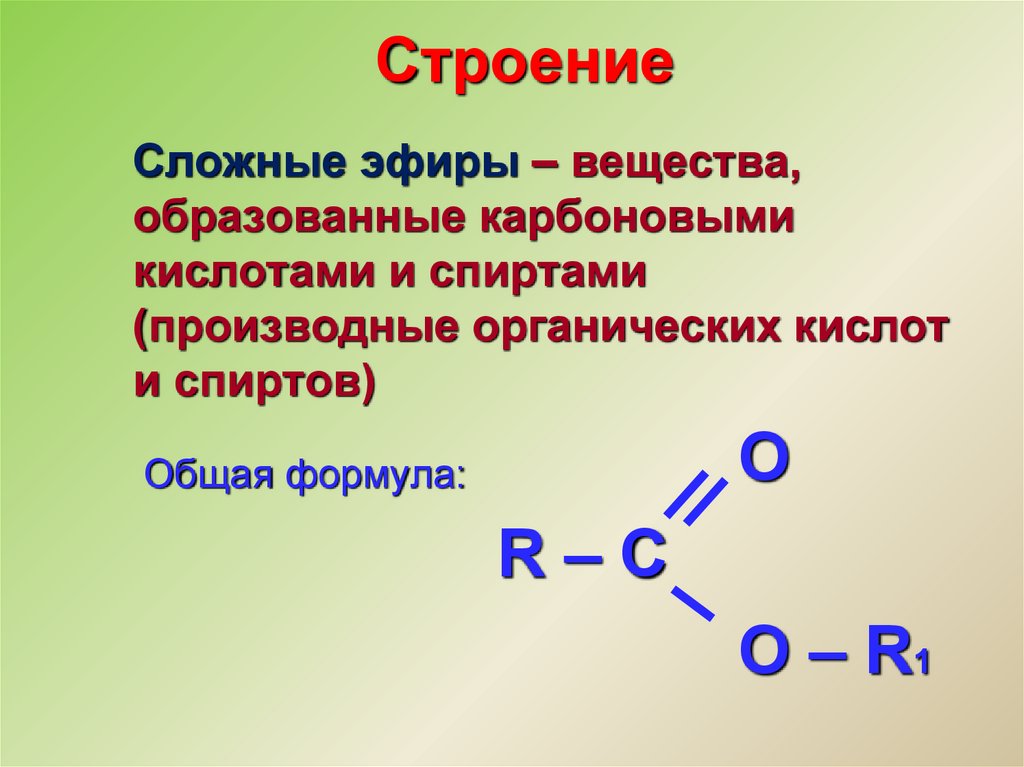
Содержание
Метилпропиловый эфир, структурная формула, химические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Получение простых эфиров реферат по химии | Сочинения Химия
Скачай Получение простых эфиров реферат по химии и еще Сочинения в формате PDF Химия только на Docsity! Введение Простыми эфирами (этерами) называют соединения общей формулы ROR’. По номенклатуре ИЮПАК эфиры рассматриваются как алкоксиалканы. При этом больший радикал считается основным. Для простых эфиров чаще, чем для других классов соединений, применяется радикально- функциональная номенклатура. В этом случае названия образуют из названий радикалов R и R’, связанных с атомом кислорода, добавляя слово «эфир»: или или этоксиэтан 2-метокси-2-метилпропан (диэтиловый эфир) (трет-бутилметиловый эфир, ТБМЭ) Хорошими протонными растворителями для проведения реакций являются целлозольв и метилцеллозольв. Хорошим растворителем для поведения реакций гидроборирования и для восстановления гидроборатом натрия является диглим. 2-метоксиэтанол 2-этоксиэтанол диэтиленгликольдиэтиловый эфир (метилцеллозольв) (целлозольв) (диглим) Широкое применение находят циклические эфиры: окись этилена тетрагидрофуран тетрагидропиран 1,4-диоксан Простые эфиры имеют ту же геометрию, что и Н2О (Гиллеспи).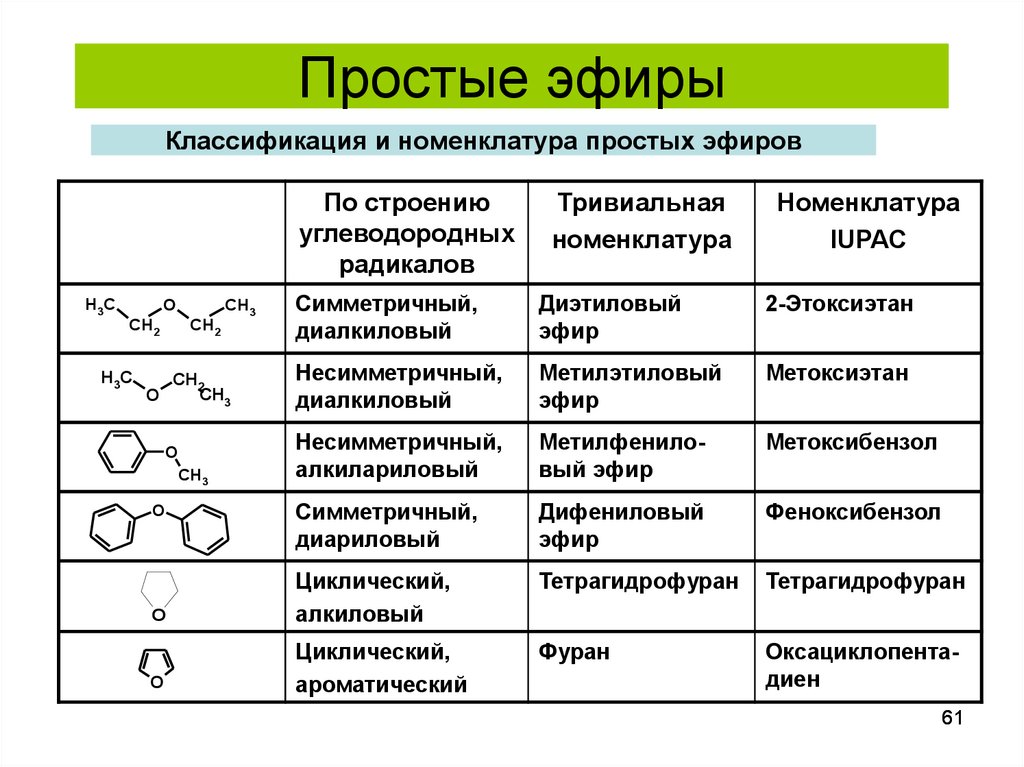 Валентный угол С-О-С соответстввует 112о для СН3ОСН3, что близко к тетраэдрическому углу и указывает на sp3-гибридизацию атома кислорода. Молекулы простых эфиров не могут образовывать водородные связи между собой, и поэтому они значительно более летучи, чем спирты с тем же числом атомов углерода. Плотность эфиров меньше, чем воды. Их растворимость в воде, с которой они могут образовывать водородные связи почти такая же как и у изомерных им спиртов, например, диэтиловый эфир и 1-бутанол растворяются в воде в количестве примерно 8 г на 100 мл воды. Эфиры химически довольно инертны и поэтому широко используются в качестве растворителей. Многие эфиры имеют приятный запах и испозьзуются в парфюмерии. Упр.1. Изобразите каркасные формулы и назовите по ИЮПАК и общепринятыми названиями следующие эфиры: (а) (б) (в) (г) (д) Ответ: (а) 2-метокси-2-метилпропани (трет-бутилметиловый эфир), (б) 2- метокси-2-метилпропани (трет-бутилэтиловый эфир), (в) транс-2- этоксициклогексанол, (г) метоксиэтен (винилметиловый эфир).
Валентный угол С-О-С соответстввует 112о для СН3ОСН3, что близко к тетраэдрическому углу и указывает на sp3-гибридизацию атома кислорода. Молекулы простых эфиров не могут образовывать водородные связи между собой, и поэтому они значительно более летучи, чем спирты с тем же числом атомов углерода. Плотность эфиров меньше, чем воды. Их растворимость в воде, с которой они могут образовывать водородные связи почти такая же как и у изомерных им спиртов, например, диэтиловый эфир и 1-бутанол растворяются в воде в количестве примерно 8 г на 100 мл воды. Эфиры химически довольно инертны и поэтому широко используются в качестве растворителей. Многие эфиры имеют приятный запах и испозьзуются в парфюмерии. Упр.1. Изобразите каркасные формулы и назовите по ИЮПАК и общепринятыми названиями следующие эфиры: (а) (б) (в) (г) (д) Ответ: (а) 2-метокси-2-метилпропани (трет-бутилметиловый эфир), (б) 2- метокси-2-метилпропани (трет-бутилэтиловый эфир), (в) транс-2- этоксициклогексанол, (г) метоксиэтен (винилметиловый эфир). Упр.3. Напишите реакции получения (а) диэтилового, (б) дибутилового и (в) F 06 2-дибромэтилового эфиров и (г) тетрагидрофурана (ТГФ) и опишите их механизм. 1.2. Синтез эфиров по реакции Вильямсона Эта реакция рассматривалась ранее при изучении алкилгалогенидов. Алкоголяты металлов легко вступают в реакции нуклеофильного замещения, предоставляя алкоксид-анионы RO F 0 2 D. В случае необходимости получения асимметричных эфиров нужно тщательно рассматривать возможность использования галогенуглеводородов и алкоголятов спиртов. (5) 2-метоксипропан (6) бензил-трет-бутиловый эфир При синтезе алкилариловых эфиров необходимо на фенолят действовать алкилгалогенидом, поскольку арилгалогениды не реагируют с алкоголятами. Упр.4. Напищите реакции получения следующих эфиров: (а) (б) Упр.5. Из каких соединений по Вильямсону можно получить (а) метилизопропиловый эфир, (б) трет-бутилэтиловый эфир (в) пропилфениловый эфир? Объясните выбор реагентов. 1.3. Присоединение спиртов к алкенам В присутствии кислоты спирты присоединяются к алкенами с образованием эфиров.
Упр.3. Напишите реакции получения (а) диэтилового, (б) дибутилового и (в) F 06 2-дибромэтилового эфиров и (г) тетрагидрофурана (ТГФ) и опишите их механизм. 1.2. Синтез эфиров по реакции Вильямсона Эта реакция рассматривалась ранее при изучении алкилгалогенидов. Алкоголяты металлов легко вступают в реакции нуклеофильного замещения, предоставляя алкоксид-анионы RO F 0 2 D. В случае необходимости получения асимметричных эфиров нужно тщательно рассматривать возможность использования галогенуглеводородов и алкоголятов спиртов. (5) 2-метоксипропан (6) бензил-трет-бутиловый эфир При синтезе алкилариловых эфиров необходимо на фенолят действовать алкилгалогенидом, поскольку арилгалогениды не реагируют с алкоголятами. Упр.4. Напищите реакции получения следующих эфиров: (а) (б) Упр.5. Из каких соединений по Вильямсону можно получить (а) метилизопропиловый эфир, (б) трет-бутилэтиловый эфир (в) пропилфениловый эфир? Объясните выбор реагентов. 1.3. Присоединение спиртов к алкенам В присутствии кислоты спирты присоединяются к алкенами с образованием эфиров. Механизм реакции напоминает механизм гидратации алкенов. (7) трет-бутилметиловый эфир Механизм: (М 2) Этот метод часто используется для защиты гидроксильной группы первичных спиртов при проведении реакций с другими функциональными группами этой же молекулы, т.к. трет-бутильная группа легко может быть снята при действии кислоты. Упр.6. Имея в своем распоряжении 3-бром-1-пропанол и ацетиленид натрия, предложите схему получения сначала 4-пентин-1-ола, а затем 4-гептин-1-ола, Ответ. Непосредственная реакция исходных продуктов между собой не может привести к желаемому результату, т.к. сильное основание этинид (ацетиленид) натрия прежде всего будет реагировать по гидроксильной группе: этинид натрия 3-бром-1-пропанол Поэтому гидроксильную группу в 3-бром-1-пропаноле сначала нужно защитить превратив ее в трет-бутоксильную, а затем действовать ацетиленидом натрия:
Механизм реакции напоминает механизм гидратации алкенов. (7) трет-бутилметиловый эфир Механизм: (М 2) Этот метод часто используется для защиты гидроксильной группы первичных спиртов при проведении реакций с другими функциональными группами этой же молекулы, т.к. трет-бутильная группа легко может быть снята при действии кислоты. Упр.6. Имея в своем распоряжении 3-бром-1-пропанол и ацетиленид натрия, предложите схему получения сначала 4-пентин-1-ола, а затем 4-гептин-1-ола, Ответ. Непосредственная реакция исходных продуктов между собой не может привести к желаемому результату, т.к. сильное основание этинид (ацетиленид) натрия прежде всего будет реагировать по гидроксильной группе: этинид натрия 3-бром-1-пропанол Поэтому гидроксильную группу в 3-бром-1-пропаноле сначала нужно защитить превратив ее в трет-бутоксильную, а затем действовать ацетиленидом натрия:
Эфирные химические реакции
Эфир представляет собой органическое химическое вещество с атомом кислорода, связанным с 2 арильными или алкильными группами, которые могут быть одинаковыми или разными.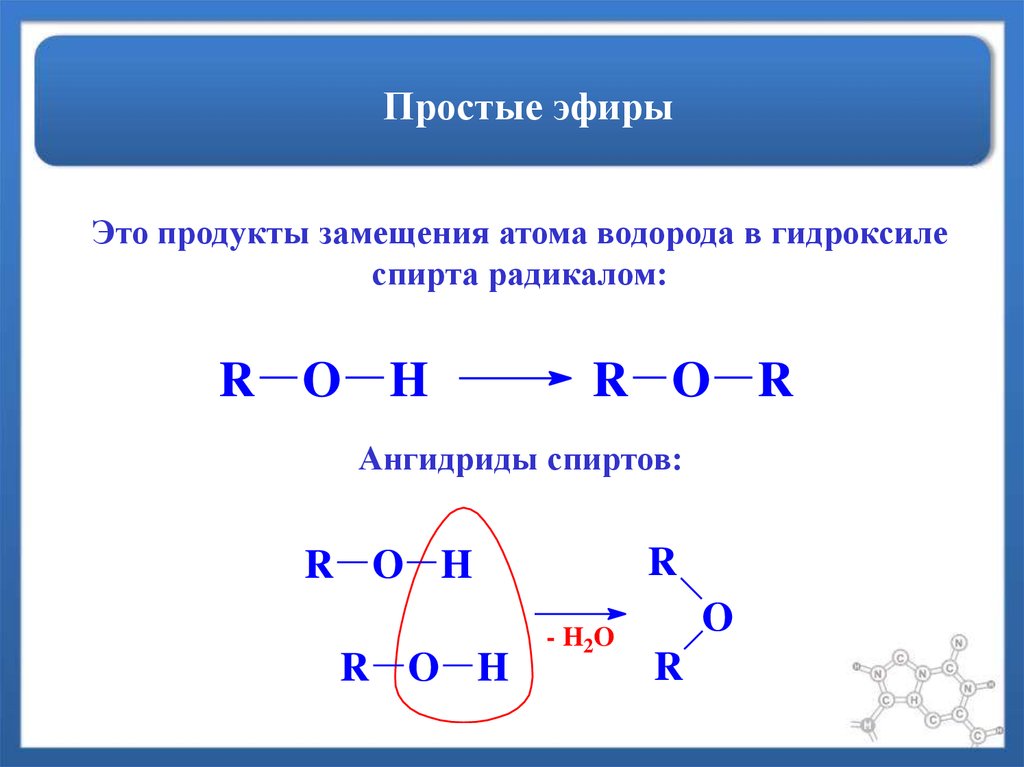 Стандартной формулой простых эфиров является R-O-R, R-O-Ar или Ar-O-Ar, в которой R представляет собой алкил, а Ar обозначает арильную группу.
Стандартной формулой простых эфиров является R-O-R, R-O-Ar или Ar-O-Ar, в которой R представляет собой алкил, а Ar обозначает арильную группу.
Эфиры обычно подразделяются на два типа в зависимости от присоединенной функциональной группы: симметричный эфир, который имеет две подобные группы, связанные с атомом кислорода, и асимметричный эфир, который имеет две различные группы, связанные с атомом кислорода. Эфиры обладают широким разнообразием физико-химических характеристик. Мы обсудим химические реакции эфира, их значение в химии и их молекулярные соединения.
Эфир
Эфир представляет собой органическое соединение, определяемое атомом кислорода, связанным с двумя арильными или алкильными группами. Эфиры имеют структуру, аналогичную спиртам, а и спирты, и эфиры имеют структуру, аналогичную воде. В спирте алкильная группа замещает один атом водорода молекулы воды, а в случае эфира все ионы водорода замещаются алкильными или арильными группами.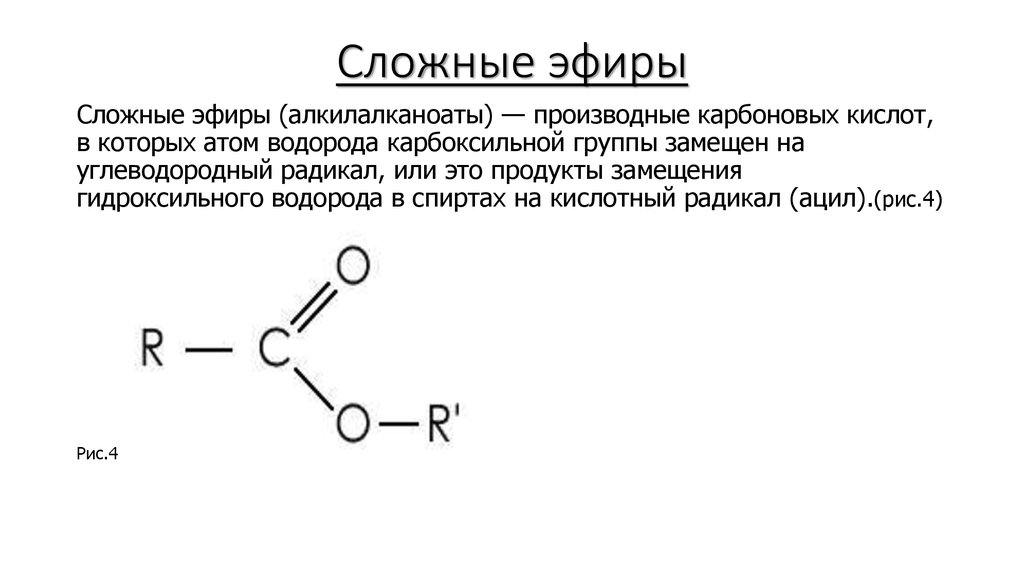
Эфиры представляют собой бесцветные жидкости с приятным запахом при комнатной температуре. Эфиры менее плотные, чем спирты, менее растворимы в воде и имеют более низкие температуры плавления и кипения. Поскольку они в основном нереакционноспособны, их можно использовать в качестве растворителей для масел, жиров, камедей, восков, смол, ароматизаторов, красителей и углеводородов. Определенные пары эфира используются как акарициды, почвенные инсектициды и фумиганты. Эфиры также полезны в фармации и медицине, особенно в качестве анестетиков. «Этиловый эфир» (Ch4Ch3OCh3Ch4), иногда называемый просто эфиром, первоначально использовался в качестве хирургического анестетика в 1842 году. «Метиловый эфир» или кодеин является сильным болеутоляющим средством. Поскольку эфир легко воспламеняется, его в основном заменяют менее воспламеняющимися анестетиками, такими как «закись азота» (N2O) или «галотан» (CF3CHClBr).
Этиловый эфир является отличным растворителем для экстракции и широкого спектра химических реакций.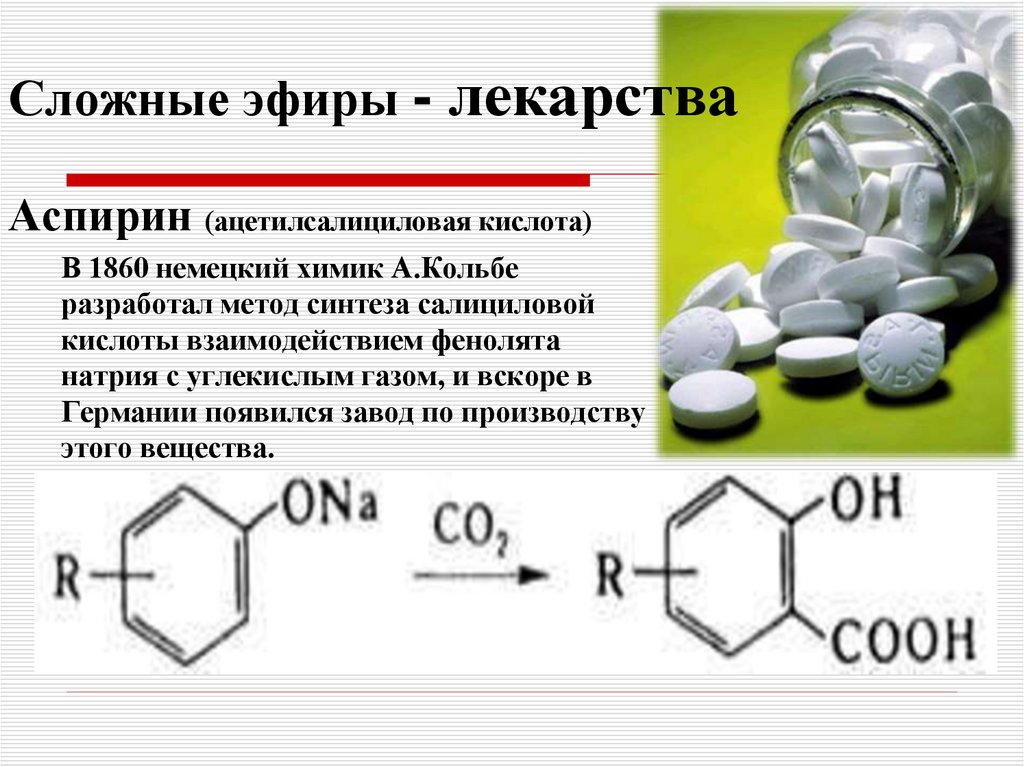 Он также используется в качестве летучей пусковой жидкости для дизельных и бензиновых двигателей в холодную погоду. Диметиловый эфир является хладагентом и распылителем. «Метил-трет-бутиловый эфир» — это компонент бензина, повышающий октановое число при одновременном снижении выбросов оксидов азота в выхлопных газах. Эфиры этиленгликоля используются в качестве растворителей и пластификаторов.
Он также используется в качестве летучей пусковой жидкости для дизельных и бензиновых двигателей в холодную погоду. Диметиловый эфир является хладагентом и распылителем. «Метил-трет-бутиловый эфир» — это компонент бензина, повышающий октановое число при одновременном снижении выбросов оксидов азота в выхлопных газах. Эфиры этиленгликоля используются в качестве растворителей и пластификаторов.
Физические свойства эфира
Простые эфиры не имеют гидроксильных групп, присутствующих в спиртах. Молекулы эфира не могут образовывать водородные связи друг с другом, если они не имеют резко поляризованной связи ОН. У простых эфиров есть барьеры, такие как отсутствие двух электронов у их кислорода, и они могут образовывать водородные связи с другими молекулами, имеющими связи NH или OH. Из-за своей склонности создавать атомы водорода с другими молекулами простые эфиры являются отличными растворителями для широкого спектра органических химических веществ и удивительного количества неорганических материалов.
Поскольку молекулы эфира не могут образовывать водородные связи друг с другом, их температуры кипения значительно ниже, чем у спиртов с аналогичной молекулярной массой. Диэтиловый эфир, например, имеет температуру кипения 35°C/95°F, тогда как 1-бутанол имеет температуру кипения 118°C/244°F. Температуры кипения простых эфиров значительно ближе к алканам с близкими молекулярными массами; пентан имеет температуру кипения 36 ° C / 97 ° F, что близко к температуре кипения диэтилового эфира.
Химические реакции с эфиром
Хотя другие в основном инертны к реакционной способности, они обладают хорошими растворяющими свойствами для широкого спектра неполярных химических молекул. Эфиры являются подходящими растворителями для протекания реакций из-за их высокой растворяющей способности и низкой реакционной способности.
Самая заметная реакция эфиров — катализируемое кислотой разрушение, которое происходит всякий раз, когда с ними вступает в реакцию гидравлическая кислота или HI. Эта реакция протекает по «механизму нуклеофильного замещения». «Первичные и вторичные алкиловые эфиры» расщепляются по механизму SN2, тогда как бензиловые, третичные и акриловые эфиры расщепляются по механизму SN1. Взаимодействие метилизопропилового эфира с HI является классической реакцией SN2.
Эта реакция протекает по «механизму нуклеофильного замещения». «Первичные и вторичные алкиловые эфиры» расщепляются по механизму SN2, тогда как бензиловые, третичные и акриловые эфиры расщепляются по механизму SN1. Взаимодействие метилизопропилового эфира с HI является классической реакцией SN2.
Кислотное расщепление эфира
По механизму SN2 или SN1 водные концентрации водорода или HI, но не HCl имеют тенденцию расщеплять эфиры на спирт и алкилгалогенидный продукт. Если эфир связан только с первичными, вторичными или метилалкильными соединениями, обычно происходит селективное расщепление с использованием механизма SN2. Сильная кислота сначала протонирует кислород эфира. Полученное в результате галогенидное конъюгированное основание затем попадает в протонированный эфир по менее замещенному затрудненному алкильному заместителю, что приводит к образованию галогенового продукта. Затрудненный алкильный заместитель простого эфира вытесняется в виде уходящей группы, образуя спиртовой продукт.
Следует отметить, что фенильная группа эфира не может участвовать в реакции кислотного распада SN2. Если присутствует фенильная группа, галогенидный нуклеофил будет предпочтительно атаковать другой алкильный заместитель, в результате чего в продукте образуется фенол.
Заключение
Эфиры являются полезными растворителями из-за их низкой реакционной способности. Большинство из них можно расщепить бромистоводородной кислотой или HBr, чтобы получить «алкилбромиды», или йодистоводородной кислотой, чтобы получить алкилйодиды. С другой стороны, автоокисление — это естественное окисление химического вещества в воздухе. Эфиры медленно самоокисляются в присутствии кислорода с образованием гидропероксидов и диалкилпероксила. Эти окислители могут взорваться при концентрировании или нагревании. Чтобы избежать таких взрывов, эфиры закупаются в небольших количествах, хранятся в хорошо запечатанных мешках и используются как можно скорее.
Статья об эфире+(химия) из The Free Dictionary
Эфир+(химия) | Статья об эфире+(химия) в The Free Dictionary
Эфир+(химия) | Статья об эфире+(химия) The Free Dictionary
Слово, не найденное в Словаре и Энциклопедии.