Большая Энциклопедия Нефти и Газа. Диэтиловый эфир температура кипения
Диэтиловый эфир теплота - Справочник химика 21
Давления паров диэтилового эфира при 20 и 30° С соответственно равны 58 945 и 86 285 Па. Рассчитать среднюю теплоту испарения эфира (Дж/г) в указанном интервале температур. Сравнить полученный результат с вычисленным по приближенной формуле Трутона . Температуру кипения эфира найти в табл. 8 приложения. [c.76]
Вычислите теплоту испарения диэтилового эфира по уравнениям Клапейрона [c.148]
Имеются основания предполагать, что адсорбция на активированном или графитизированном угле, а также на графите должна происходить главным образом на базисных плоскостях. Поэтому поверхность этих веществ должна, по-видимому, иметь-довольно однородный характер. Это подтверждается полученными значениями теплот адсорбции физически адсорбированных молекул. Так, теплоты адсорбции многих газов, включая аргон, азот, кислород и ряд углеводородов, имеют практически постоянные значения [39б-е]. В некоторых случаях теплота адсорбции слегка уменьшается с увеличением степени заполнения. Гольдман и Поляни [39е, 175], в частности, указывают,, что теплоты адсорбции хлористого этила на угле при увеличении 0 от 0,09 до 0,60 падают с 12,5 до 9,5 ккал/моль. Теплоты десорбции н-пентана [39г], сероуглерода 39д] и диэтилового эфира [39е] на том же угле обнаруживают подобную же зависимость от степени заполнения. Следовательно, можно сделать вывод, что в аналогичных случаях уменьшение теплоты адсорбции вызывается неоднородностью поверхности. [c.111]
Пример 1. Вычислите теплоту испарения диэтилового эфира, если при нормальной температуре кипения (307,9 К) (1р/(1Г = 3,53 10 Па/К. [c.65]
Сдвиг частоты данного донора протонов в зависимости от различных оснований (акцепторов протона) может быть связан с теплотой образования водородных связей [10, 108]. В качестве иллюстрации можно привести энтальпии (в ккал) некоторых систем фенол-акцептор бензол (1,6) этилацетат (4,5) диэтиловый эфир (5,4) метилэтилкетон (5,3) [218]. Также наблюдается корреляция ширин полос и интегральных интенсивностей с энтальпией, по крайней мере для некоторых соединений [18]. [c.172]
Расчет величин дифференциальных мольных изменений внутренней энергии А(У при разных величинах адсорбции показал, что для воды значения АЬ увеличиваются по мере заполнения поверхности и приближаются к значению теплоты конденсации. Это объясняется сильным взаимодействием молекул воды между собой. Для н-бутанола, диэтилового эфира и н-пентана значения AI7 в исследованном авторами [14] интервале поверхностных концентраций выше соответствуюш,их теилот конденсации. С увеличением, заполнения наблюдается вначале незначительный рост,, а затем уменьшение А I7, что свидетельствует о некоторой неоднородности поверхности и о сильном дисперсионном взаимодействии молекул рассмотренных веш,еств с поверхностью хромосорба 102. [c.102]
Суспендируют 1 моль глицина в этаноле, прибавляют 1 моль сероуглерода и затем пропускают газообразный аммиак. Реакция идет с выделением теплоты, поэтому стакан с содержимым охлаждают льдом. При насыщении аммиаком из слабо-желтого раствора выделяются почти бесцветные кристаллы, которые тотчас отфильтровывают с отсасыванием и промывают этанолом для удаления примесей (тритиокарбонат аммония и дитиокарбаминат аммония). Получают белую кристаллическую массу. Ее промывают безводным диэтиловым эфиром. Таким путем получают устойчивый продукт, который сохраняется в эксикаторе неограниченное время. Для дальнейшей очистки вещество перекристаллизовывают из горячей воды. Выделяются белые шестиугольные листочки. [c.129]
Нанесение на поверхность графитированной термической сажи, обладающей высокой концентрацией силовых центров (атомов углерода базисной грани графита), слоя фталоцианина (рис. П,35) резко уменьшает среднюю концентрацию силовых центров на поверхности. Это приводит к снижению энергии адсорбции. Так, теплота адсорбции диэтилового эфира на графитированной термической саже при малом заполнении поверхности составляет 37 кДж/моль, а на поверхности нанесенного фталоцианина — лишь 29 кДж/моль [29]. [c.79]
При расчетах потенциальных энергий Ф взаимодействия молекул с базисной гранью графита принимается также, что напряжение электростатического поля над поверхностью графита равно нулю или близко к нулю. С этим предположением согласуется наблюдаемая близость экспериментальных значений теплот адсорбции на графитированных термических сажах при низком (нулевом) заполнении поверхности для веществ с близкой энергией дисперсионного взаимодействия, но с различным электронным строением, например для аргона (не обладает постоянными электрическими моментами) и азота (обладает значительным квадрупольным моментом), для к-пентана (электрические моменты близки к нулю) и диэтилового эфира (обладает значительным периферическим дипольным моментом) [143-145]. [c.247]
Молекулы этилена и ацетилена, содержащие л-электроны, имеют значительные квадрупольные моменты [87, 88]. Предполагалось, что л-электроны решетки графита могут создавать вблизи поверхности базисной грани графита сравнительно сильное, но быстро убывающее с расстоянием электростатическое поле [89]. Поэтому можно было бы предположить, что найденное указанным выше путем более сильное взаимодействие с атомами С графита атомов С молекул углеводородов, образующих двойные и тройные связи, чем атомов С, образующих только ординарные связи, частично или полностью обусловлено тем, что в общую энергию взаимодействия ненасыщенных углеводородов с графитом заметный вклад вносит электростатическое взаимодействие квадрупольного момента молекулы ненасыщенных углеводородов с электростатическим полем базисной грани графита. Однако экспериментально установлено, что теплоты адсорбции на графитированных термических сажах даже молекул с большими периферическими дипольными моментами близки к теплотам адсорбции неполярных молекул с близкой средней поляризуемостью и геометрической структурой [90, 91]. Например, теплота адсорбции на графитированной термической саже диэтилового эфира не превышает теплоту адсорбции м-пентана (см. гл. V). Таким образом, в случае адсорбции на графитированных термических сажах энергия электростатического взаимодействия может вносить лишь незначительный вклад в общую энергию адсорбции и электростатическое взаимодействие молекул ненасыщенных углеводородов с графитом не может быть сильным. [c.338]
Этот метод был предложен в [1, 2] и развит в [6]. Исследование теплот адсорбции на неспецифическом адсорбенте (графитированной саже) позволило выделить пары молекул групп ВжА с близкими теплотами адсорбции (азот и аргон, этилен и этан, диэтиловый эфир и к-пентан). Теплоты конденсации этих вешеств также близки. На специфическом же адсорбенте II типа теплоты адсорбции молекул группы В (азота, этилена и диэтилового эфира) значительно превышают теплоты адсорбции соответствующих молекул сравнения группы А (аргона, этана, к-пентана) (литературу см. в [1, 2]). Было установлено также [14], что при дегидроксилировании поверхности кремнезема (т. е. при устранении его специфичности) величина [c.134]
Р и с. 1. Зависимость разностей теплот адсорбции Д( (при 0 = 0,1) диметилового эфира и пропана (1) и диэтилового эфира и и-пентана (2) от радиуса обменного щелочного катиона в цеолите X [c.136]
В зависимости от хим. состава обычно различают нитро-целлюлочные и смесевые П. Основа всех нитроцеллюлозных (бездымных) П.-цеялюяозы нитраты, пластифицированные разл. р-рителями. В зависимости от вида нитрата целлюлозы и летучести р-рителя различают хшроксилиновые П., баллиститы и кордиты. Пироксилиновые П. содержат пироксилин (12,2-13,5% Ы), следы летучего р-рителя-пластификатора (чаще всего смеси этанола с диэтиловым эфиром), небольшие кол-ва стабилизатора хим. стойкости П. (напр., дифениламин) и флегматизатора (напр., камфора), др. добавки. При изготовлении пироксилиновых П. после смешения компонентов и их пластификации полученную массу формуют в элементы с небольшой толщиной горя щего свода (1,5-2,0 см), из к-рых затем удаляют р-ритель Теплота сгорания пироксилиновых П. ок. 4000 кДж/кг, объ ем газообразных продуктов ок. 1000 л/кг, сила пороха ок 10 Н м/кг. Применяют их только в ствольных системах, Баллиститы и кордиты-бездымные П. для ствольных систем и твердые ракетные топлива. [c.72]
Исследованы изотермы и дифференциальные теплоты адсорбции и-пентана и диэтилового эфира на цеолитах X в натриевой, литиевой, калиевой, рубидиевой и цезиевой формах [67, 68]. При адсорбции эфира отмечено проявление дополнительного специфического взаимодействия атома кислорода в молекуле эфира с катионами цеолита. Это специфическое взаимодействие тем больше, чем меньше радиус катиона, т. е. чем более сосредоточен положительный заряд. Специфическое взаимодействие эфира уменьшается в ряду LiX NaX RbX. Авторы работы [67] наблюдали, что для всех катионных форм цеолита X теплоты адсорбции эфира во всей области заполнения больше теплот адсорбции н-пентана. Это указывает на специфическое взаимодействие диполя эфира с катионами цеолита при любых заполнениях. [c.160]
Установлено [79], что величины теплот адсорбции этилена намного больше соответствующих величин для этана. Вклад специфических взаимодействий в общую энергию адсорбции, мерой которой служит разность величин дифференциальных теплот адсорбции этана и этилена, для цеолита NaX больше, чем для гидроксилированной поверхности кремнезема. Аналогичная картина замечена при адсорбции бензола и к-гексана, диэтилового эфира и к-пентана [77, 78]. Таким образом, специфическое взаимодействие молекул с я-связями и молекул со свободными электронными парами у атомов кислорода с катионами сильнее, чем с протонизированными атомами водорода гидроксильных групп. [c.160]
При нормальной температуре кипения диэтилового эфира 34,60° С теплота испарения его равна 83,9 кал г. Определить давление насыщенного пара его при 0°С и при 25° С. [c.207]
Пример 4. Рассчитать тепловой эффект сгорания диэтилового эфира ( jH5)20 по энергиям разрыва связей при 298 К. Теплота испарения эфира [c.47]
Так, Задо и Фабесик [1] сопоставили адсорбционные свойства неполярного и полярного сорбентов порапаков Q и Т, определили теплоты адсорбции воды, нормальных алканов Сз—Сз, нормальных спиртов С —С4, ацетона, диэтилового эфира, циклогексана и бензола. Разница между теплотами адсорбции компонента на порапаках Р и Т принималась равной энергии специфического взаимодействия, разница в теплотах адсорбции соседних гомологов на каждом сорбенте — инкременту энергии СНа-груипы, разница в теплотах адсорбции нормального спирта и нормального алкана с одинаковым числом углеродных атомов — инкременту гидроксильной группы. Таким способом были рассчитаны инкременты энергий для групп СНа (отдельно в спиртах и алканах), СН3 (в алканах), ОН (в спиртах), Н (в гидроксиле спиртов и воды), О (в эфире и кетоне). [c.95]
Нижний и )едел длин волн УФ-излучсния толщина слоя в см всщсство Температуру кипения измеряли при атмосферном давлении 7G0 ммрт. ст. Д Относительная теплота испарения (для диэтилового эфира эта величина ПДК — п ]еделы10 допустимая концентрация (ч. н. млн). [c.148]
Молекула безводного хлорида алюмишчя в твердом, жидком или газообразном состоянии ниже 440 °С соответствует димерной формуле Alo U. В интервале 440—800 °С в равновесии находится смесь димерного и мономерного хлорида алюминия. В интервале 800—1000 С хлорид алюминия существует в виде мономера, который выше 1000 °С частично диссоциирует. В индифферентных растворителях типа сероуглерода существует димерная форма. В растворителях, взаимодействующих с хлоридом алюминия (вода, пиридин, нитробензол, диэтиловый эфир), образуются комплексные соединения. В разбавленных растворах эти комплексы образуют мономерные ассоциаты хлорида алюминия, а в концентрированных растворах — димерные. Теплота образования AU U составляет 1346,7 кДж/моль. Электропроводимость кристаллического хлорида алюминия увеличивается с повышением температуры до максимального значения в точке плавления. В расплаве она падает до нуля, а затем при повышении температуры расплава медленно повышается. [c.86]chem21.info
Диэтиловый эфир
Взрывы происходили и при откачивании перекисей под вакуумом, при отгонке растворителя из раствора перекиси ацетила в диэтиловом эфире, при перегонках гидроперекиси трег-бутила под уменьшенным давлением. В последнем случае взрыву предшествовало быстрое разложение со свечением. Описаны взрывы, происшедшие при откачивании под вакуумом нагретого до 115°С трег-бутилпербензоата, а также перекиси бензоила, приготовленной из смеси хлороформа и метанола, под действием вспышки света от сжигания вещества на газовой горелке, расположенной на расстоянии 1 м. [c.139]
Взрыва происходили и при откачивании пероксидов под вакуумом, при отгонке растворителя из раствора пероксида ацетилена в диэтиловом эфире, при перегонках гидропероксида трет-бутила под уменьшенным давлением. В последнем случае взрыву предшествовало быстрое разложение со свечением. Описаны взрывы, происшедшие при откачивании под вакуумом нагретого до 115°С трег-бутилпербензоата, а также пероксида бензила, полученного из смеси хлороформа и метанола, под действием вспышки света при обжигании вещества на газовой горелке, расположенной на расстоянии 1 м. [c.60]
Таково представление В. И. Блинова и Г. Н. Худякова о механизме формирования гомотермического нагретого слоя в горящей жидкости. Если бы такое представление в любых условиях соответствовало действительности, то проблему борьбы с опасным нагретым слоем можно было бы считать решенной. Однако это представление, по мнению самих авторов, не вполне соответствует известным фактам пожаров в крупных резервуарах и не способно объяснить следующее в верхнем нагретом слое все-таки существует закономерный вертикальный градиент температуры, чего нельзя ожидать при локальном и неравномерном перемешивании за счет кипения у стенки с увеличением диаметра резервуара предельная толщина слоя растет, чего нельзя ожидать при ослаблении кипения у стенки при горении бензина высота участка стенки, температура которого не ниже температуры кипения жидкости, меньше высоты нагретого слоя и, следовательно, эту высоту не определяют. С уверенностью можно утверждать только одно в мелкомасштабных лабораторных и полигонных опытах, на основе которых выработано изложенное здесь представление, для формирования гомотермического слоя кипение у стенки имело существенное и, может быть, решающее значение. Кипение у нагретой стенки действительно интенсифицировало процесс перемешивания жидкости и вынос ее свежей подогретой массы в зону горения, что естественно ускоряло формирование нагретого слоя. Сильный перегрев стенки по отношению к температуре кипения жидкости при наличии ветра (в опытах с керосином Т-1) или при отсутствии ветра (в опытах с диэтиловым эфиром) способен привести к образованию нагретого слоя там, где при обычных условиях горения он не образуется. Однако экспериментальные данные свидетельствуют о том, что в горящей жидкости происходят также иные процессы и только они могут вызвать формирование нагретого слоя и мощные выбросы при горении нефти в крупных резервуарах. [c.94]
Особое внимание должно быть обращено на легковоспламеняющиеся жидкости, имеющие температуру кипения ниже 50 °С (диэтиловый эфир, сероуглерод и др.). Такие вещества запрещается хранить в лабораторных помещениях. После окончания рабочего дня их выносят в специально отведенное для этих целей холодное помещение. [c.19]
Если во время проведения исследовательских или экспериментальных работ в химических лабораториях проливаются легковоспламеняющиеся жидкости (бензин, диэтиловый эфир и др.), необходимо немедленно выключить все источники открытого огня, электронагревательные приборы в дневное время следует обесточить комнату отключением общего рубильника, а если разлилось большое количество вещества, то нужно выключить все источники открытого огня, электронагревательные приборы и в смежных помещениях. Пролитые жидкости необходимо засыпать песком, а затем убрать и вынести за пределы лаборатории. О случившемся нужно немедленно сообщить руководителю лаборатории и в пожарную охрану. Спецодежду, загрязненную ЛВЖ и ГЖ, необходимо во избежание возможного воспламенения заменить. [c.20]
Процесс образования пероксидов резко ускоряется при попадании в емкость значительного количества воздуха во время слива части растворителя. Поэтому растворители, склонные к образованию пероксидов, не допускается хранить в больших емкостях. Так, для диэтилового эфира максимально безопасной и в условиях химической лаборатории наиболее удобной тарой являются стеклянные бутыли вместимостью 100 мл. [c.27]
Необходимо также помнить, что органические пероксиды в отличие от негорючих неорганических окислителей в большинстве своем горючи и при воздействии на другие вещества как окислители могут разлагаться со взрывом. Большая часть органических пероксидов чувствительна к удару и трению, легко загорается. Например, при продолжительном хранении у диэтилового эфира, диоксана проявляется ярко выраженная способность к самовоспламенению со взрывом под действием удара или трения. [c.39]
При проведении исследовательских работ особое внимание уделяется чистоте химической посуды. Способ мытья посуды выбирают в зависимости от используемых в работе химических реактивов. В тех случаях, когда химическая посуда не загрязнена смолой, жировыми и им подобными не растворяющимися в воде веществами, посуду моют холодной или горячей водой. Этот способ наиболее приемлемый и дешевый. Посуду, загрязненную жировыми веществами, моют органическими растворителями петролейным эфиром, диэтиловым эфиром, спиртами, ацетоном. Их применение связано с повышенной пожарной опасностью. [c.42]
Переносный газоанализатор ПГФ-2М1 в искробезопасном исполнении используется для определения содержания в воздухе метана, диэтилового эфира, водорода, этилена, пропана и других газов и паров. Его чувствительность 5.. . 60 % от нижнего предела взрываемости, а температурный диапазон применения от [c.69]
Диэтиловый эфир, резина...............8,7—9,9 [c.119]
Установлено, что температура, при которой возможно зажигание взрывчатых воздушных смесей, действительно значительно выше температуры самовоспламенения, что соответствует требованиям тепловой теории. Однако для некоторых горючих веществ наблюдаются аномально низкие температуры зажигания особенно низкие температуры (до 180—200 °С) зафиксированы для смесей сероуглерода и диэтилового эфира с воздухом. [c.149]
Физические и химические свойства. В 100 мл спирта раств. 52 мл (0°), в 100 мл диэтилового эфира 106,6 мл (0°) М. Горит бесцветным пламенем. При неполном сгорании или каталитическом окислении образует метанол, формальдегид, ацетилен. При разложении в электрической дуге реагирует с азотом, образуя H N. В смеси с воздухом взрывает (частая причина катастроф в шахтах). [c.13]
Токсическое действие. Животные. В опытах на белых крысах (однократная экспозиция 30 мин), собаках и обезьянах пары М. Э. действовали несколько сильнее, чем пары диэтилового эфира. В печени и почках животных гистологических изменений не обнаружено. [c.438]
Диэтиловый эфир-этиленгликоля [c.453]
Класс 3 - жидкости, у которых температура вспышки или равна номинальной температуре окружающей среды, или ниже ее (32 °С или 90 °Р). В принципе над такими жидкостями, по крайней мере непосредственно над их поверхностью, находится смесь пара и воздуха в концентрации выше НПВ. На некотором расстоянии от поверхности концентрация будет ниже НПВ. Однако в зависимости от химического состава пара возможны широкие вариации его концентрации даже для веществ, классифицируемых как легковоспламеняющиеся и при обычных температурах представляющих собой жидкости. Например, температура вспышки октана 13 °С, а диэтилового эфира - 49 °С. [c.141]
Класс 4 - жидкости, давление паров которых при температуре окружающей среды заключено между верхним пределом самовоспламенения (ВПВ) и атмосферным давлением. Таким образом, при температуре воздуха 20 °С октан, имеющий объемную концентрацию пара 1,3% (НПВ = 1%), следует считать веществом 3-го класса, а диэтиловый эфир с концентрацией пара 60% (ВПВ = 28%) - веществом класса 4. [c.141]
Как уже отмечалось, тепло реакции производства реактива Гриньяра снимается за счет испарения диэтилового эфира, пары которого поступают в обратный холодильник, а конденсат возвращается в реактор. Особенностью процесса является постоянство давления и температуры в реакторе при разных интенсивностях хода процесса это имеет место до момента, когда количество тепла, выделяющегося при реакции, не сравняется с тепло-отбором, соответствующим максимальной производительности обратного холодильника. Лишь после этого увеличение парообразования приводит к росту давления и температуры в реакторе [c.201]
Для проверки адекватности составленной модели процесса на пилотной установке были воспроизведены предаварийные режимы при сливе больших доз смеси. Экспериментальные и расчетные данные, полученные при 30%-ном возмущении сливом смеси бромистого этила с диэтиловым эфиром (к моменту подачи возмущения слито 25% смеси), хорошо совпали. [c.210]
Для опробования АСЗ последняя снабжена соответствующей кнопкой. Система управления процессом получения реактива Гриньяра показана на рис. 4-16. Системой управления осуществляется регулирование расхода (поз. 5а) и температуры (поз. 6а) охлаждающей реактор воды, контроль температуры рассола (поз. 1а), охлаждающего обратный холодильник, и контроль температуры реакционной массы (поз. 4а). Так как процесс ведется при температуре кипения диэтилового эфира, то эта температура изменяется очень незначительно. Остальные контролируемые параметры — давление в реакторе Р и расход конденсата из холодильника ( — используются в системе защиты. [c.216]
На рис. 76 представлены зависимости Тв от величины коэффициента избытка окислителя для воздушных смесей диэтилового эфира этиленгликоля, водорода и ацетилена, на рис. 77 — то же для смесей сероуглерода и диэтилового эфира (для различных поджигателей). Пунктиром отмечены концентрационные пределы взры-ваемости по данным [135] . Минимальные значения Т5 для смесей эфира этиленгликоля, водорода, а также бензина Б-70 равны 855— 640° С, т. е. сравнимы со значениями, найденными в измерениях для поджигания в потоке других горючих и в других исследованиях (см. табл. 17). Смеси метана не удалось поджечь при максимальной достигнутой температуре 900° С. В серии дальнейших измерений [c.290]
Однако уже для ацетилена зафиксирована значительно меньшая минимальная = 420°, а для сероуглерода и диэтилового эфира наблюдалось поджигание при 180° С. Результаты измерений хорошо воспроизводятся. Размеры и форма поджигателя, а также перемешивание смеси вентилятором за время нагревания поджигателя незначительно сказываются на величине критической температуры. Таким образом, возможность низкотемпературного поджигания можно считать установленной не только для смесей сероуглерода и диэтилового эфира, но и ацетилена. [c.291]
| Рис. 77. Зависимость температуры поджигания воздушных смесей сероуглерода и диэтилового эфира (используются различные поджигатели) | 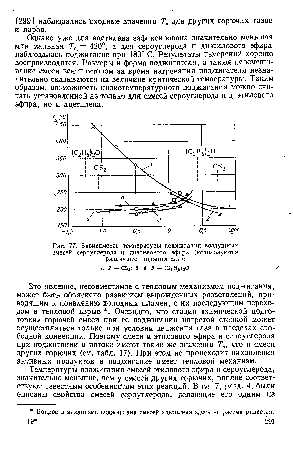 |
В качестве ингибиторов окисления для простых эфиров рекомендуется использовать добавки диэтилентрнамина, триэтилен-тетрамина или тетраэтиленпентамина в количестве 50 мг на 1 кг растворителя. Добавкой в количествах от 1 до 200 мг пирогаллола на 1 кг растворителя обычно стабилизируют диэтиловый эфир. Кроме того, резкому замедлению или полному прекращению образования пероксидов способствует контакт растворителя с медной сеткой. Наличие в диэтиловом эфире даже незначительных долей воды замедляет образование пероксида. [c.26]
Данный метод используется для экстрагирования пероксидов из эфиров, которые нерастворимы или малорастворимы в воде. При перемешивании в течение 30 мин 1 ч. (об.) 23 %-ной NaOH с 10 ч. (об.) диэтилового эфира пероксиды полностью гидролизуются. [c.27]
Т4 Дибутиловый эфир, диэтиловый эфир, диэтнло-вый эфир этиленгликоля [c.424]
Токсическое действие. Животные. Действуют сходно с диэтиловым эфиром, но в 1,5—2 раза сильнее (при вдыхании). При концентрации 6% морские свинки, кролики и обезьяны погибают при явлениях дыхательной недостаточности. При концентрации 3% у всех животных наркоз. Смертельная концентрация для белых крыс 1,6% при экспозиции 4 ч. После повторных (20 экспозиций) вдыханий паров в концентрации 1 % у морских свинок, кроликов и обезьян снижение мас- сы тела и изменения в крови. Только концентрации 0,3% по 2 ч в день и 1% по 3 ч в день не дали существенных изменений после 20 экспозиций (Silverman et al Ma hle et al.). Вдыхание концентрации 10—20 мг/л в течение 10 дней вызывало нарушения полового цикла у самок крыс. Снижался процент забеременевших самок, уменьшалось среднее число потомков на одну самку (Ели-суйская). [c.437]
Токсическое действие. Пары действуют наркотически в 2—3 раза сильнее, чем диэтиловый эфир, но слабее, чем хлороформ. У белых мышей при 86,5 мг/л через 10 мин наркоз. У белых крыс вдыхание паров в наркотической концентра- [c.438]
Токсическое действие. Пары действуют наркотически вдвое сильнее, чем диэтиловый эфир. У белых мышей при концентрации 11,7% через 7 ч 20 мин — наркоз животные оправляются через сутки. При вдыхании паров в концентрации 44 мг/л в течение 4 ч погибает 60% белых крыс. У собак не наблюдается нарушения функций печени после 60-минутного наркоза. Патогистологическпх изменений в печени и почках у белых крыс, собак и обезьян не найдено Krantz et al.). [c.440]
Человек. Д. Э. сильнее диэтилового эфира как наркотик в 6 раз, как релаксант— в 4 раза. Концентрация в крови при хирургическом наркозе 35—40 мг%. Концентрации в воздухе операционных, составляющие 0,008—0,06 мг/л, представляют потенциальную опасность хронического отравления для персонала, тем более что Д. Э. хорошо абсорбируется на поверхности одежды, тела, операционной аппаратуры и т. д. Основная опасность при вдыхании паров — поражение печени и почек (Be ker Stefanini et al.). Описаны смертельные случаи после повторного наркоза. На вскрытии — жировая инфильтрация печени и массивные [c.445]
Токсическое действие. Сильнее диэтилового эфира как наркотик и как релаксант в 3 раза. Концентрация в крови во время хирургического наркоза 15— 25 мг%. В небольших концентрациях угнетает дыхание, при нарастании концентрации вызывает падение кровяного давления. Повышает чувствительность сердца к адреналину. Наркоз сопровождается значительным увеличением в крови содержания сахара, норадреналина, трансаминаз, лейкоцитов. Содержание электролитов остается без изменений (Dobkin et al.). [c.446]
Токсическое действие. Сильнее диэтилового эфира как наркотик в 1,5 раза, как релаксант в 3 раза. В наркотических концентрациях не вызывает у белых крыс и собак существенных изменений в функциях и структуре печени. Концентрации в крови людей при хирургическом наркозе составляют 17—40 мг%. При этом наблюдаются повышение сахара в крови и нарушение функций печени. Повышает чувствительность сердца к адреналину (ОоЬкт е1 а1. Баёоуе е1 а .). [c.451]
Процесс получения реактива Гриньяра (магнийбромэтила), который является неизбежной первой стадией любого магнийорганического синтеза, проводят в реакторе полунепрерывного действия с обратным холодильником. В реактор единовременно загружается расчетное количество стружки магния и диэтилового эфира, после чего рассредоточенно во времени подается смесь бро- [c.200]
Процесс производства реактива Гриньяра можно рассматривать как процесс со взрывчатыми веществами, так как пары диэтилового эфира взрывоопасны (Ткип = 307 К) и, кроме того, в исходных продуктах реакции присутствуют чрезвычайно взрывоопасные перекисные соединения. С этой точки зрения можно выделить как вид опасности — взрыв и как следствие — механическое разрушение оборудования, выброс реакционной массы и технологический брак. Во избежание этого следует контролировать и использовать для защиты следующие параметры количество пара диэтилового эфира в помещении (С1) количество перекисных соединений (С2) в реакторе температуру паровой фазы в реакторе (Тг), а также обеспечить взрыво-, пожаро-, и искробезопас-ность оборудования. [c.201]
Изменения роста давления во времени (см. рис. 4-13), полученные при решении системы уравнений (4-7)—(4-13), позволяют проанализировать эффективность каналов защитных воздействий, осуществляемых отсечкой слива бромистого этила с диэтиловым эфиром и увеличением теплоотбора из реактора (остановка мешалки и сброс газовой фазы из реактора не моделировались, поскольку эти защитные воздействия носят второстепенный характер). Хотя увеличение теплоотбора не уступает в эффективности отсечке слива смеси, следует отметить, что применение аварийных охладителей связано с усложнением холодильного отделения и схемы обвязки реакторного узла, а съем тепла через стенку чугунного эмалированного реактора или холодильника связан с тепловой инерцией объектов, поэтому в качестве основного защитного воздействия системы автоматической защиты следует использовать отсечку подачи слива смеси. [c.211]
Рис. 4-14, на котором изображены изменения давления при нанесении возмущений сливом различных доз смеси бромистого этила с эфиром и уменьшением теплоотбора, полученные при решении системы уравнений (4-7)—(4-13), показывает, что—дву-кратное уменьшение теплоотвода при 10%-ном возмущении сливом смеси не менее опасно, чем такое же увеличение возмущения по сливу смеси бромистого этила с диэтиловым эфиром. Однако наличие примерно десятикратного запаса по мощности обратного холодильника исключает возможность развития аварийной ситуации при практически возможных колебаниях температуры рассола, поступающего в обратный холодильник, и регламентном сливе смеси. [c.211]
| Рис. 76. Зависимость гтемпературы поджигания воздушных смесей диэтилового эфира этиленгликоля, водорода, ацетилена | 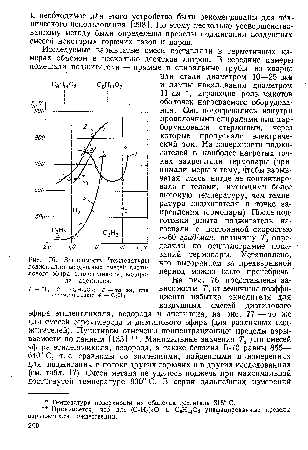 |
ru-safety.info
Диэтиловый эфир - Большая Энциклопедия Нефти и Газа, статья, страница 1
Диэтиловый эфир
Cтраница 1
Диэтиловый эфир ( его часто называют просто эфиром) - один из наиболее широко применяющихся в лабораторной практике растворителей. Он отличается хорошей растворяющей способностью и в то же время низкой температурой кипения, поэтому особенно удобен для извлечения - его легко испарить из вытяжек. [1]
Диэтиловый эфир применяется для извлечения эфирных масел нз адсорбентов. [2]
Диэтиловый эфир, удерживаемый углем, отгоняется острым паром, поступающим под ложное днище из барботера. [3]
Диэтиловый эфир был открыт в 1544 году, В то время органической химии еще не существовало. Тогдашние химики были поражены прежде всего тем, что жидкость может так легко и быстро испаряться: температура кипения диэтилового эфира всего 34 С - ниже температуры человеческого тела. [4]
Диэтиловый эфир слишком огнеопасен, чтобы его можно было в больших количествах применять в промышленности. В качестве промышленных растворителей используются несколько более сложные эфиры - их молекулы содержат еще и гидроксильные группы. [5]
Диэтиловый эфир является чрезвычайно легко воспламеняющимся растворителем, поэтому необходимо следить за тем, чтобы на расстоянии не менее 3 м от места работы с эфиром не было огня. [6]
Диэтиловый эфир является наркотиком и действует раздражающе на дыхательные пути. [7]
Диэтиловый эфир применяется для извлечения эфирных масел нз адсорбентов. [8]
Диэтиловый эфир, удерживаемый углем, отгоняется острым паром, поступающим под ложное днище из барботера. [9]
Диэтиловый эфир является чрезвычайно легко воспламеняющимся растворителем, поэтому необходимо следить за тем, чтобы на расстоянии не менее 3 м от места работы с эфиром не было огня. [10]
Диэтиловый эфир является наркотиком и действует раздражающе на дыхательные пути. [11]
Диэтиловый эфир - это и есть хорошо известный всем эфир, который используют как средство анестезии. Эфиры обладают ценными свойствами как растворители восков, жиров и других водонерастворимых органических веществ. [12]
Диэтиловый эфир при горении прогревается в глубину, образуя все возрастающий гомотермический слой. Воздушно-механическая пена является недостаточно стойкой против прорыва паров эфира через ее слой, Вследствие высокого давления паров эфира они прорываются в ряде случаев даже через слой химической пены. Для устранения повторного воспламенения паров эфира от нагретых стенок резервуара необходимо усиленно их охлаждать. [13]
Диэтиловый эфир стабилизируют добавкой 0 002 % дифениламина. [14]
Диэтиловый эфир представляет собой бесцветную жидкость со своеобразным эфирным запахом, очень летуч, его пары тяжелее воздуха. При неосторожном упаривании эфирных растворов пары эфира могут накопиться над лабораторным столом или над полом и воспламениться при соприкосновении с нагретой электроплиткой. При хранении эфира в нем могут образоваться пероксиды. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Диэтиловый эфир
Диэтиловый эфир (эфир) (C2H5)2O
Т. кип. 34.6°C; n20D=1.3527; d154=0.7193 При 15°C эфир растворяет 1.2% воды, а вода при 20°C -- 6.5% эфира. Азеотропная смесь с водой содержит 1.26% воды и кипит при 34.15°C. Продажный продукт всегда содержит некоторые количества спирта и воды. Сушка. Абсолютный эфир получают при многодневном стоянии над хлоридом кальция. Затем хлорид кальция отфильтровывают, а эфир сушат над натриевой проволокой. Натрий добавляют до тех пор, пока его поверхность не станет оставаться блестящей. Внимание! На свету эфир образует взрывчатые перекиси. Поэтому рекомендуется хранить эфир над едким кали, который переводит образующиеся гидроперекиси в нерастворимые соли, а кроме того, служит и очень подходящим осушителем. Осторожно! ЛВЖ, относится к классу AI. Взрывоопасны смеси с воздухом, содержащие 1.2-51vol% эфира.
Эфир
Рассмотрим эфир, который, помимо его применения в медицине для наркоза, является прекрасным растворителем для жиров и многих других веществ.
Строго говоря, существуют различные простые эфиры, которые так же, как алканали или алканоны, образуют класс соединений со сходными свойствами. Обычный эфир строго должен называться диэтиловым эфиром. Он образуется из двух молекул этанола путем отщепления воды, обычно с помощью концентрированной серной кислоты:
2СН3СН2ОН ——> (СН3СН2)2О + Н2О
Получим малое количество эфира. Для этого в пробирку нальем около 2 мл денатурата и 1,5 мл концентрированной серной кислоты. Подберем к пробирке пробку с двумя отверстиями. В одно из них вставим маленькую капельную воронку или просто маленькую воронку с удлиненной трубкой, выход из которой вначале закроем с помощью кусочка резинового шланга и зажима. Используя второе отверстие в пробке, присоединим к пробирке устройство для охлаждения паров — такое же, как и при получении этаналя. Приемник надо непременно охлаждать водой со льдом, потому что эфир кипит уже при 34,6 °С! Ввиду его необычайно легкой воспламеняемости, холодильник должен быть как можно длиннее (не меньше 80 см), чтобы между источником огня и приемником было достаточное расстояние. По этой же причине проведем опыт вдали от горючих предметов, на открытом воздухе или в вытяжном шкафу. Нальем в воронку еще около 5 мл денатурата и осторожно нагреем пробирку на асбестированной сетке горелкой Бунзена приблизительно до 140 °С*. В приемнике конденсируется очень летучий дистиллят, и в случае недостаточного охлаждения мы почувствуем характерный запах эфира. Осторожно приоткрывая зажим, будем постепенно, малыми порциями добавлять спирт. В конце реакции серная кислота все больше разбавляется образующейся водой, в результате чего образование эфира прекращается и перегоняется уже спирт.
При тщательном выполнении опыта мы получим около 4 мл очень подвижной, прозрачной жидкости, которая состоит в основном из эфира. Если несколько капель его нанести на палец, то почувствуешь сильный холод. Дело в том, что эфир быстро испаряется, а теплота испарения отнимается от окружающей его среды.
На химических предприятиях и в больницах при работе с эфиром случались очень сильные взрывы.
______________________
- Температура не должна превышать 145 °С, так как при более высокой (около 170°) образуется этен. Даже при работе с малым количеством эфира всегда следует учитывать опасность пожара. Поэтому рекомендуется заменить горелку закрытой электрической плиткой и между источником тепла и приемником установить защитный экран. При использовании капельной воронки надо заранее тщательно смазать и проверить кран. В качестве приемника лучше всего взять плотно присоединенную к холодильнику пробирку с боковым отводом, на который можно надеть резиновый шланг для увеличения расстояния между выходящими парами эфира и источником тепла. Приемник лучше охлаждать смесью льда с солью.
organiclab.narod.ru
Реакции алкилирования/Практикум по органической химии/Прянишников Н. Д.
  Алкилированием называют реакции, приводящие к замещению водорода гидроксильной, карбоксильной или аминогруппы на алкильную группу.
  В настоящем разделе рассматриваются лишь реакции алкилирования гидроксильной группы, приводящие к образованию простых эфиров. Реакции алкилирования карбоксильной группы, приводящие к образованию сложных эфиров, даны в разделе "Реакции ацилирования".
  Простые эфиры могут быть получены в результате отщепления молекулы воды от двух молекул спирта путем нагревания его с концентрированной серной кислотой:
R-OH + HO-R а R-O-R + h3O
  Данный способ на является, однако, общепринятым. Концентрированная серная кислота при нагревании может разрушать многие органические вещества или вступать с ними в реакцию с образованием сульфокислот и других продуктов. Кроме того, этот способ мало пригоден для получения смешенных эфиров, так как при нагревании с серной кислотой смеси двух спиртов образуется смесь трех эфиров:
R-OH + HO-R' а R-O-R' + h3O
R-OH + HO-R а R-O-R + h3O
R'-OH + HO-R' а R'-O-R' + h3O
  Более общим способом превращения гидроксильных соединений в простые эфиры является взаимодействие алкоголятов с галоидными алкилами:
R-ONa + R'I а R-O-R' + NaI
  Замещение водорода гидроксильной группы на алкильную группу легко может быть произведено также действием диалкилсульфата в присутствии щелочи:
R-OH + R2SO4 + NaOH а R-O-R' + NaR'SO4 + h3O
  При взаимодействии этилового спирта с серной кислотой образуется этилсерная кислота и вода:
C2H5-OH + HO-SO3H а C2H5-O-SO3H + h3O
  При температуре 140-150° этилсерная кислота вступает в реакцию с избытком спирта, в результате чего образуется диэтиловый эфир и серная кислота:
C2H5-O-SO3H + HO-C2H5а C2H5-O-C2H5 + HO-SO3H
  Легколетучий диэтиловый эфир отгоняется, увлекая с собой и воду, выделяющуюся при образовании этилсерной кислоты. Поэтому серная кислота не разбавляется водой и сохраняет способность вступать во взаимодействие с новыми количествами спирта, выполняя роль катализатора.
  При более высокой температуре (170°) этилсерная кислота разлагается с образованием этилена:
Ch4-Ch3-O-SO3H а Ch3=Ch3 + HO-SO3H
  Теоретически, при соблюдении надлежащей температуры реакции, можно было бы данным количеством серной кислоты превратить в эфир неограниченное количество спирта. Однако на практике невозможно избежать небольшой затраты серной кислоты на окислительные процессы, сопровождающиеся образованием сернистого газа.
  Реактивы:   Спирт 95%-ный..........150 мл (около 2,5 моля)   Серная кислота; едкий натр; хлористый кальций

  В перегонную колбу емкостью 200 мл берут 30 мл спирта и осторожно, хорошо перемешивая, приливают 30 мл концентрированной серной кислоты. Колбу закрывают пробкой, в которую вставлены капиллярная воронка и термометр, шарик термометра должен быть погружен в жидкость. К ножке капельной воронки при помощи кусочка резиновой трубки присоединяют стеклянную трубку с оттянутым и загнутым кверху концом, также погруженным в жидкость. Колбу соединяют с длинным, хорошо действующем холодильником, к которому в качестве приемника присоединяют колбу для отсасывания. На боковой тубус последней надевают длинную резиновую трубку для отвода в сторону (под тягу) легко воспламеняющихся паров эфира. Приемник охлаждают водой со льдом (рис. 33).
  В капельную воронку наливают спирт (120 мл) и нагревают колбу горелкой через асбестовую сетку. Когда температура смеси достигнет 140°, начинают понемногу приливать спирт, следя за тем, чтобы температура не поднималась выше 150°. Спирт приливают с той же скоростью, с какой отгоняется эфир. Через 45-60 мин. прибавление спирта заканчивают, нагревают смесь еще 5 мин., затем гасят горелку и отъединяют приемник.
  Дистиллят, кроме эфира, содержит воду, спирт и сернистую кислоту. Его взбалтывают в делительной воронке с 10%-ным раствором едкого натра, взятым в количестве 1/3 объема полученного дистиллята (для удаления сернистой кислоты). Отделив раствор едкого натра, эфир (для удаления спирта) обрабатывают насыщенным раствором хлористого кальция; раствор последнего берут в количестве, равным половине объема дистиллята.
  Тщательно отделив водный слой, переливают эфир в сухую склянку и сушат хлористым кальцием (около 10 г), оставляя стоять не менее 4-5 час. Затем перегоняют эфир из перегонной колбы, собирая фракцию, кипящую в пределах 33-38°.
  Выход около 40 г.
  Темп. кип. чистого эфира 35,6°; уд. вес 0,7197; показатель преломления 1,3538.  При работе с эфиром нужно соблюдать большую осторожность, помня, что эфир сильно летуч и легко воспламеняется. При перегонке эфира следует пользоваться баней с горячей водой; баню нагревают в стороне от прибора и горелку под колбой не зажигают; для поддержания нужной температуры в баню добавляют горячую воду.
  Реакция образования изоамилового эфира при нагревании изоамилового спирта с концентрированной серной кислотой идет аналогично описанной выше реакции получения этилового эфира. Сначала образуется изоамилсерная кислота:
C5h21-OH + h3SO4а C5h21-O-SO3H + h3O
  Изоамилсерная кислота реагирует с другой молекулой спирта образуя эфир:
C5h21-O-SO3H + HO-C5h21а C5h21-O-C5h21 + h3SO4
  Изоамиловый эфир кипит при температуре, значительно превышающей ту, которая необходима для нормального хода реакции. Таким образом, удается избежать разбавления серной кислоты водой и добиться вступления в реакцию большей части взятого спирта. Довести реакцию до конца все же не удается, так как по мере накопления изоамилового эфира температура кипения смеси повышается и усиливаются побочные реакции, в частности разложение изоамилсерной кислоты с образованием изоамилена:
(Ch4)2CH-Ch3-Ch3-O-SO3H а (Ch4)2CH-CH=Ch3 + h3SO4
  Реактивы:   Изоамиловый спирт...........100 г (1,13 моля)   Серная кислота; углекислый калий; амид натрия; хлористый кальций; металлический натрий
  В круглодонной колбе (с не слишком длинным горлом) емкостью 200-250 мл смешивают свежеперегнанный изоамиловый спирт, кипящий в пределах 128-132°, с 4 мл концентрированной серной кислоты. При помощи корковых пробок колбу соединяют с насадкой для отделения воды и обратным холодильником (рис. 34). Смесь нагревают до кипения и слабо кипятят в течение нескольких часов до тех пор, пока в водоотделителе не соберется 9 мл (0,5 моля) воды.
  Вначале перегонку ведут медленно. После отгонки небольшого количества амилена (кипящего при 21°) температура повышается и при 128° начинает отгоняться не вошедший в реакцию изоамиловый спирт. Когда термометр покажет 165°, меняют приемник, усиливают нагревание и в пределах 165-172° отгоняют изоамиловый эфир.
  Выход около 50 г.
  Продукт получается не вполне чистым. Для получения чистого эфира его кипятят с 1 г амида натрия, отгоняют, взбалтывают с разбавленной серной кислотой, сушат хлористым кальцием и перегоняют над металлическим натрием.
  Темп. кип. 172°; уд. вес 0,7807.  Примером реакции получения простого эфира при действии галоидных алкилов на алкоголяты или феноляты может служить получение фенетола (фенилэтилового эфира):
C6H5-OH + C2H5-ONa а C6H5-ONa + C2H5-OH
C6H5-ONa + C2H5I а C6H5-O-C2H5 + NaI
  Реакцию ведут в спиртовом растворе; спирт хорошо растворяет и фенолят натрия и иодистый этил, обеспечивая тем самым однородность среды и легкое протекание реакции.  Реактивы:   Фенол....................9,4 г (0,1 моля)   Натрий металлический.....2,3 г (0,1 грамматома)   Иодистый этил............20 г (0,13 моля)   Спирт; эфир; едкий натр; хлористый кальций
  В круглодонной колбе емкостью 100 мл, снабженной двугорлой насадкой и обратным холодильником, растворяют 2,3 г натрия в 30 мл спирта. Натрий вносят небольшими кусочками.
  По охлаждении раствора к нему прибавляют фенол и иодистый этил и смесь нагревают на водяной бане до тех пор, пока спиртовый раствор не перестанет показывать щелочную реакцию. Затем колбу соединяют с нисходящим холодильником, отгоняют возможно полно спирт и прибавляют к остатку небольшое количество воды для растворения образовавшегося при реакции иодистого натрия.
  Фенетол извлекают эфиром, эфирный раствор отделяют при помощи делительной воронки, взбалтывают с разбавленным раствором едкого натра для удаления не вступившего в реакцию фенола и сушат хлористым кальцием. Отгоняют эфир, заменяют водяной холодильник небольшим воздушным и при 167-172° перегоняют фенетол.
  Выход около 9 г.
  Фенетол - бесцветная жидкость с характерным запахом; темп. кип. 172°; уд. вес 0,9702.c-books.narod.ru




















